抗cldn18a2的抗体以及治疗肿瘤的药物
技术领域
1.本发明涉及生物医药技术领域,具体而言,涉及抗cldn18a2的抗体以及治疗肿瘤的药物。
背景技术:
2.大约90%的恶性肿瘤来源于上皮细胞,上皮细胞间的紧密连接与恶性肿瘤的发生、发展密切相关,肿瘤的发生往往伴随着紧密连接功能的降低及claudin蛋白表达的改变。
3.claudin蛋白是紧密连接结构和功能的骨架蛋白,位于相邻细胞间隙顶侧,与其他结构蛋白和信号蛋白协同作用,主要生物学功能为细胞间黏附、维持细胞急性、调节细胞旁通透性、参与细胞增殖、分化的调节。claudins蛋白主要通过激酶a(pka)或蛋白激酶c(pkc)磷酸化以及丝氨酸、苏氨酸等为主的氨基酸来调节细胞连接处的渗透性。claudin的异常表达将破坏上皮渗透屏障,使细胞极性丧失,细胞间粘附力下降,导致多种肿瘤的发生和发展。
4.claudin 18a2属于紧密连接蛋白(claudin)家族,是1998年在鸡肝中发现的维持细胞极性、细胞间黏附以及调节细胞旁通透性的重要组成分子。claudin 18a2蛋白具有261个氨基酸,分子量约27.9kda(claudin 18a1为27.7kda)。claudin 18a2是一种跨膜蛋白复合体,包含4个跨膜区域、两个细胞外环以及一个细胞内环,其中n末端和c末端在胞浆内。claudin 18基因有两个选择性剪接变异体claudin 18a1以及claudin 18a2,分别特异性表达于肺组织和胃上皮组织。claudin 18a1与claudin 18a2在第一胞外结构域之间仅有8个氨基酸的差异,相似性较大。claudin 18a2这一靶点不存在于除了胃壁(胃上皮细胞)的任何健康组织,使其成为了一个有潜力的抗肿瘤靶点。
5.claudin 18.2在多种肿瘤发生过程中过表达,包括80%的胃肠道腺癌、60%的胰腺肿瘤以及部分结直肠癌、卵巢癌、肺癌等。claudin 18a2在肿瘤表达情况(数据来源ganymed imab-362ii期临床实验):730例患者,685(94%)进行了免疫组化,其中49%(n=333/685)表达cldn18.2(≥40%肿瘤细胞cldn18.2≥2 )。
6.ganymed的产品imab362是首个靶向claudin 18.2的抗体,imab362通过直接作用于claudin18.2,激发抗体依赖的细胞介导的细胞毒作用(adcc)和补体依赖的细胞毒作用(cdc)等免疫反应,并可同化疗药物一起起到招募t细胞和改变肿瘤微环境的作用,从而达到杀伤claudin18.2阳性肿瘤的效果。相比之下,对于只有很少表达或者不表达claudin18.2的正常组织,imab362则不会起到杀伤作用。
技术实现要素:
7.本发明的目的在于提供一种抗cldn18a2的抗体以及治疗肿瘤的药物。本发明提供了一种新的抗cldn18a2的抗体,该抗体能够特异性识别并结合cldn18a2,具有良好的特异性,此外,本发明提供的抗体可以通过结合cldn18a2介导cdc反应造成细胞死亡,可作为治
疗cldn18a2阳性的肿瘤的药物。
8.本发明是这样实现的:
9.第一方面,本发明提供抗cldn18a2的抗体或其功能性片段,所述抗体或其功能性片段具有重链可变区和轻链可变区,其中,所述重链可变区的互补决定区hcdr1(重链互补决定区1)、hcdr2和hcdr3的氨基酸序列和所述轻链可变区的互补决定区lcdr1(轻链互补决定区1)、lcdr2和lcdr3的氨基酸序列为如下(1)-(7)中的任意一种:
10.(1):hcdr1如seq id no.28所示,hcdr2如seq id no.35所示,hcdr3如seq id no.42所示;
11.lcdr1如seq id no.49所示,lcdr2如seq id no.54所示,lcdr3如seq id no.59所示;
12.(2):hcdr1如seq id no.29所示,hcdr2如seq id no.36所示,hcdr3如seq id no.43所示;lcdr1如seq id no.50所示,lcdr2如seq id no.54所示,lcdr3如seq id no.60所示;
13.(3):hcdr1如seq id no.30所示,hcdr2如seq id no.37所示,hcdr3如seq id no.44所示;
14.lcdr1如seq id no.51所示,lcdr2如seq id no.55所示,lcdr3如seq id no.61所示;
15.(4):hcdr1如seq id no.31所示,hcdr2如seq id no.38所示,hcdr3如seq id no.45所示;
16.lcdr1如seq id no.52所示,lcdr2如seq id no.56所示,lcdr3如seq id no.62所示;
17.(5):hcdr1如seq id no.32所示,hcdr2如seq id no.39所示,hcdr3如seq id no.46所示;
18.lcdr1如seq id no.50所示,lcdr2如seq id no.54所示,lcdr3如seq id no.63所示;
19.(6):hcdr1如seq id no.33所示,hcdr2如seq id no.40所示,hcdr3如seq id no.47所示;
20.lcdr1如seq id no.53所示,lcdr2如seq id no.57所示,lcdr3如seq id no.64所示;
21.(7)hcdr1如seq id no.34所示,hcdr2如seq id no.41所示,hcdr3如seq id no.48所示;
22.lcdr1如seq id no.49所示,lcdr2如seq id no.58所示,lcdr3如seq id no.65所示。
23.cldn18a1和cldn18a2高度同源,差异区域较小,筛选cldn18a2特异性的抗体难度较高,此外,cldn18是多次跨膜蛋白,无法直接表达可溶胞外结构域,免疫时无法使用蛋白抗原。但本发明的发明人经过创造性的劳动,得到具有上述(1)-(7)所示cdr区结构的抗体,该抗体能够特异性识别并结合cldn18a2,不与cldn18a1结合,具有良好的特异性;此外,本发明提供的抗体通过结合cldn18a2可以激发补体依赖的细胞毒作用(cdc)等免疫反应,对表达cldn18a2的细胞造成杀伤作用;该抗体可以用于治疗cldn18a2表达阳性的肿瘤,为治
疗肿瘤提供一种的用药选择和治疗思路。
24.需要说明的是,本领域技术人员在本发明上述抗体的cdr序列的基础上,容易想到对重链或轻链可变区中的cdr序列(cdr1、cdr2和cdr3)序列进行一个或多个氨基酸的替换、删除或添加等,以得到与上述(1)-(7)任一项所示序列相同或等同生物活性的变体序列,其也是属于本发明的保护范围。
25.可选的,在本发明的一些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列为如下(a)-(g)中的任意一种:
26.(a):所述重链可变区如seq id no.14所示,所述轻链可变区如seq id no.21所示;
27.(b):所述重链可变区如seq id no.15所示,所述轻链可变区如seq id no.22所示;
28.(c):所述重链可变区如seq id no.16所示,所述轻链可变区如seq id no.23所示;
29.(d):所述重链可变区如seq id no.17所示,所述轻链可变区如seq id no.24所示;
30.(e):所述重链可变区如seq id no.18所示,所述轻链可变区如seq id no.25所示;
31.(f):所述重链可变区如seq id no.19所示,所述轻链可变区如seq id no.26所示;
32.(g):所述重链可变区如seq id no.20所示,所述轻链可变区如seq id no.27所示。
33.需要说明的是,本领域技术人员在本发明上述抗体的重链或轻链可变区序列的基础上,容易想到对重链或轻链可变区中的骨架区(fr1、fr2、fr3和fr4)序列进行一个或多个氨基酸的替换、删除或添加等,以得到与上述(a)-(g)任一项所示序列相同或等同生物活性的变体序列,其也是属于本发明的保护范围。
34.可选的,在本发明的一些实施方案中,所述抗体的轻链恒定区为κ型轻链恒定区或λ型轻链恒定区。
35.可选的,在本发明的一些实施方案中,所述抗体的重链恒定区为iga、igd、ige、igg或igm抗体的重链恒定区。
36.可选的,在本发明的一些实施方案中,所述抗体的重链恒定区为igg抗体的重链恒定区。
37.可选的,在本发明的一些实施方案中,所述抗体的重链恒定区为igg1、igg2、igg3或igg4抗体的重链恒定区。
38.可选的,在本发明的一些实施方案中,所述抗体的轻链恒定区如seq id no.66所示;
39.可选的,在本发明的一些实施方案中,所述抗体的重链恒定区如seq id no.67或seq id no.68所示。
40.需要说明的是,在本发明公开的上述抗体恒定区序列基础上,本领域技术人员容易想到对抗体的恒定区序列进行改造例如人源化改造等,无论对恒定区序列进行何种改
造,得到的抗体均属于本发明的保护范围。
41.可选的,在本发明的一些实施方案中,所述功能性片段为fab、fab’、f(ab’)2、fv或scfv片段。
42.第二方面,本发明提供一种抗体偶联物,其包括与治疗剂偶联的如上任一项的抗体或其功能性片段。
43.可选的,在本发明的一些实施方案中,所述治疗剂为毒素、放射性同位素或细胞毒剂。
44.本发明的抗体可以与其他的治疗剂例如毒素、放射性同位素或细胞毒剂等偶联,起到增强细胞杀伤或起到抑制细胞增殖的效果。治疗剂的类型,本领域技术人员可以根据实际需要进行选择,这对本领域技术人员来说是不需要付出创造性的劳动,无论选用何种治疗剂与本发明的抗体偶联,其均属于本发明的保护范围。
45.第三方面,本发明提供一种融合蛋白,其含有如上任一项所述的抗体或其功能性片段。
46.在本发明公开的抗体基础上,本领域技术人员容易想到将该抗体与其他的功能性蛋白或多肽融合,以增强抗体的功能或者便于抗体的纯化等,这对本领域技术人员来说是不需要付出创造性的劳动的,基于此,将本发明抗体与任何类型蛋白或多肽融合所得到的融合蛋白均属于本发明的保护范围。
47.第四方面,本发明提供一种治疗肿瘤的药物,其含有如上任一项所述的抗体或其功能性片段、如上任一项所述的抗体偶联物、或者如上所述的融合蛋白。
48.可选的,在本发明的一些实施方案中,所述肿瘤为cldn18a2表达呈阳性的肿瘤。
49.可选的,在本发明的一些实施方案中,所述cldn18a2表达呈阳性的肿瘤选自胃腺癌、胰腺癌、直肠癌、乳腺癌、卵巢癌和肺癌中的任意一种。
50.需要说明的是,本发明提供的药物可以治疗cldn18a2表达呈阳性的任何肿瘤,包括但不限于胃腺癌、胰腺癌、直肠癌、乳腺癌、卵巢癌和肺癌,对于其他类型cldn18a2表达呈阳性的肿瘤也可以使用本发明的药物进行治疗。
51.可选的,在本发明的一些实施方案中,所述药物还包括药学上可接受的辅料。
52.第五方面,本发明提供一种检测cldn18a2的试剂,其含有如上任一项所述的抗体或其功能性片段。
53.本发明提供的抗体特异性结合cldn18a2蛋白,因此,本发明提供的抗体可以用于检测cldn18a2蛋白,作为cldn18a2蛋白的检测试剂。
54.第六方面,本发明提供一种分离的核酸分子,其编码如上任一项所述的抗体或其功能性片段。
55.基于密码子的简并性,本领域技术人员容易获得编码上述抗体的核酸序列,无论何种核酸序列,其只要编码本发明的抗体即属于本发明的保护范围。
56.第七方面,本发明提供一种含有如上所述的核酸分子的重组载体。
57.第八方面,本发明提供一种含有如上所述的重组载体的重组细胞。
58.第九方面,本发明提供制备如上任一项所述的抗体或其功能性片段的方法,其包括:培养如上所述的重组细胞,从培养物种分离纯化得到所述抗体或其功能性片段。
59.在本发明公开了抗体序列的基础上,本领域技术容易想到采用基因工程技术制备
本发明的抗体,这对本领域技术人员来说是不需要付出创造性劳动的,无论以何种方法制备本发明的抗体,其均属于本发明的保护范围。
附图说明
60.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
61.图1为hek293细胞瞬转表达cldn18a2的检测结果。
62.图2为cho-cldn18a2稳定表达细胞系筛选结果,图中,a为免疫印迹结果,b为流式细胞术检测结果。
63.图3为结合cldn18单克隆抗体的初步筛选结果。
64.图4为人cldn18a1与cldn18a2的序列比对结果。
65.图5为特异性结合cho-cldn18a2细胞但不结合cho-cldn18a1细胞的鼠单克隆抗体筛选结果。
66.图6为特异性结合hek293-cldn18a2细胞但不结合cho-cldn18a1细胞的鼠单克隆抗体筛选结果。
67.图7为肿瘤细胞系经eof处理前后的cldn18a1和cldn18a2的rna表达水平检测结果。
68.图8为肿瘤细胞系的cldn18a1和cldn18a2的蛋白表达水平检测结果。
69.图9为特异性结合nugc4-cldn18a2和nci-snu-16-cldn18a2的单克隆抗体筛选结果。
70.图10为鼠单克隆抗体(#1、#26、#38、#49、#52、#60、#63)以及抗体imab362-ch1与cho-cldn18a2细胞的结合曲线。
71.图11为先加imab362抗体条件下,鼠单克隆抗体(#1、#26、#38、#49、#52、#60)与imab361抗体表位竞争检测结果。
72.图12为先加鼠单克隆抗体(#1、#26、#38、#49、#52、#60)条件下,鼠单克隆抗体(#1、#26、#38、#49、#52、#60)与imab361抗体表位竞争检测结果。
73.图13为鼠单克隆抗体(#1、#26、#38、#49、#52、#60、#63)与外周血淋巴细胞的结合结果。
74.图14为鼠单克隆抗体(#26、#38、#49、#52、#60、#63)与非小细胞癌的结合结果。
75.图15为鼠单克隆抗体(#26、#38、#49、#52、#60、#63)与乳腺癌组织的结合结果。
76.图16为鼠单克隆抗体(#26、#38、#49、#52、#60、#63)与胃癌组织的结合结果。
77.图17为鼠单克隆抗体(#26、#38、#49、#52、#60、#63)介导的补体依赖性细胞毒性流式检测结果。
78.图18为图17的数据统计结果。
79.图19为真核表达载体pcdna3.4a的质粒图谱。
具体实施方式
80.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
81.以下结合实施例对本发明的特征和性能作进一步的详细描述。
82.实施例1
83.制备针对cldn18的小鼠抗体
84.1.免疫
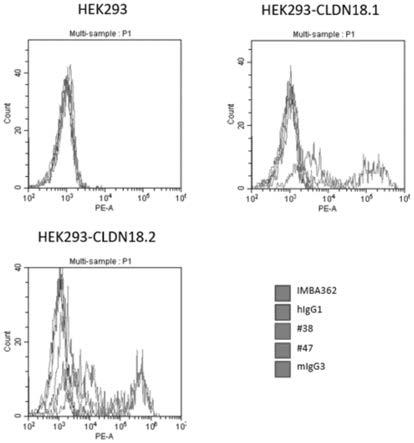
85.构建编码人cldn18a2片段(人cldn18同种型a2前体多肽,氨基酸序列如seq idno.1,编码序列如seq id no.2所示)的真核表达载体pcdna3.4a(见图19),用该载体瞬转hek293细胞,使用ganzymed公司cldn18.2抗体imab362(自产,轻链氨基酸序列如seq id no.5所示,重链氨基酸序列如seq id no.6所示)检测cldn18a2在293细胞的表达情况,结果见图1。cldn18a2阳性细胞占比在24小时、48小时、72小时分别为25.8%,41.96%和44.60%,cldn18a2的表达峰值大致出现在48-72小时。
86.以2
×
107个细胞/只/次的细胞量,用过表达人cldn18a2的hek 293细胞免疫5周龄balb/c小鼠。免疫采取如下两种方式(表1)。
87.表1:用于产生单克隆抗体的免疫方案
[0088][0089]
方案一:在无佐剂存在下,在第1天、第16天、第30天、第43天、第50天、第57天、第63天将细胞注射进小鼠腹腔,用于产生第1组单克隆抗体。
[0090]
方案二:使用弗氏佐剂,在第1天将细胞注射于小鼠背部皮下,第16天将细胞注射腹腔进行加强,第30天再次进行背部皮下注射,之后在第43天、第50天、第57天、第63天用细胞进行腹腔加强,用于产生第2组单克隆抗体。其中第1天使用弗氏完全佐剂,第16天和第30天使用弗氏不完全佐剂,其余4针不使用佐剂。
[0091]
根据所使用的具体免疫方案,在第16天和63天之间通过流式细胞术(facs)检测小鼠尾血效价。在取脾脏之前3天用前述过表达cldn18a2的hek 293细胞对小鼠进行加强免疫,以产生第1组和第2组单克隆抗体。
[0092]
2.制备生产抗cldn18的人单克隆抗体的杂交瘤
[0093]
将经免疫过bal b/c小鼠的脾细胞与小鼠骨髓瘤细胞融合,然后对得到的杂交瘤进行抗原特异性抗体的筛选。小鼠脾细胞基于标准方案进行分离,用peg 1500(roche cat#10783641001)将来自经免疫过小鼠的脾细胞的单细胞悬浮液与五分之一数目且不分泌免疫球蛋白的小鼠骨髓瘤细胞sp2/0(atcc,cat#crl1581)进行细胞融合。将融合细胞以约1x105个/孔铺在96孔细胞培养板中,放入培养箱(panasonic mco-18aic),培养条件为37℃,5%co2。随后在hat选择性培养基中培养大约一周,hat选择性培养基是1640培养基中含有1
×
青链霉素双抗(gibco,cat#15140122),1
×
hat(sigma,cat#crlp-7185)和20%胎牛血清(royacel,cat#ry-f11-01)。1周后,再用ht培养基(1640培养基含1
×
青链霉素双抗(gibco,cat#15140122),1
×
ht(gibco,cat#11067030)和20%胎牛血清(royacel,cat#ry-f11-01))替换hat的培养基进行培养,然后通过facs检测融合板中细胞培养上清液与cho-cldn18a1有结合的,筛出分泌可结合人cld18a2的杂交瘤。将分泌抗体的杂交瘤再次转孔铺至48孔板,再次筛选,仍为阳性的抗cldn18单克隆抗体则通过有限稀释进行亚克隆。接着体外培养杂交瘤中选择至少一个保留亲本母细胞(通过facs测定)反应性的克隆,对每个克隆产生9-20管,保存于液氮中。
[0094]
3.选择与cldn18结合的单克隆抗体
[0095]
进行同种型elisa试验,以确定抗体的同种型。使用小鼠单抗ig类/亚类鉴定用elisa试剂盒(igg1\igg2a\igg2b\igg3\igm\iga)(博奥龙,cat#bf06001)来测定所鉴定cldn18反应性单克隆抗体的ig亚类。所产生抗体同种型鉴定结果如下:
[0096]
表2.鼠单克隆抗体亚型
[0097][0098][0099]
以2
×
106个细胞/ml将杂交瘤细胞接种到基于透析的生物反应器中,每周收获一次含有抗体的上清液。借助fplc使用protein a(ge-mabselectsure lx,cat#17-5438-03)纯化小鼠单克隆抗体。通过bca试剂盒或a280吸光值来确定抗体浓度,抗体纯度通过sec(尺寸排阻色谱)确定,并通过sds(十二烷基硫酸钠)凝胶电泳和考马斯亮蓝染色来检查纯度。
[0100]
实施例2
[0101]
针对cldn18a2的单克隆抗体的结合特征
[0102]
1.转染细胞的质量控制
[0103]
为了产生稳定表达cldn18a2的细胞,用编码cldn18a2的载体(同实施例1中的真核表达载体)转染cho细胞,然后通过靶向cldn18蛋白c端的抗体(invitrogen,cat#700178)以
及靶向cldn18a2的抗体imab362,用流式细胞术以cho细胞作为阴性对照,筛选稳定细胞系。
[0104]
分别收集cho细胞和稳定表达cldn18a2的cho-cldn18a2细胞,用含有溴酚蓝的上样缓冲液裂解细胞并进行十二烷基硫酸钠凝胶电泳(sds-page)。对凝胶进行免疫印迹,并用靶向cldn18蛋白c端的抗体(invitrogen,cat#700178)孵育,之后与过氧化物酶(hrp)标记的抗兔抗体孵育后,用tmb试剂使印迹显色。由图2中a可以看到,仅在转染并稳定表达cldn18a2的细胞中可以看到cldn18预计分子量的条带,而cho细胞阴性对照中则没有条带。
[0105]
流式细胞术(facs)检测结果(图2中b)与免疫印迹结果一致,相比于cho空细胞,靶向cldn18a2的抗体imab362结合cho-cldn18.2后,流式峰图呈现很明显的右移。
[0106]
2.与cldn18结合的单克隆抗体的初步筛选
[0107]
将表达人cldn18a2的cho-cldn18a2细胞以2
×
105/孔铺至u底96孔板中。4℃将细胞与杂交瘤上清液孵育30分钟,其后用含1%牛血清白蛋白(bsa)的1
×
pbs洗涤一次。加入apc标签抗鼠fc二抗或者pe标签抗鼠fc二抗于4℃再次孵育30分钟,重复之前的洗涤步骤一次。加入1
×
pbs重悬细胞,用cytoflex流式细胞仪(beckman countler)评估结合。64株小鼠抗体中(表2),除#10、#32、#45与cho-cldn18a2细胞不结合外,其余鼠单抗均检测到与cho-cldn18a2细胞表面的特异性结合,例如含有单克隆抗体#26、#38、#47的杂交瘤上清液(图3中,v1r门中的细胞)。但在这63株抗体中,#8、#9、#21、#22、#27、#29、#30、#33、#36、#44、#46、#56与cho空细胞有交叉反应。
[0108]
人cldn18a1与人cldn18a2的序列比对:人cldn18a1和人cldn18a2在序列比较中n端1-69个氨基酸序列存在一定差异,第70位之后序列完全一致。序列差异位点见图4。
[0109]
通过流式细胞术比较抗体与人cldn18a1及cldn18a2的结合
[0110]
因为cldn18a1在cldn18a2在序列上高度相似,因而需要排除与人cldn18a1有交叉的鼠单克隆抗体。构建表达cldn18a1片段(氨基酸序列如seq id no.3所示,编码序列如seq id no.4)的表达载体,并转染cho细胞建立稳定表达cldn18a1的cho-cldn18a1细胞系。在4℃将cho细胞、稳定表达人cldn18a1的cho细胞(cho-cldn18a1)和稳定表达人cldn18a2的cho细胞(cho-cldn18a2)与单克隆抗体孵育30分钟,其后用含1%牛血清白蛋白(bsa)的1
×
pbs洗涤一次。其后与apc标签或者pe标签的抗小鼠igg的第二抗体孵育再孵育30分钟,重复之前的洗涤步骤一次。加入1
×
pbs重悬细胞用cytoflex流式细胞仪(beckman coulter公司)评估结合。图5显示在48株鼠克隆抗体(64株中除去与cho交叉和不结合cho-cldn18a2细胞的)中鉴定的几组单克隆抗体实例:单克隆抗体#1、#26、#38、#63均对cho-cldn18a2有很好的结合,但不结合cho-cldn18a1,单克隆抗体#47与两种同工型cldn18均有结合。
[0111]
此外,本实施例还在cldn18过表达体系里检测了鼠单克隆抗体的特异性。在hek293细胞中分别转染了cldn18a1和cldn18a2的表达载体,转染48小时后,将hek293、hek293-cldn18a1和hek293-cldn18a2细胞铺板,加入单克隆抗体,在4℃孵育30分钟,其后用含1%牛血清白蛋白(bsa)的1
×
pbs洗涤一次。其后与apc标签或者pe标签的抗小鼠igg的第二抗体孵育再孵育30分钟,重复之前的洗涤步骤一次。加入1
×
pbs重悬细胞用beckman countlerli流式细胞仪评估结合。如图6所示,单克隆抗体#38可以结合hek293-cldn18a2,但不结合hek293-cldn18a1,而单克隆抗体#47则对hek293cldn18a1和hek293 cld18a2均可结合。
[0112]
综合以上两体系的结果,这48株鼠单抗中,比较特异的结合cldn18a2的鼠单抗为#
1、#4、#6、#8、#13、#14、#16、#18、#20、#24、#26、#28、#31、#35、#38、#49、#52、#60、#62和#63。
[0113]
3.确定胃癌细胞和人胰腺癌细胞系中cldn18的表达
[0114]
在real-time pcr分析中使用cldn18a1和cldn18a2基因特异性引物对(seq id no.7-13,seq id no.7-10检测cldn18a1基因,seq id no.11-13检测cldn18a2基因)检测cldn18a1和cldn18a2在肿瘤细胞系的表达,发现人胃癌细胞系nci-snu-16(北纳创联生物,cat#bncc332906)、nugc-4(南京科佰生物,cat#cbp60493)和kato-iii(中科院上海细胞库,cat#scsp-573)和人胰腺癌细胞系dan-g(北纳创联生物,cat#bncc340507)有cldn18a2的表达。其中,相对于jurkat细胞(来源于北京合作单位),nugc-4细胞的cldn18a2的rna水平最高,nci-snu-16表达cldn18a2的水平最低。而nci-snu-16、nugc-4、kato-iii、dan-g在rna水平均未检测到cldn18a1的表达(图7中a和图7中b)。
[0115]
在用化药组合eof(10ng/ml表柔比星 10ng/ml 5-氟脲嘧啶 500ng/ml奥沙利铂)处理96小时后,可以看到nugc4、katoiii和dan-g的cldn18a2的转录呈现了明显的增加,而nci-snu-16处理前后cldn18a2的表达无明显变化。对于cldn18a1,eof处理后nci-snu-16、nugc-4和kato-iii的cldn18a1的表达也呈现一定的增加,但转录水平远远低于cldn18a2。而dan-g在处理前后的cldn18a1无明显变化(图7中c和图7中d)。
[0116]
取人胃癌细胞系snu-16、nugc-4和kato-iii、人胰腺癌细胞系dan-g细胞以及淋巴瘤细胞jurkat细胞和k562细胞(中科院上海细胞库,cat#tchu191)样品,用含十二烷基硫酸钠的上样缓冲液裂解细胞,进行sds-page,对凝胶进行免疫印迹,并用靶向cldn18蛋白c端的抗体(invitrogen,cat#700178)孵育,之后与辣根过氧化物酶(hrp)标记的抗兔第二抗体孵育后,用tmb试剂使印迹显色。结果如图8所示,katoiii、k562、nugc-4、raji以及nci-snu-16细胞均有cldn18蛋白的表达,nugc-4的表达量最高。而jurkat和dan-g在蛋白水平未检测到cldn18的表达。
[0117]
4.在内源性表达cldn18的细胞中检测筛选特异性结合cldn18a2的单克隆抗体
[0118]
为了进一步筛选确认特异性结合cldn18a2的抗体,用编码cldn18a1和编码cldn18a2的表达载体分别转染胃癌细胞nugc-4和nci-snu-16。48小时后,将转染后的细胞铺至u底96孔板,4℃与鼠单抗孵育30分钟,其后用含1%牛血清白蛋白(bsa)的1
×
pbs洗涤一次。再与apc标签或者pe标签的抗小鼠igg的第二抗体孵育30分钟,重复之前的洗涤步骤一次。加入1
×
pbs重悬细胞,用cytoflex流式细胞仪(beckman coulter)评估结合。如图9显示,最终确认的无cldn18a1结合交叉的单克隆抗体包括#1、#26、#38、#49、#52、#60、#63(序列信息见表3-5)。
[0119]
表3小鼠单克隆抗体序列信息
[0120][0121]
表4小鼠单克隆抗体cdr序列信息
[0122][0123]
表5小鼠单克隆抗体cdr序列对应的序列标识符
[0124]
序号名称hcdr1hcdr2hcdr312cld18.2-6283542262cldn18.2-529364338cld18.2-1303744
494cld18.2-3313845526cld18.2-27323946608cld18.2-1334047634cld18.2-1344148序号名称lcdr1lcdr2lcdr312cld18.2-6495459262cldn18.2-550546038cld18.2-1515561494cld18.2-3525662526cld18.2-27505463608cld18.2-1535764634cld18.2-1495865
[0125]
5.单克隆抗体与cho-cldn18a2的结合曲线测定
[0126]
为了比较鼠单克隆抗体和imab362的亲和力,将imab362的fc段替换成了小鼠migg1,构建表达了imab362-ch1。
[0127]
对上述表3中的7个特异性结合cldn18a2的鼠单抗与cho-cldn18a2细胞的结合进行了浓度滴定,借助流式细胞仪进行检测,绘制出了结合曲线(图10)。从图中可以看到,7个鼠单抗与cho-cldn18a2有很好的结合,其中至少有两个鼠单抗(#52和#63)对cho-cldn18a2细胞的亲和力是高于阳性抗体imab362-ch1的。
[0128]
实施例3
[0129]
针对cldn18a2的单克隆抗体的结合表位竞争检测
[0130]
检测了靶向cldn18a2的鼠单克隆抗体与imab362的表位交叉情况。具体实验步骤如下:
[0131]
(1)体稀释:用含1%bsa的1
×
pbs将鼠单抗、imab362及同型对照稀释成浓度20μg/ml;
[0132]
(2)胞计数并铺板:将待检测细胞cho-cldn18a2细胞用facs buffer调整细胞密度为4
×
106个/ml,按100μl/管均分到96孔v型板中,离心弃上清;
[0133]
(3)上述稀释好的第一抗体别加入到cho-cldn18a2细胞中,100μl/孔,2-8℃孵育30分钟,之后加入第二抗体,100μl/孔,2-8℃继续孵育30分钟;
[0134]
(4)取出96孔板,250g离心5min,小心去上清后,加入facs buffer 200ul/孔,再次250g离心5min,小心去上清;
[0135]
(5)用含1%bsa的1
×
pbs配制pe荧光二抗(1:500x稀释),按100μl/孔加入对应的96孔板中,2-8度孵育30分钟;
[0136]
(6)取出96孔板,250g离心5min,小心去上清后,加入facs buffer 200ul/孔,再次250g离心5min,小心去上清;
[0137]
(7)用1
×
pbs 100μl/孔重悬,流式细胞仪上机检测。
[0138]
结果如图11和图12所示。第一抗体为imab362时,基本不影响第二抗体1#、#26、#49、#52、#60和#63的结合,但是会显著阻断#38鼠单克隆抗结合。而第一抗体为鼠单克隆抗体#1、#26、#49、#60、#63的情况下,会完全阻断imab362抗体的结合,第一抗体为#38、#49、#
52会减弱imab362抗体的结合。以上结果说明,#38和#52抗体与imab362结合表位可能重叠,而#1、#26、#49、#60、#63则与imab362识别不同表位。
[0139]
实施例4
[0140]
靶向cldn18a2的单克隆抗体与外周血淋巴细胞(pbmc)的结合
[0141]
分离外周血淋巴细胞按如下步骤进行:
[0142]
(1)从健康志愿者体内抽取新鲜血液至采血管,2000rpm室温离心(加速9,减速5),5min,去血清,加pbs稀释一倍;
[0143]
(2)在50ml管中加15ml的ficoll淋巴分离液(达科为,cat#as1114546),将稀释后的血细胞加至ficoll液面,2000rpm室温离心(加速5,减速0),20min;
[0144]
(3)将白膜层取至50ml管中,加pbs稀释三倍以上,1500rpm室温离心5min,得到外周血淋巴细胞(pbmc)。
[0145]
(4)在4℃将pbmc细胞与单克隆抗体孵育30分钟,其后用含1%牛血清白蛋白(bsa)的1
×
pbs洗涤一次。其后用apc标签或者pe标签的抗小鼠igg的第二抗体再孵育30分钟,重复之前的洗涤步骤一次。加入1
×
pbs重悬细胞,用cytoflex流式细胞仪(beckman countler公司)评估结合。同步的,用cd14(biolegend,cat#301808)抗体、cd3(biolegend,cat#300312)抗体、cd19(biolegend,cat#392504)抗体对pbmc细胞进行染色,画门。
[0146]
如图13所示,鼠单克隆抗体(#1、#26、#38、#49、#52、#60、#63)与p1、p2、p3门中的pbmc细胞均无结合。其中,p1门中主要为cd14阳性细胞,p2门中为cd3和cd14阳性细胞,p3门中为cd19和cd3阳性细胞。
[0147]
实施例5
[0148]
靶向cldn18a2的单克隆抗体与肿瘤组织结合的特异性
[0149]
为了确认单克隆抗体与肿瘤组织结合的特异性,检测了单克隆抗体与胃腺癌、非小细胞肺癌以及乳腺癌组织的结合。
[0150]
将浸泡在hanks溶液(碧云天,cat#c0218)中的肿瘤组织和癌旁组织用手术剪剪成小块,放置在10cm培养皿中。加入用1
×
pbs缓冲液配制0.1%的胶原酶(sigma-aldrich,cat#c5138)的0.25%的胰蛋白酶,37℃、5%co2条件下消化30分钟至1小时。将消化后的肿瘤组织通过细胞滤膜过滤,离心收集消化下来的单细胞,分别加入2ml红细胞裂解液(gibco,cat#a1049201)重悬,室温反应5分钟,补加pbs至20ml,离心收集细胞。将待检测细胞进行细胞计数,并调整细胞密度,以2
×
105/孔加入到96孔u型板中,4℃、300g离心5分钟。用含3%牛血清白蛋白(bsa)的1
×
pbs将鼠单抗和对照抗体稀释至20μg/ml。每孔加入100μl稀释好的抗体,4℃孵育30分钟。其后用含3%牛血清白蛋白(bsa)的1
×
pbs洗涤一次。其后用apc标签抗小鼠的第二抗体再在4℃孵育30分钟,重复之前的洗涤步骤一次。然后每孔加入100μl含3%牛血清白蛋白的1
×
pbs,之后加入fitc标签抗人cd45的抗体(biolegend,cat#304054),设置好对照,4摄氏度孵育30分钟。重复之前的洗涤步骤一次,然后每孔用100μl 1
×
pbs重悬。用cytoflex流式细胞仪(beckman countler公司)评估抗体结合情况。
[0151]
图14展示了鼠单克隆抗体与肺癌组织的结合情况,鼠单克隆抗体#26与#60与肺癌组织有结合,鼠单克隆抗体#38、#49、#52、#60、#63与imab362-ch1类似,与肺癌组织无结合。
[0152]
图15展示了鼠单抗与乳腺癌组织的结合情况,鼠单克隆抗体#26、#38、#49、imab362-ch1与乳腺癌组织有结合,鼠单克隆抗体#52、#60、#63与乳腺癌组织弱结合或不结
合。
[0153]
图16展示了鼠单抗与胃癌组织的结合情况,鼠单克隆抗体#26、#38、#49、#52、#60、#63和imab362-ch1均与胃癌组织结合。
[0154]
实施例6
[0155]
补体依赖性细胞毒性(cdc)
[0156]
通过从健康志愿者中抽血至采血管,接着以600g、离心20分钟来制备用于补体裂解的血清,收获血清保存在4℃。室温下将细胞(cho、cho-cldn18a1、cho-cldn18a2)、单克隆抗体(30μg/ml)、健康志愿者血清(用optimem培养基按1:3稀释后的)等体积混合(单克隆抗体终浓度为10μg/ml),37℃,5%co2条件下孵育3小时,收样前15分钟,加入碘化丙锭(pi,终浓度2.5μg/ml)共孵育,其后用含1%牛血清白蛋白(bsa)的1
×
pbs洗涤一次,加入1
×
pbs重悬。用cytoflex流式细胞仪(beckman countler)上机检测杀伤效果。
[0157]
通过调整前侧向散射(forward scatter and sideward scatter)阈值来区分细胞碎片。pi细胞阳性细胞的百分比示于图17。单克隆抗体#26、#38、#49、#52、#60、#63及imab362、imab362-ch1的补体依赖性细胞毒性结果汇总于图18。
[0158]
在无血清情况下,相比于同型对照组,单克隆抗体#52、#63和imab362、imab362-ch1不介导cho细胞和cho-cldn18a1的cdc。但鼠单克隆抗体#26、#38、#49、#60在无血清情况下即可引起一定程度的细胞死亡,说明鼠单克隆抗体#26、#38、#49和#60可能还有其他非cdc的细胞死亡诱导机制。
[0159]
在有血清情况下,相比于同型对照组,单克隆抗体对cho细胞依然不产生cdc效应。对cho-cldn18a2细胞,单克隆抗体#26、#38、#49、#60及imab362介导高度cdc反应,#52、#63单克隆抗体介导中度cdc反应,imab362-ch1介导低度cdc反应。对cho-cldn18a1,imab362和鼠单克隆抗体#38介导低度cdc反应,鼠单克隆抗体#26、#49、#60介导中度cdc反应。在加血清后,#38单克隆抗体所引起的细胞死亡较无血清条件有所降低。
[0160]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

