1.本发明涉及动物饲料原料领域,具体涉及一种高消化率乳酸片球菌发酵湿豆粕及其制备方法。
背景技术:
2.豆粕作为一种植物性饲料蛋白原料,已受到广大的应用及关注。但豆粕中含有较多抗营养因子,严重影响了豆粕在动物饲料中的消化吸收利用率。豆粕中的抗营养因子分为两类,热不稳定性抗营养因子和热稳定性抗营养因子,其中热稳定性抗营养因子主要包括大豆抗原蛋白球蛋白和β
‑
伴球蛋白、大豆寡糖主要为棉籽糖和水苏糖为主, 还包括胰蛋白酶抑制因子、植酸和脲酶活性等。大豆抗原蛋白主要是大豆球蛋白与β
‑
伴大豆球蛋白,它们具有抗原性和致敏性。当抗原蛋白进入动物机体后。免疫系统对抗原蛋白特别敏感,引起过敏反应, 哺乳期动物易导致腹泻、生产性能下降甚至死亡,同时伴随肠粘膜损害及肠道消化吸收能力下降。豆粕中的寡糖类物质是其另一大抗营养因子,这些糖在肠道中被有益菌发酵利用,但含量过高,发酵产气过多可能导致肠胃胀气,同时,发酵产物也可导致腹泻。另外,豆粕还存一定量的非淀粉多糖。非淀粉多糖(nsp)是饲料纤维的主要成分,这些纤维将饲料营养物质包围在细胞壁里面,部分纤维可溶解于水并产生粘性物质。这些粘性物质抑制动物的正常消化功能,妨碍动物吸收营养。如将这些nsp去除,营养物质就能从细胞壁里释放出来,从而提高代谢能和蛋白质的利用率。豆粕中的非淀粉多糖可通过利用酶制剂及发酵的方式去除豆粕中被细胞结构包围的淀粉和蛋白就可释放,从而提高了大豆粕的代谢能和蛋白质的利用率。
3.目前已有大量的关于发酵豆粕的专利,大多降低抗原蛋白含量和寡糖含量为主。但关于去除豆粕中非淀粉多糖的文献报道少之又少。严重影响豆粕在动物饲料中的消化吸收利用率。
4.相关专利一种高蛋白发酵豆粕及其应用表明,虽然能够得到粗蛋白含量高达的发酵豆粕,但由于机体蛋白吸收能力有限,以及其他抗营养因子的存在,也会导致蛋白的消化利用率降低。综上所述,通过微生物发酵技术及酶工程技术,可降低非淀粉多糖含量、及寡糖含量,通过有益代谢产物的积累提高动物对豆粕的利用率,可以进一步提高豆粕在动物蛋白饲料源的地位。
技术实现要素:
5.本发明为了解决现有技术中存在的不足,本发明的目的是提供一种高消化率乳酸片球菌发酵湿豆粕及其制备方法。
6.为达到上述目的,本发明主要提供如下技术方案:
7.一种高消化率乳酸片球菌发酵湿豆粕,粉碎的豆粕原料中加入经液态增殖的乳酸片球菌和复合酶制剂进行发酵即可。
8.具体方法采用如下步骤:将豆粕原料粉碎,加水混合均匀后灭菌,同时加入经液态
增殖的乳酸片球菌和复合酶制剂,恒温慢速酶解发酵,发酵后固液分离,烘干、粉碎即得到乳酸片球菌高消化率发酵湿豆粕。所述豆粕原料与水的质量比为5~7:3~5,所述恒温慢速酶解发酵的条件为37℃,72h。
9.所述复合酶制剂即酸性蛋白酶、中性蛋白酶、碱性蛋白酶,按质量份数比4:2:4混合。
10.所述乳酸片球菌的接种量为5~15%。
11.所述酸性蛋白酶、中性蛋白酶和碱性蛋白酶添加量均为2500u。
12.所述乳酸片球菌(pediococcus acidilacticii)来源于手工酸菜作坊采集样品,于2020年9月16日,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址:北京市朝阳区北辰西路1号院3 号,保藏编号为cgmcc no.20658。
13.5、按权利要求7所述高消化率乳酸片球菌发酵湿豆粕,其特征在于:经液态增殖的乳酸片球菌是将保藏于微生物菌种保藏中心的乳酸片球菌,按照1
‰
接种量接种到mrs液体培养基中,37℃培养24h,活化 2~3代即可。
14.将豆粕原料粉碎,加水混合均匀后灭菌,同时加入经液态增殖的乳酸片球菌和复合蛋白酶,恒温慢速发酵,发酵后固液分离,烘干、粉碎即得到乳酸片球菌高消化率发酵湿豆粕。
15.本发明由于采取以上技术方案,其具有以下优点:
16.本产品通过添加复合酶制剂与乳酸片球菌混合发酵相结合的方法酸溶蛋白含量高达10.25%,必需氨基酸整体提升,消化率高达79.68%。其他各项营养含量有所增加,本方法对豆粕的营养价值提升具有重要作用。
17.通过特定的复合酶制剂的组成和添加量,利用各种酶之间的协同作用, 有效降低了非淀粉多糖含量,再经发酵,被微生物利用形成一系列有利于消化吸收的代谢产物,提高了饲料消化利用率。
18.还通过添加复合酶制剂及乳酸片球菌,进一步酶解非淀粉多糖的降解物,进行生物转化,积累有益代谢产物,提高了发酵豆粕的风味,得到的高消化率发酵豆粕,适口性更好。
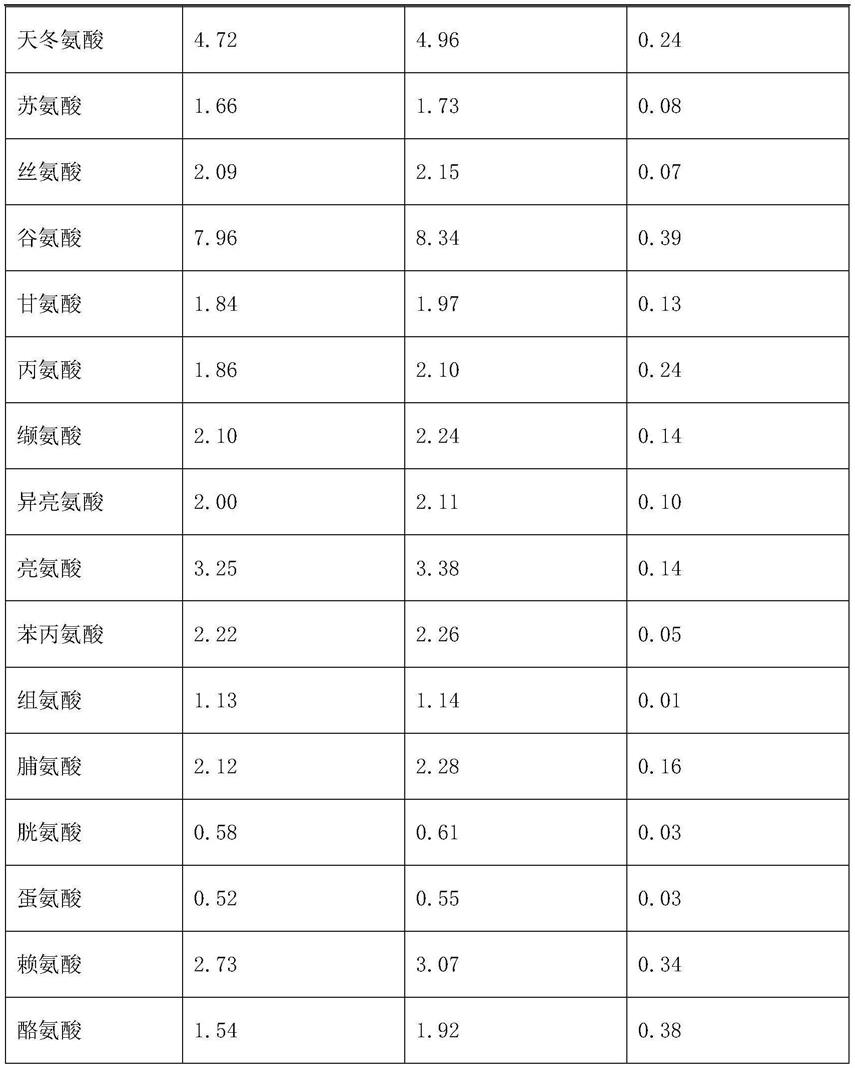
19.本产品的高消化率发酵豆粕粗蛋白含量提高至26.4%,酸溶蛋白含量高达10.25%,必需氨基酸整体提升,消化率高达79.68%。
具体实施方式
20.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
21.实施例一
22.将两份1kg豆粕粉碎至40目为原料和水按比例50%混合,121℃灭菌,一份作为试验组,一份作为对照组,试验组和对照组均添加复合酶制剂,复合酶制剂(酸性蛋白酶:中性蛋白酶:碱性蛋白酶为4:2:4),添加量均为2500u。对照组不添加菌株,试验组再添加10%活化好的乳酸片球菌进行发酵处理(乳酸片球菌按照1
‰
接种量接种到mrs液体培养基中,37
℃培养24h,活化3代即可),发酵72小时后固液分离, 烘干、粉碎。
23.乳酸片球菌(pediococcus acidilacticii)来源于手工酸菜作坊采集样品,于2020年9月16日,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址:北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.20658。
24.表一 豆粕原料与本实施例的高消化率乳酸片球菌发酵湿豆粕的处理前和处理后对比表如下:
25.营养指标对照组试验组粗蛋白22.4%26.34%酸溶蛋白1.25%10.25%消化率43.52%79.72%总酸0.6%4.8%粗纤维6.3%5.2%酸溶蛋白/粗蛋白5.5838.9非淀粉多糖13.99%9.99%有益活菌含量—6.8
×
108cfu/g
26.分析:表一是对本实施例的豆粕原料对照组和按本实施例方法得到的试验组产品进行营养成分分析。结果显示,豆粕中的营养成分均有所改善,其中蛋白质含量从22%左右提升至26%左右,此外,本实施得到的发酵豆粕中的大分子蛋白明显降解为小分子蛋白,即酸溶蛋白,酸溶蛋白含量高达10.25%,分子蛋白相比于大分子蛋白更利于动物吸收,促进肠道发育。有益菌活菌含量达到108cfu/g以上,消化率高达79.68%,提高其饲用品质。
27.表二 处理前后豆粕中必需氨基酸组成的变化(%)
28.[0029][0030]
分析:由上表二可知,必需氨基酸含量有所提升,豆粕氨基酸平衡进一步得到改善。
[0031]
表三 抗营养因子含量的变化
[0032]
[0033][0034]
由表三可知,抗营养因子含量有效降低,豆粕营养价值进一步提高。
[0035]
实施例二
[0036]
将三份1kg豆粕粉碎至40目为原料和水按比例50%混合,121℃灭菌, 一份作为试验i组,一份作为试验ii组,一份作为对照组,三组均添加复合酶制剂,其中复合酶制剂(酸性蛋白酶:中性蛋白酶:碱性蛋白酶为4:2:4)添加量均为2500u。对照组不进行添加菌株处理,试验i组添加10%活化好的乳酸片球菌进行发酵处理,试验ii组添加 10%活化好的酿酒酵母菌进行发酵处理(酿酒酵母菌活化步骤同乳酸片球菌,菌株为实验室分离菌株)均发酵72小时后固液分离,烘干、粉碎。
[0037]
表四 豆粕原料与试验i组,试验ii组处理常规营养指标对比如下:
[0038][0039][0040]
分析:由表四可知,试验i组、试验ii组较对照组豆粕中的营养指标均有所改善,但试验i组较试验ii组改善效果更好,
[0041]
表五 豆粕中必需氨基酸组成的变化(%)
[0042][0043][0044]
分析:由表五可知,试验组必需氨基酸含量较对照组相比有所提升,且试验i组必需氨基酸提升量高于试验ii组,因此,经乳酸片球菌发酵处理的豆粕氨基酸平衡改善效果更好。
[0045]
表六 抗营养因子含量的变化
[0046]
抗营养因子对照组试验i组降低量试验ii组降低量胰蛋白酶抑制剂活(iu/g)3.21.746.8%2.618.7%大豆半球蛋白7s(ng/g)1.040.3547.5%0.8518.3%大豆球蛋白11s(ng/g)1.470.3476.8%0.9634.7%
植酸含量(mg)5.461.1079.8%3.9827.1%
[0047]
分析:表六可知,与对照组相比,试验i组,试验ii组抗营养因子含量均降低趋势,但试验i组抗营养因子含量降低量更高,豆粕营养价值提升更高。
[0048]
实施三
[0049]
将四份1kg豆粕粉碎至40目为原料和水按比例50%混合,121℃灭菌, 一份作为试验i组,一份作为试验ii组,一份作为试验iii组,一份作为对照组,
[0050]
四组均添加复合酶制剂,其中复合酶制剂(酸性蛋白酶:中性蛋白酶:碱性蛋白酶为4:2:4)添加量均为2500u。对照组不进行添加菌株处理,随后试验i组添加5%活化好的乳酸片球菌进行发酵处理,试验 ii组添加10%活化好的乳酸片球菌进行发酵处理,试验iii组添加15%活化好的活化好的乳酸片球菌进行发酵处理。均发酵72小时后固液分离,烘干、粉碎。
[0051]
表七 豆粕原料与试验处理组常规营养指标对比如下:
[0052]
营养指标对照组试验组i试验组ii试验iii组粗蛋白22.4%24.32%26.34%25.46%酸溶蛋白1.25%5.26%10.25%6.47%消化率43.52%52.34%79.72%61.25%总酸0.6%1.4%4.8%2.7%粗纤维6.3%5.8%5.2%6.0%酸溶蛋白/粗蛋白5.5821.638.925.4非淀粉多糖13.99%12.78%9.99%12.12%有益活菌含量—7.6
×
105cfu/g6.8
×
108cfu/g7.4
×
107cfu/g
[0053]
分析:根据表七可知,与对照组相比,试验ii组豆粕相关营养指标改善程度较好,因此,10%乳酸片球菌处理组对发酵豆粕营养指标改善最明显。
[0054]
表八 豆粕中必需氨基酸组成的变化(%)
[0055]
[0056][0057]
分析:由表五可知,试验组必需氨基酸含量较对照组相比有所提升,且试验ii组必需氨基酸提升量高于试验i组和试验iii组,因此,经添加量为10%的乳酸片球菌发酵处理的豆粕氨基酸平衡改善效果更好。
[0058]
(表九)抗营养因子含量的变化
[0059][0060]
分析:表九可知,与对照组相比,试验i组、试验ii组、试验iii组抗营养因子含量均降低趋势,但试验ii组抗营养因子含量降低量比对照组和试验i组、iii组更高,因此,试验ii组豆粕营养价值提升更高。
[0061]
以上的检查方法采用以下检测标准:
[0062]
非淀粉多糖测定按总糖含量减去还原糖的含量计算,总糖和还原糖采用—硝基水杨酸比色法进行测定。
[0063]
用移液管分别准确吸取0ml、0.2ml、0.4ml、0.8ml、1.0ml、1.2ml 葡萄糖标准溶液于6支10ml具塞刻度试管中,加水使溶液体积补至 2.0ml,加入4.0ml 3,5
‑
二硝基水杨酸试剂,置沸水浴中加热5min,取出,立即置冷水中,冷却至室温,定容,摇匀。所得系列葡金糖标准溶液浓度分别为0mg/ml、0.02mg/ml、0.04mg/ml、0.08mg/ml、0.10mg/ml、0.12mg/ml.用分光光度计测定540nm吸光度值。以葡萄糖浓度(mg/ml)为纵坐标(y),吸光度值为横坐标(x),绘制标准曲线。根据不同样品中糖的含量,用移液管吸取滤液5ml~20ml(v2)于容量瓶中,用水定容至100ml(v1).从容量瓶中吸取1.00ml(v1)样液于 10ml(vs)容量瓶或具塞刻度试管中,各加水至2.0ml.以下按上述标准曲线绘制的步骤操作。记录测定的吸光度值,从标准曲线求得测定液中还原糖的浓度。
[0064]
根据样品含糖量高低,用移液管吸取样液5ml~10ml(v2)于容量瓶中,加入6mol/l.盐酸溶液1ml.置恒温水浴锅中(80
±
2)℃加热10min, 取出,置冷水槽中冷却至室温,加甲基红指示剂3滴,用6mol/l氢氧化钠溶液中和至浅橙色,用水定容至100ml(v3),混匀。以下按还原糖的测定步骤操作。
[0065]
空白试验:除不加试料外,采用完全相同的测定步骤进行平行操作。
[0066]
结果计算
[0067]
除水果干制品外的样品可溶性糖含量以质量分数计,按式(1)计算,水果干制品可溶性糖含量以质量分数计,按式(2)计算。
[0068][0069]
x
‑
样品中可溶性糖含量,单位为质量百分数(%);
[0070]
p
‑
试样测定液中还原糖的浓度,单位为毫克每毫升(mg/ml);v1‑
样液定容体积,单位为毫升(ml);
[0071]
v2‑
样液分取体积,单位为毫升(ml);
[0072]
v3‑
分取样液定容体积,单位为毫升(ml);
[0073]
v4‑
测定液吸取体积,单位为毫升(ml);
[0074]
v5‑
测定样液体积,单位为毫升(ml);
[0075]
a
‑
稀释倍数,多汁水果为1,含水量少的水果为2;
[0076]
m
‑
试样质量,单位为克(g);
[0077]
10
‑
测定结果换算为质量百分数的转换系数。
[0078][0079]
m1‑
样品烘干前质量,单位为克(g);
[0080]
m2‑
样品烘干后质量,单位为克(g)。
[0081]
计算结果表示到小数点后两位。
[0082]
蛋白质含量测定按照一食品中蛋白质的测定方法测定。
[0083]
根据国标gb5009.5—2016,称取充分混匀的固体试样0.2g~2g、半固体试样2g~5g或液体试样10g
‑
25g(约当于30mg~40mg氮),精确至0.001g,至消化管中,再加入0.4g硫酸铜、6g硫酸钾及20ml硫酸于消化炉进行消化。当消化炉温度达到420℃之后,继续消化1h,此时消化管中的液体呈绿色透明状,取出冷却后加入50ml水,于自动凯氏定氮仪(使用前加入氢氧化钠溶液、盐酸或硫酸标准溶液以及含有混合指示剂a或b的硼酸溶液)上实现自动加液、蒸馏、滴定和记录滴定数据的过程。
[0084]
试样中蛋白质的含量按式(1)计算:
[0085]
(1)式中:
[0086]
x———试样中蛋白质的含量,单位为克每百克(g/100g);
[0087]
v1———试液消耗硫酸或盐酸标准滴定液的体积,单位为毫升(ml);
[0088]
v2———试剂空白消耗硫酸或盐酸标准滴定液的体积,单位为毫升(ml)
[0089]
c———硫酸或盐酸标准滴定溶液浓度,单位为摩尔每升(mol/l);
[0090]
0.0140———1.0ml硫酸[c(12h2so4)=1.000mol/l]或盐酸[c(hcl)=1.000mol/l]标准滴定溶液相当的氮的质量,单位为克(g);
[0091]
m———试样的质量,单位为克(g);
[0092]
v3———吸取消化液的体积,单位为毫升(ml);
[0093]
f———氮换算为蛋白质的系数,各种食品中氮转换系数见附录a;
[0094]
100———换算系数。蛋白质含量≥1g/100g时,结果保留三位有效数字;蛋白质含量<1g/100g时,结果保留两位有效数字。
[0095]
注:当只检测氮含量时,不需要乘蛋白质换算系数f。
[0096]
必需氨基酸的测定按照
‑
食品中氨基酸的测定方法测定。
[0097]
根据国标gb5009.235
‑
2016进行检测,称量1.00g(或吸取1.0ml)试样于50ml容量瓶中,加水稀释至刻度,混匀。精密吸取氨氮标准使用溶液0ml、0.05ml、0.1ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml(相当于nh3‑
n0μg、5.0μg、10.0μg、20.0μg、40.0μg、60.0μg、 80.0μg、100.0μg)分别于10ml比色管中。向各比色管分别加入4ml 乙酸钠
‑
乙酸缓冲溶液(ph4.8)及4ml显色剂,用水稀释至刻度,混匀。置于100℃水浴中加热15min,取出,水浴冷却
至室温后,移入1cm比色皿内,以零管为参比,于波长400nm处测量吸光度,绘制标准曲线或计算线性回归方程。精密吸取2ml试样稀释溶液于10ml比色管中。加入4ml乙酸钠
‑
乙酸缓冲溶液(ph4.8)及4ml显色剂,用水稀释至刻度,混匀。置于100℃水浴中加热15min,取出,水浴冷却至室温后,移入1cm比色皿内,以零管为参比,于波长400nm处测量吸光度。
[0098]
试样吸光度与标准曲线比较定量或代入线性回归方程,计算试样含量。试样中氨基酸态氮的含量按下式进行计算:
[0099][0100][0101]
x1———试样中氨基酸态氮的含量,单位为克每百克(g/100g);
[0102]
x2———试样中氨基酸态氮的含量,单位为克每百毫升(g/100ml);
[0103]
m———试样测定液中氮的质量,单位为微克(ug);
[0104]
m1———称取试样的质量,单位为克(g);
[0105]
v———吸取试样的体积,单位为毫升(ml);
[0106]
v1———测定用试样溶液体积,单位为毫升(ml);
[0107]
v2———试样前处理中的定容体积,单位为毫升(ml);
[0108]
100、1000———单位换算系数。
[0109]
有益菌活菌含量检测以无菌操作称取25g样品,置于装有225ml生理盐水的无菌均质杯内,于8000~10000r/min均质1~2min,制成1:10样品匀液;用1ml 无菌吸管或微量移液器吸取1:10样品匀液1ml,沿管壁缓慢注于装有9ml生理盐水的无菌试管中,漩涡震荡充分混合均匀,制成1:100 的样品匀液。另取1ml无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品匀液,每递增稀释一次,即换用1次1ml灭菌吸管或吸头。根据待检样品活菌总数的估计,选择3个连续的适宜稀释度,每个稀释度吸取0.1ml样品匀液分别置于2个琼脂平板,使用l形棒进行表面涂布。翻转平皿置30
±
1℃培养箱中培养20~48h后计算平板上的所有菌落数。从样品稀释到平板涂布尽量在30min内完成。结果计算:
[0110][0111]
产品的活菌含量即检测得到的总活菌数。
[0112]
根据菌落计数结果出具报告,称重取样以cfu/g为单位报告,体积取样以cfu/ml为单位报告。
[0113]
以上仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。