一种采用光催化多组分petasis反应制备
α
‑
分支仲胺类化合物的方法
技术领域
1.本发明涉及催化合成技术领域,具体涉及α
‑
分支仲胺类化合物的制备方法。
背景技术:
2.多组分反应是一种聚合反应,三种或三种以上的起始物质通过“一锅法”反应生成一种产物,基本上所有或大部分的原子对新形成的产物均起作用,该过程允许快速和高效地获得高度多样化的化合物,使得反应在原子上和步骤上更经济。其中,α
‑
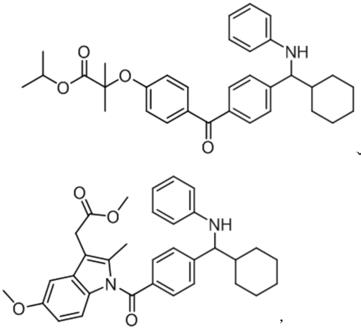
分支仲胺类衍生物普遍存在于医药以及农用化学品中,如以下两种:
[0003][0004]
因此使用便捷高效的多组分方法来合成α
‑
分支仲胺类衍生物是具有很高吸引力的方法。
[0005]
传统的petasis反应就是通过多组分实现α
‑
分支仲胺类化合物的制备,其中一种策略就是通过三氟硼酸钾来预活化烷烃的c
‑
h键作为烷基源进行多组分反应,尽管能够实现α
‑
分支仲胺类化合物的合成,但是,该过程比较复杂,烷基源需要预活化并且原料价格昂贵,这使得该反应策略在工业上大规模应用受到局限,不够节约、便捷高效。因此,寻求一种通过多组分反应,条件绿色温和、便捷高效、节约环保的方法合成α
‑
分支仲胺类化合物是亟待解决的关键问题。
技术实现要素:
[0006]
本发明要解决目前petasis反应需要预活化的烷基源才可实现α
‑
分支仲胺类化合物的合成,并且反应成本较高的技术问题,而提供一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法。
[0007]
一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0008]
一、将一级芳胺化合物、烷烃化合物、醛类化合物、tbadt和乙酸加入到溶剂中,得到混合溶液;
[0009]
二、在惰性氛围条件下,采用leds光源照射步骤一获得的混合溶液,光照时间为12
~50h,旋蒸,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0010]
进一步的,步骤一先将一级芳胺化合物、醛类化合物和乙酸溶于溶剂中,然后加入烷烃化合物和tbadt,得到混合溶液。
[0011]
步骤一所述tbadt为光催化剂四丁基胺十钨酸盐,结构式如下:
[0012][0013]
进一步的,步骤一所述一级芳胺化合物为苯胺、对甲基苯胺、对甲氧基苯胺、对氟苯胺、对氯苯胺、对溴苯胺或2
‑
碘
‑4‑
氟苯胺。
[0014]
进一步的,步骤一所述烷烃化合物为环己烷、环辛烷、降冰片烷、1,4
‑
二氧六环、对甲基甲苯、对氯甲苯、2,3
‑
二甲基
‑2‑
丁烯、3
‑
甲基甲苯、环庚烷或均三甲苯。
[0015]
进一步的,步骤一所述醛类化合物为丙醛、对三氟甲氧基苯甲醛、戊醛、4
‑
(吡唑
‑1‑
基)苯甲醛、庚醛、2
‑
醛基噻唑、异戊醛、3,3
‑
二甲基丁醛、4
‑
苯基丁醛、环己基甲醛、4
‑
醛基四氢吡喃、异丁醛或苯甲醛。
[0016]
进一步的,步骤一所述溶剂为乙腈。
[0017]
进一步的,步骤一所述一级芳胺化合物与溶剂的比例关系为0.2~0.3mmol∶1ml;所述醛类化合物与溶剂的比例关系为0.24~0.36mmol∶1ml;所述烷烃化合物与溶剂的比例关系为4~6mmol∶1ml;tbadt与溶剂的比例关系为12~18mg∶1ml;乙酸与溶剂的比例关系为0.1~0.15mmol∶1ml。
[0018]
进一步的,步骤二通入惰性气体除氧,获得惰性气氛,惰性气体为氩气或氮气。
[0019]
进一步的,步骤二所述leds光源波长为380~400nm,功率为10w,光照温度为室温。
[0020]
进一步的,步骤二所述leds光源波长为380~400nm,功率为50w,光照温度为室温。
[0021]
进一步的,步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液。
[0022]
本发明利用光催化氢原子转移策略,通过使用催化量的tbadt作为氢原子转移催化剂抽取烷烃上的氢用于生成烷基自由基,进一步与一级胺和醛缩合形成的亚胺中间体发生自由基加成反应,进一步发生快速的氢原子过程,最终实现α
‑
分支仲胺类化合物的高效制备,解决了现有合成方法上过于繁琐,需要预活化以及昂贵的烷基源等问题,提供了一种更加温和、绿色、高效的方法。
[0023]
本发明的有益效果是:
[0024]
与现有技术相比,本发明通过一种便捷、绿色温和、高效率的方法来构筑芳基叔胺类化合物,主要具有以下优势:
[0025]
(1)该反应体系为多组份反应,通过一步反应便能实现复杂含氮化合物的构建,操作便捷。
[0026]
(2)反应在室温下通过光照便能实现富有挑战性的α
‑
分支仲胺类化合物的合成,
反应条件绿色温和。
[0027]
(3)该反应体系用的一级芳胺类化合物、烷烃类化合物、醛类化合物、tbadt、乙酸、乙腈溶剂都是廉价、易得的商用化学品,使得整个反应体系节约、效率高。
[0028]
(4)该反应体系底物普适性好,能够进行放大量实验,在室温下通过光照射便能实现克级反应,并且具有较好的产率,体现出高效。
[0029]
(5)使用催化量的光敏剂便能实现该反应的转化,体现了反应的节约环保,并且具有潜在的应用价值。
[0030]
本发明用于制备合成α
‑
分支仲胺类化合物。
附图说明
[0031]
图1为实施例一制备α
‑
分支仲胺化合物
‑
1的反应机理图;
[0032]
图2为实施例五制备的产物为α
‑
分支仲胺化合物
‑
5的1h nmr谱图;
[0033]
图3为实施例五制备的产物为α
‑
分支仲胺化合物
‑
5的
13
c nmr谱图。
具体实施方式
[0034]
本发明技术方案不局限于以下所列举的具体实施方式,还包括各具体实施方式之间的任意组合。
[0035]
具体实施方式一:本实施方式一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0036]
一、将一级芳胺化合物、烷烃化合物、醛类化合物、tbadt和乙酸加入到溶剂中,得到混合溶液;
[0037]
二、在惰性氛围条件下,采用leds光源照射步骤一获得的混合溶液,光照时间为12~50h,旋蒸,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0038]
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一所述一级芳胺化合物为苯胺、对甲基苯胺、对甲氧基苯胺、对氟苯胺、对氯苯胺、对溴苯胺或2
‑
碘
‑4‑
氟苯胺。其它与具体实施方式一相同。
[0039]
具体实施方式三:本实施方式与具体实施方式一或二不同的是:步骤一所述烷烃化合物为环己烷、环辛烷、降冰片烷、1,4
‑
二氧六环、对甲基甲苯、对氯甲苯、2,3
‑
二甲基
‑2‑
丁烯、3
‑
甲基甲苯、环庚烷或均三甲苯。其它与具体实施方式一或二相同。
[0040]
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤一所述醛类化合物为丙醛、对三氟甲氧基苯甲醛、戊醛、4
‑
(吡唑
‑1‑
基)苯甲醛、庚醛、2
‑
醛基噻唑、异戊醛、3,3
‑
二甲基丁醛、4
‑
苯基丁醛、环己基甲醛、4
‑
醛基四氢吡喃、异丁醛或苯甲醛。其它与具体实施方式一至三之一相同。
[0041]
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤一所述溶剂为乙腈。其它与具体实施方式一至四之一相同。
[0042]
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤一所述一级芳胺化合物与溶剂的比例关系为0.2~0.3mmol∶1ml;所述醛类化合物与溶剂的比例关系为0.24~0.36mmol∶1ml;所述烷烃化合物与溶剂的比例关系为4~6mmol∶1ml;tbadt与溶
剂的比例关系为12~18mg∶1ml;乙酸与溶剂的比例关系为0.1~0.15mmol∶1ml。其它与具体实施方式一至五之一相同。
[0043]
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤二通入惰性气体除氧,获得惰性气氛,惰性气体为氩气或氮气。其它与具体实施方式一至六之一相同。
[0044]
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤二所述leds光源波长为380~400nm,功率为10w,光照温度为室温。其它与具体实施方式一至七之一相同。
[0045]
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:步骤二所述leds光源波长为380~400nm,功率为50w,光照温度为室温。其它与具体实施方式一至八之一相同。
[0046]
具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液。其它与具体实施方式一至九之一相同。
[0047]
采用以下实施例和对比实验验证本发明的有益效果:
[0048]
实施例一:
[0049]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0050]
一、将0.2mmol苯胺、0.24mmol苯甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg摩尔浓度为2%的光催化剂tbadt(十钨酸四丁基胺),再加入6mmol环己烷,得到混合溶液;
[0051]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为18h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0052]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0053]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
1,其结构式为:
[0054][0055]
纯度99%,产率为82%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.28(d,j=4.3hz,3h),7.20(dd,j=8.8,4.5hz,1h),7.05(dd,j=8.5,7.4hz,2h),6.60(t,j=7.2hz,1h),6.50(d,j=7.5hz,2h),4.11(d,j=6.3hz,2h),1.89(d,j=12.5hz,1h),1.77
–
1.62(m,4h),1.53(d,j=12.8hz,1h),1.22
–
1.01(m,5h).
13
c nmr(101mhz,cdcl3)δ129.1,128.2,127.3,126.8,113.3,63.6,44.9,30.3,29.5,26.4,26.4,26.4.hrms(esi)(m/z):[m
h] called.for c
19
h
24
n:266.1909,found:266.1918.
[0056]
本实施例的反应机理图,如图1所示:最初,苯胺a与苯甲醛b在乙酸的作用下能够形成亚胺中间体ⅰ,tbadt在leds光源照射下受光激发达到激发态*[w
10
o
32
]4‑
,进一步能够抽取环己烷上c
‑
h键上的氢生成环己基自由基中间体ⅱ,环己基自由基ⅱ进一步去进攻亚胺中间体ⅰ生成氮自由基中间体ⅲ,随后经过一个快速的氢原子转移过程得到α
‑
分支仲胺化合物
‑
1。
[0057]
实施例二:
[0058]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0059]
一、将0.2mmol对氟苯胺、0.24mmol苯甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg摩尔浓度为2%的光催化剂tbadt(十钨酸四丁基胺),再加入6mmol环己烷,得到混合溶液;
[0060]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为18h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0061]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0062]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
2,其结构式为:
[0063][0064]
纯度99%,产率为77%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.31
–
7.24(m,4h),7.20(t,j=6.8hz,1h),6.75(t,j=8.8hz,2h),6.42(s,2h),4.03(d,j=6.3hz,2h),1.89(d,j=12.2hz,1h),1.79
–
1.61(m,4h),1.53(d,j=12.9hz,1h),1.23
–
1.00(m,5h).
13
c nmr(101mhz,cdcl3)δppm=128.2,127.3,126.9,115.45(d,j=22.3hz),114.0,64.2,44.9,30.2,29.6,26.4,26.4,26.3.
19
f nmr(376mhz,cdcl3)δppm=
‑
128.75(s).
[0065]
实施例三:
[0066]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0067]
一、将0.2mmol 2
‑
碘
‑4‑
氟苯胺、0.24mmol苯甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg摩尔浓度为2%的光催化剂tbadt(十钨酸四丁基胺),再加入6mmol环己烷,得到混合溶液;
[0068]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为19h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯
化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0069]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0070]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
3,其结构式为:
[0071][0072]
纯度99%,产率为54%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.36(dd,j=7.9,2.9hz,1h),7.32
–
7.26(m,2h),7.22(dd,j=13.2,7.0hz,3h),6.73(td,j=8.6,2.9hz,1h),6.18(dd,j=9.0,4.9hz,1h),4.63(s,1h),4.10(d,j=5.8hz,1h),1.90(d,j=12.5hz,1h),1.80
–
1.64(m,4h),1.59(d,j=12.9hz,1h),1.17(dt,j=27.0,12.2hz,5h).
13
c nmr(101mhz,cdcl3)δppm=154.45(d,j=239.3hz),143.3,141.6,128.3,127.2,125.3,125.1,115.73(d,j=21.7hz),111.39(d,j=7.3hz),83.98(d,j=8.7hz),64.5,45.0,30.4,29.2,26.4,26.4.
19
f nmr(376mhz,cdcl3)δppm=
‑
127.54(s).
[0073]
实施例四:
[0074]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0075]
一、将0.2mmol苯胺、0.24mmol 4
‑
(吡唑
‑1‑
基)苯甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg(2mmol%)光催化剂tbadt(十钨酸四丁基胺),再加入6mmol环己烷,得到混合溶液;
[0076]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为17h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0077]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0078]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
4,其结构式为:
[0079][0080]
纯度99%,产率为75%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.87(d,j=2.4hz,1h),7.69(d,j=1.5hz,1h),7.61(d,j=8.6hz,2h),7.37(d,j=8.6hz,2h),7.09
–
7.03(m,2h),6.62(t,j=7.2hz,1h),6.51(d,j=7.3hz,2h),6.44
–
6.41(m,1h),4.15(d,j=6.1hz,2h),1.89(d,j=12.1hz,1h),1.77
–
1.57(m,5h),1.25
–
1.04(m,5h).
13
c nmr
(101mhz,cdcl3)δ140.9,139.1,129.1,128.3,126.7,119.2,113.5,107.4,63.1,44.9,30.1,29.5,26.4,26.4,26.3.
[0081]
实施例五:
[0082]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0083]
一、将0.2mmol苯胺、0.24mmol 2
‑
醛基噻唑和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg(2mmol%)光催化剂tbadt(十钨酸四丁基胺),再加入6mmol环己烷,得到混合溶液;
[0084]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为18h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0085]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0086]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
5,其结构式为:
[0087][0088]
纯度99%,产率为62%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.74(d,j=3.3hz,1h),7.19(d,j=3.3hz,1h),7.15
–
7.09(m,2h),6.70(t,j=7.3hz,1h),6.60(d,j=8.5hz,2h),4.59(d,j=5.8hz,1h),1.96(s,1h),1.80(dd,j=36.8,12.0hz,3h),1.70
–
1.60(m,2h),1.28
–
1.13(m,5h).
13
c nmr(101mhz,cdcl3)δppm=175.7,147.1,142.4,129.3,118.7,118.2,113.4,61.7,44.4,30.0,28.9,26.3,26.2.
[0089]
实施例六:
[0090]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0091]
一、将0.2mmol苯胺、0.24mmol环己基甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg(2mmol%)光催化剂tbadt(十钨酸四丁基胺),再加入6mmol环己烷,得到混合溶液;
[0092]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为18h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0093]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0094]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
6,其结构式为:
[0095][0096]
纯度99%,产率为72%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.10(t,j=7.2hz,2h),6.56(d,j=6.9hz,3h),3.36(s,1h),2.98(t,j=5.7hz,1h),1.79
–
1.69(m,6h),1.63(d,j=9.0hz,4h),1.53(d,j=12.1hz,2h),1.17(s,8h),0.96(d,j=12.0hz,2h).
13
c nmr(101mhz,cdcl3)δppm=129.2,115.8,112.3,62.7,40.7,31.1,29.7,28.3,26.5,26.4,22.7.
[0097]
实施例七:
[0098]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0099]
一、将0.2mmol苯胺、0.24mmol苯甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg(2mmol%)光催化剂tbadt(十钨酸四丁基胺),再加入2mmol 2,3
‑
二甲基
‑2‑
丁烯,得到混合溶液;
[0100]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为18h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0101]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0102]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
7,其结构式为:
[0103][0104]
纯度99%,产率为54%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.38(d,j=7.2hz,2h),7.29(t,j=7.3hz,2h),7.24(d,j=4.9hz,1h),7.00(t,j=7.8hz,2h),6.59(t,j=7.3hz,1h),6.38(d,j=8.1hz,2h),5.00(s,2h),4.17(s,2h),1.76(s,3h),1.02(d,j=10.3hz,6h).
13
c nmr(101mhz,cdcl3)δppm=151.4,147.9,140.2,129.0,127.8,127.0,117.3,113.4,112.3,63.4,43.6,26.0,20.7,19.2.
[0105]
实施例八:
[0106]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法,具体按以下步骤进行:
[0107]
一、将0.2mmol苯胺、0.24mmol苯甲醛和0.1mmol乙酸溶于1ml乙腈中,然后加入12mg(2mmol%)光催化剂tbadt(十钨酸四丁基胺),再加入2mmol 1,4
‑
二氧六环,得到混合
溶液;
[0108]
二、通氮气除氧5min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为10w的leds光源照射步骤一获得的混合溶液,控制光照时间为18h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0109]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0110]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
8,其结构式为:
[0111][0112]
纯度99%,产率为69%(d.r.=1.3:1);其核磁数据分析为:major:1h nmr(400mhz,cdcl3)δppm=7.37(d,j=7.5hz,2h),7.32(t,j=7.4hz,2h),7.25(d,j=5.6hz,1h),7.05(t,j=7.9hz,2h),6.64(t,j=7.3hz,1h),6.52(d,j=7.9hz,2h),4.84(s,1h),4.25(d,j=6.8hz,1h),3.86(d,j=11.7hz,1h),3.74
–
3.67(m,3h),3.63(d,j=13.4hz,1h),3.56(d,j=6.7hz,2h).
13
c nmr(101mhz,cdcl3)δppm=147.5,140.4,129.0,128.8,127.8,127.3,117.8,113.9,78.3,68.7,66.6,66.4,59.4.minor:1h nmr(400mhz,cdcl3)δppm=7.40
–
7.28(m,5h),7.15
–
7.07(m,2h),6.71(t,j=7.3hz,1h),6.58(d,j=7.8hz,2h),4.76(s,1h),4.50(d,j=4.7hz,1h),4.01(ddd,j=10.2,4.7,2.5hz,1h),3.86(dtd,j=14.4,11.7,2.9hz,2h),3.75
–
3.67(m,2h),3.57(td,j=11.4,3.1hz,1h),3.43
–
3.36(m,1h).
13
c nmr(101mhz,cdcl3)δppm=147.0,139.0,129.1,128.5,127.6,127.5,117.9,114.1,77.7,68.0,67.4,66.4,59.5.
[0113]
实施例九:
[0114]
本实施例一种采用光催化多组分petasis反应制备α
‑
分支仲胺类化合物的方法(克级反应),具体按以下步骤进行:
[0115]
一、将3mmol苯胺、3.3mmol苯甲醛和1.5mmol乙酸溶于15ml乙腈中,然后加入120mg光催化剂tbadt(十钨酸四丁基胺),再加入9ml环己烷,得到混合溶液;
[0116]
二、通氮气除氧15min,然后在氮气氛围、磁力搅拌器搅拌条件下,采用波长为380~400nm,功率为50w的leds光源照射步骤一获得的混合溶液,控制光照时间为30h,光照温度为室温,用tlc监测反应进度,反应结束后,减压蒸馏除去溶剂,然后采用薄层色谱法分离纯化,所得产物即为α
‑
分支仲胺类化合物,完成该方法。
[0117]
步骤二所述薄层色谱法分离纯化所采用的溶剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的体积比为100:1。
[0118]
通过核磁氢谱、碳谱以及高分辨质谱鉴定本实施例制备的产物为α
‑
分支仲胺化合物
‑
1,其结构式为:
[0119][0120]
纯度99%,产率为82%;其核磁数据分析为:1h nmr(400mhz,cdcl3)δppm=7.28(d,j=4.3hz,3h),7.20(dd,j=8.8,4.5hz,1h),7.05(dd,j=8.5,7.4hz,2h),6.60(t,j=7.2hz,1h),6.50(d,j=7.5hz,2h),4.11(d,j=6.3hz,2h),1.89(d,j=12.5hz,1h),1.77
–
1.62(m,4h),1.53(d,j=12.8hz,1h),1.22
–
1.01(m,5h).
13
c nmr(101mhz,cdcl3)δ129.1,128.2,127.3,126.8,113.3,63.6,44.9,30.3,29.5,26.4,26.4,26.4.hrms(esi)(m/z):[m h] called.for c
19
h
24
n:266.1909,found:266.1918.
[0121]
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

