1.本发明属于公共卫生领域,具体涉及一种检测表面病毒灭活效力的方法及其应用。
背景技术:
2.随着经济和人民生活水平的不断改善,民众对于医疗卫生的意识逐步提高,各类消毒杀毒产品也逐渐走进了千家万户。与此同时,国家对于医疗卫生的重视,也使各企业也纷纷自觉提高自身的卫生标准,建立了多种环境消毒作业流程和产品消毒作业流程,以保证生产环境与产品的洁净度。目前,大部分的消毒程序主要是为了追求更好的灭活效果,因此,往往会采用细胞毒性高、大剂量的药剂进行病毒灭活消毒作业,但大剂量的药物使用会带来严重的消毒剂残留。其中,诸如酸性,或有毒性的消毒剂残留更是会造成产品、仪器设备的腐蚀,缩短设备的使用寿命,或对工作人员的健康造成威胁,增加职业病的患病风险。因此,开发一种灭活效力高、消毒剂使用浓度低、毒性小的多步骤消毒方案极为重要。
3.多步骤病毒灭活方法主要应用于食品包装消毒、商品整体消毒、工作生产环境消毒等多种场景。如在食品包装过程中,生产企业可以利用低浓度药物多次浸泡包装表面以达到对应的灭活效力,同时减少了产品的药物残留以符合食品生产安全标准。而在环境消毒中,消毒人员可以利用多次喷洒低浓度药物从而降低药物对人员健康的危害。因此,研发多步骤消毒的方法对于生产作业尤为重要。
4.但在相关技术中,尚缺乏能够准确测定多步骤消毒方案中每个步骤的灭活效力与整体灭活效力的有效方法及对应的算法,无法得到有效的数据,从而导致多步骤消毒方案的开发收受到了极大的限制。因此,开发一套算法完备的且可适用于单步骤和多步骤消毒方案的检测表面病毒灭活效力的方法对于推动消毒作业体系的完善和发展具有极为重要的意义。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种检测消毒产品或消毒作业的病毒灭活效力的方法,能够模拟多步骤病毒消毒作业流程或以组合用药的形式的抗病毒产品的使用情况,同时考虑了该载体的病毒残留比例,利用残留比例快速计算出该流程的分步(单步)灭活效力与总体灭活效力,实现了产品消毒能力的量化,对多步骤消毒作业方案和抗病毒产品的开发具有极为重要的意义。
6.本发明的第一个方面,提供一种检测消毒产品或消毒作业的病毒灭活效力的方法,包括以下步骤:
7.(1)确定载体类型;
8.(2)判定实验有效性;
9.(3)灭活效力检测;
10.(4)判断待测消毒产品或消毒作业有效性和灭活效力。
11.发明人发现,现有的检测手段难以模拟多步骤消毒作业流程或需多次用药的消毒产品,尤其是其对于多步骤消毒作业中每一步的灭活效力难以确定,而且如果强硬的套用检测手段中的算法,会导致模拟测试结果与实际情况误差大、多次用药灭活效力与单次用药灭活效力难以比较等问题。此外,在检测时,不同材质的载体容器会有不同的病毒残留比例,该残留比例会影响药物的实际灭活效力以及对应的药物施加方法,目前并无有效的手段检测不同材质的材料表面的病毒残留比情况,因此,无法得知其对测试结果的实际影响,不利于多步骤灭活作业或抗病毒产品的研发。基于上述问题,发明人开发了一种检测消毒产品或消毒作业的病毒灭活效力的方法,能够模拟多步骤病毒消毒作业流程或以组合用药的形式的抗病毒产品的使用情况,同时还可以获得该载体的病毒残留比例,并利用残留比例快速计算出该流程的分步灭活效力,与总体灭活效力。而且,本发明中的方法还能获知每一个步骤间的病毒残留比例,从而能够以此为重要指标,判读材料的清洗和灭菌难度,从而可以更高效的获知其适用于何种消毒作业方式。
12.根据本发明的第一个方面,在本发明的一些实施方式中,所述方法的步骤具体为:
13.(1)预备测试:
14.预备测试包含:待测病毒滴度鉴定、产品细胞毒性鉴定、产品有效中和测试三个部分,并设置有阳性对照和阴性对照。
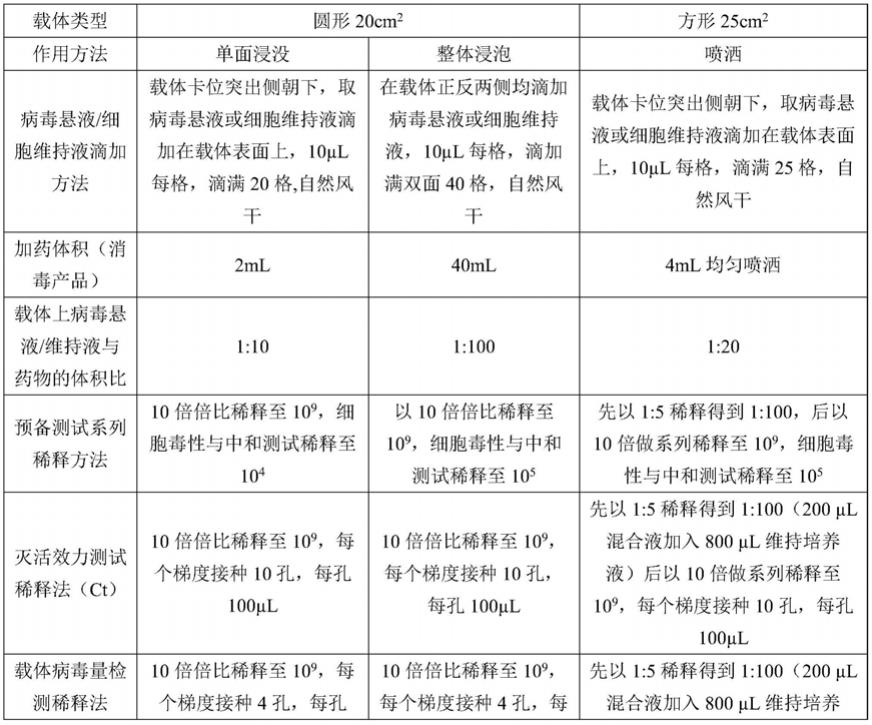
15.在所有测试开始前,需根据待检测的消毒产品或消毒流程用法,选择尺寸合适的载体(选择标准如说明书表1所示),同时确定消毒步骤数。预备测试的检测孔数及其稀释操作如说明书表2所示。
16.①
待测病毒滴度鉴定:
17.按照表2所示,将待测病毒的病毒悬液进行10倍倍比稀释,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。接种后将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天。采用本领域常规方法检测培养后的待测病毒的半数组织培养感染剂量(tcid50),确保其tcid50每毫升的对数值大于7。
18.②
细胞毒性鉴定:
19.根据表1所示,选择尺寸合适的载体,将对应体积的细胞维持液滴加在载体上,静置风干。风干后,将对应体积的待测消毒产品以相应的作用方法施加在载体上,混匀后按对应方法进行稀释,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。其中,若已知待测的消毒产品不可在细胞维持液中稀释去除其细胞毒性,可将其混匀后在sephadex g25凝胶中过滤之后再按表2所示方法稀释。接种完成后,将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天,观察待测消毒产品对细胞生长的影响。
20.③
有效中和测试
21.根据表1所示,选择尺寸合适的载体,将对应体积的细胞维持液滴加在载体上,静置风干。风干后,将对应体积的待测消毒产品以相应的作用方法施加在载体上,混匀后取1200μl混合液(细胞维持液 待测消毒产品)于sephadex g25凝胶过滤之后再按表2所示方法稀释。稀释后,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。其中,若已知待测的消毒产品无细胞毒性,或可通过在细胞维持液中稀释去除其细胞毒性的,则无需使用sephadex g25凝胶过滤,可直接按表2所示方法稀释并接种在细胞板上。然后,每孔加入100μl tcid50对数值在2~3之间的病毒悬液,放入二氧化碳培养箱(37℃,5%co2)培养3~5
天,观察待测消毒产品对细胞生长有无影响,若每孔细胞均被病毒感染,则表明待测消毒产品被有效中和。
22.④
阳性对照与阴性对照:
23.阳性对照:根据表1所示,选择尺寸合适的载体,将对应体积的病毒悬液滴加在载体上,静置风干。风干后,将对应体积的细胞维持液以相应的作用方法施加在载体上,混匀后取100μl接种于细胞板上,接种4孔,将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天,若每孔细胞均被病毒感染,则可认为阳性对照通过,实验数据可采纳,若出现未被病毒感染的情况,重新开始实验。
24.阴性对照:根据表1所示,选择尺寸合适的载体,将对应体积的细胞维持液滴加在载体上,静置风干。风干后,将对应体积的细胞维持液以相应的作用方法施加在载体上,混匀后取100μl接种于细胞板上,接种4孔,将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天,若每孔细胞均无异常,正常生长,则可认为阴性对照通过,实验数据可采纳,若出现任何异常情况或病毒感染,重新开始实验。
25.(2)灭活效力检测:
26.灭活效力检测包含:待测病毒滴度鉴定、灭活效力测试、载体病毒量检测,三个部分,并设置有阳性对照和阴性对照。
27.①
待测病毒滴度鉴定(cv):
28.测试方法同步骤(1)中的
①
。
29.②
灭活效力测试:
30.根据表1所示,选择尺寸合适的载体,将对应体积的病毒悬液滴加在载体上,静置风干。风干后,将对应体积的待测消毒产品以相应的作用方法施加在载体上,混匀后静置使其充分反应。然后取1200μl混合液(病毒悬液 待测消毒产品)于sephadex g25凝胶过滤,根据表1使用合适的稀释法,稀释后,每个稀释度取100μl接种于细胞板上,每个稀释其中,若消毒作业流程为多步消毒法,在第一次灭活效力测试后,用镊子取出载体,放入事先准备好的无菌培养皿中,再重复上述灭活效力测试的操作进行第二次消毒后的灭活效力测试。重复次数按照消毒作业流程的消毒次数决定,但原则上施药次数不超过三次。若已知待测的消毒产品无细胞毒性,或可通过在细胞维持液中稀释去除其细胞毒性的,则无需使用sephadex g25凝胶过滤,直接按上述方法稀释并接种在细胞板上,放入二氧化碳培养箱(37℃,5%co2)培养3~5天,观察测试结果,根据消毒作业流程中的消毒次数,将第n次消毒的结果记录为ct1
‑
ctn。
31.③
载体病毒量检测:
32.根据表1所示,选择尺寸合适的载体,将对应体积的病毒悬液滴加在载体上,静置风干。风干后,将对应体积的细胞维持液以相应的作用方法施加在载体上,混匀后根据表1方法进行稀释。稀释后,取100μl混合液(病毒悬液 细胞维持液)接种于细胞板上,每个稀释度接种4孔。
33.其中,若消毒作业流程为多步消毒法,在第一次载体病毒量检测后,用镊子取出载体,放入事先准备好的无菌培养皿中,再重复上述载体病毒量检测的操作进行第二次消毒后的载体病毒量检测。重复次数按照消毒作业流程的消毒次数决定,但原则上施药次数不超过三次。根据消毒作业流程中的消毒次数,将第n次消毒的结果记录为cc1
‑
ccn。
34.④
阳性对照与阴性对照:
35.同步骤(1)中的阳性对照与阴性对照。
36.其中,上述测试均需于不同时间点重复三次,每次测试的结果单独计算,以确保其准确性。
37.(3)统计与分析:
38.在得到上述实验结果后,利用下述公式计算待测消毒产品或消毒流程的表面灭活效力与单位面积灭活效力,得到最终结果。
39.灭活效力的计算包括三个步骤:分步灭活效力的计算、总体灭活效力的计算、单位面积灭活效力换算,通过该三步,可获得待测消毒产品或消毒流程每毫升灭活病毒滴度值、平均每平方厘米病毒有效感染单位减少值、测试病毒残留比。其算法根据消毒流程的步骤数(消毒次数)分为一步测试计算公式与多步(n步)计算公式。
40.其中,在代入算法前,应准确记录好灭活效力测试(ct)与载体病毒量测试(cc)的所有有效数据,包括其每一步(每一次消毒)的tcid50滴度值,数据格式设为10
n
格式。
41.具体算法如下:
42.①
计算分步灭活效力:
43.每毫升灭活病毒滴度值的公式为:
44.r
logn
=log(10ct(n
‑
1)
×
r
ratio
)
‑
log(10ctn);
45.其中,上述式中,r
ratio
为第n步表面病毒残留比,计算公式为:
[0046][0047]
ccn为第n步载体病毒量测试结果;
[0048]
cc(n
‑
1)为第n
‑
1步载体病毒量测试结果;
[0049]
ctn为第n步灭活效力测试结果;
[0050]
ct(n
‑
1)为第n
‑
1步灭活效力测试结果;
[0051]
r
logn
为第n步每毫升灭活病毒滴度值。
[0052]
②
计算总体灭活效力:
[0053]
将灭活效力测试中最后一步(消毒流程中的最后一次消毒)得到测试结果(ctn)与载体病毒量测试中的第一步(消毒流程中的第一次消毒)得到测试结果(cc1),代入下述算法中,即可得到总体灭活效力。
[0054]
为便于理解,本步骤公式中的n表示最后一步的步骤数(消毒次数)。
[0055]
待测消毒产品或消毒流程的总体每毫升灭活病毒滴度值公式为:
[0056]
r
logt
=log(10cc1)
‑
log(10ctn);
[0057]
其中,上述式中,
[0058]
cc1为第1步载体病毒量测试结果;
[0059]
ctn为最后一步灭活效力测试结果;
[0060]
r
logt
为总体每毫升灭活病毒滴度值。
[0061]
③
单位面积灭活效力换算:
[0062]
在本步骤中,根据具体的作用方法(如表1),代入下述公式计算单位面积灭活效力。其中,本步骤公式中的n表示第n步(第n次消毒)时的步骤数(消毒次数)。
[0063]
(a)作用方法为单面浸泡法或整体浸泡作用法时:
[0064]
总体平均每平方厘米病毒有效感染单位减少值的公式为:
[0065][0066]
第n步平均每平方厘米病毒有效感染单位减少值的公式为:
[0067][0068]
其中,上述式中,
[0069]
cc1为第1步载体病毒量测试结果;
[0070]
r
ratio
为第n步表面病毒残留比,计算公式如上述步骤
①
;
[0071]
ct(n
‑
1)为第n
‑
1步灭活效力测试结果;
[0072]
ctn为最后一步/第n步灭活效力测试结果;
[0073]
rt/cm2为总体平均每平方厘米病毒有效感染单位减少值
[0074]
rn/cm2为第n步平均每平方厘米病毒有效感染单位减少值。
[0075]
(b)作用方法为喷洒作用法时:
[0076]
总体平均每平方厘米病毒有效感染单位减少值的公式为:
[0077][0078]
第n步平均每平方厘米病毒有效感染单位减少值的公式为:
[0079][0080]
④
判断标准:
[0081]
使用上述算法计算后,根据计算结果判断待测消毒产品或消毒流程的实际效力。
[0082]
其中,对于表面病毒残留比(r
ratio
),若病毒残留比小于3%,为极低度残留,说明表面黏度极低,灭活效力极高;若病毒残留比为3~10%,为低度残留,说明表面黏度低,灭活效力高;若病毒残留比为10~20%,为中度残留,说明表面黏度中,灭活效力中;若病毒残留比大于20%,为重度残留,说明表面黏度高,灭活效力低。上述实施例中得到的病毒残留比,可以作为该材质在该消毒法下,病毒洗脱效力的指标,残留比越大表明病毒越容易依附在载体上且该材质越不容易清洗,或该消毒法对载体上的病毒的洗脱效力越弱。在实际操作中,残留比应小于0.43,且会受到载体材质、病毒悬液滴度、温度、消毒作业步骤等因素影响,测试时应尽量按照实际情况操作。在计算实际消毒效力对数值时,应用灭活对数值(r
logt
、r
logn
)减去该测试得有效中和度的对数值,或最小稀释度的对数值(优先有效中和度,没有该数据时才使用最小稀释度)。
[0083]
本发明中的检测方法的流程图如说明书附图1所示。
[0084]
在本发明中,设置了4个残留比例级别,能够定量定性体现出不同材料之间病毒灭活效力,使本领域技术人员可以定量判定不同材料的物理性质对灭活效力的影响,给予了一个新的维度来比较该消毒步骤是否适合该材料。此外,本发明中的方法测试结果更接近实际,尤其是对于多步消毒步骤,准确性更高且能定量测出每步的病毒灭活量,从而有利于在新型多步骤消毒作业流程或消毒产品的研发过程中,对其病毒灭活效力的综合评估。而且,本发明还可以作为一种比较方法,通过测试得出多步骤消毒法中的分步(单步)或总和的病毒灭活效力,从而可以使得使用低浓度、低效力或低细胞毒性药剂的多步骤消毒法可以和使用高浓度、高效力或高细胞毒性药剂的单步消毒相比较。
[0085]
根据本发明的第一个方面,在本发明的一些实施方式中,步骤(2)中实验有效性的判定方法为:进行病毒滴度鉴定、细胞毒性鉴定和有效中和测试,若病毒滴度鉴定的tcid50每毫升的对数值大于7、且阳性对照和阴性对照均无异常,则判定实验结果有效;若否,则无效。
[0086]
根据本发明的第一个方面,在本发明的一些实施方式中,步骤(3)中灭活效力检测包括病毒滴度鉴定、灭活效力测试和载体病毒量检测。
[0087]
根据本发明的第一个方面,在本发明的一些实施方式中,步骤(4)中待测消毒产品或消毒作业有效性的判断方法为:
[0088]
根据灭活效力检测结果,计算总体灭活效力、单步灭活效力;
[0089]
若总体灭活效力的对数值大于等于4,单步灭活效力的对数值大于等于1,且重复测试后,总体灭活效力的对数值之间的差值和单步灭活效力的对数值之间的差值均小于0.5时,待测消毒产品或消毒作业有效;
[0090]
若否,则无效。
[0091]
根据本发明的第一个方面,在本发明的一些实施方式中,所述单步灭活效力的算法公式为:
[0092]
r
logn
=log(10ct(n
‑
1)
×
r
ratio
)
‑
log(10ctn);
[0093]
其中,r
ratio
为第n步表面病毒残留比,计算公式为:
[0094][0095]
ccn为第n步载体病毒量测试结果;cc(n
‑
1)为第n
‑
1步载体病毒量测试结果;ctn为第n步灭活效力测试结果;ct(n
‑
1)为第n
‑
1步灭活效力测试结果;r
logn
为第n步每毫升灭活病毒滴度值;
[0096]
所述总体灭活效力的算法公式为:
[0097]
r
logt
=log(10cc1)
‑
log(10ctn);
[0098]
其中,cc1为第1步载体病毒量测试结果;ctn为最后一步灭活效力测试结果;r
logt
为总体每毫升灭活病毒滴度值。
[0099]
根据本发明的第一个方面,在本发明的一些实施方式中,步骤(4)中待测消毒产品或消毒作业灭活效力的方法为:
[0100]
根据灭活效力检测结果,计算病毒残留比,计算公式为:
[0101][0102]
其中,ccn为第n步载体病毒量测试结果;cc(n
‑
1)为第n
‑
1步载体病毒量测试结果;
[0103]
若病毒残留比小于3%,为极低度残留,表面黏度极低,灭活效力极高;
[0104]
若病毒残留比为3~10%,为低度残留,表面黏度低,灭活效力高;
[0105]
若病毒残留比为10~20%,为中度残留,表面黏度中,灭活效力中;
[0106]
若病毒残留比大于20%,为重度残留,表面黏度高,灭活效力低。
[0107]
根据本发明的第一个方面,在本发明的一些实施方式中,步骤(1)中所述载体的表面设置有l形卡扣。所述卡扣垂直于所述载体表面,所述载体的制备材料包括玻璃、不锈钢和塑料。
[0108]
当然,本领域技术人员可以根据实际使用需求,合理选择适当的材质作为载体材
料。
[0109]
在本发明的一些优选实施方式中,本发明中的载体为(1)或(2)中的任一种:
[0110]
(1)如图2所示的圆形20cm2载体。具体为:载体为直径50.5mm、厚0.5mm的圆形结构,面积为20cm2,该载体外侧上设置有一个长2mm、宽2mm、向一侧突出2mm的“l“形状卡位,载体表面设有标记线,将载体表面均分为20格,每格1cm2。
[0111]
(2)如图3所示的方形25cm2载体。具体为:载体为边长5cm、厚0.5mm的正方形结构,面积为25cm2,该载体外侧上设置有一个长20mm、宽2mm、向一侧突出2mm的“l“形状卡位,载体表面设有标记线,将载体表面均分为25格,每格1cm2。
[0112]
在本发明中,所述载体与试剂滴加流程可使待测病毒等量均匀的分布在载体上,避免了因分布不均而浓度过高引起的假阳性,使得本测试方案更为准确可靠。
[0113]
根据本发明的第一个方面,在本发明的一些实施方式中,步骤(1)中载体类型根据消毒作用方式确定,其中,所述消毒作用方式包括单面浸没、整体浸泡和喷洒。
[0114]
在本发明的一些优选实施方式中,载体类型与消毒作用方式的对应方式为:
[0115]
若消毒作用方式为单面浸没或整体浸泡时,载体类型为圆形载体;
[0116]
若消毒作用方式为喷洒时,载体类型为方形载体。
[0117]
本发明的第二个方面,提供本发明第一个方面所述的方法在抗病毒产品筛查中的应用。
[0118]
本发明的第三个方面,提供本发明第一个方面所述的方法在材料清洁难易度定量检测中的应用。
[0119]
本发明的有益效果是:
[0120]
1.本发明中的检测方法能够模拟多步骤病毒消毒作业流程或以组合用药的形式的病毒灭活产品的使用情况,同时考虑了该载体的病毒残留比例,利用残留比例快速计算出该流程的分步(单步)灭活效力与总体灭活效力,实现了产品消毒能力的量化,对多步骤消毒作业方案和抗病毒产品的开发具有极为重要的意义。
[0121]
2.本发明中的检测方法能够定量定性体现出不同材料之间病毒灭活效力,使本领域技术人员可以定量判定不同材料的物理性质对灭活效力的影响,给予了一个新的维度来比较该消毒步骤是否适合该材料。此外,本发明中的方法测试结果更接近实际,尤其是对于多步消毒步骤,准确性更高且能定量测出每步的病毒灭活量,最小灵敏度为101/ml或每毫升滴度值为1.0,从而有利于在新型多步骤消毒作业流程或消毒产品的研发过程中,对其病毒灭活效力的综合评估。
[0122]
3.本发明中的检测方法还可以作为一种比较方法,通过测试得出多步骤消毒法中的分步(单步)或总和的病毒灭活效力,从而可以使得使用低浓度、低效力或低细胞毒性药剂的多步骤消毒法可以和使用高浓度、高效力或高细胞毒性药剂的单步消毒相比较。
附图说明
[0123]
图1为本发明实施例中的检测方法的流程图;
[0124]
图2为本发明实施例中的圆形20cm2载体三视图,其中,1表示标记线,2表示载体外侧,3表示卡扣;
[0125]
图3为本发明实施例中的方形25cm2载体三视图,其中,1表示载体外侧,2表示标记
线,3表示卡扣。
具体实施方式
[0126]
为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
[0127]
所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
[0128]
检测表面病毒灭活效力的方法的构建
[0129]
本实施例中的检测表面病毒灭活效力的方法可分为三部分进行:
[0130]
(1)预备测试:
[0131]
预备测试包含:待测病毒滴度鉴定、产品细胞毒性鉴定、产品有效中和测试三个部分,并设置有阳性对照和阴性对照。
[0132]
在所有测试开始前,需根据待检测的消毒产品或消毒流程用法,选择尺寸合适的载体(选择标准如表1所示),同时确定消毒步骤数,并准备实验所需器材(如:水浴缸、无菌培养皿、镊子等)。同时,根据测试所用的病毒毒株培养对应细胞,培养方式依据本领域的常规操作方法,将传代细胞培养至单层细胞,备用。
[0133]
表1载体类型、作用方法及其具体操作参数
[0134]
[0135][0136]
其中,圆形20cm2载体如图2所示。具体为:载体为直径50.5mm、厚0.5mm的圆形结构,面积为20cm2,该载体外侧上设置有一个长2mm、宽2mm、向一侧突出2mm的“l“形状卡位,载体表面设有标记线,将载体表面均分为20格,每格1cm2。
[0137]
方形25cm2载体如图3所示。具体为:载体为边长5cm、厚0.5mm的正方形结构,面积为25cm2,该载体外侧上设置有一个长20mm、宽2mm、向一侧突出2mm的“l“形状卡位,载体表面设有标记线,将载体表面均分为25格,每格1cm2。
[0138]
上述载体材料无限制,包括但不限于玻璃、不锈钢、塑料等材质。
[0139]
使用时,将载体放置于无菌培养皿内,载体外侧设置的“l“形结构解决了因液面压力差而造成的载体难以取出的问题。
[0140]
预备测试与灭活效力测试的检测孔数及其稀释操作如表2所示。
[0141]
表2预备测试与灭活效力测试的检测孔数
[0142][0143]
①
待测病毒滴度鉴定:
[0144]
按照表2所示,将待测病毒的病毒悬液进行10倍倍比稀释,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。接种后将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天。采用本领域常规方法检测培养后的待测病毒的半数组织培养感染剂量(tcid50),确保其tcid50每毫升的对数值大于7。
[0145]
②
细胞毒性鉴定:
[0146]
根据表1所示,选择尺寸合适的载体,将对应体积的细胞维持液滴加在载体上,静置风干。风干后,将对应体积的待测消毒产品以相应的作用方法施加在载体上,混匀后按对应方法进行稀释,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。其中,若已知待测的消毒产品不可在细胞维持液中稀释去除其细胞毒性,可将其混匀后在sephadex g25凝胶中过滤之后再按表2所示方法稀释。接种完成后,将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天,观察待测消毒产品对细胞生长的影响。
[0147]
③
有效中和测试
[0148]
根据表1所示,选择尺寸合适的载体,将对应体积的细胞维持液滴加在载体上,静置风干。风干后,将对应体积的待测消毒产品以相应的作用方法施加在载体上,混匀后取
1200μl混合液(细胞维持液 待测消毒产品)于sephadex g25凝胶过滤之后再按表2所示方法稀释。稀释后,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。其中,若已知待测的消毒产品无细胞毒性,或可通过在细胞维持液中稀释去除其细胞毒性的,则无需使用sephadex g25凝胶过滤,可直接按表2所示方法稀释并接种在细胞板上。然后,每孔加入100μl tcid50对数值在2~3之间的病毒悬液,放入二氧化碳培养箱(37℃,5%co2)培养3~5天,观察待测消毒产品对细胞生长有无影响,若每孔细胞均被病毒感染,则表明待测消毒产品被有效中和。
[0149]
④
阳性对照与阴性对照:
[0150]
阳性对照:根据表1所示,选择尺寸合适的载体,将对应体积的病毒悬液滴加在载体上,静置风干。风干后,将对应体积的细胞维持液以相应的作用方法施加在载体上,混匀后取100μl接种于细胞板上,接种4孔,将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天,若每孔细胞均被病毒感染,则可认为阳性对照通过,实验数据可采纳,若出现未被病毒感染的情况,重新开始实验。
[0151]
阴性对照:根据表1所示,选择尺寸合适的载体,将对应体积的细胞维持液滴加在载体上,静置风干。风干后,将对应体积的细胞维持液以相应的作用方法施加在载体上,混匀后取100μl接种于细胞板上,接种4孔,将细胞板放入二氧化碳培养箱(37℃,5%co2)中培养3~5天,若每孔细胞均无异常,正常生长,则可认为阴性对照通过,实验数据可采纳,若出现任何异常情况或病毒感染,重新开始实验。
[0152]
(2)灭活效力检测:
[0153]
灭活效力检测包含:待测病毒滴度鉴定、灭活效力测试、载体病毒量检测,三个部分,并设置有阳性对照和阴性对照。
[0154]
与步骤(1)相同,在所有测试开始前,需根据待检测的消毒产品或消毒流程用法,选择尺寸合适的载体(选择标准如表1所示),同时确定消毒步骤数,并准备实验所需器材(如:水浴缸、无菌培养皿、镊子等)。同时,根据测试所用的病毒毒株培养对应细胞,培养方式依据本领域的常规操作方法,将传代细胞培养至单层细胞,备用。此外,病毒悬液与试剂需在超净工作台或水浴缸中放置至适宜温度后进行测试。
[0155]
①
待测病毒滴度鉴定(cv):
[0156]
测试方法同步骤(1)中的
①
。
[0157]
②
灭活效力测试:
[0158]
根据表1所示,选择尺寸合适的载体,将对应体积的病毒悬液滴加在载体上,静置风干。风干后,将对应体积的待测消毒产品以相应的作用方法施加在载体上,混匀后静置使其充分反应。然后取1200μl混合液(病毒悬液 待测消毒产品)于sephadex g25凝胶过滤,根据表1所规定的稀释法进行稀释。稀释后,每个稀释度取100μl接种于细胞板上,每个稀释度接种10孔。
[0159]
其中,若消毒作业流程为多步消毒法,在第一次灭活效力测试后,用镊子取出载体,放入事先准备好的无菌培养皿中,再重复上述灭活效力测试的操作进行第二次消毒后的灭活效力测试。重复次数按照消毒作业流程的消毒次数决定,但原则上施药次数不超过三次。若已知待测的消毒产品无细胞毒性,或可通过在细胞维持液中稀释去除其细胞毒性的,则无需使用sephadex g25凝胶过滤,直接按上述方法稀释并接种在细胞板上,放入二氧
化碳培养箱(37℃,5%co2)培养3~5天,观察测试结果,根据消毒作业流程中的消毒次数,将第n次消毒的结果记录为ct1
‑
ctn。
[0160]
③
载体病毒量检测(cc):
[0161]
根据表1所示,选择尺寸合适的载体,将对应体积的病毒悬液滴加在载体上,静置风干。风干后,将对应体积的细胞维持液以相应的作用方法施加在载体上,混匀后,根据表1所规定的稀释法进行稀释。稀释后,取100μl混合液(病毒悬液 细胞维持液)接种于细胞板上,每个稀释度接种4孔。
[0162]
其中,若消毒作业流程为多步消毒法,在第一次载体病毒量检测后,用镊子取出载体,放入事先准备好的无菌培养皿中,再重复上述载体病毒量检测的操作进行第二次消毒后的载体病毒量检测。重复次数按照消毒作业流程的消毒次数决定,但原则上施药次数不超过三次。根据消毒作业流程中的消毒次数,将第n次消毒的结果记录为cc1
‑
ccn。
[0163]
④
阳性对照与阴性对照:
[0164]
同步骤(1)中的阳性对照与阴性对照。
[0165]
其中,上述测试均需于不同时间点重复三次,每次测试的结果单独计算,以确保其准确性。
[0166]
(3)统计与分析:
[0167]
在得到上述实验结果后,利用下述公式计算待测消毒产品或消毒流程的表面灭活效力与单位面积灭活效力,得到最终结果。
[0168]
灭活效力的计算包括三个步骤:分步灭活效力的计算、总体灭活效力的计算、单位面积灭活效力换算,通过该三步,可获得待测消毒产品或消毒流程每毫升灭活病毒滴度值、平均每平方厘米病毒有效感染单位减少值、测试病毒残留比。其算法根据消毒流程的步骤数(消毒次数)分为一步测试计算公式与多步(n步)计算公式。
[0169]
其中,在代入算法前,应准确记录好灭活效力测试(ct)与载体病毒量测试(cc)的所有有效数据,包括其每一步(每一次消毒)的tcid50滴度值,数据格式设为10
n
格式。
[0170]
具体算法如下:
[0171]
①
计算分步灭活效力:
[0172]
每毫升灭活病毒滴度值的公式为:
[0173]
r
logn
=log(10ct(n
‑
1)
×
r
ratio
)
‑
log(10ctn);
[0174]
其中,上述式中,r
ratio
为第n步表面病毒残留比,计算公式为:
[0175][0176]
ccn为第n步载体病毒量测试结果;
[0177]
cc(n
‑
1)为第n
‑
1步载体病毒量测试结果;
[0178]
ctn为第n步灭活效力测试结果;
[0179]
ct(n
‑
1)为第n
‑
1步灭活效力测试结果;
[0180]
r
logn
为第n步每毫升灭活病毒滴度值。
[0181]
②
计算总体灭活效力:
[0182]
将灭活效力测试中最后一步(消毒流程中的最后一次消毒)得到测试结果(ctn)与载体病毒量测试中的第一步(消毒流程中的第一次消毒)得到测试结果(cc1),代入下述算
法中,即可得到总体灭活效力。
[0183]
为便于理解,本步骤公式中的n表示最后一步的步骤数(消毒次数)。
[0184]
待测消毒产品或消毒流程的总体每毫升灭活病毒滴度值公式为:
[0185]
r
logt
=log(10cc1)
‑
log(10ctn);
[0186]
其中,上述式中,
[0187]
cc1为第1步载体病毒量测试结果;
[0188]
ctn为最后一步灭活效力测试结果;
[0189]
r
logt
为总体每毫升灭活病毒滴度值。
[0190]
③
单位面积灭活效力换算:
[0191]
在本步骤中,根据具体的作用方法(如表1),代入下述公式计算单位面积灭活效力。其中,本步骤公式中的n表示第n步(第n次消毒)时的步骤数(消毒次数)。
[0192]
(a)作用方法为单面浸泡法或整体浸泡作用法时:
[0193]
总体平均每平方厘米病毒有效感染单位减少值的公式为:
[0194][0195]
第n步平均每平方厘米病毒有效感染单位减少值的公式为:
[0196][0197]
其中,上述式中,
[0198]
cc1为第1步载体病毒量测试结果;
[0199]
r
ratio
为第n步表面病毒残留比,计算公式如上述步骤
①
;
[0200]
ct(n
‑
1)为第n
‑
1步灭活效力测试结果;
[0201]
ctn为最后一步/第n步灭活效力测试结果;
[0202]
rt/cm2为总体平均每平方厘米病毒有效感染单位减少值
[0203]
rn/cm2为第n步平均每平方厘米病毒有效感染单位减少值。
[0204]
(b)作用方法为喷洒作用法时:
[0205]
总体平均每平方厘米病毒有效感染单位减少值的公式为:
[0206][0207]
第n步平均每平方厘米病毒有效感染单位减少值的公式为:
[0208][0209]
④
判断标准:
[0210]
使用上述算法计算后,根据计算结果判断待测消毒产品或消毒流程的实际效力。
[0211]
其中,对于表面病毒残留比(r
ratio
),若病毒残留比小于3%,为极低度残留,说明表面黏度极低,灭活效力极高;若病毒残留比为3~10%,为低度残留,说明表面黏度低,灭活效力高;若病毒残留比为10~20%,为中度残留,说明表面黏度中,灭活效力中;若病毒残留比大于20%,为重度残留,说明表面黏度高,灭活效力低。上述实施例中得到的病毒残留比,可以作为该材质在该消毒法下,病毒洗脱效力的指标,残留比越大表明病毒越容易依附在载体上,或该消毒法对载体上的病毒的洗脱效力越弱。在实际操作中,残留比应小于0.43,且会受到载体材质、病毒悬液滴度、温度、消毒作业步骤等因素影响,测试时应尽量按照实际情况操作。在计算实际消毒效力对数值时,应用灭活对数值(r
logt
、r
logn
)减去该测试得有
效中和度的对数值,或最小稀释度的对数值(优先有效中和度,没有该数据时才使用最小稀释度)。上述实施例中的检测方法的理论最小稀释度为:单面浸没法为
‑
2(10
‑2)、喷洒作用法为
‑
1.3(10
‑
1.3
)。
[0212]
对于整体浸泡法消毒作业流程或者消毒产品灭活效力,可根据下述条件判定:总体灭活效力的对数值应大于等于4、多步骤消毒测试每步的灭活效力的对数值应大于等于1,每次重复测试所得灭活效力之间的对数值差异小于0.5,只有在该条件下,可判定该消毒作业流程或消毒产品对该病毒可有效灭活。
[0213]
其中,根据实践操作,上述实施例中的检测方法最小灵敏度为101滴度/ml或每毫升滴度值为1.0。结果有效性判定需符合下述要求:病毒滴度鉴定(cv)的tcid50每毫升的对数值应大于7,且阳性对照和阴性对照均无异常。
[0214]
效果验证实验
[0215]
在本实施例中,以现行常用方案(以消毒技术规范ws/t367
‑
2012和新冠病毒评价标准ws/t775
‑
2021改进得到)作为对照,比较上述实施例中的检测方法与现行常用方案的检测效果(分别采用玻璃材质载体和木头材质载体)。
[0216]
需要注意的是,为了使两种检测方法具有可比性,做出以下调整说明:
[0217]
1.相同面积情况下,上述实施例中的检测方法采用一个20cm2或25cm2载体,而现行常用方案采用20或25个1cm2载体,测试20或25次取均值。
[0218]
2.现行常用方案在检测多步骤消毒方案时,先单独测第1步,之后单独测1 2步,测试两次,原因在于其并不具备单独得到每步消毒效力结果的能力,因此,只能采用该方法以获得第2步消毒效力结果(第2步效力=第1 2步效力减去第1步效力),但该方法没有考虑到第1步时会冲洗掉部分病毒,以及步骤间隔时间长会使部分病毒失活(实际消毒作业时步骤间会有10分钟到数小时的间隔),因此,其实际消毒效力应低于实验值。
[0219]
效果对比实验1:
[0220]
本实施例的载体材质为玻璃材质,待测消毒产品为过氧化氢,消毒作业步骤为2步(消毒次数为2),检测病毒为h1n1病毒(病毒毒株购自atcc,编号vr
‑
95)配套mdck细胞株(用于产生h1n1病毒,细胞株购自atcc,编号ccl
‑
34),无有机干扰。
[0221]
(1)上述实施例中的检测方法:
[0222]
按照上述实施例中的方法进行检测,具体步骤为:
[0223]
①
病毒滴度鉴定:取100μl h1n1病毒悬液,加入900μl细胞维持液按照表1进行10倍梯度稀释(10
‑1~10
‑9九个梯度),每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0224]
②
细胞毒性鉴定:将细胞维持液滴加在20cm2圆形玻璃材质载体表面上,10μl每格,滴满20格,在超净工作台中风干。风干后,取2ml 0.5%过氧化氢溶液滴加在载体表面上,50秒后,从载体表面上吸取1.2ml混合液用sephadex g25凝胶过滤,过滤后的滤液稀释度视为10
‑1。取200μl滤液,加入1.8ml细胞维持液进行10倍梯度稀释,稀释至10
‑4(10
‑1~10
‑4四个梯度),每个稀释度接种4孔,每孔100μl。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0225]
③
有效中和测试:取新的20cm2圆形玻璃材质载体,将细胞维持液滴加在载体表面上,10μl每格,滴满20格,风干。风干后,取2ml 0.5%过氧化氢溶液滴加在载体表面上,50秒
后,从载体表面上吸取1.2ml混合液用sephadex g25凝胶过滤,过滤后滤液稀释度视为10
‑1。取200μl滤液,加入1.8ml细胞维持液进行10倍梯度稀释,稀释至10
‑4(10
‑1~10
‑4四个梯度),每个稀释度接种4孔,每孔100μl。然后在每孔加入100μl tcid50对数值在2~3之间的h1n1病毒悬液,接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0226]
④
按照上述实施例中的方法设置阳性对照和阴性对照。
[0227]
⑤
在步骤
①‑④
满足有效判读要求后,重新进行病毒滴度鉴定,步骤同
①
。
[0228]
⑥
灭活效力检测:将未稀释的病毒悬液滴加在20cm2圆形玻璃材质载体表面上,10μl每格,滴满20格,在超净工作台中风干。风干后,取2ml 0.5%过氧化氢溶液滴加在载体表面上,50秒后,从载体表面上吸取1.2ml混合液用sephadex g25凝胶过滤(本次步骤记为ct1)。将载体侧倾,倒出载体表面残余液体,并将载体放入另一无菌培养皿中,取2ml 0.3%过氧化氢溶液滴加在载体表面上,1分钟后,从载体表面上吸取1.2ml混合液用sephadex g25凝胶过滤(本次步骤记为ct2)。步骤ct1与ct2过滤后的滤液稀释度均视为10
‑1。分别取200μl滤液,加入1.8ml细胞维持液进行10倍梯度稀释,稀释至10
‑4(10
‑1~10
‑9九个梯度),每个稀释度接种10孔,每孔100μl。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0229]
⑦
载体病毒量测试:将未稀释的病毒悬液滴加在20cm2圆形玻璃材质载体表面上,10μl每格,滴满20格,在超净工作台中风干。风干后,取2ml细胞维持液滴加在载体表面上,50秒后,从载体表面上吸取100μl混合液接种于细胞板上,同时,取200μl混合液用于连续稀释(本次步骤记为cc1)。将载体侧倾,倒出载体表面残余液体,并将载体放入另一无菌培养皿中,取2ml细胞维持液滴加在载体表面上,1分钟后,从载体表面上吸取100μl混合液接种于细胞板上,同时,取200μl混合液用于连续稀释(本次步骤记为cc2)。步骤cc1与cc2中的混合液(病毒悬液与细胞维持液)的稀释度均视为10
‑1。分别取200μl滤液,加入1.8ml细胞维持液进行10倍梯度稀释,稀释至10
‑4(10
‑1~10
‑9九个梯度),每个稀释度接种4孔,每孔100μl。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0230]
⑧
按照上述实施例中的方法设置阳性对照和阴性对照。
[0231]
步骤
①‑④
的检测结果如表3~6所示。
[0232]
表3病毒滴定鉴定结果
[0233][0234]
表4细胞毒性鉴定结果
[0235]
稀释度10
‑110
‑210
‑310
‑4病变细胞0/40/40/40/4
[0236]
表5有效中和测试结果
[0237]
稀释度10
‑110
‑210
‑310
‑4感染数4/44/44/44/4百分比%100100100100
[0238]
表6阳性对照与阴性对照结果
[0239]
阳性对照1234是否感染 阴性对照1234是否感染
‑‑‑‑
[0240]
如上述结果所示,在本实施例中,病毒悬液滴度对数值大于7,过滤后无细胞毒性且对病毒感染无抑制作用,步骤能有效中和消毒产品,阳性对照全为阳性,阴性对照全为阴性,测试结果均通过,说明该测试结果有效,可以进一步进行灭活效力检测。
[0241]
步骤
⑤‑⑧
的检测结果如表7~12所示。
[0242]
表7病毒滴定鉴定(cv)结果
[0243][0244][0245]
表8步骤一灭活效力(ct1)
[0246][0247]
表9步骤二灭活效力(ct2)
[0248][0249]
表10步骤一载体病毒量对照(cc1)
[0250][0251]
表11步骤二载体病毒量对照(cc2)
[0252]
[0253]
表12阳性对照与阴性对照
[0254]
阳性对照1234是否感染 阴性对照1234是否感染
‑‑‑‑
[0255]
将上述表中数据以10
n
格式代入上述实施例中的算法,可得:步骤一的tcid50灭活效力为10
5.30
/ml或tcid50每毫升滴度值为5.30。步骤二的tcid50灭活效力为10
2.03
/ml或tcid50每毫升滴度值为2.03。代入公式后消毒作业总体的tcid50灭活效力为10
7.67
/100μl换算成每毫升值为10
8.67
/ml或tcid50每毫升滴度值为8.67,实际有效滴度为7.67,总体单位面积灭活效力为平均每平方厘米减少4.68
×
106个感染单位。此外,将cc1与cc2代入公式后得到该消毒作业的病毒残留比为4.57%,该数据表明残留至步骤二中的病毒浓度为步骤一中的病毒浓度的4.57%,为低度残留,说明该材质较容易清洗。基于上述数据显示,病毒悬液滴度对数值大于7,病毒阳性对照全为阳性,阴性对照全为阴性,因此,可以判断该测试结果为有效结果。
[0256]
(2)现行常用方案:
[0257]
①
使用1cm
×
1cm玻璃片20片,正式测试前需进行有效中和测试,细胞毒性测试,以确保数据有效。
[0258]
其中,有效中和测试的步骤为:取3片玻璃载体,每片滴加10μl细胞维持液,风干。风干后,在每片玻璃载体上滴加100μl0.5%过氧化氢溶液,待到作用时间后,将玻璃载体浸入1ml中和剂中,作用10分钟。取出后以细胞维持液为稀释液,进行10倍稀释(10
‑1、10
‑2、10
‑3、10
‑4,共4个组),每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。随后每孔加入100μl tcid50对数值在2~3之间的h1n1病毒悬液。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0259]
细胞毒性测试的步骤为:取3片玻璃载体,每片滴加10μl细胞维持液,风干。风干后,在每片玻璃载体上滴加100μl0.5%过氧化氢溶液,待到作用时间后,以细胞维持液为稀释液,进行10倍稀释(10
‑1、10
‑2、10
‑3、10
‑4,共4个组),每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0260]
②
设置阳性对照和阴性对照。阳性对照为不加0.5%过氧化氢溶液的病毒悬液,阴性对照为不加病毒悬液的细胞维持液,方法同步骤
①
。
[0261]
②
效力测试:
[0262]
第一次效力测试:取20片玻璃载体,每片滴加10μl细胞维持液,风干。风干后,在每片玻璃载体上滴加100μl 0.5%过氧化氢溶液,待到作用时间后,将玻璃载体浸入1ml中和剂中,作用10分钟。取出后以细胞维持液为稀释液,进行10倍稀释,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0263]
第二次效力测试:取20片玻璃载体,每片滴加10μl病毒悬液,风干。风干后,在每片玻璃载体上滴加100μl 0.5%过氧化氢溶液,待到作用时间后,将玻璃载体放入无菌培养皿中。之后每片玻璃载体上滴加100μl 0.3%过氧化氢溶液,待到作用时间后,浸入1ml中和剂中,作用10分钟。取出后以细胞维持液为稀释液,进行10倍稀释,每个稀释度取100μl接种于细胞板上,每个稀释度接种4孔。接种后在二氧化碳培养箱(37℃,5%co2)培养3~5天。
[0264]
测试结果如表13~17所示:
[0265]
表13有效中和测试结果
[0266][0267]
表14细胞毒性测试结果
[0268][0269]
表15阳性对照中病毒悬液滴度
[0270][0271]
表16第一次灭活效力测试结果
[0272][0273]
表17第二次灭活效力测试结果
[0274]
[0275][0276]
阳性对照与阴性对照均无显示异常。
[0277]
第一次灭活效力测试结果为:10
5.23
/ml或tcid50每毫升滴度值为5.23,第二次灭活效力测试结果为:10
3.27
/ml或tcid50每毫升滴度值为3.27。消毒作业总体的tcid50灭活效力为10
8.50
/ml或tcid50每毫升滴度值为8.50,实际滴度值为7.50。
[0278]
效果对比实验2:
[0279]
本实施例的载体材质为木头材质(防水木片),待测消毒产品为过氧化氢,消毒作业步骤为2步(消毒次数为2),检测病毒为h1n1病毒(病毒毒株购自atcc,编号vr
‑
95)配套mdck细胞株(用于产生h1n1病毒,细胞株购自atcc,编号ccl
‑
34),无有机干扰。
[0280]
所有检测步骤同效果对比实验1。
[0281]
其中,按照上述实施例中的方法进行检测,步骤
①‑④
的检测结果如表18~21所示。
[0282]
表18病毒滴定鉴定结果
[0283][0284]
表19细胞毒性鉴定结果
[0285]
稀释度10
‑110
‑210
‑310
‑4病变细胞0/40/40/40/4
[0286]
表20有效中和测试结果
[0287]
稀释度10
‑110
‑210
‑310
‑4感染数4/44/44/44/4百分比%100100100100
[0288]
表21阳性对照与阴性对照结果
[0289]
阳性对照1234是否感染 阴性对照1234是否感染
‑‑‑‑
[0290]
如上述结果所示,在本实施例中,病毒悬液滴度对数值大于7,过滤后无细胞毒性且对病毒感染无抑制作用,步骤能有效中和消毒产品,阳性对照全为阳性,阴性对照全为阴性,测试结果均通过,说明该测试结果有效,可以进一步进行灭活效力检测。
[0291]
步骤
⑤‑⑧
的检测结果如表22~27所示。
[0292]
表22病毒滴定鉴定(cv)结果
[0293][0294]
表23步骤一灭活效力(ct1)
[0295][0296]
表24步骤二灭活效力(ct2)
[0297][0298]
表25步骤一载体病毒量对照(cc1)
[0299][0300]
表26步骤二载体病毒量对照(cc2)
[0301][0302]
表27阳性对照与阴性对照
[0303]
阳性对照1234是否感染 阴性对照1234是否感染
‑‑‑‑
[0304]
将上述表中数据以10
n
格式代入上述实施例中的算法,可得:步骤一的tcid50灭活效力为10
5.62
/ml或tcid50每毫升滴度值为5.62。步骤二的tcid50灭活效力为10
2.71
/ml或tcid50每毫升滴度值为2.71。代入公式后消毒作业总体的tcid50灭活效力为10
8.33
/100μl
换算成每毫升值为10
9.33
/ml或tcid50每毫升滴度值为9.33,实际有效滴度为8.33,总体单位面积灭活效力为平均每平方厘米减少2.14
×
107个感染单位。此外,将cc1与cc2代入公式后得到该消毒作业的病毒残留比为10.00%,该数据表明残留至步骤二中的病毒浓度为步骤一中的病毒浓度的10.00%,为中度残留,说明该材质清洗难度中等。基于上述数据显示,病毒悬液滴度对数值大于7,病毒阳性对照全为阳性,阴性对照全为阴性,因此,可以判断该测试结果为有效结果。
[0305]
现行常用方案结果如表28~32所示。
[0306]
表28有效中和测试结果
[0307][0308]
表29细胞毒性测试结果
[0309][0310]
表30阳性对照中病毒悬液滴度
[0311][0312][0313]
表31第一次灭活效力测试结果
[0314][0315]
表32第二次灭活效力测试结果
[0316][0317]
阳性对照与阴性对照均无显示异常。
[0318]
第一次灭活效力测试结果为:10
5.71
/ml或tcid50每毫升滴度值为5.71,第二次灭活效力测试结果为:10
3.79
/ml或tcid50每毫升滴度值为3.79。消毒作业总体的tcid50灭活效力为10
9.50
/ml或tcid50每毫升滴度值为9.50,实际滴度值为8.50。
[0319]
实验结果
[0320]
根据上述两种方法(上述实施例中的检测方法和现行常用方案)的数据(表33),可以看出,上述实施例中的检测方法的总体灭活效力结果与现行常用方案非常接近,且上述实施例中的检测方法在第一步检测时,与现行常用方案20组数据均值接近,第二步检测时,虽然与现行常用方案有区别,但考虑到环境及现行常用方案中的操作会导致部分病毒流失,使实验值产生虚高,而上述实施例中的检测方法则完全避免了上述问题,只计算载体上实际载有的病毒计算灭活效力,其结果相较现行常用方案更加接近真实值。
[0321]
表33上述实施例中的检测方法和现行常用方案的对比
[0322][0323][0324]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

