1.本发明属于改善贝肉糜制品凝胶特性技术领域,具体涉及一种具有提高凝胶特性和风味的纳米乳液的制备方法及应用。
背景技术:
2.鱼糜,是将鱼肉经水洗、采肉、漂洗、脱水和斩拌等工序制作而成的一种深加工制品。鱼糜既能直接食用,也能作为一种其他类型产品的原辅料,利用率高,因而市场占有率大,已成为不可或缺的日常营养食品。凝胶性一直都是影响产品鱼糜制品质量的重要因素,凝胶性的强弱能够对鱼糜制品的保水性、黏度、组织性状等各项性状产生影响。为了改善鱼糜制品的凝胶性,一般要加入淀粉、亲水胶体等糖类,蛋白酶类,脂肪等外源添加物。外源物的添加虽然降低了产品的成本,增加了凝胶特性,但也同时降低了产品的营养价值和风味特性。
3.文蛤肉营养丰富,味道鲜美,蛋白质氨基酸种类齐全,呈味氨基酸含量较高,约占氨基酸总量的一半,是海洋生物中优质的蛋白质。文蛤肉中盐溶性蛋白含量较低、水溶性蛋白含量较高,经冷冻贮藏后蛋白质的结构和理化特性易发生变化,且蛋白是易发生冷冻变性。有研究表明,贝肉糜随着贮藏时间的延长,文蛤蛋白质冷冻变性越厉害,蛋白结构发生改变,蛋白质之间交联作用下降,影响了空间网络结构的良好构建,从而导致贝肉糜凝胶强度下降。因此,单纯使用文蛤肉制作贝肉糜制品凝胶性较弱,只能在贝肉糜中添加鱼糜、淀粉、复合磷酸盐、tg酶、脂肪等物质来增加其凝胶特性。但是也不能完全解决贝肉糜凝胶特性差的问题,同时添加过多外源物质也降低了贝肉糜制品的独特风味和营养价值。因此,亟待开发出一种具有改善贝肉糜制品凝胶特性、以及具有风味特性贝肉糜制品添加剂,丰富贝类产品种类,提升贝类产品附加值。
技术实现要素:
4.本发明要解决的技术问题是提供一种具有提高凝胶特性和风味的纳米乳液的制备方法及应用,获得的纳米乳液用于贝肉糜制品中,具有增强风味的特性,且可改善贝肉糜制品凝胶特性。
5.本发明的技术方案是:一种具有提高凝胶特性和风味的纳米乳液的制备方法,其具体步骤如下:(1)文蛤分离蛋白
‑
葡聚糖共价复合物制备a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:2~1:3加入冰水得到混合溶液,首先在10000r/min~15000r/min条件下,高速均质1min~3min,调节ph至12,接着在冰浴条件下搅拌10min~20min,然后在8000r/min~10000r/min条件下离心20min,取上清液,调节ph至4.2,静置30min,8000r/min~10000r/min条件下再次离心20min,取沉淀用超纯水溶解,调节ph至中性,干燥后获得文蛤分离蛋白;b.取步骤a的文蛤分离蛋白,加入去离子水搅拌,调节ph至12,室温下温和搅拌至
文蛤分离蛋白溶解,再按照文蛤分离蛋白与葡聚糖按照质量比1:1加入葡聚糖,继续搅拌,使葡聚糖与文蛤分离蛋白混合均匀,然后调节ph值至10~12,得到蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃~120℃温度下进行油浴反应,反应75 分钟~105分钟后,置于冰浴中冷却,最后干燥,得到文蛤分离蛋白
‑
葡聚糖共价复合物;(2)文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液的制备按照重量百分含量计,将文蛤分离蛋白
‑
葡聚糖共价复合物1.5%~3%、大豆卵磷脂0.4%~0.6%,溶于90%~ 95%的去离子水中,室温下搅拌使其充分溶解,调节ph为7,加入2.5%~7%的大豆油;利用高速分散均质机在8000rmp~11000rmp的转速下均质2min~4min,得到粗乳液;将粗乳液置于超声波粉碎机中超声乳化,超声波乳化时,调节超声变幅杆为超声功率为300w~700w,超声时间为4min~10min,工作和间歇时间均为5s,粗乳液整个超声乳化过程中使用冰水浴降温,超声波乳化完成,得到纳米乳液。
6.进一步的,所述步骤(1)中的葡聚糖分子量为10kda~50kda。
7.进一步的,步骤(1)b中,去离子水的加入量为文蛤分离蛋白和葡聚糖总质量的9倍。
8.进一步的,步骤(2)中,文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液原料按照重量份数计组成为:文蛤分离蛋白
‑
葡聚糖共价复合物1.7份、大豆卵磷脂0.45份、去离子水94.45份、油脂3.4份。
9.进一步的,步骤(2)中,超声功率为400w,超声时间5分钟。
10.一种实施上述的制备方法获得的纳米乳液在贝肉糜制品中的应用,所述贝肉糜制品原料为鱼糜和贝糜、或贝糜,以提高海产品肉糜制品的凝胶特性和风味特性。
11.一种实施上述的制备方法获得的纳米乳液在贝肉糜制品中的应用。
12.进一步的,所述纳米乳液的加入量占海产品肉糜质量的6%~10%。
13.本发明具有以下有益效果:(1)将文蛤分离蛋白与葡聚糖经湿热法获得文蛤分离蛋白
‑
葡聚糖共价复合物,具有较好的接枝度;该共价复合物乳化活性和乳化稳定性好,实现了文蛤蛋白功能特性的改善。该文蛤分离蛋白
‑
葡聚糖共价复合物制备的纳米乳液,具有乳液液滴小、分散均匀,无聚集体,且浊度较小,稳定性较好,能较好的抵抗外界环境干扰。结合电子舌、电子鼻和gc
‑
ims技术分析文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液,含有的芳香族敏感物质及挥发性成分增多,具有更好的风味特性。
14.(2)在凝胶特性方面,加入文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液可以显著增强贝肉香肠的凝胶强度、弹性、白度增大、持水性增强、自由水含量降低、不易流动水增加,结合水没有显著性变化,凝胶网状结构更为致密均匀;在纳米乳液添加量为8%时,其凝胶特性最强;且纳米乳液的添加可以降低贝肉肠脂质氧化的程度。
15.(3)在风味方面,文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液的加入可以提升贝肉肠的鲜味、降低苦味。文蛤分离蛋白
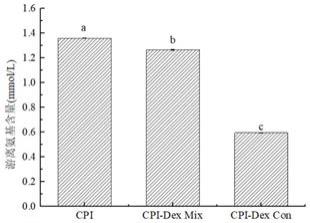
‑
葡聚糖共价复合物纳米乳液可以同时使贝肉肠的色泽、滋味、组织状态和口感得到改善。总之,将文蛤分离蛋白
‑
葡聚糖共价复合物制备成高稳定性的纳米乳液,加入到贝
肉肠中,有效改善了贝肉肠凝胶、乳化等理化特性,并提升了贝肉肠的风味;解决了贝肉糜制品凝胶特性差的问题。
附图说明
16.图1是本发明实施例1
‑
3和对比例1、对比例2不同反应温度下形成的文蛤分离蛋白
‑
葡聚糖共价复合物接枝度(a)及乳化活性(b)曲线图;图2是本发明实施例1、4、5和对比例3、对比例4不同ph值下形成的文蛤分离蛋白
‑
葡聚糖共价复合物接枝度(a)及乳化活性(b)曲线图;图3是本发明实施例1、6、7和对比例5、对比例6不同反应时间下形成的文蛤分离蛋白
‑
葡聚糖共价复合物接枝度(a)及乳化活性(b)曲线图;图4是本发明实施例1和对比例7
‑
10不同文蛤分离蛋白、葡聚糖质量比形成的文蛤分离蛋白
‑
葡聚糖共价复合物接枝度(a)及乳化活性(b)曲线图;图5本发明实施例8制备的cpi、cpi
‑
dex con及普通混合cpi
‑
dex mix的游离氨基含量变化图;图6本发明实施例8制备的cpi、cpi
‑
dex con及普通混合cpi
‑
dex mix的荧光光谱图;图7本发明实施例8制备的cpi和cpi
‑
dex con的ft
‑
ir图;图8本发明实施例8制备的cpi和cpi
‑
dex con的sem图(
×
7000);图9不同温度处理对本发明实施例9、对比例11和对比例12制备的三种纳米乳液粒径(a)和pdi(b) 的影响;图10不同贮藏时间处理本发明实施例9、对比例11和对比例12制备的三种纳米乳液粒径(a)和pdi(b) 的影响;图11不同ph处理对本发明实施例9、对比例11和对比例12制备的三种纳米乳液粒径(a)和pdi(b) 的影响;图12不同nacl浓度处理对本发明实施例9、对比例11和对比例12制备的三种纳米乳液粒径(a)和pdi (b)的影响;图13本发明实施例9、对比例11和对比例12制备的三种纳米乳液的光学显微镜图(
×
100);图14本发明实施例9、对比例11和对比例12制备的三种纳米乳液的clsm图;图15本发明实施例9、对比例11和对比例12制备的三种纳米乳液的主成分分析图;图16本发明不同cpi
‑
dex con纳米乳液添加量对文蛤味鱼糜肠凝胶强度的影响;图17本发明不同cpi
‑
dex con纳米乳液添加量对贝肉肠离心损失(a)和蒸煮损失(b)的影响;图18本发明不同cpi
‑
dex con纳米乳液添加量对贝肉肠t2弛豫时间的影响;图19本发明不同cpi
‑
dex con纳米乳液添加量的贝肉肠的感官评价(a)及感官评价雷达图(b);图20本发明不同cpi
‑
dex con纳米乳液添加量对贝肉肠tba值的影响;图21本发明不同cpi
‑
dex con纳米乳液添加量对贝肉肠微观结构的影响(
×
40);图22本发明不同cpi
‑
dex con纳米乳液添加量对贝肉肠滋味主成分分析的影响;
图23本发明不同cpi
‑
dex con纳米乳液添加量对贝肉肠鲜味(a)和苦味(b)的影响。
具体实施方式
17.下面结合具体实施例,对本发明作进一步详细的阐述,但本发明的实施方式并不局限于实施例表示的范围。这些实施例仅用于说明本发明,而非用于限制本发明的范围。
18.本发明涉及的实施例和对比例使用的葡聚糖分子量为40kda,而分子量为10kda~50kda的葡聚糖均适用于本发明。
19.实施例1a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物(记为cpi
‑
dex con),接枝度和乳化活性检测结果如表1所示,利用多次检测结果平均作为标准值,接枝度标准值如图1(a)所示,乳化活性标准值如图1(b)所示。表1文蛤分离蛋白
‑
葡聚糖共价复合物的接枝度和乳化活性 1234平均值接枝度%49.7143.3046.0953.3248.10乳化活性0.760.800.920.940.86乳化稳定性63.7763.7470.5574.5068.14
20.实施例2a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在110℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物
(记为cpi
‑
dex con),接枝度如图1(a) 所示,乳化活性如图1(b)所示。
21.实施例3a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在120℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物(记为cpi
‑
dex con),接枝度如图1(a) 所示,乳化活性如图1(b)所示。
22.对比例1a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在80℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物(记为cpi
‑
dex con),接枝度如图1(a) 所示,乳化活性如图1(b)所示。
23.对比例2a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在90℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物
(记为cpi
‑
dex con),接枝度如图1(a) 所示,乳化活性如图1(b)所示。
24.一、不同反应温度对形成文蛤分离蛋白
‑
葡聚糖共价复合物接枝度的影响图1为本发明实施例1
‑
3和对比例1、对比例2文蛤分离蛋白(cpi)和葡聚糖混合溶液在不同反应温度条件下产物的接枝度曲线图。从图1(a)可以看出,随着反应温度的增加,文蛤分离蛋白
‑
葡聚糖共价复合物的接枝度也显著增加,在80
‑
90℃时,曲线较陡峭,接枝度较低,而温度在100
‑
120℃时,曲线较稳定平缓,该温度条件下,文蛤分离蛋白
‑
葡聚糖共价复合物具有较好的接枝度。
25.二、不同反应温度对形成文蛤分离蛋白
‑
葡聚糖共价复合物乳化特性的影响图1(b)为本发明实施例1
‑
3和对比例1、对比例2文蛤分离蛋白(cpi)和葡聚糖混合溶液在不同反应温度条件下产物的乳化特性曲线图。从图1(b)可以看出,随着温度的升高,复合物的乳化活性呈先升高后降低的趋势,且在110℃时,产物乳化活性最好。
26.实施例4a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至11;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图2(a)所示,乳化活性如图2(b)所示。
27.实施例5a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至12;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图2(a)所示,乳化活性如2 (b)所示。
28.对比例3a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品
级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至8;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图2(a)所示,乳化活性如2 (b)所示。
29.对比例4a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至9;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图2(a)所示,乳化活性如2 (b)所示。
30.三、不同反应ph对形成文蛤分离蛋白
‑
葡聚糖共价复合物接枝度、乳化特性的影响图2(a)、(b)为本发明实施例1、4、5和对比例3、对比例4文蛤分离蛋白(cpi)和葡聚糖混合溶液在不同ph值条件下反应产物接枝度、乳化特性曲线图。从图2(a)、(b)可以看出,反应产物的接枝度、乳化活性随着ph的升高呈现先增加后降低的趋势,当ph为11时,产物的接枝度最好,乳化活性在ph 值为10时最好。从图2(b)可以看出,随着ph升高,乳化稳定性呈逐渐升高的趋势。
31.实施例6a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应105分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图3(a)所示,乳化活性如3(b)所示。
32.实施例7a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min,9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应75分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图3(a)所示,乳化活性如3 (b)所示。
33.对比例5a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应60分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图3(a)所示,乳化活性如3 (b)所示。
34.对比例6a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min,9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应120分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图3(a)所示,乳化活性如3(b)所示。
35.四、不同反时间对形成文蛤分离蛋白
‑
葡聚糖共价复合物接枝度、乳化特性的影响图3(a)、图3(b)为本发明实施例1、6、7和对比例5、对比例6文蛤分离蛋白(cpi)和葡聚糖混合溶液在不同反应时间条件下反应产物接枝度、乳化特性曲线图。从图3(a)可以看出,反应产物的接枝度随着反应时间的增加而增加。从图3(b)可以看出,复合产物乳化活性在75min和90min时没有显著性差异,且75min时乳化活性最好,随着反应时间的继续增加,乳化活性逐渐降低。
36.对比例7a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取文蛤分离蛋白,加入去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至蛋白分散溶解,再以文蛤分离蛋白的1:4质量比加入葡聚糖,其中,去离子水的加入量为文蛤分离蛋白和葡聚糖总质量的 9倍,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图4(a)所示,乳化活性如4 (b)所示。
37.对比例8a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min,9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取文蛤分离蛋白,加入去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至蛋白分散溶解,再以文蛤分离蛋白的1:2质量比加入葡聚糖,其中,去离子水的加入量为文蛤分离蛋白和葡聚糖总质量的 9倍,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图4(a)所示,乳化活性如4 (b)所示。
38.对比例9a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白,得到文蛤分离蛋白/葡聚糖混合液;
b.取文蛤分离蛋白,加入去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至蛋白分散溶解,再以文蛤分离蛋白的2:1质量比加入葡聚糖,其中,去离子水的加入量为文蛤分离蛋白和葡聚糖总质量的 9倍,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级1mol/l的hcl调节ph值至10; c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图4(a)所示,乳化活性如4 (b)所示。
39.对比例10a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白;b.取文蛤分离蛋白,加入去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至蛋白分散溶解,再以文蛤分离蛋白的4:1质量比加入葡聚糖,其中,去离子水的加入量为文蛤分离蛋白和葡聚糖总质量的 9倍,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级1mol/l的hcl调节ph值至10,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在100℃温度下进行油浴反应,反应90分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物;接枝度如图4(a)所示,乳化活性如4 (b)所示。
40.五、不同文蛤分离蛋白、葡聚糖质量比形成文蛤分离蛋白
‑
葡聚糖共价复合物褐变程度和乳化特性的影响图4(a)、图4(b)为本发明实施例1、对比例7
‑
10的文蛤分离蛋白(cpi)和葡聚糖混合溶液在不同质量比条件下产物乳化性、接枝度的曲线图。从图4(a)、图4(b)中可以看出,随着文蛤分离蛋白/葡聚糖 (记为蛋白/糖)质量比的增加,复合产物的接枝度、乳化活性呈先增加后降低的趋势,乳化活性在蛋白/ 糖质量比为1:1、2:1和4:1时没有显著性差异,乳化稳定性呈现先升高后缓慢下降的趋势,且在蛋白 /糖质量比为1:1时,复合产物的接枝度、乳化特性最高。
41.实施例8a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:3加入冰水得到混合溶液,首先在13000r/min条件下,高速均质1min,用食品级naoh调节ph至12,接着在冰浴条件下搅拌15min,然后在9500r/min条件下离心20min,取上清液,用食品级1mol/l的hcl调节ph至4.2,静置30min, 9500r/min条件下再次离心20min,取沉淀用超纯水溶解,用食品级naoh调节ph至中性,干燥后,得到文蛤分离蛋白(cpi);b.取50g文蛤分离蛋白,加入900g去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至文蛤分离蛋白分散溶解,加入50g葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级 1mol/l的hcl调节ph值至11,得到文蛤分离蛋白/葡聚糖混合液;c.取文蛤分离蛋白/葡聚糖混合液置于油浴具塞容器中,在109℃温度下进行油浴反应,反应89分钟后,置于冰浴中冷却,最后干燥,即为文蛤分离蛋白
‑
葡聚糖共价复合物
(cpi
‑
dex con);乳化活性为1.22,乳化稳定性为75.56%。
42.六、不同处理样品的游离氨基含量变化、内源荧光分析(1)不同处理样品的游离氨基含量变化在糖基化反应体系中,游离氨基可能受蛋白糖基化、分子间/内交联及降解反应等的影响,使游离氨基含量发生变化。因此,通过游离氨基含量的变化可以表明美拉德反应初级阶段的进程情况,进而可作为美拉德反应在初/中级阶段的评估指标;检测实施例8文蛤分离蛋白cpi的游离氨基含量、文蛤分离蛋白和葡聚糖共价复合物(cpi
‑
dex con)的游离氨基含量以及葡聚糖简单混合物(cpi
‑
dex mix)的游离氨基含量,检测结果如图5所示,荧光光谱如图6所示,其中,游离氨基含量以及葡聚糖简单混合物的具体方法如下:取实施例8制备的文蛤分离蛋白50g,加入去离子水900g搅拌,用食品级naoh调节ph至12,室温下温和搅拌至蛋白分散溶解,再加入葡聚糖50g,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级1mol/l的hcl调节ph值至11,得到葡聚糖简单混合物(cpi
‑
dex mix);从图5可以看出,与文蛤分离蛋白cpi(1.36mmol/l)相比,文蛤分离蛋白和葡聚糖简单混合物(cpi
‑
dexmix)的游离氨基含量为1.27mmol/l,降低了6.62%;文蛤分离蛋白和葡聚糖共价复合物(cpi
‑
dex con) 的为0.59mmol/l,与cpi相比,其含量降低了56.62%,与cpi
‑
dex mix相比,降低了53.54%,游离氨基含量显著下降,说明糖基化反应一定时间后,葡聚糖中的羰基和cpi中的氨基发生结合,导致游离氨基含量减少,表明有糖基化产物形成。
43.(2)不同处理样品的内源荧光分析:图6为cpi、cpi
‑
dex mix以及cpi
‑
dex con的荧光色谱图,由图可知,cpi与cpi
‑
dex mix的光谱曲线变化大体一致,表明单独添加葡聚糖对蛋白质的三级结构影响不大。在290nm下,cpi中trp的最大发射波长为348nm,其在345nm处出现最大荧光强度,cpi
‑
dex con在348nm处出现最大荧光强度。这说明文蛤蛋白糖基化后并没有明显的构象改变,但是cpi
‑
dex con的荧光强度显著降低,这可能是由于cpi 的trp与葡聚糖发生糖基化反应,使trp含量发生变化,也可能是由于葡聚糖分子空间位阻效应,减少其与荧光猝灭物质的反应,导致荧光强度降低。且糖基化反应后cpi的最大发射波长无明显红移,但荧光强度显著降低,且糖基化时间越长,荧光强度降低越明显,说明cpi和葡聚糖糖基化反应后,荧光强度减小,但cpi分子的空间结构没有展开。表明cpi和葡聚糖以共价结合的方式形成了复合物,这与下述ft
‑
ir分析结果一致。
44.七、不同处理样品的ft
‑
ir分析通过cpi和cpi
‑
dex con的ft
‑
ir图分析多肽和蛋白质结构,能灵敏地反映出肽链结构的变化。当蛋白质与糖分子共价结合后,蛋白质分子中的羟基增加,这反映在3700cm
‑1‑
3200cm
‑1处的宽峰和1260cm
‑1‑
1000 cm
‑1处的吸收。图7为实施例8的cpi和cpi
‑
dex con的ft
‑
ir图,从图可以看出,与cpi相比,cpi
‑
dexcon在3600cm
‑1‑
3200cm
‑1处的吸收峰明显增宽,这是因为葡聚糖的加入增加了羟基数量,也可能与共价交联反应出现新的键有关。与cpi相比,cpi
‑
dex con在1649cm
‑1及1545cm
‑1‑
1525cm
‑1处吸收峰强度降低,这是由于
‑
nh基团的改变。cpi
‑
dex con在1200cm
‑1‑
900cm
‑1处的吸收峰明显增强和变化,同样说明了葡聚
糖的加入增加了羟基数量。以上变化可以说明cpi以共价结合方式引入了糖分子。此外,从图中还可以看到反应前后cpi的特征吸收峰没有发生明显的位移现象,这说明反应前后cpi分子的空间结构没有发生展开,糖基化反应只是将蛋白质分子与多糖链共价结合以改善其功能性质,而蛋白质本身的分子结构并没有改变。
45.八、不同处理样品的sem分析蛋白质分子的状态可以通过蛋白质的结构来反映,这对蛋白质的功能性质有着重要的作用。将实施例8的 cpi和cpi
‑
dex con真空冷冻干燥后,采用扫描电子显微镜观察了样品的微观特征,图8为cpi及cpi dexcon放大7000倍的扫描电镜图,从图可以看出,当cpi经过美拉德糖基化反应后,其表面微观结构发生了明显的改变,cpi不规则的刚性结构消失,形成的共聚物结构相对致密,且结构相对均匀平滑。这可能是由于cpi与糖分子共价结合后,分子扩散并减少了蛋白的聚集。
46.实施例9(1)文蛤分离蛋白
‑
葡聚糖共价复合物同实施例8;(2)文蛤分离蛋白
‑
葡聚糖共价复合物(cpi
‑
dex con)0.45g(1.70%)、大豆卵磷脂0.12g(0.45%)、大豆油0.90g(3.40%)、去离子水25ml(94.45%)利用高速分散均质机在10000rmp的转速下均质3min,得到粗乳液;将粗乳液置于超声波粉碎机中乳化,调节超声变幅杆为超声功率为400w,超声时间5min制备纳米乳液,工作和间歇时间均为5s,粗乳液超声乳化过程中用冰水浴降温,完成得cpi
‑
dex con 纳米乳液。
47.对比例11将实施例8的文蛤分离蛋白(cpi)0.45g(1.70%)、大豆卵磷脂0.12g(0.45%)、大豆油0.90g(3.40%)、去离子水25ml(94.45%)利用高速分散均质机在10000rmp的转速下均质3min,得到粗乳液;将粗乳液置于超声波粉碎机中乳化,调节超声变幅杆为超声功率为400w,超声时间5min制备纳米乳液,工作和间歇时间均为5s,粗乳液超声乳化过程中用冰水浴降温,完成得cpi纳米乳液。
48.对比例12(1)取实施例8制备的文蛤分离蛋白,加入去离子水搅拌,用食品级naoh调节ph至12,室温下温和搅拌至蛋白分散溶解,再以文蛤分离蛋白的1:1质量比加入葡聚糖,继续搅拌,直至葡聚糖与文蛤分离蛋白混合均匀,然后用食品级1mol/l的hcl调节ph值至11,得到葡聚糖简单混合物(cpi
‑
dex mix);(2)将葡聚糖简单混合物(cpi
‑
dex mix)0.45g(1.70%)、大豆卵磷脂0.12g(0.45%)、大豆油0.90g(3.40%)、去离子水25ml(94.45%)利用高速分散均质机在10000rmp的转速下均质3min,得到粗乳液;将粗乳液置于超声波粉碎机中乳化,调节超声变幅杆为超声功率为400w,超声时间5min制备纳米乳液,工作和间歇时间均为5s,粗乳液超声乳化过程中用冰水浴降温,完成得cpi
‑
dex mix纳米乳液。
49.九、纳米乳液粒径、pdi、电位及浊度分析据研究表明乳液的稳定性可能与液滴粒径有关,粒径越小,乳液的稳定性越强。表2为实施例9、对比例 11和对比例12的三种纳米乳液的粒径、pdi、电位和浊度分析。从表2可以看出,与cpi纳米乳液相比, cpi
‑
dex mix纳米乳液粒径最大,而cpi
‑
dex con纳米乳液粒径最小,说明cpi
‑
dex con纳米乳液稳定性更高。pdi是表征分散体系中粒径分布情况的指
标,pdi值越小,说明乳液体系的粒径分布范围越小,液滴分散性越好,体系越稳定。由表可知,cpi
‑
dex con纳米乳液pdi最小,表明其液滴分散性较好,稳定性较高。电位用于表征油滴之间的静电斥力,当电位绝对值小于30mv时,乳液的稳定性较弱,电位绝对值大于30mv时,乳液的稳定性较强。从表中可以看出,三种纳米乳液电位绝对值都大于30mv,同时cpi
‑
dex con纳米乳液电位绝对值最大,说明三种纳米乳液稳定性较强,且cpi
‑
dex con纳米乳液的稳定性最高。乳液浊度也可以衡量乳液的粒径和稳定性,乳液的浊度越大则表明较大粒径的液滴分布越多。 cpi
‑
dex con纳米乳液的浊度最小,研究发现,当体系中的油量固定时,乳液粒径是影响浊度的主要因素,乳液粒径越大,体系浊度越高,浊度与粒径变化结果保持一致,这与该实验结果相一致。综合说明cpi
‑
dexcon纳米乳液的稳定性更高。
50.表2 cpi、cpi
‑
dex mix及cpi
‑
dex con纳米乳液的粒径、pdi、电位和浊度电位和浊度注:同一列不同小写字母表示有显著性差异(p<0.05),下同。
51.十、纳米乳液热稳定性分析图9为实施例9、对比例11和对比例12的纳米乳液加热后其粒径和pdi的变化。由图13可知,在温度为 40℃时,三种纳米乳液的粒径和pdi增加,这可能是加热使乳液中部分蛋白发生变性,使乳液液滴发生絮凝和聚集导致粒径及pdi增大。随着温度进一步升高,cpi纳米乳液和cpi
‑
dex mix纳米乳液的粒径和pdi 逐渐降低,cpi
‑
dex con纳米乳液的粒径和pdi随着温度的升高没有发生显著变化(p>0.05),粒径仅在 170
‑
182nm内发生变化,且在整个温度范围内(30
‑
80℃)没有显著性变化(p>0.05)。结果表明cpi
‑
dex con 纳米乳液在整个加热过程中较稳定。
52.十一、贮藏稳定性分析图10为不同贮藏时间对实施例9、对比例11和对比例12的纳米乳液粒径和pdi的影响,从图可以看出,cpi纳米乳液和cpi
‑
dex mix纳米乳液随着贮藏时间的增加,在8d以前其粒径增加不显著,随后粒径显著增加,且cpi
‑
dex mix纳米乳液在整个贮藏期间随着时间的延长其粒径由200nm
‑
375nm区间逐渐变大,其变化最大,这可能是由于在cpi中简单混入葡聚糖,使乳液液滴之间发生相互吸引,形成消耗性絮凝,使乳液变得不稳定,导致其受外界影响较大。cpi
‑
dex con纳米乳液在整个贮藏期间的粒径最小且未显著增加,pdi良好,说明经过糖基化反应的cpi可以显著提高乳液的贮藏稳定性。
53.十二、ph稳定性分析在食品的加工过程中添加物的不同会导致整个体系呈现不同的ph,ph稳定性对于乳液体系的广泛应用至关重要。图11为不同ph变化对实施例9、对比例11和对比例12的三种纳米乳液粒径和pdi的影响。由图11可知,乳液ph在4
‑
5时,cpi纳米乳液和cpi
‑
dex mix纳米乳液的粒径和pdi显著增加,ph为5 时,cpi纳米乳液和cpi
‑
dex mix纳米乳液的粒径和pdi最大,表明此时乳液最不稳定。这是因为在等电点附近,蛋白质的溶解度降低,而且蛋白质的静电荷为零,静电排斥作用被屏蔽,因此液滴更容易聚集,导致粒径增。同时发现,在酸性
环境下,cpi纳米乳液、cpi
‑
dex mix纳米乳液粒径和pdi显著增加,而在碱性环境下,粒径和pdi没有显著性变化,说明该乳液在碱性条件下较稳定。而cpi
‑
dex con纳米乳液随着ph的变化,乳液粒径和pdi没有显著性变化,这是由于cpi经过改性后,在等电点附近静电斥力增加,蛋白分散均匀,因此受ph影响最小,形成的乳液最稳定。
54.十三、离子强度稳定性分析图12不同nacl浓度处理对实施例9、对比例11和对比例12的三种纳米乳液粒径(a)和pdi(b)的影响;由图12可知,cpi纳米乳液的和cpi
‑
dex mix纳米乳液的粒径和pdi随着nacl浓度的增大而逐渐增大,这可能是由于nacl的加入对蛋白质的静电排斥效应具有一定的屏蔽作用,说明nacl浓度对cpi纳米乳液的、cpi
‑
dex mix纳米乳液粒径和pdi影响显著(p<0.05)。而cpi
‑
dex con纳米乳液的粒径和pdi 没有随着nacl浓度的增加发生显著性变化(p>0.05),说明其具有很好的离子强度稳定性。
55.十四、冷冻
‑
解冻稳定性表3为冷冻
‑
解冻对实施例9、对比例11和对比例12的三种纳米乳液粒径的变化情况。从表3中可以看出,与4℃未经冷冻
‑
解冻处理的乳液相比,冷冻
‑
解冻后三种纳米乳液的粒径都显著增加(p<0.01),同时可以看出,经冷冻
‑
解冻处理后,cpi
‑
dex con纳米乳液粒径变化最小,这可能是由于cpi
‑
dex con纳米乳液界面膜较厚,阻止冰晶穿透,且较大的空间位阻效应增加了油滴间的静电排斥力,从而阻止液滴过于接近,提高了乳液的稳定性。表明cpi
‑
dex con纳米乳液可以提高乳液的抗冻稳定性。
56.表3冷冻
‑
解冻处理对cpi、cpi
‑
dex mix及cpi
‑
dex con纳米乳液粒径的影响(单位:nm) cpicpi
‑
dex mixcpi
‑
dex con4℃179.71
±
2.69198.66
±
2.47150.43
±
0.72
‑
80℃5134.60
±
130.22
**
1793.46
±
75.13
**
655.06
±
25.15
**
注:“**”表示差异极显著(p<0.01)。
57.十五、光学显微镜结构观察:通过测定其微观结构可以更好的直观地反应出乳液液滴的结构特征。图13为cpi、cpi
‑
dex mix及cpi
‑
dexcon三种纳米乳液在目镜和物镜100倍条件下观察的光学显微镜图。由图可知,cpi纳米乳液液滴少许部分较大,分散较均匀;cpi
‑
dex mix纳米乳液液滴颗粒较大,而且分散不均匀;cpi
‑
dex con纳米乳液液滴小且分散均匀,这与粒径和pdi结果一致,说明cpi
‑
dex con制备的纳米乳液液滴较小,分散均匀,乳液较稳定。
58.十六、clsm结构观察为了更加直观地表征纳米乳液液滴形态,运用激光共聚焦显微镜对实施例8的实施例9、对比例11和对比例12的三种纳米乳液微观形态进行了观察,如图14所示。a、d、i分别为cpi纳米乳液、cpi
‑
dex mix 纳米乳液和cpi
‑
dex con纳米乳液红光和绿光的叠加图,b、e、h和c、f、r分别为cpi纳米乳液、cpi
‑
dexmix纳米乳液和cpi
‑
dex con纳米乳液单独的绿光和红光图。由图可知,cpi纳米乳液的微观结构均匀,有一些较大的液滴存在,还有少部分较大的聚集体存在(图14a黄色部分),图中出现黄色是因为部分蛋白质会吸附在油滴表面,过多的蛋白质分散在连续相中从而呈现黄色(红色 绿色=黄色)。cpi
‑
dex mix 纳米乳液液滴倾向于相互连接在一起形成更大的油滴,且形成更多的聚集体(图14d黄色部分),同时
油相相互聚结出现较大聚集体(如图14f所示)。cpi
‑
dex con纳米乳液红色油相小球颗粒均匀的分散在绿色的蛋白水溶液中,液滴较小且分散均匀,未出现聚集现象,液滴呈规则球形(如图14i所示),表明cpi
‑
dexcon纳米乳液具有较好的稳定性,从侧面说明糖基化共价复合物可以有效改善蛋白质乳液的乳化性。该结果与粒径测定结果相一致。
59.十七、电子舌滋味主成分分析表4是实施例9、对比例11和对比例12中cpi
‑
dex con、cpi及cpi
‑
dex mix三种纳米乳液稀释100倍后测得的电子舌分析结果。由表可知,三种乳液的酸味、涩味、咸味均为负值,未能被人体味觉感知到,而苦味和鲜味明显高于其他滋味的响应值。与cpi相比,cpi
‑
dex mix纳米乳液的苦味值和鲜味值与其相近,而cpi
‑
dex con纳米乳液有较高的鲜味值和较低的苦味值(p<0.05),且苦味和涩味回味较低,浓厚味较高,表明由cpi
‑
dex mix制备的纳米乳液鲜味更加丰富。
60.表4 cpi、cpi
‑
dex mix及cpi
‑
dex con三种纳米乳液的电子舌滋味分析滋味cpicpi
‑
dex mixcpi
‑
dex con酸味
‑
11.82
±
0.03
a
‑
21.06
±
0.49
b
‑
22.46
±
0.39
b
苦味9.26
±
0.10
b
9.41
±
0.37
a
8.04
±
0.21
c
涩味
‑
7.56
±
0.34
a
‑
7.85
±
0.27
a
‑
7.89
±
0.21
a
涩味回味
‑
0.07
±
0.01
a
‑
0.10
±
0.44
a
‑
0.08
±
0.01
a
苦味回味0.01
±
0.03
a
‑
0.01
±
0.20
a
‑
0.01
±
0.02
a
鲜味1.08
±
0.25
b
1.03
±
0.14
b
1.33
±
0.14
a
浓厚味1.80
±
0.04
a
1.80
±
0.20
a
1.86
±
0.18
a
咸味
‑
7.74
±
0.31
a
‑
8.50
±
0.35
b
‑
8.20
±
0.30
ab
图15为cpi、cpi
‑
dex mix及cpi
‑
dex con三种纳米乳液的主成分分析(principal component analysis,pca) 图,当主成分总贡献率超过85%时表明实验方法的可行性。由图可知,pc1为61.18%,pc2为38.82,累计贡献率为100%,总贡献率大于85%,说明pc1和pc2包含了图中所有样品中滋味物质的大部分信息,能够反映样品的整体信息。同时可以看出cpi
‑
dex con样品的分布区域与cpi和cpi
‑
dex mix样品分布区域分离较远,说明cpi
‑
dex con样品在滋味上与cpi和cpi
‑
dex mix样品差异显著,表明cpi经糖基化反应形成共价复合物后滋味发生了变化。
61.实施例10纳米乳液在贝肉肠中的应用(1)按照重量百分含量,称取45.3%鱼糜置于真空斩拌机中斩拌3min,加入15%文蛤肉糜继续斩拌直至两者混合均匀,加入1.8%的食盐继续盐斩3min,然后加入12%淀粉、1.80%大豆蛋白、0.08%卡拉胶、 0.12%三聚磷酸钠、0.08%味精、7.5%猪油膘、1.20%植物油、0.12%海藻酸钠、15%冰水辅料进行混斩4min,整个过程含水量控制在76%,且在冰浴条件下进行,得到混合原料;(2)然后添加制备好的占步骤(1)混合原料总质量8%cpi
‑
dex con纳米乳液真空斩拌1.5min,然后将脱气后的肠采用灌肠机灌入塑料肠衣中,手动封口机封口。采用二段式加热法先将贝肉肠置于50℃水浴锅中加热30min,随后转移至90℃水浴锅中加热20min,完成之后置于冰水中快速冷却。
62.对比例13纳米乳液在贝肉肠中的应用
(1)按照重量百分含量,称取45.3%鱼糜置于真空斩拌机中斩拌3min,加入15%文蛤肉糜继续斩拌直至两者混合均匀,加入1.8%的食盐继续盐斩3min,然后加入12%淀粉、1.80%大豆蛋白、0.08%卡拉胶、 0.12%三聚磷酸钠、0.08%味精、7.5%猪油膘、1.20%植物油、0.12%海藻酸钠、15%冰水辅料进行混斩5.5min,整个过程含水量控制在76%,且在冰浴条件下进行;(2)然后将脱气后的肠采用灌肠机灌入塑料肠衣中,手动封口机封口。采用二段式加热法先将贝肉肠置于50℃水浴锅中加热30min,随后转移至90℃水浴锅中加热20min,完成之后置于冰水中快速冷却。
63.对比例14纳米乳液在贝肉肠中的应用cpi
‑
dex con纳米乳液添加量占实施例10步骤(1)混合原料总质量为2%,其余操作同实施例10。
64.对比例15纳米乳液在贝肉肠中的应用cpi
‑
dex con纳米乳液添加量占实施例10步骤(1)混合原料总质量为4%,其余操作同实施例10。
65.对比例16纳米乳液在贝肉肠中的应用cpi
‑
dex con纳米乳液添加量占实施例10步骤(1)混合原料总质量为6%,其余操作同实施例10。
66.对比例17纳米乳液在贝肉肠中的应用cpi
‑
dex con纳米乳液添加量占实施例10步骤(1)混合原料总质量为10%,其余操作同实施例10。
67.十八、cpi
‑
dex con纳米乳液添加量对贝肉肠质构的影响表5为纳米乳液添加量对贝肉肠质构的影响。从表可以看出,随着cpi
‑
dex con纳米乳液的添加,贝肉肠的硬度、弹性、粘聚性和咀嚼度都有显著性的变化。与对比例13(0%)相比,乳液的加入可以降低贝肉肠的硬度,且随着乳液量的增加,其硬度逐渐降低,在乳液量为8%
‑
10%时硬度趋于稳定。这可能是随着乳液量的增加,肠的保水性和乳化性都有所增强,导致硬度逐渐下降。咀嚼度随着乳液量的增加呈现逐渐降低的趋势,当乳液量为10%时有所回升但不显著。当乳液添加量为8%和10%时,弹性和粘聚性都没有显著性差异(p>0.05),但在10%出现下降的趋势。综合说明cpi
‑
dex con纳米乳液的加入可以降低贝肉肠的硬度和咀嚼度,增强其弹性,从而改善贝肉肠的质构。
68.表 5cpi
‑
dex con纳米乳液添加量对贝肉肠质构的影响 乳液添加量(%)硬度弹性粘聚性咀嚼度对比例1305756.98
±
214.74
a
0.895
±
0.01
c
0.687
±
0.006
d
3633.76
±
27.39
a
对比例1425685.14
±
117.77
ab
0.899
±
0.006
bc
0.697
±
0.003
c
3585.94
±
76.13
a
对比例1545509.02
±
83.22
b
0.904
±
0.001
abc
0.699
±
0.001
bc
3474.60
±
92.70
b
对比例1665472.10
±
111.93
b
0.905
±
0.005
abc
0.704
±
0.003
ab
3439.35
±
63.22
b
实施例1084838.39
±
37.06
c
0.915
±
0.003
a
0.710
±
0.003
a
3072.65
±
10.34
c
对比例17104827.55
±
7.90
c
0.907
±
0.007
ab
0.705
±
0.004
ab
3098.28
±
61.15
c
注:不同列小写字母表示不同处理间有显著性差异(p<0.05),下同。
69.十九、cpi
‑
dex con纳米乳液添加量对贝肉肠凝胶强度的影响图16为不同纳米乳液添加量对贝肉肠凝胶性能的影响。由图可知,与空白对照组
对比例13相比,cpi
‑
dex con纳米乳液的加入显著提高了贝肉肠的凝胶强度,且随着乳液量的增加,呈现逐渐增加的趋势,当实施例10乳液添加量为8%和对比例17乳液添加量为10%时没有显著性变化(p>0.05)。乳液添加量在8%时凝胶强度最大为5122.08g
·
mm,与空白对照组对比例13(3390.58g
·
mm)相比提升了51.07%。综上说明经糖基化反应制备的纳米乳液可以提高贝肉肠的凝胶强度。
70.二十、cpi
‑
dex con纳米乳液添加量对贝肉肠色泽的影响一般来说,l
*
值越大,b
*
值越低,样品越白,产品质量更好。表6为不同cpi
‑
dex con纳米乳液量对贝肉肠色泽的影响。由表可知,与空白对照组对比例13相比,cpi
‑
dex con纳米乳液的加入可以提高样品的白度,且随着乳液量的增加,贝肉肠的白度值逐渐增加。表明经糖基化反应制备的cpi
‑
dex con纳米乳液可以增强贝肉肠的亮度及白度。
71.表6 cpi
‑
dex con纳米乳液添加量对贝肉肠色泽的影响 乳液添加量/%l
*
a
*
b
*
白度对比例13060.13
±
0.83
c
‑
5.54
±
0.12
ab
21.34
±
0.09
a
54.44
±
0.14
f
对比例14261.89
±
1.46
c
‑
5.41
±
0.02
a
21.70
±
0.36
a
55.81
±
0.25
e
对比例15464.93
±
0.61
b
‑
5.52
±
0.10
ab
21.44
±
0.34
a
58.53
±
0.16
d
对比例16665.74
±
1.27
b
‑
5.65
±
0.11
b
21.34
±
0.09
a
59.24
±
0.34
c
实施例10868.09
±
0.80
a
‑
5.88
±
0.09
c
21.70
±
0.36
a
60.93
±
0.17
b
对比例171070.08
±
1.49
a
‑
5.97
±
0.13
c
22.00
±
0.31
a
62.39
±
0.26
a
二十一、cpi
‑
dex con纳米乳液添加量对贝肉肠持水性能的影响cpi
‑
dex con纳米乳液添加量对贝肉肠离心损失和蒸煮损失的影响如图17所示。由图17(a)可知,空白对照组对比例13贝肉肠的离心损失为10.42%,在所有处理组中,添加cpi
‑
dex con纳米乳液显著降低了贝肉肠的离心损失(p<0.05),且加入量为8%时,离心损失最小,使贝肉肠的离心损失从10.42%降至7.25%。由图17(b)可知,与空白对照组对比例13相比,蒸煮损失率在乳液添加量为0%、2%、4%和6%几个处理组间没有显著性差异(p>0.05),当纳米乳液添加量为8%时可以显著降低贝肉肠的蒸煮损失率(p<0.05),当添加量大于8%时,蒸煮损失率有所回升,这与离心损失结果一致。综上表明cpi
‑
dex con纳米乳液的加入可以减少贝肉肠的离心损失和蒸煮损失,从而提高样品的保水能力,且在添加量为8%时,可以较好的增强贝肉肠的凝胶结合力,减少离心损失和蒸煮损失,增加持水性。
72.二十二、cpi
‑
dex con纳米乳液添加量对贝肉肠水分分布状态的影响不同cpi
‑
dex con纳米乳液添加量的贝肉肠的t2弛豫时间分布如图18所示,由图可知,t
21
为与大分子紧密相连的结合水,弛豫时间分布在0.1~10 nm,t
22
为存在于凝胶网络中的不易流动水,弛豫时间分布在 10~100 nm,t
23
为能够自由流动的自由水,弛豫时间分布在100~1000 nm。结合图18和表7所知,随着 cpi
‑
dex con乳液量的增加,不易流动水的弛豫时间发生了向左偏移的现象,不易流动水部分向结合水和自由水发生转移,这可能是因为随着cpi
‑
dex con纳米乳液的添加,贝肉肠的凝胶性逐渐增强,凝胶网络结构限制了水的移动,从而使更多的水分保留在凝胶网状结构中。从表中可以看出,随着cpi
‑
dex con乳液的逐渐增加,结合水的峰面积比例没有发生显著性的变化(p>0.05),与空白对照组对比例13相比,加入cpi
‑
dex con纳米乳液之后贝肉肠中的不易流动水显著增加(p<0.05),且呈现先上升后稍微降低的趋势,不易流动水在乳液添加量为4%、6%和8%时没有显著性差
异,且在8%时最高。自由水随着cpi
‑
dex con 乳液量的增加呈现逐渐升高的趋势,部分向结合水和不易流动水转移,当乳液量为8%时,贝肉肠中的自由水最少。且所有加入cpi
‑
dex con纳米乳液的贝肉肠的自由水峰面积占比都小于未加入纳米乳液的,不易流动水的峰面积占比都高于未加入纳米乳液的。说明cpi
‑
dex con纳米乳液的加入使贝肉肠的吸水能力、形成的凝胶网络增强,锁住更多的水分,使其不易流动水增加,从而赋予贝肉肠较好的口感。这与持水性、质构及凝胶强度的测定结果相一致。
73.表7不同cpi
‑
dex con纳米乳液添加量对贝肉肠水分状态的影响
74.二十三、cpi
‑
dex con纳米乳液添加量对贝肉肠感官评价的影响:图19为不同cpi
‑
dex con乳液添加量的贝肉肠的感官评价及雷达图。由图可知,空白对照组对比例13感官评分最低为73分,随着cpi
‑
dex con纳米乳液的添加,贝肉肠的感官评分逐渐增加,当乳液量为8%时感官评分最高为92分,随着cpi
‑
dex con纳米乳液的继续添加,感官评分有所降低,但变化不明显(p> 0.05)。由图19(b)雷达图可知,随着纳米乳液量的增加,贝肉肠的色泽评分逐渐升高,这可能是随着乳液量的增加贝肉肠的颜色逐渐变白,这与色泽测定结果一致。滋味评分也是随着乳液的添加而升高,这可能是经糖基化反应制备的纳米乳液可以提升样品的风味,说明其加入可以增强贝肉肠的滋味,这与第三章风味研究结果一致。组织状态和口感评分也是随着乳液的添加逐渐升高,这可能是因为加入纳米乳液可以改善贝肉肠的质构,增强其凝胶性,使其吃起来比较饱满,口感良好。综上说明,添加纳米乳液可以提升贝肉肠的感官评分,这与质构、凝胶强度、持水性结果相一致。
75.二十四、cpi
‑
dex con纳米乳液添加量对贝肉肠脂质氧化的影响当肉制品中的不饱和脂肪酸发生氧化分解时,产生的丙二醛(mda)会与tba试剂发生反应生成红色络合物,在532nm处有最大吸光值。因此,tba值可以用来表示脂肪氧化分解为mda等次级氧化产物量的程度。一般情况下,tba值越大,脂肪氧化程度越高,酸败越严重。图20为不同纳米乳液的量对贝肉肠脂质氧化的影响。从图可以看出,cpi
‑
dex con纳米乳液的加入可以显著降低mda的含量(p<0.05),且在各处理组(2%、4%、6%和8%)间没有显著性变化(p>0.05),空白对照组对比例13mda含量为0.41 mg/kg,而加入cpi
‑
dex con纳米乳液后mda含量在0.33
‑
0.36mg/kg之间,且所有组中mda的含量都小于0.5mg/kg。说明经糖基化反应制备的纳米乳液的加入可以降低贝肉肠脂质氧化的程度。
76.二十五、cpi
‑
dex con纳米乳液添加量对贝肉肠微观结构的影响图21为不同cpi
‑
dex con纳米乳液添加量的贝肉肠的凝胶微观结构。由图可知,随着乳液的添加,贝肉肠的凝胶网状结构逐渐由疏松变得紧密,其空隙逐渐变小变均匀,且在乳液添加量为8%时,贝肉肠的凝胶网状结构较为均匀致密,当乳液添加量超过8%时,贝肉
肠的凝胶网状结构又开始逐渐疏松,分布不均匀,空隙逐渐变大,与凝胶强度测定结果一致。结果表明,cpi
‑
dex con纳米乳液的加入可以使贝肉肠的凝胶网状结构更加致密,且在乳液添加量为8%时,贝肉肠的凝胶网状结构最为紧密均匀。
77.二十六、cpi
‑
dex con纳米乳液添加量对贝肉肠风味特征的影响电子舌主成分分析:图22为利用电子舌对测定的6个贝肉肠样品信号数据进行的主成分分析结果。由图可知,pc1贡献率为76.78%,pc2贡献率为22.69%,累积贡献率为99.47%,大于85%,说明pc1和pc2 包含了样品的大量信息,能够反映样品的整体信息。从纵坐标可以看出,所有样品的分布区域与0%样品的分布区域相近。从横坐标可以看出2%、4%、6%和10%的的分布区域分离较近,且与0%的样品距离较远,而8%的与它们分布较远,说明在滋味上2%、4%、6%和10%的样品相近,8%的样品的滋味与它们有所不同。综合说明加入纳米乳液的贝肉肠的滋味可以和未加入纳米乳液的分开,且加入8%的纳米乳液可以显著的和没有加入纳米乳液的贝肉肠在滋味上区分开来。
78.鱼糜制品的苦味和鲜味主要是由鱼糜中的呈味氨基酸所决定的。苦味值越低,鲜味值越高,表明鱼糜制品的风味越佳。不同cpi
‑
dex con纳米乳液添加量的贝肉肠的鲜味值和苦味值变化的雷达图如图23 所示。从图可知,未加入cpi
‑
dex con纳米乳液的贝肉肠的鲜味值和苦味值分别为1.85和7.84,随着乳液量的增加,贝肉肠的鲜味值逐渐增加,苦味值逐渐降低,当cpi
‑
dex con纳米乳液添加量为8%时,贝肉肠的鲜味值最高为2.32、苦味值最低为7.54,说明cpi
‑
dex con纳米乳液的加入可以提升贝肉肠的鲜味,同时降低其苦味。
79.实施例11纳米乳液在文蛤肉肠中的应用(1)按照重量百分含量,称取73.21%文蛤肉糜置于真空斩拌机中斩拌3min,加入1.5%的食盐继续盐斩 3min,然后加入12.5%淀粉、1.47%大豆蛋白、0.07%卡拉胶、0.1%三聚磷酸钠、0.07%味精、6.2%猪油膘、 0.98%植物油、0.1%海藻酸钠、3.8%冰水辅料进行混斩4min,整个过程含水量控制在76%,且在冰浴条件下进行,得到混合原料;(2)然后添加制备好的占上述总量6%的cpi
‑
dex con纳米乳液真空斩拌1.5min,然后将脱气后的乳化糜采用灌肠机灌入塑料肠衣中,手动封口机封口。采用二段式加热法先将贝肉肠置于50℃水浴锅中加热30 min,随后转移至90℃水浴锅中加热20min,完成之后置于冰水中快速冷却。
80.对比例18纳米乳液在文蛤肉肠中的应用不添加纳米乳液,其余操作同实施例11。
81.对比例19纳米乳液在文蛤肉肠中的应用添加6%cpi纳米乳液,其余操作同实施例11。
82.对比例20纳米乳液在文蛤肉肠中的应用添加6%cpi
‑
dex mix纳米乳液,其余操作同实施例11。
83.二十七、纳米乳液对文蛤肉肠凝胶强度的影响表8纳米乳液对文蛤肉肠凝胶强度的影响 破断力g破断距离mm凝胶强度g
·
mm实施例1170.78
±
1.80
a
15.12
±
0.10
a
1070.36
±
19.97
a
对比例1861.37
±
0.78
c
14.15
±
0.06
c
866.59
±
10.65
d
对比例1965.51
±
0.70
b
14.52
±
0.04
b
950.93
±
9.04
c
对比例2067.19
±
0.26
b
14.60
±
0.11
b
980.95
±
11.10
b
由表8可知,实施例11组与对比例18、19、20相比,纳米乳液的加入显著提高了文蛤肉肠的凝胶强度。并且添加了cpi
‑
dex con纳米乳液的凝胶强度最强,其次分别是cpi
‑
dex mix纳米乳液和cpi纳米乳液。综上说明经糖基化反应制备的纳米乳液可以提高文蛤肉肠的凝胶强度且添加了cpi
‑
dex con纳米乳液的文蛤肠的凝胶强度最好。
84.二十八、纳米乳液对文蛤肉肠滋味特征的影响表9纳米乳液对文蛤肉肠的电子舌滋味分析滋味对比例18对比例19对比例20实施例11酸味
‑
18.42
±
0.00
‑
19.96
±
1.83
‑
34.06
±
2.53
‑
38.92
±
2.31苦味3.15
±
0.003.20
±
0.370.04
±
0.00
‑
3.42
±
0.90涩味
‑
5.01
±
0.00
‑
5.73
±
0.05
‑
11.84
±
1.59
‑
14.77
±
1.07苦味回味
‑
0.03
±
0.000.03
±
0.060.28
±
0.06
‑
0.13
±
0.02涩味回味
‑
0.21
±
0.00
‑
0.20
±
0.02
‑
0.23
±
0.02
‑
0.06
±
0.03鲜味7.10
±
0.007.31
±
0.1915.58
±
1.5518.34
±
1.00丰富度
‑
0.07
±
0.0025.52
±
2.7824.33
±
4.3542.04
±
4.77咸味8.90
±
0.009.39
±
0.8318.45
±
0.1126.52
±
1.72由表9可知,四种样品的酸味和涩味均为负值,未能被人体味觉感知到,而鲜味明显高于其他滋味的响应值。四种样品的鲜味均是正值且与对比例18(对照组)相比添加了纳米乳液的文蛤肉肠的鲜味明显增加,添加了cpi
‑
dex con纳米乳液的文蛤肠鲜味最强。与对比例18(对照组)相比,对比例19的鲜味值和苦味值与其相近,而实施例11(添加了cpi
‑
dex con纳米乳液)的样品有较高的鲜味值和较低的苦味值,且苦味和涩味回味较低,丰富度较高,表明了添加了cpi
‑
dex con纳米乳液的文蛤肉肠的鲜味更高,滋味更加丰富。实施例12(1)文蛤分离蛋白
‑
葡聚糖共价复合物制备a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:2加入冰水得到混合溶液,首先在10000r/min条件下,高速均质3min,调节ph至12,接着在冰浴条件下搅拌20min,然后在8000 r/min条件下离心20min,取上清液,调节ph至4.2,静置30min,8000r/min条件下再次离心20min,取沉淀用超纯水溶解,调节ph至中性,干燥后获得文蛤分离蛋白;步骤b和步骤c同实施例1,得到文蛤分离蛋白
‑
葡聚糖共价复合物;(2)文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液的制备按照重量百分含量计,将文蛤分离蛋白
‑
葡聚糖共价复合物3g、大豆卵磷脂1.2g,溶于181.8g的去离子水中,室温下搅拌使其充分溶解,调节ph为7,加入14g的大豆油;利用高速分散均质机在11000rmp的转速下均质2min,得到粗乳液;将粗乳液置于超声波粉碎机中超声乳化,超声波乳化时,调节超声变幅杆为超声功率为700w,超声时间为4min,工作和间歇时间均为5s,粗乳液整个超声乳化过程中使用冰水浴降温,超声波乳化完成,得到纳米乳液。实施例13(1)文蛤分离蛋白
‑
葡聚糖共价复合物制备
a.将冷冻的文蛤肉解冻并用绞肉机搅碎至浆状态,按照文蛤肉与冰水的质量比1:2.5加入冰水得到混合溶液,首先在15000r/min条件下,高速均质1min,调节ph至12,接着在冰浴条件下搅拌10min,然后在 10000r/min条件下离心20min,取上清液,调节ph至4.2,静置30min,10000r/min条件下再次离心 20min,取沉淀用超纯水溶解,调节ph至中性,干燥后获得文蛤分离蛋白;步骤b和步骤c同实施例1,得到文蛤分离蛋白
‑
葡聚糖共价复合物;(2)文蛤分离蛋白
‑
葡聚糖共价复合物纳米乳液的制备按照重量百分含量计,将文蛤分离蛋白
‑
葡聚糖共价复合物6g、大豆卵磷脂0.8g,溶于188.2g的去离子水中,室温下搅拌使其充分溶解,调节ph为7,加入5g的大豆油;利用高速分散均质机在8000rmp的转速下均质4min,得到粗乳液;将粗乳液置于超声波粉碎机中超声乳化,超声波乳化时,调节超声变幅杆为超声功率为300w,超声时间为10min,工作和间歇时间均为5s,粗乳液整个超声乳化过程中使用冰水浴降温,超声波乳化完成,得到纳米乳液。
87.以上仅为本发明的具体实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。