1.本发明涉及一种西他列汀中间体的绿色合成方法,属于药物中间体合成技术领域。
背景技术:
2.西他列汀是第一种问世的二肽基酶
‑
4(dpp
‑
4)抑制剂,用于治疗2型糖尿病,于2006年10月,美国fda批准上市。该药具有新颖的作用机制,服用后能够降低dpp
‑
4的活性,减少对肠促胰岛素的降解,由此触发糖尿病患者的胰腺提高胰岛素生产并使肝脏停止葡萄糖生产、最终降低血糖浓度的临床效果。
3.目前现有的文献中关于合成盐酸西他列汀的方法中,其中用到的关键中间体3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐(ⅰ),结构式如下所示:。
[0004][0005]
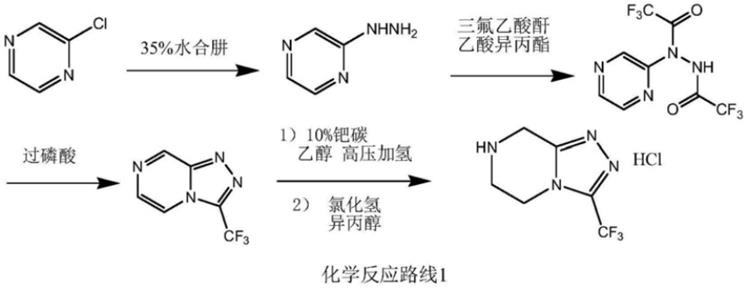
又如现有文献organic process research&develop ment 2005,9,634
‑
639有公开的是利用2
‑
氯吡嗪先和水合肼、三氟乙酸酐反应,再经过磷酸脱水成环、钯碳催化加氢还原,盐酸成盐制备式ⅰ化合物,总收率为25%,如下化学反应路线1所示:
[0006][0007]
该方法中2
‑
氯吡嗪、三氟乙酸酐、过磷酸、钯碳催化剂价格较高,且产品收率低,不利于成本控制;同时使用的三氟乙酸酐、过磷酸会产生大量的酸性废水,且较难处理,不利于环保;钯碳催化加氢反应压力高,操作隐患大,也不利于安全和工业化生产。
[0008]
现有工业生产中还有利用三氟乙酸乙酯、水合肼、氯乙酰氯反应生成n
′‑
三氟乙酰基氯乙酰肼,再经三氯氧磷缩合成环制备2
‑
氯甲基
‑5‑
三氟甲基
‑
1,3,4
‑
噁二唑,再与乙二胺反应得到n
‑
[(2z)
‑
哌嗪
‑2‑
亚基]三氟乙酰肼,最后经浓盐酸成环成盐制备式ⅱ化合物,总收率为54%,如下化学反应路线所示:
[0009][0010]
该合成路线中在环合过程中使用三氯氧磷产生大量含磷废水,环保性差,且生成的中间产物n
′‑
三氟乙酰基氯乙酰肼、n
‑
[(2z)
‑
哌嗪
‑2‑
亚基]三氟乙酰肼不稳定,易分解,影响产品质量且给存储物料带来不便。
技术实现要素:
[0011]
本发明针对以上现有技术中存在的问题,提供一种西他列汀中间体的绿色合成方法,解决的问题是如何实现提高反应稳定性和对环境友好,且具有高产物收率和纯度质量。
[0012]
本发明的目的是通过以下技术方案得以实现的,一种西他列汀中间体的绿色合成方法,该方法包括以下步骤:
[0013]
a、在醚类溶剂中,将三氟乙酸乙酯和乙二胺进行反应生成式ⅱ化合物2
‑
三氟乙酰胺基乙胺;
[0014][0015]
b、在缚酸剂存在下,使式ⅱ化合物2
‑
三氟乙酰胺基乙胺与卤代乙酸乙酯在温度为45℃~65℃的条件下进行缩合反应生成中间体式ⅲ化合物,然后,再升温到90~110℃进行环合反应生成中间体式ⅳ化合物n
‑
三氟乙酰基哌嗪酮;
[0016][0017]
c、将式ⅳ化合物n
‑
三氟乙酰基哌嗪酮与水合肼进行反应,生成式
ⅴ
化合物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮;
[0018]
[0019]
d、使式
ⅴ
化合物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮与盐酸作用进行内成环成盐反应,得到相应的产物式ⅰ化合物西他列汀中间体;
[0020][0021]
本发明通过先合成2
‑
三氟乙酰胺基乙胺,再与卤代乙酸乙酯后,高温成环,能够使反应在缚酸剂作用下即可促进反应的进行,更有利于实现环境友好的优点,减少对环境的污染,无需采用三氯氧磷存在下进行缩合,且能够使反应过程中形成的中间态相对稳定,从而更有利于反应的进行和操作,也能保证更好转化率的优点,提高中间体的产物收率和最后产物的纯度质量;同时,本发明的反应形成的中间态能够使第二步反应中以缩合先充分反应形成中间态,而该中间态能够直接通过提高温度实现环合的目的得到进一步中间体,也使形成的中间态能够稳定存在,利于操作,且也简化了生产操作的过程,再与水合肼进行反应形成的中间态也能稳定存在,不易分解的优点,形成的中间体的腙健在中间体分子外,也能够使在盐酸体系下更易于与哌嗪基上的碳原子键合而环合形成相应的产物,整体上能够使反应具有高产物收率和纯度的优点。
[0022]
在上述西他列汀中间体的绿色合成方法中,作为优选,步骤b中所述缩合反应在醇溶剂和非水溶性溶剂的混合溶剂中进行。能够使反应更均匀,且采用醇溶剂和非水溶性溶剂共同的体系,能够更好的促进反应的进行,利于反应,非水溶性溶剂存在下也能够有利于反应后续的处理和中间体的分离。作为进一步的优选,所述醇溶剂选自甲醇、乙醇和丙醇中的一种或几种;所述非水溶性溶剂选自甲苯或环己烷等烷烃类。最好使非水溶性溶剂的沸点在90℃以上的溶剂。这里最好使醇溶剂与非水溶性溶剂的用量体积比为1:4~6。也就相当于每1ml的醇溶剂,加入4~6ml的非水溶性溶剂。
[0023]
在上述西他列汀中间体的绿色合成方法中,步骤b中缚酸剂目的在于能够促进反应时,有效的除去反应体系中形成的小分子盐,这里的缚酸剂可以采用有机碱或无机碱,无机碱如可以是氢氧化钠、氢氧化钾或碳酸钠等,最好采用无机碱,能够更好的保证反应的进行,减少副产物的产生,有利于提高产物的纯度质量。作为优选,所述缚酸剂选自有机碱,所述有机碱选自n
‑
甲基中吗啉、吡啶、哌啶和吡咯中的一种或几种。
[0024]
在上述西他列汀中间体的绿色合成方法中,步骤c中的反应最好在脱水剂存在下进行。作为进一步的优选,步骤c中所述反应在5a分子筛存在下进行,所述反应的温度为45℃~60℃。反应过程中会形成小分子水,能够5a分子筛的加入能够起到脱水的作用,更利于反应的进行,提高反应的效率。
[0025]
在上述西他列汀中间体的绿色合成方法中,作为优选,所述三氟乙酸乙酯与水合肼的摩尔比为1:1.0~1.3。使反应充分进行,更好的保证减少原料的浪费。
[0026]
在上述西他列汀中间体的绿色合成方法中,作为优选,步骤a中所述反应的温度为
‑
10℃~5.0℃。在相对低温的条件下,能够更好的保证反应形成所需的乙二胺中的单一氮上取代的产物,提高原料的原子利用率和中间体产物的纯度质量。作为进一步的优选,步骤a中所述三氟乙酸乙酯和乙二胺的摩尔比为1:1.0~1.3。通过反应当量的控制,也能够更
好的实现单一取代的产物,避免形成过多的双取代的产物。
[0027]
在上述西他列汀中间体的绿色合成方法中,作为优选,步骤a中所述醚类溶剂选自甲基叔丁醚或乙基叔丁醚。能够更好的保证反应充分且温和的进行。这里对于醚类溶剂的用量根据本领域常规的量加入即可,最好一般采用醚类溶剂的质量为原料三氟乙酸乙酯乙胺的质量的5~8倍。
[0028]
在上述西他列汀中间体的绿色合成方法中,作为优选,所述三氟乙酸乙酯、卤代乙酸乙酯与敷酸剂的摩尔比为1:1.0~1.3:1.0~1.5。使保证反应充分进行,有利于减少原料的浪费和避免原料过多引入其它副产物,更利于保证产物的纯度质量要求。
[0029]
在上述西他列汀中间体的绿色合成方法中,作为优选,步骤d中所述反应的温度为45℃~60℃。采用本方法形成的中间体1
‑
三氟乙酰肼基
‑2‑
哌嗪酮具有稳定性好的优点,且环合过程温度也较温和,更利于操作。
[0030]
在上述西他列汀中间体的绿色合成方法中,作为优选,步骤d中的反应最好在醇溶剂中进行,使反应能够温和进行。醇溶剂采用无水乙醇、甲醇和丙醇中的一种或几种等。同时,采用的醇溶剂还具有安全性高,易于操作,对环境污染也相对较少,还能够进行回收利用,减少了整体的生产成本的。这里对于醇溶剂的用量按照本领域一般的常规用量即可,当然,最好使这里的醇溶剂的加入质量为1
‑
三氟乙酰肼基
‑2‑
哌嗪酮的质量的6
‑
8倍。
[0031]
本发明的西他列汀中间体的绿色合成方法的反应方程式如下所示:
[0032][0033]
综上所述,与现有技术相比,本发明具有以下优点:
[0034]
1.本发明能够实现环境友好的优点,无需采用三氯氧磷存在下进行缩合,且能够使反应过程中形成的中间态相对稳定,从而更有利于反应的进行和操作,提高中间体的产物收率和最后产物的纯度质量,整体上能够使反应具有高产物收率和纯度的优点,且具有对环境友好的优点。
[0035]
2.通过采用本方法能够命名中间体的合成具有更好的收率,尤其是中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮具有较好的收率和纯度质量,以三氟乙酸乙酯计,收率达到85%以上,纯度≥98%。
具体实施方式
[0036]
下面通过具体实施例,对本发明的技术方案作进一步具体的说明,但是本发明并不限于这些实施例。
[0037]
实施例1
[0038]2‑
三氟乙酰氨基乙胺的合成
[0039]
在500ml的洁净的三口瓶中加入200ml甲基叔丁醚,然后,再称取乙二胺30.05g(0.50mol)滴入三口瓶中,滴加过程中,控温≤25℃,滴毕搅拌均匀,降温至
‑
5~0℃。缓慢滴入三氟乙酸乙酯71.04g(0.50mol),控温
‑
5~0℃,滴毕,保温搅拌反应4~6h,取样中控≥97%,反应结束后,加入饱和食盐水进行水洗两次,每次用50ml饱和食盐水,水层用50ml甲基叔丁基醚萃取一次,合并收集的有机相,加入15g无水硫酸钠进行干燥1h,然后,抽滤,收集的滤液进行减压蒸馏脱除溶剂,得到浓缩物2
‑
三氟乙酰氨基乙胺,再向浓缩物中加入50ml乙醇和200ml甲苯进行搅拌溶解,得到相应的含浓缩物2
‑
三氟乙酰氨基乙胺的料液,直接用于下一步的反应。
[0040]
实施例2
[0041]
实施例1得到的含浓缩物2
‑
三氟乙酰氨基乙胺的料液转至另一500ml洁净的三口瓶中,室温下滴加氯乙酸乙酯61.28g(0.50mol),滴毕后,再室温下搅拌1h,然后缓慢滴加n
‑
甲基吗林50.5g(0.50mol),滴毕升温至50~55℃并控制温度进行保温搅拌反应2h,结束后,直接继续再升温至90℃~100℃,搅拌反应5h脱除乙醇生成中间产物1
‑
三氟乙酰基
‑2‑
哌嗪酮,同时可收集蒸出的乙醇,反应完毕后,加入水100ml,搅拌30min,静置,分液,收集有机层,水层用50ml甲苯提取一次,合并有机相得到含有相应中间体的料液用于下一步反应。
[0042]
实施例3
[0043]
将上步实施例2得到的料液转至500ml洁净的三口瓶中,室温下滴加80%水合肼31.29g(0.50mol),滴毕缓慢升温至50℃~55℃,保温搅拌反应3h,反应结束后,降温至室温,静置、分液,收集有机相,有机相转入500ml三口瓶中,再加入50g的5a分子筛,然后升温至50℃~55℃进行搅拌充分反应3h脱水生成1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,反应完毕后,抽滤,收集的有机相进行减压蒸馏脱溶,加入200ml的甲基叔丁基醚在室温条件下进行打浆处理2h,然后,缓慢降温至0~5℃充分析晶,抽滤,得到湿品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,再在40℃~50℃的条件下进行真空干燥,得干品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮72.35g,以三氟乙酸乙酯计,收率约为88.23%,纯度≥98.2%。
[0044]
实施例4
[0045]
本实施例为3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐的合成
[0046]
在1000ml的洁净的三口瓶中加入上述实施例3得到的1
‑
三氟乙酰肼基
‑2‑
哌嗪酮72.35g(0.44mol)和无水乙醇600ml,然后,在室温下滴加浓度为36%的精制盐酸44.61g,滴毕后,将反应体系升温至50℃~55℃,并保温进行搅拌反应3h,反应结束后,缓慢降温至0~5℃进行充分析晶,抽滤,得最终产物湿品,烘干,得干品最终产物3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐80g,收率为79.55%,纯度为99.0%,外标含量为98%~102%。
[0047]
实施例5
[0048]
在500ml的洁净的三口瓶中加入200ml甲基叔丁醚,然后,再称取乙二胺36g
(0.60mol)滴入三口瓶中,滴加过程中,控温≤25℃,滴毕搅拌均匀,降温至
‑
5~0℃。缓慢滴入三氟乙酸乙酯71.04g(0.50mol),控温
‑
5℃~
‑
2℃,滴毕,保温搅拌反应5h,取样中控≥97%,反应结束后,加入饱和食盐水进行水洗两次,每次用50ml饱和食盐水,水层用50ml甲基叔丁基醚萃取一次,合并收集的有机相,向有机相中加入20g无水硫酸钠进行干燥1h,然后,抽滤,收集的滤液进行减压蒸馏脱除溶剂,得到浓缩物2
‑
三氟乙酰氨基乙胺,再向浓缩物中加入50ml乙醇和200ml甲苯进行搅拌溶解,得到相应的含浓缩物2
‑
三氟乙酰氨基乙胺的料液,直接用于下一步的反应。
[0049]
将上步得到的含浓缩物2
‑
三氟乙酰氨基乙胺的料液转至另一500ml洁净的三口瓶中,室温下滴加氯乙酸乙酯73.5g(0.6mol),滴毕后,再室温下搅拌1.0h,然后缓慢滴加n
‑
甲基吗林60.6g(0.6mol),滴毕升温至55℃并控制温度进行保温搅拌反应1.5h,结束后,直接继续再升温至100℃~110℃,搅拌反应4h脱除乙醇生成中间产物1
‑
三氟乙酰基
‑2‑
哌嗪酮,同时可回收蒸出的乙醇,反应完毕后,加入水150ml,搅拌30min,静置,分液,收集有机层,水层用50ml甲苯提取一次,合并有机相得到含有相应中间体的料液用于下一步反应。
[0050]
将上步得到的料液转至500ml洁净的三口瓶中,室温下滴加80%水合肼37.5g(0.6mol),滴毕缓慢升温至53℃~55℃,保温搅拌反应2.5h,反应结束后,降温至室温,静置、分液,收集有机相,有机相转入500ml三口瓶中,再加入55g的5a分子筛,然后升温至55℃进行搅拌充分反应2h脱水生成1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,反应完毕后,抽滤,收集的有机相进行减压蒸馏脱溶,向脱溶后的浓缩物加入200ml的甲基叔丁基醚在室温条件下进行打浆处理2h,然后,缓慢降温至0~5℃充分析晶,抽滤,得到湿品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,再在40℃~50℃的条件下进行真空干燥,得干品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮73.4g,以三氟乙酸乙酯计,收率约为89.5%,纯度≥98.8%。
[0051]
在1000ml的洁净的三口瓶中加入上述得到的1
‑
三氟乙酰肼基
‑2‑
哌嗪酮73.4g(0.45mol)和无水乙醇600ml,然后,在室温下滴加浓度为36%的精制盐酸46g,滴毕后,将反应体系升温至55℃,并保温进行搅拌反应2h,反应结束后,缓慢降温至0~5℃进行充分析晶,抽滤,得最终产物湿品,烘干,得干品最终产物3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐82g,收率为81.5%,纯度为99.3%,外标含量为98%~102%。
[0052]
实施例6
[0053]
在500ml的洁净的三口瓶中加入200ml乙基叔丁醚,然后,再称取乙二胺36g(0.65mol)滴入三口瓶中,滴加过程中,控温≤25℃,滴毕搅拌均匀,降温至
‑
5~0℃。缓慢滴入三氟乙酸乙酯71.04g(0.50mol),控温
‑
10℃~
‑
5℃,滴毕,保温搅拌反应4h,取样中控≥97%,反应结束后,加入饱和食盐水进行水洗两次,每次用50ml饱和食盐水,水层用50ml乙基叔丁基醚萃取一次,合并收集的有机相,向有机相中加入15g无水硫酸钠进行干燥1h,然后,抽滤,收集的滤液进行减压蒸馏脱除溶剂,得到浓缩物2
‑
三氟乙酰氨基乙胺,再向浓缩物中加入50ml乙醇和230ml甲苯进行搅拌溶解,得到相应的含浓缩物2
‑
三氟乙酰氨基乙胺的料液,直接用于下一步的反应。
[0054]
将上步得到的含浓缩物2
‑
三氟乙酰氨基乙胺的料液转至另一500ml洁净的三口瓶中,室温下滴加氯乙酸乙酯79.6g(0.65mol),滴毕后,再室温下搅拌1.5h,然后缓慢滴加n
‑
甲基吗林60.6g(0.6mol),滴毕升温至65℃并控制温度进行保温搅拌反应1.5h,结束后,直接继续再升温至100℃~110℃,搅拌反应4h脱除乙醇生成中间产物1
‑
三氟乙酰基
‑2‑
哌嗪
酮,同时可回收蒸出的乙醇,反应完毕后,加入水150ml,搅拌30min,静置,分液,收集有机层,水层用50ml甲苯提取一次,合并有机相得到含有相应中间体的料液用于下一步反应。
[0055]
将上步得到的料液转至500ml洁净的三口瓶中,室温下滴加80%水合肼40.6g(0.65mol),滴毕缓慢升温至55℃,保温搅拌反应2.0h,反应结束后,降温至室温,静置、分液,收集有机相,有机相转入500ml三口瓶中,再加入55g的5a分子筛,然后升温至60℃进行搅拌充分反应2h脱水生成1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,反应完毕后,抽滤,收集的有机相进行减压蒸馏脱溶,向脱溶后的浓缩物加入200ml的乙基叔丁基醚在室温条件下进行打浆处理2h,然后,缓慢降温至
‑
5~0℃进行充分析晶1h,抽滤,得到湿品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,再在40℃~50℃的条件下进行真空干燥,得干品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮72.4g,以三氟乙酸乙酯计,收率约为89.5%,纯度为98.7%。
[0056]
在1000ml的洁净的三口瓶中加入上述得到的1
‑
三氟乙酰肼基
‑2‑
哌嗪酮72.4g(0.44mol)和无水乙醇600ml,然后,在室温下滴加浓度为36%的精制盐酸45g,滴毕后,将反应体系升温至45℃,并保温进行搅拌反应2h,反应结束后,缓慢降温至0~5℃进行充分析晶,抽滤,得最终产物湿品,烘干,得干品最终产物3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐82g,收率为81%,纯度为99.5%,外标含量为98%~102%。
[0057]
实施例7
[0058]
本实施例为3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐的合成
[0059]
在1000ml的洁净的三口瓶中加入上述实施例3得到的1
‑
三氟乙酰肼基
‑2‑
哌嗪酮72.35g(0.44mol)和无水甲醇600ml,然后,在室温下滴加浓度为36%的精制盐酸46g,滴毕后,将反应体系升温至45℃~50℃,并保温进行搅拌反应3h,反应结束后,缓慢降温至0~5℃进行充分析晶,抽滤,得最终产物湿品,烘干,得干品最终产物3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
1,2,4
‑
三唑[4,3
‑
a]吡嗪盐酸盐82.5g,收率为80.5%,纯度为99.4%,外标含量为98%~102%。
[0060]
实施例8
[0061]
将实施例2得到的料液转至500ml洁净的三口瓶中,室温下滴加80%水合肼40.6g(0.65mol),滴毕缓慢升温至45℃~50℃,保温搅拌反应2h,反应结束后,降温至室温,静置、分液,收集有机相,有机相转入500ml三口瓶中,再加入55g的5a分子筛,然后升温至45℃~50℃进行搅拌充分反应3h脱水生成1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,反应完毕后,抽滤,收集的有机相进行减压蒸馏脱溶,加入200ml的甲基叔丁基醚在室温条件下进行打浆处理2h,然后,缓慢降温至0~5℃充分析晶,抽滤,得到湿品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,再在40℃~50℃的条件下进行真空干燥,得干品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮73.4g,以三氟乙酸乙酯计,收率约为89.5%,纯度为98.5%。
[0062]
实施例9
[0063]
实施例1得到的含浓缩物2
‑
三氟乙酰氨基乙胺的料液转至另一500ml洁净的三口瓶中,室温下滴加溴乙酸乙酯83.5g(0.50mol),滴毕后,再室温下搅拌1h,然后缓慢滴加吡啶39.5g(0.50mol),滴毕升温至50~55℃并控制温度进行保温搅拌反应2h,结束后,直接继续再升温至90℃~100℃,搅拌反应5h脱除乙醇生成中间产物1
‑
三氟乙酰基
‑2‑
哌嗪酮,同时可收集蒸出的乙醇,反应完毕后,加入水100ml,搅拌30min,静置,分液,收集有机层,水层用50ml甲苯提取一次,合并有机相得到含有相应中间体的料液用于下一步反应。
[0064]
将得到的料液转至500ml洁净的三口瓶中,室温下滴加80%水合肼34.3g(0.55mol),滴毕缓慢升温至55℃~60℃,保温搅拌反应1.5h,反应结束后,降温至室温,静置、分液,收集有机相,有机相转入500ml三口瓶中,再加入55g的5a分子筛,然后升温至55℃~60℃进行搅拌充分反应2h脱水生成1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,反应完毕后,抽滤,收集的有机相进行减压蒸馏脱溶,加入200ml的甲基叔丁基醚在室温条件下进行打浆处理2h,然后,缓慢降温至0~5℃充分析晶,抽滤,得到湿品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮,再在40℃~50℃的条件下进行真空干燥,得干品中间产物1
‑
三氟乙酰肼基
‑2‑
哌嗪酮72.2g,以三氟乙酸乙酯计,收率约为88%,纯度为98.6%。
[0065]
本发明中所描述的具体实施例仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
[0066]
尽管对本发明已作出了详细的说明并引证了一些具体实施例,但是对本领域熟练技术人员来说,只要不离开本发明的精神和范围可作各种变化或修正是显然的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

