1.本发明涉及一种培养组织及其制造方法。
背景技术:
2.近年来,业界要求开发一种基于组织工程学的人造器官、移植材料等生物材料以供医疗应用,从而主要着眼于在体外形成组织结构而进行研究。模仿生物体内组织的组织模型可用于阐明该组织的基本机理,另外,也可以用于在利用动物实验对治疗用药的有效成分的候选化合物的药物代谢动力或安全性进行评价之前,以体外的组织水平进行评价。因此,迄今已报告了各种培养组织作为组织模型(例如专利文献1及2)。
3.腺是进行分泌的组织,有直接向血管或淋巴管输送分泌物的内分泌腺、以及通过导管向体表或体腔内输送分泌物的外分泌腺。外分泌腺具有:分泌出分泌物的腺细胞、预先将腺细胞所分泌出的分泌物暂时储存的腺腔、以及将分泌物从腺腔输送到体表或体腔内的导管。腺腔是被腺细胞包围而形成的内腔,来自腺细胞的分泌物首先会被分泌到腺腔中。腺腔与导管相连,而形成了用于将来自腺细胞的分泌物分泌到体表或体腔的流路。
4.现有技术文献
5.专利文献
6.专利文献1:日本专利特开2018
‑
029611号公报
7.专利文献2:日本专利特开2018
‑
166512号公报
技术实现要素:
8.发明所要解决的技术问题
9.此前,即便在体外培养细胞来构建腺组织模型,也很难使腺腔与导管功能性地结合。如果腺腔与导管未被功能性地结合在一起,那么腺细胞所分泌出的分泌物就不会流入导管中,而滞留在腺腔中造成潴留,有时还有可能导致腺细胞坏死。
10.因此,本发明的目的在于提供一种培养组织,所述培养组织的腺腔与导管被功能性地结合在一起,而使从腺细胞分泌到腺腔内的分泌物流入导管内。
11.用于解决问题的技术手段
12.本发明人等反复进行了努力研究,结果发现了腺腔与导管被功能性地结合在一起的培养组织的制作方法,从而完成了本发明。
13.即,本发明的一实施方式如下所述。
14.1.15.一种培养组织,其包含腺细胞、由腺细胞形成的腺腔、及
16.由上皮细胞形成的导管,且
17.腺腔与导管在生物体外被功能性地结合在一起。
18.2.19.根据[1]所述的培养组织,其中培养组织为外分泌腺。
[0020]
[3]
[0021]
根据[1]或[2]所述的培养组织,其中腺细胞为肝细胞,上皮细胞为胆管上皮细胞。
[0022]
[4]
[0023]
根据[1]或[2]所述的培养组织,其中腺细胞为胰腺腺泡细胞,上皮细胞为胰管上皮细胞。
[0024]
[5]
[0025]
根据[1]至[4]中任一项所述的培养组织,其中上皮细胞是由前驱细胞诱导而获得的上皮细胞。
[0026]
[6]
[0027]
根据[5]所述的培养组织,其中前驱细胞是由成熟细胞重编程而获得的前驱细胞。
[0028]
[7]
[0029]
根据[1]至[6]中任一项所述的培养组织,其中腺细胞为原代细胞。
[0030]
[8]
[0031]
根据[3]所述的培养组织,其中腺细胞为原代肝细胞,胆管上皮细胞是由肝前驱细胞诱导而获得的胆管上皮细胞,此处,肝前驱细胞是由肝细胞重编程而获得的肝前驱细胞。
[0032]
[9]
[0033]
根据[1]至[8]中任一项所述的培养组织,其中上皮细胞为啮齿类细胞。
[0034]
[10]
[0035]
根据[1]至[9]中任一项所述的培养组织,其中腺细胞为人类细胞。
[0036]
[11]
[0037]
根据[1]至[3]及[5]至[10]中任一项所述的培养组织,其中腺细胞为人肝细胞。
[0038]
[12]
[0039]
根据[1]至[3]及[5]至[11]中任一项所述的培养组织,其中上皮细胞为啮齿类的胆管上皮细胞。
[0040]
[13]
[0041]
一种培养组织的制造方法,其包括以下步骤:培养上皮细胞,利用上皮细胞来形成导管;及
[0042]
将导管与腺细胞以所述导管和所述腺细胞接触的方式进行共培养。
[0043]
[14]
[0044]
根据[13]所述的制造方法,其中共培养是以二维培养方式进行的。
[0045]
[15]
[0046]
根据[13]或[14]所述的制造方法,其中腺细胞为肝细胞,上皮细胞为胆管上皮细胞。
[0047]
[16]
[0048]
根据[13]或[14]所述的制造方法,其中腺细胞为胰腺腺泡细胞,上皮细胞为胰管上皮细胞。
[0049]
[17]
[0050]
根据[13]至[16]中任一项所述的制造方法,其还包括将前驱细胞分化诱导成上皮细胞的步骤。
[0051]
[18]
[0052]
根据[17]所述的制造方法,其中在将前驱细胞分化诱导成上皮细胞的步骤之前,
[0053]
还包括将成熟细胞重编程为前驱细胞的步骤。
[0054]
[19]
[0055]
根据[13]至[18]中任一项所述的制造方法,其中腺细胞为原代细胞。
[0056]
[20]
[0057]
根据[13]至[19]中任一项所述的制造方法,其中上皮细胞为啮齿类细胞。
[0058]
[21]
[0059]
根据[13]至[20]中任一项所述的制造方法,其中腺细胞为人类细胞。
[0060]
[22]
[0061]
根据[13]至[15]及[17]至[21]中任一项所述的制造方法,其中腺细胞为人肝细胞。
[0062]
[23]
[0063]
根据[13]至[15]及[17]至[22]中任一项所述的制造方法,其中上皮细胞为啮齿类的胆管上皮细胞。
[0064]
[24]
[0065]
一种受检物质的评价方法,其使用根据[1]至[12]中任一项所述的培养组织。
[0066]
[25]
[0067]
一种受检物质的评价试剂盒,其包含根据[1]至[12]中任一项所述的培养组织。
[0068]
发明的效果
[0069]
根据本发明,可提供一种培养组织,所述培养组织的腺腔与导管被功能性地结合在一起,而使从腺细胞分泌到腺腔内的分泌物流入导管内。
附图说明
[0070]
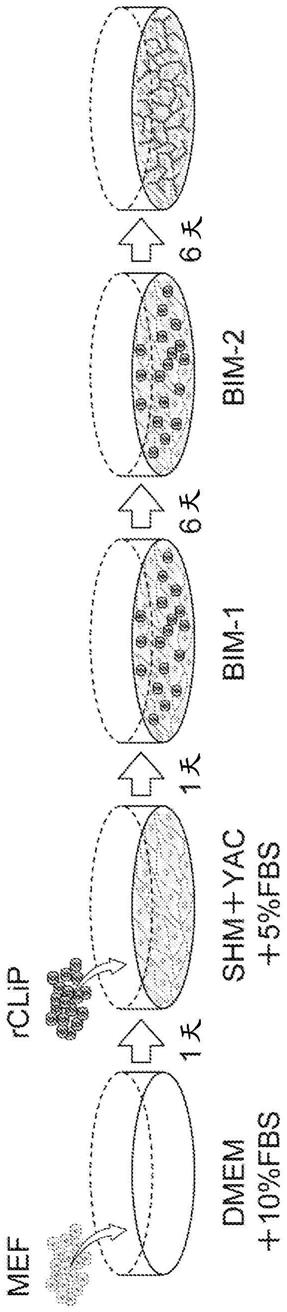
[图1a]是对由大鼠clip(rclip)诱导胆管上皮细胞、以及形成胆管的顺序进行说明的概念图。
[0071]
[图1b]是表示由rclip诱导胆管上皮细胞以及形成胆管的情况的相位差显微镜图像,从左到右依次为:将rclip接种到小鼠胚胎成纤维细胞(mef)上经过1天后、6天后、12天后的图像。
[0072]
[图2a]是对由rclip形成的胆管与大鼠肝细胞的共培养顺序进行说明的概念图。
[0073]
[图2b]是表示由rclip形成的胆管与大鼠肝细胞的共培养情况的相位差显微镜图像。从左到右依次为:开始共培养1天后、3天后的图像。
[0074]
[图3a]是表示与肝细胞进行共培养的胆管中储存胆汁酸的照片。上图分别是相位差显微镜图像,下图分别是荧光显微镜图像,从左到右依次为:将胆酰赖氨酰荧光素(clf)添加到培养基中2小时后、24小时后、72小时后的照片。
[0075]
[图3b]是向未与肝细胞进行共培养的胆管自身的培养基中添加clf,从添加起2小时后的相位差显微镜图像(左图)及荧光显微镜图像(右图)。
[0076]
[图4a]是对由rclip诱导胆管上皮细胞、以及形成胆管的顺序进行说明的概念图。
[0077]
[图4b]是表示由rclip诱导胆管上皮细胞以及形成胆管的情况的相位差显微镜图
像,从左到右依次为:将rclip接种到小鼠胚胎成纤维细胞(mef)上经过1天后、6天后、12天后的图像。
[0078]
[图5a]是对由rclip形成的胆管与人肝细胞的共培养顺序进行说明的概念图。
[0079]
[图5b]是表示由rclip形成的胆管与人肝细胞的共培养情况的相位差显微镜图像。从左到右依次为:开始共培养1天后、3天后的图像。
[0080]
[图6a]是表示在与人肝细胞进行共培养的胆管中胆汁酸储存情况的照片。上图分别是相位差显微镜图像,下图分别是荧光显微镜图像,从左到右依次为:利用含clf的汉克氏平衡盐溶液(hbss)进行培养后再利用不含clf的hbss来清洗细胞后立即得到的照片、以及4小时后、24小时后的照片。
[0081]
[图6b]是表示未与人肝细胞进行共培养的胆管的照片。上图分别是相位差显微镜图像,下图分别是荧光显微镜图像,从左到右依次为:利用含clf的hbss进行培养后再利用不含clf的hbss来清洗细胞后立即得到的照片、以及4小时后、24小时后的照片。
具体实施方式
[0082]
[培养组织]
[0083]
本发明提供一种培养组织,所述培养组织包含腺细胞、由腺细胞形成的腺腔、及由上皮细胞形成的导管,且腺腔与导管在生物体外被功能性地结合在一起。在本说明书中,“培养组织”是指在生物体外被人工培养出来的细胞集群,其能够作为人类或除人类以外的动物的生物组织而发挥功能。
[0084]
[外分泌腺]
[0085]
在本发明的一实施方式中,培养组织优选为外分泌腺。在本说明书中,“外分泌腺”是指腺细胞通过导管将其分泌物排出到体表或者像肠道、气管这种体腔的内表面的腺。在培养组织为外分泌腺的情况下,“导管”不包括血管。作为外分泌腺,例如可列举:消化腺、汗腺、皮脂腺、乳腺等,作为消化腺,例如可列举:肝脏、胰腺、唾液腺、胃腺、肠腺等。在本发明的一实施方式中,外分泌腺优选肝脏或胰腺,更优选肝脏。
[0086]
[腺细胞、腺腔及导管]
[0087]
在本说明书中,“腺细胞”是指分泌出分泌物的细胞。在本说明书中,“腺腔”是指由腺细胞形成的空腔。在本说明书中,“导管”是指由上皮细胞形成且输送分泌物的管。在本发明的一实施方式中,腺细胞只要是能够分泌出分泌物且形成腺腔的细胞即可,上皮细胞只要是能够形成内腔的上皮细胞即可。可以根据所要构建的培养组织来适当地选择腺细胞及上皮细胞。
[0088]
在本说明书中,所谓“功能性地结合”、“功能性结合”,是指腺腔和导管以分泌物从腺腔流入导管中的方式连结。关于所述结合,腺腔与导管可以直接连续地连结,例如腺腔与导管也可以通过细胞外基质等细胞间质而连续地连结。另外,例如还包括下述状态:将已标记的分泌物或其类似物引入到腺细胞中,确认能否从导管中检测到腺细胞分泌出的标记分泌物或其类似物,而发现该导管中有所述已标记的分泌物或其类似物。
[0089]
所谓“腺腔与导管在生物体外被功能性地结合”是指腺腔与导管的功能性结合是在生物体外进行的。因此,直接对从生物体摘出的腺组织进行培养而获得的培养组织不包括在本发明内。
[0090]
在本发明的一实施方式中,作为本发明的培养组织中所含的腺细胞,可列举:原代细胞、确立细胞株以及由多能干细胞(例如ips细胞(induced pluripotent stem cells,诱导性多能干细胞)及es细胞(embryonic stem cell,胚胎干细胞))诱导而获得的腺细胞等。在本说明书中,“原代细胞”是指从生物体采集并进行培养,且未被确立的细胞。因此,本说明书中的“原代细胞”也可以包含从生物体采集的细胞经过连续继代培养后所得的细胞。在腺细胞为原代细胞的情况下,其比确立细胞株更能维持生物体内细胞的实际功能,因此,能够使所要构建的培养组织成为更接近生物体的组织模型。另外,可以使用由多能干细胞诱导而获得的腺细胞来代替原代细胞。所述多能干细胞例如为ips细胞。在另一实施方式中,所要构建的培养组织是癌症患者的腺组织的组织模型时,可以使用癌细胞株的腺细胞。
[0091]
[肝脏组织]
[0092]
在本发明的一实施方式中,培养组织为肝脏组织。肝脏是负责生物体的主要代谢反应的器官。肝脏担负各种职责,例如从食物获得的糖、蛋白质、脂质的代谢;血浆蛋白质的合成;红细胞的分解;酒精、药物、毒素、废物的分解;胆汁的分泌等。
[0093]
在培养组织为肝脏组织的情况下,腺细胞是肝细胞(也称为肝实质细胞)。肝细胞是构成肝脏的主要细胞,且是分泌出作为消化液的胆汁的腺细胞。肝细胞除了分泌胆汁以外,还承担有在肝脏内进行的代谢及生物合成等职责。单个肝细胞是约25~30μm的多面体,具有面向被称为血窦的毛细血管的面、及肝细胞彼此粘附的面。在生物体内,肝细胞沿着血窦排成一列,而形成了被称为肝细胞索的栅状组织。肝细胞在肝细胞索的邻接的肝细胞间,形成了被称为胆小管的腺腔。由肝细胞产出的胆汁被分泌于胆小管中。在本发明的一实施方式中,关于肝细胞,只要其细胞群的绝大部分被肝细胞占据即可,可以含有肝非实质细胞,也可以仅由肝细胞所构成。例如,原代肝细胞的细胞群绝大部分由肝细胞所构成,但也可以含有肝非实质细胞。
[0094]
胆管上皮细胞承担对肝细胞所分泌的胆汁的流量、离子浓度、ph值等进行调节的职责。胆管上皮细胞聚集而形成管状结构。该管是将胆汁运往胆囊及十二指肠的导管、也就是胆管。
[0095]
在一实施方式中,本发明的培养组织是如下肝脏组织:腺细胞为肝细胞,分泌物为胆汁,腺腔为胆小管,上皮细胞为胆管上皮细胞,导管为胆管。根据本发明的一实施方式的肝脏组织,由肝细胞向胆小管分泌胆汁,进而胆小管与胆管被功能性地结合在一起,所以在胆小管中胆汁不会发生潴留而流向导管。所述肝脏组织可用于对肝脏中的受检物质的药效、毒性以及药物代谢动力等进行评价。
[0096]
用来形成胆管的胆管上皮细胞优选由肝前驱细胞诱导而获得的胆管上皮细胞。此处,在本说明书中,“前驱细胞”还包括:处于由所述多能干细胞分化成特定的成熟细胞的中途阶段的细胞;或者由成熟细胞向未分化程度更深的状态诱导而获得的细胞。因此,在本说明书中,“肝前驱细胞”可以是处于由肝脏干细胞分化成肝细胞的中途阶段的细胞,或者也可以是由作为成熟细胞的肝细胞向未分化程度更深的状态诱导而获得的细胞。另外,在本说明书中,“成熟细胞”是指并非胚细胞或生殖细胞来源的体细胞,可列举构成肝脏的肝细胞。关于所述由肝前驱细胞向胆管上皮细胞进行的诱导,优选以二维培养方式进行。另外,以二维培养方式形成胆管时,容易进行下文所述的使肝细胞与胆管接触的共培养。
[0097]
供诱导成胆管上皮细胞的肝前驱细胞优选为,由作为成熟细胞的肝细胞重编程为
肝前驱细胞而获得的细胞。此处,在本说明书中,“重编程”是指对细胞进行诱导以使其处于发育能力比成熟细胞高的状态的过程,换言之,是指使成熟细胞回到未分化程度更深状态的过程。关于本发明的一实施方式的培养组织,通过在指定的条件及方法下对肝细胞进行培养,能够将肝细胞重编程为肝前驱细胞。由肝细胞重编程而获得的肝前驱细胞被已知为clip(chemically
‑
induced liver progenitor,化学诱导肝祖细胞),这种重编程条件及方法例如在takeshi katsuda等人,conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity,cell stem cell,2017年1月5日,第20卷,p.1
‑
15(以下,称为“参考文献1”)中有详细记载。
[0098]
肝前驱细胞难以从生物体进行采集、鉴定以及单离,因此,通过使用由肝细胞重编程而获得的肝前驱细胞,能够比从生物体采集、鉴定及分离,效率更优地获取纯度高的肝前驱细胞。
[0099]
如上所述,根据本发明的一实施方式,提供一种培养组织,所述培养组织的胆小管与胆管被功能性地结合在一起,而使由肝细胞分泌到胆小管中的胆汁从胆小管流向胆管。
[0100]
[胰腺组织]
[0101]
在另一实施方式中,本发明的培养组织为胰腺组织。胰腺是向血液中分泌出胰岛素及胰高血糖素等血糖调节激素的内分泌腺,同时也作为外分泌腺而分泌出胰液,所述胰液包含对来自食物的糖、蛋白质、脂质进行分解的各种消化酶。胰腺腺泡细胞是占胰腺整体的90%以上的主要细胞,且是分泌胰液的腺细胞。胰腺腺泡细胞以十几个细胞形成被称为腺泡的腺腔,并向腺泡分泌胰液。
[0102]
多个胰管上皮细胞(也称为胰导管细胞)聚集而形成被称为胰管的导管,胰管将分泌到腺泡中的胰液运往十二指肠。另外,胰管上皮细胞本身会分泌出包含碳酸氢根离子的水。由胰导管细胞分泌出的碳酸氢根离子溶液与来自腺泡的胰液一起构成胰液的一部分,经过胰管,流向十二指肠。
[0103]
本发明的培养组织的一实施方式为如下胰腺组织:腺细胞为胰腺腺泡细胞,分泌物为胰液,腺腔为腺泡,上皮细胞为胰管上皮细胞,导管为胰管。关于本发明的胰腺组织,其腺泡与胰管被功能性地结合,由胰腺腺泡细胞分泌至腺泡中的胰液不会在腺泡中潴留,而流向胰管,因此可以用作外分泌腺中胰腺的组织模型。
[0104]
[其它组织]
[0105]
在另一实施方式中,本发明的培养组织也可以是:腮腺、颌下腺、舌下腺等唾液腺;胃底腺、贲门腺、幽门腺等胃腺;十二指肠腺、利伯屈恩(lieberkuhn)腺等肠腺;小汗腺、顶泌腺等汗腺;皮脂腺或乳腺等。构成各个腺组织的腺细胞及导管的组合对于本领域的技术人员而言是公知的,可以根据所要构建的培养组织进行适当选择。
[0106]
[培养组织的用途]
[0107]
在一实施方式中,本发明的培养组织可用于如下方面:在生物体外对受检物质在腺组织中的药效及毒性以及吸收、分布、代谢、排泄等药物代谢动力进行评价。即,本发明还提供一种所述受检物质的评价方法,其使用本发明的一实施方式的培养组织。
[0108]
另外,本发明在一实施方式中还提供一种试剂盒,其用于在生物体外对所述受检物质进行评价。通过所述试剂盒,可以在生物体外简便地进行受检物质的评价。评价试剂盒包含本发明的一实施方式的培养组织,还可以包含:培养基、在该培养组织中的药效、毒性
及/或药物代谢动力已被获知的阳性对照化合物、用于指定检查的试剂、材料、用具及装置、以及使用说明书这其中的至少1个。
[0109]
另外,在另一实施方式中,本发明的培养组织可以用于如下用途,即,在生物体外对生物体内的腺组织进行基础研究及评价。
[0110]
另外,在另一实施方式中,本发明的培养组织可以用于如下用途,即,对腺组织中癌细胞的行为、抗癌剂的代谢、排泄进行评价。
[0111]
另外,在另一实施方式中,本发明的培养组织可以用作移植治疗目的的移植物。
[0112]
在本发明的一实施方式中,腺细胞与上皮细胞可以来自同类的动物,也可以来自不同类的动物。为了在生物体外对受检物质进行评价,腺细胞可以是人类细胞,也可以是除人类以外的动物(例如小鼠及大鼠等啮齿类)细胞。在一实施方式中,腺细胞是人腺细胞,作为人腺细胞,可列举人肝细胞。上皮细胞优选为容易诱导形成导管的上皮细胞。作为所述上皮细胞,可列举小鼠及大鼠等啮齿类的上皮细胞。在某一实施方式中,本发明的一实施方式的培养组织使用人腺细胞、及啮齿类的上皮细胞。在本发明的一实施方式的培养组织用于移植物用途时,腺细胞与上皮细胞均优选为来自和移植对象动物同类的动物的细胞。
[0113]
[培养组织的制造方法]
[0114]
本发明的培养组织的制造方法包括以下步骤:培养上皮细胞而形成导管;及将导管与腺细胞以导管和腺细胞接触的方式进行共培养。在各步骤中,可以使用上文所述的上皮细胞及腺细胞。
[0115]
培养上皮细胞而形成导管的步骤可以通过公知的多种方法来进行。例如,当在细胞外基质或饲养细胞等适合培养上皮细胞的支架(scaffold)材料上接种上皮细胞,并加入适当的培养基进行培养时,因为上皮细胞具有极性,所以按照细胞的顶端面侧朝向内腔,侧面侧朝向相邻的上皮细胞,底面侧朝向支架材料的方式,利用上皮细胞来形成管状结构、也就是导管。
[0116]
作为能够用作支架材料的细胞外基质,例如除了下述实施例中所示的matrigel以外,还可列举胶原蛋白凝胶、纤连蛋白、层粘连蛋白等,作为饲养细胞,例如除了实施例中所使用的小鼠胚胎成纤维细胞(mef)以外,还可使用人间充质干细胞、人成纤维细胞等。上述细胞外基质及饲养细胞可以使用一种或者组合两种以上而使用。
[0117]
作为能够用于形成导管的培养基,例如除了实施例中所使用的bim(bile duct inducing medium,胆管诱导培养基)
‑
1培养基及bim
‑
2培养基以外,还可列举mtesr(商标)1培养基、培养肝细胞的培养基、培养胆管上皮细胞的培养基、培养胰岛细胞的培养基、培养小肠细胞的培养基、杜氏改良伊格尔培养基(dmem)、伊格尔最低必需培养基(emem)、α改良型伊格尔最低必需培养基(α
‑
mem)、格拉斯哥最低必需培养基(gmem)、哈姆的f
‑
12营养混合物(ham’sf
‑
12)、杜氏改良伊格尔培养基/哈姆的f
‑
12营养混合物(d
‑
mem/ham’s f
‑
12)、lscove改良杜氏培养基(imdm)、rpmi
‑
1640培养基、杜氏磷酸盐缓冲生理盐水(d
‑
pbs)、汉克氏平衡盐溶液(hbss)等,这些培养基可以使用一种或组合两种以上而使用,还可以适当变更。培养基可以根据培养时间及细胞数而适当地更换、变更为新的培养基、新的组成。
[0118]
培养上皮细胞的培养温度及培养时间可由本领域的技术人员根据所培养的上皮细胞及所要形成的导管的种类而适当地设定。例如,在利用来自人类或啮齿类的胆管上皮细胞来形成胆管时,培养温度例如可为30℃~39℃、或36℃~38℃。培养时间例如可为4~
720小时、120~336小时、或168~288小时。
[0119]
另外,所接种的上皮细胞的密度例如可为5
×
103~5
×
106个细胞/cm2、或5
×
104~5
×
105个细胞/cm2。
[0120]
继所述步骤之后进行下述步骤,或者与所述步骤同时进行下述步骤:将所形成的导管、与腺细胞以导管和腺细胞接触的方式进行共培养。在本说明书中,“导管和腺细胞接触”包括导管和腺细胞直接接触的方式、及导管和腺细胞通过细胞外基质等细胞间质而接触的方式这两种方式。通过使所形成的导管和腺细胞接触来进行共培养,而形成为腺腔与导管被功能性地结合在一起的结构,从而从腺细胞分泌到腺腔中的分泌物会流入导管中。虽然尚不清楚腺腔与导管像这样功能性地结合的原因,但本发明认为,形成导管的上皮细胞与形成腺腔的腺细胞接触而在细胞间进行信号传导,这对腺腔与导管的功能性结合而言是必要的。
[0121]
关于导管与腺细胞的共培养,只要能够使导管与腺细胞接触,培养方法可以是平板培养等二维培养,也可以是三维培养,优选以二维培养方式进行。如果以二维培养方式进行共培养,那么容易使导管和腺细胞接触,因此,容易形成腺腔与导管被功能性地结合在一起的结构。
[0122]
关于二维培养方式下的导管与腺细胞的共培养,例如可通过下述方式进行:首先在细胞培养用板等二维培养装置上,由上皮细胞形成导管,以和所形成的该导管接触的方式在导管上直接接种腺细胞,并在该状态下对导管与腺细胞进行培养。因此,形成导管的步骤、及对导管与腺细胞进行共培养的步骤可以在同一二维培养装置中连续或同时进行。关于和腺细胞开始共培养的时间点,只要形成了导管,便可为任意时间点,例如可为从诱导形成导管起4~720小时后、120~336小时后、或168~288小时后。
[0123]
关于所接种的腺细胞的密度,在二维培养的情况下,例如可为3
×
103~6
×
105个细胞/cm2、1
×
104~1
×
105个细胞/cm2、或3
×
104~6
×
104个细胞/cm2。
[0124]
导管和腺细胞的共培养温度例如可为30℃~39℃、或36℃~38℃。共培养时间例如可为4~720小时、24~168小时、或48~72小时。
[0125]
关于共培养时的腺细胞的细胞数,相对于诱导形成导管之前的上皮细胞的细胞数,例如可为0.001~1000倍、0.01~100倍、或0.05~10倍。但是,关于培养温度、培养时间、腺细胞与上皮细胞的细胞数的比率,可由本领域的技术人员根据共培养的导管及腺细胞的种类而适当地设定。
[0126]
关于对导管与腺细胞进行共培养的培养基,可由本领域的技术人员根据共培养的导管及腺细胞的种类而适当地选择。例如除了实施例中所使用的bim
‑
1培养基以外,还有上述作为可用于形成导管的培养基所列举的培养基,可使用所列举的培养基中的一种或者组合两种以上而使用,且可适当进行变更。培养基可根据培养时间及细胞数而适当地更换、变更为新的培养基、新的组成。
[0127]
接种到导管上的腺细胞在进行接种的时间点,可为单离细胞,也可为腺细胞已彼此聚集而形成了腺腔结构的细胞集群。即便在接种时为单离细胞,腺细胞也可以在共培养中彼此聚集而形成腺腔。形成了腺腔的腺细胞与导管接触,从而使腺腔与导管功能性地结合。另外,在接种到导管上的腺细胞是人肝细胞的情况下,该人肝细胞的形态没有特别限制,例如也可列举被调整成悬浮液状的形态。此时,将该悬浮液接种到所述导管上。该人肝
细胞的调整方法可采取公知的各种方法。
[0128]
本发明的另一实施方式的方法还可包括下述步骤:将前驱细胞分化诱导成形成所述导管的上皮细胞。例如在所要制造的培养组织为肝脏组织的情况下,这种步骤是由肝前驱细胞分化诱导成胆管上皮细胞的步骤。优选为,不仅以二维培养方式进行共培养步骤,而且还以二维培养方式进行将前驱细胞分化诱导成上皮细胞的步骤以及形成导管的步骤。在以二维培养方式进行这些步骤的情况下,可在同一二维培养装置中连续或同时进行将前驱细胞分化诱导成上皮细胞的步骤、形成导管的步骤以及共培养步骤。通过在同一二维培养装置中进行这些步骤,可在共培养步骤中使导管和腺细胞效率良好地接触,使得所制造的培养组织中,腺腔与导管更容易功能性地结合。
[0129]
关于本发明的另一实施方式的方法,也可在由上述前驱细胞分化诱导成上皮细胞的步骤之前,还包括将成熟细胞重编程为所述前驱细胞的步骤。关于将成熟细胞重编程为前驱细胞的步骤,可使用公知的方法。被重编程的成熟细胞可以是原代细胞,也可以是确立细胞株。例如,在目标培养组织为肝脏组织,上皮细胞为胆管上皮细胞的情况下,被重编程的所述成熟细胞宜为肝细胞,前驱细胞宜为肝前驱细胞。关于将肝细胞重编程为肝前驱细胞的步骤,例如可以依据上述参考文献1中所记载的条件及方法来进行。在目标培养组织为肝脏组织的情况下,被重编程的成熟细胞与腺细胞都有可能是肝细胞。
[0130]
通过上述方法所制造的培养组织中,腺腔与导管被功能性地结合在一起,这可以通过利用标记化合物的多种方法进行确认。例如,可以使用对在确认对象即腺腔和导管中的行为已被获知的化合物进行标记后的化合物。具体来说,可以通过下述方式进行确认:将经标记的分泌物或其类似物引入到腺细胞中,确认能否从导管中检测到从腺细胞分泌出的标记分泌物或其类似物。例如,在腺细胞为肝细胞,腺腔为胆小管,导管为胆管的情况下,作为这种标记分泌物或其类似物,可以使用经荧光标记的胆汁酸类似物、也就是胆酰赖氨酰荧光素(clf)。向已与胆管进行共培养的肝细胞中引入clf,当从胆管中检测到clf的荧光时,能够确认到clf从肝细胞被分泌到胆小管,且所分泌的clf移动到了胆管,即,胆小管与胆管被功能性地结合在一起。作为标记化合物,除了荧光标记以外,还可以使用放射性同位素这种标记化合物。另外,关于腺腔与导管被功能性地结合在一起,也可以使用在该腺腔和导管中的行为已被获知且未经标记的化合物来确认。此时,可以通过以下方式来确认:使用高效液相色谱仪(hplc)及质谱仪来测定培养基中或细胞中的该化合物。关于经标记或未经标记且在对象腺腔及导管中的行为是已知的化合物,其可作为阳性对照而任意地包含在本发明的一实施方式的试剂盒中。
[0131]
可以利用相同的方法,使用经荧光或放射性同位素标记的受检物质、或者未经标记的受检物质,对腺组织中的受检物质进行评价。受检物质的检测、测定可由本领域的技术人员根据受检物质及其标记的有无、种类,从荧光检测、辐射检测、以及hplc(high performance liquid chromatography,高效液相色谱)和质谱分析的组合等公知的方法中适当进行选择。
[0132]
实施例
[0133]
以下,使用实施例来进一步说明本发明。但是,本发明并不限定于以下实施例进行解释。
[0134]
实施例1.使用大鼠肝细胞来制作培养组织
[0135]
<大鼠clip的制备>
[0136]
基于上述参考文献1中所记载的方法,由大鼠肝细胞重编程为肝前驱细胞。
[0137]
具体来说,通过胶原酶二步灌注法对从7周龄的雄性wistar大鼠中摘出的肝脏进行灌注,分离出原代肝细胞。向涂有胶原蛋白的培养皿以1
×
104个细胞/cm2的密度接种原代肝细胞。使用以下的shm(small hepatocyte culture medium,小肝细胞培养基) yac培养基作为培养基。
[0138]
shm yac培养基:该培养基含有基础培养基(含有nahco3及l
‑
谷酰胺的dmem/f12培养基)以及以下物质。5mm的hepes(hydroxyethylpiperazine ethane sulfonic acid,羟乙基哌嗪乙磺酸)、30mg/l的l
‑
脯氨酸、0.05%bsa(bovine serum albumin,牛血清白蛋白)、10ng/ml的表皮生长因子(egf)、胰岛素
‑
运铁蛋白
‑
亚硒酸钠(its)
‑
x添加物(gibco公司制造)、10
‑7m地塞米松、10mm烟酰胺、1mm抗坏血酸
‑2‑
磷酸盐(asc2p,ascorbic acid
‑
2 phosphate)、100单位/ml青霉素、100μg/ml链霉素、10μm y
‑
27632、0.5μm a
‑
83
‑
01、3μm chir99021。
[0139]
每2天更换1次培养基,进行12~14天的培养直到细胞融合,从而制作rclip。
[0140]
利用tryple(商标)express(赛默飞世尔科技公司制造)处理10分钟以使细胞解离,而制作rclip,对所制作的rclip进行继代。
[0141]
<由rclip诱导胆管上皮细胞以及形成胆管>
[0142]
以下,如图1a所示,由rclip诱导胆管上皮细胞以及形成胆管。
[0143]
在涂有胶原蛋白的培养皿以5.3
×
104个细胞/cm2的密度接种经丝裂霉素处理的小鼠胚胎成纤维细胞(mef),培养1天。使用包含dmem低糖培养基及10%胎牛血清(fbs)的培养基作为接种mef时的培养基。
[0144]
接种mef经过1天后,将经继代的rclip以1.3
×
105个细胞/cm2的密度接种在mef上。使用包含上述shm yac培养基及5%fbs的培养基作为接种rclip时的培养基。
[0145]
接种rclip经过1天后,将培养基更换为以下的bim(bile duct inducing medium)
‑
1培养基,然后培养6天,获得胆管上皮细胞。在培养中每2天新换1次bim
‑
1培养基。
[0146]
bim
‑
1培养基:该培养基包含mtesr(商标)1(stemcell(商标)technologies公司制造)、以及10μm y
‑
27632、0.5μm a
‑
83
‑
01及3μm chir99021。
[0147]
利用bim
‑
1培养基将胆管上皮细胞培养6天后,将培养基更换成以下的bim
‑
2培养基,再培养6天。在培养中每2天新换1次bim
‑
2培养基。利用bim
‑
2培养基培养6天后,观察到由胆管上皮细胞形成的胆管(图1b的最右侧图)。
[0148]
bim
‑
2培养基:该培养基包含bim
‑
1培养基及2%matrigel。
[0149]
<rclip胆管与原代肝细胞的共培养>
[0150]
以下,如图2a所示,进行由rclip形成的胆管与原代肝细胞的共培养。
[0151]
在以上述方式由rclip诱导胆管上皮细胞而形成有胆管的培养基(利用bim
‑
1培养基及bim
‑
2培养基分别培养6天后)中,将通过胶原酶二步灌注法进行灌注并分离出的大鼠原代肝细胞以5.3
×
104个细胞/cm2的密度进行接种。接种原代肝细胞时的培养基使用培养肝细胞的培养基。
[0152]
接种原代肝细胞经过1天后,将培养基更换为bim
‑
2培养基。接种原代肝细胞经过3天后,为了对肝细胞
‑
胆小管
‑
胆管的功能性结合进行评价,而将clf溶液添加至培养基中。
利用相位差显微镜及荧光显微镜对添加clf溶液经过2小时后、24小时后、72小时后的细胞情况进行观察(图3a)。利用荧光显微镜进行观察时的激发波长采用480nm。
[0153]
作为阴性对照,在以相同方式由rclip诱导胆管上皮细胞而形成有胆管的培养基(利用bim
‑
1培养基及bim
‑
2培养基分别培养6天后)中,不接种原代肝细胞,而添加clf溶液。利用相位差显微镜及荧光显微镜对添加clf溶液经过2小时后的情况进行观察(图3b)。
[0154]
如图3a所示,从胆管中检测到荧光,这表示被引入到原代肝细胞中的clf被分泌到胆小管中,并从胆小管移动到了胆管。即,在所制作的培养组织中,成功使胆小管与胆管功能性地结合在一起。另一方面,如图3b所示,尽管向只有胆管的培养基中添加clf,也未检测到荧光。
[0155]
实施例2.使用人肝细胞来制作培养组织
[0156]
此外,基于使用人肝细胞而非大鼠肝细胞的实施例来进一步说明本发明。但是,本发明并不限定于以下实施例进行解释。
[0157]
<大鼠clip的制备>
[0158]
依据上述参考文献1中所记载的方法,由大鼠肝细胞重编程为肝前驱细胞。
[0159]
具体来说,通过胶原酶二步灌注法对8周龄的雄性wistar大鼠的肝脏进行灌注,分离出原代肝细胞后,在涂有胶原蛋白的培养皿以1
×
104个细胞/cm2的密度接种原代肝细胞。培养基使用以下的shm(small hepatocyte culture medium) yac培养基。
[0160]
shm yac培养基:该培养基含有基础培养基(dmem/f12培养基)以及以下物质。5mm hepes、30mg/l的l
‑
脯氨酸、0.05%bsa、10ng/ml的表皮生长因子(egf)、1%胰岛素
‑
运铁蛋白
‑
亚硒酸钠(its)
‑
x添加物(赛默飞世尔科技制造)、10μm地塞米松、10mm烟酰胺、1mm抗坏血酸
‑2‑
磷酸盐(asc2p)、100单位/ml青霉素
‑
100μg/ml链霉素
‑
250ng/ml两性霉素b(antibiotic
‑
antimycotic,抗菌
‑
抗真菌剂)、10μm y
‑
27632、0.5μm a
‑
83
‑
01、3μm chir99021。
[0161]
接种大鼠原代肝细胞经过1天后,将培养基更换为shm yac培养基,然后每2~3天更换1次培养基,培养12~15天直到细胞融合,从而制作rclip。
[0162]
利用tryple(商标)express(赛默飞世尔科技公司制造)处理10~15分钟,而将rclip从培养皿分离,进行继代。
[0163]
<由rclip诱导胆管上皮细胞以及形成胆管>
[0164]
以下,如图4a所示,由rclip诱导胆管上皮细胞以及形成胆管。
[0165]
在涂有胶原蛋白的12孔板,以5.3
×
104个细胞/cm2的密度接种经丝裂霉素处理的小鼠胚胎成纤维细胞(mef),培养1天。接种mef时的培养基使用包含10%胎牛血清(fbs)的dmem高糖培养基。
[0166]
接种mef经过1天后,将经继代的rclip以1.3
×
105个细胞/cm2的密度接种到mef上。接种rclip时使用的培养基是向以下的bim(bile duct inducing medium)
‑
1培养基中添加5%fbs而获得的培养基。
[0167]
bim
‑
1培养基:该培养基包含mtesr(商标)1(stemcell(商标)technologies公司制造)、以及10μm y
‑
27632、0.5μm a
‑
83
‑
01及3μm chir99021。
[0168]
接种rclip经过1天后,将培养基更换为bim
‑
1培养基,然后培养6天,获得胆管上皮细胞。在培养中每2~3天新换1次bim
‑
1培养基。
[0169]
利用bim
‑
1培养基将胆管上皮细胞培养6天后,将培养基更换为以下的bim
‑
2培养基,再培养6天。在培养中每2~3天新换1次bim
‑
2培养基。利用bim
‑
2培养基培养6天后,观察到由胆管上皮细胞形成的胆管(图4b的最右侧图)。
[0170]
bim
‑
2培养基:该培养基包含bim
‑
1培养基及2%matrigel。
[0171]
<rclip胆管与人肝细胞的共培养>
[0172]
以下,如图5a及图5b所示,对由rclip形成的胆管与人肝细胞进行共培养。
[0173]
(基于人冻存肝细胞来调整人肝细胞悬浮溶液)
[0174]
使用冻存肝细胞恢复培养基(cryopreserved hepatocytes recovery medium)(chrm(注册商标))(赛默飞世尔科技公司制造),使人冻存肝细胞融解,对细胞进行离心分离而去除上清液。然后,向人肝细胞添加含有原代肝细胞解冻和铺板添加剂(primary hepatocyte thawing and plating supplement)(赛默飞世尔科技公司制造)的威廉姆斯e培养基(william’s medium e),制备人肝细胞悬浮溶液。
[0175]
以上述方式由rclip诱导胆管上皮细胞而形成胆管(利用bim
‑
1培养基及bim
‑
2培养基分别培养6天后),从形成有该胆管的培养孔中去除培养基,将上述人肝细胞以5.3
×
104个细胞/cm2的密度进行接种。
[0176]
接种人肝细胞经过1天后,将培养基更换为bim
‑
2培养基。接种人肝细胞经过3天后,为了对肝细胞
‑
胆小管
‑
胆管的功能性结合进行评价,而将培养基更换为含clf的汉克氏平衡盐溶液(hanks’balanced salt solution(hbss))(赛默飞世尔科技公司制造),并培养30分钟。培养后,利用不含clf的hbss来清洗细胞,利用相位差显微镜及荧光显微镜对刚清洗完以及4小时后、24小时后的细胞情况进行观察(图6a)。利用荧光显微镜进行观察时的激发波长采用470nm。
[0177]
作为阴性对照,在以相同方式由rclip诱导胆管上皮细胞而形成有胆管的孔中,不接种人肝细胞而更换为含clf的hbss,并培养30分钟。培养后,利用不含clf的hbss来清洗细胞,利用相位差显微镜及荧光显微镜对刚清洗完及4小时后、24小时后的细胞情况进行观察(图6b)。
[0178]
如图6a所示,从胆管中检测到荧光,这表示被引入至人肝细胞中的clf被分泌到胆小管中,并从胆小管移动到了胆管。即,在所制作的培养组织中,成功使胆小管与胆管功能性地结合在一起。另一方面,如图6b所示,将未接种人肝细胞而只有胆管的培养基更换为含clf的hbss并进行培养,尽管如此,也未检测到荧光。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

