1.本发明涉及分子生物学及代谢工程学领域,具体涉及的是一种协同催化茶树酯型儿茶素 生物合成的基因组合及其应用。
背景技术:
2.茶树是一种重要的经济作物,现今广泛种植在世界上60多个国家。茶叶具有天然健康属 性,已经成为全世界最流行的饮料之一,其消费市场不断扩大。茶叶中富含酯型儿茶素,约 占茶叶干重的12%左右。酯型儿茶素是茶树中含量最多的次级代谢产物,与茶树的自身抗性 和茶叶的感官品质密切相关。酯型儿茶素是茶叶苦味和涩味的主要贡献物质,与茶叶的感官 品质密切相关。同时,酯型儿茶素也是对人体健康非常有益的一类物质,具有抗氧化、减肥 降脂、抗病毒、抗癌等功效。
3.儿茶素类化合物的主体结构是2
‑
苯基苯并吡喃,具有a环、b环和c环。酯型儿茶素是 在儿茶素c环的3位羟基上连接有没食子基团。茶树体内的没食子酰基转移酶,负责催化将 βg上的没食子基团转移到儿茶素的c环3位羟基上形成酯型儿茶素。然而,有关参与酯型儿 茶素生物合成的功能基因和分子调控机理尚没有真正探明,使得人们难以通过分子标记和育 种手段对茶树高积累酯型儿茶素这一重要品质性状进行遗传改良,这也是目前酯型儿茶素生 物合成研究领域的热点和难点。
4.通过对茶树中酯型儿茶素合成关键基因进行挖掘和鉴定,在农业上能够为茶树遗传育种, 品质调控等方面奠定理论基础,在工业上能够为酶代谢工程合成高纯度酯型儿茶素提供技术 支撑。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种协同催化茶树酯型儿茶素生物合成的 基因组合及其应用。
6.本发明采用以下技术方案来实现:
7.一种协同催化茶树酯型儿茶素生物合成的基因组合,包括基因csscpl4和基因 csscpl5,所述基因csscpl4和基因csscpl5具有如下序列中任意一种:
8.(1)如seq id no.1和seq id no.2所示的核苷酸序列;
9.(2)具有(1)的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能 蛋白质的核苷酸序列。
10.进一步改进在于,所述基因csscpl4和csscpl5是从茶树鲜叶中分离并克隆获得。
11.进一步改进在于,所述基因csscpl4和csscpl5编码蛋白的氨基酸序列如seq id no.3 和seq id no.4所示。
12.本发明还提供了一种表达盒,包含上述协同催化茶树酯型儿茶素生物合成的基因组合。
13.本发明还提供了一种重组植物表达载体组合,所述载体组合包含将上述协同催化
茶树酯 型儿茶素生物合成的基因组合重组至pcb2004载体上所获得的pcb
‑
csscpl4质粒和 pcb
‑
csscpl5质粒。
14.本发明还提供了一种工程菌组合,其所述工程菌组合包含将上述pcb
‑
csscpl4质粒和 pcb
‑
csscpl5质粒分别转化至农杆菌gv3101获得的工程菌。
15.本发明还提供了一种上述基因组合在催化酯型儿茶素生物合成中的应用。
16.本发明还提供了一种酯型儿茶素生物的合成方法,向含有βg和表儿茶素类物质作为底 物的反应体系中,加入上述工程菌组合菌液在本式烟叶片中瞬时共表达的重组蛋白,或者是 加入上述稳定转基因烟草共表达的重组蛋白,通过酶催化反应合成酯型儿茶素。
17.进一步改进在于,所述基因组合的共表达重组蛋白的获得方法包括:利用农杆菌介导的 瞬时共表达技术,将csscpl4基因和csscpl5基因共同转化至植物细胞中进行蛋白共表达, 或者,将csscpl4基因和csscpl5基因的阳性稳定转基因植株通过授粉杂交方法获得共表 达植株。
18.本发明的有益效果是:
19.1、本发明提供了一种协同催化茶树酯型儿茶素生物合成的基因组合及其应用,首次从 茶树中克隆并验证了催化酯型儿茶素生物合成的基因csscpl4和csscpl5的功能。
20.2、本发明还提供了含有csscpl4和csscpl5基因的表达盒、载体组合、转基因工程农 杆菌、转基因稳定共表达烟草和共表达重组蛋白。
21.3、本发明提供了一种简单高效的酯型儿茶素生物合成技术,为进一步实现利用酶代谢 工程生产高纯度酯型儿茶素提供了基础。
22.4、本发明对csscpl4和csscpl5基因的功能验证,为茶树酯型儿茶素的生物合成与代 谢调控等研究领域奠定了坚实的基础。
附图说明
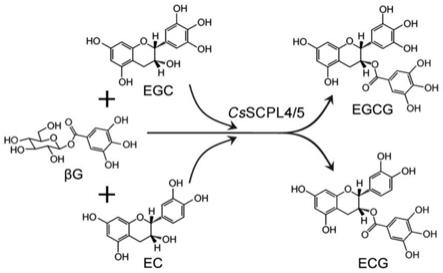
23.图1为本发明实施例中茶树体内共表达的csscpl4和csscpl5蛋白协同催化酯型儿茶素 生物合成流程图。
24.图2为本发明实施例中csscpl4和csscpl5基因与不同植物的scpl基因系统进化树分析 图;其中csscpl4和csscpl5基因分布于scpl
‑
ia组,该组蛋白具有酰基转移酶功能。
25.图3为本发明实施例中csscpl4和csscpl5蛋白与已知的丝氨酸羧肽酶氨基酸序列比对 结果图。
26.图4为本发明实施例中利用烟草真核共表达体系验证csscpl4和csscpl5基因的酶活功 能图;其中,图4
‑
a为农杆菌介导的本式烟瞬时共表达流程图;图4
‑
b为利用uplc技术检测瞬 时共表达的重组蛋白酶反应产物egcg图;图4
‑
c为底物注射本式烟叶片流程图;图4
‑
d为利 用uplc
‑
ms/ms技术检测本式烟体内酶反应产物egcg图;图4
‑
e为转基因烟草杂交流程图; 图4
‑
f为利用uplc技术检测稳定共表达的重组蛋白酶反应产物egcg图。
27.图5为本发明实施例中csscpl4和csscpl5共表达的重组蛋白催化合成的酯型儿茶素 的lc
‑
ms/ms分析谱图;其中,图5
‑
a为酶反应产物egcg和ecg的母离子谱图,酶反应分 别是以egc和βg为底物合成egcg,以ec和βg为底物合成ecg;图5
‑
b为酶反应产物和ecg的二级碎片谱图。
28.图6为本发明实施例中csscpl4和csscpl5共表达的重组蛋白酶反应时间梯度曲线
图。
29.图7为本发明实施例中植物表达载体pcb2004的结构图谱。
具体实施方式
30.为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具 体图示,进一步阐述本发明。
31.1、材料
32.(1)茶树品种:舒茶早(camellia sinensis(l.)o.kuntze.var.sinensis cultivar shuchazao), 采集茶树鲜叶,立即用液氮冷冻,存于
‑
80℃冰箱保存备用;
33.(2)模式植物本式烟和烟草,生长温室条件:16h光照,8h黑暗,环境温度25
±
1℃。
34.(3)克隆感受态大肠杆菌细胞dh5α,农杆菌感受态gv3101均购自上海唯地生物技术 有限公司;
35.(4)lb培养基:称取酵母提取物5g,胰蛋白胨10g,氯化钠10g,加950ml纯水,超 声至充分溶解后,用1mol/lnaoh溶液调节ph至7.0,加水定容至1l;lb固体培养基,按 照每200mllb液体培养基加3g琼脂粉混匀,121℃高压蒸汽灭菌15min。
36.(5)卡那霉素母液(50mg/ml):称取0.5g卡那霉素,溶于10ml灭菌水,过滤除菌, 分装小管,
‑
20℃保存;
37.(6)利福平母液(20mg/ml):称取0.2g利福平,溶于10mldmso溶液,过滤除菌, 分装小管,
‑
20℃保存;
38.(7)乙酰丁香酮母液(0.2mol/l):称取0.0314g乙酰丁香酮,充分溶于0.8mldmso溶 液即可。
39.(8)mes缓冲液:称取1.066gmes,0.476gmgcl2,溶于500ml纯水中,超声至充分 溶解后,加入0.5ml乙酰丁香酮母液,用1mol/lkoh溶液调ph至5.6。
40.若未特别指明,实施例均按照常规实验条件或按照制造厂商说明书建议的条件进行。所 用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
41.2、方法
42.2.1协同催化酯型儿茶素生物合成的基因组合的克隆及表达
43.2.1.1csscpl4和csscpl5基因的克隆
44.(1)根据csscpl4和csscpl5基因的开放阅读框序列,设计特异引物。
45.引物序列如seq id no.5、seq id no.6、seq id no.7和seq id no.8所示:
46.seq id no:5:csscpl4正向引物:
[0047]5’‑
atgtttccaacaaagtcatacagttc
‑3’
;
[0048]
seq id no:6:csscpl4反向引物:
[0049]5’‑
ctaaataggatagtaatgaatccatctg
‑3’
;
[0050]
seq id no:7:csscpl5正向引物:
[0051]5’‑
atggcaccacaagcaaaagttgagc
‑3’
;
[0052]
seq id no:8:csscpl5反向引物:
[0053]5’‑
ttagattggataataagcgaaccac
‑3’
;
[0054]
(2)按照多糖多酚总rna提取试剂盒说明书,从茶树品种舒茶早鲜叶中提取出总
rna, 然后利用反转录试剂盒对总rna进行反转录,获得茶树cdna模板。
[0055]
(3)以茶树cdna为模板,用seq id no.5和6所示的引物以及seq id no.7和8所 示的引物分别进行扩增,扩增程序为:98℃变性10s,62℃退火15s,72℃延伸30s,30个循环, 再72℃继续延伸10min。
[0056]
(4)利用dna纯化回收试剂盒纯化pcr产物,送测序公司测序,结果表明:两条基因 开放阅读框长度均为1443bp,编码480个氨基酸。
[0057]
(5)植物表达载体构建方法:根据gateway克隆技术说明书,通过bp反应和lr反应, 将csscpl4和csscpl5基因重组到pcb2004载体上,然后转化至dh5α大肠杆菌感受态, 涂布含有卡那霉素(50mg/l)的lb固体培养基上。利用菌落pcr鉴定阳性克隆,测序正确 后抽提pcb
‑
csscpl4质粒和pcb
‑
csscpl5质粒。
[0058]
2.1.2csscpl4和csscpl5基因的序列分析
[0059]
茶树体内酯型儿茶素的生物合成途径如图1所示。通过将茶树csscpl4和csscpl5的 蛋白序列与拟南芥、葡萄、柿树等植物中检索到的scpl蛋白序列一起构建系统进化树,图2 结果显示:csscpl4和csscpl5蛋白属于scpl
‑
ia分支,该分支的蛋白在功能划分上属于 scpl酰基转移酶。
[0060]
从图3的csscpl4和csscpl5氨基酸序列比对结果,可以看出:csscpl4和csscpl5 序列一致性为50.2%,并具有scpl蛋白典型特征:信号肽区域、氧阴离子结合位点、五肽 基序和形成二硫键的半胱氨酸残基,但是二者在催化三联体的位置存在差异,csscpl4蛋白 具有保守的催化三联体ser
‑
asp
‑
his(s
‑
d
‑
h);而csscpl5蛋白的催化三联体出现了突变现 象,为thr
‑
asp
‑
tyr(t
‑
d
‑
y)。
[0061]
2.1.3csscpl4和csscpl5基因的转烟草共表达与蛋白提取技术
[0062]
本实施例中所用到的烟草共表达和蛋白提取技术为本领域的技术人员常用或完全可以理 解的技术手段。
[0063]
(1)本式烟瞬时共表达技术
[0064]
将所述植物表达载体pcb
‑
csscpl4质粒和pcb
‑
csscpl5质粒分别用电击法转入农杆菌 感受态gv3101(含psoup
‑
p19)中,然后涂布在含有50μg/ml卡纳霉素和20μg/ml利福平 的培养基上进行抗性筛选。利用菌落pcr鉴定出阳性克隆,获得转基因工程菌。随后挑取阳 性菌落,分别摇菌以及扩大培养。待od600值达到1.0时,离心收集菌体,用mes缓冲液 反复重悬三次,然后将菌液od600值稀释到0.8。然后将csscpl4农杆菌液和csscpl5农 杆菌液等体积混合均匀,室温孵育2h后,注射生长四周的本式烟叶片。人工气候室培养3d 后,收集叶片,用液氮冷冻后保存在
‑
80℃冰箱。
[0065]
(2)烟草稳定共表达技术
[0066]
本发明将单基因稳定表达的csscpl4转基因烟草和csscpl5转基因烟草进行异花授粉 杂交。具体操作步骤:首先将csscpl4转基因烟草和csscpl5转基因烟草在气候室生长至 开花,选择半开放还未授粉的花朵作为母本花朵,用剪刀小心去掉雄蕊,再用牙签蘸取父本 花朵的花粉,轻轻涂在母本花朵的柱头上,将透明袋子扎几处小孔,套在授粉后的花朵上, 防止污染其他花粉。做好标记待种子成熟后收集。取适量的杂交种子放到2ml管子里,随后 无菌条件下操作,加1ml75%消毒酒精快速振荡15s,无菌水重复清洗4次;再加0.1%生汞 振荡8min,无菌水重复清洗4次。将种子用无菌水悬浮起来后,用枪头吸取种子,
均匀滴在 msk固体培养基(含除草剂10mg/l)培养瓶中。封好封口膜,置于培养室中长出小苗。然 后移栽至营养土中,待长至4~5片真叶时,进行pcr验证。筛选出csscpl4和csscpl5基 因共表达的阳性植株后,采摘叶片,液氮冷冻,
‑
80℃保存,以备提取粗酶。
[0067]
(3)粗酶蛋白提取技术方法
[0068]
研磨叶片:研钵中加入5g转基因烟草叶片,液氮下充分研磨,加入10ml0.1m磷酸盐缓 冲液(ph7.0,0.15mnacl)后充分研磨成匀浆状溶液。接着,转入50ml离心管中,5000g 离心10min,转移上清至新的离心管中定容至15ml;
[0069]
硫酸铵分级沉淀蛋白:按照硫酸铵溶液饱和度表,向上清液中加硫酸铵,置于摇床上4℃ 条件下混匀6h,以利于蛋白充分沉淀,离心收集0~85%硫酸铵饱和度区间段的沉淀蛋白,用 适量的0.1m磷酸盐缓冲液充分溶解,10000g离心收集上清液,利用考马斯亮兰试剂盒测定 蛋白浓度。
[0070]
2.2csscpl4和csscpl5共表达重组蛋白的酶活功能验证
[0071]
2.2.1酶活检测方法
[0072]
酶活反应体系100μl:包括50mm的磷酸盐缓冲液(ph6.0),60μg粗酶蛋白,0.4mmegc, 0.4mmβg没食子酰葡萄糖,4mm抗坏血酸。接着30℃水浴反应3h后,加等体积甲醇后振荡 混匀,室温静置5min,然后放超声仪中超声10min,使酶充分变性,12000g离心20min,吸 取上清至进样瓶中待测。
[0073]
uplc检测酶反应产物方法:安捷伦1260uplc系统,流动相:a相1%乙酸水,b相纯 乙腈,流速0.4ml/min,柱子型号poroshellhph
‑
c18column(2.7μm,4.6
×
100mm),检测器波长 280nm,进样量5μl,梯度洗脱方法:从0min到5min,b相从1%升至10%;从5min到20min, b相由10%升至35%;从20min到21min,b相从35%降至10%,从21min到23min,b相 从10%降至1%,从23min到25min,维持b相1%状态平衡柱子。根据标准品出峰时间和最 大紫外吸收峰确定酶反应产物。
[0074]
uplc
‑
ms/ms检测酶反应产物方法:安捷伦6460uplc
‑
qqq
‑
lc/ms系统,流动相a相 为0.4%乙酸水,b相纯乙腈,柱子型号与梯度洗脱方法同上述uplc方法。质谱条件:电喷 雾,负离子模式,采集质荷比在100
‑
1000的化合物。根据标准品和特征离子碎片对产物峰进 行鉴定分析。
[0075]
2.2.2csscpl4和csscpl5共表达重组蛋白的酶反应产物鉴定
[0076]
以本式烟为实验材料,利用农杆菌介导的瞬时表达技术,将csscpl4、csscpl5以及空 载pcb2004分别转入本式烟叶片中进行蛋白表达,同时,利用农杆菌介导的瞬时共表达技术, 将csscpl4和csscpl5共同转化至本式烟叶片中进行蛋白共表达(图4
‑
a)。酶活检测结果 表明:在csscpl4 csscpl5基因共表达的酶反应体系中检测到了产物峰egcg,而同一时 间注射的空载pcb2004,csscpl4和csscpl5单基因表达的酶反应体系中均没有检测到产 物峰egcg(图4
‑
b)。为了进一步在植物体内验证酶活,将底物βg和egc等比例混合后注 射进已转化2天的本式烟叶片内,使底物与植物体内瞬时表达的目的蛋白进行反应,1天后 收集叶片(图4
‑
c)。利用uplc
‑
ms/ms技术检测本式烟叶片的代谢产物,图4
‑
d结果表明: 在csscpl4 csscpl5基因共表达的叶片中检测到了产物峰egcg,而在单基因表达的叶片 中均没有检测到产物峰egcg。
[0077]
以烟草为实验材料,利用烟草遗传转化方法分别获得过表达csscpl4基因和
csscpl5 基因的阳性植株烟草,并通过授粉杂交获得csscpl4和csscpl5基因共表达烟草(图4
‑
e)。 然后提取转基因植株粗酶进行酶活检测。uplc分析图谱显示:在稳定转基因共表达csscpl4 和csscpl5植株的酶反应样品中检测到了产物峰egcg,而在单基因过表达植株的酶反应样 品中均没有检测到产物峰egcg(图4
‑
f)。综合以上实验得出结论:只有csscpl4和csscpl5 基因在烟草体内共表达,才能形成具有催化活性的没食子酰基转移酶。
[0078]
利用uplc
‑
ms/ms对酶反应产物进行定性分析,图5结果表明:产物峰的保留时间,一 级和二级质谱信息与标准品的色谱和质谱信息一致,进一步确定了酶反应产物为egcg和 ecg。
[0079]
2.2.3csscpl4和csscpl5共表达重组蛋白的底物转化率检测
[0080]
通过对体外酶活实验设置不同反应时间梯度,从图6共表达的酶反应体系中底物和产物 的变化曲线可以看出:随着反应时间的延长,底物βg和egc在逐渐减少,产物egcg则逐 渐增长,反应1h后的底物转化率达到50%以上,反应3h后的底物转化率能达到80%以上。 这为后续利用酶工程生产酯型儿茶素提供了基础条件。
[0081]
上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础 上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。本行业的技术人 员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明 的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和 改进都落入要求保护的本发明范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

