1.本发明涉及多糖制备的技术领域,尤其涉及一种太子参多糖及其制备方法。
背景技术:
2.太子参又名“孩儿参”,具有益气、健脾润肺之功效,临床常用于食欲不振、病后康复、止咳等不适症,常作为滋补佳品。相对于人参、西洋参而言,太子参药性温和,更适宜于儿童食用。太子参多糖是太子参中主要的活性物质之一,研究表明,太子参多糖有多种健康保护作用,比如调节免疫、抗氧化、抗疲劳、抗肿瘤、降血糖等。
3.目前,有很多关于制备太子参多糖的方法。然而,这些制备方法存在一定的弊端:一方面采用传统熬制、浸泡等方式得到的太子参浸提液,其原料特有的土腥味、中药味仍十分突出,对产品的风味、口感有负面影响,不易被消费者接受;另一方面活性成分的含量及纯度不明,成分复杂,不利于产品质量的控制。因此,提供一种可掩盖太子参固有土腥味、中药味等不良风味且纯度极高的太子参多糖是目前急需解决的问题。
技术实现要素:
4.本发明的目的在于为克服现有技术中存在的上述缺陷,提供一种可掩盖太子参固有土腥味、中药味等不良风味且纯度高的太子参多糖及其制备方法。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种太子参多糖的制备方法,包括如下步骤:
7.(1)将太子参烘干破碎,得太子参粉;
8.(2)对所得太子参粉顺次进行水提、浓缩,得浓缩液;
9.(3)对所得浓缩液进行醇沉,将所得沉淀冷冻干燥后得太子参粗多糖;
10.(4)对所得太子参粗多糖顺次进行纯化、洗脱、透析、浓缩和冷冻干燥,得太子参多糖。
11.优选的,所述步骤(1)太子参粉的粒径为40~60目。
12.优选的,所述步骤(2)中,所述水提是指在太子参粉中加入8~10倍水进行提取,水提的温度为80~120℃,水提的时间为100~140min,水提的次数为2~4次;
13.所述浓缩为浓缩至原体积的1/11~1/9。
14.优选的,所述步骤(3)中,所述醇沉是采用乙醇进行沉淀,所述乙醇的体积分数为75~85%,所述醇沉的温度为3~5℃,醇沉的时间为12~18h;
15.所述冷冻干燥的温度为
‑
40~
‑
20℃,冷冻干燥的时间为48~72h。
16.优选的,所述步骤(4)中,所述纯化是采用deae cellulose
‑
52离子交换柱纯化多糖,所述纯化条件为采用tris
‑
hcl缓冲液上样,所述tris
‑
hcl缓冲液的ph为7.5~7.7,所述上样的浓度为1~2mg/ml太子参粗多糖;
17.所述洗脱是指顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,收集第一个单一洗脱峰,所述洗脱的流速为1.5~2.5ml/min;
18.所述透析是指用450~550da的透析袋进行透析;
19.所述浓缩为浓缩至原体积的1/11~1/9;
20.所述冷冻干燥的温度为
‑
40~
‑
20℃,冷冻干燥的时间为48~72h。
21.本发明还提供了一种太子参多糖。
22.与现有技术相比,本发明的有益效果如下:
23.本发明方法可有效掩盖太子参固有土腥味、中药味等不良风味且纯度高。经研究验证,本发明制得的太子参多糖还可通过调整小鼠体重生长,修复组织病理损伤,缓解机体炎症表达水平,综合表现出太子参多糖具备调节小鼠体内免疫的能力。
附图说明
24.图1为空白组的raw264.7小鼠巨噬细胞形态图;
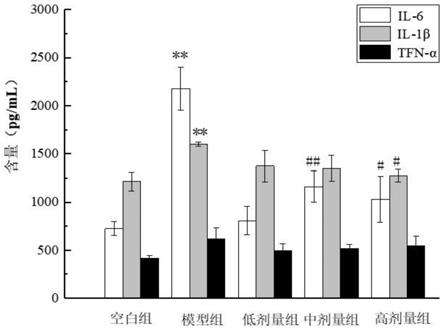
25.图2为模型组的lps诱导损伤的raw264.7小鼠巨噬细胞形态图;
26.图3为实施例2所得太子参多糖80μg/ml剂量组对lps诱导损伤的raw264.7细胞形态的影响图;
27.图4为实施例2所得太子参多糖160μg/ml剂量组对lps诱导损伤的raw264.7细胞形态的影响图;
28.图5为实施例2所得太子参多糖320μg/ml剂量组对lps诱导损伤的raw264.7细胞形态的影响图;
29.图6为实施例2所得太子参多糖640μg/ml剂量组对lps诱导损伤的raw264.7细胞形态的影响图;
30.图7为不同处理组的小鼠体重增重情况比较图(注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01);
31.图8为空白组的小鼠肝组织切片图(200x);
32.图9为模型组的小鼠肝组织切片图(200x);
33.图10为实施例2所得太子参多糖低剂量组的小鼠肝组织切片图(200x);
34.图11为实施例2所得太子参多糖中剂量组的小鼠肝组织切片图(200x);
35.图12为实施例2所得太子参多糖高剂量组的小鼠肝组织切片图(200x);
36.图13为空白组的小鼠肾组织切片图(200x);
37.图14为模型组的小鼠肾组织切片图(200x);
38.图15为实施例2所得太子参多糖低剂量组的小鼠肾组织切片图(200x);
39.图16为实施例2所得太子参多糖中剂量组的小鼠肾组织切片图(200x);
40.图17为实施例2所得太子参多糖高剂量组的小鼠肾组织切片图(200x);
41.图18为不同处理组的小鼠血清中免疫因子的含量图(注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01)。
具体实施方式
42.本发明提供了一种太子参多糖的制备方法,包括如下步骤:
43.(1)将太子参烘干破碎,得太子参粉;
44.(2)对所得太子参粉顺次进行水提、浓缩,得浓缩液;
45.(3)对所得浓缩液进行醇沉,将所得沉淀冷冻干燥后得太子参粗多糖;
46.(4)对所得太子参粗多糖顺次进行纯化、洗脱、透析、浓缩和冷冻干燥,得太子参多糖。
47.在本发明中,所述步骤(1)太子参粉的粒径优选为40~60目,进一步优选为50目。
48.在本发明中,所述步骤(2)中,所述水提是指在太子参粉中优选加入8~10倍水进行提取,进一步优选为9倍水进行提取,所述水提的温度优选为80~120℃,进一步优选为90~110℃,更进一步优选为100℃,水提的时间优选为100~140min,进一步优选为110~130min,更进一步优选为120min,水提的次数优选为2~4次,进一步优选为3次;
49.所述浓缩为优选浓缩至原体积的1/11~1/9,进一步优选为浓缩至原体积的1/10。
50.在本发明中,所述步骤(3)中,所述醇沉优选采用乙醇进行沉淀,所述乙醇的体积分数优选为75~85%,进一步优选为80%,所述醇沉的温度优选为3~5℃,进一步优选为4℃,醇沉的时间优选为12~18h,进一步优选为13~16h,更进一步优选为14h;
51.所述冷冻干燥的温度优选为
‑
40~
‑
20℃,进一步优选为
‑
35~
‑
25℃,更进一步优选为
‑
30℃,冷冻干燥的时间优选为48~72h,进一步优选为56~64h,更进一步优选为60h。
52.在本发明中,所述步骤(4)中,所述纯化优选采用deae cellulose
‑
52离子交换柱纯化多糖,所述纯化条件为优选采用tris
‑
hcl缓冲液上样,所述tris
‑
hcl缓冲液的ph优选为7.5~7.7,进一步优选为7.6,所述上样的浓度优选为1~2mg/ml太子参粗多糖,进一步优选为1.5mg/ml太子参粗多糖;
53.所述洗脱优选顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,收集第一个单一洗脱峰,所述洗脱的流速优选为1.5~2.5ml/min,进一步优选为2ml/min;
54.所述透析优选用450~550da的透析袋进行透析,进一步优选为用500da的透析袋进行透析;
55.所述浓缩为优选浓缩至原体积的1/11~1/9,进一步优选为浓缩至原体积的1/10;
56.所述冷冻干燥的温度优选为
‑
40~
‑
20℃,进一步优选为
‑
35~
‑
25℃,更进一步优选为
‑
32℃,冷冻干燥的时间优选为48~72h,进一步优选为56~64h,更进一步优选为62h。
57.本发明还提供了一种太子参多糖。
58.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
59.实施例1
60.1)将太子参烘干后,用高速破碎机破碎,过40目筛,得太子参粉;
61.2)在太子参粉中加入8倍蒸馏水,80℃提取100min后离心,提取2次,合并滤液,浓缩至原体积的1/11,后用体积分数为75%的乙醇,在3℃下醇沉12小时,离心得沉淀,在
‑
40℃下冷冻干燥48h得太子参粗多糖;
62.3)采用deae cellulose
‑
52离子交换柱纯化多糖,纯化条件为:ph为7.5的tris
‑
hcl缓冲液上样,上样浓度为1mg/ml太子参粗多糖,上样结束后,顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,流速为1.5ml/min,收集第一个单一洗脱峰,450da透析袋透析除盐,浓缩至原体积的1/11,在
‑
40℃下冷冻干燥48h后得太子参多糖。
63.实施例2
64.1)将太子参烘干后,用高速破碎机破碎,过50目筛,得太子参粉;
65.2)在太子参粉中加入9倍蒸馏水,100℃提取120min后离心,提取3次,合并滤液,浓缩至原体积的1/10,后用体积分数为80%的乙醇,在4℃下醇沉14小时,离心得沉淀,在
‑
30℃下冷冻干燥60h得太子参粗多糖;
66.3)采用deae cellulose
‑
52离子交换柱纯化多糖,纯化条件为:ph为7.6的tris
‑
hcl缓冲液上样,上样浓度为1.5mg/ml太子参粗多糖,上样结束后,顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,流速为2ml/min,收集第一个单一洗脱峰,500da透析袋透析除盐,浓缩至原体积的1/10,在
‑
32℃下冷冻干燥62h后得太子参多糖。
67.实施例3
68.1)将太子参烘干后,用高速破碎机破碎,过60目筛,得太子参粉;
69.2)在太子参粉中加入10倍蒸馏水,120℃提取140min后离心,提取4次,合并滤液,浓缩至原体积的1/9,后用体积分数为85%的乙醇,在5℃下醇沉18小时,离心得沉淀,在
‑
20℃下冷冻干燥72h得太子参粗多糖;
70.3)采用deae cellulose
‑
52离子交换柱纯化多糖,纯化条件为:ph为7.7的tris
‑
hcl缓冲液上样,上样浓度为2mg/ml太子参粗多糖,上样结束后,顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,流速为2.5ml/min,收集第一个单一洗脱峰,550da透析袋透析除盐,浓缩至原体积的1/9,在
‑
20℃下冷冻干燥72h后得太子参多糖。
71.实施例4
72.1)将太子参烘干后,用高速破碎机破碎,过50目筛,得太子参粉;
73.2)在太子参粉中加入9倍蒸馏水,100℃提取120min后离心,提取3次,合并滤液,浓缩至原体积的1/10,后用体积分数为80%的乙醇,在4℃下醇沉14小时,离心得沉淀,在
‑
30℃下冷冻干燥60h得太子参粗多糖;
74.3)采用deae cellulose
‑
52离子交换柱纯化多糖,纯化条件为:ph为7.6的tris
‑
hcl缓冲液上样,上样浓度为1.5mg/ml太子参粗多糖,上样结束后,顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,流速为2ml/min,收集第一个单一洗脱峰,500da透析袋透析除盐,浓缩至原体积的1/10,在
‑
32℃下冷冻干燥62h后得太子参多糖。
75.实施例5
76.1)将太子参烘干后,用高速破碎机破碎,过50目筛,得太子参粉;
77.2)在太子参粉中加入9倍蒸馏水,100℃提取120min后离心,提取3次,合并滤液,浓缩至原体积的1/10,后用体积分数为80%的乙醇,在4℃下醇沉14小时,离心得沉淀,在
‑
30℃下冷冻干燥60h得太子参粗多糖;
78.3)采用deae cellulose
‑
52离子交换柱纯化多糖,纯化条件为:ph为7.6的tris
‑
hcl缓冲液上样,上样浓度为1.5mg/ml太子参粗多糖,上样结束后,顺次用含0、0.1、0.2、0.3mol/lnacl的盐溶液等体积洗脱,流速为2ml/min,收集第一个单一洗脱峰,500da透析袋透析除盐,浓缩至原体积的1/10,在
‑
32℃下冷冻干燥62h后得太子参多糖。
79.实验例1
80.研究实施例2所得太子参多糖对raw264.7小鼠巨噬细胞体外免疫调节作用的影响:以raw264.7小鼠巨噬细胞为模型,设置6个处理组:空白组、模型组、80、160、320、640μg/ml实施例2所得太子参多糖剂量组;观察太子参多糖对免疫损伤的细胞形态的影响,细胞形态变化如图1
‑
6所示。
81.由图1
‑
6可知,空白对照组的小鼠巨噬细胞大多呈椭圆或圆形;模型组免疫损伤的细胞形态发生改变,伸展爬开呈现成纤维样,呈现较多的菱形、梭形,细胞密度也大不如空白对照组,还可见较长伪足;加入实施例2所得太子参多糖后的细胞相对收缩变圆,增殖减慢,呈标准圆形、类椭圆形、纺锤形及其他不规则形等。可见,实施例2所得太子参多糖具有调节免疫的潜在能力。
82.实验例2
83.研究实施例2所得太子参多糖对小鼠机体免疫调节作用的影响:选取清洁级昆明小鼠40只,随机分为5组:空白组、模型组、太子参多糖低、中、高剂量组,每组雌雄各4只。
84.正常组灌胃、注射生理盐水;模型组灌胃生理盐水,皮下注射150mg/kg d
‑
半乳糖;低剂量组灌胃75mg/kg实施例2所得太子参多糖,皮下注射150mg/kg d
‑
半乳糖;中剂量组灌胃150mg/kg实施例2所得太子参多糖,皮下注射150mg/kg d
‑
半乳糖;高剂量组灌胃300mg/kg实施例2所得太子参多糖,皮下注射150mg/kg d
‑
半乳糖。
85.实验进行至49天,对小鼠末次给药后,断食不断水12h,称重,取血,处死。测定其体重生长、组织病理、免疫分子含量变化,结果如图7
‑
18所示。
86.由图7可知,模型组的体重增长率为15%左右。与模型组相比,实施例2所得太子参多糖的同步喂养使小鼠的体重增长有一定回升,接近20%,相对缓解了d
‑
半乳糖导致的不良发育状况。
87.由图8
‑
12可知,模型组的细胞核表现出明显核固缩或其他变形,细胞质疏松化,核界限模糊,经太子参多糖干预后,肝细胞核固缩现象及细胞质疏松化现象得到缓解,细胞形态结构更趋完整,细胞质紧密,说明实施例2所得太子参多糖对肝损伤有一定的修复作用。
88.由图13
‑
17可知,相较于正常组,模型组出现肾小球体积明显增大,部分肾小囊腔变窄的现象。太子参多糖干预后,肾小球体积均有不同程度的相对缩小,肾小囊腔积相对变大,说明实施例2所得太子参多糖对肾脏损伤有一定的修复作用。
89.细胞因子的分泌水平反映了机体的炎症反应及应答能力。由图18可知,与模型组相比,实施例2所得太子参多糖组的小鼠的炎症水平(il
‑
6、il
‑
1β、tfn
‑
α)相对下调。
90.研究结果综合提示,本发明制得的太子参多糖通过调整小鼠体重生长,修复组织病理损伤,缓解机体炎症表达水平,综合表现出太子参多糖具备调节小鼠体内免疫的能力。
91.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

