一种抗人ifnar1单克隆抗体浓缩溶液的制备方法
技术领域
1.本发明涉及生物技术领域,尤其涉及一种抗人ifnar1单克隆抗体浓缩溶液的制备方法。
背景技术:
2.生物制剂市场作为一个快速增长的市场,拥有众多的研发管线,同时为患者带来更多创新疗法,针对一些传统化药较难治疗的疾病,生物制剂靶向药物提供了更多的选择。另一方面为了降低生物制剂的临床使用成本,并提高患者的依从性,生物制剂剂型逐渐由冻干剂型向水针剂型转变,由静脉给药方式向皮下注射剂型转变。由于单克隆抗体注射液的给药剂量通常在100mg~600mg范围,而皮下注射药液体积一般限制在2ml以下,在所述情况下,必须制备高度浓缩的蛋白制剂,通常蛋白含量可达到100mg/ml或者更大的浓度。
3.高浓度的单克隆抗体注射液给生产工艺的可制造、工艺放大、及最终的患者施用带来了许多挑战。最主要的一个挑战是超高的粘度,由于单克隆抗体的生物高分子特性,以及蛋白分子间相互作用力(如疏水、电荷作用等)在高浓度条件时增强,倾向于形成高粘性溶液。在某些极端情况下甚至会形成凝胶状物质,这对超滤膜和超滤设备本身带来不小的挑战,比如最终浓缩时压差的急速上升导致的切向流速减小,浓差极化逐渐失控,直至出现蛋白沉淀将膜堵塞的现象,如此必然会造成回收率降低或工艺失败。另一方面,即使通过改进设备或膜包类型获得最终的高浓度蛋白溶液,也难以将其投入到实际的临床应用中,因为皮下给药时需要使用一次性无菌注射器吸取或者采用预充针的最终包装形式,而过高的粘度将导致装药注射器的滑动性能降低,从而无法手动推注入皮下。超滤浓缩高浓度单克隆抗体药液的另一个难题是在高度浓缩时蛋白样品容易聚集形成可溶性聚体,进一步会聚集形成蛋白沉淀。
4.因此,针对高浓度的抗人ifnar1单克隆抗体皮下注射剂的制备,需要开发一种能够有效降低超滤浓缩液的粘度、减少单克隆抗体聚集并提高其稳定性的超滤浓缩制备方法。
技术实现要素:
5.为了解决现有技术中存在的问题,本发明提供了一种抗人干扰素α受体1(ifnar1)单克隆抗体浓缩溶液的制备方法,所述方法通过超滤浓缩制备包含抗人ifnar1单克隆抗体的超滤浓缩液体,并能够有效降低超滤浓缩液的粘度、减少抗人ifnar1单克隆抗体聚集并提高其稳定性。
6.抗人干扰素α受体1(ifnar1)单克隆抗体(qx006n)为自主研发的靶向人i型干扰素素α/β受体1的重组人源化单克隆抗体,阻断包括ifnα、ifnβ和ifn
‑
ω在内的所有i型干扰素的活性,拟用于系统性红斑狼疮(sle)的治疗,拟采用静脉或皮下注射方式给药。目前国内外尚未有上市的靶向人干扰素α/β受体1(ifnar1)单克隆抗体药物,阿斯利康开发的anifrolumab进度最快,目前正在进行3期临床研究,其制剂规格为150mg/1ml,拟给药方式
为静脉或皮下注射。体外药效学研究表明qx006n生物学活性与anifrolumab相当。该新的抗人i型干扰素素α/β受体1单克隆抗体制备成皮下注射液,则该皮下注射液中的蛋白含量要高达100~150mg/ml。
7.本发明具体技术方案如下:
8.1.一种抗人干扰素α受体1(ifnar1)单克隆抗体浓缩溶液的制备方法,其包括下述步骤:
9.第一超滤浓缩:在流速为120
‑
300l/m2·
h和跨膜压差(tmp)为0.6
‑
1.5bar的条件下将含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液浓缩至蛋白质浓度为20
‑
60mg/ml,得到浓缩样品;
10.超滤置换:采用置换缓冲液置换浓缩样品,当置换缓冲液的使用量为浓缩样品重量的6
‑
10倍时得到超滤置换溶液;
11.第二超滤浓缩:将超滤置换溶液和碱性氨基酸母液混匀使得氨基酸的浓度为100
‑
150mm,进行超滤浓缩后得到蛋白质浓度为100
‑
200mg/ml的浓缩溶液;
12.所述抗ifnar1单克隆抗体包含三个重链互补决定区(cdr
‑
h1、cdr
‑
h2和cdr
‑
h3)和三个轻链互补决定区(cdr
‑
l1、cdr
‑
l2和cdr
‑
l3),其中:
13.(a)cdr
‑
h1的氨基酸序列如seq id no:1所示;
14.(b)cdr
‑
h2的氨基酸序列如seq id no:2所示;
15.(c)cdr
‑
h3的氨基酸序列如seq id no:3所示;
16.(d)cdr
‑
l1的氨基酸序列如seq id no:4所示;
17.(e)cdr
‑
l2的氨基酸序列如seq id no:5所示;且
18.(f)cdr
‑
l3的氨基酸序列如seq id no:6所示。
19.2.根据项1所述的制备方法,其中,所述抗人干扰素α受体1(ifnar1)单克隆抗体包含重链可变区和轻链可变区,其中,
20.所述重链可变区的氨基酸序列如seq id no:7所示;且,
21.所述轻链可变区的氨基酸序列如seq id no:8所示。
22.3.根据项2所述的制备方法,其中,所述抗人干扰素α受体1(ifnar1)单克隆抗体的重链的氨基酸序列如seq id no:10所示;轻链的氨基酸序列如seq id no:11所示。
23.4.根据项1
‑
3中任一项所述的制备方法,其中,在第一超滤浓缩中,将含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液浓缩至蛋白质浓度为30
‑
50mg/ml。
24.5.根据项1
‑
4中任一项所述的制备方法,其中,在超滤置换中,置换缓冲液的浓度为5
‑
50mm,优选为20mm;优选的,置换缓冲液的ph为6.0
‑
7.0,优选为6.2
‑
6.8。
25.6.根据项5所述的制备方法,其中,所述置换缓冲液为组氨酸
‑
盐酸缓冲液、柠檬酸缓冲液、磷酸盐缓冲液或醋酸钠
‑
醋酸缓冲液,优选为组氨酸
‑
盐酸缓冲液。
26.7.根据项1
‑
6中任一项所述的制备方法,其中,在第二超滤浓缩中,所述碱性氨基酸为盐酸精氨酸、赖氨酸和/或脯氨酸,优选为盐酸精氨酸。
27.8.根据项1
‑
7中任一项所述的制备方法,其中,所述碱性氨基酸母液的浓度为0.5
‑
2.0mol/l,优选为1mol/l~1.5mol/l。
28.9.根据项1
‑
8中任一项所述的制备方法,其中,所述浓缩溶液的粘度≤20cp。
29.10.根据项1
‑
9中任一项所述的制备方法,其中,所述含有抗人干扰素α受体1
(ifnar1)单克隆抗体的溶液通过对表达抗人干扰素α受体1(ifnar1)单克隆抗体的细胞发酵液进行亲和层析、低ph灭活、阴离子层析、阳离子层析和纳滤得到。
30.发明的效果
31.本发明所述的抗人干扰素α受体1(ifnar1)单克隆抗体浓缩溶液的制备方法,能够降低高浓度抗体药液的粘度并提高稳定性,方法简单易行,能够进行放大生产,可以保证样品的高纯度并获得较高的回收率。同时,发明中经过对不同亚型的高浓度抗体进行验证,证明本发明中的添加碱性氨基酸降低粘度的方法具有较强的适用性及良好的稳定性。
32.所述的抗人干扰素α受体1(ifnar1)单克隆抗体,其与现有的抗人干扰素α受体1单克隆抗体(anifrolumab)相比,结合ifnar1的亲和力相当,在细胞水平的中和活性与anifrolumab相当。
33.所述的单克隆抗体在细胞水平显示出与anifrolumab(根据专利公开序列表达制备)相当的中和活性,其有望在预防和治疗相关疾病方面展现出良好的临床效果。
附图说明
34.图1是显示构建hzd1203
‑
45瞬转表达质粒的核酸电泳结果的图。其中,m:marker;条带1:pcr产物362vh
‑
hu6;条带2:phzdch,hindiii/nhei;条带3:pcr产物362vk
‑
hu20;条带4:phzdck,hindiii/bsiwi。
35.图2是瞬转表达流程图。
36.图3是qx006n(hzd1203
‑
45
‑
igg4.1)的电泳检测图。
具体实施方式
37.下面结合附图所描述的实施方式对本发明做以详细说明,其中所有附图中相同的数字表示相同的特征。虽然附图中显示了本发明的具体实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
38.需要说明的是,在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可以理解,技术人员可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名词的差异作为区分组件的方式,而是以组件在功能上的差异作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”或“包括”为开放式用语,故应解释成“包含但不限定于”。说明书后续描述为实施本发明的较佳实施方式,然而所述描述乃以说明书的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
39.本发明提供了一种抗人干扰素α受体1(ifnar1)单克隆抗体浓缩溶液的制备方法,其包括下述步骤:
40.第一超滤浓缩:在流速为120
‑
300l/m2·
h和跨膜压差(tmp)为0.6
‑
1.5bar的条件下将含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液浓缩至蛋白质浓度为20
‑
60mg/ml,得到浓缩样品;
41.超滤置换:采用置换缓冲液置换浓缩样品,当待置换缓冲液的使用量为浓缩样品重量的6
‑
10倍时得到超滤置换溶液;
42.第二超滤浓缩:将超滤置换溶液和碱性氨基酸母液混匀使得氨基酸的浓度为100
‑
150mm,进行超滤浓缩后得到蛋白质浓度为100
‑
200mg/ml的浓缩溶液;
43.所述抗ifnar1单克隆抗体包含三个重链互补决定区(cdr
‑
h1、cdr
‑
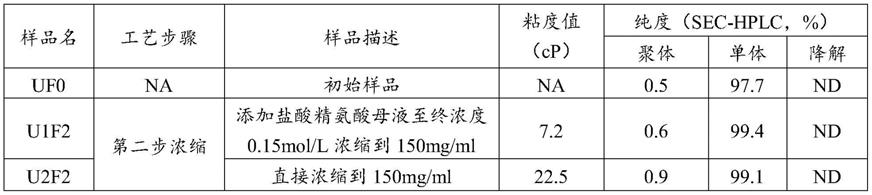
h2和cdr
‑
h3)和三个轻链互补决定区(cdr
‑
l1、cdr
‑
l2和cdr
‑
l3),其中:
44.(a)cdr
‑
h1(在本说明书中cdr
‑
h1表示重链cdr1)的氨基酸序列如seq id no:1所示;
45.(b)cdr
‑
h2(在本说明书中cdr
‑
h2表示重链cdr2)的氨基酸序列如seq id no:2所示;
46.(c)cdr
‑
h3(在本说明书中cdr
‑
h3表示重链cdr3)的氨基酸序列如seq id no:3所示;
47.(d)cdr
‑
l1(在本说明书中cdr
‑
l1表示轻链cdr1)的氨基酸序列如seq id no:4所示;
48.(e)cdr
‑
l2(在本说明书中cdr
‑
l2表示轻链cdr2)的氨基酸序列如seq id no:5所示;且
49.(f)cdr
‑
l3(在本说明书中cdr
‑
l3表示轻链cdr3)的氨基酸序列如seq id no:6所示。
50.其中,seq id no:1的氨基酸序列如下所示:
51.syymt
52.seq id no:2的氨基酸序列如下所示:
53.vinvyggtyyaswakg
54.seq id no:3的氨基酸序列如下所示:
55.edvavymaidl
56.seq id no:4的氨基酸序列如下所示:
57.qasqsisnqls
58.seq id no:5的氨基酸序列如下所示:
59.dasslas
60.seq id no:6的氨基酸序列如下所示:
61.lgiygdgaddgia
62.例如,流速可以为120l/m2·
h、150l/m2·
h、180l/m2·
h、200l/m2·
h、250l/m2·
h、300l/m2·
h等;
63.跨膜压差(tmp)可以为0.6bar、0.7bar、0.8bar、0.9bar、1.0bar、1.1bar、1.2bar、1.3bar、1.4bar、1.5bar等;
64.在第一超滤浓缩中,浓缩样品的蛋白质浓度例如可以为20mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml等;
65.在超滤置换中,当置换缓冲液的使用量为浓缩样品重量的6倍、7倍、8倍、9倍、10倍等时得到超滤置换溶液,所述使用量为体积使用量。
66.在第二超滤浓缩中,将超滤置换溶液和碱性氨基酸母液混匀后使得氨基酸的浓度例如可以为100mm、110mm、120mm、130mm、140mm、150mm等,进行超滤浓缩后得到蛋白质浓度例如可以为100mg/ml、110mg/ml、120mg/ml、130mg/ml、140mg/ml、150mg/ml、160mg/ml、
170mg/ml、180mg/ml、190mg/ml、200mg/ml等的浓缩溶液。
67.所述单克隆抗体表示得自基本上同源的抗体的群体的抗体,即,构成所述群体的各个抗体是相同的和/或结合相同表位,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制品的生产过程中产生)以外,这样的变体通常以微量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品不同,单克隆抗体制品的每种单克隆抗体针对抗原上的单个决定簇。因而,修饰语“单克隆”指示所述抗体得自基本上同源的抗体群体的特征,并且不应解释为需要通过任何特定方法生产所述抗体。例如,要根据本发明使用的单克隆抗体可以通过多种技术来制备,所述技术包括、但不限于杂交瘤方法、重组dna方法、噬菌体展示方法、和使用包含人免疫球蛋白基因座的全部或部分的转基因动物的方法,本文描述了这样的方法和其它示例性的制备单克隆抗体的方法。
68.所述抗人干扰素α受体1(ifnar1)单克隆抗体表示这样的单克隆抗体:其能够以足够的亲和力结合人干扰素α受体1,使得所述单克隆抗体可用作靶向人干扰素α受体1的诊断剂和/或治疗剂。
69.本发明的抗人干扰素α受体1(ifnar1)单克隆抗体与靶标无关的蛋白不结合。这里,“无关的蛋白”是指除作为靶标的人干扰素α受体1以外的其他蛋白;这里,“不结合”是指:在将本发明的抗人干扰素α受体1(ifnar1)单克隆抗体与作为其靶标的人干扰素α受体1的结合能力作为100%的情况下,本发明的抗人干扰素α受体1单克隆抗体与所述无关蛋白的结合能力小于10%,例如9%、8%、7%、6%、5%、4%、3%、2%、1%或者0。
70.本发明所述的抗人干扰素α受体1(ifnar1)单克隆抗体与其他动物种属的干扰素α受体1可以不结合。这里,“其他动物种属”是指除人以外的其他动物种属,例如狨猴、食蟹猴、猪、犬、兔、大鼠、小鼠、豚鼠等;这里,“不结合”是指:在将本发明的抗人干扰素α受体1(ifnar1)单克隆抗体与作为其靶标的人干扰素α受体1的结合能力作为100%的情况下,本发明的抗人干扰素α受体1(ifnar1)单克隆抗体与其他动物种属的干扰素α受体1的结合能力小于10%,例如9%、8%、7%、6%、5%、4%、3%、2%、1%或者0。
71.本发明所述的抗人干扰素α受体1单克隆抗体具有≤1μm、≤100nm、≤50nm、≤40nm的平衡解离常数(kd)。
72.所述抗人干扰素α受体1(human interferon alpha/beta receptor 1,ifnar1)表示一种源自人的膜蛋白,其胞外区氨基酸序列如seq id no:9所示,其中,下划线部分表示信号肽。
73.seq id no:9:
74.mmvvllgattlvlvavapwvlsaaaggknlkspqkvevdiiddnfilrwnrsdesvgnvtfsfdyqktgmdnwiklsgcqnitstkcnfsslklnvyeeiklriraekentsswyevdsftpfrkaqigppevhleaedkaivihispgtkdsvmwaldglsftyslviwknssgveerieniysrhkiyklspettyclkvkaalltswkigvyspvhcikttvenelpppenievsvqnqnyvlkwdytyanmtfqvqwlhaflkrnpgnhlykwkqipdcenvkttqcvfpqnvfqkgiyllrvqasdgnntsfwseeikfdteiqafllppvfnirslsdsfhiyigapkqsgntpviqdypliyeiifwentsnaerkiiekktdvtvpnlkpltvycvkarahtmdeklnkssvfsdavcektkpgntsk
75.在一个实施方案中,所述抗人干扰素α受体1(ifnar1)单克隆抗体包含重链可变区和轻链可变区,其中,
76.所述重链可变区的氨基酸序列如seq id no:7所示;且,
77.所述轻链可变区的氨基酸序列如seq id no:8所示。
78.其中,seq id no:7的氨基酸序列如下所示:
79.evqlvesggglvqpggslrlscaasgfslssyymtwvrqapgkglewvsvinvyggtyyaswakgrftisrdnskntlylqmnslraedtavyycaredvavymaidlwgqgtlvtvss
80.seq id no:8的氨基酸序列如下所示:
81.aiqmtqspsslsasvgdrvtitcqasqsisnqlswyqqkpgkapklliydasslasgvpsrfsgsrsgtkftltisslqpedfatyyclgiygdgaddgiafgggtkveik
82.在一个实施方案中,所述抗人干扰素α受体1(ifnar1)单克隆抗体的重链的氨基酸序列如seq id no:10所示;轻链的氨基酸序列如seq id no:11所示。
83.其中,seq id no:10的氨基酸序列如下所示:
84.evqlvesggglvqpggslrlscaasgfslssyymtwvrqapgkglewvsvinvyggtyyaswakgrftisrdnskntlylqmnslraedtavyycaredvavymaidlwgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
85.seq id no:11的氨基酸序列如下所示:
86.aiqmtqspsslsasvgdrvtitcqasqsisnqlswyqqkpgkapklliydasslasgvpsrfsgsrsgtkftltisslqpedfatyyclgiygdgaddgiafgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
87.其中,seq id no:10和11均为经人源化的序列。
88.在一个实施方案中,在第一超滤浓缩中,将含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液浓缩至蛋白质浓度为30
‑
50mg/ml。
89.在一个实施方案中,在超滤置换中,对于置换缓冲液的浓度,本发明不作任何限制,本领域技术人员可以根据需要进行选择,例如置换缓冲液的浓度为5
‑
50mm,优选为20mm。
90.对于置换缓冲液的ph,本发明不作任何限制,其只要为偏酸性即可,例如,置换缓冲液的ph为6.0
‑
7.0,优选为6.2
‑
6.8。
91.例如,置换缓冲液的浓度可以为5mm、10mm、20mm、30mm、40mm、50mm等;置换溶液的ph可以为6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0等。
92.在一个实施方案中,所述置换缓冲液为组氨酸
‑
盐酸缓冲液、柠檬酸缓冲液、磷酸盐缓冲液或醋酸钠
‑
醋酸缓冲液,优选为组氨酸
‑
盐酸缓冲液。
93.所述柠檬酸缓冲液例如为柠檬酸
‑
柠檬酸钠缓冲液。
94.所述磷酸盐缓冲液例如为磷酸氢二钠
‑
磷酸二氢钠缓冲液。
95.优选的,使用蠕动泵将置换的缓冲液泵入浓缩样品中,继续超滤,同时调节置换缓冲液的泵入速度与透过流速一致,当置换缓冲液的泵入量为浓缩样品重量的6
‑
10倍时即完成置换。
96.在一个实施方案中,在第二超滤浓缩中,所述碱性氨基酸为盐酸精氨酸、赖氨酸和/或脯氨酸,优选为盐酸精氨酸。
97.对于碱性氨基酸母液的浓度,本发明不作任何限制,本领域技术人员可以根据需要进行选择,例如在一个实施方案中,所述碱性氨基酸母液的浓度为0.5
‑
2.0mol/l,优选为1
‑
1.5mol/l。
98.例如,所述碱性氨基酸母液的浓度可以为0.5mol/l、1.0mol/l、1.5mol/l、2.0mol/l等。
99.在一个实施方案中,所述浓缩溶液的粘度≤20cp。
100.例如,所述浓缩溶液的粘度例如可以为20cp、18cp、15cp、12cp、10cp、8cp、5cp、3cp、1cp等。
101.优选的,在第二超滤浓缩中,计算超滤置换溶液中的蛋白质浓度,并计算该超滤浓缩溶液的理论体积,并加入碱性氨基酸母液混匀,优选的,碱性氨基酸母液的体积是超滤浓缩溶液理论体积的1/9,使得氨基酸的浓度为100
‑
150mm,进行超滤浓缩后得到蛋白质浓度为100
‑
200mg/ml的浓缩溶液,所述浓缩溶液的粘度≤20cp。
102.在一个实施方案中,所述含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液通过对表达抗人干扰素α受体1(ifnar1)单克隆抗体的细胞发酵液进行亲和层析、低ph灭活、阴离子层析、阳离子层析和纳滤得到。
103.所述细胞发酵液生产使用的哺乳动物包括但不限于目前使用的各种杂交瘤细胞、中国仓鼠卵巢细胞(cho),优选的是cho细胞。
104.所述亲和层析采用protein a进行亲和层析。
105.在一个实施方案中,在第一超滤浓缩和超滤置换时,使用的超滤膜包的材质包括但不限于改良聚醚砜(pes)、聚偏氟乙烯(pvdf)、醋酸纤维素(ca)等,其孔径通常采用30kda或50kda,优选的,超滤膜包为默克密理博的pellicon2/pellicon3(a型筛网,30kda),以及赛多利斯和颇尔公司的超滤膜包。
106.在一个实施方案中,所述抗人干扰素α受体1(ifnar1)单克隆抗体为igg4型抗体,阻断包括ifnα、ifnβ和ifn
‑
ω在内的所有i型干扰素的活性,拟用于系统性红斑狼疮(sle)的治疗,拟采用静脉或皮下注射方式给药。该剂型注射液的蛋白浓度高达150mg/ml。
107.本发明使用上述所述的方法来制备抗人干扰素α受体1(ifnar1)单克隆抗体浓缩溶液,能够降低粘度,避免堵塞现象,同时抑制蛋白聚集沉淀,起到保护剂作用。
108.并且所述的方法简单易行,能够进行放大生产,可以保证样品的高纯度并获得较高的回收率。
109.实施例
110.本发明对试验中所用到的材料以及试验方法进行一般性和/或具体的描述,在下面的实施例中,如果无其他特别的说明,%表示wt%,即重量百分数。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
111.实施例1抗人干扰素α受体1单克隆抗体qx006n的制备
112.从上海近岸科技有限公司采购人干扰素α受体1(ifnar1),用于免疫新西兰兔,运用b细胞克隆技术获得抗原结合特异性抗体克隆,进而筛选出结合人ifnar1并具有人ifnar1抑制活性的单克隆抗体。首先,用binding elisa检测细胞上清,挑选出与人ifnar1结合的克隆;再用hek blue ifnα/β报告基因细胞法进行检测,挑选出具有人ifnar1抑制活性的克隆。以上免疫和筛选过程委托给商业化公司完成。
113.先后挑选出37个克隆进行重组表达,并测序。经测定,362#与1203#的细胞中和活性最好,且两个克隆的序列很相似。因此,先对362#进行人源化改造,当筛选获得1203#、且发现1203#的活性更好时,在362#人源化的基础上对1203#克隆进行人源化改造。利用ncbi igblast进行人igg胚系序列(germline)同源性比对,选择ighv3
‑
66*01作为重链cdr移植模板,将1203#克隆重链的cdr区(即cdr
‑
h1(seq id no:1)、cdr
‑
h2(seq id no:2)和cdr
‑
h3(seq id no:3))移植入ighv3
‑
66*01的骨架区;选择igkv1
‑
6*01作为轻链cdr移植模板,将1203#克隆轻链的cdr区(即cdr
‑
l1(seq id no:4)、cdr
‑
l2(seq id no:5)和cdr
‑
l3(seq id no:6))移植入igkv1
‑
6*01的骨架区;对骨架区特定位点进行回复突变,获得本发明的单克隆抗体qx006n可变区。最终,人源化后的重链可变区序列如seq id no:7所示;人源化后的轻链可变区氨基酸序列如seq id no:8所示。
114.上述重链可变区(seq id no:7)的基因和轻链可变区(seq id no:8)的基因,以362#人源化抗体的基因序列为模板,利用pcr扩增获得。用hindiii和nhei双酶切重链表达质粒phzdch;用hindiii和bsiwi双酶切轻链表达质粒phzdck;用infusion重组酶将pcr扩增基因分别插入对应的表达质粒中,构建重链表达质粒phzdch
‑
362vh
‑
hu6和轻链表达质粒phzdck
‑
362vk
‑
hu20。在人源化改造过程中,1203#人源化抗体的基因用362编号,蛋白用1203编号。
115.通过核酸电泳检测质粒的双酶切结果如图1所示。根据图1的结果可以看出,抗体重链可变区和轻链可变区pcr扩增结果以及双酶切重链和轻链表达质粒的结果,其中,重链和轻链的质粒大小约10000bp,轻链可变区约447bp,重链可变区约471bp。
116.通过对1203#进行人源化改造,获得人源化抗体hzd1203
‑
45。为了降低抗体的adcc效应,将hzd1203
‑
45重链表达质粒phzdch
‑
362vh
‑
hu6的人igg1恒定区换成人igg4,获得重链表达质粒phzdch
‑
362vh
‑
hu6
‑
igg4.1。
117.将序列正确的重链表达质粒phzdch
‑
362vh
‑
hu6
‑
igg4.1和轻链表达质粒phzdck
‑
362vk
‑
hu20共转染expicho
‑
s细胞。转染前一天,将expicho
‑
s细胞稀释成3
×
106个细胞/ml进行转染前传代。转染当天,将细胞密度稀释成6
×
106个细胞/ml,125ml摇瓶装25ml细胞,等待转染。转染和表达过程如图2所示。
118.转染后第4
‑
8天,收获培养上清,用proteina进行一步纯化。用sds
‑
page电泳检测纯化的抗体,将其命名为qx006n(hzd1203
‑
45
‑
igg4.1),利用蛋白电泳检测该抗体的结果如图3所示。蛋白电泳用变性还原胶检测,图3的结果显示出有两条带,两个条带的大小分别约50kda和25kda,与重链(48.9kda)和轻链(23.4kda)理论分子量一致。
119.实施例2平衡解离常数(k
d
)的测定
120.用biacoret200检测qx006n(hzd1203
‑
45
‑
igg4.1)与人ifnar1的亲和力,所有过程都在25℃进行。采用商品化protein a芯片,通过捕获法固定适量的抗体,使得rmax在50ru左右,捕获流速是10μl/min。将抗原进行梯度稀释,仪器流速切换成30μl/min,按照浓度从低到高的顺序依次流过参比通道和固定抗体的通道,流过缓冲液作为阴性对照。每一个结合、解离完成后用ph1.5甘氨酸再生芯片。用仪器自带分析软件选择kinetics选项中1:1结合模型进行拟合,计算抗体的结合速率常数k
a
,解离速率常数k
d
以及解离平衡常数k
d
值。
121.除此之外,将qx006n(hzd1203
‑
45
‑
igg4.1)与已进入临床iii期的针对人ifnar1的单克隆抗体,即anifrolumab的亲和力进行比较,针对已知抗体的检测方法与对qx006n进行
检测的方法相同,结果如表1所示。其中anifrolumab根据专利wo2009100309a2提供的9d4序列,构建表达质粒,瞬转expicho
‑
s细胞自制获得。
122.表1抗体结合人ifnar1的亲和力
123.样品名称k
a
(105m
‑1s
‑1)k
d
(10
‑5s
‑1)k
d
(10
‑
10
m)hzd1203
‑
45
‑
igg4.13.473.761.08anifrolumab18.6712.400.67
124.表中的数据为:每个样品检测三次,计算平均值的数据。
125.实施例3qx006n和anifrolumab中和人干扰素诱导的hek blue ifnα/β细胞stat1/2磷酸化活性
126.利用hek blue ifnα/β报告基因细胞系测定qx006n拮抗干扰素通过ifnar1介导的胞内信号分子stat1/2磷酸化活性:将培养液中的细胞以每孔4
×
104细胞加入到96孔内,然后在37℃和5%co2条件下培养过夜。向细胞中加入抗体浓度范围为0至5μg/ml的系列稀释液,并加入0.2ng/ml的ifnα.2b。然后在37℃和5%co2条件下培养24小时,收集细胞培养上清加入10%的quanti
‑
blue
tm
检测试剂在37℃和5%co2条件下反应1小时,然后检测od630nm值及绘制剂量效应曲线,进而分析抗体的拮抗活性,实验结果表明,qx006n能够抑制干扰素诱导hek blue ifnα/β细胞中stat1/2磷酸化,其抑制干扰素诱导的hek blue ifnα/β细胞中1/2磷酸化活性的ic
50
为5.23ng/ml,而anifrolumab抑制干扰素诱导的hek blue ifnα/β细胞中1/2磷酸化活性的ic
50
为4.43ng/ml。
127.实施例4qx006n和anifrolumab中和人干扰素抑制daudi细胞增殖的活性
128.利用daudi人淋巴瘤细胞系测定qx006n拮抗干扰素通过ifnar1诱导的细胞增殖活性:将培养液中的细胞以每孔4
×
104细胞加入到96孔内,然后在37℃和5%co2条件下培养过夜。向细胞中加入抗体浓度范围为0至20μg/ml的系列稀释液,并加入0.8ng/ml的ifnα.2b。然后在37℃和5%co2条件下培养72小时,收集细胞培养物采用celltiter
‑
glo检测细胞增殖情况及绘制剂量效应曲线,进而分析抗体的拮抗活性,实验结果表明,qx006n能够抑制干扰素诱导的daudi细胞增殖,其抑制干扰素诱导的daudi细胞增殖活性的ec
50
为29.9ng/ml,而anifrolumab抑制干扰素诱导的daudi细胞增殖活性的ec
50
为31.7ng/ml。
129.实施例5qx006n和anifrolumab中和人干扰素诱导全血释放cxcl10/ip10活性.
130.利用人全血测定qx006n拮抗干扰素通过ifnar1诱导的cxcl10/ip10释放活性:将全血按照100μl/孔加入到96孔板中,暂存于37℃和5%co2条件下,向全血中加入抗体浓度范围为0至40μg/ml的系列稀释液,并加入8ng/ml的ifnα.2b,40ng/ml的tnf
‑
α。然后在37℃和5%co2条件下培养48小时,收集细胞培养上清采用夹心elisa法检测上清中cxcl10/ip10的表达及绘制剂量效应曲线,进而分析抗体的拮抗活性,实验结果表明,qx006n能够抑制干扰素诱导的全血释放cxcl10/ip10,其抑制干扰素诱导的全血释放cxcl10/ip10活性的ic
50
为698ng/ml,而anifrolumab抑制干扰素诱导的全血释放cxcl10/ip10活性的ic
50
为562ng/ml。
131.实施例6抗人ifnar1单克隆抗体高浓度超滤浓缩后粘度的比较
132.使用cho细胞作为宿主细胞,在2l规模的生物反应器上进行发酵,生产实施例1所得到的抗体qx006n。通过离心机或深层膜包过滤获得澄清发酵液,采用protein a层析进行目的蛋白的捕获,再经过低ph值病毒灭活、阴离子和阳离子层析去除杂质,并进行纳滤得到
含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液,将该溶液采用下述方法进行浓缩:
133.(1)第一超滤浓缩:超滤设备选用默克密理博的labscale小型超滤仪(夹持两块50cm
2 pellicon xl膜包,截留量30kd)。以120
‑
300l/m2·
h的流速,tmp维持在0.6~1.5bar条件下将含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液浓缩至蛋白质浓度约为30~50mg/ml,得到浓缩样品。
134.(2)超滤置换:置换溶液为20mm的组氨酸
‑
盐酸缓冲液,ph值为6.5,使用蠕动泵将组氨酸
‑
盐酸缓冲液泵入至所述浓缩样品中,继续超滤,同时调节组氨酸
‑
盐酸缓冲液的泵入速度与透过流速一致,即保持样品的重量恒定,待组氨酸
‑
盐酸缓冲液的体积为浓缩样品重量的7倍时上即完成置换得到超滤置换溶液。
135.(3)第二超滤浓缩:取样测定超滤置换溶液中蛋白质的浓度,并计算此时超滤置换溶液的理论体积,并加入1/9理论体积的碱性氨基酸母液,混匀,使得缓冲体系如表1所示,然后使用默克密理博的30kda的超滤离心管浓缩至蛋白质浓度为表1的浓度得到浓缩溶液,分别测定浓缩溶液的粘度值,粘度值测定方法如下:
136.1.取一次性专用注射器,抽取200~400微升浓缩溶液,排尽注射器内气泡,并用无尘纸轻擦残留液体;
137.2.将注射器安放至管槽中固定,点击仪器主机界面,设置剪切速率,设置完成后,点击“run”进行检测,记录粘度值,一般多次测量取平均值;
138.3.对于多个样品的检测,前一个样品完成检测后,取出注射器,排空管内液体,无尘纸轻柔擦拭管口后及可进行下一个样品的吸取测量。
139.其粘度值结果如表2所示。
140.表2粘度值结果
141.编号缓冲体系蛋白浓度mg/ml粘度值cpa
‑
120mm his
‑
hcl20042.1a
‑
220mm his
‑
hcl18029.3a
‑
320mm his
‑
hcl15022.5a
‑
420mm his
‑
hcl12014.4a
‑
520mm his
‑
hcl 70mg/ml蔗糖15025.2a
‑
620mm his
‑
hcl 45mg/ml山梨醇15025.6a
‑
720mm his
‑
hcl 150mm nacl1507.1a
‑
820mm his
‑
hcl 150mm盐酸精氨酸1507.2a
‑
920mm his
‑
hcl 150mm赖氨酸1507.3a
‑
1020mm his
‑
hcl 150mm脯氨酸1507.2a
‑
1120mm his
‑
hcl 50mg/ml蔗糖 50mm盐酸精氨酸15011.5
142.由表2结果可知,随着蛋白质浓度的提高,该抗人ifnar1抗体的粘度值呈指数级增加,若无添加剂加入,该单抗在浓度为200mg/ml时粘度值会达到42.1cp,如此高的粘度值无法使用常规的超滤膜实现浓缩工艺。以150mg/ml蛋白浓度为例,通过添加150mm的碱性氨基酸或其组合可以将相同蛋白浓度条件下的抗体粘度值降至原来的50%以下,小于20cp。基于上述实验结果,可以实现该抗人ifnar1单抗的给药浓度为100
‑
150mg/ml。
143.实施例7不同方法的比较
144.含有抗人干扰素α受体1(ifnar1)单克隆抗体qx006n的溶液(uf0)的制备、第一超滤浓缩和超滤置换的方法均与实施例6相同;
145.第二超滤浓缩:将超滤置换溶液分成两份分别进行第二步浓缩工艺:
146.a.从第一份中取样测定超滤置换溶液中蛋白质的浓度,并计算此时超滤置换溶液的理论体积,并加入1/9理论体积的盐酸精氨酸母液(1.5mol/l)混匀,然后使用默克密理博的30kda的超滤离心管浓缩至蛋白质浓度为150mg/ml,记为浓缩溶液1(u1f2);
147.b.将第二份直接采用第一超滤浓缩的方法进行浓缩,蛋白质浓度为150mg/ml,记为浓缩溶液2(u2f2);
148.分别检测浓缩溶液1(u1f2)和2(u2f2)的粘度和纯度,其中粘度的测定方法与实施例6的方法相同,纯度的测定方法如下:
149.1.采用高效液相色谱仪(agilent 1260或等效仪器)、色谱柱(waters,beh规格:3.5μm,7.8
×
300mm;或等效色谱柱),流动相为pbs缓冲液;
150.2.拧开四元泵管路,在5ml/min流速条件下100%流动相冲洗管路3分钟,拧紧四元泵开关,接上色谱柱,在1.0ml/min流速条件下100%流动相冲洗色谱柱30min;
151.3.样品分析方法设置:流速为1.0ml/min,分析时间为15min,进样量为50mg;检测波长为280nm;进样前需先检查系统适应性(使用参考品连续进样,进样次数不少于5次,取后5次结果计算),然后分析1针空白样品,接着分析样品。
152.4.按照聚合体、主峰及降解产物等顺序依次积分每个样品的色谱峰,所有与空白样品保留时间不一致的色谱峰均应积分,以面积归一法计算各峰比例。
153.测定结果如表3所示。
154.表3不同方法处理的粘度和纯度结果
[0155][0156]
由表3结果可知,超滤工艺的第二步浓缩在添加盐酸精氨酸后粘度值由原来的22.5cp下降至7.2cp,同时盐酸精氨酸也作为保护剂一定程度上抑制聚体形成。高浓度的抗人ifnar1单抗加入盐酸精氨酸后其粘度值明显降低,不会引起过高的反压,有利于超滤工艺的流速和膜压力的控制,提高了工艺的可操作性。
[0157]
实施例8放大实验
[0158]
基于上述实验结果,将实施例6进一步放大至200l中试规模,采用默克密理博pellicon手动超滤系统,夹持两块0.5m2 pellicon 2型膜包。纳滤后的含有抗人干扰素α受体1(ifnar1)单克隆抗体的溶液(uf0)以流速120
‑
300l/m2·
h,tmp控制在0.6
‑
1.5bar,按照实施例6的方法先进行第一超滤浓缩(uf1),将样品浓缩至30~50mg/ml;然后按照实施例6的超滤置换方法进行置换,置换结束后,加入盐酸精氨酸母液,浓缩至蛋白质浓度为150mg/ml,进一步浓缩得到蛋白质浓度为193mg/ml(uf2),回收样品,其粘度和纯度结果如表4所示。
[0159]
表4:抗人ifnar1单抗超滤工艺中试放大确认结果汇总
[0160][0161]
由表4结果可知,超滤工艺放大后,超滤的过程中流速和膜压力的控制参数和收率基本与小试规模一致,顺利实现放大。添加的盐酸精氨酸抑制聚体,超滤后样品的纯度与超滤前基本一致,且在190~200mg/ml范围时粘度值控制在20cp以下,若无精氨酸添加剂则无法通过上述的超滤系统浓缩至如此高浓度。
[0162]
综上所述,本发明所述的方法能够制备出高浓度、低粘度的抗人干扰素α受体1(ifnar1)单克隆抗体的浓缩溶液,蛋白质浓度为100
‑
200mg/ml时,粘度控制在20cp以下,所得到的浓缩溶液可以用于制备抗人干扰素α受体1(ifnar1)单克隆抗体皮下注射剂。
[0163]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

