1.本发明涉及功能微生物技术领域,具体涉及一种凝结芽孢杆菌制剂及其制备方法。
背景技术:
2.根据国际益生菌和益生元科学协会isapp(international scientific association probiotic and prebiotic)的定义,益生菌是指活的微生物,当施以足够的数量时能够对宿主健康带来有益影响。目前人用益生菌种主要有乳杆菌、双歧杆菌、肠球菌、如球菌、芽孢杆菌、大肠杆菌、嗜热链球菌和酵母菌。应用最多的主要是双歧杆菌和乳杆菌两个属。同时,fho/who规定益生菌发挥作用的最低活菌数不少于106cfu/ml,但目前益生菌制剂存在的最为关键问题是加工运输储存过程中活菌数下降较快。
3.影响益生菌制剂活力的因素主要有加工、运输、存储过程中的温度、湿度、压力、酸碱度和产品剂型等。其次菌株本身所具备的耐胃酸耐胆碱等抗逆性能也会影响活菌数。为了保证益生菌制剂产品一定的活菌数,有效防止加工或存储过程中活菌数的衰减,需要采取一定的方法来提高产品的活菌数,延长期保存期。而包被喷干技术正是解这一难题的有效方法之一。
4.现阶段,芽孢杆菌包被喷干的制备方法中包被材料通常采用β-环糊精、羧甲基纤维素、阿拉伯胶等原料,生产成本高不适合产业化应用。有的芽孢杆菌包被喷干采用离子交换二次包被方法,一定程度上提高了芽孢杆菌芽孢菌粉产品的稳定性,但缺点是包被工艺复杂,而且会影响使用过程中孢子萌发,延缓了益生功能的发挥,降低了益生菌制剂的实际利用率。因此,目前急需开发一种简单、高效的益生菌制剂生产工艺。
技术实现要素:
5.为了解决现有技术问题,本发明提供了一种凝结芽孢杆菌制剂及其制备方法。所述凝结芽孢杆菌制剂不仅活菌量高,而且对人工胃酸和肠液的耐受性好,耐热性也很强,可广泛应用于食品、保健品等领域。
6.本发明一方面涉及一种凝结芽孢杆菌制剂,所述制剂是通过将凝结芽孢杆菌与包被材料的混合液进行喷雾干燥制备得到的。
7.所述凝结芽孢杆菌为凝结芽孢杆菌vhprobi c08(bacillus coagulans vhprobi c08),已于2019年9月23日保藏于中国武汉武汉大学的中国典型培养物保藏中心,其保藏号为cctcc no:m2019738。
8.所述包被材料由大豆蛋白、脱脂奶粉、玉米淀粉、蔗糖、阿拉伯胶、低聚果糖和乳酸钙组成。
9.所述包被材料中各组分及其重量比分别为1~5:4~6:1~4:1~3:0.1~1:1~2:5~10。
10.本发明一方面涉及上述凝结芽孢杆菌制剂的制备方法,包括:
11.(1)制备凝结芽孢杆菌发酵液
12.在无菌条件下,将凝结芽孢杆菌种子液以3-5%的体积比接种于发酵培养基中,40-50℃培养23~36h,转速为180~200rpm,通风量为1:1.2~1.5,罐压为0.05~0.08mpa;发酵完成后,升温至50~60℃,维持20min,即得到凝结芽孢杆菌发酵液;
13.(2)制备喷雾混合液
14.将凝结芽孢杆菌发酵液在4℃,5000r/min条件下离心10min,收集菌体后用无菌生理盐水洗涤2次,重悬菌体制成菌悬液;
15.按比例分别称取大豆蛋白、脱脂奶粉、玉米淀粉、蔗糖、阿拉伯胶、低聚果糖和乳酸钙七种包被材料,加水搅拌混匀,并与上述菌悬液充分混匀,得喷雾混合液;所述喷雾混合液中包被材料的组分及其重量体积比(g/ml)分别为:大豆蛋白2.5%~12.5%、脱脂奶粉10%~15%、玉米淀粉2.5%~10%、蔗糖2.5%~7.5%、阿拉伯胶0.25%~2.5%、低聚果糖2.5%~5%、乳酸钙12.5%~25%;所述喷雾混合液中凝结芽孢杆菌的终浓度为10
9-10
10
cfu/ml;
16.(3)喷雾干燥处理
17.采用离心式喷雾干燥器进行喷雾干燥处理,干燥塔进风温度为130~150℃,雾化压力为0.2~0.5mpa,输送混合液的蠕动泵转速为10~25r/min,出风温度为70~80℃,干燥的颗粒随塔内的热风进入旋风分离器,粒径为50~90μm,即为本发明所述凝结芽孢杆菌制剂。
18.步骤(1)中所述的发酵培养基中各组分及其含量分别为:玉米淀粉10~40g/l、葡萄糖0.5~3g/l、豆粕5~25g/l、碳酸钙0.1~1.5g/l、氯化铵0.1~1.0g/l、磷酸氢二钾0.1~1.0g/l、硫酸镁0.01~0.7g/l和硫酸锰0.01~0.7g/l。
19.进一步优选的,步骤(2)中所述的喷雾混合液中包被材料的组分及其重量体积比(g/ml)分别为:大豆蛋白2.5%、脱脂奶粉10%、玉米淀粉2.5%、蔗糖2.5%、阿拉伯胶0.25%、低聚果糖2.5%、乳酸钙20%。
20.进一步优选的,步骤(3)中所述的干燥塔进风温度为130℃,雾化压力为0.3mpa,输送混合液的蠕动泵转速为13r/min,出风温度为70℃。
21.所述凝结芽孢杆菌制剂中活菌数不低于10
10
cfu/g。
22.本发明还涉及所述凝结芽孢杆菌制剂在食品和保健品中的应用。
23.本发明提供的凝结芽孢杆菌vhprobi c08不产生溶血素,不会溶解血细胞,对常见抗生素敏感,生物安全性良好;能够耐受较高的盐度,最大耐受盐浓度为7%;能在较广阔的温度范围内生长,并且能产生耐热性很强的孢子,方便该益生菌株后期工业化加工;体外细胞表面疏水性为8.58%,对肠道细胞具有一定的粘附性。
24.凝结芽孢杆菌vhprobi c08具备较强的抗氧化功能,其中对dpph自由基清除率为87.80%,hrs自由基清除率为47.79%;上清液抗脂质过氧化抑制率为84.46%,菌体抗脂质过氧化抑制率为44.88%。
25.凝结芽孢杆菌vhprobi c08具备较强的降解胆固醇能力,其中体外胆固醇降解率达到39.21%;在高血脂小鼠模型中,用本发明提供的凝结芽孢杆菌vhprobi c08喂食模型鼠30天后预处理组血液胆固醇水平降低了约34%,后处理组血液胆固醇水平降低了约10%;40天后,凝结芽孢杆菌vhprobi c08预处理组血液胆固醇水平降低了约39%,后处理
组血液胆固醇水平降低了约30%,效果非常显著。
26.凝结芽孢杆菌vhprobi c08能有效预防和缓解腹泻,抑制肠蠕动。给大鼠连续服用凝结芽孢杆菌vhprobi c08 7天后,能有效延迟腹泻时间,减少粪便量。凝结芽孢杆菌vhprobi c08代谢产生的有机酸等代谢产物能够抑制有害菌的生长,促进肠道对营养物质的消化和吸收,恢复肠道的微生物屏障功能,刺激机体免疫功能,缩短疾病病程。
27.本发明提供的凝结芽孢杆菌制剂单位活菌量高,其中的凝结芽孢杆菌vhprobi c08存活率高达98.2%,效果显著。所述凝结芽孢杆菌制剂具有很强的耐胃酸耐胆碱能力,经过人工胃液和人工肠液消化后,活菌量不仅没有下降反而还有一定的上升;还具有良好的热稳定性,在85℃条件下加热2h后,凝结芽孢杆菌vhprobi c08的存活率高达78.3%,在95℃条件下加热2h后,存活率仍高于50%,取得了意料不到的技术效果。
28.此外,通过大鼠腹泻造模试验和胃肠道蠕动造模试验结果可知,本发明提供的凝结芽孢杆菌制剂能有减缓肠道蠕动过快、缓解腹泻的效果,具备预防腹泻的良好功能。
29.本发明提供的凝结芽孢杆菌制剂的制备工艺过程简单,包被材料便宜,产业化成本低,能有效提高了凝结芽孢杆菌vhprobi c08在存储加工运输过程中的稳定性,有力提高了凝结芽孢杆菌vhprobi c08的实际使用效果,可广泛应用于食品、保健品等领域。
附图说明
30.图1为riboprinter指纹图谱;
31.图2为rapd指纹图谱;
32.图3为rep-pcr指纹图谱;
33.图4为12h大鼠饮水量比较;
34.图5为连续4、8、12h观察大鼠粪便量比较。
具体实施方式
35.实施例只是对本发明的说明,并不是对本发明保护范围的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
36.本发明用于制备包被材料的大豆蛋白、脱脂奶粉、玉米淀粉、蔗糖、阿拉伯胶、低聚果糖、乳酸钙均可采购自市售的任意一种,例如大豆蛋白选用西王食品有限公司;脱脂奶粉选用伊利乳业有限公司;玉面淀粉选用龙大食品有限公司;蔗糖选用国药集团化学试剂有限公司;阿拉伯胶选用国药集团化学试剂有限公司;低聚果糖选用国药集团化学试剂有限公司;乳酸钙选用国药集团化学试剂有限公司。
37.下面结合具体实施例对本发明做进一步的说明。
38.实施例1菌株的分离与筛选
39.1、芽孢杆菌初筛
40.取1g发酵的酸白菜,捣碎机捣碎,然后用10ml的0.85%的生理盐浸泡10分钟,放入无菌样品袋中用均质机拍打混匀,倒入试管内,水浴锅70℃加热10分钟,悬浊液进行梯度稀释,分别取10-1
、10-2
、10-3
三个稀释梯度100ul涂布于mrs培养基上,好氧条件下37℃培养箱中培养48h,待平板长出单菌落后,分别进行镜检。根据镜检结果,申请人共筛选出10株芽孢
杆菌,分别命名为nh-1,nh-2,
……
,nh-10。
41.2、芽孢杆菌复筛
42.液体发酵培养基:称取酵母粉3.0g、蛋白胨5.0、牛肉膏2.0g、k2hpo
4 3g、mnso
4 0.005g、mgso
4 0.02g和nacl 2g,混匀,加入1000ml蒸馏水溶解,121℃20分钟高压灭菌。
43.菌量计数培养基:酵母粉5.0g、蛋白胨5.0g、葡萄糖5.0g、k2hpo
4 0.5g kh2po
4 0.5g、mgso
4 0.3g、微量元素溶液1.0ml、琼脂粉15.0g,加入1000ml蒸馏水溶解,115℃ 30分钟高压灭菌。其中微量元素浓缩溶液配方(1l):氯化钠10g,七水硫酸铁18g,一水硫酸锰16g,七水硫酸锌1.6g,五水硫酸铜1.6g,七水硫酸钴1.6g。
44.(1)成孢率筛选
45.将筛选得到的10株芽孢杆菌按6%接种量分别接种于上述液体发酵培养基中,40℃好氧条件下置于摇床中培养,210rpm/min培养48h。取发酵液进行菌量计数n1,同时把发酵液放到70℃,10分钟灭活菌体,再次进行计数n2,计算各株芽孢杆菌的成孢率。
46.成孢率=n2/n1*100%。
47.结果显示:本发明筛选得到的芽孢杆菌nh-1,nh-2,
……
,nh-10的成孢率分别是58%,70%,60%,60%,62%,67%,70%,90%,83%和78%,其中nh-8菌株的成孢率最高,达90%。
48.(2)95℃条件下存活率筛选
49.将芽孢杆菌nh-1,nh-2,
……
,nh-10按6%接种量分别接种于上述液体发酵培养基中,40℃好氧条件下置于摇床中培养,210rpm/min培养48h后,将发酵液放到70℃,10分钟灭活菌体,计算孢子浓度;利用液体发酵培养基稀释发酵液,使10株芽孢杆菌的孢子量保持一致,孢子菌量的对数值为9.0logcfu/ml;将稀释后的发酵液在95℃条件下处理20分钟后,分别测定菌量,菌量的对数值分别为5.38,5.92,6.37,6.23,5.84,5.95,6.53,6.86,5.92,5.83logcfu/ml,其中nh-8菌株的孢子存活量最多,其对数值达6.86logcfu/ml。从而说明,本发明筛选到的10株芽孢杆菌中nh-8菌株的耐热性最强,效果显著。
50.综上所述,本发明筛选到的10株芽孢杆菌中nh-8菌株的成孢率最高,且耐热性最强,有利于该芽孢杆菌的广泛应用。
51.实施例2菌株鉴定
52.2.1菌落形态鉴定
53.nh-8菌株的单菌落呈乳白色,有光泽,菌落表面平整湿润,边缘整齐,菌落直径在2-3mm。显微镜下呈杆状,单个、成对或链状排列,芽孢端生。
54.2.2生理生化特性鉴定
55.本实施例中接种液的准备如下:在无菌条件下,取适量新鲜菌液,5000rpm离心5min,用pbs缓冲液洗2次,再用同体积pbs缓冲液重悬后稀释50倍,作为接种液。
56.1、温度生长范围实验
57.在无菌条件下,将接种液按10%的接种量接种到10ml mrs液体培养基中,不接菌的10ml mrs液体培养基作为对照,分别置于15℃恒温振荡培养箱培养7天,51℃和61℃恒温振荡培养箱培养2天,观察培养液是否变浑浊。
58.结果显示:15℃恒温培养7天后,培养基仍澄清;57℃恒温培养2天后,培养基变浑浊,61℃恒温培养2天后,培养基仍澄清。从而说明,nh-8菌株在15℃和61℃条件下不能生
长,在57℃条件下能正常生长。
59.2、过氧化氢酶测定实验
60.取新鲜菌液,滴于载玻片上,然后再滴加3%~15%过氧化氢。
61.结果显示:nh-8菌株不产生气泡,过氧化氢酶反应为阴性。
62.3、碳源代谢实验
63.本实施例中所用的含酚红的基础培养基配方如下:
64.蛋白胨1.5g;酵母提取物0.6g;吐温80 0.1g;盐溶液0.5ml;酚红18mg;蒸馏水100ml;ph7.4
±
0.2。盐溶液成分:mgso4·
7h2o 11.5g,mnso4·
4h2o
2 8g,蒸馏水100ml。
65.配制10g/ml的糖、醇和苷类碳水化合物溶液,并用0.22μm的无菌过滤器进行过滤。在无菌条件下,向96孔板中加入20μl除菌后的碳水化合物溶液,每种碳水化合物4个平行,然后加入170μl灭菌后含酚红的基础培养基,再加入10ul接种液,不接菌孔作为对照。每孔加入50μl液体石蜡以防止培养过程中水分蒸发。37℃培养,以酚红为指示剂,观察培养基颜色变化,结果见表1。
66.表1 nh-8菌株碳源代谢结果
[0067][0068]
注:“ ”阳性反应;
“-”
阴性反应
[0069]
4、葡萄糖产酸产气试验
[0070]
本实施例中所用的培养基配方如下:
[0071]
蛋白胨0.5g;酵母提取物0.3g;吐温80 0.1ml;盐溶液a 0.5ml;盐溶液b 0.5ml;乙酸钠0.5g;葡萄糖2.5g;2%溴甲酚绿(w/v)0.05ml;蒸馏水100ml;ph6.8~7.0。
[0072]
将配制好的培养基分装至含有倒置小试管的大试管中,3ml/管,121℃,高压灭菌15min。
[0073]
盐溶液a成分:kh2po
4 10g、k2hpo
4 1.0g,溶于蒸馏水,定容至100ml。
[0074]
盐溶液b成分:mgso4·
7h2o 11.5g、mnso4·
2h2o 2.4g、feso4·
7h2o 0.68g,溶于蒸馏水,定容至100ml。
[0075]
在无菌条件下,将接种液按10%的接种量接种培养基,不接菌的培养基作为对照,然后用2ml无菌液体石蜡封住顶部,置于37℃培养。连续培养6d,每天观察培养基颜色有无变化。
[0076]
结果显示:37℃培养6d后,培养基由绿色变为黄色,小倒管内无气体,说明nh-8菌株发酵葡萄糖产酸,不产气。
[0077]
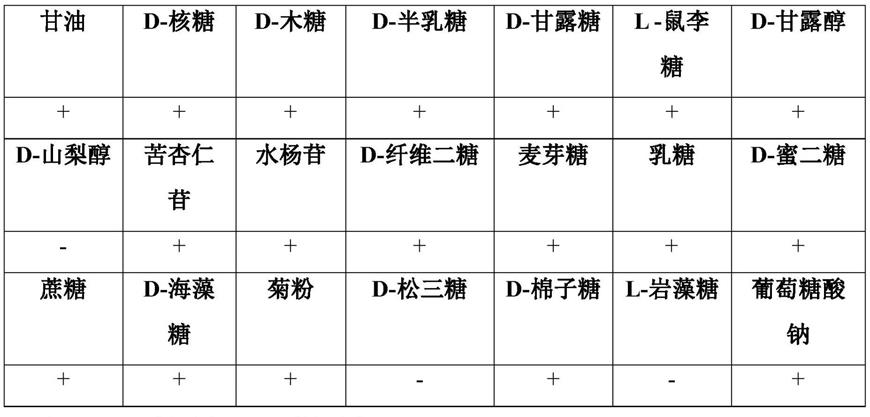
综上,nh-8菌株的生理生化鉴定结果如下:能利用甘油、d-核糖、d-木糖、d-半乳糖、d-甘露糖、l-鼠李糖、d-甘露醇、苦杏仁苷、水杨苷、d-纤维二糖、麦芽糖、乳糖、d-蜜二糖、蔗糖、d-海藻糖、菊粉、d-棉子糖、葡萄糖酸钠作为碳源,而不能利用d-山梨醇、d-松三糖、l-岩藻糖作为碳源;在15℃和61℃条件下不能生长,在57℃条件下能正常生长;过氧化氢酶反应阴性;发酵葡萄糖产酸,不产气。
[0078]
2.3分子生物学鉴定
[0079]
挑取平板上nh-8菌株的单菌落于mrs肉汤培养基中,37℃培养24小时,然后取500ul发酵液,参照天根细菌基因组dna提取试剂盒(目录号:dp302)操作得到该菌株的基因组,该基因组用于后面的分子生物学鉴定。
[0080]
1、16s rdna基因序列鉴定
[0081]
16s rdna基因扩增
[0082]
1)引物序列:
[0083]
27f:agagtttgatcctggctca
[0084]
1492r:ggttaccttgttacgactt
[0085]
2)反应体系(50μl)
[0086]
表2 16s rdna pcr扩增体系
[0087][0088][0089]
3)电泳验证pcr产物核酸电泳结果为1500bp左右时符合要求。
[0090]
4)pcr产物测序
[0091]
测序结果显示nh-8菌株的16s rdna序列为seq id no:1。将该序列在ncbi数据库中进行blast比对,其与凝结芽孢杆菌(bacillus coagulans)的相似性最高。因此,初步确定nh-8菌株为凝结芽孢杆菌(bacillus coagulans)。
[0092]
2、riboprinter指纹图谱
[0093]
用一根取菌棒从琼脂培养基平板上沾取已纯化好的nh-8菌株单菌落,将其放入有缓冲液的样品管中,用手持搅拌器搅拌使菌体在缓冲液中悬浮,然后将样品架放入加热器中灭活后放入riboprinter系统中,样品经过dna制备、转膜、成像检测及数据处理后,得到细菌鉴定结果。鉴定结果显示,nh-8菌株为凝结芽孢杆菌(bacillus coagulans),其riboprinter指纹图谱如图1所示。
[0094]
经比对,nh-8菌株的riboprinter指纹图谱与riboprinter库里附带的上万株菌株
的指纹图谱的最高相似性仅为73%,说明nh-8菌株与菌株库里的所有菌株均不同。另外,经查询全球所有发表的文献中凝结芽孢杆菌的riboprinter指纹图谱,未发现有与该指纹图谱吻合的菌株,从而进一步说明nh-8菌株是一株新的凝结芽孢杆菌菌株。
[0095]
3、rapd指纹图谱鉴定
[0096]
1、rapd指纹图谱鉴定
[0097]
1)引物序列:m13(5
’-
gagggtggcggttct-3’)
[0098]
2)rapd反应体系
[0099]
表3 rapd反应体系
[0100][0101]
3)电泳
[0102]
制备1.5%的琼脂糖凝胶板,dl2000 dna marker作为结果对照,稳压100v电泳80min,最后利用凝胶成像系统检测电泳图,nh-8菌株和对照菌株凝结芽孢杆菌gbi-306086的rapd指纹图谱如图2所示。
[0103]
从图2可以看出,本发明提供的nh-8菌株的rapd指纹图谱与对照菌株凝结芽孢杆菌gbi-30 6086存在明显的区别,而且经查询全球所有发表的文献中凝结芽孢杆菌的rapd指纹图谱,未发现有与该指纹图谱吻合的菌株,从而说明nh-8菌株是一株新的凝结芽孢杆菌菌株。
[0104]
4、rep-pcr指纹图谱鉴定
[0105]
1)rep-pcr引物
[0106]
gtggtggtggtggtg
[0107]
2)rep-pcr的反应体系
[0108]
表4 rep-pcr的反应体系
[0109][0110]
3)电泳
[0111]
dl2000 dna marker作为结果对照。电压100v,电泳时间80min检测扩增结果,nh-8菌株和对照菌株凝结芽孢杆菌gbi-30 6086的rep-pcr指纹图谱如图3所示。
[0112]
从图3可以看出,本发明提供的nh-8菌株的rep-pcr指纹图谱与对照菌株凝结芽孢杆菌gbi-30 6086存在明显的区别,而且经查询全球所有发表的文献中凝结芽孢杆菌的rep-pcr指纹图谱,未发现有与该指纹图谱吻合的菌株,从而说明nh-8菌株是一株新的凝结芽孢杆菌菌株。
[0113]
综上,将nh-8菌株的菌落形态以及生理生化特性结果上传至网站http://www.tgw1916.net/bacteria_logare_desktop.html,同时结合文献de clerck e,et al.systematic and applied microbiology,2004,27(1)50公布的结果,进行比对。综合分子生物学的鉴定结果,可以得出结论,nh-8菌株为一株新的凝结芽孢杆菌菌株,将其正式命名为凝结芽孢杆菌vhprobi c08(bacillus coagulans vhprobi c08)。
[0114]
实施例3凝结芽孢杆菌vhprobi c08盐度耐受性试验
[0115]
在无菌条件下,将接种液按10%的接种量接种到盐浓度分别为1%、2%、3%、4%、5%、6%、7%、8%的5ml mrs液体培养基中,不接菌的5ml mrs液体培养基作为对照,置于37℃恒温振荡培养,观察培养基是否变浑浊。
[0116]
结果显示:凝结芽孢杆菌vhprobi c08在1%~7%盐浓度下生长,在8%盐浓度下不生长,凝结芽孢杆菌vhprobi c08的最大耐受盐浓度为7%。
[0117]
实施例4凝结芽孢杆菌vhprobi c08的溶血性试验
[0118]
1、接种液制备:将冷冻保存的凝结芽孢杆菌vhprobi c08菌株划线接种于mrs固体培养基中,37℃培养24~48h,再经mrs液体培养基传代培养1次后,以5%的接种量把凝结芽孢杆菌vhprobi c08接种到新鲜的mrs液体培养基中40℃振荡培养24~48h,获得新鲜的菌液,作为接种液;
[0119]
2、血细胞培养基准备:称取tbs基础培养基的各种组分,溶解,121℃高压灭菌15min,等培养基冷却到50℃的时候加入5%的无菌脱纤维绵羊血,混匀,倒平板;
[0120]
3、划线培养:将测试菌株划线接种于准备好的血细胞平板,37℃培养箱培养,24~48小时观察测试菌是否有溶血现象。
[0121]
结果显示:凝结芽孢杆菌vhprobi c08生长,血细胞平板没有变化,说明凝结芽孢杆菌vhprobi c08不产生溶血素,不能够溶解血细胞。
[0122]
实施例5凝结芽孢杆菌vhprobi c08的抗生素耐受性试验
[0123]
1、抗生素配制:氨苄青霉素、克林霉素、红霉素、庆大霉素、链霉素、四环素、万古霉素均配制成2048μg/ml的贮存液,-20℃保存备用。使用时将贮存液用mrs液体培养基进行2倍系列梯度稀释成使用液,梯度稀释浓度为1~1024μg/ml共11个梯度。
[0124]
2、接种液制备:接种液的准备:取适量新鲜菌液(24~48h,40℃培养),5000rpm离心5min,用无菌生理盐水洗一次,再用同体积生理盐水重悬后稀释50倍,作为接种液。
[0125]
3、微量肉汤稀释法测定抗生素对凝结芽孢杆菌vhprobi c08的最小抑菌浓度mic。
[0126]
(1)96孔板第1列次加入不含抗生素的mrs液体培养基,作为阴性对照,向第2~12列依次加入190μl含不同浓度抗生素的mrs液体培养基,然后分别接种10μl上述接种液,做3个平行孔,并以1个孔不加菌液作为空白。
[0127]
(2)加入50μl石蜡油覆盖防止水分蒸发。
[0128]
(3)将96孔板于40℃振荡培养48h后取出,测定od
600
值,用48h的结果统计抗生素对菌株的mic值,结果见表5。
[0129]
表5凝结芽孢杆菌vhprobi c08的抗生素mic值
[0130][0131]
注:mic单位μg/ml
[0132]
从表5的结果可以看出,本发明提供的凝结芽孢杆菌vhprobi c08对红霉素等常见抗生素敏感,生物安全性良好。
[0133]
实施例6凝结芽孢杆菌vhprobi c08的疏水性细胞表面测试
[0134]
1、待测菌液制备:挑取纯化好的凝结芽孢杆菌vhprobi c08菌落接种于新配制的mrs液体培养基中,于40℃振荡培养24~48h。再按1%(v/v)的接种量接至mrs液体培养基中于40℃继续振荡培养24~48h后6000
×
g离心10min,收集菌体后用无菌生理盐水冲洗2次,再用灭菌0.1m kno
3 1ml溶液重悬菌体,作为待测菌液。
[0135]
2、表面疏水性测定:吸取50μl上述菌悬液加入2450μl的0.1m kno3并记录od
600
为a0,取1.5ml菌悬液与500μl二甲苯混匀后在室温下静置10min(此时形成两相体系)。将两相体系涡旋振荡2min后再静置20min,重新形成水相和有机相。小心吸取水相(不要吸到有机相)在600nm处测量吸光度a1。细胞疏水性按公式:疏水性(%)=(a
0-a1)/a1×
100计算,测三次实验取平均值。
[0136]
结果显示:本发明提供的凝结芽孢杆菌vhprobi c08细胞表面疏水性为8.58%,标准差为0.48%。
[0137]
实施例7凝结芽孢杆菌vhprobi c08抗氧化功能测定
[0138]
1、菌株清除dpph和羟基自由基(hrs)能力测定
[0139]
1)pbs菌悬液制备
[0140]
将生长状态优良的单菌落接种于3ml的mrs液体培养基中,37℃条件下培养18-20h,以此培养液为接种液,按照2%的接种量接种于50ml的mrs液体培养基中,静置培养18h,获得菌株的培养液。吸取1ml菌液收集菌体后用1mlpbs缓冲液洗涤菌体2遍后再加入2mlpbs溶液重悬菌体备用。
[0141]
2)菌株清除dpph自由基能力的测定
[0142]
取1ml待测菌株的pbs菌悬液,加入1ml 0.4mm的现配的dpph自由基溶液,混合均匀后然后置于室温温度下遮光反应30min,然后测定样品在波长517nm处的吸光度a
样本
,测3次平行。对照组样品以等体积pbs溶液和dpph
·
乙醇混合液,并以等体积pbs菌悬液和乙醇混合液空白调零。清除率按下列公式计算:清除率%=[1-(a
样品-a
空白
)/a
对照
]
×
100%。
[0143]
结果显示:本发明提供的凝结芽孢杆菌vhprobi c08对dpph自由基的清除率高达87.80%,标准差为3%。
[0144]
3)菌株清除羟基自由基hrs能力的测定
[0145]
将100ul 5mm的水杨酸钠-乙醇溶液,100ul 5mm的硫酸亚铁,500ul去离子水和200ul乳酸菌pbs菌悬液混匀后加入100ul过氧化氢溶液(3mm),37℃水浴15min后在510nm波长处测量样品吸光度。羟自由基清除率按照下列公式进行计算:清除率%=(a
样品-a
控制
)/
(a
空白-a
控制
)
×
100%,其中a
控制
为去离子水替代样品,a
空白
为去离子水替代样品和h2o2。
[0146]
结果显示:本发明提供的凝结芽孢杆菌vhprobi c08对hrs自由基的清除率高达47.79%,标准差为2.51%。
[0147]
2、菌株抗脂质过氧化能力测定
[0148]
1)菌株培养及发酵上清液、菌体、胞内提取物的制备:
[0149]
菌株在mrs液体培养基中37℃培养24h,传3代后,6000r/min,4℃离心10min,收集上清液即为发酵上清液。收集的菌体用pbs缓冲液(ph 7.4)于6000r/min离心10min,洗涤3次。将菌体重悬于pbs缓冲液,调整菌体浓度为1.0
×
109cells/ml,获得菌悬液。
[0150]
2)亚油酸乳化液的制备:0.1ml亚油酸,0.2ml tween 20,19.7ml去离子水。
[0151]
3)0.5ml的pbs溶液(ph 7.4)中加入1ml亚油酸的乳化液,1mlfeso4(1%),再加入0.5ml样品,37℃水浴1.5h,混合液加入0.2ml tca(4%),2ml tba(0.8%),100℃水浴30min,迅速冷却,4000r/min离心15min,收集上清液在od
532nm
下测吸光度即为a;对照组以0.5ml蒸馏水代替样品即为a0。抑制率/%=(a0-a)/a0×
100。
[0152]
结果显示:本发明提供的凝结芽孢杆菌vhprobi c08的上清液抗脂质过氧化抑制率为84.46%,标准差为0.28%;菌体抗脂质过氧化抑制率为44.88%,标准差为0.43%。
[0153]
实施例8凝结芽孢杆菌vhprobi c08体外胆固醇降解试验
[0154]
1、胆固醇胶束溶液的配制:准确称取1g胆固醇,溶于无水乙醇中,并定容至100ml,在无菌条件下用0.22μm微孔滤膜过滤除菌。
[0155]
2、称取蛋白胨10.0g牛肉膏10.0g酵母膏5.0g柠檬酸氢二铵2.0g葡萄糖20.0g,吐温80 1.0ml,乙酸钠5.0硫酸镁0.1硫酸锰0.05,磷酸氢二钾2.0g,蒸馏水1000ml,调节ph值7.3,115℃灭菌30min,然后加入胆固醇溶液使胆固醇终浓度为0.1%。按照0.1%的接种量接种新鲜菌液,37℃静止培养48小时,然后取0.2ml菌液,加入1.8ml无水乙醇,混匀,静止10分钟,3000转离心5分钟,取上清用于测定胆固醇含量。胆固醇测定方法按照gb/t 5009.128-2003《食品中胆固醇的测定》。
[0156]
结果显示:本发明提供的凝结芽孢杆菌vhprobi c08对胆固醇的降解率高达39.21%。
[0157]
实施例9凝结芽孢杆菌vhprobi c08在预防大鼠腹泻中的应用
[0158]
1、实验材料
[0159]
(1)实验动物
[0160]
wistar大鼠spf级,30只,雌雄各半,体重150-200g。由济南朋悦实验动物繁育有限公司提供,生产许可证号scxk(鲁)20190003。
[0161]
动物检疫和标识:所有动物到达后,适应期至少一周,进行检疫观察,观察动物的活动、饮食等表现,动物在试验前需检查合格,合格的动物方可用于试验。动物检疫合格后,给每只动物指定一个单一的动物号,在动物尾部加以标记。检疫观察期笼卡上标明专题编号、动物号、笼号、性别、动物接收日期和专题负责人;分组后,笼卡上标明专题编号、动物号、笼号、性别、组别、试验起止日期和专题负责人。
[0162]
实验动物饲养管理的环境条件:室温20~26℃,日温差≤4℃,相对湿度40~70%,明暗交替时间为12/12h。动物饲养于标准大鼠笼具中,每笼10只。
[0163]
动物饲料、饮水:自由摄食、饮水。饲料为spf级大鼠生长繁育饲料,由济南朋悦实
验动物繁育有限公司(批号:20190905)提供。饮用水是经过高温消毒的城市自来水。
[0164]
(2)试剂耗材
[0165]
洛哌丁胺(批号:190106588),西安杨森制药有限公司;蓖麻油(批号:20190426),国药集团化学试剂有限公司。
[0166]
2、实验方法
[0167]
(1)菌液配制
[0168]
将凝结芽孢杆菌vhprobi c08冻干菌粉溶解于生理盐水中,配制成浓度为109cfu/ml的菌液。
[0169]
(2)造模、分组及给药
[0170]
spf级wistar大鼠,适应性饲养5天后开始分组、给药。选用合格大鼠随机分为5组,分别为空白对照组、阳性对照组、阴性对照组、益生菌预处理组、益生菌后处理组。分组后益生菌预处理组开始按照1ml/只给予凝结芽孢杆菌vhprobi c08菌液,连续给予7天,其他组不做处理。第7天后,大鼠禁食18h,自由饮水。实验第8天,空白对照组组仍不做处理,阴性对照组给予等体积生理盐水,阳性对照组按1mg/kg体重给予洛哌丁胺处理,益生菌预处理组和益生菌后处理组按1ml/只给予凝结芽孢杆菌vhprobi c08菌液。给药4h后,空白对照组不做处理,其余组大鼠每只给予蓖麻油1ml诱导腹泻,诱导腹泻后观察大鼠初次腹泻时间,称量大鼠在4h、8h、12h腹泻粪便重量及12内饮水量,结果见表6。
[0171]
3、数据统计处理方法
[0172]
所有实验数据以均数
±
标准差
“±
sd”表示,用microsoft excel进行数据统计和作图,两组数据间比较采用t检验,以p<0.05判定为有显著性差异。
[0173]
4、实验结果与分析
[0174]
表6大鼠预防腹泻指数比较(n=6)
[0175][0176][0177]
与阴性对照组比较:*p<0.05
[0178]
从表6的数据可以看出,与空白对照组比较,阴性对照组及给药组大鼠均出现腹泻,证明造模成功。
[0179]
如图4所示,12h内各组大鼠的饮水量没有统计学差异,所以饮水量和排便量没有关系,排便量多并不是由饮水量多造成的。
[0180]
如图5所示,连续观察4h,与阴性对照组比较,阳性对照组稀便次数显著减少,粪便重量减少有显著差异(p<0.05);益生菌预处理粪便重量减少有显著差异(p<0.05);后处理组未减少无显著性差异。连续观察8h,与阴性对照组比较,阳性对照组稀便次数减少,粪便量减少有显著性差异(p<0.05);益生菌预处理粪便量减少有显著性差异(p<0.05),后处理未出现减少。连续观察12h,阳性对照组粪便量减少有显著差异(p<0.05);益生菌预处理和后处理均未出现减少。与阴性对照组比较,阳性对照组、益生菌预处理和后处理组均出现不同程度减少,但无显著差异。
[0181]
5、实验结论
[0182]
综合以上指标可知,凝结芽孢杆菌vhprobi c08预处理组大鼠观察到延迟腹泻时间,粪便量减少有显著性差异;而凝结芽孢杆菌vhprobi c08后处理大鼠未观察到治疗作用。从而说明,本发明提供的凝结芽孢杆菌vhprobi c08能有效预防大鼠腹泻,但对于大鼠腹泻的治疗效果不显著。
[0183]
实施例10凝结芽孢杆菌vhprobi c08在调节大鼠胃肠道蠕动中的应用
[0184]
1、实验材料
[0185]
(1)实验动物
[0186]
wistar大鼠spf级,24只,雌雄各半,体重150-200g。由济南朋悦实验动物繁育有限公司提供,生产许可证号scxk(鲁)20190003。
[0187]
动物检疫和标识:所有动物到达后,适应期至少一周,进行检疫观察,观察动物的活动、饮食等表现,动物在试验前需检查合格,合格的动物方可用于试验。动物检疫合格后,给每只动物指定一个单一的动物号,在动物尾部加以标记。检疫观察期笼卡上标明专题编号、动物号、笼号、性别、动物接收日期和专题负责人;分组后,笼卡上标明专题编号、动物号、笼号、性别、组别、试验起止日期和专题负责人。
[0188]
实验动物饲养管理的环境条件:室温20~26℃,日温差≤4℃,相对湿度40~70%,明暗交替时间为12/12h。动物饲养于标准大鼠笼具中,每笼10只。
[0189]
动物饲料、饮水:自由摄食、饮水。饲料为spf级大鼠生长繁育饲料,由济南朋悦实验动物繁育有限公司(批号:20190905)提供。饮用水是经过高温消毒的城市自来水。
[0190]
(2)试剂耗材
[0191]
硫酸阿托品(批号:1902161),天津金耀药业有限公司;阿拉伯胶(批号:20190502),天津市北辰方正试剂长;活性碳粉(批号:7440-44-0),索莱宝。
[0192]
2、实验方法
[0193]
(1)溶液的配制
[0194]
菌液的配制:将凝结芽孢杆菌vhprobi c08冻干菌粉溶解于生理盐水中,配制浓度为109cfu/ml的菌液。
[0195]
3%失活碳的配制:将阿拉伯胶溶解于高纯水中,配制2%阿拉伯胶水溶液;将碳粉混悬于2%阿拉伯胶水溶液中配制3%失活碳。
[0196]
(2)造模、分组及给药
[0197]
spf级wistar大鼠,适应性饲养4天后开始分组、给药。选用合格大鼠随机分为4组,分别为阴性对照组(等体积生理盐水)、阳性对照组(硫酸阿托品,4mg/kg体重)、益生菌预处理组(109cfu/只)、益生菌后处理组(109cfu/只)。分组后益生菌预处理组开始按照1ml/只给予凝结芽孢杆菌vhprobi c08菌液,连续给予7天,其他组不做处理。第7天后,大鼠禁食18h,自由饮水。实验第8天,阳性对照组按1ml/100g腹腔注射硫酸阿托品,2h后每只大鼠灌胃给予3%失活碳2ml,1h后co2窒息处死;益生菌预处理组和益生菌后处理组分别按照1ml/只灌胃给予凝结芽孢杆菌vhprobi c08菌液,阴性对照组灌胃给予等体积生理盐水,4h后每只大鼠灌胃给予3%失活碳2ml,1h后co2窒息处死;快速分取小肠并拉成直线,置于无菌垫单上,测量肠管(幽门至回盲部)长度作为小肠总长度,从碳粉前沿至幽门的距离为碳粉在小肠内推进距离,计算碳粉推进率及碳粉推进抑制率,结果见表7。
[0198]
碳粉推进率(%)=碳粉在肠内推进距离(cm)/小肠全长(cm)
×
100%。
[0199]
3、数据统计处理方法
[0200]
所有实验数据以均数
±
标准差表示,用microsoft excel软件进行数据统计和作图,两组数据间比较采用t检验,以p<0.05判定为有显著性差异。
[0201]
4、实验结果与分析
[0202]
表7各组大鼠小肠碳粉推进率比较(n=6)
[0203][0204]
从表7的数据可知,与阴性对照组比较,阳性对照组大鼠小肠中碳粉推进率降低,有显著性差异;益生菌预处理组碳粉推进率降低,有显著性差异;而益生菌后处理组碳粉推进率降低无显著性差异。
[0205]
5、实验结论
[0206]
综合以上指标可知,凝结芽孢杆菌vhprobi c08预处理组大鼠小肠中碳粉推进率降低,有显著性差异,但后处理组与阴性组比较没有显著性差异,从而说明预服本发明提供的凝结芽孢杆菌vhprobi c08,有效抑制肠蠕动。
[0207]
本发明实施例10和实施例11两个应用实验的结果显示:在预先服用本发明所述凝结芽孢杆菌vhprobi c08 7天后,会出现减缓肠道蠕动过快、缓解腹泻的效果,具备预防腹泻的良好功能。但在仅服用一次凝结芽孢杆菌vhprobi c08的4小时后,则没有明显出现减缓肠道蠕动过快、缓解腹泻的效果。从而说明凝结芽孢杆菌vhprobi c08对肠道蠕动的调节能力需要一定的时间才能发挥作用,凝结芽孢杆菌vhprobi c08需要足够的时间在肠道内生长、定植,分泌对机体有益的代谢产物,调节肠道菌群,才会发挥缓解腹泻的效果。如果凝结芽孢杆菌vhprobi c08在肠道内的定植时间太短,对机体的有益效果则体现不出来。
[0208]
实施例11凝结芽孢杆菌vhprobi c08在降低小鼠体内胆固醇含量中的应用
[0209]
1、实验材料
[0210]
(1)实验动物
[0211]
8周龄大的雌性spf级balb/c小鼠,90只,体重150-200g。由济南朋悦实验动物繁育有限公司提供,生产许可证号scxk(鲁)20190003。
[0212]
动物检疫和标识:所有动物到达后,适应期至少一周,进行检疫观察,观察动物的活动、饮食等表现,动物在试验前需检查合格,合格的动物方可用于试验。动物检疫合格后,给每只动物指定一个单一的动物号,在动物尾部加以标记。检疫观察期笼卡上标明专题编号、动物号、笼号、性别、动物接收日期和专题负责人;分组后,笼卡上标明专题编号、动物号、笼号、性别、组别、试验起止日期和专题负责人。
[0213]
实验动物饲养管理的环境条件:室温20~26℃,日温差≤4℃,相对湿度40~70%,明暗交替时间为12/12h。动物饲养于标准小鼠笼具中,每笼6只。
[0214]
动物饲料、饮水:自由摄食、饮水。饲料为spf级小鼠生长繁育饲料,其成分构成为:蛋白质23.9%,脂肪4.6%,纤维5.5%,总的可消化营养物75.5%由济南朋悦实验动物繁育有限公司提供。饮用水是经过高温消毒的城市自来水。
[0215]
(2)试剂耗材
[0216]
胆固醇购于北京索莱宝科技有限公司;胆固醇检测试剂盒购于默克sigma-aldrich。
[0217]
2、实验方法
[0218]
(1)菌液配制
[0219]
将凝结芽孢杆菌vhprobi c08冻干菌粉溶解于生理盐水中,配制浓度为109cfu/ml的菌液。
[0220]
(2)造模、分组及给药
[0221]
spf级balb/c小鼠适应性饲养5天后开始分组、给药。选用合格小鼠随机分为3组,每组30只,分别为阳性对照组(等体积生理盐水)、益生菌预处理组(109cfu/ml/只)、益生菌后处理组(109cfu/ml/只)。分组后小鼠喂食高胆固醇饲料14天进行造模。益生菌预处理组从造模开始按照1ml/只给予凝结芽孢杆菌vhprobi c08菌液,一直持续到实验结束,益生菌后处理组从造模结束后按照1ml/只给予凝结芽孢杆菌vhprobi c08菌液,一直持续到实验结束。阳性对照组从造模结束后喂食等体积生理盐水。整个过程持续了40天,每10天处死每组小鼠6只,检测前小鼠禁食24h,自由饮水,取眼眶血检测血液胆固醇水平,结果见表8。
[0222]
3、数据统计处理方法
[0223]
所有实验数据以均数
±
标准差表示,两组数据间比较采用t检验,以p<0.05判定为有显著性差异。
[0224]
4、实验结果与分析
[0225]
表8小鼠降胆固醇指数比较(n=6)
[0226]
[0227][0228]
单位mg/dl与阳性对照组比较:*p<0.05
[0229]
从表8的数据可知,与阳性对照组相比,连续观察30天后,凝结芽孢杆菌vhprobi c08预处理组血液胆固醇水平降低了约34%,有显著性差异,凝结芽孢杆菌vhprobi c08后处理组血液胆固醇水平降低了约10%,也有显著性差异;连续观察40天后,凝结芽孢杆菌vhprobi c08预处理组血液胆固醇水平降低了约39%,有显著性差异,凝结芽孢杆菌vhprobi c08后处理组血液胆固醇水平降低了约30%,也有显著性差异。
[0230]
5、实验结论
[0231]
综合以上指标可知,在高血脂小鼠模型中,用本发明提供的凝结芽孢杆菌vhprobi c08喂食模型鼠30天后能够有效降低高血脂小鼠血液胆固醇水平,从而表明凝结芽孢杆菌vhprobi c08具有降低血液胆固醇水平的功效。
[0232]
作为我国可食用的菌种之一,凝结芽孢杆菌的安全性已获得广泛的认可。本发明提供的凝结芽孢杆菌vhprobi c08符合我国的规定,可以作为一种食品原料来使用,长期服用不会有任何副作用以及过量的风险。凝结芽孢杆菌vhprobi c08是一株新的凝结芽孢杆菌菌株,经过体外动物实验证实其具有预防腹泻和降解胆固醇的功能。此外,凝结芽孢杆菌vhprobi c08所具有的耐热性特点及良好的成孢率使其可以添加在大多数种类的食品中,制备成有预防腹泻和降解胆固醇功能的功能性食品,该菌株发酵条件简单、产业化成本低、市场前景广阔,是一株具有巨大经济价值的新型益生菌株。
[0233]
申请人已于2019年9月23日将所述凝结芽孢杆菌vhprobi c08(bacillus coagulans vhprobi c08)保藏于中国典型培养物保藏中心,保藏号为cctcc no:m2019738。
[0234]
实施例12一种凝结芽孢杆菌制剂及其制备方法
[0235]
1、制备凝结芽孢杆菌发酵液
[0236]
在无菌条件下,将凝结芽孢杆菌vhprobi c08种子液以3-5%的体积比接种于发酵培养基中,所述发酵培养基中各组分及其含量分别为:玉米淀粉10~40g/l、葡萄糖0.5~3g/l、豆粕5~25g/l、碳酸钙0.1~1.5g/l、氯化铵0.1~1.0g/l、磷酸氢二钾0.1~1.0g/l、硫酸镁0.01~0.7g/l和硫酸锰0.01~0.7g/l;40℃培养23~36h,转速为180~200rpm,通风量为1:1.2~1.5,罐压为0.05~0.08mpa。发酵完成后,升温至50~60℃,维持20min,即得到凝结芽孢杆菌vhprobi c08发酵液,其中凝结芽孢杆菌的活菌量为10
10-10
11
cfu/ml。
[0237]
2、制备喷雾混合液
[0238]
将凝结芽孢杆菌vhprobi c08发酵液在4℃,5000r/min条件下离心10min,收集菌体后用无菌生理盐水洗涤2次,重悬菌体制成菌悬液。
[0239]
按1:4:1:1:0.1:1:8的重量比分别称取大豆蛋白、脱脂奶粉、玉米淀粉、蔗糖、阿拉伯胶、低聚果糖和乳酸钙七种包被材料,加水搅拌混匀,并与上述菌悬液充分混匀,得喷雾混合液;所述喷雾混合液中各种包被材料的重量体积比(g/ml)分别为:大豆蛋白2.5%、脱脂奶粉10%、玉米淀粉2.5%、蔗糖2.5%、阿拉伯胶0.25%、低聚果糖2.5%、乳酸钙20%;所
述喷雾混合液中凝结芽孢杆菌vhprobi c08的终浓度为1.5
×
109cfu/ml;
[0240]
3、喷雾干燥处理
[0241]
采用离心式喷雾干燥器进行喷雾干燥处理,干燥塔进风温度为130℃,雾化压力为0.3mpa,输送混合液的蠕动泵转速为13r/min,出风温度为70℃,干燥的颗粒随塔内的热风进入旋风分离器,粒径为50~90μm,收集并称重。
[0242]
实施例13一种凝结芽孢杆菌制剂及其制备方法
[0243]
1、制备凝结芽孢杆菌发酵液
[0244]
在无菌条件下,将凝结芽孢杆菌vhprobi c08种子液以3-5%的体积比接种于发酵培养基中,所述发酵培养基中各组分及其含量分别为:玉米淀粉10~40g/l、葡萄糖0.5~3g/l、豆粕5~25g/l、碳酸钙0.1~1.5g/l、氯化铵0.1~1.0g/l、磷酸氢二钾0.1~1.0g/l、硫酸镁0.01~0.7g/l和硫酸锰0.01~0.7g/l;40℃培养23~36h,转速为180~200rpm,通风量为1:1.2~1.5,罐压为0.05~0.08mpa。发酵完成后,升温至50~60℃,维持20min,即得到凝结芽孢杆菌vhprobi c08发酵液,其中凝结芽孢杆菌的活菌量为10
10-10
11
cfu/ml。
[0245]
2、制备喷雾混合液
[0246]
将凝结芽孢杆菌vhprobi c08发酵液在4℃,5000r/min条件下离心10min,收集菌体后用无菌生理盐水洗涤2次,重悬菌体制成菌悬液。
[0247]
按5:6:2:3:0.4:2:10的重量比分别称取大豆蛋白、脱脂奶粉、玉米淀粉、蔗糖、阿拉伯胶、低聚果糖和乳酸钙七种包被材料,加水搅拌混匀,并与上述菌悬液充分混匀,得喷雾混合液;所述喷雾混合液中各种包被材料的重量体积比(g/ml)分别为:大豆蛋白12.5%、脱脂奶粉15%、玉米淀粉5%、蔗糖7.5%、阿拉伯胶1%、低聚果糖5%、乳酸钙25%;所述喷雾混合液中凝结芽孢杆菌vhprobi c08的终浓度为1.1
×
10
10
cfu/ml;
[0248]
3、喷雾干燥处理
[0249]
采用离心式喷雾干燥器进行喷雾干燥处理,干燥塔进风温度为150℃,雾化压力为0.5mpa,输送混合液的蠕动泵转速为25r/min,出风温度为77℃,干燥的颗粒随塔内的热风进入旋风分离器,粒径为50~90μm,收集并称重。
[0250]
实施例14一种凝结芽孢杆菌制剂及其制备方法
[0251]
1、制备凝结芽孢杆菌发酵液
[0252]
在无菌条件下,将凝结芽孢杆菌vhprobi c08种子液以3-5%的体积比接种于发酵培养基中,所述发酵培养基中各组分及其含量分别为:玉米淀粉10~40g/l、葡萄糖0.5~3g/l、豆粕5~25g/l、碳酸钙0.1~1.5g/l、氯化铵0.1~1.0g/l、磷酸氢二钾0.1~1.0g/l、硫酸镁0.01~0.7g/l和硫酸锰0.01~0.7g/l;40℃培养23~36h,转速为180~200rpm,通风量为1:1.2~1.5,罐压为0.05~0.08mpa。发酵完成后,升温至50~60℃,维持20min,即得到凝结芽孢杆菌vhprobi c08发酵液,其中凝结芽孢杆菌的活菌量为10
10-10
11
cfu/ml。
[0253]
2、制备喷雾混合液
[0254]
将凝结芽孢杆菌vhprobi c08发酵液在4℃,5000r/min条件下离心10min,收集菌体后用无菌生理盐水洗涤2次,重悬菌体制成菌悬液。
[0255]
按2:5:4:2:1:1.2:5的重量比分别称取大豆蛋白、脱脂奶粉、玉米淀粉、蔗糖、阿拉伯胶、低聚果糖和乳酸钙七种包被材料,加水搅拌混匀,并与上述菌悬液充分混匀,得喷雾混合液;所述喷雾混合液中各种包被材料的重量体积比(g/ml)分别为:大豆蛋白5%、脱脂
奶粉12.5%、玉米淀粉10%、蔗糖5%、阿拉伯胶2.5%、低聚果糖3%、乳酸钙12.5%;所述喷雾混合液中凝结芽孢杆菌vhprobi c08的终浓度为3.5
×
109cfu/ml;
[0256]
3、喷雾干燥处理
[0257]
采用离心式喷雾干燥器进行喷雾干燥处理,干燥塔进风温度为145℃,雾化压力为0.2mpa,输送混合液的蠕动泵转速为10r/min,出风温度为80℃,干燥的颗粒随塔内的热风进入旋风分离器,粒径为50~90μm,收集并称重。
[0258]
实施例15凝结芽孢杆菌制剂性能检测
[0259]
1、菌株存活率检测
[0260]
取实施例12-14制备得到的凝结芽孢杆菌制剂各1g,经生理盐水梯度稀释后,采用平板涂布法计数所述制剂中的活菌数,计算制剂中单位活菌量及凝结芽孢杆菌的存活率,结果见表9。
[0261]
存活率=(制剂质量
×
单位活菌量)/(喷雾混合液体积
×
单位活菌量)
×
100%。
[0262]
表9凝结芽孢杆菌制剂中单位活菌量及菌株的存活率比较
[0263]
凝结芽孢杆菌制剂单位活菌量凝结芽孢杆菌的存活率实施例122.35
×
10
10
cfu/g98.2%实施例131.97
×
10
10
cfu/g92.0%实施例141.52
×
10
10
cfu/g95.4%
[0264]
从表9的结果可以看出,本发明提供的凝结芽孢杆菌制剂单位活菌量高,且凝结芽孢杆菌vhprobi c08经喷雾干燥后存活率高达98.2%,从而说明本发明选用的包被材料和喷雾干燥制备工艺对凝结芽孢杆菌vhprobi c08的伤害非常小,效果显著。
[0265]
2、抗逆性检测
[0266]
2.1人工胃液的配制
[0267]
分别称取蛋白胨5g、酵母提取物2.5g、葡萄糖1g和nacl 2g,加入1000ml蒸馏水,用稀盐酸调ph3.0,然后115℃灭菌20min。然后使用前加入3.2g猪粘膜胃蛋白酶,摇匀溶解,置37℃水浴摇床中温水浴1h,以模拟人体温度。
[0268]
2.2人工肠液的配制
[0269]
分别称取蛋白胨5g、酵母提取物2.5g、葡萄糖1g、kh2po4 6.8g和牛胆盐3.0g,加入77ml的0.2mol/l的naoh溶液,定容至1000ml,用稀盐酸或者氢氧化钠溶液调ph6.8
±
0.1,115℃灭菌20min。然后使用前加入1g胰酶,摇匀溶解,置37℃水浴摇床中温水浴1h,以模拟人体温度。
[0270]
2.3试验方法
[0271]
取2g实施例12制备得到的凝结芽孢杆菌制剂用2ml生理盐水重悬,作为接种液。取1ml接种液,加入到9ml提前温水浴1h的人工胃液中,置于37℃水浴摇床以200rpm/min转速振荡2h,分别于0h和2h时取样1ml,检测活菌量。然后取1ml消化2h后的人工胃液,加入到24ml人工肠液中,置于37℃水浴摇床(200rpm/min)3h,取样1ml,检测活菌量。活菌计数方法按照国标《gb4789.35-2016-食品微生物检验乳酸菌检验》测定菌量,该菌株经过人工胃液和人工肠液消化后的活菌量(log cfu/ml)见表10。
[0272]
表10凝结芽孢杆菌制剂对人工胃液和人工肠液的耐受效果
[0273]
分组消化前人工胃液消化后人工肠液消化后
活菌量log cfu/ml10.31
±
0.1710.38
±
0.1510.46
±
0.23
[0274]
从表10的结果可以看出,本发明提供的凝结芽孢杆菌制剂经过人工胃液和人工肠液消化后,活菌量不仅没有下降反而还有一定的上升,从而说明制剂中的凝结芽孢杆菌vhprobi c08进行了一定的萌发,具有很强的耐胃酸耐胆碱能力。
[0275]
3、耐高温性能检测
[0276]
取1g实施例12制备得到的凝结芽孢杆菌制剂溶于1ml的无菌生理盐水中制成菌悬液,取100ul用于平板计数,剩余菌悬液分别在85℃和95℃中水浴2h,然后再平板涂布计数,计算菌株的存活率。
[0277]
存活率=热处理后的活菌量/热处理前的活菌量
×
100%。
[0278]
结果显示,本发明所述凝结芽孢杆菌制剂具有良好的热稳定性,在85℃条件下加热2h后,凝结芽孢杆菌vhprobi c08的存活率高达78.3%,在95℃条件下加热2h后,存活率仍高于50%,取得了意料不到的技术效果。
[0279]
申请人将本发明提供的凝结芽孢杆菌制剂提前喂食wistar大鼠10天后对大鼠进行腹泻造模试验,观察大鼠的排便量等指标。结果显示,与阴性组大鼠相比,提前喂食凝结芽孢杆菌制剂的大鼠稀便次数显著减少,粪便重量也减少。
[0280]
将本发明提供的凝结芽孢杆菌制剂提前喂食wistar大鼠10天后对大鼠进行胃肠道蠕动造模试验,观察大鼠的小肠蠕动能力。结果显示,与阴性组大鼠相比,提前喂食凝结芽孢杆菌制剂的大鼠中,碳粉推进率会降低,小肠蠕动能力减弱。从而说明本发明提供的凝结芽孢杆菌制剂能有减缓肠道蠕动过快、缓解腹泻的效果,具备预防腹泻的良好功能。
[0281]
本发明提供的凝结芽孢杆菌制剂的制备工艺过程简单,包被材料便宜,产业化成本低,能有效提高了凝结芽孢杆菌vhprobi c08在存储加工运输过程中的稳定性,有力提高了凝结芽孢杆菌vhprobi c08的实际使用效果,可广泛应用于食品、保健品等领域。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

