马铃薯tf72354基因及其在花青素合成调控中的应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一个马铃薯花青素合成相关基因tf72354的克隆及应用。
背景技术:
2.马铃薯(solanum tuberosum l.)是仅次于水稻、小麦和玉米的第四大粮食作物,粮、菜、饲和工业原料兼用,营养丰富,适种区域广,增产潜力大,经济效益高。彩色马铃薯除了含有一般马铃薯所含有的淀粉、蛋白质、多种微量元素和氨基酸外,其抗氧化活性是白肉或黄肉马铃薯的3
‑
5倍(brown et al., 2003),其中抗氧化活性物质主要是花青素。花青素是植物次生代谢过程中产生的类黄酮物质,广泛存在于植物的花、果实、种子、茎、叶和根的细胞液中,使其呈现从红、紫到蓝等不同的颜色(brenda, 2002)。花青素作为一种具有天然生物活性的植物色素,不仅具有强抗氧化性,其在营养器官中的合成和积累对植物适应和抵抗恶劣环境条件至关重要,可以增强植物对不同生物胁迫和非生物胁迫的抵抗能力(王鸿雪等,2020;zhang et al., 2018;chen et al., 2016)。花青素的合成途径比较明确,需要一系列酶的参与(holton and cornish, 1995; liu et al., 2018),如chs(查尔酮合酶基因)、chi(查尔酮异构酶基因)、f3h(黄烷酮
‑3‑
羟基化酶基因)、f3’h(类黄酮3
’‑
羟化酶)、f3
’5’
h(类黄铜3
’‑
羟化酶)、fls(黄酮醇合成酶)、dfr(二氢黄酮醇还原酶基因)、ans(花青素合成酶)、3gt(类黄酮3
‑
o
‑
葡萄糖基转移酶)、gst(谷胱甘肽s
‑
转移酶)等。
3.关键酶基因的表达主要受转录因子的调控,目前研究比较多的是由r2r3
‑
myb, basic helix
‑
loop
‑
helix (bhlh) 和 wd40
‑
repeat (wdr) 蛋白组成的mbw蛋白复合体对花青素合成的调控(grotewold, 2006)。马铃薯中mbw成员stan2,stmyba1,stan11等基因促进花青素的合成(liu et al., 2017;li et al., 2014;jung et al., 2009),而stmyb44基因抑制花青素的合成(liu et al., 2019)。除mbw成员外,wrky和nac等转录因子也参与花青素的合成。如pywrky26可以与pybhlh3共同作用于pymyb114的启动子,增强花青素合成相关结构基因的表达,从而调节红皮梨中花青素的合成与运输(li et al., 2020)。
4.b3基因家族是植物中广泛存在的转录因子家族,这类转录因子在调控植物的生长发育、器官形态建成、花芽分化以及应答多种逆境胁迫中发挥重要的作用(swaminathan et al., 2008)。但是,b3类转录因子在花青素合成中的作用还未见报道。
技术实现要素:
5.针对上述问题,本发明的目的在于提供一个可以调控马铃薯花青素合成的b3类转录因子基因tf72354,及其重组表达载体和基因的应用。
6.为了实现上述目的,本发明采用的具体方案为:本发明的tf72354基因是从马铃薯基因型ft033
‑
5块茎cdna中克隆得到。构建表达载体,分别在烟草和马铃薯中研究基因功能,发现该基因可以调控花青素的合成。具体在于:
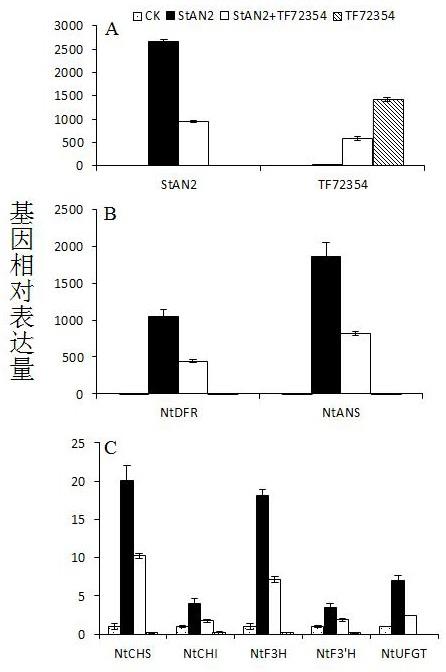
stan2是马铃薯myb转录因子,可以促进马铃薯花青素的合成。在烟草中注射stan2叶片中有花青素积累,同时注射stan2和tf72354时叶片红色比单独注射stan2浅(图1)。说明tf72354可以协同stan2调控花青素的合成。对注射叶片进行基因表达分析发现,共同注射stan2和tf72354的叶片中stan2基因的表达量低于只注射stan2的叶片,并且tf72354基因的表达量低于只注射tf72354的叶片(图2a)。进一步检测花青素合成相关酶基因表达量,与单独注射stan2的叶片相比,共同注射stan2和tf72354的叶片中结构基因ntdfr、ntans、ntchs、ntchi、ntf3h、ntf3’h和ntufgt的表达量显著降低(图2b和2c)。这些结果说明tf72354基因可以与stan2相互协调,降低结构基因ntdfr、ntans、ntchs、ntchi、ntf3h、ntf3’h和ntufgt的表达量,从而调控烟草叶片花青素的合成与累积。
7.tf72354基因转化马铃薯,获得转基因株系。转基因块茎薯皮颜色红色程度比对照浅(图3),花青素含量显著低于对照(图4)。转基因块茎中tf72354基因的表达量显著高于非转基因对照desiree,而stan2基因的表达量显著低于desiree(图5)。进一步检测块茎中花青素合成相关酶基因的表达模式,转基因株系中stchs,stf3h,stdfr和stans的表达量显著低于非转基因对照(图6),这些结果说明tf72354可以通影响转录因子stan2以及酶基因stchs,stf3h,stdfr和stans的表达调控块茎花青素的合成和积累。
8.因此,本发明请求保护一种调控马铃薯花青素合成的基因tf72354,其orf序列全长864bp,核苷酸序列如seq id no:1所示,编码288个氨基酸,氨基酸序列如seq id no:2所示。
9.一种基因重组表达载体,包含上述的基因tf72354。具体为psak
‑
tf72354重组表达载体,以马铃薯ft033
‑
5块茎表皮cdna为模板,以5
’‑ꢀ
tagtggatccaaagaattcatggaagaatcatctagaaattcttcg
‑3’
为正向引物,5
’‑ꢀ
cgagaagctttttgaattcttatccctggtgatatctcatctga
‑3’
为反向引物,扩增tf72354基因;通过ecorⅰ单酶切将所述tf72354基因片段与植物表达载体psak
‑
277重组,获得psak
‑
tf72354重组表达载体。
10.一种转化体,是将上述的重组表达载体转化农杆菌所得。
11.本发明还请求保护所述的基因tf72354在花青素合成调控中的应用。
12.有益效果:本发明涉及的tf72354基因是一个含有b3结构域的转录因子。通过构建超量表达载体,在烟草和马铃薯中过表达该基因可以抑制烟草叶片和马铃薯块茎中花青素的合成,说明马铃薯tf72354基因在花青素合成过程中起调控作用。因此,从马铃薯中分离tf72354基因并鉴定其在花青素合成过程中的作用,对于培育高花青素含量马铃薯新品种具有重要意义,为育高花青素含量马铃薯(植物)新品种提供了基因资源。
附图说明
13.图1是超量表达tf72354基因的烟草叶片表型鉴定图;其中:标号1是指注射stan2 tf72354;标号2是指注射stan2;标号3是指注射tf72354;图2是超量表达tf72354基因的烟草叶片中相关基因表达模式分析图;图3是超量表达tf72354基因的马铃薯块茎表型鉴定图;图4是超量表达tf72354基因的马铃薯块茎花青素含量图;图5是超量表达tf72354基因的马铃薯块茎中tf72354和stan2基因表达模式分析
图;图6是超量表达tf72354基因的马铃薯块茎中相关酶基因表达模式分析图。
具体实施方式
14.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
15.本发明从马铃薯ft033
‑
5基因型块茎中克隆得到b3类转录因子成员tf72354。其orf序列全长864bp,编码288个氨基酸。将该基因分别在烟草和马铃薯中超量表达,能有效调控花青素的合成。
16.序列表seq id no:1是本发明分离克隆的tf72354基因的核苷酸编码序列,序列长度为 867bp,共计编码288个氨基酸。序列表seq id no:2是tf72354基因的蛋白质序列。
17.1、tf72354基因克隆及表达载体构建。
18.以马铃薯ft033
‑
5块茎表皮cdna为模板,以5
’‑ꢀ
tagtggatccaaagaattcatggaagaatcatctagaaattcttcg
‑3’
为正向引物,5
’‑ꢀ
cgagaagctttttgaattcttatccctggtgatatctcatctga
‑3’
为反向引物,扩增tf72354基因。将基因片段利用ligation
‑
free cloning kit试剂盒与植物表达载体psak
‑
277(ecorⅰ单酶切)重组,重组反应体系:3
µ
l 目的基因回收产物,2
µ
l psak
‑
277(切),2
µ
l 5
×
master mix,3
µ
l dh2o。将配好的反应体系放置在冰盒中冰浴30min进行重组,然后转化大肠杆菌dh5α感受态细胞。经spe抗生素筛选,挑取单克隆摇菌,阳性克隆测序,形成植物表达载体psak
‑
tf72354。提取psak
‑
tf72354载体质粒,转化农杆菌gv3101,经spe和rif抗生素筛选,得到阳性克隆,为植物表达载体psak
‑
tf72354农杆菌。
19.2、烟草中超量表达tf72354基因。
20.将含有重组植物表达载体psak
‑
tf72354和psak
‑
stan2(liu et al., 2016)的农杆菌划线培养在lb平板(含50 mg/l的spe,50 mg/l的rif)上,置于28℃条件下培养48 h;挑取单克隆在10 ml yeb液体培养基(含50 mg/l的spe,50 mg/l的rif)中,28℃,250r/min条件下培养24 h;取5 ml菌液转移至50 ml新鲜的yeb液体培养基(含50 mg/l的spe)中,28℃,250r/min条件下继续培养,至菌液od600达到0.6左右。转移菌液至离心管中,室温条件下,5000r/min离心10min,收集沉淀,重悬于mma缓冲液(10mm mes,10mm mgcl2)。调od600至0.4,室温静置2h。一次性注射器将溶液注射烟草叶片(生长4w左右),以psak277空载体为阴性对照,暗室培养12h,再移入26℃,16h光照和8h黑暗的光周期下进行培养。
21.3、超量表达tf72354基因的烟草叶片中花青素合成相关基因表达模式分析。
22.烟草叶片注射3天时,可观察到同时注射stan2和tf72354的叶片中有花青素积累,但是比单独注射stan2的叶片颜色浅(图1)。说明tf72354可以协同stan2调控花青素的合成。收集注射样品,提取烟草叶片总rna,用real
‑
time pcr技术检测花青素合成相关基因的表达,以注射psak277空载体的叶片为对照。检测tf72354基因表达量的正向引物为5'
‑ꢀ
aacaacacaaggaggcaagt
‑3’
,反向引物为5'
‑ꢀ
gttgaccagcttgtgactga
‑
3';检测stan2基因表达量的正向引物为5'
‑ꢀ
ggccacatatcaagagaggtgactttg
‑3’
,反向引物为5'
‑ꢀ
tcacatcgttagctgtccttcctgg
‑
3';检测ntdfr基因表达量的正向引物为5'
‑
aaccaacagtcaggggaatg
‑3’
,反向引物为5'
‑
ttggacatcgacagttccag
‑
3';检测ntans基因表达量的正向引物为5'
‑
tggcgttgaagctcatactg
‑3’
,反向引物为5'
‑
ggaattaggcacacactttgc
‑
3';检测ntchs基因表达量的正向引物为5'
‑
ttgttcgagcttgtctctgc
‑3’
,反向引物为5'
‑
agcccaggaacatctttgag
‑
3';检测ntchi基因表达量的正向引物为5'
‑
gtcaggccattgaaaagctc
‑3’
,反向引物为5'
‑
ctaatcgtcaatgccccaac
‑
3';检测ntf3h基因表达量的正向引物为5'
‑
caaggcatgtgtggatatgg
‑3’
,反向引物为5'
‑
tgtgtcgtttcagtccaagg
‑
3';检测ntf3’h基因表达量的正向引物为5'
‑ꢀ
aggctcaacacttctcgt
‑3’
,反向引物为5'
‑ꢀ
catcaactttgggcttct
‑
3';检测ntufgt基因表达量的正向引物为5'
‑ꢀ
gagtgcattggatgcctttt
‑3’
,反向引物为5'
‑ꢀ
ccagctccattaggtccttg
‑
3';内参基因ntef正向引物为5'
‑
tgaaccatccakgacagattgg,反向引物为5'
‑ꢀ
tgggctccttctcaatctcctt
‑3’
。 pcr反应在bio
‑
rad 公司的icycler iq5 real
‑
time pcr 仪上进行。用2
‑△△
ct
法对不同样品中基因的相对表达量进行规一化。结果显示,共同注射stan2和tf72354的叶片中stan2基因的表达量低于只注射stan2的叶片,并且tf72354基因的表达量低于只注射tf72354的叶片(图2a)。共同注射stan2和tf72354的叶片中结构基因ntdfr、ntans、ntchs、ntchi、ntf3h、ntf3’h和ntufgt的表达量要显著低于单独注射stan2的叶片(图2b和2c)。这些结果说明tf72354基因可以与stan2相互协调,降低酶基因ntdfr、ntans、ntchs、ntchi、ntf3h、ntf3’h和ntufgt的表达量,从而调控烟草叶片花青素的合成与累积。
23.4、在马铃薯中超量表达tf72354基因。
24.将含有tf72354基因表达载体质粒的农杆菌gv3101接种于含50 mg/l spe和50 mg/l rif的yeb培养基中,于28℃、240 r/min摇床上培养至od600为0.5左右。于5000 r/min离心6 min,其沉淀用ms液体培养基重新悬浮。将生长8
‑
12周、直径约为0.5 cm的desiree试管薯切成1
‑
2 mm的薄片,在上述农杆菌菌液中浸泡5
‑
10 min,取出后用无菌滤纸吸干表面菌液,转入共培养基(ms 0.2 mg/l iaa 0.5 mg/l 6ba 0.2 mg/l ga3 2 mg/l zt),于26℃暗培养2 d后转移到再生培养基(ms 0.1 mg/l iaa 2 mg/l zt 50 mg/l kan 200 mg/l cef),置于光照强度2000 lx、光周期16 h/d、温度23
±
1℃的条件下培养。3
‑
4周后,从试管薯薄片中央长出抗性芽,当抗性芽长达0.5
‑
1 cm时,将其切下转入生根培养基(ms 50mg/l kan 200mg/l cef)上诱导生根,从而获得完整植株。
25.5、超量表达tf72354基因的马铃薯块茎中花青素含量分析。
26.为了验证tf72354基因在马铃薯块茎花青素合成中的功能,将转基因株系(oe
‑
1,oe
‑
3和oe
‑
4)和对照(desiree)同时种植在同一个大棚中,管理条件是相同的。收获的块茎20℃避光保存7天,观察到转基因株系块茎表皮红色比对照浅(图3),花青素含量低于对照(图4)。说明tf72354可以调控马铃薯块茎花青素的合成。收集块茎表皮样品,采用分光光度ph示差法测定花青素含量。取0.5g左右样品与10ml 甲醇盐酸溶液(甲醇与0.05mol/l的盐酸按85:15的比例混匀)混匀,50度水浴2h。将浸提液移到另一15毫升离心管中,在滤渣中加入5ml甲醇盐酸溶液,50度水浴2h,合并2次提取液。提取液7000r/min离心10分钟,收集上清液,定容为25ml。上清液用注射器过滤膜(0.45um)过滤,用来做实验样品。1ml样品分别用3ml 0.025mol/l kcl
‑
hcl 溶液(ph 1.0)和3ml 0.4mol/l 醋酸钠溶液(ph4.5)稀释,然后颜色反应30分钟。分别测定530和700 nm的吸光度。
27.6、超量表达tf72354基因的马铃薯块茎中花青素合成相关基因表达模式分析。
28.提取转基因株系薯皮总rna,用real
‑
time pcr技术检测花青素合成相关基因的表达。检测stchs基因表达量的正向引物为5'
‑
gcgaaggtgctattgatg
‑3’
,反向引物为5'
‑
aatgcctattggttggaatg
‑
3';检测stf3h基因表达量的正向引物为5'
‑ꢀ
gaggttcaagaatgctgat
‑3’
,反向引物为5'
‑ꢀ
tgtaatcggctcatccat
‑
3';检测stdfr基因表达量的正向引物为5'
‑ꢀ
tgctaagaagatgacaggat
‑3’
,反向引物为5'
‑ꢀ
gtggtggtatgatgctaatg
‑
3';检测stans基因表达量的正向引物为5'
‑ꢀ
atggtgagtgaagtggtt
‑3’
,反向引物为5'
‑ꢀ
ccttgtcctctgagttga
‑
3';内参基因ef正向引物为5'
‑ꢀ
attggaaacggatatgctcca,反向引物为5'
‑ꢀ
tccttacctgaacgcctgtca
‑3’
。结果显示,与对照相比,转基因块茎中tf72354表达量显著提高,而stan2基因表达量显著降低(图5),花青素合成相关酶基因stchs,stf3h,stdfr和stans表达量显著降低(图6),说明tf72354通过影响stan2和相关酶基因的表达调控块茎花青素的合成。
29.需要说明的是,以上所述的实施方案应理解为说明性的,而非限制本发明的保护范围,本发明的保护范围以权利要求书为准。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对本发明作出的一些非本质的改进和调整仍属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

