a0201复合物的活性。
10.在本发明的一个优选例中,所述t细胞受体包含tcrα链可变域和tcrβ链可变域,其中,其具有结合ymldlqpet-hla a0201复合物的活性,并且所述tcr的α链可变域包含与seq id no:1所示的序列有至少90%序列同源性的氨基酸序列和所述tcrβ链可变域包含与seq id no:2所示的序列有至少90%序列同源性的氨基酸序列。
11.在另一优选例中,所述tcr与ymldlqpet-hla a0201复合物的亲和力是野生型tcr的至少2倍。
12.在另一优选例中,所述tcr的α链可变域包含与seq id no:1所示的序列有至少91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同源性的氨基酸序列。
13.在另一优选例中,所述tcr的β链可变域为与seq id no:2所示的序列有至少91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同源性的氨基酸序列。
14.在另一优选例中,所述tcr的α链可变域包含与seq id no:1所示的序列有至少96%序列同源性的氨基酸序列。
15.在另一优选例中,所述tcr的β链可变域包含与seq id no:2所示的序列有至少97%序列同源性的氨基酸序列。
16.在另一优选例中,所述tcrα链可变域的3个cdr区的基准序列如下,
17.cdr1α:atgyps
18.cdr2α:atkaddk
19.cdr3α:alynqggkli,并且cdr3α含有至少一个下列突变:
20.突变前的残基突变后的残基cdr3α的第4位nl或a或vcdr3α的第5位qf或y或wcdr3α的第6位gn或s或d或a或v或t或h或mcdr3α的第7位ga或n或s或fcdr3α的第8位kv或r或l或i或m或q或s或n
21.在另一优选例中,所述tcrα链可变域中,cdr3α的氨基酸突变个数为2个或3个或4个。
22.在另一优选例中,所述tcrβ链可变域的3个cdr区的基准序列如下:
23.cdr1α:atgyps
24.cdr2α:atkaddk
25.cdr3α:alynqggkli,并且cdr3α含有至少一个下列突变:
26.突变前的残基突变后的残基cdr3α的第4位nlcdr3α的第5位qf或ycdr3α的第6位gn或scdr3α的第7位ga或n或scdr3α的第8位kv或r或l
27.在另一优选例中,所述tcrα链可变域的3个cdr区的基准序列如下,
28.cdr1α:atgyps
29.cdr2α:atkaddk
30.cdr3α:alynqggkli,并且cdr3α含有至少一个下列突变:
31.突变前的残基突变后的残基cdr3α的第4位nl或a或vcdr3α的第5位qf或y或wcdr3α的第6位gn或s或d或a或v或t或h或mcdr3α的第7位ga或n或s或fcdr3α的第8位kv或r或l或i或m或q或s或n
32.并且,所述tcr的β链可变域包含与seq id no:2所示的序列有至少97%序列同源性的氨基酸序列。
33.在另一优选例中,所述tcrα链可变域的3个cdr区的基准序列如下:
34.cdr1α:atgyps
35.cdr2α:atkaddk
36.cdr3α:alynqggkli,并且cdr3α含有至少一个下列突变:
37.突变前的残基突变后的残基cdr3α的第4位nl或a或vcdr3α的第5位qf或y或wcdr3α的第6位gn或s或d或a或v或t或h或mcdr3α的第7位ga或n或s或fcdr3α的第8位kv或r或l或i或m或q或s或n
38.并且,所述tcrβ链可变域的3个cdr区如下:
39.cdr1β:sghta
40.cdr2β:fqgtga和
41.cdr3β:assllagsyeqy。
42.在另一优选例中,所述tcrα链可变域的3个cdr区的基准序列如下:
43.cdr1α:atgyps
44.cdr2α:atkaddk
45.cdr3α:alynqggkli,并且cdr3α含有至少一个下列突变:
46.突变前的残基突变后的残基cdr3α的第4位nl或a或vcdr3α的第5位qf或y或wcdr3α的第6位gn或s或d或a或v或t或h或mcdr3α的第7位ga或n或s或fcdr3α的第8位kv或r或l或i或m或q或s或n
47.并且,所述tcrβ链可变域的氨基酸序列为seq id no:2。
48.在另一优选例中,所述tcrβ链可变域的3个cdr区的基准序列如下,
49.cdr1β:sghta
50.cdr2β:fqgtga
51.cdr3β:assllagsyeqy,并且cdr3β含有至少一个下列突变:
52.突变前的残基突变后的残基cdr3β的第10位ey或mcdr3β的第11位qv或lcdr3β的第12位ys或e
53.在另一优选例中,所述tcrβ链可变域包含3个cdr区,所述tcrβ链可变域的3个cdr区的氨基酸序列如下:
54.cdr1β:sghta
55.cdr2β:fqgtga和
56.cdr3β:assllagsyeqy
57.在另一优选例中,所述tcrβ链可变域的氨基酸序列为seq id no:2。
58.在另一优选例中,所述tcrα链可变域包含3个cdr区,其中cdr1α为atgyps,并且cdr2α为atkaddk。
59.在另一优选例中,所述tcrα链可变域包含cdr1α、cdr2α和cdr3α,其中cdr1α的氨基酸序列为atgyps,cdr2α的氨基酸序列为atkaddk,并且cdr3α的氨基酸序列为:aly[3αx1][3αx2][3αx3][3αx4][3αx5]li,其中[3αx1]为n或l或a或v,[3αx2]为q或f或y或w,[3αx3]为g或n或s或d或a或v或t或h或m,[3αx4]为g或a或n或s或f,和[3αx5]为k或v或r或l或i或m或q或s或n。
[0060]
在另一优选例中,所述tcrα链可变域包含cdr1α、cdr2α和cdr3α,其中cdr1α的氨基酸序列为atgyps,cdr2α的氨基酸序列为atkaddk,并且cdr3α的氨基酸序列为:aly[3αx1][3αx2][3αx3][3αx4][3αx5]li,其中[3αx1]为n或l或a或v。
[0061]
在另一优选例中,所述tcrα链可变域包含cdr1α、cdr2α和cdr3α,其中cdr1α的氨基酸序列为atgyps,cdr2α的氨基酸序列为atkaddk,并且cdr3α的氨基酸序列为:aly[3αx1][3αx2][3αx3][3αx4][3αx5]li,其中[3αx2]为q或f或y或w。
[0062]
在另一优选例中,所述tcrα链可变域包含cdr1α、cdr2α和cdr3α,其中cdr1α的氨基酸序列为atgyps,cdr2α的氨基酸序列为atkaddk,并且cdr3α的氨基酸序列为:aly[3αx1][3αx2][3αx3][3αx4][3αx5]li,其中[3αx3]为g或n或s或d或a或v或t或h或m。
[0063]
在另一优选例中,所述tcrα链可变域包含cdr1α、cdr2α和cdr3α,其中cdr1α的氨基酸序列为atgyps,cdr2α的氨基酸序列为atkaddk,并且cdr3α的氨基酸序列为:aly[3αx1][3αx2][3αx3][3αx4][3αx5]li,其中[3αx4]为g或a或n或s或f。
[0064]
在另一优选例中,所述tcrα链可变域包含cdr1α、cdr2α和cdr3α,其中cdr1α的氨基酸序列为atgyps,cdr2α的氨基酸序列为atkaddk,并且cdr3α的氨基酸序列为:aly[3αx1][3αx2][3αx3][3αx4][3αx5]li,其中[3αx5]为k或v或r或l或i或m或q或s或n。
[0065]
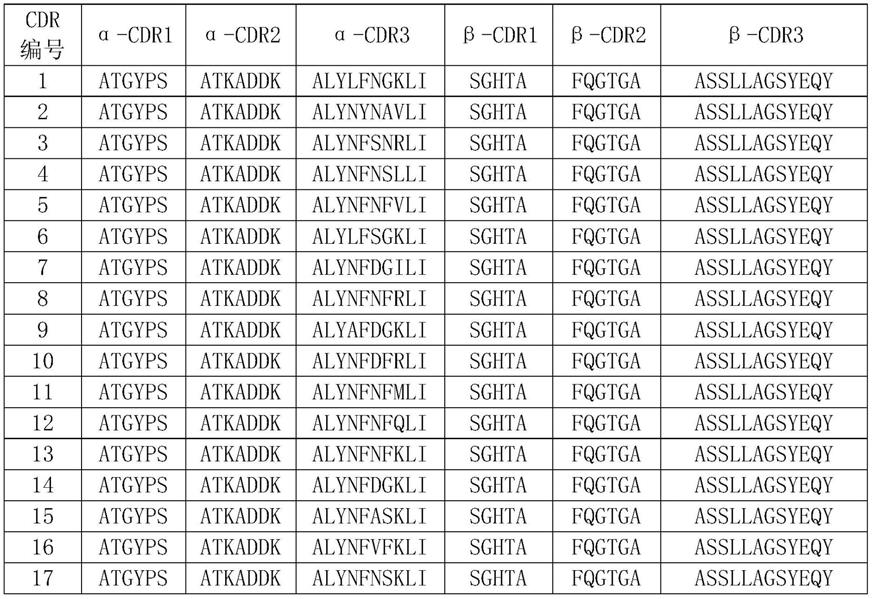
在另一优选例中,所述cdr3α的氨基酸序列选自:alylfngkli、alynynavli、alynfsnrli和alynfnslli。
[0066]
在另一优选例中,所述tcrβ链可变域包含cdr1β、cdr2β和cdr3β,其中cdr1β的氨基酸序列为sghta,cdr2β的氨基酸序列为fqgtga,并且cdr3β的氨基酸序列为:assllagsy[3βx1][3βx2][3βx3],其中[3βx1]为e或y或m,[3βx2]为q或v或l,[3βx3]为y或e或s。
[0067]
在另一优选例中,所述tcrβ链可变域包含cdr1β、cdr2β和cdr3β,其中cdr1β的氨基
酸序列为sghta,cdr2β的氨基酸序列为fqgtga,并且cdr3β的氨基酸序列为:assllagsy[3βx1][3βx2][3βx3],其中[3βx1]为e或y或m。
[0068]
在另一优选例中,所述tcrβ链可变域包含cdr1β、cdr2β和cdr3β,其中cdr1β的氨基酸序列为sghta,cdr2β的氨基酸序列为fqgtga,并且cdr3β的氨基酸序列为:assllagsy[3βx1][3βx2][3βx3],其中[3βx2]为q或v或l。
[0069]
在另一优选例中,所述tcrβ链可变域包含cdr1β、cdr2β和cdr3β,其中cdr1β的氨基酸序列为sghta,cdr2β的氨基酸序列为fqgtga,并且cdr3β的氨基酸序列为:assllagsy[3βx1][3βx2][3βx3],其中[3βx3]为y或e或s。
[0070]
在另一优选例中,所述tcr在seq id no:1所示的α链可变域中发生突变,所述突变选自n94l/a/v、q95f/y/w、g96n/s/d/a/v/t/h/m、g97a/n/s/f、k98v/r/l/i/m/q/s/n中的一组或几组,其中,氨基酸残基编号采用seq id no:1所示的编号。
[0071]
在另一优选例中,所述tcr在seq id no:2所示的β链可变域中发生突变,所述突变选自e102y/m、q103v/l、y104s/e中的一组或几组,其中,氨基酸残基编号采用seq id no:2所示的编号。
[0072]
在另一优选例中,所述tcr具有选自下组的cdr:
[0073]
[0074][0075]
在另一优选例中,所述tcr是可溶的。
[0076]
在另一优选例中,所述tcr为αβ异质二聚tcr,包含α链trac恒定区序列和β链trbc1或trbc2恒定区序列。
[0077]
在另一优选例中,所述tcr包含(i)除其跨膜结构域以外的全部或部分tcrα链,和(ii)除其跨膜结构域以外的全部或部分tcrβ链,其中(i)和(ii)均包含tcr链的可变域和至少一部分恒定域。
[0078]
在另一优选例中,所述tcr的α链恒定区与β链恒定区之间含有人工链间二硫键。
[0079]
在另一优选例中,在所述tcrα与β链的恒定区之间形成人工链间二硫键的半胱氨酸残基取代了选自下列的一组或多组位点:
[0080]
trac*01外显子1的thr48和trbc1*01或trbc2*01外显子1的ser57;
[0081]
trac*01外显子1的thr45和trbc1*01或trbc2*01外显子1的ser77;
[0082]
trac*01外显子1的tyr10和trbc1*01或trbc2*01外显子1的ser17;
[0083]
trac*01外显子1的thr45和trbc1*01或trbc2*01外显子1的asp59;
[0084]
trac*01外显子1的ser15和trbc1*01或trbc2*01外显子1的glu15;
[0085]
trac*01外显子1的arg53和trbc1*01或trbc2*01外显子1的ser54;
[0086]
trac*01外显子1的pro89和trbc1*01或trbc2*01外显子1的ala19;
[0087]
和trac*01外显子1的tyr10和trbc1*01或trbc2*01外显子1的glu20。
[0088]
在另一优选例中,所述tcr的α链可变域氨基酸序列选自:seq id no:13-46;和/或所述tcr的β链可变域氨基酸序列为seq id no:2。
[0089]
在另一优选例中,所述tcr选自下组:
[0090][0091]
[0092]
在另一优选例中,所述tcr为单链tcr。
[0093]
在另一优选例中,所述tcr是由α链可变域和β链可变域组成的单链tcr,所述α链可变域和β链可变域由一柔性短肽序列(linker)连接。
[0094]
在另一优选例中,所述tcr的α链和/或β链的c-或n-末端结合有偶联物,优选地,所述偶联物为可检测标记物、治疗剂、pk修饰部分或任何这些物质的组合。
[0095]
在另一优选例中,与所述tcr结合的治疗剂为连接于所述tcr的α或β链的c-或n-末端的抗-cd3抗体。
[0096]
本发明的第二方面,提供了一种多价tcr复合物,包含至少两个tcr分子,并且其中的至少一个tcr分子为本发明第一方面所述的tcr。
[0097]
本发明的第三方面,提供了一种核酸分子,所述核酸分子包含编码本发明第一方面所述的tcr分子或者本发明第二方面所述的多价tcr复合物的核酸序列或其互补序列。
[0098]
本发明的第四方面,提供了一种载体,所述的载体含有本发明第三方面所述的所述的核酸分子。
[0099]
本发明的第五方面,提供了一种宿主细胞,所述的宿主细胞中含有本发明第四方面所述的载体或染色体中整合有外源的本发明第三方面所述的核酸分子。
[0100]
本发明的第六方面,提供了一种分离的细胞,所述细胞表达本发明第一方面所述的tcr。
[0101]
本发明的第七方面,提供了一种药物组合物,所述组合物含有药学上可接受的载体以及本发明第一方面所述的tcr、或本发明第二方面所述的tcr复合物、或本发明第六方面所述的细胞。
[0102]
本发明的第八方面,提供了一种治疗疾病的方法,包括给需要治疗的对象施用适量的本发明第一方面所述的tcr、或本发明第二方面所述的tcr复合物、或本发明第六方面所述的细胞、或本发明第七方面所述的药物组合物,优选地,所述疾病为hpv阳性肿瘤,更优选地,所述肿瘤为宫颈癌。
[0103]
本发明的第九方面,提供了本发明第一方面所述的tcr、或本发明第二方面所述的tcr复合物、或本发明第六方面所述的细胞的用途,用于制备治疗肿瘤的药物,优选地,所述疾病为hpv阳性肿瘤,更优选地,所述肿瘤为宫颈癌。
[0104]
本发明的第十方面,提供了一种制备本发明第一方面所述的t细胞受体的方法,包括步骤:
[0105]
(i)培养本发明第五方面所述的宿主细胞,从而表达本发明第一方面所述的t细胞受体;
[0106]
(ii)分离或纯化出所述的t细胞受体。
[0107]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0108]
图1a和图1b分别显示了对ymldlqpet-hla a0201复合物能够特异性结合的野生型tcrα与β链可变域氨基酸序列。
[0109]
图2a和图2b分别为本发明构建的单链模板tcr的α可变域的氨基酸序列和β链可变域的氨基酸序列。
[0110]
图3a和图3b分别为本发明构建的单链模板tcr的α可变域的dna序列和β链可变域的dna序列。
[0111]
图4a和图4b分别为本发明构建的单链模板tcr的连接短肽(linker)的氨基酸序列和核苷酸序列。
[0112]
图5a和图5b分别为本发明构建的单链模板tcr的氨基酸序列和dna序列。
[0113]
图6a和图6b分别显示了本发明中可溶性参比tcrα与β链的氨基酸序列。
[0114]
图7(1)-(34)分别显示了对ymldlqpet-hla a0201复合物具有高亲和力的异质二聚tcr的α链可变域氨基酸序列,突变的残基以加下划线表示。
[0115]
图8a-c分别显示了对ymldlqpet-hla a0201复合物具有高亲和力的异质二聚tcr的β链可变域氨基酸序列,突变的残基以加下划线表示。
[0116]
图9a和图9b分别显示了对ymldlqpet-hla a0201复合物能够特异性结合的野生型tcrα与β链的胞外氨基酸序列。
[0117]
图10a和图10b分别显示了对ymldlqpet-hla a0201复合物能够特异性结合的野生型tcrα与β链的氨基酸序列。
[0118]
图11为可溶性参比tcr即野生型tcr与ymldlqpet-hla a0201复合物的结合曲线。
[0119]
图12a和图12b为针对负载短肽的t2细胞,转染本发明高亲和力tcr的效应细胞的激活功能实验结果。
[0120]
图13为针对肿瘤细胞系,转染本发明高亲和力tcr的效应细胞的激活功能实验结果。
[0121]
图14为针对负载短肽的t2细胞,转染本发明高亲和力tcr的效应细胞的杀伤功能实验结果。
[0122]
图15为针对肿瘤细胞系,转染本发明高亲和力tcr的效应细胞的杀伤功能实验结果(ldh实验)。
[0123]
图16a和图16b为针对肿瘤细胞系,转染本发明高亲和力tcr的效应细胞的杀伤功能实验结果(incucyte实验)。
具体实施方式
[0124]
本发明通过广泛而深入的研究,获得一种识别ymldlqpet短肽(衍生自hpv16e7蛋白)的高亲和性t细胞受体(tcr),所述ymldlqpet短肽以肽-hla a0201复合物的形式被呈递。所述高亲和性tcr在其α链可变域的3个cdr区:
[0125]
cdr1α:atgyps
[0126]
cdr2α:atkaddk
[0127]
cdr3α:alynqggkli中发生突变;和/或在其β链可变域的3个cdr区:
[0128]
cdr1β:sghta
[0129]
cdr2β:fqgtga
[0130]
cdr3β:assllagsyeqy中发生突变;并且,突变后本发明tcr对上述ymldlqpet-hla a0201复合物的亲和力和/或结合半衰期是野生型tcr的至少2倍。
[0131]
在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且其意图不是限制性的,本发明的范围将仅由所附的权利要求书限制。
[0132]
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。
[0133]
虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
[0134]
术语
[0135]
t细胞受体(t cell receptor,tcr)
[0136]
可以采用国际免疫遗传学信息系统(imgt)来描述tcr。天然αβ异源二聚tcr具有α链和β链。广义上讲,各链包含可变区、连接区和恒定区,β链通常还在可变区和连接区之间含有短的多变区,但该多变区常视作连接区的一部分。通过独特的imgt的traj和trbj确定tcr的连接区,通过imgt的trac和trbc确定tcr的恒定区。
[0137]
各可变区包含嵌合在框架序列中的3个cdr(互补决定区),cdr1、cdr2和cdr3。在imgt命名法中,trav和trbv的不同编号分别指代不同vα类型和vβ的类型。在imgt系统中,α链恒定结构域具有以下的符号:trac*01,其中“tr”表示t细胞受体基因;“a”表示α链基因;c表示恒定区;“*01”表示等位基因1。β链恒定结构域具有以下的符号:trbc1*01或trbc2*01,其中“tr”表示t细胞受体基因;“b”表示β链基因;c表示恒定区;“*01”表示等位基因1。α链的恒定区是唯一确定的,在β链的形式中,存在两个可能的恒定区基因“c1”和“c2”。本领域技术人员通过公开的imgt数据库可以获得tcrα与β链的恒定区基因序列。
[0138]
tcr的α和β链一般看作各有两个“结构域”即可变域和恒定结构域。可变域由连接的可变区和连接区构成。因此,在本技术的说明书和权利要求书中,“tcrα链可变域”指连接的trav和traj区,同样地,“tcrβ链可变域”指连接的trbv和trbd/trbj区。tcrα链可变域的3个cdr分别为cdr1α、cdr2α和cdr3α;tcrβ链可变域的3个cdr分别为cdr1β、cdr2β和cdr3β。本发明tcr可变域的框架序列可以为鼠源的或人源的,优选为人源的。tcr的恒定结构域包含胞内部分、跨膜区和胞外部分。
[0139]
本发明中,能够结合ymldlqpet-hla a0201复合物的野生型tcr的α与β链可变域氨基酸序列分别为seq id no:1和seq id no:2,如图1a和图1b所示。本发明中所述可溶性“参比tcr”的α链氨基酸序列及β链氨基酸序列分别为seq id no:11和seq id no:12,如图6a和图6b所示。本发明中所述“野生型tcr”的α链胞外氨基酸序列及β链胞外氨基酸序列分别为seq id no:50和seq id no:51,如图9a和图9b所示。本发明中所用的tcr序列为人源的。本发明中所述“野生型tcr”的α链氨基酸序列及β链氨基酸序列分别为seq id no:52和seq id no:53,如图10a和10b所示。在本发明中,术语“本发明多肽”、“本发明的tcr”、“本发明的t细胞受体”可互换使用。
[0140]
天然链间二硫键与人工链间二硫键
[0141]
在天然tcr的近膜区cα与cβ链间存在一组二硫键,本发明中称为“天然链间二硫键”。在本发明中,将人工引入的,位置与天然链间二硫键的位置不同的链间共价二硫键称为“人工链间二硫键”。
[0142]
为方便描述,本发明中trac*01与trbc1*01或trbc2*01氨基酸序列的位置编号按
从n端到c端依次的顺序进行位置编号,如trbc1*01或trbc2*01中,按从n端到c端依次的顺序第60个氨基酸为p(脯氨酸),则本发明中可将其描述为trbc1*01或trbc2*01外显子1的pro60,也可将其表述为trbc1*01或trbc2*01外显子1的第60位氨基酸,又如trbc1*01或trbc2*01中,按从n端到c端依次的顺序第61个氨基酸为q(谷氨酰胺),则本发明中可将其描述为trbc1*01或trbc2*01外显子1的gln61,也可将其表述为trbc1*01或trbc2*01外显子1的第61位氨基酸,其他以此类推。本发明中,可变区trav与trbv的氨基酸序列的位置编号,按照imgt中列出的位置编号。如trav中的某个氨基酸,imgt中列出的位置编号为46,则本发明中将其描述为trav第46位氨基酸,其他以此类推。本发明中,其他氨基酸的序列位置编号有特殊说明的,则按特殊说明。
[0143]
肿瘤
[0144]
术语“肿瘤”指包括所有类型的癌细胞生长或致癌过程,转移性组织或恶性转化细胞、组织或器官,不管病理类型或侵染的阶段。肿瘤的实施例非限制性地包括:实体瘤,软组织瘤,和转移性病灶。实体瘤的实施例包括:不同器官系统的恶性肿瘤,例如肉瘤,肺鳞癌和癌症。例如:感染的前列腺,肺,乳房,淋巴,肠胃(例如:结肠),和生殖泌尿道(例如:肾脏,上皮细胞),咽头。肺鳞癌包括恶性肿瘤,例如,多数的结肠癌,直肠癌,肾细胞癌,肝癌,肺部的非小细胞癌,小肠癌和食道癌。上述癌症的转移性病变可同样用本发明的方法和组合物来治疗和预防。
[0145]
发明详述
[0146]
众所周知,tcr的α链可变域与β链可变域各含有3个cdr,类似于抗体的互补决定区。cdr3与抗原短肽相互作用,cdr1和cdr2与hla相互作用。因此,tcr分子的cdr决定了其与抗原短肽-hla复合物的相互作用。能够结合抗原短肽ymldlqpet与hla a0201复合物(即,ymldlqpet-hla a0201复合物)的野生型tcr的α链可变域氨基酸序列与β链可变域氨基酸序列分别为seq id no:1和seq id no:2,该序列为本发明人首次发现。其具有下列cdr区:
[0147]
α链可变域cdr cdr1α:atgyps
[0148]
cdr2α:atkaddk
[0149]
cdr3α:alynqggkli
[0150]
和β链可变域cdr cdr1β:sghta
[0151]
cdr2β:fqgtga和
[0152]
cdr3β:assllagsyeqy。
[0153]
本发明通过对上述cdr区进行突变筛选,获得了与ymldlqpet-hla a0201复合物的亲和力是野生型tcr与ymldlqpet-hla a0201复合物亲和力至少2倍的高亲和力tcr。
[0154]
本发明提供了一种t细胞受体(tcr),其具有结合ymldlqpet-hla a0201复合物的活性。
[0155]
所述t细胞受体包含tcrα链可变域和tcrβ链可变域,所述tcrα链可变域包含3个cdr区,所述tcrα链可变域的3个cdr区的基准序列如下,
[0156]
cdr1α:atgyps
[0157]
cdr2α:atkaddk
[0158]
cdr3α:alynqggkli,并且cdr3α含有至少一个下列突变:
[0159]
突变前的残基突变后的残基
cdr3α的第4位nl或a或vcdr3α的第5位qf或y或wcdr3α的第6位gn或s或d或a或v或t或h或mcdr3α的第7位ga或n或s或fcdr3α的第8位kv或r或l或i或m或q或s或n
[0160]
并且,所述tcrβ链可变域的3个cdr区如下:
[0161]
cdr1β:sghta
[0162]
cdr2β:fqgtga和
[0163]
cdr3β:assllagsyeqy。
[0164]
更详细地,所述tcrα链cdr区的氨基酸突变个数可以为2个或3个或4个。
[0165]
进一步,本发明所述tcr是αβ异质二聚tcr,所述tcr的α链可变域包含与seq id no:1所示的氨基酸序列有至少85%;优选地,至少90%;更优选地,至少92%;更优选地,至少94%(如,可以是至少88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同源性)的序列同源性的氨基酸序列;和/或所述tcr的β链可变域包含与seq id no:2所示的氨基酸序列有至少90%,优选地,至少92%;更优选地,至少94%(如,可以是至少91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同源性)的序列同源性的氨基酸序列。
[0166]
进一步,本发明所述tcr是单链tcr,所述tcr的α链可变域包含与seq id no:3所示的氨基酸序列有至少85%,优选地,至少90%;更优选地,至少92%;最优选地,至少94%(如,可以是至少88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同源性)的序列同源性的氨基酸序列;和/或所述tcr的β链可变域包含与seq id no:4所示的氨基酸序列有至少85%,优选地,至少90%;更优选地,至少92%;最优选地,至少94%;(如,可以是至少91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同源性)的序列同源性的氨基酸序列。
[0167]
本发明中野生型tcrα链可变域seq id no:1的3个cdr即cdr1、cdr2和cdr3分别位于seq id no:1的第27-32位、第50-56位和第91-100位。据此,氨基酸残基编号采用seq id no:1所示的编号,94n即为cdr3α的第4位n、95q即为cdr3α的第5位q、96g即为cdr3α的第6位g、97g即为cdr3α的第7位g,98k即为cdr3α的第8位k。
[0168]
本发明提供具有结合ymldlqpet-hla a0201复合物的特性的tcr,并包含α链可变域和β链可变域,其特征在于,所述tcr在seq id no:1所示的α链可变域中发生突变,所述突变的氨基酸残基位点包括94n、95q、96g、97g和98k中的一个或多个,其中,氨基酸残基编号采用seq id no:1所示的编号。
[0169]
优选地,突变后的所述tcrα链可变域包括选自下组的一个或多个氨基酸残基:94l或94a或94v;95f或95y或95w;96n或96s或96d或96a或96v或96t或96h或96m;97a或97n或97s或97f;98v或98r或98l或98i或98m或98q或98s或98n,其中,氨基酸残基编号采用seq id no:1所示的编号。
[0170]
更具体地,α链可变域中所述突变的具体形式包括n94l/a/v、q95f/y/w、g96n/s/d/a/v/t/h/m、g97a/n/s/f、k98v/r/l/i/m/q/s/n中的一组或几组。
[0171]
本发明中野生型tcrβ链可变域seq id no:2的3个cdr即cdr1、cdr2和cdr3分别位
于seq id no:2的第27-31位、第49-54位和第93-104位。据此,氨基酸残基编号采用seq id no:2所示的编号,102e即为cdr3β的第10位e、103q即为cdr3β的第11位q、104y即为cdr3β的第12位y。
[0172]
本发明提供具有结合ymldlqpet-hla a0201复合物的特性的tcr,并包含β链可变域和β链可变域,其特征在于,所述tcr在seq id no:2所示的β链可变域中发生突变,所述突变的氨基酸残基位点包括102e、103q和104y中的一个或多个,其中,氨基酸残基编号采用seq id no:2所示的编号。
[0173]
优选地,突变后的所述tcrβ链可变域包括选自下组的一个或多个氨基酸残基:102y或102m、103v或103l、104s或104e,其中,氨基酸残基编号采用seq id no:2所示的编号。
[0174]
更具体地,β链可变域中所述突变的具体形式包括e102y/m、q103v/l、y104s/e中的一组或几组。
[0175]
根据本领域技术人员熟知的定点突变的方法,将野生型tcrα链恒定区trac*01外显子1的thr48突变为半胱氨酸,β链恒定区trbc1*01或trbc2*01外显子1的ser57突变为半胱氨酸,即得到参比tcr,其氨基酸序列分别为seq id no:11和seq id no:12,如图6a和图6b所示,突变后的半胱氨酸残基以加粗字母表示。上述半胱氨酸取代能使参比tcr的α与β链的恒定区之间形成人工链间二硫键,以形成更加稳定的可溶性tcr,从而能够更加方便地评估tcr与ymldlqpet-hla a0201复合物之间的结合亲和力和/或结合半衰期。应理解,tcr可变区的cdr区决定了其与pmhc复合物之间的亲和力,因此,上述tcr恒定区的半胱氨酸取代并不会对tcr的结合亲和力和/或结合半衰期产生影响。所以,在本发明中,测得的参比tcr与ymldlqpet-hla a0201复合物之间的结合亲和力即认为是野生型tcr与ymldlqpet-hla a0201复合物之间的结合亲和力。同样地,如果测得本发明tcr与ymldlqpet-hla a0201复合物之间的结合亲和力是参比tcr与ymldlqpet-hla a0201复合物之间的结合亲和力的至少10倍,即等同于本发明tcr与ymldlqpet-hla a0201复合物之间的结合亲和力是野生型tcr与ymldlqpet-hla a0201复合物之间的结合亲和力的至少10倍。
[0176]
可通过任何合适的方法测定结合亲和力(与解离平衡常数k
d
成反比)和结合半衰期(表示为t
1/2
),如采用表面等离子共振技术进行检测。应了解,tcr的亲和力翻倍将导致k
d
减半。t
1/2
计算为in2除以解离速率(k
off
)。因此,t
1/2
翻倍会导致k
off
减半。优选采用相同的试验方案检测给定tcr的结合亲和力或结合半衰期数次,例如3次或更多,取结果的平均值。在优选的实施方式中,采用本文实施例中的表面等离振子共振(biacore)方法检测可溶性tcr的亲和力,条件为:温度25℃,ph值为7.1-7.5。该方法检测到参比tcr对ymldlqpet-hla a0201复合物的解离平衡常数k
d
为6.31e-05m,即63.1μm,本发明中即认为野生型tcr对ymldlqpet-hla a0201复合物的解离平衡常数k
d
也为63.1μm。由于tcr的亲和力翻倍将导致k
d
减半,所以若检测到高亲和力tcr对ymldlqpet-hla a0201复合物的解离平衡常数k
d
为6.31e-06m,即6.31μm,则说明该高亲和力tcr对ymldlqpet-hla a0201复合物的亲和力是野生型tcr对ymldlqpet-hla a0201复合物的亲和力的10倍。本领域技术人员熟知k
d
值单位间的换算关系,即1m=106μm,,1μm=1000nm,1nm=1000pm。在本发明中,所述tcr与ymldlqpet-hla a0201复合物的亲和力是野生型tcr的至少2倍;优选地,至少5倍;更优选地,至少10倍。
[0177]
可采用任何合适的方法进行突变,包括但不限于依据聚合酶链式反应(pcr)的那些、依据限制性酶的克隆或不依赖连接的克隆(lic)方法。许多标准分子生物学教材详述了这些方法。聚合酶链式反应(pcr)诱变和依据限制性酶的克隆的更多细节可参见sambrook和russell,(2001)分子克隆-实验室手册(molecular cloning-a laboratory manual)(第三版)cshl出版社。lic方法的更多信息可见(rashtchian,(1995)curr opin biotechnol 6(1):30-6)。
[0178]
产生本发明的tcr的方法可以是但不限于从展示此类tcr的噬菌体颗粒的多样性文库中筛选出对ymldlqpet-hla-a0201复合物具有高亲和性的tcr,如文献(li,et al(2005)nature biotech 23(3):349-354)中所述。
[0179]
应理解,表达野生型tcrα和β链可变域氨基酸的基因或者表达略作修饰的野生型tcr的α和β链可变域氨基酸的基因都可用来制备模板tcr。然后在编码该模板tcr的可变域的dna中引入产生本发明的高亲和力tcr所需的改变。
[0180]
本发明的高亲和性tcr包含α链可变域氨基酸序列seq id no:13-46之一和/或β链可变域氨基酸序列seq id no:2。本发明中,形成异质二聚tcr分子的α链可变域与β链可变域的氨基酸序列优选自下表1:
[0181]
表1
[0182]
[0183][0184]
基于本发明的目的,本发明tcr是具有至少一个tcrα和/或tcrβ链可变域的部分。它们通常同时包含tcrα链可变域和tcrβ链可变域。它们可以是αβ异源二聚体或是单链形式或是其他任何能够稳定存在的形式。在过继性免疫治疗中,可将αβ异源二聚tcr的全长链(包含胞质和跨膜结构域)进行转染。本发明tcr可用作将治疗剂递送至抗原呈递细胞的靶向剂或与其他分子结合制备双功能多肽来定向效应细胞,此时tcr优选为可溶形式。
[0185]
对于稳定性而言,现有技术中公开了在tcr的α与β链恒定域之间引入人工链间二硫键能够获得可溶且稳定的tcr分子,如专利文献pct/cn2015/093806中所述。因此,本发明tcr可以是在其α和β链恒定域的残基之间引入人工链间二硫键的tcr。半胱氨酸残基在所述tcr的α和β链恒定域间形成人工链间二硫键。半胱氨酸残基可以取代在天然tcr中合适位点的其他氨基酸残基以形成人工链间二硫键。例如,取代trac*01外显子1的thr48和取代trbc1*01或trbc2*01外显子1的ser57来形成二硫键。引入半胱氨酸残基以形成二硫键的其他位点还可以是:trac*01外显子1的thr45和trbc1*01或trbc2*01外显子1的ser77;trac*01外显子1的tyr10和trbc1*01或trbc2*01外显子1的ser17;trac*01外显子1的thr45和trbc1*01或trbc2*01外显子1的asp59;trac*01外显子1的ser15和trbc1*01或trbc2*01外显子1的glu15;trac*01外显子1的arg53和trbc1*01或trbc2*01外显子1的ser54;trac*01外显子1的pro89和trbc1*01或trbc2*01外显子1的ala19;或trac*01外显子1的tyr10和trbc1*01或trbc2*01外显子1的glu20。即半胱氨酸残基取代了上述α与β链恒定域中任一组位点。可在本发明tcr恒定域的一个或多个c末端截短最多15个、或最多10个、或最多8个或更少的氨基酸,以使其不包括半胱氨酸残基来达到缺失天然链间二硫键的目的,也可通过将形成天然链间二硫键的半胱氨酸残基突变为另一氨基酸来达到上述目的。
[0186]
如上所述,本发明的tcr可以包含在其α和β链恒定域的残基间引入的人工链间二硫键。应注意,恒定域间含或不含上文所述的引入的人工二硫键,本发明的tcr均可含有
trac恒定域序列和trbc1或trbc2恒定域序列。tcr的trac恒定域序列和trbc1或trbc2恒定域序列可通过存在于tcr中的天然链间二硫键连接。
[0187]
另外,对于稳定性而言,专利文献pct/cn2016/077680还公开了在tcr的α链可变区与β链恒定区之间引入人工链间二硫键能够使tcr的稳定性显著提高。因此,本发明的高亲和力tcr的α链可变区与β链恒定区之间还可以含有人工链间二硫键。具体地,在所述tcr的α链可变区与β链恒定区之间形成人工链间二硫键的半胱氨酸残基取代了:trav的第46位氨基酸和trbc1*01或trbc2*01外显子1的第60位氨基酸;trav的第47位氨基酸和trbc1*01或trbc2*01外显子1的61位氨基酸;trav的第46位氨基酸和trbc1*01或trbc2*01外显子1的第61位氨基酸;或trav的第47位氨基酸和trbc1*01或trbc2*01外显子1的第60位氨基酸。优选地,这样的tcr可以包含(
ⅰ
)除其跨膜结构域以外的全部或部分tcrα链,和(
ⅱ
)除其跨膜结构域以外的全部或部分tcrβ链,其中(
ⅰ
)和(
ⅱ
)均包含tcr链的可变域和至少一部分恒定域,α链与β链形成异质二聚体。更优选地,这样的tcr可以包含α链可变域和β链可变域以及除跨膜结构域以外的全部或部分β链恒定域,但其不包含α链恒定域,所述tcr的α链可变域与β链形成异质二聚体。
[0188]
对于稳定性而言,另一方面,本发明tcr还包括在其疏水芯区域发生突变的tcr,这些疏水芯区域的突变优选为能够使本发明tcr的稳定性提高的突变,如在公开号为wo2014/206304的专利文献中所述。这样的tcr可在其下列可变域疏水芯位置发生突变:(α和/或β链)可变区氨基酸第11,13,19,21,53,76,89,91,94位,和/或α链j基因(traj)短肽氨基酸位置倒数第3,5,7位,和/或β链j基因(trbj)短肽氨基酸位置倒数第2,4,6位,其中氨基酸序列的位置编号按国际免疫遗传学信息系统(imgt)中列出的位置编号。本领域技术人员知晓上述国际免疫遗传学信息系统,并可根据该数据库得到不同tcr的氨基酸残基在imgt中的位置编号。
[0189]
更具体地,本发明中疏水芯区域发生突变的tcr可以是由一柔性肽链连接tcr的α与β链的可变域而构成的高稳定性单链tcr。tcr可变区的cdr区决定了其与短肽-hla复合物之间的亲和力,疏水芯的突变能够使tcr更加稳定,但并不会影响其与短肽-hla复合物之间的亲和力。应注意,本发明中柔性肽链可以是任何适合连接tcrα与β链可变域的肽链。本发明实施例1中构建的用于筛选高亲和性tcr的模板链即为上述含有疏水芯突变的高稳定性单链tcr。采用稳定性较高的tcr,能够更方便的评估tcr与ymldlqpet-hla-a0201复合物之间的亲和力。
[0190]
该单链模板tcr的α链可变域及β链可变域的cdr区与野生型tcr的cdr区完全相同。即α链可变域的3个cdr分别为cdr1α:atgyps;cdr2α:atkaddk;cdr3α:alynqggkli和β链可变域的3个cdr分别为cdr1β:sghta;cdr2β:fqgtga;cdr3β:assllagsyeqy。该单链模板tcr的氨基酸序列(seq id no:9)及核苷酸序列(seq id no:10)分别如图5a和5b所示。以此筛选出对ymldlqpet-hla a0201复合物具有高亲和性的由α链可变域和β链可变域构成的单链tcr。
[0191]
本发明的对ymldlqpet-hla-a0201复合物具有高亲和性的αβ异质二聚体的获得是通过将筛选出的高亲和性单链tcr的α与β链可变域的cdr区转移到野生型tcrα链可变域(seq id no:1)与β链可变域(seq id no:2)的相应位置而得到。
[0192]
本发明的tcr也可以多价复合体的形式提供。本发明的多价tcr复合体包含两个、三个、四个或更多个本发明tcr相结合而形成的多聚物,如可以用p53的四聚结构域来产生
四聚体,或多个本发明tcr与另一分子结合而形成的复合物。本发明的tcr复合物可用于体外或体内追踪或靶向呈递特定抗原的细胞,也可用于产生具有此类应用的其他多价tcr复合物的中间体。
[0193]
本发明的tcr可以单独使用,也可与偶联物以共价或其他方式结合,优选以共价方式结合。所述偶联物包括可检测标记物(为诊断目的,其中所述tcr用于检测呈递ymldlqpet-hla-a0201复合物的细胞的存在)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。
[0194]
用于诊断目的的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。
[0195]
可与本发明tcr结合或偶联的治疗剂包括但不限于:1.放射性核素(koppe等,2005,癌转移评论(cancer metastasis reviews)24,539);2.生物毒(chaudhary等,1989,自然(nature)339,394;epel等,2002,癌症免疫学和免疫治疗(cancer immunology and immunotherapy)51,565);3.细胞因子如il-2等(gillies等,1992,美国国家科学院院刊(pnas)89,1428;card等,2004,癌症免疫学和免疫治疗(cancer immunology and immunotherapy)53,345;halin等,2003,癌症研究(cancer research)63,3202);4.抗体fc片段(mosquera等,2005,免疫学杂志(the journal of immunology)174,4381);5.抗体scfv片段(zhu等,1995,癌症国际期刊(international journal of cancer)62,319);6.金纳米颗粒/纳米棒(lapotko等,2005,癌症通信(cancer letters)239,36;huang等,2006,美国化学学会杂志(journal of the american chemical society)128,2115);7.病毒颗粒(peng等,2004,基因治疗(gene therapy)11,1234);8.脂质体(mamot等,2005,癌症研究(cancer research)65,11631);9.纳米磁粒;10.前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl));11.化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
[0196]
与本发明tcr结合的抗体或其片段包括抗-t细胞或nk-细胞决定抗体,如抗-cd3或抗-cd28或抗-cd16抗体,上述抗体或其片段与tcr的结合能够对效应细胞进行定向来更好地靶向靶细胞。一个优选的实施方式是本发明tcr与抗-cd3抗体或所述抗-cd3抗体的功能片段或变体结合。具体地,本发明的tcr与抗cd3单链抗体的融合分子包括选自tcrα链可变域氨基酸序列seq id no:13-46之一,和tcrβ链可变域氨基酸序列seq id no:2。
[0197]
本发明还涉及编码本发明tcr的核酸分子。本发明的核酸分子可以是dna形式或rna形式。dna可以是编码链或非编码链。例如,编码本发明tcr的核酸序列可以与本发明附图中所示的核酸序列相同或是简并的变异体。举例说明“简并的变异体”的含义,如本文所用,“简并的变异体”在本发明中是指编码具有seq id no:3的蛋白序列,但与seq id no:5的序列有差别的核酸序列。
[0198]
本发明的核酸分子全长序列或其片段通常可以用但不限于pcr扩增法、重组法或人工合成的方法获得。目前,已经可以完全通过化学合成来得到编码本发明tcr(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。
[0199]
本发明也涉及包含本发明的核酸分子的载体,以及用本发明的载体或编码序列经基因工程产生的宿主细胞。
[0200]
本发明还包括表达本发明tcr的分离细胞,特别是t细胞。有许多方法适合于用编码本发明的高亲和力tcr的dna或rna进行t细胞转染(如,robbins等.,(2008)j.immunol.180:6116-6131)。表达本发明高亲和性tcr的t细胞可以用于过继免疫治疗。本领域技术人员能够知晓进行过继性治疗的许多合适方法(如,rosenberg等.,(2008)nat rev cancer8(4):299-308)。
[0201]
本发明还提供一种药物组合物,所述药物组合物含有药学上可接受的载体以及本发明tcr、或本发明tcr复合物、或呈递本发明tcr的细胞。
[0202]
本发明还提供了一种治疗疾病的方法,包括给需要治疗的对象施用适量的本发明tcr、或本发明tcr复合物、或呈递本发明tcr的细胞、或本发明的药物组合物。
[0203]
应理解,本文中氨基酸名称采用国际通用的单英文字母标识,与其相对应的氨基酸名称三英文字母简写分别是:ala(a)、arg(r)、asn(n)、asp(d)、cys(c)、gln(q)、glu(e)、gly(g)、his(h)、ile(i)、leu(l)、lys(k)、met(m)、phe(f)、pro(p)、ser(s)、thr(t)、trp(w)、tyr(y)、val(v);
[0204]
本发明中,pro60或者60p均表示第60位脯氨酸。另外,本发明中所述突变的具体形式的表述方式如“n93d”代表第93位的n被d取代,同理,“n93d/e”代表第93位的n被d取代或被e取代。其他以此类推。
[0205]
在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的结构和功能。因此,本发明tcr还包括本发明tcr的至多5个,较佳地至多3个,更佳地至多2个,最佳地1个氨基酸(尤其是位于cdr区之外的氨基酸),被性质相似或相近的氨基酸所替换,并仍能够保持其功能性的tcr。
[0206]
本发明还包括对本发明tcr略作修饰后的tcr。修饰(通常不改变一级结构)形式包括:本发明tcr的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在本发明tcr的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的tcr。这种修饰可以通过将tcr暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的tcr。
[0207]
本发明的tcr、tcr复合物或本发明tcr转染的t细胞可与药学上可接受的载体一起在药物组合物中提供。本发明的tcr、多价tcr复合物或细胞通常作为无菌药物组合物的一部分提供,所述组合物通常包括药学上可接受的载体。该药物组合物可以是任何合适的形式(取决于给予患者的所需方法)。其可采用单位剂型提供,通常在密封的容器中提供,可作为试剂盒的一部分提供。此类试剂盒(但非必需)包括使用说明书。其可包括多个所述单位剂型。
[0208]
此外,本发明的tcr可以单用,也可与其他治疗剂结合或偶联在一起使用(如配制在同一药物组合物中)。
[0209]
药物组合物还可含有药学上可接受的载体。术语“药学上可接受的载体”指用于治疗剂给药的载体。该术语指这样一些药剂载体:它们本身不诱导产生对接受该组合物的个体有害的抗体,且给药后没有过分的毒性。这些载体是本领域普通技术人员所熟知的。在雷明顿药物科学(remington's pharmaceutical sciences(mack pub.co.,n.j.1991))中可
找到关于药学上可接受的赋形剂的充分讨论。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、佐剂、及其组合。
[0210]
治疗性组合物中药学上可接受的载体可含有液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如润湿剂或乳化剂、ph缓冲物质等。
[0211]
通常,可将治疗性组合物制成可注射剂,例如液体溶液或悬液;还可制成在注射前适合配入溶液或悬液中、液体载体的固体形式。
[0212]
一旦配成本发明的组合物,可将其通过常规途径进行给药,其中包括(但并不限于):眼内、肌内、静脉内、皮下、皮内、或局部给药,优选为胃肠外包括皮下、肌肉内或静脉内。待预防或治疗的对象可以是动物;尤其是人。
[0213]
当本发明的药物组合物被用于实际治疗时,可根据使用情况而采用各种不同剂型的药物组合物。较佳地,可以例举的有针剂、口服剂等。
[0214]
这些药物组合物可根据常规方法通过混合、稀释或溶解而进行配制,并且偶尔添加合适的药物添加剂,如赋形剂、崩解剂、粘合剂、润滑剂、稀释剂、缓冲剂、等渗剂(isotonicities)、防腐剂、润湿剂、乳化剂、分散剂、稳定剂和助溶剂,而且该配制过程可根据剂型用惯常方式进行。
[0215]
本发明的药物组合物还可以缓释剂形式给药。例如,本发明tcr可被掺入以缓释聚合物为载体的药丸或微囊中,然后将该药丸或微囊通过手术植入待治疗的组织。作为缓释聚合物的例子,可例举的有乙烯-乙烯基乙酸酯共聚物、聚羟基甲基丙烯酸酯(polyhydrometaacrylate)、聚丙烯酰胺、聚乙烯吡咯烷酮、甲基纤维素、乳酸聚合物、乳酸-乙醇酸共聚物等,较佳地可例举的是可生物降解的聚合物如乳酸聚合物和乳酸-乙醇酸共聚物。
[0216]
当本发明的药物组合物被用于实际治疗时,作为活性成分的本发明tcr或tcr复合物或呈递本发明tcr的细胞,可根据待治疗的每个病人的体重、年龄、性别、症状程度而合理地加以确定,最终由医师决定合理的用量。
[0217]
本发明的主要优点在于:
[0218]
(1)本发明的高亲和力tcr对所述ymldlqpet-hla-a0201复合物的亲和力和/或结合半衰期是野生型tcr的至少2倍,优选地,至少5倍,更优选地,至少10倍。
[0219]
(2)本发明的高亲和力tcr能够与所述ymldlqpet-hla a0201特异性结合,同时转染了本发明高亲和力tcr的细胞能够被特异性激活与增殖。
[0220]
(3)转染本发明的高亲和力tcr的效应细胞对靶细胞有很强的杀伤作用。
[0221]
下面的具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如(sambrook和russell等人,分子克隆:实验室手册(molecular cloning-a laboratory manual)(第三版)(2001)cshl出版社)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0222]
材料和方法
[0223]
本发明实施例中所用的实验材料如无特殊说明均可从市售渠道获得,其中,e.coli dh5α购自tiangen、e.coli bl21(de3)购自tiangen、e.coli tuner(de3)购自novagen、质粒pet28a购自novagen。
[0224]
实施例1疏水芯突变的稳定性单链tcr模板链的产生
[0225]
本发明利用定点突变的方法,根据专利文献wo2014/206304中所述,构建了以一个柔性短肽(linker)连接tcrα与β链可变域而构成的稳定性单链tcr分子,其氨基酸及dna序列分别为seq id no:9和seq id no:10,如图5a和图5b所示。并以该单链tcr分子为模板进行高亲和性tcr分子的筛选。该模板链的α可变域(seq id no:3)及β可变域(seq id no:4)的氨基酸序列如图2a和2b所示;其对应的dna序列分别为seq id no:5和6,如图3a和3b所示;柔性短肽(linker)的氨基酸序列及dna序列分别为seq id no:7和8,如图4a和4b所示。
[0226]
将携带模板链的目的基因经ncoⅰ和notⅰ双酶切,与经过ncoⅰ和notⅰ双酶切的pet28a载体连接。连接产物转化至e.coli dh5α,涂布含卡那霉素的lb平板,37℃倒置培养过夜,挑取阳性克隆进行pcr筛选,对阳性重组子进行测序,确定序列正确后抽提重组质粒转化至e.coli bl21(de3),用于表达。
[0227]
实施例2实施例1中构建的稳定性单链tcr的表达、复性和纯化
[0228]
将实施例1中制备的含有重组质粒pet28a-模板链的bl21(de 3)菌落全部接种于含有卡那霉素的lb培养基中,37℃培养至od
600
为0.6-0.8,加入iptg至终浓度为0.5mm,37℃继续培养4h。5000rpm离心15min收获细胞沉淀物,用bugbuster master mix(merck)裂解细胞沉淀物,6000rpm离心15min回收包涵体,再用bugbuster(merck)进行洗涤以除去细胞碎片和膜组分,6000rpm离心15min,收集包涵体。将包涵体溶解在缓冲液(20mm tris-hcl ph 8.0,8m尿素)中,高速离心去除不溶物,上清液用bca法定量后进行分装,于-80℃保存备用。
[0229]
向5mg溶解的单链tcr包涵体蛋白中,加入2.5ml缓冲液(6m gua-hcl,50mm tris-hcl ph 8.1,100mm nacl,10mm edta),再加入dtt至终浓度为10mm,37℃处理30min。用注射器向125ml复性缓冲液(100mm tris-hcl ph8.1,0.4m l-精氨酸,5m尿素,2mm edta,6.5mmβ-mercapthoethylamine,1.87mm cystamine)中滴加上述处理后的单链tcr,4℃搅拌10min,然后将复性液装入截留量为4kda的纤维素膜透析袋,透析袋置于1l预冷的水中,4℃缓慢搅拌过夜。17小时后,将透析液换成1l预冷的缓冲液(20mm tris-hcl ph 8.0),4℃继续透析8h,然后将透析液换成相同的新鲜缓冲液继续透析过夜。17小时后,样品经0.45μm滤膜过滤,真空脱气后通过阴离子交换柱(hitrap q hp,ge healthcare),用20mm tris-hcl ph 8.0配制的0-1m nacl线性梯度洗脱液纯化蛋白,收集的洗脱组分进行sds-page分析,包含单链tcr的组分浓缩后进一步用凝胶过滤柱(superdex 75 10/300,ge healthcare)进行纯化,目标组分也进行sds-page分析。
[0230]
用于biacore分析的洗脱组分进一步采用凝胶过滤法测试其纯度。条件为:色谱柱agilent bio sec-3(300a,φ7.8
×
300mm),流动相为150mm磷酸盐缓冲液,流速0.5ml/min,柱温25℃,紫外检测波长214nm。
[0231]
实施例3结合表征
[0232]
biacore分析
[0233]
使用biacore t200实时分析系统检测tcr分子与ymldlqpet-hla-a0201复合物的结合活性。将抗链霉亲和素的抗体(genscript)加入偶联缓冲液(10mm醋酸钠缓冲液,ph 4.77),然后将抗体流过预先用edc和nhs活化过的cm5芯片,使抗体固定在芯片表面,最后用乙醇胺的盐酸溶液封闭未反应的活化表面,完成偶联过程,偶联水平约为15,000ru。条件为:温度25℃,ph值为7.1-7.5。
[0234]
使低浓度的链霉亲和素流过已包被抗体的芯片表面,然后将ymldlqpet-hla-a0201复合物流过检测通道,另一通道作为参比通道,再将0.05mm的生物素以10μl/min的流速流过芯片2min,封闭链霉亲和素剩余的结合位点。采用单循环动力学分析方法测定其亲和力,将tcr用hepes-ep缓冲液(10mm hepes,150mm nacl,3mm edta,0.005%p20,ph 7.4)稀释成几个不同的浓度,以30μl/min的流速,依次流过芯片表面,每次进样的结合时间为120s,最后一次进样结束后让其解离600s。每一轮测定结束后用ph 1.75的10mm gly-hcl再生芯片。利用biacore evaluation软件计算动力学参数。
[0235]
上述ymldlqpet-hla-a0201复合物的制备过程如下:
[0236]
a.纯化:收集100ml诱导表达重链或轻链的e.coli菌液,于4℃8000g离心10min后用10ml pbs洗涤菌体一次,之后用5ml bugbuster master mix extraction reagents(merck)剧烈震荡重悬菌体,并于室温旋转孵育20min,之后于4℃,6000g离心15min,弃去上清,收集包涵体。
[0237]
将上述包涵体重悬于5ml bugbuster master mix中,室温旋转孵育5min;加30ml稀释10倍的bugbuster,混匀,4℃6000g离心15min;弃去上清,加30ml稀释10倍的bugbuster重悬包涵体,混匀,4℃6000g离心15min,重复两次,加30ml 20mm tris-hcl ph 8.0重悬包涵体,混匀,4℃6000g离心15min,最后用20mm tris-hcl 8m尿素溶解包涵体,sds-page检测包涵体纯度,bca试剂盒测浓度。
[0238]
b.复性:将合成的短肽ymldlqpet(北京赛百盛基因技术有限公司)溶解于dmso至20mg/ml的浓度。轻链和重链的包涵体用8m尿素、20mm tris ph 8.0、10mm dtt来溶解,复性前加入3m盐酸胍、10mm醋酸钠、10mm edta进一步变性。将ymldlqpet肽以25mg/l(终浓度)加入复性缓冲液(0.4m l-精氨酸、100mm tris ph 8.3、2mm edta、0.5mm氧化性谷胱甘肽、5mm还原型谷胱甘肽、0.2mm pmsf,冷却至4℃),然后依次加入20mg/l的轻链和90mg/l的重链(终浓度,重链分三次加入,8h/次),复性在4℃进行至少3天至完成,sds-page检测能否复性成功。
[0239]
c.复性后纯化:用10体积的20mm tris ph 8.0作透析来更换复性缓冲液,至少更换缓冲液两次来充分降低溶液的离子强度。透析后用0.45μm醋酸纤维素滤膜过滤蛋白质溶液,然后加载到hitrap q hp(ge通用电气公司)阴离子交换柱上(5ml床体积)。利用akta纯化仪(ge通用电气公司),20mm tris ph 8.0配制的0-400mm nacl线性梯度液洗脱蛋白,pmhc约在250mm nacl处洗脱,收集诸峰组分,sds-page检测纯度。
[0240]
d.生物素化:用millipore超滤管将纯化的pmhc分子浓缩,同时将缓冲液置换为20mm tris ph 8.0,然后加入生物素化试剂0.05m bicine ph 8.3、10mm atp、10mm mgoac、50μm d-biotin、100μg/ml bira酶(gst-bira),室温孵育混合物过夜,sds-page检测生物素化是否完全。
[0241]
e.纯化生物素化后的复合物:用millipore超滤管将生物素化标记后的pmhc分子浓缩至1ml,采用凝胶过滤层析纯化生物素化的pmhc,利用akta纯化仪(ge通用电气公司),用过滤过的pbs预平衡hiprep
tm 16/60s200 hr柱(ge通用电气公司),加载1ml浓缩过的生物素化pmhc分子,然后用pbs以1ml/min流速洗脱。生物素化的pmhc分子在约55ml时作为单峰洗脱出现。合并含有蛋白质的组分,用millipore超滤管浓缩,bca法(thermo)测定蛋白质浓度,加入蛋白酶抑制剂cocktail(roche)将生物素化的pmhc分子分装保存在-80℃。
[0242]
实施例4高亲和力tcr的产生
[0243]
噬菌体展示技术是产生tcr高亲和力变体文库以筛选高亲和力变体的一种手段。将li等((2005)nature biotech 23(3):349-354)描述的tcr噬菌体展示和筛选方法应用于实施例1中的单链tcr模板。通过突变该模板链的cdr区来建立高亲和性tcr的文库并进行淘选。经过几轮淘选后的噬菌体文库均和相应抗原有特异性结合,从中挑取单克隆,并进行分析。
[0244]
将筛选到的高亲和力的单链tcr的cdr区突变引入到αβ异质二聚tcr的可变域的相应位点中,并通过biacore来检测其与ymldlqpet-hla-a0201复合物的亲和力。上述cdr区高亲和力突变点的引入采用本领域技术人员熟知的定点突变的方法。上述野生型tcr的α链与β链可变域氨基酸序列分别如图1a(seq id no:1)和1b(seq id no:2)所示。
[0245]
应注意,为获得更加稳定的可溶性tcr,以便更方便地评估tcr与ymldlqpet-hla a0201复合物之间的结合亲和力和/或结合半衰期,αβ异质二聚tcr可以是在α和β链的恒定区中分别引入了一个半胱氨酸残基以形成人工链间二硫键的tcr,本实施例中引入半胱氨酸残基后tcrα与β链的氨基酸序列分别如图6a(seq id no:11)和6b所示(seq id no:12),引入的半胱氨酸残基以加粗字母表示。
[0246]
通过《分子克隆实验室手册》(molecular cloning a laboratory manual)(第三版,sambrook和russell)中描述的标准方法将待表达的tcrα和β链的胞外序列基因经合成后分别插入到表达载体pet28a (novagene),上下游的克隆位点分别是ncoi和noti。cdr区的突变通过本领域技术人员熟知的重叠pcr(overlap pcr)引入。插入片段经过测序确认无误。
[0247]
实施例5高亲和力tcr的表达、复性和纯化
[0248]
将tcrα和β链的表达载体分别通过化学转化法转化进入表达细菌bl21(de3),细菌用lb培养液生长,于od
600
=0.6时用终浓度0.5mm iptg诱导,tcr的α和β链表达后形成的包涵体通过bugbuster mix(novagene)进行提取,并且经bugbuster溶液反复多次洗涤,包涵体最后溶解于6m盐酸胍,10mm二硫苏糖醇(dtt),10mm乙二胺四乙酸(edta),20mm tris(ph 8.1)中。
[0249]
溶解后的tcrα和β链以1:1的质量比快速混合于5m尿素,0.4m精氨酸,20mm tris(ph 8.1),3.7mm cystamine,6.6mmβ-mercapoethylamine(4℃)中,终浓度为60mg/ml。混合后将溶液置于10倍体积的去离子水中透析(4℃),12小时后将去离子水换成缓冲液(20mm tris,ph 8.0)继续于4℃透析12小时。透析完成后的溶液经0.45μm的滤膜过滤后,通过阴离子交换柱(hitrap q hp,5ml,ge healthcare)纯化。洗脱峰含有复性成功的α和β二聚体的tcr通过sds-page胶确认。tcr随后通过凝胶过滤层析(hiprep 16/60,sephacryl s-100hr,ge healthcare)进一步纯化。纯化后的tcr纯度经过sds-page测定大于90%,浓度由bca法确定。
[0250]
实施例6biacore分析结果
[0251]
采用实施例3中所述方法检测引入高亲和力cdr区的αβ异质二聚tcr与ymldlqpet-hla-a0201复合物的亲和力。
[0252]
本发明得到高亲和力tcrα和β链可变域氨基酸序列,分别如图7(1)-图7(34)和图8a-c所示。由于tcr分子的cdr区决定了其与相应的pmhc复合物的亲和力,所以本领域技术
人员能够预料引入高亲和力突变点的αβ异质二聚tcr也具有对ymldlqpet-hla-a0201复合物的高亲和力。利用实施例4中所述方法构建表达载体,利用实施例5中所述方法对上述引入高亲和力突变的αβ异质二聚tcr进行表达、复性和纯化,然后利用biacore t200测定其与ymldlqpet-hla-a0201复合物的亲和力,如下表2所示。
[0253]
表2
[0254]
[0255][0256]
由上表2可知,所述异质二聚tcr的亲和力是野生型tcr对ymldlqpet-hla-a0201复合物的亲和力的至少2倍。
[0257]
实施例7抗-cd3抗体与高亲和性αβ异质二聚tcr的融合体的表达、复性和纯化
[0258]
将抗-cd3的单链抗体(scfv)与αβ异质二聚tcr融合,制备融合分子。抗-cd3的scfv与tcr的β链融合,该tcrβ链可以包含任一上述高亲和性αβ异质二聚tcr的β链可变域,融合
分子的tcrα链可以包含任一上述高亲和性αβ异质二聚tcr的α链可变域。
[0259]
融合分子表达载体的构建
[0260]
1.α链表达载体的构建:将携带αβ异质二聚tcr的α链的目的基因经ncoⅰ和notⅰ双酶切,与经过ncoⅰ和notⅰ双酶切的pet28a载体连接。连接产物转化至e.coli dh5α,涂布于含卡那霉素的lb平板,37℃倒置培养过夜,挑取阳性克隆进行pcr筛选,对阳性重组子进行测序,确定序列正确后抽提重组质粒转化至e.coli tuner(de3),用于表达。
[0261]
2.抗-cd3(scfv)-β链表达载体的构建:通过重叠(overlap)pcr的方法,设计引物将抗-cd3 scfv和高亲和性异质二聚tcrβ链基因连接起来,中间的连接短肽(linker)为ggggs(seq id no:31),并且使抗-cd3的scfv与高亲和性异质二聚tcrβ链的融合蛋白的基因片段带上限制性内切酶位点ncoⅰ(ccatgg(seq id no:32))和notⅰ(gcggccgc(seq id no:33))。将pcr扩增产物经ncoⅰ和notⅰ双酶切,与经过ncoⅰ和notⅰ双酶切的pet28a载体连接。连接产物转化至e.coli dh5α感受态细胞,涂布含卡那霉素的lb平板,37℃倒置培养过夜,挑取阳性克隆进行pcr筛选,对阳性重组子进行测序,确定序列正确后抽提重组质粒转化至e.coli tuner(de3)感受态细胞,用于表达。
[0262]
融合蛋白的表达、复性及纯化
[0263]
将表达质粒分别转化进入e.coli tuner(de3)感受态细胞,涂布lb平板(卡那霉素50μg/ml)置于37℃培养过夜。次日,挑克隆接种至10ml lb液体培养基(卡那霉素50μg/ml)培养2-3h,按体积比1:100接种至1l lb培养基中,继续培养至od600为0.5-0.8,加入终浓度为1mm iptg诱导目的蛋白的表达。诱导4小时以后,以6000rpm离心10min收获细胞。pbs缓冲液洗涤菌体一次,并且分装菌体,取相当于200ml的细菌培养物的菌体用5ml bugbuster master mix(merck)裂解细菌,以6000g离心15min收集包涵体。然后进行4次洗涤剂洗涤以去除细胞碎片和膜组分。然后,用缓冲液如pbs洗涤包涵体以除去洗涤剂和盐。最终,将包涵体用含6m盐酸胍,10mm二硫苏糖醇(dtt),10mm乙二胺四乙酸(edta),20mm tris,ph 8.1缓冲溶液溶解,并测定包涵体浓度,将其分装后置于-80℃冷冻保存。
[0264]
溶解后的tcrα链和抗-cd3(scfv)-β链以2:5的质量比快速混合于5m尿素(urea),0.4m l-精氨酸(l-arginine),20mm tris ph 8.1,3.7mm cystamine,6.6mmβ-mercapoethylamine(4℃),终浓度α链和抗-cd3(scfv)-β链分别为0.1mg/ml,0.25mg/ml。
[0265]
混合后将溶液置于10倍体积的去离子水中透析(4℃),12小时后将去离子水换成缓冲液(10mm tris,ph 8.0)继续于4℃透析12小时。透析完成后的溶液经0.45μm的滤膜过滤后,通过阴离子交换柱(hitrap q hp 5ml,ge healthcare)纯化。洗脱峰含有复性成功的tcrα链与抗-cd3(scfv)-β链二聚体的tcr通过sds-page胶确认。tcr融合分子随后通过尺寸排阻色谱法(s-100 16/60,ge healthcare)进一步纯化,以及阴离子交换柱(hitrap q hp 5ml,ge healthcare)再次纯化。纯化后的tcr融合分子纯度经过sds-page测定大于90%,浓度由bca法测定。
[0266]
实施例8针对负载短肽的t2细胞,转染本发明高亲和力tcr的效应细胞的激活功能实验
[0267]
本实施例验证了转染本发明高亲和力tcr的效应细胞对靶细胞有很好的特异性激活作用。通过本领域技术人员熟知的elispot实验检测本发明高亲和力tcr在细胞中的功能及特异性。随机选择本发明高亲和力tcr转染从健康志愿者的血液中分离到的cd3 t细胞作
为效应细胞,并以同一志愿者转染野生型tcr(wt-tcr)和转染其他tcr(a6)的cd3 t细胞作为对照组。所用的靶细胞为负载了hpv16 e7抗原短肽ymldlqpet的t2细胞,并以负载了其他短肽的t2细胞、空载的t2细胞作为对照组。
[0268]
将以下两个tcr批次(ⅰ)、(ⅱ)先后进行实验:
[0269]
(ⅰ)所述高亲和力tcr以及其编号从表2获悉,分别为tcr1(α链可变域seq id no:13,β链可变域seq id no:2)、tcr9(α链可变域seq id no:21,β链可变域seq id no:2)、tcr3(α链可变域seq id no:15,β链可变域seq id no:2)、tcr10(α链可变域seq id no:22,β链可变域seq id no:2)、tcr11(α链可变域seq id no:23,β链可变域seq id no:2)、tcr12(α链可变域seq id no:24,β链可变域seq id no:2)、tcr14(α链可变域seq id no:26,β链可变域seq id no:2)、tcr4(α链可变域seq id no:16,β链可变域seq id no:2)、tcr15(α链可变域seq id no:27,β链可变域seq id no:2)、tcr23(α链可变域seq id no:32,β链可变域seq id no:2)、tcr2(α链可变域seq id no:14,β链可变域seq id no:2)、tcr18(α链可变域seq id no:30,β链可变域seq id no:2)、tcr19(α链可变域seq id no:1,β链可变域seq id no:47)和tcr21(α链可变域seq id no:1,β链可变域seq id no:49)。
[0270]
(ⅱ)所述高亲和力tcr以及其编号从表2获悉,分别为tcr6(α链可变域seq id no:18,β链可变域seq id no:2)、tcr16(α链可变域seq id no:28,β链可变域seq id no:2)、tcr22(α链可变域seq id no:31,β链可变域seq id no:2)、tcr7(α链可变域seq id no:19,β链可变域seq id no:2)和tcr5(α链可变域seq id no:17,β链可变域seq id no:2)。
[0271]
上述的两批次均进行以下实验步骤:首先准备elispot平板。elispot平板乙醇活化包被,4℃过夜。实验第1天,去掉包被液,洗涤封闭,室温下孵育两个小时,去除封闭液,将试验的各个组分加入elispot平板:靶细胞为1*104个/孔,效应细胞为2*103个/孔(按转染的阳性率计算),并设置二个复孔。加入对应短肽,使短肽在elispot孔板中的终浓度为1
×
10-6
m。温育过夜(37℃,5%co2)。实验第2天,洗涤平板并进行二级检测和显色,干燥平板,再利用免疫斑点平板读数计(elispot reader system;aid20公司)计数膜上形成的斑点。
[0272]
实验结果如图12a和图12b所示,针对负载了hpv16 e7抗原短肽的靶细胞,转染本发明高亲和力tcr的t细胞相比于转染野生型的t细胞起更明显的激活反应,而转染其他tcr的t细胞无激活状态;同时,转染本发明高亲和力tcr的t细胞未被负载其他短肽或空载的t2细胞激活。
[0273]
实施例9针对肿瘤细胞系,转染本发明高亲和力tcr的效应细胞的激活功能实验
[0274]
本实施例同样验证了转染本发明高亲和力tcr的效应细胞对靶细胞有很好的特异性激活作用。通过本领域技术人员熟知的elispot实验检测本发明高亲和力tcr在细胞中的功能及特异性。随机选择本发明高亲和力tcr转染从健康志愿者的血液中分离到的cd3 t细胞作为效应细胞,并以同一志愿者转染其他tcr(a6)的cd3 t细胞作为对照组。其中所述高亲和力tcr以及其编号从表2获悉,分别为tcr2(α链可变域seq id no:14,β链可变域seq id no:2)、tcr6(α链可变域seq id no:18,β链可变域seq id no:2)、tcr16(α链可变域seq id no:28,β链可变域seq id no:2)、tcr5(α链可变域seq id no:17,β链可变域seq id no:2)和tcr8(α链可变域seq id no:20,β链可变域seq id no:2)。在本实验使用的肿瘤细胞系中,a375-e7(hpv16 e7过表达)为阳性肿瘤细胞系,而a375、hccc9810、sk-mel-1、kato-iii细胞为阴性肿瘤细胞系,作为对照。
[0275]
首先准备elispot平板。elispot平板乙醇活化包被,4℃过夜。实验第1天,去掉包被液,洗涤封闭,室温下孵育两个小时,去除封闭液,按以下顺序将试验的各个组分加入elispot平板:靶细胞为2*104个/孔,效应细胞为2*103个/孔(按转染的阳性率计算),并设置二个复孔。温育过夜(37℃,5%co2)。实验第2天,洗涤平板并进行二级检测和显色,干燥平板,再利用免疫斑点平板读数计(elispot reader system;aid20公司)计数膜上形成的斑点。
[0276]
实验结果如图13所示,转染本发明高亲和力tcr的效应细胞能够很好地被阳性肿瘤细胞系激活,而针对阴性靶细胞,转染本发明高亲和力tcr的效应细胞基本没有激活效应;转染其他tcr的效应细胞不能被激活。
[0277]
实施例10针对梯度负载短肽的t2细胞,转染本发明高亲和力tcr的效应细胞的杀伤功能实验
[0278]
本实施例通过本领域技术人员熟知的非放射性细胞毒性实验,测定ldh的释放,从而验证转染本发明tcr的细胞的杀伤功能。该试验是51cr释放细胞毒性试验的比色替代试验,定量测定细胞裂解后释放的乳酸脱氢酶(ldh)。采用30分钟偶联的酶反应来检测释放在培养基中的ldh,在酶反应中ldh可使一种四唑盐(int)转化为红色的甲臜(formazan)。生成的红色产物的量与裂解的细胞数成正比。可以用标准的96孔读板计收集490nm可见光吸光值数据。计算公式:%细胞毒性=100
×
(实验-效应细胞自发-靶细胞自发)/(靶细胞最大-靶细胞自发)
[0279]
本实施例ldh实验用从健康志愿者的血液中分离到的cd3 t细胞转染本发明高亲和力tcr作为效应细胞,并以同一志愿者转染野生型tcr(wt-tcr)和转染其他tcr(a6)的cd3 t细胞作为对照组。其中所述高亲和力tcr以及其编号从表2获悉,分别为tcr1(α链可变域seq id no:13,β链可变域seq id no:2)、tcr3(α链可变域seq id no:15,β链可变域seq id no:2)、tcr4(α链可变域seq id no:16,β链可变域seq id no:2)和tcr2(α链可变域seq id no:14,β链可变域seq id no:2)。而靶细胞为负载ymldlqpet肽的t2细胞,同时以负载其他抗原和空载的t2细胞作为对照。
[0280]
首先准备ldh平板,先按靶细胞3*104个细胞/孔、效应细胞3*104个细胞/孔加如对应中,然后在实验组加入hpv16 e7抗原短肽ymldlqpet,且使其短肽在elispot孔板中的终浓度依次为1
×
10-15
m到1
×
10-8
m,共8个梯度;在对照组加入其他短肽,且使其短肽终浓度为依次为1
×
10-8
m到1
×
10-6
m,共3个梯度,并设置三个复孔。同时设置效应细胞自发孔,靶细胞自发孔,靶细胞最大孔,体积校正对照孔及培养基背景对照孔。温育过夜(37℃,5%co2)。实验第2天,检测显色,终止反应后用酶标仪(bioteck)在490nm记录吸光值。
[0281]
实验结果如图14所示,针对梯度负载hpv16 e7抗原短肽ymldlqpet的t2细胞,转染本发明高亲和力tcr的效应细胞有很强的杀伤功能,且在上述短肽浓度较低时即起反应,而转染其他tcr的效应细胞自始无杀伤效应;同时,转染本发明高亲和力tcr的效应细胞对负载其他短肽的靶细胞无杀伤作用。
[0282]
实施例11针对肿瘤细胞系,转染本发明高亲和力tcr的效应细胞的杀伤功能实验(ldh实验)
[0283]
本实施例同样通过本领域技术人员熟知的非放射性细胞毒性实验,测定ldh的释放,从而验证转染本发明tcr的细胞的杀伤功能。
[0284]
本实施例ldh实验用从健康志愿者的血液中分离到的cd3 t细胞转染本发明高亲和力tcr作为效应细胞,并以同一志愿者转染野生型tcr(wt-tcr)和转染其他tcr(a6)的cd3 t细胞作为对照组。其中所述高亲和力tcr以及其编号从表2获悉,分别为tcr1(α链可变域seq id no:13,β链可变域seq id no:2)、tcr3(α链可变域seq id no:15,β链可变域seq id no:2)、tcr4(α链可变域seq id no:16,β链可变域seq id no:2)和tcr2(α链可变域seq id no:14,β链可变域seq id no:2)。在本实验使用的靶细胞中,caski为阳性细胞系;而a375和hccc9810为阴性细胞系,作为对照。
[0285]
首先准备ldh平板,按以下顺序将试验的各个组分加入平板:靶细胞25000个细胞/孔、效应细胞20000个细胞/孔加入对应孔中,并设置三个复孔。同时设置效应细胞自发孔,靶细胞自发孔,靶细胞最大孔,体积校正对照孔及培养基背景对照孔。温育过夜(37℃,5%co2)。实验第2天,检测显色,终止反应后用酶标仪(bioteck)在490nm记录吸光值。
[0286]
实验结果如图15所示,转染野生型tcr的细胞对阳性肿瘤细胞系的杀伤可达到20%,转染本发明高亲和力tcr的细胞对阳性肿瘤细胞系的杀伤效力显著增强,而转染其他tcr的效应细胞基本无杀伤效力,同时,转染本发明高亲和力tcr的细胞对不表达相关抗原的靶细胞基本没有杀伤作用。
[0287]
实施例12针对肿瘤细胞系,转染本发明高亲和力tcr分子的效应细胞的杀伤功能验证(incucyte实验)
[0288]
本实施例通过本领域技术人员熟知利用-incucyte实验进一步验证了转染本发明高亲和力tcr的效应细胞对靶细胞有很好的特异性杀伤作用。incucyte是在培养箱中通过实时显微拍摄,能对不同时间点图像进行自动分析,量化实时的细胞凋亡数的功能分析系统。
[0289]
随机选择本发明tcr转染从健康志愿者的血液中分离到的cd3 t细胞,作为效应细胞,并以同一志愿者转染其他tcr(a6)的cd3 t细胞作为对照组。所述tcr以及其编号从表2获悉,分别为tcr1(α链可变域seq id no:13,β链可变域seq id no:2)、tcr2(α链可变域seq id no:14,β链可变域seq id no:2)。靶细胞系中,a375-e7(hpv16 e7过表达)为阳性细胞系;hccc9810为阴性细胞系,作为对照。
[0290]
实验第一天,将靶细胞进行消化处理,离心;用无酚红的rpmi1640 10%fbs的完全培养基重悬,将靶细胞均匀的平铺在96孔板中:2*104个/孔;放回37度,5%co2的培养箱中,孵育过夜;第二天将96孔板中培养基弃掉,换成含有染料caspase3/7reagent的无酚红的rpmi1640 10%fbs培养基,使染料浓度为2滴/ml。弃去旧的培养基,更换新的无酚红的rpmi1640 10%fbs的培养基,将效应细胞2*104个/孔(按转染的阳性率计算)和已铺有靶细胞的实验组进行共孵育;将板子放至incucyte检测专用的实时动态活细胞成像分析仪-incucyte zoom中,孵育半小时后;开始实时观察并拍照;采用incucyte zoom 2016a对检测结果进行处理和数据分析、导出。
[0291]
实验结果如图16a和图16b所示,针对阳性肿瘤细胞系,转染本发明高亲和力tcr的细胞能够在短期内达到强有效的杀伤作用,而转染其他tcr的效应细胞基本无杀伤效力;同时,转染本发明高亲和力tcr的细胞对不表达相关抗原的靶细胞基本没有杀伤作用。
[0292]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可
以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

