检测具有感染性asfv的ema
‑
ddpcr引物、探针及应用
技术领域
1.本发明涉及asfv核酸检测领域,更具体地,涉及检测具有感染性asfv的ema
‑
ddpcr 引物、探针及应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus, asfv)引起的猪的一种急性、热性、高度接触性传染病,发病率和死亡率可达100%。世界动物卫生组织(oie)将其列为法定报告动物疫病,我国将其列为一类动物疫病。1921年, asf最初发现于肯尼亚,上世纪五、六十年代在非洲、欧洲、南美洲流行。由于asfv感染机制复杂,目前世界范围内至今尚无有效预防用非洲猪瘟疫苗,采取严格的生物安全措施清除猪场内已存在的asfv及阻止病毒与猪的接触是目前防控asf唯一有效的途径。因此及时发现、精准检测是控制该病传播和发生的关键。
3.当前,对asfv的核酸检测手段主要是qpcr法,该方法以其较高的特异性及敏感性在 asfv检测方面发挥着重大作用。但该方法只能检测样本中是否存在病毒的核酸序列,对于样本中的病毒是否具有衣壳蛋白完整性和感染性等均不能给出有效提示。研究报道了大量在猪场生产区、生活区、办公区、环境等场所及饲料中出现asfv核酸阳性事件。更加细致的研究发现,这些核酸检测阳性有很多是由于这些场所已进行高温、消毒剂等灭活措施而产生的“假阳性”。经相关研究,猪接触不具备感染性但核酸阳性的asfv样本,并不会引起其感染asfv。但是,大家对asfv核酸阳性产品避之不及,唯恐产品中含asfv,核酸阳性结果势必造成一定的恐慌。同时,假阳性事件严重影响猪场复养前风险评估、日常生物安全监控等结果数据的真实性,延缓本已具备复养条件养殖场的复养时间,影响养殖收益和效率。因此,感染性asfv的检测十分重要。现阶段,感染性asfv检测通常包括病毒分离和红细胞吸附试验(hemoadsorption test,had)。但是目前国内仅有少数机构实验室具有开展 asfv活病毒实验的资质,多数实验室无法进行,这使得活病毒检测实施困难。病毒分离和 had测定需要消耗珍贵的仔猪原代骨髓细胞或肺泡巨噬细胞(porcine alveolar macrophage, pam),也只能检测到具有红细胞吸附特性的asfv毒株,红细胞吸附试验一般需要7
‑
15 天,耗时较长。因此,迫切需要开发一种检测感染性asfv快速简便,准确性、灵敏度高的替代技术。
4.叠氮溴化乙锭(ema)是一种对dna具有高度亲和力的光敏核酸染料,ema不能穿透完整的病毒衣壳蛋白,只能选择性地结合病毒衣壳蛋白受损后所暴露出来的核酸。病毒衣壳蛋白的完整性是判断病毒活性的一个标志,猪场复养前终末消除、日常消毒处理大多使用高温灭活或化学消毒剂灭活等方式进行消毒杀菌,这些灭活方法及化学制剂主要通过破坏病毒衣壳蛋白结构的方式使病毒失活。ema能够穿透受损的病毒衣壳蛋白与病毒核酸结合,在一定条件下孵育、光解后,ema会和暴露的核酸稳定交联使核酸无法进行后续的pcr反应,从而去除失活病毒暴露的核酸所引起的干扰(假阳性),达到检测样本中是否含有感染性病毒的目的。ema
‑
qpcr已在检测食品、环境、水等样品中感染性细菌及病毒中得到了良好的应用。ema抑制衣壳蛋白受损病毒pcr扩增的效率除与ema孵育条件、孵育温度、光解时间
等有关,还与扩增目的片段的长度、靶基因的位置有关。ema进入衣壳蛋白受损的病毒中时,会以一定的化学计量比与病毒核酸结合,理论上靶基因受到ema修饰即可抑制目的片段pcr的扩增,因此较长的目的基因扩增片段会提高与ema结合的概率,从而提高ema抑制效果,然而较长的扩增片段可能会降低pcr反应的扩增效率以及灵敏度。另外,病毒基因组中不同区域、不同位置由于其gc含量、碱基偏好、构象特征不同,其与 ema结合效率也不同。在沙门氏菌ema抑制死细菌效果试验中,选择了相同长度但不同位置的目的基因片段,获得了不同的ema抑制效果。因此,平衡好目的片段长度与ema 抑制效率、筛选出asfv基因组中较为合适的ema结合区域对于检测感染性asfv技术方法的研发至关重要。微滴式数字pcr(droplet digital pcr,ddpcr)是第三代pcr(polymerasechain reaction,聚合酶链式反应)技术,是一种对核酸分子进行绝对定量的方法。其基本原理是将核酸稀释并平均分配到无数个独立的反应单元中,对反应单元中的pcr体系进行 pcr扩增,然后通过pcr终点信号“有或无”来实现不依赖于标准曲线的单分子绝对定量。 ddpcr具有高灵敏度、绝对定量、抗干扰性强的优势。因此,检测感染性asfv的ema
‑
ddpcr 引物和探针及检测方法的建立,不仅能选择性的区分asfv的感染性,还能对样品中的asfv 进行快速、准确的定量检测,为asfv核酸检测开辟新的技术领域。
技术实现要素:
5.本发明的目的在于提供了一种检测基于ema
‑
ddpcr的方法的靶点序列的试剂在制备区分非洲猪瘟病毒核酸阳性与病毒阳性的试剂盒中的应用,所述的靶点序列为seq idno.94所示。
6.本发明的另一个目的在于提供了基于ema
‑
ddpcr的方法设计的引物和探针在制备区分非洲猪瘟病毒核酸阳性与病毒阳性的试剂盒中的应用,所述的引物为:f:cattgccta tgccatccatg和r:acgcaaagtcgagacct,探针为p:acctcgggcaatggtac tgcaag。
7.为了达到上述目的,本发明采取以下技术措施:
8.本发明的目的在于提供了一种检测基于ema
‑
ddpcr的方法的靶点序列的试剂在制备区分非洲猪瘟病毒核酸阳性与病毒阳性的试剂盒中的应用,所述的靶点序列为seq idno.94所示。
9.以上所述的应用中,优选的,所述的基于ema
‑
ddpcr的方法的靶点序列的试剂为引物和探针,引物为:f:cattgcctatgccatccatg和r:acgcaaagtcgagacct,探针为p:acctcgggcaatggtactgcaag,探针携带有本领域的常规荧光基团。
10.以上所述的应用中,优选的,所述试剂盒在应用过程中的体系为:
[0011]2×
supermix 15μl、上下游引物终浓度各800pm、探针终浓度400pm、dna模板4μl, ddh2o补足至30μl;
[0012]
与现有技术相比,本发明具有以下优点:
[0013]
本发明所提供的检测asfv的ddpcr引物和探针可以很好的区分非洲猪瘟病毒核酸阳性与病毒阳性,同时具有灵敏度高、重复性好的特点。将该引物探针及检测方法应用于检测感染性asfvddpcr试剂盒,在2
‑
3小时即可完成全部实验。与常规感染性asfv检测试验相比,本发明极大缩短了感染性asfv检测的试验周期,降低了对科研条件和设备的要求;有效区分了病毒衣壳蛋白损伤导致病毒失活的核酸与和感染性病毒粒子,提高了检测的准确
性,减少了实际检测中出现的假阳性现象。对于asfv的实际防控,如猪场复养前的风险评估、日常生物安全监控、消毒剂处理效果评估猪场经过消毒处理后环境中是否还有感染性病毒等,具有重要参考意义和良好应用前景。
附图说明
[0014]
图1检测感染性asfv引物、探针特异性试验。
[0015]
图2测定空白检测限(lob)结果图(a为1d散点图,b为2d散点图)
[0016]
图3不同浓度梯度标准质粒的ddpcr标准曲线
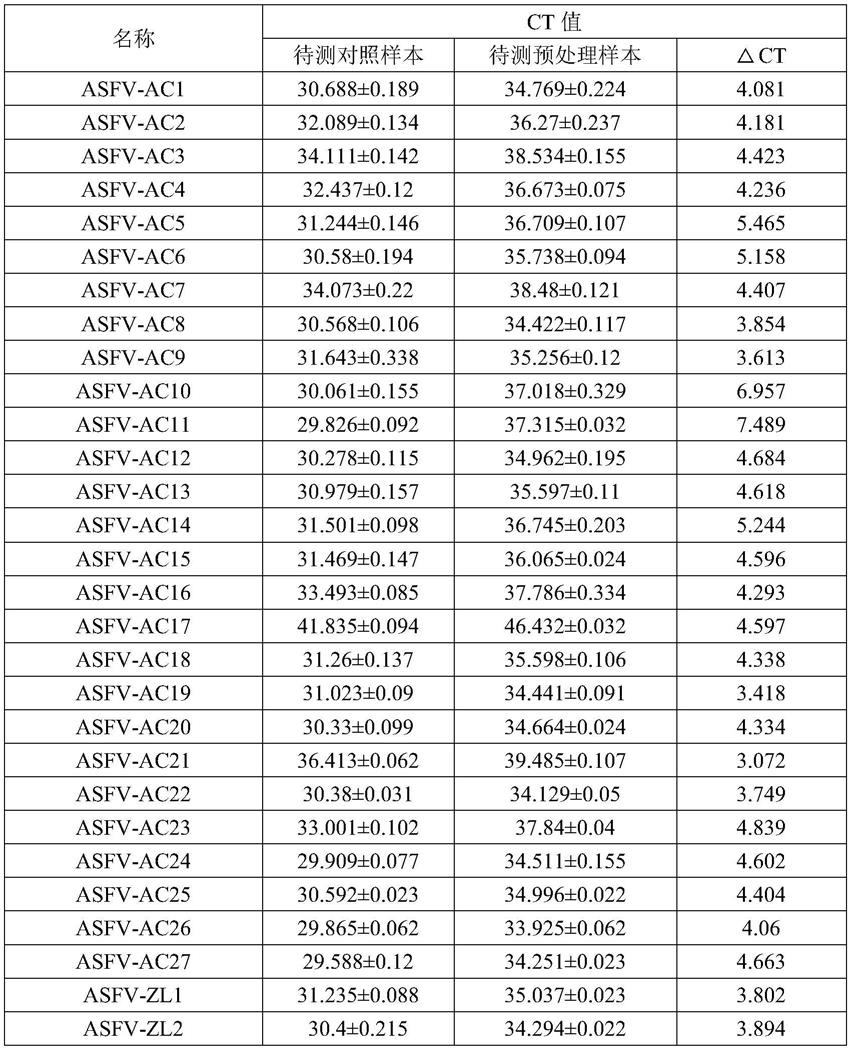
具体实施方式
[0017]
为了更好地理解本发明的内容,下面结合具体实施方法对本发明内容作进一步说明,但本发明的保护内容不局限于以下实施例。本发明实施例中的试验方法和条件如无特殊说明,均为常规方法。本发明所述的技术方案,如无特殊说明,均为领域的常规方案;所述试剂或材料如无特殊说明,均来源于商业渠道。本发明中所有与asfv活病毒相关的试验均在华中农业大学动物生物安全三级实验室严格按照《实验室生物安全通用要求》(gb19489
‑
2008) 和非洲猪瘟实验安全操作标准技术规范(hzau a3
‑ⅲ‑
10
‑
b)完成。以下具体实施例对本发明做进一步阐述:
[0018]
实施例1:
[0019]
检测感染性asfv扩增片段的筛选、引物探针的优化及特异性试验:
[0020]
1.1感染性asfv引物和探针的设计与参考
[0021]
申请人根据asfv基因组,选择了27个靶序列进行引物和探针的设计,设计的引物探针组合命名为asfv
‑
ac1~asfv
‑
ac27;引物和探针序列依次为seq id no.1~seq idno.81所示;例如asfv
‑
ac1的引物为seq id no.1~seq id no.2所示,探针为seq i d no.3所示;其余组合依次类推。
[0022]
同时选择了19个现有的检测asfv的引物探针组合,命名为asfv
‑
zl1~asfv
‑
zl15,其中:
[0023]
asfv
‑
zl1的引物探针组来源于cn2020100456541中的权利要求1中的引物和探针;
[0024]
asfv
‑
zl2的引物探针组来源于cn111172321a中的权利要求4中的p72基因的引物和探针;
[0025]
asfv
‑
zl3的引物探针组来源于cn111172321a中的权利要求4中的cd2v基因的引物和探针;
[0026]
asfv
‑
zl4的引物探针组来源于cn111676327a中的权利要求1中的b646l基因的引物和探针;
[0027]
asfv
‑
zl5的引物探针组来源于cn111676327a中的权利要求1中的mgf505
‑
2r基因的引物和探针;
[0028]
asfv
‑
zl6的引物探针组来源于cn103757134a中的权利要求1中的vp72基因的引物和探针;
[0029]
asfv
‑
zl7的引物探针组来源于cn110760617a中的权利要求1中的引物和探针;
[0030]
asfv
‑
zl8的引物探针组来源于cn110699489a中的说明书表1中的cd2v
‑
1;
[0031]
asfv
‑
zl9的引物探针组来源于cn110699489a中的说明书表1中的cd2v
‑
2;
[0032]
asfv
‑
zl10的引物探针组来源于cn110699489a中的说明书表1中的cd2v
‑
3;
[0033]
asfv
‑
zl11的引物探针组来源于cn112301167a中的权利要求1中的引物和探针;
[0034]
asfv
‑
zl12的引物探针组来源于cn112094950a中的说明书实施例1中的检测vp72的引物和探针;
[0035]
asfv
‑
zl13的引物探针组来源于cn112094950a中的说明书实施例1中的检测mgf360
‑
14l的引物和探针;
[0036]
asfv
‑
zl14的引物探针组来源于cn112094950a中的说明书实施例1中的检测cd2v的引物和探针;
[0037]
asfv
‑
zl15的引物探针组来源于cn110894556a中的权利要求1中的引物和探针;
[0038]
asfv
‑
gb2020的引物探针组来源于《非洲猪瘟诊断技术》国家标准(gb/t18648
‑
2020)公布的asfv荧光pcr引物探针组,具体为seqidno.82
‑
seqidno.84所示;
[0039]
asfv
‑
oie的引物探针组来源于世界动物卫生组织(worldorganizationforanimalhealth,oie)公布的asfv荧光pcr引物探针组,具体为seqidno.85
‑
seqidno.87所示;
[0040]
asfv
‑
cvma的引物探针组来源于《非洲猪瘟病毒实时荧光pcr检测方法》中国兽医协会团体标准(t/cvma5—2018)公布的asfv荧光pcr引物探针组,具体为seqidno.88
‑
seqidno.90所示;
[0041]
asfv
‑
172的引物探针组来源于中华人民共和国农业农村部公告(第172号)——猪用生物制品及相关猪源原辅材料中非洲猪瘟病毒核酸检测方法公布的荧光pcr检测引物探针组,具体为seqidno.91
‑
seqidno.93所示。
[0042]
1.2感染性asfv扩增片段的筛选
[0043]
选取asfvp72核酸检测阳性的猪脾脏组织样本,按照非洲猪瘟实验安全操作标准技术规范(hzaua3
‑ⅲ‑
10
‑
b)进行asfv病毒分离试验,并经红细胞吸附反应试验和测序鉴定后,将病毒液移取适量等分成数份,参考中国农业农村部发布的《非洲猪瘟疫情应急实施方案(2020年第二版)》和中国农业科学院发布的《非洲猪瘟清洁消毒技术要点(第二版)》中提及的asfv消毒标准,采用过硫酸氢钾灭活asfv,同时准备未灭活样本待用。
[0044]
合成1.1所述所有引物(上海生工生物科技有限公司),使用appliedbiosystemsquantstudio5实时荧光定量pcr仪和sybr
tm
selectmastermix试剂盒进行qpcr试验。
[0045]
qpcr反应体系(20μl):selectmastermix(2x)10μl,正反向引物(10μm)各0.4μl,dna模板2μl,无菌水补足至20μl,每个配比做三个重复。
[0046]
qpcr反应条件设置为:95℃预变性5min;每个循环为:95℃,15sec;60℃,15sec;72℃,30sec;45个循环;然后95℃,15sec;60℃,1min;95℃,1sec。反应结束后利用自带软件获取数据。
[0047]
其中,阳性对照为合成的病毒核酸序列质粒,含asfv引物扩增片段,阴性对照为不含rna的无菌水。阳性对照ct值<40并出现典型的扩增曲线,阴性对照无ct值且无典型扩增曲线表明该次实验结果成立,以下所有有关pcr反应的试验所列举出的数据均为实验结果成立数据,阳性对照与阴性对照ct值或拷贝数结果数据不赘述。
[0048]
灭活完成样品分别等体积移取两份试验样品,一份加ema(2μg/ml)避光于室温漩
涡孵育20min,孵育结束后,使用pma
‑
lite
tm
led光解仪对样品光解15min,作为待测预处理样本;另一份加等量pbs作为待测对照样本,与待测预处理样本进行相同条件下孵育和光解。采用天根全自动核酸提取仪提取ema预处理(待测预处理样本)和无ema预处理样本(待测对照样本)的核酸,并以此为模板,使用不同引物,按照上述qpcr反应体系与反应条件进行试验,筛选最佳感染性asfv扩增片段。
[0049]
表1感染性asfv扩增片段的筛选
[0050]
[0051][0052]
如表1所示,不同扩增片段的待测预处理样本与待测对照样本相比,ct值均有变大,
△
ct值(待测预处理样本ct值
‑
待测对照样本ct值)越大,表明该扩增片段与ema结合效率越高,对于区分感染性asfv的效果越强。其中,引物asfv
‑
ac11具有最大的
△
c t值,最适合作为检测asfv病毒阳性(具有感染性)指标,具体为:
[0053]
f:cattgcctatgccatccatg
[0054]
r:acgcaaagtcgagacct
[0055]
p:acctcgggcaatggtactgcaag。
[0056]
1.3检测感染性asfv引物、探针浓度和退火温度优化
[0057]
检测感染性asfv引物探针组asfv
‑
ac11由上海生工生物科技有限公司合成,所述探针5’端荧光基团为fam,3’端淬灭基团为bhq1。为获得该引物探针组的最优添加量,使用applied biosystems quantstudio5实时荧光定量pcr仪和applied biosystems
tm taqpathproamp master mixes试剂盒对检测感染性asfv引物探针组ac11的使用浓度和退火温度进行优化。其中qpcr反应体系(20μl):master mixes10μl,正反向引物终浓度各400~10 00pm,探针终浓度200~400pm,dna模板2μl,无菌水补足至20μl,每个配比做三个重复。qpcr反应条件设置为:95℃预变性30sec;每个循环为:95℃,15sec;58~62℃,5sec;45个循环,收集fam通道荧光信号,反应结束后利用仪器自带软件获取数据。
[0058]
不同引物和探针浓度条件下的ct值测定结果如表2所示。
[0059]
表2检测感染性asfv引物、探针浓度,退火温度优化
[0060][0061]
从上表可以看出,引物终浓度为800pm、探针终浓度400pm,退火温度58℃时,扩增结果的ct值最低,因此选择该浓度配比(即上下游引物终浓度均为800pm,探针终浓度为 400pm)为后续反应的终浓度。
[0062]
1.4检测感染性asfv引物、探针特异性试验
[0063]
本实施选取副猪嗜血杆菌(hps)、猪流行性腹泻病毒(pedv)、猪δ冠状病毒(pdco v)、猪传染性胃肠炎病毒(tgev)、经典猪瘟病毒(csfv)、猪繁殖与呼吸综合征病毒(prr sv)、asfv
‑
ac11标准品(含有检测感染性asfv
‑
ac11引物探针组扩增的靶序列seq idno.94)为实验对象。以上样本采用天根全自动核酸提取仪提取核酸,并分别作为模板根据 1.3所获得的最优反应体系和反应条件进行qpcr验证设计的引物和探针的特异性。qpcr 扩增曲线如图1所示,asfv
‑
ac11标准品组出现典型的扩增曲线且ct值<40,而以其他细菌或病毒的核酸为模板的扩增ct值>40且无典型扩增曲线,说明该引物和探针设计特异性强,可用于asfv的特异性检测。
[0064]
1.5检测感染性asfv引物、探针基于微流控芯片digital pcr的标准曲线、重复性与敏感性
[0065]
将asfv
‑
ac11标准质粒十倍倍比稀释为104copies/μl、103copies/μl、102copies/μl、1 01copies/μl,置于4℃备用。使用阴性样本dna对检测体系测定其lob,共8份样本进行测定,确定最低检测限。
[0066]
以上述不同浓度梯度的asfv
‑
ac11标准质粒及阴性对照为模板使用新奕制造科技(北京)有限公司生产的基于微流控生物芯片法的样本制备仪、样本制备通用试剂盒和probedpcrsupermix试剂盒制备样品:ddpcr反应体系为:2
×
supermix 15μl、上下游引物终浓度各800pm、探针终浓度400pm、模板4μl,ddh2o补足至30μl。每个质粒标准品梯度做三个重复。在微液滴生成芯片水孔中加入30μl待测样本,在油孔中加入180μl微液滴生成油,按照说明书进行样本制备。
[0067]
使用美国bio
‑
rad t100 pcr仪扩增,pcr反应程序为:95℃预变性10min,每个循环为:94℃,30sec;58℃,1min;40个循环。
[0068]
使用新奕生物芯片分析仪和微液滴检测通用试剂盒检测反应后的微液滴:将装有已返应完成的pcr管和微液滴检测芯片分别放在检测芯片机械卡具的相应位置,压下卡具上盖固定芯片,在微液滴检测芯片油孔1和油孔2分别加入430μl和500μl微液滴检测油,盖上密封垫,然后将带有微液滴检测芯片的卡具放入生物芯片分析仪中。后续按照生物芯片分析仪说明书要求,进行微液滴检测。
[0069]
表3阴性样本进行测定结果
[0070] 样本1样本2样本3样本4样本5样本6样本7样本8fam4.52.915.211.918.38.112.96.2μ10
ꢀꢀꢀꢀꢀꢀꢀ
lob16.002
ꢀꢀꢀꢀꢀꢀꢀ
lod24.073
ꢀꢀꢀꢀꢀꢀꢀ
[0071]
阴性对照样本测定1d散点图和2d散点图见图2,检测结果见表3,lob为16.002copies,lod为24.073copies。
[0072]
lob计算公式如下:lob=μ 1.645μ
1/2
0.8,μ为检测到的阳性液滴数的平均值
[0073]
lod计算公式如下:lod=[1.645 (1.6452 4lob)
1/2
)]2/4
[0074]
用灵敏度参考品(5copies/ul)多次测定,参考品重复检测8次,均能稳定检测出来,因此,确定其最低检测限lod为20copies/体系,表明基于微流控芯片digital pcr的检测感染性 asfv引物、探针具有良好的敏感性。
[0075]
不同浓度梯度标准质粒的ddpcr标准曲线如图3所示,均呈线性关系,r2=1,说明线性关系良好;平均变异系数为:0.045,表明具有良好的重复性。
[0076]
实施例2:ema检测感染性asfv方法的优化
[0077]
2.1ema使用浓度优化
[0078]
分别等体积移取灭活完成样本的试验样品,加不同浓度ema(终浓度为0,0.25,0.5,1,1.5,2,2.5,3μg/ml)避光于4℃漩涡孵育30min,孵育结束后,使用pma
‑
lite
tm
led 光解仪对样品光解20min。采用天根全自动核酸提取仪提取核酸,并以此为模板使用实施例1所获得的最佳反应体系和条件进行qrt
‑
pcr。筛选能达到检测感染性asfv目的的最低e ma浓度。
[0079]
表4 ema使用浓度优化
[0080]
ema终浓度(μg/ml)ct值平均数
±
标准差
△
ct033.523
±
0.01600.2535.923
±
0.1282.40.536.237
±
0.1552.714136.923
±
0.0523.41.538.245
±
0.1284.7222undetermined
‑
2.5undetermined
‑
3undetermined
‑
[0081]
结果如表4所示,随着ema使用浓度的提高,ct值均有变大,
△
ct值(待测预处理样本ct值
‑
待测对照样本ct值)越大,表明对于区分感染性asfv效果越强,当ema浓度达到2μg/
ml时,即可达到区分感染性asfv的目的,因此ema最佳工作浓度为2μg/ml。
[0082]
2.2ema孵育时间、光解时间优化
[0083]
分别等体积移取灭活完成样本的试验样品,添加2μg/ml ema,避光,分别于4℃下孵育5、10和30min,之后分别光解2、12和20min。采用天根全自动核酸提取仪提取核酸,并以此为模板进行qrt
‑
pcr。选择δct差异最大或ema预处理组ct>40且无典型扩增曲线的孵育时间和光解时间作为最佳处理条件。
[0084]
表5 ema孵育时间优化
[0085][0086]
表6 ema光解时间优化
[0087][0088][0089]
结果如表5~6所示,最佳孵育时间为30min;最佳光解时间为20min。
[0090]
实施例3:基于微流控芯片检测感染性asfvddpcr试剂盒的应用
[0091]
本实施例参考中国农业农村部发布的《非洲猪瘟疫情应急实施方案(2020年第二版)》和中国农业科学院发布的《非洲猪瘟清洁消毒技术要点(第二版)》中提及的asfv消毒标准、有效消毒物质含量、消毒剂浓度、作用时间等模拟醛类消毒剂(甲醛)、醇类消毒剂 (75%乙醇)、含氯类消毒剂(84消毒液)、季铵盐类消毒剂(洁尔灭)、过氧化物类消毒剂 (过氧化氢)、过硫酸氢钾类(过硫酸氢钾)消毒剂处理后的灭活样品(经红细胞吸附试验验证阴性,作为灭活完成组),另外取asfv红细胞吸附试验阳性的病毒液作为未灭活组。采用实施例1~2中所得到的最佳检测感染性asfv引物和探针和处理方法,应用于基于微流控芯片检测感染性asfvddpcr试剂盒。
[0092]
检测步骤:
[0093]
(1)取待检样本等体积分为2份,其中一份样本加2μg/ml ema预处理作为待测预处理样本,另一份添加等量pbs作为待测对照样本。
[0094]
(2)使用天根全自动核酸提取仪分别提取待测预处理样本和待测对照样本的病毒rna;
[0095]
(3)分别以待测预处理样本和待测对照样本的核酸为模板进行ddpcr。
[0096]
反应体系为:2
×
supermix 15μl、上下游引物终浓度各800pm、探针终浓度400pm、模板4μl,ddh2o补足至30μl。
[0097]
反应程序为:95℃预变性10min,每个循环为:94℃,30sec;58℃,1min;40个循环。
[0098]
其中,阳性对照为合成的含靶标基因片段的病毒核酸序列质粒,阴性对照为不含rna 的无菌水。
[0099]
(4)以检测感染性asfv
‑
ac11引物探针组得到的待测对照样本拷贝数作为核酸阳/阴性指标;以检测感染性asfv
‑
ac11引物探针组得到的待测对照样本和待测预处理样本拷贝数的比值(待测对照样本拷贝数:待测预处理样本拷贝数)作为asfv病毒阳/阴性(感染性)指标:即待测对照样本拷贝数:待测预处理样本拷贝数>200或待测预处理样本拷贝数<20,即为asfv病毒阴性(不具有感染性),待测对照样本拷贝数:待测预处理样本拷贝数≤200则为asfv病毒阳性(具有感染性)。
[0100]
进一步地:所述待测样本预处理的具体步骤包括以下:
[0101]
(1)将待测样本置于无dnase/rnase酶的ep管中离心,收集上清;
[0102]
(2)取190μl上清液置于无dnase和rnase酶的ep管中,避光向其中加入10μl ema,混匀后,4℃避光漩涡孵育30min;所述ema终浓度为2μg/ml。
[0103]
(3)将样品转移至无dnase/rnase酶的lobind ep管中,然后使用pma
‑
lite
tm
led光解仪对样品光解20min。
[0104]
待测对照样本与待测序预处理样本进行相同的条件孵育和光解,但待测对照样本不加e ma,仅加等体积pbs。
[0105]
检测感染性asfvddpcr试剂盒应用于不同灭活方法处理的asfv样品结果如表7所示。
[0106]
另外,本实施例以国家标准(gb/t 18648
‑
2020)asfv引物探针组asfv
‑
gb2020,具体为:f:5
’‑
gctttcaggatagagatacagctct
‑3’
[0107]
r:5
’‑
ccgtagtggaagggtatgtaagag
‑3’
[0108]
p:5
’‑
fam
‑
ccgtaactgctcatggtatcaatcttatcg
‑
bhq1
‑3’
[0109]
oie asfv引物探针组asfv
‑
oie,具体为:
[0110]
f:5
’‑
ctgctcatggtatcaatcttatcga
‑3’
[0111]
r:5
’‑
gataccacaagatcrgccgt
‑3’
[0112]
p:5
’‑
fam
‑
ccacgggaggaataccaacccagtg
‑
tamra
‑3’
[0113]
中国兽医协会团体标准(t/cvma 5—2018)asfv引物探针组asfv
‑
cvma,具体为:
[0114]
f:5
’‑
atagagatacagctcttccag
‑3’
[0115]
r:5
’‑
gtatgtaagagctgcagaac
‑3’
[0116]
p:5
’‑
fam
‑
tatcgataagattgat
‑
mgb
‑3’
[0117]
中华人民共和国农业农村部公告(第172号)asfv引物探针组asfv
‑
172,具体为:
[0118]
f:5
’‑
cctcggcgagcgctttatcac
‑3’
[0119]
r:5
’‑
ggaaactcattcaccaaatcctt
‑3’
[0120]
p:5
’‑
fam
‑
cgatgcaagctttat
‑
mgb
‑3’
[0121]
上述四组作为对照asfv病毒阳/阴性(感染性)指标,探讨现有引物探针组对检测感染性asfv的使用效果。除更换引物探针组,反应体系和条件参考引物探针组出处推荐浓度和退火温度外,其余步骤均与实施例3检测感染性asfv ddpcr试剂盒的应用步骤相同。
[0122]
表7检测感染性asfvddpcr试剂盒应用于不同灭活方法处理的样本
[0123][0124][0125]
表8对照引物探针组检测不同灭活方法处理的样本结果
[0126][0127][0128]
表7数据表明,所有样本核酸指标检测结果均为阳性。其中,经过甲醛、酒精、84消毒液、洁尔灭、过硫酸氢钾、过氧化氢灭活(灭活完全样本)的样本感染性指标待测对照样品拷贝数:待测预处理样品拷贝数>200或待测预处理样本拷贝数<20,表明不具备感染性。
而未灭活样本感染性指标待测对照样品拷贝数:待测预处理样品拷贝数<200,表明具备感染性,该检测感染性asfv引物探针ac
‑
11检测结果与红细胞吸附试验结果一致,表明本发明的试剂盒可以达到快速检测感染性asfv的目的。
[0129]
表8数据表明,以国家标准、oie、中国兽医协会团体标准、农业农村部公告推荐的a sfv引物探针组为感染性指标检测不同方法灭活的样本获得的待测对照样品拷贝数:待测预处理样品拷贝数比值均小于200,表明常规asfv引物探针组对于检测病毒感染性效果欠佳,无法起到区分感染性asfv的目的。
[0130]
由于本发明的试剂盒能在2~3h内完成感染性asfv的检测,具有快速、简单、高效等优点,可用于感染性asfv快检的初步筛查。
[0131]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

