通过检测bcan基因区域的甲基化状态筛查大肠瘤的方法和试剂盒
技术领域
1.本技术涉及肿瘤筛查领域,具体涉及通过检测生物样品中目标基因的甲基化状态来筛查大肠瘤的方法和试剂盒。
背景技术:
2.结直肠癌是全球第三位常见恶性肿瘤,也是我国常见恶性肿瘤。根据疾病的发展阶段,结直肠癌被分为i-iv期。对于iv期结直肠癌患者,总体生存率非常低,5年生存率不足10%。而i期的患者能达到90%以上的生存率。因此,为了改善肠癌的整体预后,早期诊治显得至关重要。
3.现阶段,中国的大肠癌筛查技术主要包括粪便隐血试验、肿瘤标记物检测和肠镜检查。虽然结肠镜检查仍然是确诊肠癌的根本方法,但其高昂的费用、较差的可依从性以及可能的致伤性使得结肠镜难以大规模应用于无症状人群的筛查。粪便隐血试验和肿瘤标记物(例如,外周血癌胚抗原)检测虽然易被接受,但其较差的灵敏度和特异度也给肠癌早期诊治带来了挑战。
4.近年来,发现肠上皮细胞内的表观遗传学和遗传学的改变可能有助于结直肠癌的诊断。目前,septin9基因甲基化已经拥有了一些商业化试剂盒。综合检测bmp3和ndrg4基因甲基化以及kras和β-actin基因突变的试剂盒也已经在美国上市。但是一些现有试剂盒存在的问题是结直肠癌的检测效率有待进一步提高。研究者们也在探索其他检测的基因,但所能达到的肿瘤诊断灵敏度和特异性差别较大,且都难以达到大规模筛查的使用要求。
5.因此需要灵敏度和特异性更高的大肠瘤筛查方法和试剂盒。
6.发明简述
7.在一个方面,本技术提供了一种在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向或监测大肠瘤进展或预后的方法,所述方法包括在来自所述个体的生物样品中检测bcan基因区域的甲基化状态,并且将检测到的bcan基因区域的甲基化状态与bcan基因区域的正常甲基化状态进行比较,其中相对于bcan基因区域的正常甲基化状态而言,在来自所述个体的生物样品中检测到的bcan基因区域的甲基化状态改变表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
8.在一些实施方案中,相对于bcan基因区域的正常甲基化状态而言,在来自所述个体的生物样品中检测到的bcan基因区域的较高甲基化状态表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
9.在另一个方面,本技术提供了一种监测个体对大肠瘤治疗的应答的方法,所述方法包括在所述个体接受大肠瘤治疗之前和之后分别在来自所述个体的生物样品中检测bcan基因区域的甲基化状态,其中相对于接受大肠瘤治疗之前的bcan基因区域的甲基化状
态而言,所述个体在接受大肠瘤治疗之后的bcan基因区域的甲基化状态改变表示所述个体对大肠瘤治疗有应答。
10.在一些实施方案中,相对于接受大肠瘤治疗之前的bcan基因区域的甲基化状态而言,所述个体在接受大肠瘤治疗之后的bcan基因区域的较低甲基化状态表示所述个体对大肠瘤治疗有应答。
11.在一些实施方案中,所述bcan基因区域包括:a)hg19坐标chr1:156611182-156629324及其上游5kb和下游5kb限定的区域;或b)上述a)所列区域经亚硫酸氢盐转化后的对应区域;或c)上述a)所列区域经甲基化敏感限制酶(msre)处理后的对应区域。
12.在一些实施方案中,所述bcan基因区域选自下组:a)hg19坐标chr1:156611182-156629324及其上游5kb和下游5kb限定的区域;或b)上述a)所列区域经亚硫酸氢盐转化后的对应区域;或c)上述a)所列区域经甲基化敏感限制酶(msre)处理后的对应区域。
13.在一些实施方案中,所述检测bcan基因区域的甲基化状态包括在来自所述个体的生物样品中测定bcan基因区域的一个或多个cpg位点中的胞嘧啶残基的甲基化状态。在一些实施方案中,所述bcan基因区域的甲基化状态包括目标dna区域的甲基化状态,所述目标dna区域包括hg19坐标选自下组的序列:chr1:156611399-156612667、chr1:156616348-156617162、chr1:156626037-156630544和chr1:156611866-156611966,及所述区域的上游200bp和下游200bp的区域,及其任意组合。
14.在一些实施方案中,所述生物样品选自组织学切片、组织活检、石蜡包埋的组织、手术切除样本、分离的细胞、体液、结肠流出物,及其任意组合。在一些实施方案中,所述体液选自下组:全血、血清、血浆、尿液、唾液、粘液、腹膜液、胸腔液、胸膜积液、滑液、脑脊髓液、胸腔穿刺液、腹腔积液,及其任意组合。在一些实施方案中,所述结肠流出物选自粪便和灌肠洗涤样品。
15.在一些实施方案中,在来自所述个体的生物样品中检测bcan基因区域的甲基化状态之前,进一步包括以下步骤:
16.(a)从所述个体获取含有dna的生物样品;
17.(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获取处理的dna。
18.在一些实施方案中,所述dna包括基因组dna或细胞外游离dna。在一些实施方案中,所述细胞外游离dna包括循环肿瘤dna。
19.在一些实施方案中,步骤(b)中的所述试剂为亚硫酸氢盐试剂或甲基化敏感限制酶(msre)。在一些实施方案中,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。在一些实施方案中,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶,及其任意组合。
20.在一些实施方案中,所述检测使用基于扩增的方法、基于杂交的方法、基于测序的方法、或基于限制性酶切的方法。
21.在一些实施方案中,所述检测bcan基因区域的甲基化状态包括使用扩增酶和一组或多组引物扩增所述处理的dna,以产生至少一种扩增产物或者所述处理的dna不被扩增,
可选地,所述处理的dna包括seq id nos:4-9、11-12所示的核苷酸序列及其任意组合,或选自由seq id nos:4-9、11-12组成的核苷酸序列。在一些实施方案中,所述扩增酶包括耐热dna聚合酶或缺乏5
’-3’
外切酶活性的聚合酶。
22.在一些实施方案中,所述扩增是在检测试剂或封闭试剂的存在下进行的。在一些实施方案中,所述检测试剂包括可检测的标记物标记的寡核苷酸探针,和/或所述封闭试剂包括不能被聚合酶延长的封闭寡核苷酸。在一些实施方案中,所述寡核苷酸探针包含能够与所述扩增产物杂交的序列,和/或封闭寡核苷酸包含能够与所述扩增产物以甲基化特异性的方式杂交的序列。
23.在一些实施方案中,所述引物是甲基化特异性的引物。在一些实施方案中,所述引物包含与所述处理的dna中对应于bcan基因区域序列的至少9个连续核苷酸的序列基本互补或基本相同的序列,其中所述连续核苷酸包含至少一个cpg、tpg或cpa二核苷酸,或者其中所述扩增产物包含至少一个cpg、tpg或cpa二核苷酸。在一些实施方案中,所述引物包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。在一些实施方案中,所述引物选自下组:
24.gggaagaaagggggttttgt(seq id no:13)bcan上游引物序列tacgacgaaaactacgcgaa(seq id no:14)bcan下游引物序列
25.和/或,所述寡核苷酸探针选自下组:
26.cgtcgggagggtcgg(seq id no:15)bcan探针序列
27.在一些实施方案中,基于所述扩增产物是否存在及其性质,确定所述bcan基因区域的甲基化状态。在一些实施方案中,所述检测或确定bcan基因区域的甲基化状态包括使用聚合酶链式反应(例如实时聚合酶链式反应、数字聚合酶链式反应)、核酸测序、基于质量的分离(例如电泳法、质谱法)或靶标捕获(例如微阵列)。在一些实施方案中,所述确定包括对所述扩增产物进行测序。
28.在一些实施方案中,所述bcan基因区域的正常甲基化状态代表在来自未患有大肠瘤的个体,或者来自没有大肠瘤形成或形成的倾向的个体,或者来自没有大肠瘤发展或发展的倾向的个体,或者来自有大肠瘤预后良好或者预后良好的倾向的个体中所述bcan基因区域的甲基化状态。
29.在一些实施方案中,所述大肠瘤是结直肠瘤。在一些实施方案中,所述结直肠瘤是结直肠癌、结直肠腺瘤或无蒂锯齿状息肉。在一些实施方案中,所述大肠瘤是癌前的。
30.在一些实施方案中,所述个体是人。
31.在另一个方面,本技术提供了一种用作检测工具的寡核苷酸,其包含bcan基因区域或其互补序列的至少9个连续核苷酸或者由bcan基因区域或其互补序列的至少9个连续核苷酸组成。
32.在另一个方面,本技术提供了一种用作检测工具的寡核苷酸,其包含bcan基因区域的经处理的dna序列或其互补序列的至少9个连续核苷酸,或者由bcan基因区域的经处理的dna序列或其互补序列的至少9个连续核苷酸组成,所述处理适于将bcan基因区域中的至少一个未甲基化的胞嘧啶残基转变为尿嘧啶残基、胸腺嘧啶残基或在杂交上可检测地不同于胞嘧啶的其他残基。
33.在另一个方面,本技术提供了一种用于诊断大肠瘤、筛查大肠瘤形成或形成的倾
向或监测大肠瘤进展或预后的试剂盒,其包括第一试剂,所述第一试剂包含一种或多种如本技术所述的寡核苷酸。在一些实施方案中,所述寡核苷酸包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。在一些实施方案中,所述寡核苷酸选自下组:
34.gggaagaaagggggttttgt(seq id no:13)bcan上游引物序列tacgacgaaaactacgcgaa(seq id no:14)bcan下游引物序列cgtcgggagggtcgg(seq id no:15)bcan探针序列
35.在一些实施方案中,本技术所述的试剂盒进一步包括第二试剂,所述第二试剂能够区分dna中的甲基化和未甲基化的cpg位点。在一些实施方案中,所述第二试剂为亚硫酸氢盐试剂或甲基化敏感限制酶(msre)。在一些实施方案中,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。在一些实施方案中,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶,及其任意组合。
36.在一些实施方案中,所述第一试剂和所述第二试剂被包装在单一容器内或者被分别包装在独立的容器内。在一些实施方案中,本技术所述的试剂盒进一步包括适于盛放来自所述个体的生物样品的容器。在一些实施方案中,本技术所述的试剂盒进一步包括使用说明书和/或对试剂盒检测结果的解释。
37.在另一个方面,本技术提供了用于检测bcan基因区域的甲基化状态的试剂在制备用于在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向、或监测大肠瘤进展或预后的方法的试剂盒中的用途,其中所述方法包括在来自所述个体的生物样品中检测bcan基因区域的甲基化状态,并且将检测到的bcan基因区域的甲基化状态与bcan基因区域的正常甲基化状态进行比较,其中相对于bcan基因区域的正常甲基化状态而言,在来自所述个体的生物样品中检测到的bcan基因区域的甲基化状态改变表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
38.在一些实施方案中,相对于bcan基因区域的正常甲基化状态而言,在来自所述个体的生物样品中检测到的bcan基因区域的较高甲基化状态表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
39.在另一个方面,本技术提供了用于检测bcan基因区域的甲基化状态的试剂在制备用于在所述个体中监测所述个体对大肠瘤治疗的应答的方法的试剂盒中的用途,其中所述方法包括在来自所述个体的生物样品中检测bcan基因区域的甲基化状态,其中相对于接受大肠瘤治疗之前的bcan基因区域的甲基化状态而言,所述个体在接受大肠瘤治疗之后的bcan基因区域的甲基化状态改变表示所述个体对大肠瘤治疗有应答。
40.在一些实施方案中,相对于接受大肠瘤治疗之前的bcan基因区域的甲基化状态而言,所述个体在接受大肠瘤治疗之后的bcan基因区域的较低甲基化状态表示所述个体对大肠瘤治疗有应答。
41.在一些实施方案中,所述检测bcan基因区域的甲基化状态的试剂包括一组或多组
寡核苷酸,所述寡核苷酸包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。在一些实施方案中,所述寡核苷酸选自下组:seq id nos:13、14和15。
42.在另一个方面,本技术提供了区分目标dna区域的甲基化和未甲基化cpg位点的至少一种试剂在制备用于在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向、或监测大肠瘤进展或预后的方法的试剂盒中的用途,其中所述方法包括使从所述个体的生物样品中分离的dna与所述至少一种试剂和与所述目标dna区域在严紧条件下、中等严紧条件下或者高度严紧条件下杂交的一种或多种寡核苷酸接触,其中所述目标dna区域包含bcan基因区域或其互补序列的至少9个连续核苷酸,其中所述连续核苷酸包含至少一个cpg位点。
43.在另一个方面,本技术提供了区分目标dna区域的甲基化和未甲基化cpg位点的至少一种试剂在制备用于在所述个体中监测所述个体对大肠瘤治疗的应答的方法的试剂盒中的用途,其中所述方法包括使从所述个体的生物样品中分离的dna与所述至少一种试剂和与所述目标dna区域在严紧条件下、中等严紧条件下或者高度严紧条件下杂交的一种或多种寡核苷酸接触,其中所述目标dna区域包含bcan基因区域或其互补序列的至少9个连续核苷酸,其中所述连续核苷酸包含至少一个cpg位点。在一些实施方案中,所述试剂为亚硫酸氢盐试剂或甲基化敏感限制酶(msre)。
44.在一些实施方案中,本技术所述的试剂盒包括(a)亚硫酸氢盐试剂;(b)一组或多组引物,其包含能够与经亚硫酸氢盐处理的dna中的bcan基因区域序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。
45.在另一个方面,本技术提供了适合于实施本技术所述方法的试剂盒,包括(a)甲基化敏感限制酶;(b)一组或多组引物,其包含能够与经甲基化敏感限制酶处理的dna中的bcan基因区域序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。在一些实施方案中,所述试剂盒进一步包括dna聚合酶,可选地耐热dna聚合酶或缺乏5
’-3’
外切酶活性的聚合酶。
46.在另一个方面,本技术提供了一种在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向或监测大肠瘤进展或预后的方法,包括:
47.(a)从所述个体获取含有dna的生物样品;
48.(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化的cpg位点和未甲基化的cpg位点,从而获取处理的dna;
49.(c)使步骤(b)中所述的处理的dna与扩增酶和一组或多组适于扩增目标dna区域的引物接触,所述目标dna区域包含bcan基因区域或其互补序列的至少9个连续核苷酸,其中所述连续核苷酸包含至少一个cpg位点;
50.(d)基于扩增产物存在与否及其性质,确定目标dna区域的甲基化状态;
51.(e)将步骤(d)中确定的目标dna区域的甲基化状态与目标dna区域的正常甲基化状态进行比较,
52.其中相对于目标dna区域的正常甲基化状态而言,在步骤(d)中确定的目标dna区域的甲基化状态改变表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
53.在一些实施方案中,相对于目标dna区域的正常甲基化状态而言,在步骤(d)中确定的目标dna区域的较高甲基化状态表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
54.在另一个方面,本技术提供了适合于实施本技术所述的方法的试剂盒,包括:
55.(a)亚硫酸氢盐试剂;
56.(b)适合于容纳所述试剂和来自所述个体的生物样品的容器;
57.(c)一组或多组引物,其包含能够与经亚硫酸氢盐处理的dna中的bcan基因区域序列的至少9个连续核苷酸的序列基本互补或基本相同的序列;以及任选地,
58.(d)使用说明书和/或对试剂盒检测结果的解释。
59.在另一个方面,本技术提供了适合于实施本技术所述的方法的试剂盒,包括:
60.(a)甲基化敏感限制酶试剂;
61.(b)适合于容纳所述试剂和来自所述个体的生物样品的容器;
62.(c)一组或多组引物,其包含能够与经甲基化敏感限制酶处理的dna中的bcan基因区域序列的至少9个连续核苷酸的序列基本互补或基本相同的序列;以及任选地,
63.(d)使用说明书和/或对试剂盒检测结果的解释。
附图说明
64.图1显示对bcan基因区域内的目标dna区域(图1a)和内参基因actb(图1b)的甲基化特异性引物的验证。纵坐标表示δrn值,它是由在特定的循环次数下检测到的荧光强度值减去荧光强度基线值得到的。横坐标表示循环次数。如图1a所示,ct值随着dna混合物中转化的甲基化dna百分比的增加而降低,这表明用于扩增bcan基因区域目标靶点的引物是甲基化特异性的。如图1b所示,每种dna混合物的曲线重合,这表明尽管dna混合物中转化的甲基化dna百分比增加,但是ct值仍然保持不变,这也与用于扩增内参基因actb的引物是非甲基化特异性的引物这一事实一致。
65.图2a显示血细胞和不同组织样本(癌旁组织、高级别腺瘤组织、结直肠癌组织)中bcan基因区域目标靶点的甲基化丰度的比较。采用内参基因actb作为对照,图2b显示血细胞和不同组织样本(癌旁组织、高级别腺瘤组织、结直肠癌组织)中内参基因actb的甲基化丰度的比较。纵坐标表示ct值,横坐标表示各种样本(血细胞、癌旁组织、高级别腺瘤组织、结直肠癌组织)。ct值与甲基化丰度反向相关,即,ct值越高,甲基化丰度越低。因此,由图2a可以看出,bcan基因区域在血细胞中的甲基化丰度远远低于组织样本,且在癌旁组织中低于高级别腺瘤和结直肠癌组织,具有进行血液筛查的潜能。
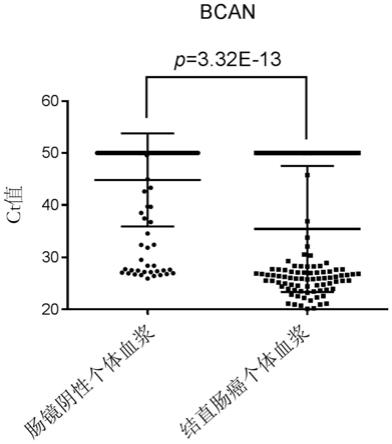
66.图3显示肠镜阴性个体的血浆样本和结直肠癌个体的血浆样本中bcan基因区域目标靶点的甲基化丰度的比较,纵坐标表示ct值,横坐标表示肠镜阴性个体的血浆样本和结直肠癌个体的血浆样本。ct值与甲基化水平反向相关,即,ct值越低,甲基化水平越高。由图3可以看出,结直肠癌个体的血浆样本中的bcan基因区域的甲基化水平显著性地高于肠镜阴性个体的血浆样本中的bcan基因区域的甲基化水平。
67.图4显示bcan基因区域内的示例性目标dna区域的序列、引物序列以及探针序列。
68.发明详述
69.虽然本技术公开了本技术的各个方面和各种实施方式,但是本领域技术人员可以在不脱离本技术的精神和范围的前提下做出各种等同改变或修改。本技术公开的各个方面和各种实施方式均是示例性的,并不旨在限制本技术的范围,本技术的实际保护范围以权利要求书为准。除非另有说明,否则本技术中使用的所有技术和科学术语均是本领域技术人员通常理解的含义。本技术引用的所有参考文献、专利和专利申请均通过引用并入本技术。
70.1.基本术语
71.在本技术的说明书和权利要求书,除非另有说明,否则术语“包含”或“包括”是指含有所列出的数值、步骤或成分,但也不排除还含有其他数值、步骤或成分。
72.在本技术中,术语“个体”包括人类和非人类的动物。非人类的动物包括所有的脊椎动物,例如哺乳动物和非哺乳动物。“个体”也可以是家畜动物,例如牛、猪、羊、家禽和马;或啮齿类动物,例如大鼠、小鼠;或灵长类动物,例如猿、猴子;或家养动物,例如狗和猫。在一些实施方案中,所述个体是人。
73.在本技术中,术语“大肠”是指始于回肠的终端区域,包含以下解剖区域的脏器:盲肠、升结肠、横结肠、降结肠、乙状结肠、直肠、脾曲、肝曲。
74.在本技术中,术语“瘤”或“肿瘤”是指以细胞非正常增生为特征的疾病。肿瘤可以是良性的(例如,腺瘤)、潜在恶性的、或恶性的(通常又称为癌),其中恶性肿瘤以肿瘤细胞的恶性增殖为特征,即肿瘤细胞的生长不受调节且缺乏分化,并具有侵入局部组织和转移的潜力或能力。如本技术所用,大肠瘤是指大肠部位的肿瘤。
75.在本技术中,术语“诊断”是指对个体的健康状态作出医学判断。如本技术所用,在个体中诊断大肠瘤是指判断个体是否患有大肠瘤(包括处在任何进展阶段的大肠瘤)。
76.在本技术中,术语“筛查”是指通过对来自个体的一项或多项生物样品的分析,从而判断个体是否患有特定疾病和/或判断其进展阶段。筛查是发现早期癌症和癌前病变的一项重要手段,通常用于从外表健康的群体中鉴定出已经患有或者可能患有特定肿瘤(例如大肠瘤)的个体。
77.在本技术中,描述大肠瘤时所用的术语“形成”是指个体的大肠的一个或多个细胞出现非正常增生,其可以指大肠瘤处在极早期,数量较少的大肠细胞出现非正常增生,也可以指大肠瘤已发展至形成包含非正常增生的细胞的团块。
78.在本技术中,术语“倾向”是指个体尚未出现某种状态,但在未来很有可能出现该状态。
79.在本技术中,术语“监测大肠瘤进展”是指在诊断患有大肠瘤的个体中监测大肠瘤的进展阶段。
80.在本技术中,术语“预后”是指疾病或病症的未来病程或结果的预测或预计。该术语也指对治疗的临床获益可能性的预测。在一些实施方案中,使用统计学算法为个体提供疾病的预后。例如,预后可以是手术、癌症临床亚型的进展、一种或多种临床因素的进展、或者从疾病中恢复。预后可以是预后不良(例如,可能复发或者产生耐药)或者预后良好。
81.在本技术中,术语“生物样品”是指从包括人类和非人类的动物的个体获得的包含生物材料的任何样品。生物样品可以是直接从个体来源获得的样品或经过处理的样品,可以是新鲜收获的或经贮藏的(如冻存)样品。生物样品包括但不限于体液(例如全血、血浆、
血清、脑脊液、滑液、尿液、汗液、精液、粪便、痰、唾液、眼泪、粘液、羊水、积液、骨髓样品、腹水、胸膜液、脊髓液、淋巴液、眼液),导入个体中并且随后取出的样品(如骨盆冲洗液、灌肠洗涤样品),鼻、喉或生殖器拭子的提取物,组织和器官样品,和由上述样品衍生的经处理的样品(如来自消化的组织的细胞悬浮液,粪便提取物)。
82.在本技术中,术语“bcan基因区域”是指基因组dna的特定区域,其含有用于产生bcan基因的所有转录本所需的全部脱氧核苷酸序列,包括调节bcan基因转录的转录调节元件和启动子序列。该dna区域可以通过基因名称或一组染色体坐标来确定。人类bcan基因也称为brevican基因。可用于本技术所述方法的bcan基因区域包括hg19坐标chr1:156611182-156629324及其上游5kb和下游5kb的区域,或者选自由hg19坐标chr1:156611182-156629324及其上游5kb和下游5kb组成的区域。可以通过公开的数据库例如ucsc genome browser、ensemble、ncbi网站查询hg19坐标chr1:156611182-156629324及其上游5kb和下游5kb的区域的具体序列。已知基因在个体间可能存在多种变体,例如等位变异或单核苷酸多态性(snp,包括不定尺寸的插入和缺失和简单序列重复序列,如二核苷酸和三核苷酸重复序列),因此术语“bcan基因区域”还应理解为包括bcan基因的所有变体序列所对应的bcan基因区域。根据ensembl注解,bcan基因具有8个转录本变体。此外,术语“bcan基因区域”还应理解为包括该基因区域内的正义链和反义链的序列。
83.此外,术语“bcan基因区域”还广泛地包括:(1)在生物样品或基因组dna中发现的原始bcan基因区域(特别是具有特定甲基化状态的原始bcan基因区域);(2)及其经处理的序列(例如,经亚硫酸氢盐转化或者甲基化敏感限制酶(msre)处理的序列)。经亚硫酸氢盐转化的序列与其原始序列在基因序列上的区别在于,原始bcan基因区域的一个或多个未甲基化的胞嘧啶残基被转化为尿嘧啶碱基、胸腺嘧啶碱基或在杂交方式上与胞嘧啶不相似的其他碱基。经msre处理的序列与其原始序列在基因序列上的区别在于,序列在一个或多个msre切割位点被切割。
84.在本技术中,术语“甲基化状态”是指dna序列内一个或多个胞嘧啶碱基的甲基化或未甲基化的状态。在哺乳动物中,dna甲基化通常在cpg二核苷酸中的胞嘧啶处发生。cpg可以成簇地以cpg岛的形式存在,cpg岛存在于许多基因的5’调节区中,其甲基化状态可以影响基因的转录。甲基化胞嘧啶可以有不同的形式,例如,5-甲基胞嘧啶(5mc)、5-羟甲基胞嘧啶(5hmc)、5-甲酰胞嘧啶(5fc)和5-羧基胞嘧啶(5cac)等。dna序列内cpg位点的甲基化状态包括未甲基化(两条dna单链上的cpg均未甲基化)、全甲基化(两条dna单链上的cpg均甲基化)和半甲基化(仅一条dna单链上的cpg甲基化)。本领域技术人员已知多种用于确定dna的甲基化状态或水平的方法。在本技术中,当分析生物样品中的dna甲基化状态时,可以使用定量测定法来确定一个或多个甲基化位点(例如cpg二核苷酸)的甲基化水平(例如百分比、份数、比率或程度)。相应地,术语“甲基化状态”还应被认为是指反映生物样品的dna中一个或多个胞嘧啶甲基化程度的值。
85.在本技术中,术语“bcan基因区域的甲基化状态”是指bcan基因区域中的一个或多个胞嘧啶碱基的甲基化或未甲基化的状态。bcan基因区域内部的一段或几段序列的甲基化状态可以代表bcan基因区域内的甲基化状态。例如,可以通过检测bcan基因区域内部的一个或几个目标dna区域的甲基化状态,获知bcan基因区域的甲基化状态。
86.在本技术中,术语“目标dna区域”是指bcan基因区域内的dna序列,其包含bcan基
因区域的至少9个连续核苷酸,且包含至少一个甲基化位点(例如cpg二核苷酸位点)。在本技术中,分析目标dna区域的甲基化状态,对于在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向或监测大肠瘤进展或预后,或监测个体对大肠瘤治疗的应答尤其有用。在一些实施方案中,目标dna区域包含bcan基因区域的至少9个、10个、12个、15个、18个、20个、22个、25个、28个、30个、32个、35个、35个、50个、100个、150个、200个、250个或500个连续核苷酸。在一些实施方案,目标dna区域可以包含一个或多个cpg二核苷酸位点,例如至少1个或至少2个、3个、4个、5个、8个或10个cpg二核苷酸位点,这可以取决于目标dna区域的长度。
87.在一些实施方案中,目标dna区域含有高密度的cpg二核苷酸(或者由其转化而来的tpg二核苷酸或cpa二核苷酸)。这些cpg二核苷酸在基因组序列中的甲基化程度被发现与大肠瘤形成(如结直肠癌)相关。不受理论限制,但认为可以通过分析这些更短的更清晰限定的目标dna区域的甲基化状态来获得诊断结果,并且如果与对横跨整个bcan基因区域的甲基化状态的分析相比,对这些目标dna区域的分析将提供更加准确的诊断结果,因此bcan基因区域中的目标dna区域对本发明提供的方法特别有用。在一些实施方案中,目标dna区域包括hg19坐标选自下组的序列:chr1:156611399-156612667、chr1:156616348-156617162、chr1:156626037-156630544和chr1:156611866-156611966,及所述区域的上游200bp和下游200bp的区域,及其任意组合。在一些实施方案中,所述目标dna区域包括seq id nos:1-3或10中任一所示的核苷酸序列。在一些实施方案中,目标dna区域包括上述基因组序列的经处理的序列(例如经亚硫酸氢盐或msre处理的序列)。在一些实施方案中,目标dna区域包含选自下组的序列:seq id nos:4-9和11-12。图4显示了seq id nos:1-12的具体序列。
88.在本技术中,术语“正常甲基化状态”是指一种阈值水平,其代表了在来自未患有大肠瘤的个体,或者来自没有大肠瘤形成或形成的倾向的个体,或者来自没有大肠瘤发展或发展的倾向的个体,或者来自有大肠瘤预后良好或者预后良好的倾向的个体中所述bcan基因区域或目标区域的甲基化状态。可以通过本领域技术人员将熟知的任何适合手段获得正常甲基化状态。例如,可以获得一组健康人群的生物样品并评估其bcan基因区域的甲基化状态,从而建立一个标准值或范围,用于和将来获得的生物样品的甲基化状态进行比较。应该理解,bcan基因区域的甲基化状态可能受多个特征如年龄、性别、种族等的影响,因此,在一些实施方案中,可以就多个特定队列的人群分别建立多个相应的正常甲基化状态的标准值或范围。
89.在本技术中,术语“较高甲基化状态”是指与正常甲基化状态相比,存在更高水平的甲基化胞嘧啶,例如在一个或多个cpg位点处甲基化的dna分子的比例更高,或存在更多的甲基化cpg位点。
90.在本技术中,术语“较低甲基化状态”是指与正常甲基化状态相比,存在更低水平的甲基化胞嘧啶,例如在一个或多个cpg位点处甲基化的dna分子的比例更低,或存在更少的甲基化cpg位点。
91.在本技术中,术语“杂交”指一条核酸链上的碱基通过碱基配对与另一条核酸链上的互补碱基结合的过程。杂交反应可以是选择性的,使得特定目的序列以低浓度存在时也能从样品中选择该序列。杂交条件的严紧性(例如高度严紧、中度严紧、严紧)可以由例如预杂交溶液和杂交溶液中盐或甲酰胺的浓度、或杂交温度等来调整,例如,可以通过降低盐浓
度、增加甲酰胺浓度或升高杂交温度增加严紧性。一般而言,严紧条件包括在约25℃至约42℃的温度,在至少约0%到至少约15%v/v甲酰胺和至少约1m到至少约2m盐中杂交,和至少约1m到至少约2m盐中洗涤;中度严紧条件包括在约25℃至约65℃的温度,在至少约16%到至少约30%v/v甲酰胺和至少约0.5m盐到至少约0.9m盐中杂交,和至少约0.5m到至少约0.9m盐中洗涤;高度严紧条件包括在约至少65℃的温度,在至少约31%到至少约50%v/v甲酰胺和至少约0.01m到至少约0.15m盐中杂交,和至少约0.01m到至少约0.15m盐中洗涤;甲酰胺在这些杂交条件中是可任选的。其它合适的杂交缓冲液和条件是本领域技术人员众所周知的,并且描述于例如sambrook et al.,molecular cloning:a laboratory manual,2
nd ed.cold spring harbor press,plainview,n.y.(1989);和ausubel et al.,short protocols in molecular biology,4
th ed.,john wiley&sons(1999)。
92.在本技术中,术语“甲基化特异性”是指某些行为或者性质仅作用于具有特定甲基化状态或者不具有特定甲基化状态的分子。例如,以甲基化特异性的方式杂交的寡核苷酸在高度严紧杂交条件下仅能够与具有未甲基化状态的核酸杂交,或仅能够与具有甲基化状态的核酸杂交,但不会既与具有未甲基化状态的核酸杂交又与具有甲基化状态的核酸杂交。
93.在本技术中,术语“有应答”是指个体对治疗的有益响应。有益响应在临床上可以以各种形式表现,如肿瘤消失、肿瘤尺寸的减少、肿瘤生长停滞、与肿瘤有关的一种或多种症状的减轻、治疗后的生存时间增加等。
94.2.筛查和监测方法
95.在一个方面,本技术提供了一种在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向或监测大肠瘤进展或预后的方法,所述方法包括在来自所述个体的生物样品中检测bcan基因区域的甲基化状态,并且将检测到的bcan基因区域的甲基化状态与bcan基因区域的正常甲基化状态进行比较,其中相对于bcan基因区域的正常甲基化状态而言,在来自所述个体的生物样品中检测到的bcan基因区域的甲基化状态改变(例如具有较高甲基化状态)表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
96.在一个方面,本技术提供了一种监测个体对大肠瘤治疗的应答的方法,所述方法包括在所述个体接受大肠瘤治疗之前和之后分别在来自所述个体的生物样品中检测bcan基因区域的甲基化状态,其中相对于接受大肠瘤治疗之前的bcan基因区域的甲基化状态而言,所述个体在接受大肠瘤治疗之后的bcan基因区域的甲基化状态改变(例如治疗之后具有较低甲基化状态)表示所述个体对大肠瘤治疗有应答。
97.在一些实施方案中,所述的大肠瘤是结直肠瘤。结直肠瘤是最常见的大肠瘤类型,其发生于结肠、直肠和盲肠中,根据其性质,可划分为无蒂锯齿状息肉、结直肠腺瘤和结直肠癌。不受任何理论限制,息肉和腺瘤通常为上皮来源(源自上皮组织或具有明确的上皮结构特征)的良性组织增生,随着其进展,其内部可能出现恶性增殖的肿瘤细胞,向恶性转变。在一些实施方案中,所述大肠瘤是结直肠癌。
98.在一些实施方案中,所述大肠瘤是癌前的。术语“癌前的”是指非正常增生的细胞正在向恶性增殖的肿瘤细胞转变。对于结直肠瘤而言,包括以下类别:等级1:恶性腺体从肌粘膜渗透入息肉头部内的粘膜下层;等级2:相同的粘膜下层侵入,但存在于头部至茎部的
接合处;等级3:侵入茎部;以及等级4:在连接至结肠壁的连接处侵入茎的基部(该等级对应于dukes a期)。
99.在一些实施方案中,所述检测bcan基因区域的甲基化状态包括在来自所述个体的生物样品中测定bcan基因区域的一个或多个甲基化位点(例如cpg位点)中的胞嘧啶残基的甲基化状态。例如,可以选择测定整个bcan基因区域的甲基化状态,或其中部分区域的甲基化状态,例如上述目标dna区域的甲基化状态。
100.3.生物学样品的准备
101.本技术提供的方法可以用于任何从个体获得的含有dna的合适的生物样品。在一些实施方式中,所述生物样品选自组织学切片、组织活检、石蜡包埋的组织、手术切除样本、分离的细胞、体液(例如全血、血清、血浆、尿液、唾液、粘液、腹膜液、胸腔液、胸膜积液、滑液、脑脊髓液、胸腔穿刺液或腹腔积液)、结肠流出物(例如粪便和灌肠洗涤样品),及其任意组合。在生物学样品包含多种细胞群体的情况下,可能需要通过纯化或富集操作,分离出特定的细胞群体。在一些实施方式中,所述生物学样品是血液样品(例如全血、血清、血浆)或组织活检。
102.可以将生物样品直接用于本技术提供的方法,也可以先从生物样品中获取或分离dna,然后再用于本技术提供的方法。从所述生物样品中获取的dna可以是例如基因组dna、细胞内dna、或者细胞外游离dna。细胞外游离dna又称游离循环dna(cfdna),是一类被释放到体液(例如血浆)中的降解的dna片段。细胞外游离dna的来源多样,常见种类包括例如循环肿瘤dna(ctdna)。已在癌症患者中观察到升高的游离循环dna水平。
103.可以通过现有技术中的任何标准手段来分离样品中dna,对方法的选择会受到多种因素的影响,包括时间、费用和所需的dna的量。当dna被包裹在细胞膜中时,分离dna的一般性步骤包括:将生物样品破碎并通过酶、化学或机械手段裂解细胞;随后通过例如蛋白激酶k的消化清除蛋白和其它的污染物;接着通过包括盐析、有机提取或将dna结合到固相支持物等方法,从溶液回收dna。当dna未被包裹在细胞膜中时(例如来自血液样品的细胞外游离dna),可以使用现有技术中分离和/或纯化dna的标准方法。包括使用蛋白降解试剂,乙醇沉淀或丙醇沉淀等。也可以利用装置,例如诸如超滤的滤器,硅表面或膜,磁性颗粒,带正电荷的表面等。
104.在一些实施方案中,所述细胞外游离dna包括循环肿瘤dna。循环肿瘤dna是体液(例如,血液、尿液、唾液、痰液等)中来源于肿瘤细胞的dna片段。循环肿瘤dna的形成原因还不明确,推测是由凋亡或坏死的肿瘤细胞释放或由肿瘤细胞主动释放。
105.在一些实施方案中,本技术提供的方法还包括用试剂处理从所述生物样品中获取的所述dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获取处理的dna。
106.本领域已知某些试剂可以选择性地作用于未甲基化的胞嘧啶碱基,但不显著性地作用于甲基化的胞嘧啶残基;或者选择性地作用于甲基化的胞嘧啶碱基,但不显著性地作用于未甲基化的胞嘧啶残基。例如,某些试剂能够选择性地将未甲基化的胞嘧啶碱基转化为尿嘧啶、胸腺嘧啶或在杂交行为上不同于胞嘧啶的另一碱基。本领域已知甲基胞嘧啶与胞嘧啶具有与鸟嘌呤配对的相同的碱基配对行为,因此,所述处理可以将甲基化的dna根据其中胞嘧啶甲基化的状态转化成在杂交行为上不同的dna。在本技术中,经能够将未甲基化
的胞嘧啶碱基转化为尿嘧啶的试剂处理的dna又称为转化的dna,或预转化的dna。又例如,某些试剂能够选择性地酶切具有甲基化dna的酶切位点,或者选择性地酶切不具有甲基化dna的酶切位点。
107.在一些实施方式中,所述试剂是亚硫酸氢盐。本领域已知亚硫酸氢盐与未甲基化的胞嘧啶的特异反应,未甲基化的胞嘧啶被转变为尿嘧啶。甲基化的胞嘧啶不发生变化。常用的亚硫酸氢盐试剂包括:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。
108.亚硫酸氢盐处理通常在变性溶剂存在下进行,所述变性溶剂包括例如正烷基二醇、二乙二醇二甲基醚(dme)、二噁烷或二噁烷衍生物,优选地,所述变性溶剂以1%至35%(v/v)的浓度使用。优选地,该亚硫酸氢盐处理在清除剂存在下进行,所述清除剂包括例如色原烷衍生物、三羟基苯甲酸及其衍生物。还优选地,亚硫酸氢盐处理在30℃至70℃的反应温度下进行,在反应期间,温度可以短时间地增加至超过85℃。
109.在一些实施方式中,所述试剂是甲基化敏感限制酶(msre)。甲基化敏感限制酶根据其识别位点的甲基化状态而选择性消化核酸,从而区分(如位于cpg位点中)包含甲基化和未甲基化的胞嘧啶的dna。一部分甲基化敏感限制酶只对未甲基化的识别位点进行剪切,当其识别位点被甲基化时,不发生剪切或以显著降低的效率剪切;一部分甲基化敏感限制酶只对甲基化的识别位点进行剪切,当识别位点未被甲基化时,不会发生剪切或以显著降低的效率剪切。优选的是只对识别位点中胞嘧啶未甲基化的识别位点进行剪切的甲基化敏感限制酶。可用于本技术的甲基化敏感限制酶包括hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶以及其任何组合。在一个实施方案中,使用甲基化敏感性限制性核酸内切酶在足以消化核酸的条件下处理dna,获取处理的dna,随后用于核酸甲基化状态的检测。
110.4.核酸甲基化状态的检测
111.用所述试剂处理后的dna可以通过基于碱基特异性配对的常规技术(如扩增和杂交)来鉴定在从样品中获取的dna中甲基化位点(如cpg位点)的甲基化状态或水平。本技术所述的方法中可以使用任何适用于检测dna甲基化的任何方法。本领域已知众多方法可用于在生物样品(如血液、尿粪便或唾液)中检测在基因组特定位点的甲基化dna(参见kristensen和hansen,clin chem.55:1471-83,2009;ammerpohl et al.,biochim biophys acta.1790:847-62,2009;shames et al.,cancer lett.251:187-98,2007;clark et al.,nat protoc.1:2353-64,2006)。在一些实施方案中,所述甲基化状态的检测可以使用包括但不限于,基于扩增的方法、基于杂交的方法、基于测序的方法或基于限制性酶切的方法等。示例性的方法包括,聚合酶链式反应(例如实时聚合酶链式反应、数字聚合酶链式反应)、核酸测序、基于质量的分离(例如电泳法、质谱法)或靶标捕获(例如微阵列)。
112.a.基于扩增的方法
113.在一些实施方案中,检测bcan基因区域的甲基化状态包括使用扩增酶和一组或多组引物,扩增所述处理的dna,以产生至少一种扩增产物或者所述处理的dna不被扩增。在某些实施方案中,所述处理(例如经亚硫酸氢盐处理)的dna包括seq id nos:4-9、11-12所示的核苷酸序列及其任意组合,或选自由seq id nos:4-9、11-12组成的核苷酸序列。在某些实施方案中,所述扩增产物包含seq id nos:4-9、11-12所示的核苷酸序列及其任意组合,
是指两个或更多个核酸分子进行序列比对后,核苷酸残基的相同程度,比对时可以引入缺口以实现核苷酸残基的最大相同程度或最大配对程度。当两条核酸链具有至少80%同一性(通常至少约90%至95%,更优选约98%至100%同一性)时,可以认为这两条核苷酸链是基本相同的。在一些实施方案中,基本相同的两条核苷酸链可以是至少80%相同,至少85%相同,至少90%相同,至少95%相同,或100%相同。
121.同一性百分比(%)或互补性百分比(%)可以用比对中得到的相同核苷酸残基的数目除以比对中较短的核酸序列的核苷酸残基总数得到。本领域技术人员可以使用例如公开可用的工具(例如blastn,可在美国国家生物技术信息中心(ncbi)的网站上获得)来进行核酸序列比对得到同一性百分比(参见例如altschul sf et al.,j.mol.biol.,215:403-410(1990);stephen f.et al.,nucleic acids res.,25:3389-3402(1997))。
122.在一些实施方案中,所述引物包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。在一些实施方案中,所述引物包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列至少85%互补、至少90%互补、至少95%互补或100%互补的序列,或至少85%相同、至少90%相同、至少95%相同或100%相同的序列。
123.在一些实施方案中,所述引物是甲基化特异性的。如本文所用,甲基化特异性的引物是指这样的引物,其能够以甲基化特异性的方式扩增处理的dna上的特定靶标。所述引物可以特异性地扩增具有特定甲基化状态的dna分子而不扩增没有特定甲基化状态的dna分子。例如,所述引物可以是在中度严紧、严紧或高度严紧条件下特异性地与甲基化的特定cpg位点杂交,而不与未甲基化的该特定cpg位点特异性地杂交,因此所述引物将特异性地扩增在该特定cpg位点有甲基化的靶标。再例如,所述引物可以是在中度严紧、严紧或高度严紧条件特异性与未甲基化的特定cpg位点杂交,而不与甲基化的该cpg位点特异性地杂交,因此将特异性地扩增在该特定cpg位点未甲基化的靶标。
124.在本技术中可以使用甲基化特异性的引物来扩增处理的dna,从而区分甲基化和未甲基化的dna。甲基化特异性的引物包含至少一个与亚硫酸氢盐处理的cpg二核苷酸杂交的引物,即包含至少一个cpg二核苷酸用于扩增亚硫酸氢盐处理的甲基化的dna,或包含至少一个tpg或cpa二核苷酸用于扩增亚硫酸氢盐处理的未甲基化的dna。
125.在一些实施方案中,所述引物包含选自下组的序列,或者由选自下组的序列组成:
126.gggaagaaagggggttttgt(seq id no:13)bcan上游引物序列tacgacgaaaactacgcgaa(seq id no:14)bcan下游引物序列
127.设计例如在pcr中使用的引物的方法是本领域已知的(参见pcr primer:a laboratory manual,cold spring harbor laboratories,ny,1995)。为多种测定法设计最佳引物的的几种软件包也是公众可获得的,例如从美国马萨诸塞州cambridge的基因组研究中心(center for genome research,cambridge,mass.,usa)可获得的primer3。当然,设计引物期间还应考虑引物的可能用途。例如,为本技术目的设计的引物序列可以包含至少一个cpg位点,或者由所述引物得到的扩增产物可以包含至少一个cpg位点。本领域已知涉及检测dna甲基化状态的引物设计工具,例如methprimer(参见li lc and dahiya r.methprimer:designing primers for methylation pcrs.bioinformatics.2002nov;18(11):1427-31)。
128.制备寡核苷酸引物的方法是本领域已知的(参见oligonucleotide synthesis:a practical approach,irl press,oxford,1984)。例如,引物可以通过生物学合成法(例如通过用限制性核酸内切酶消化核酸)或通过化学合成法获得。对于短序列(至多到约100个核苷酸),优选化学合成法。对于较长序列,优选分子生物学中使用的标准复制方法,例如,使用m13获得单链dna(参见messing,methods enzymol.,101,20-78,1983)。
129.在一些实施方案中,扩增是在封闭试剂的存在下进行的。通过使用封闭试剂,也可以达到甲基化特异性扩增的效果。使用此类实例在本领域是已知的(参见yu et al.,biotechniques 23:714-720,1997)。
130.在一些实施方案中,所述封闭试剂包括不能被dna聚合酶延长和/或不能被dna聚合酶降解的封闭寡核苷酸。对于使用封闭寡核苷酸的pcr方法,要有效破坏封闭寡核苷酸特异性结合的核酸的扩增,需要使封闭寡核苷酸不能被聚合酶延伸。在一些实施方案中,所述封闭寡核苷酸在3’端不含有自由羟基,例如3’脱氧或者被羟基之外的其他基团取代(例如3
’-
o-乙酰基),从而不能被聚合酶延伸。另外,还需要防止dna聚合酶介导的封闭寡核苷酸的降解。在一些实施方案中,封闭寡核苷酸的5’端具有硫酯桥,从而防止被具有5
’-3’
外切酶活性的聚合酶降解。在一些实施方案中,设计引物的结合序列与封闭寡核苷酸的结合序列重叠,从而防止封闭寡核苷酸被具有5
’-3’
外切酶活性的聚合酶降解。另一些实施方案中,使用缺少具有5
’-3’
外切酶活性的聚合酶。本技术还可以使用肽核酸(pna)寡聚物作为封闭寡核苷酸。pna既不会被dna聚合酶分解也不会被dna聚合酶延伸,是理想的封闭寡核苷酸。
131.在一些实施方案中,所述封闭寡核苷酸能够与处理的dna上的cpg位点以甲基化特异性的方式杂交。例如,为了在未甲基化核酸的背景中检测甲基化核酸,对于经亚硫酸氢盐处理的dna,可以使用在相应位点包含“cpa”或“tpg”的封闭寡核苷酸来抑制在所述位置未甲基化的核酸的扩增;相对应地,如果需要抑制甲基化核酸扩增,可以使用在相应位点包含“cpg”的封闭寡核苷酸。
132.在一些实施方案中,扩增是在检测试剂的存在下进行的。
133.在一些实施方案中,检测试剂包含可检测的标记物标记的引物、可检测的标记物标记的寡核苷酸检测探针、或者dna双链插入染料。可检测的标记物的实例包括例如,荧光分子、生色分子、生物素、放射性同位素等。在一些实施方案中,检测试剂能够实时报告扩增产物的信息。
134.在一些实施方案中,其中所述寡核苷酸探针包含能够与所述扩增产物在严紧条件、中等严紧条件或高度严紧条件下杂交的序列。在一些实施方案中,所述寡核苷酸探针包含选自下组的序列,或者由选自下组的序列组成,
135.cgtcgggagggtcgg(seq id no:15)bcan探针序列
136.在一些实施方案中,寡核苷酸探针在5'端包含荧光染料(例如fam,hex/vic,tamra,德克萨斯红或cy5)的标记物,并在3'端包含淬灭剂(例如bhq1,bhq2,bhq3,dabcyl或tamra)的标记物。
137.探针可以使用与引物类似或相同的方法进行制备。在探针上标记可检测的标记物可以通过直接或间接的方法来完成。直接标记涉及将标记物直接(共价或非共价)偶联至寡核苷酸探针。间接标记涉及将标记物通过可以特异性结合(共价或非共价结合)标记物的中
间试剂偶联至寡核苷酸探针。中间试剂可以是多个(例如2个、3个以特异性方式依次结合的中间试剂),多个中间试剂通常用于放大可检测信号。适合用间接形式连接的可检测标记物包括抗体、链霉亲和素-生物素系统。
138.基于核酸扩增的方法也可以用于分析经过甲基化敏感限制酶(msre)消化的dna。例如,设计引物,使其结合位点位于目标dna区域内的特定甲基化敏感限制酶识别位点的两侧或与识别位点毗邻,从而仅在限制性识别位点未受切割时,才产生扩增产物,即扩增产物的存在或量可以指示目标dna区域内的特定甲基化敏感限制酶识别位点内的胞嘧啶的甲基化状态。在一些实施方案中,当msre切割未甲基化的dna时,扩增产物的存在将指示所述msre识别位点具有甲基化;在另一些实施方案中,当msre切割甲基化的dna时,扩增产物的存在将指示所述msre识别位点不具有甲基化。可以使用实时定量pcr对扩增产物进行分析,扩增产物的量指示甲基化的水平。
139.在一些实施方案中,基于所述扩增产物是否存在及其性质,确定所述bcan基因区域的甲基化状态。扩增的核酸产物可以通过本领域的常用方法进行分析,例如荧光检测、非变性琼脂糖凝胶电泳、非变性聚丙烯酰胺凝胶电泳、质谱法、液相色谱(例如hplc)、或毛细管电泳法。高通量检测方法也可用于本技术,例如基质辅助激光解吸附/电离飞行时间法(maldi-tof)、电喷雾电离(esi)、串联质谱法(如lc ms/ms)、生物传感器技术等。
140.在一些实施方案中,使用甲基化特异性pcr(methylation-specific pcr,msp)通过扩增经处理的dna的方法来检测甲基化状态(参见herman et al.,proc.natl.acad.sci.usa 93:9821-9826,1992)。例如,该扩增体系包含在中度和/或高度严紧条件下与未突变的序列特异性杂交的一个或多个引物,仅由包含甲基化胞嘧啶的模板产生扩增产物。类似地,从亚硫酸氢盐处理的dna的混合物中选择性扩增并检测甲基化或未甲基化组分的方法参见cottrell et al.,nucl.acids res.32:e10,2003(heavy methyl pcr)、rand et al.,nucl.acids res.33:e127,2005(headloop pcr)、rand et al.,epigenetics1:94-100,2006(bisulfite differential denaturation pcr)和pct/au07/000389(end-specific pcr)。
141.在一些实施方案中,使用实时定量pcr通过扩增经处理的dna的方法来检测dna甲基化状态(参见holland et al.,proc.natl.acad.sci.usa,88:7276-7280,1991;lee et al.,nucleic acid res.21:3761-3766,1993)。例如,methylight方法使用改良的taqman测定法来检测cpg二核苷酸的胞嘧啶甲基化(参见eads et al.,nucl.acids res.28:e32,2000)。简而言之,这种方法用亚硫酸氢盐处理包含核酸的样品后进行核酸扩增,扩增反应包含具有5'至3'核酸外切酶活性的dna聚合酶(例如taq dna聚合酶)和三种寡核苷酸。三种寡核苷酸分别是在扩增目的区域旁侧退火的正向引物和反向引物,以及在这两个引物之间与一个或多个甲基化cpg二核苷酸的位点杂交的探针。探针寡核苷酸的5'和3'段分别用荧光报告分子和淬灭剂标记,当探针是完整时,淬灭剂与荧光报告分子靠近,淬灭荧光,当探针寡核苷酸与扩增产物退火后,dna聚合酶的5'至3'核酸外切酶活性切割探针,使得淬灭剂释放荧光报告分子,荧光增强。可以通过荧光信号的增强来估测初始核酸模板的甲基化水平。在上述方法中,可检测性标记的探针可以使用分子信标(molecular beacon),该体系不依赖于dna聚合酶的5'至3'核酸外切酶活性(参见mhlanga和malmberg,methods 25:463-471,2001)。
1831,1992,clark et al.,nucl.acids res.22:2990-2997,1994)。例如,可以通过将未用亚硫酸氢盐处理过的样品所获得的测序结果或目的区域的已知核苷酸序列,与经亚硫酸氢盐处理过的样品的测序结果进行比较,从而鉴定dna序列中的甲基胞嘧啶:在亚硫酸氢盐处理的样品中对应于对照样品中的胞嘧啶位点处检测到的任何胸腺嘧啶可以视为由亚硫酸氢盐处理的引起的突变,即该位点存在甲基化胞嘧啶。该方法可以用于扩增后的经处理的dna,也可以直接用于处理的dna。
151.本领域已知多种dna测序的方法,例如双脱氧链终止法或maxam-gilbert法(见sambrook et al.,molecular cloning,a laboratory manual(第2版),cshp,new york 1989),焦磷酸测序法(如uhlmann et al.,electrophoresis,23:4072-4079,2002),固相焦磷酸测序法(参见landegren et al.,genome res.,8(8):769-776,1998),固相微量测序法(参见如southern et al.,genomics,13:1008-1017,199),采用fret的微量测序法(参见如chen和kwok,nucleic acids res.25:347-353,1997中描述),连接法测序,或超深度测序(参见marguiles et al.,nature437(7057):376-80(2005))。
152.一种用于测定亚硫酸氢盐处理的dna序列的方法可以是甲基化敏感性单核苷酸引物延伸法(methylation-sensitive single nucleotide primer extension,me-snupe)或snapmeth(参见gonzalgo和jones,nucl.acids res.,25:2529-2531)。使用一种寡核苷酸杂交至与甲基化胞嘧啶的位点毗邻的核酸区域,随后采用聚合酶和可检测标记(如荧光团标记)的游离核苷酸二磷酸或双脱氧核苷酸三磷酸进行引物延伸反应中,其中所述的游离核苷酸二磷酸或双脱氧核苷酸三磷酸对应于亚硫酸氢盐处理后在这个位点处可能出现的两种碱基之一(即,胸腺嘧啶或胞嘧啶)。在引物延伸后,将未结合的游离的核苷酸二磷酸或双脱氧核苷酸三磷酸,并且检测掺入的标记的核苷酸,从而显示在该位点的碱基。
153.d.基于限制性内切酶的方法
154.在一些实施方案中,通过组合的亚硫酸氢盐限制分析(combined bisulfite restriction analysis,cobra)来检测dna序列中的甲基化胞嘧啶的存在(参见(xiong和laird,nucl.acids res.,25:2532-2534,2001)。该方法利用首先利用试剂选择性修饰未甲基化的胞嘧啶,再利用未甲基化的胞嘧啶被修饰之后与甲基化的胞嘧啶之间在限制性酶识别位点的差异进行区分。
155.简而言之,亚硫酸氢盐处理将甲基化依赖的序列差异引入基因组dna后,使用特异性引物扩增包含有甲基化位点的目标dna区域,然后将扩增的产物用限制性内切酶消化,可以选择限制性位点以指示甲基化的存在或不存在。例如,限制性内切核酸酶taq1切割序列tcga,若该识别序列中的胞嘧啶未甲基化,经亚硫酸氢盐处理后,该序列将是ttga,因此将不被切割。限制性内切酶消化后的产物可以使用本领域已知的检测手段,例如电泳和/或质谱法进行检测。
156.在另一些实施方案中,基于用选择性突变未甲基化胞嘧啶残基的试剂处理后的核苷酸序列和/或二级结构的差异,使用不同的技术检测扩增产物中的核酸差异,例如甲基化单链构象分析法(ms-ssca)(bianco et al.,hum.mutat.,14:289-293,1999)、甲基化特异性变性梯度凝胶电泳(ms-dgge)(abrams和stanton,methods enzymol.,212:71-74,1992)和甲基化特异性变性高效液相色谱(ms-dhplc)(deng et al.,chin.j.cancer res.,12:171-191,2000)。
157.在一个方面,本技术提供一种在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向或监测大肠瘤进展或预后的方法,包括:
158.(a)从所述个体获取含有dna的生物样品;
159.(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中甲基化的cpg位点和未甲基化的cpg位点,从而获取处理的dna;
160.(c)使步骤(b)中所述的处理的dna与扩增酶和一组或多组适于扩增目标dna区域的引物接触,所述目标dna区域包含bcan基因区域或其互补序列的至少9个连续核苷酸,其中所述连续核苷酸包含至少一个cpg位点;
161.(d)基于扩增产物存在与否及其性质,确定目标dna区域的甲基化状态;
162.(e)将步骤(d)中确定的目标dna区域的甲基化状态与目标dna区域的正常甲基化状态进行比较,
163.其中相对于目标dna区域的正常甲基化状态而言,在步骤(d)中确定的目标dna区域的甲基化状态改变表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
164.在一些实施方案中,所述试剂(如亚硫酸氢盐)将未在5’甲基化的胞嘧啶碱基转变为尿嘧啶、胸腺嘧啶或其他在杂交行为上不同于胞嘧啶的另一碱基。在另一些实施方案,所述试剂是甲基化敏感限制酶。
165.在一些实施方案中,扩增目标dna区域,并基于扩增产物存在与否及其性质,确定目标dna区域的甲基化状态的方法可以选自现有技术已知的合适的任何方法。
166.在一些实施方案中,相对于目标dna区域的正常甲基化状态而言,在步骤(d)中确定的目标dna区域的较高甲基化状态表示所述个体患有大肠瘤,或者所述个体有大肠瘤形成或形成的倾向,或者所述个体有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向。
167.在一些实施方案中,bcan基因区域或目标区域的正常甲基化状态代表在来自未患有大肠瘤的个体,或者来自没有大肠瘤形成或形成的倾向的个体,或者来自没有大肠瘤发展或发展的倾向的个体,或者来自有大肠瘤预后良好或者预后良好的倾向的个体中所述bcan基因区域或目标区域的甲基化状态。
168.与正常甲基化状态的比较,可以以手动或计算机辅助的方式进行。对于计算机辅助的方式,可以通过计算机程序将检测到的生物样品的甲基化状态与储存在数据库中的正常甲基化状态进行比较。该计算机程序可以进一步评估比较的结果,并以合适的输出格式自动提供期望的评估。
169.在一些实施方案中,本技术提供的方法具有至少40%的灵敏度,且至少80%的特异性鉴定患有大肠瘤、有大肠瘤形成或形成的倾向、有大肠瘤发展或发展的倾向、有大肠瘤预后不良或预后不良的倾向的个体。
170.灵敏度的计算为:灵敏度=tp/(tp fn);特异性的计算为:特异性=tn/(fp tn),其中真阳性(tp)结果是测试为阳性且该疾病状态存在的情况,假阳性(fp)结果是测试为阳性但该疾病状态不存在的情况。真阴性(tn)结果是测试为阴性且该疾病状态不存在的情况。假阴性(fn)结果是测试为阴性但该疾病状态存在的情况。敏感性可以衡量在所测试的
个体中测试正确检测目标疾病或状态的测试能力,本技术提供的方法具有较高的敏感性,有利于减少因遗漏诊断而耽误疾病治疗的情况的发生。
171.5.检测工具及其应用
172.在一个方面,本技术提供一种用作检测工具的寡核苷酸,其包含bcan基因区域或其互补序列的至少9个连续核苷酸或者由bcan基因区域或其互补序列的至少9个连续核苷酸组成。
173.在一个方面,本技术提供一种用作检测工具的寡核苷酸,其包含bcan基因区域的经处理的dna序列或其互补序列的至少9个连续核苷酸,或者由bcan基因区域的经处理的dna序列或其互补序列的至少9个连续核苷酸组成。在一些实施方案中,所述处理适于将bcan基因区域中的至少一个未甲基化的胞嘧啶残基转变为尿嘧啶残基、胸腺嘧啶残基或在杂交上可检测地不同于胞嘧啶的其他残基。在一些实施方案中,所述处理的dna包括seq id nos:4-9、11-12所示的核苷酸序列及其任意组合。在一些实施方案中,所述处理的dna选自由seq id nos:4-9、11-12组成的核苷酸序列。在一些实施方案中,所述处理的dna包括seq id nos:1-3或10所示的核苷酸序列的msre酶切产物。
174.在一些实施方案中,所述寡核苷酸包含一个或多个cpg、tpg或cpa二核苷酸。
175.在一些实施方案中,所述寡核苷酸可以以化学连接的方式连接至一个或多个偶联物进行修饰,以提高该寡核苷酸的活性、稳定性或可检测性等。合适的偶联物包括生色团、荧光团、胆固醇、胆酸、硫醚、脂族链、磷脂、多胺、聚乙二醇、棕榈基、肽、杂交触发的交联剂、转运剂、杂交触发的切割剂等。所述寡核苷酸的糖和/或碱基可以包含至少一种已知的修饰,所述寡核苷酸的主链也可以是被修饰的,例如包含非天然核苷间键。在一些实施方案中,所述寡核苷酸可以采用肽核酸分子(pna)或锁定核酸分子(lna)的形式,以具有更好的配对性。
176.在一些实施方案中,所述寡核苷酸可以用作引物(如pcr引物)、检测探针或封闭寡核苷酸,优选地,所述寡核苷酸与样品中dna的杂交在高度严紧条件下进行。
177.在一些实施方案中,多个所述寡核苷酸可以以阵列(如矩形或六角形点阵)的形式结合到固相表面。固相表面的材料可以是硅、玻璃、聚苯乙烯、金属、硝酸纤维素、尼龙等。寡聚体阵列制备可以参见nature genetics supplement,volume21,january 1999。
178.在一些实施方案中,所述寡核苷酸包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列基本互补或基本相同的序列。在一些实施方案中,所述寡核苷酸包含与选自seq id nos:1-12的序列的至少9个连续核苷酸的序列至少80%互补、至少85%互补、至少90%互补、至少95%互补、或100%互补的序列,或者至少80%相同、至少85%相同、至少90%相同、至少95%相同、或100%相同的序列。在一些实施方案中,所述寡核苷酸含有选自下组的序列,或者由选自下组的序列组成:seq id no:13、14和15。
179.在一些实施方案中,所述寡核苷酸可以用于在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向、监测大肠瘤进展或预后、或监测对大肠瘤治疗的应答的方法。在另一些实施方案中,所述寡核苷酸可以用于制备用于在个体中诊断大肠瘤、筛查大肠瘤形成或形成的倾向、监测大肠瘤进展或预后,或监测对大肠瘤治疗的应答的方法的试剂盒。
180.在另一个方面,本技术提供一种区分目标dna区域的甲基化和未甲基化cpg位点的试剂(例如亚硫酸氢盐试剂或甲基化敏感限制酶(msre)),所述试剂可用于制备在个体中诊
断大肠瘤、筛查大肠瘤形成或形成的倾向、监测大肠瘤进展或预后,或监测对大肠瘤治疗的应答的方法的试剂盒,其中所述方法包括使所述个体的生物样品中分离的dna与所述至少一种试剂和与所述目标dna区域在严紧条件下、中等严紧条件下或者高度严紧条件下杂交的一种或多种寡核苷酸接触。在一些实施方案中,所述试剂为亚硫酸氢盐试剂或甲基化敏感限制酶(msre)。
181.在另一个方面,本技术提供一种用于诊断大肠瘤、筛查大肠瘤形成或形成的倾向或监测大肠瘤进展或预后的试剂盒,其包括第一试剂,所述第一试剂包含一种或多种如本技术所提供的用作检测工具的寡核苷酸。
182.在一些具体实施方案中,所述试剂盒还包括第二试剂,所述第二试剂包含一种或多种如本技术所提供的区分目标dna区域的甲基化和未甲基化cpg位点的试剂。
183.在一些具体实施方案中,所述第一试剂和所述第二试剂被包装在单一容器内或者被分别包装在独立的容器内。在一些具体实施方案中,所述的试剂盒进一步包括适于盛放来自所述个体的生物样品的容器。在一些具体实施方案中,所述的试剂盒进一步包括使用说明书和/或对试剂盒检测结果的解释。
184.在某些实施方案中,试剂盒可进一步包含存储在计算机可读介质上的计算机程序产品。当计算机程序产品由计算机执行时,它基于以下鉴定出有大肠瘤发展或发展的倾向,或者所述个体有大肠瘤预后不良或预后不良的倾向的个体:相对于bcan基因区域的正常甲基化状态而言,在来自所述个体的生物样品中检测到的bcan基因区域的较高甲基化状态。本技术考虑任何能够存储此类计算机可执行指令并将其传送给最终使用者的介质。这样的介质包括但不限于电子存储介质(例如磁盘、磁带、磁带盒(cartridge)、芯片)、光学介质(例如,cd rom)等。此类介质可以包括提供此类指导材料的因特网网站的网址。
185.也可以使用载波信号对计算机程序进行编码和传输,这些载波信号适用于经由符合包括因特网的各种协议的有线网络、光学网络和/或无线网络进行传输。因此,可以使用此类程序编码的数据信号来创建根据本技术的实施方案的计算机可读介质。可以将程序代码编码的计算机可读介质与兼容设备打包在一起,或者与其他设备分开(例如,通过因特网下载)提供。任何这样的计算机可读介质可以驻留在单个计算机产品(例如,硬盘驱动器、cd或整个计算机系统)上或内部,并且可以存在于系统或网络内的不同计算机产品上或内部。
186.在一些实施方案中,试剂盒可以包含天然或合成性对照dna序列,其代表目标dna区域的甲基化或未甲基化形式。在一些实施方案中,试剂盒还可以包含可检测标记物,其任选地与所述第一试剂连接。在一些实施方案中,试剂盒中包括在实施本技术提供的方法时有用的其他材料,例如试管、移液管等。
187.在一些实施方案中,所述试剂盒包括,
188.(a)亚硫酸氢盐试剂或甲基化敏感限制酶试剂;
189.(b)适合于容纳所述试剂和来自所述个体的生物样品的容器;
190.(c)一组或多组引物,其包含能够与经亚硫酸氢盐或甲基化敏感限制酶处理的dna中的bcan基因区域序列的至少9个连续核苷酸的序列互补或相同的序列;以及任选地,
191.(d)使用说明书和/或对试剂盒检测结果的解释。
具体实施方式
192.实施例1.甲基化特异性引物、探针的验证
193.选取经亚硫酸氢盐处理的参考dna来验证引物的特异性。首先,针对bcan基因区域内的目标dna区域以及内参基因actb分别设计了引物和探针。然后,梯度配置了100%、50%、25%、10%比例的甲基化dna(qiagen 59655)至非甲基化dna(qiagen 59665)中,dna总量为4ng。最后,在各个梯度的dna混合物中使用设计的引物来扩增dna,重复两次。用于检测bcan的引物和探针,以及用于检测内参基因actb的无甲基化特异性引物和探针的序列参见表1。在pcr反应体系中,引物终浓度为500nm,探针终浓度为100nm。
194.表1.bcan基因区域内的目标dna区域和内参基因actb的引物序列和探针序列
[0195][0196]
pcr反应体系如下:4ng不同甲基化比例的dna混合物10ul;表1所示引物和探针预混液2.5ul;pcr试剂(epitect methylight pcr kit,qiagen)12.5ul。
[0197]
pcr反应条件如下:95℃5分钟;95℃15秒,56℃40秒(采集荧光),50个循环。针对不同基因探针修饰荧光,选择相应检测荧光通道,使用abi 7500real-time pcr仪器进行检测。
[0198]
结果
[0199]
计算每个pcr反应的ct值,并分析各个dna混合物中各个基因pcr反应得到的ct值。结果显示,对于bcan,ct值随着dna混合物中转化的甲基化dna百分比的增加而降低(如图1a所示),这表明用于扩增bcan基因区域目标靶点的引物是甲基化特异性的引物。而对于内参基因actb,每种dna混合物的曲线重合(如图1b所示),这表明尽管dna混合物中转化的甲基化dna百分比增加,但是ct值仍然保持不变,这表明用于扩增内参基因actb的引物是非甲基化特异性的引物。
[0200]
实施例2.比较bcan在不同组织中的甲基化丰度
[0201]
分别使用来自肠镜阴性个体的血细胞、来自结直肠癌个体的癌旁组织和结直肠癌组织、来自腺瘤个体的高级别腺瘤组织的dna样本来检测目标靶点bcan基因区域的甲基化丰度,探索目标靶点在结直肠癌血液筛查中的潜能。
[0202]
所述检测包括如下步骤:
[0203]
1.分别从血细胞、癌旁组织、高级别腺瘤组织和结直肠癌组织各获取10份dna样本
(即,总共40份样本)。采用商业化试剂盒qiaamp dna mini kit按照说明书要求提取血细胞dna;对于癌旁组织、高级别腺瘤组织和结直肠癌组织dna,采用商业化试剂盒qiaamp dna ffpe tissue kit按照说明书要求进行提取。
[0204]
2.使用商业化亚硫酸氢盐转化试剂methylcode
tm bisulfite conversion kit对步骤1中获取的dna样本进行亚硫酸盐转化处理,得到转化后的dna。
[0205]
3.对转化后的dna进行荧光pcr检测,使用如表1所示的引物和探针序列,并且同时对内参基因actb进行检测,作为对照。
[0206]
引物终浓度为500nm,探针终浓度为100nm,探针用荧光基团vic和淬灭基团bhq1标记。
[0207]
pcr反应体系如下:转化后的dna 10ul;表1所示引物和探针预混液2.5ul;pcr试剂(pcr mixuniversal probe qpcr master mix(neb))12.5ul。
[0208]
pcr反应条件如下:95℃3分钟;95℃30秒,56℃60秒(采集荧光),15个循环。针对不同基因探针修饰荧光,选择相应检测荧光通道,使用abi 7500real-time pcr仪器进行检测。
[0209]
4.计算和汇总各检测的ct值,比较血细胞、癌旁组织、高级别腺瘤组织和结直肠癌组织样本的ct值分布。
[0210]
结果
[0211]
结果显示bcan基因区域在血细胞中的甲基化丰度远远低于组织样本,且在癌旁组织中低于高级别腺瘤组织和结直肠癌组织(参见图2a),具有进行血液筛查的潜能。图2b的内参基因actb作为对照。
[0212]
实施例3.用细胞外游离dna检测bcan甲基化
[0213]
使用荧光pcr检测方法对130例结直肠癌个体的血浆样本和116例肠镜阴性个体的血浆样本进行检测。在130例结直肠癌个体的血浆样本中,有25例i期样本、33例ii期样本、40例iii期样本、22例iv期样本、10例分期信息不明。
[0214]
所述检测包括如下步骤:
[0215]
1.使用商业化qiagen qiaamp circulating nucleic acid kit抽提上述血浆样本中的细胞外游离dna。
[0216]
2.使用商业化亚硫酸氢盐转化试剂methylcode
tm bisulfite conversion kit对抽提出的细胞外游离dna进行亚硫酸盐转化处理,得到转化后的dna。
[0217]
3.将上述转化后的dna稀释10倍后用于荧光pcr检测。使用如表1所示的引物、检测探针序列,并且同时对内参基因actb进行检测,作为对照。引物终浓度为500nm,探针终浓度为200nm。选择商业化pcr mix试剂,即neb公司universal probe qpcr master mix(neb)作为pcr试剂。
[0218]
4.pcr反应体系与实施例2相同。pcr反应条件如下:95℃5分钟;95℃15秒,56℃40秒(采集荧光),50个循环。针对不同基因探针修饰荧光,选择相应检测荧光通道。
[0219]
5.计算和汇总各结直肠癌血浆样本和肠镜阴性血浆样本的ct值,结果如图3所示。其中无任何扩增信号样本的ct值被设定为50。
[0220]
6.判读标准:bcan ct值小于等于27,actb ct值小于等于25为阳性;bcan ct值大于27,actb ct值小于等于25为阴性;actb ct值大于25,认定检测失败,需重新检测。
[0221]
结果
[0222]
由图3可以看出,结直肠癌个体的血浆样本中的bcan基因区域的甲基化水平显著性地高于肠镜阴性个体的血浆样本中的bcan基因区域的甲基化水平。经由spss独立样本等方差t检验,得到p值为3.32e-13,远小于常用的统计学显著性的阈值0.05。
[0223]
表2中显示了用本技术所述的方法检测到的结直肠癌阳性样本数和阴性样本数,并分别与肠镜检查结果进行比较。结果显示,在130例结直肠癌样本中,本技术所述的方法共检出了其中的66例(灵敏度高达50.7%);对于116例肠镜阴性样本,本技术所述的方法检出了其中的99例(特异性高达84.6%)。由此可见,本技术所述的方法对结直肠癌筛查具有较高的灵敏度和特异性。作为对比,目前公认用于血浆检测的septin9,在临床试验样本中的肠癌检出率为48.2%(请参见,t.r.church et al.,gut.;63:317
–
325(2014))。
[0224]
表2.本技术方法检测结果与肠镜检查结果的对比
[0225]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

