1.本发明涉及一种药物中间体的产生菌选育及其发酵技术,特别涉及一种用于生产奥利万星中间体a82846b组分的微生物菌株的诱变育种及其相应的发酵工艺。
背景技术:
2.当前,在抗细菌感染药物领域,临床应用较多的是以青霉素类和头孢类抗生素为代表的β-内酰胺类广谱抗生素。由于长期、大剂量的不当使用,造成近年来耐药性病原菌大量出现,并不断进化,使得传统一线抗生素品种遭遇抗菌效果不良甚至无效的窘境。
3.糖肽类抗生素由于其不同于β-内酰胺类抗生素的作用机制,对于常见具有β-内酰胺酶的耐药菌具有很好的抗菌效果。万古霉素作为第一代糖肽类抗生素的代表品种,被用于治疗耐甲氧西林金葡菌(mrsa)感染,一度取得了极佳的疗效。但随着日益广泛的临床应用,又开始出现对万古霉素耐药的金葡菌(vrsa)和肠球菌(vre)。万古霉素、替考拉宁等第一代糖肽类抗生素已不能完全满足当前的临床需要,有必要开发新一代的糖肽类抗生素。
4.奥利万星(oritavancin)是由the medicines公司最终完成上市开发的第二代糖肽类广谱抗生素,其抗菌谱和临床应用效果比万古霉素更为优秀。该品种于2014年8月6日获fda批准上市。获准上市的化合物为奥利万星的二磷酸盐,商品名为fda批准其用于由敏感革兰氏阳性菌(包括mrsa)导致的absssi成人患者的治疗。
5.奥利万星属于新型半合成脂糖肽类抗生素,对多重耐药(mdr)的葡萄球菌、肠球菌以及链球菌都有着良好的活性,同时较长的半衰期使得它在临床实践上竟可以采用全疗程单次给药的治疗方案,这是fda批准的首个也是唯一用于absssi治疗的单剂量治疗方案抗生素。
6.a82846b是奥利万星化学合成的关键中间体,目前其唯一来源是微生物发酵生产。该化合物最初由eli lilly&company公司于20世纪90年代从东方诺卡氏菌(nocardia orientalis)某些菌株的发酵液中发现,美国专利us5312738(申请日1990年5月9日)对a82846b的产生菌、发酵及提取工艺进行了阐述。但该专利及后续文献所报道的发酵工艺存在下列三方面缺陷:一是目标组分a82846b发酵效价较低(150mg/l);二是发酵培养基中大量采用酪蛋白、酪氨酸等价格昂贵的原料,造成发酵成本高昂;三是发酵液中同时含有三种同系物:a82846a、a82846b、a82846c(分别简称为“a组分”、“b组分”、“c组分”),其中,作为杂质的a组分占比过高(a/b比值为3~4),由此造成目标产物分离困难,提取收率低、成本高。上述缺陷制约了该新型抗生素的产业化开发。通过生产菌株选育及配套发酵工艺的开发,减少发酵培养基中高价原材料的使用,进一步提升发酵效价,尤其是提高发酵液中b组分的占比(即降低a/b比值),对于该品种的产业化开发将极具应用价值。
7.奥利万星中间体a82846b的分子式为c
73
h
88
cl2n
10
o
26
;cas no.:118395-73-6;结构式如式1所示:
[0008][0009]
主要杂质a组分的研发代号为a82846a,分子式为c
73
h
89
cln
10
o
26
;cas no.:110865-90-2;结构式如式2所示:
[0010][0011]
自然界中,微生物的遗传物质在繁殖传代的过程中会自发产生一些突变,从而形成新的性状。但自然突变的概率很低,仅为10-9
~10-6
,不能满足科研和实际生产的需要。通过人工诱变技术处理,可大大提高菌株的突变率,加速育种工作的进程。uv紫外诱变技术是微生物诱变育种领域广泛采用的经典诱变技术,具有操作简便、效果稳定、安全可靠的优点。其作用原理在于:利用uvc波段的短波紫外光(λ=254nm)照射微生物细胞,可造成受试
细胞dna分子的损伤(断裂或形成嘧啶二聚体),并在随后的修复过程中进一步产生错配等突变,由此在子代细胞中形成新的性状。紫外诱变所造成的dna损伤及由此所产生的突变是随机的,因此需要在大量样本中筛选出希望的目标突变株。
技术实现要素:
[0012]
本发明的目的在于提供一株产生奥利万星中间体a82846b的菌株,该菌株的保藏编号为cgmcc no.17931。
[0013]
其中,奥利万星中间体a82846b的结构式如式1所示:
[0014][0015]
该菌株的生物材料保藏信息:
[0016]
该菌株,已于2019年6月14日提交中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)进行专利保藏。保藏地址:北京市朝阳区北辰西路1号院3号(邮编100101);保藏编号为:cgmcc no.17931;生物材料(株)为:jh100-32b16b;分类命名为:荒漠拟孢囊菌kibdelosporangium aridum。
[0017]
以东方诺卡氏菌(nocardia orientalis)产a82846系列化合物菌株的自然分离株jh100为原始出发菌株,经第一轮诱变及复筛后得到突变株jh100-32b;再以突变株jh100-32b为后续出发菌株进行多轮紫外诱变,筛得一株生产性能独特,可利用不含速效有机氮源的贫培养基发酵的突变株,命名为jh100-32b16b。
[0018]
该菌株具有下列生物学特性:
[0019]
(1)形态学特征
[0020]
所述菌株在不同固体培养基上可分化或不分化气生菌丝,气生菌丝一般为白色。基质菌丝淡黄色或棕色。菌落隆起,形成该菌特有的环形山形态。培养后期,菌落顶部会生成白色分生孢子。在isp-2固体培养基上,基质菌丝可产淡棕色水溶性色素,其他配方固体培养基上暂未发现有可溶性色素生成。
[0021]
所述菌株在液体培养环境中会形成菌丝球,培养液粘度逐步增大。
[0022]
所述菌株镜下形态为丝状多细胞,原核,革兰氏染色阳性。菌丝直径约0.5μm。
[0023]
(2)培养特性
[0024]
所述菌株在20~35℃、ph4.5~7.8条件下的固体、液体培养基中均能良好生长。
[0025]
(3)生理生化特征
[0026]
碳源利用方面,所述菌株除乳糖、山梨糖、山梨醇、赤藓醇、棉籽糖外,一般碳源均能利用;氮源方面,所述菌株不能利用赖氨酸和还原硝酸盐;所述菌株能胨化牛奶,不能液化明胶。
[0027]
本发明克服现有菌株发酵生产奥利万星中间体a82846b的过程中,发酵培养基含酪氨酸、水解酪蛋白等高价原料,且目标产物发酵效价低,造成发酵成本过高;以及发酵液中杂质-产物比(a/b值)较高,造成产物提取收率低、成本高的问题。
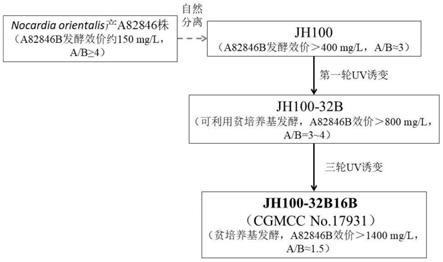
[0028]
本发明的另一个目的在于,提供一种发酵制备奥利万星中间体a82846b的方法。
[0029]
将保藏编号为cgmcc no.17931的菌株,在不含速效有机氮源的贫培养基中进行发酵,从发酵液中获得奥利万星中间体a82846b。
[0030]
所述贫培养基包含下列组分(g/l):速效碳源0~30,缓效碳源10~60,缓效氮源10~50。所述的速效碳源为葡萄糖、蔗糖、麦芽糖中的一种或多种;所述的缓效碳源为麦芽糊精、玉米淀粉中的一种或多种;所述的缓效氮源为大豆饼粉、棉籽饼粉、花生饼粉中的一种或多种。所述的贫培养基不含速效有机氮源。所述贫培养基的ph值为各组分按比例配制后所呈现的自然ph值。
[0031]
较佳的,所述的贫培养基包含下列组分(g/l):葡萄糖10~30,麦芽糊精20~60,糖蜜10~30,棉籽饼粉10~50,ph自然。
[0032]
更佳的,所述的贫培养基各组分含量为(g/l):葡萄糖20~30,麦芽糊精30~50,糖蜜15~25,棉籽饼粉10~20,ph 6.0~7.5。
[0033]
所述的发酵其温度为20~35℃,较佳的为25~30℃;发酵周期240~500小时,较佳的为288~360小时。
[0034]
所述的发酵在10l发酵罐中进行时,工艺参数为:起始装液量为4~7l,较佳的为4.5~6.0l;搅拌转速为200~1000rpm,较佳的为300~800rpm;通气量为0.3~1.0vvm,较佳的为0.5~1.0vvm;发酵液溶解氧水平为0~100%,较佳的为20~50%;发酵接种量为5~15%,较佳的为5~10%。
[0035]
所述的发酵在30l发酵罐中进行时,工艺参数为:起始装液量为10~20l,较佳的为12~15l;搅拌转速为200~1000rpm,较佳的为200~700rpm;通气量为0.2~1.0vvm,较佳的为0.3~0.5vvm;发酵液溶解氧水平为0~100%,较佳的为20~30%;发酵接种量为5~15%,较佳的为5~8%。
[0036]
所述的发酵在发酵罐中进行时还包括补料操作。
[0037]
所述的补料包含下列组分:有机碳源0~50%,有机氮源0~30%。所述的有机碳源为蔗糖、麦芽糖、糖蜜、麦芽糊精中的一种或多种;所述的有机氮源为蛋白胨、玉米浆、鱼粉、大豆蛋白粉中的一种或多种。
[0038]
较佳的,所述补料的组分为:糖蜜10~30%,蔗糖0~50%,蛋白胨0~30%。
[0039]
所述的补料操作是将前文所述的补料按一定流速补入主发酵罐的过程。补料速率根据发酵过程的溶解氧、还原糖、氨基氮等指标综合评估后确定。
[0040]
以下制备方法是在实施例的基础上进行概括和提炼,请核对下是否准确:
[0041]
根据实施例之一,奥利万星中间体a82846b的制备方法,包括以下步骤:
[0042]
将甘油管保藏的jh100-32b16b菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d。挑取活化好的菌苔,转接到种子瓶中。种子瓶装液量为:250ml三角瓶内装30ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵摇瓶中,进行摇瓶发酵。摇瓶发酵培养基配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。发酵瓶装液量为250ml三角瓶内装20ml培养基。发酵摇瓶接种量10%。发酵培养条件为28℃,恒温摇床转速200rpm,振荡培养7d。
[0043]
根据实施例之一,奥利万星中间体a82846b的制备方法,包括以下步骤:
[0044]
将甘油管保藏的jh100-32b16b菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d;挑取活化好的菌苔,转接到种子瓶中;种子瓶装液量为500ml三角瓶内装125ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵罐中进行罐上发酵。发酵罐底料配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。初始装液量为6l,将发酵培养基各组分投料后加入去离子水溶解,5n naoh溶液调节ph值为7.5,121℃灭菌30min后冷却到室温等待接种;发酵罐接种量8~10%。发酵温度28℃,起始搅拌转速300rpm,起始通气量0.5vvm,此后根据溶氧情况逐步上调搅拌转速和通气量。发酵运行48h开始启动补料;补料配方为:糖蜜30%、蔗糖10%、蛋白胨20%;补料方式为恒速流加,速率100ml/d。主发酵运行384h后放罐,采用hplc检测目标产物a82846b的浓度。
[0045]
根据实施例之一,奥利万星中间体a82846b的制备方法,包括以下步骤:
[0046]
将甘油管保藏的jh100-32b16b菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d;挑取活化好的菌苔,转接到种子瓶中;种子瓶装液量为1l三角瓶内装250ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵罐中进行罐上发酵。发酵罐底料配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。主发酵罐初始装液量为16l,将发酵培养基各组分投料后加入去离子水溶解,5n naoh溶液调节ph值为7.5,121℃灭菌30min后冷却到室温等待接种;本次接种量1l种子液。发酵温度28℃,起始搅拌转速300rpm,起始通气量0.5vvm,此后根据溶氧情况逐步上调搅拌转速和通气量。发酵运行48h开始启动补料;补料配方为:糖蜜30%、蔗糖10%、蛋白胨20%;补料方式为do关联,维持do在10~30%区间。主发酵运行312h后放罐,采用hplc检测目标产物a82846b的浓度。
[0047]
本发明还提供了一种用于发酵生产奥利万星中间体a82846b的种子制备工艺。
[0048]
所述的种子制备工艺包括将保藏编号为cgmcc no.17931菌株活化后转接摇瓶种,摇瓶种成熟后再转接罐种子,最终获得主发酵所需种子培养液的过程。
[0049]
所述的菌种活化是指将保藏编号为cgmcc no.17931菌株转接到活化培养基上进行培养的过程。所述的菌种活化培养采用常见的放线菌培养基,较优的为isp-2固体培养基。培养基形式为平板或斜面。所述的菌种活化培养条件为:温度15~35℃,较优的为25-30
℃;培养周期3~10d,较优的为5~7d。
[0050]
所述摇瓶种的制备是指将活化后的荒漠拟孢囊菌cgmcc no.17931培养物转接到种子培养基,并在摇瓶中进行培养的过程。
[0051]
所述的种子培养基含下列组分(g/l):葡萄糖5~20,麦芽糊精10~30,水解酪蛋白3~10,酵母提取物3~10,ph自然。
[0052]
较佳的,所述的摇瓶种子培养基各组分含量为(g/l):葡萄糖8~15,麦芽糊精15~20,水解酪蛋白5~10,酵母提取物5~10,ph6.5~7.5。
[0053]
所述摇瓶种的培养在摇瓶中进行。较佳的,摇瓶采用1l容量,内装250ml摇瓶种子培养基;所装摇瓶种子培养基采用本领域常规的高压蒸汽灭菌工艺进行灭菌;采用前述的经过活化培养的荒漠拟孢囊菌cgmcc no.17931培养物对灭过菌的摇瓶种子培养基进行接种,接种量较佳的为2~8%;将接种后的摇瓶在恒温摇床上进行振荡培养,摇床转速较佳的为150~250rpm,温度较佳的为25~30℃,培养周期较佳的为1~2d。
[0054]
所述罐种子的制备是指将荒漠拟孢囊菌cgmcc no.17931的摇瓶种转接到种子培养基中并在种子罐内进行培养的过程。
[0055]
所述罐种子的培养在10l种子罐中进行。工艺参数为:种子罐起始装液量为4~7l,较佳的为5~6l;搅拌转速为100~600rpm,较佳的为200~400rpm;通气量为0.1~0.5vvm,较佳的为0.3~0.5vvm;发酵液溶解氧水平为0~100%,较佳的为20~30%;初始接种量为2~10%,较佳的为3~5%。培养时间视菌密度、ph值及do变化趋势而确定,一般为24-48h。
[0056]
在不违背本领域常识的前提下,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0057]
本发明所用试剂和原料均市售可得。
[0058]
本发明的积极进步效果在于:
[0059]
本发明提供了一株通过紫外诱变筛得的奥利万星中间体(a82846b)产生菌cgmcc no.17931菌株,该菌株遗传性状稳定,能以不含速效氮源的贫培养基作为主发酵罐培养基进行发酵产生奥利万星中间体a82846b组分,且发酵液中的杂质-产物比(a/b值)远低于对照水平。采用该菌株,以及基于该菌株所开发的发酵培养基及控制工艺,可在30l发酵罐上实现a82846b发酵效价1450mg/l,发酵原材料成本比对照工艺降低90%以上;且发酵液中杂质-产物比(a/b值)仅为1.5~2.0(已有文献报道中该值一般为3~5),极大提高了后续的提取步骤得率,有助于进一步降低提取成本。
[0060]
本发明所选用的荒漠拟孢囊菌株,无需速效氮源和酪蛋白等昂贵原材料,可利用低成本的贫培养基发酵生产a82846b组分,发酵效价高,且b组分占比远高于对照工艺,显著降低发酵和提取成本,有利于本品种的工业化生产。
[0061]
本发明利用uv照射方式对出发菌株进行多轮人工诱变,获得了具有优良生产性能的荒漠拟孢囊菌突变株。并基于该荒漠拟孢囊菌突变株进行了有针对性的培养基组分优化及发酵工艺开发,提高了发酵效价、降低了杂质-产物比(降至对照菌株水平的一半),并显著降低了发酵成本(降至对照水平的1/10),简化了提取流程。
附图说明
[0062]
图1是菌株jh100-32b16b(cgmcc no.17931)的选育谱系图。
[0063]
图2是实施例3的发酵液hplc分析谱图。
[0064]
图3是实施例7的发酵液hplc分析谱图。
[0065]
图4是实施例7发酵液中所产a82846b的lc-ms谱图。
[0066]
图5是实施例7发酵过程的a82846b效价曲线。
具体实施方式
[0067]
下面结合具体实例和附图,进一步说明本发明内容。应理解这些实例仅为更好地说明发明内容,并不因此而将本发明限定于所举实施例各项技术参数范围内。
[0068]
实施例1
[0069]
菌株jh100-32b16b(cgmcc no.17931)的获得。
[0070]
从一株产a82846系列化合物的东方诺卡氏菌(hamill et al.a82846 antibiotics[p].usp 5312738,may 17,1994)中通过自然分离获得jh100菌株。以jh100为出发菌株,开始后续诱变育种操作。
[0071]
细胞准备:首先将jh100液体培养物以无菌水作梯度稀释,稀释试管内加入玻璃珠,在振荡器上充分振荡,确保菌丝打散;以无菌刻度吸管吸取约0.1ml适当稀释度的菌悬液,滴加在无菌isp2平板上,以l型玻璃刮棒进行涂布。按此操作准备若干涂布平板。
[0072]
第一轮诱变:将前文所述的出发菌株(jh100)涂布平板置于紫外灯下照射。所述的紫外灯照射参数为:uv波长254nm,灯管功率8w,受试样品照射间距20cm,照射时间分别为30s、1min、2min、5min、10min。对照组(ck)不照射。除uv照射外的操作全程在避光环境中完成。将所有完成照射的受试组和对照组平板置于28℃恒温培养箱中培养5d。
[0073]
初筛:将前文所述的受试组及对照组平板从培养箱取出,观察菌落生长情况。对照组生长正常,显示培养条件和菌种均无异常,实验结果可信。2min、5min和10min照射组致死率均>99%,在这三组平板上随机挑取若干单菌落,转接斜面,编号后置于28℃恒温培养箱培养48h。斜面所用配方仍为isp-2。从培养完成的斜面挑取菌苔,转接种子瓶,同时制作甘油管进行保藏,以备后续复筛时使用。
[0074]
所述的种子瓶配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白10,酵母提取物10,ph 7.2。所述的种子瓶装液量为250ml三角瓶内装30ml培养基。所述的种子瓶培养条件为28℃,恒温摇床转速180rpm,振荡培养48h。所述的甘油管保藏条件是-80℃深冻冰箱保藏。
[0075]
种子培养完成后转接发酵瓶进行摇瓶发酵。所述的发酵培养基组分为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,水解酪蛋白10,酵母提取物10,棉籽饼粉10,ph 7.5。发酵瓶装液量为250ml三角瓶内装20ml培养基。种子液接种量10%。发酵培养条件为28℃,恒温摇床转速200rpm,振荡培养10d。发酵结束后采用hplc检测目标产物a82846b的浓度,并计算a/b值,以这两项指标作为判断菌株表现的评价标准。
[0076]
复筛:从初筛得到的实验结果中,挑选出a82846b发酵效价高、a/b值低的突变株,再次制种、摇瓶发酵。所述的制种、发酵培养基及条件参数均与初筛相同,考察其发酵效价和a/b值。将复筛结果中两项指标优于对照组(出发菌株),且前后两次筛选的数据重复性好、遗传性状稳定的突变株挑选出来,进行第二轮诱变筛选。本轮诱变得到一株较优突变株jh100-32b,其a82846b的摇瓶发酵效价>400mg/l,a/b值约为3。
[0077]
第二轮及后续诱变:将第一轮诱变所获较优突变株jh100-32b作为后续操作的出发菌株,按前文所述第一轮诱变的方法再次进行紫外诱变。诱变后的初筛、复筛操作均与第一轮诱变相同。从后续诱变中挑选出相对最优的菌株继续诱变。共进行了三轮后续诱变,得到一株编号为jh100-32b16b的突变株,该菌株能利用不含速效有机氮源的贫培养基进行摇瓶发酵。在250ml摇瓶中a82846b发酵效价>400mg/l,a/b值为1.2~1.5。所述的贫培养基配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。
[0078]
将上述编号为jh100-32b16b的突变株于2019年6月14日送交中国微生物菌种保藏管理委员会普通微生物中心进行专利保藏,登记入册编号为:cgmcc no.17931。生物材料(株)为:jh100-32b16b;分类命名为:荒漠拟孢囊菌kibdelosporangium aridum。
[0079]
实施例2
[0080]
菌株jh100-32b16b(cgmcc no.17931)的鉴定。
[0081]
(1)菌株jh100-32b16b的形态特征
[0082]
将菌株jh100-32b16b在不同配方的固体培养基(平板)上28℃培养5~7d后观察菌落形态参见表1:
[0083]
表1
[0084][0085]
挑取菌株jh100-32b16b的气生菌丝,在光学显微镜下观察,其特征为:孢子丝直、柔曲、钩状、松敞及紧密的螺旋形;孢子柱形,存在孢囊结构。
[0086]
(2)菌株jh100-32b16b的培养和生理生化特性
[0087]
考察了菌株jh100-32b16b在培养过程中的生理生化特性,表2显示了碳源利用特性;表3显示了该菌株的氮源利用特性;表4显示了该菌株的其他生理生化特性。
[0088]
表2
[0089][0090]
表3
[0091][0092]
由表3结果可见,该菌株除赖氨酸不能利用外,其余常见氨基酸均能利用。
[0093]
表4
[0094][0095]
由表4的结果可见,该菌株不产硝酸还原酶、不能液化明胶;但牛奶胨化反应阳性,并可产酪氨酸酶和淀粉酶。
[0096]
(3)菌株jh100-32b16b的16s rrna序列测定
[0097]
对菌株jh100-32b16b的16s rrna基因进行测序,序列如后附序列表所示。并将此序列在genbank中进行了blast比对分析,序列比对按同源性排序前六位的结果如表5所示。
[0098]
表5
[0099][0100]
综上所述,根据所述菌株的培养特征、细胞形态、生理生化特征、16s rrna基因序列等实验数据综合分析,参考《伯杰氏系统细菌学手册》以及international journal of systematic and evolutionary microbiology有关研究论文,jh100-32b16b的鉴定结果为:荒漠拟孢囊菌kibdelosporangium aridum。
[0101]
实施例3
[0102]
对照菌株jh100的摇瓶发酵。将甘油管保藏的jh100菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d。挑取活化好的菌苔,转接到种子瓶中。种子瓶装液量为:250ml三角瓶内装30ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵摇瓶中,进行摇瓶发酵。摇瓶发酵培养基配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,水解酪蛋白10,酵母提取物10,棉籽饼粉10,ph 7.5。发酵瓶装液量为250ml三角瓶内装20ml培养基。发酵摇瓶接种量10%。发酵培养条件为28℃,恒温摇床转速200rpm,振荡培养7d。发酵结束后采用hplc检测目标产物a82846b的浓度,并计算a/b值。产物检测条件为:将发酵液用5n氢氧化钠溶液调节ph值10.5,离心,取上清液,0.22μm微滤膜过滤后进行hplc检测;所用液相色谱为岛津lc-2030系列高效液相色谱仪,色谱柱型号为agilent zorbax eclipse plus c18(4.6
×
250mm,5.0μm)流动相为水:乙腈。对照菌株jh100摇瓶发酵7d发酵液中a82846b的效价为198mg/l,a/b=2.2。
[0103]
实施例4
[0104]
菌株jh100-32b16b的摇瓶发酵。将甘油管保藏的jh100-32b16b菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d。挑取活化好的菌苔,转接到种子瓶中。种子瓶装液量为:250ml三角瓶内装30ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵摇瓶中,进行摇瓶发酵。摇瓶发酵培养基配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。发酵瓶装液量为250ml三角瓶内装20ml培养基。发酵摇瓶接种量10%。发酵培养条件为28℃,恒温摇床转速200rpm,振荡培养7d。发酵结束后采用hplc检测目标产物a82846b的浓度,并计算a/b值。产物检测条件为:将发酵液用5n氢氧化钠溶液调节ph值10.5,离心,取上清液,0.22μm微滤膜过滤后进行hplc检测;所用液相色谱为岛津lc-2030系列高效液相色谱仪,色谱柱型号为agilent zorbax eclipse plus c18(4.6
×
250mm,5.0μm)流动相为水:乙腈。对照菌株jh100-32b16b摇瓶发酵7d发酵液中a82846b的效价为531mg/l,a/b=1.6。
[0105]
实施例5
[0106]
对照菌株jh100在10l发酵罐中的发酵。将甘油管保藏的jh100菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d;挑取活化好的菌苔,转接到种子瓶中;种子瓶装液量为500ml三角瓶内装125ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵罐中进行罐上发酵。发酵罐底料配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,水解酪蛋白10,酵母提取物10,棉籽饼粉10,ph 7.5。初始装液量为6l,将发酵培养基各组分投料后加入去离子水溶解,5n naoh溶液调节ph值为7.5,121℃灭菌30min后冷却到室温等待接种;发酵罐接种量8~10%。罐上发酵温度28℃,起始搅拌转速300rpm,起始通气量0.5vvm,此后根据溶氧情况逐步上调搅拌转速和通气量。发酵运行48h开始启动补料;补料配方为:糖蜜50%、水解酪蛋白10%;补料方式为do偶联流加,将补料泵动作与do值偶联,维持do水平处于10~30%区间即可。主发酵运行213h后放罐,采用hplc检测目标产物a82846b的浓度,并计算a/b值。产物检测条件为:将发酵液用5n氢氧化钠溶液调节ph值10.5,离心,取上清液,0.22μm微滤膜过滤后进行hplc检测;所用液相色谱为岛津lc-2030系列高效液相色谱仪,色谱柱型号为agilent zorbax eclipse plus c18(4.6
×
250mm,5.0μm)流动相为水:乙腈。对照菌株jh100在10l发酵罐上发酵213h,发酵液中a82846b的效价为544mg/l,a/b=3.1。
[0107]
实施例6
[0108]
菌株jh100-32b16b在10l发酵罐中的发酵。将甘油管保藏的jh100-32b16b菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d;挑取活化好的菌苔,转接到种子瓶中;种子瓶装液量为500ml三角瓶内装125ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵罐中进行罐上发酵。发酵罐底料配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。初始装液量为6l,将发酵培养基各组分投料后加入去离子水溶解,5n naoh溶液调节ph值为7.5,121℃灭菌30min后冷却到室温等待接种;发酵罐接种量8~10%。发酵温度28℃,起始搅拌转速300rpm,起始通气量0.5vvm,此后根据溶氧情况逐步上调搅拌转速和通气量。发酵运行48h开始启动补料;补料配方为:糖蜜30%、蔗糖10%、蛋白胨20%;补料方式为恒速流加,速率100ml/d。主发酵运行384h后放罐,采用hplc检测目标产物a82846b的浓度,并计算a/b值。产物检测条件为:将发酵液用5n氢氧化钠溶液调节ph值10.5,离心,取上清液,0.22μm微滤膜过滤后进行hplc检测;所用液相色谱为岛津lc-2030系列高效液相色谱仪,色谱柱型号为agilent zorbax eclipse plus c18(4.6
×
250mm,5.0μm)流动相为水:乙腈。对照菌株jh100在10l发酵罐上发酵384h,发酵液中a82846b的效价为1450mg/l,a/b=1.86。
[0109]
实施例7
[0110]
菌株jh100-32b16b在30l发酵罐中的发酵。将甘油管保藏的jh100-32b16b菌种转接到isp-2斜面上,置于28℃恒温恒湿培养箱中活化培养5~7d;挑取活化好的菌苔,转接到种子瓶中;种子瓶装液量为1l三角瓶内装250ml种子培养基。种子培养基配方为(g/l):葡萄糖15,麦芽糊精15,水解酪蛋白3,酵母提取物3,ph 7.2。种子瓶在恒温摇床上28℃振荡培养48h,摇床转速200rpm。将成熟的种子转接到发酵罐中进行罐上发酵。发酵罐底料配方为(g/l):葡萄糖30,麦芽糊精30,糖蜜25,棉籽饼粉10,ph 7.5。主发酵罐初始装液量为16l,将发
酵培养基各组分投料后加入去离子水溶解,5n naoh溶液调节ph值为7.5,121℃灭菌30min后冷却到室温等待接种;本次接种量1l种子液。发酵温度28℃,起始搅拌转速300rpm,起始通气量0.5vvm,此后根据溶氧情况逐步上调搅拌转速和通气量。发酵运行48h开始启动补料;补料配方为:糖蜜30%、蔗糖10%、蛋白胨20%;补料方式为do关联,维持do在10~30%区间。主发酵运行312h后放罐,采用hplc检测目标产物a82846b的浓度,并计算a/b值。产物检测条件为:将发酵液用5n氢氧化钠溶液调节ph值10.5,离心,取上清液,0.22μm微滤膜过滤后进行hplc检测;所用液相色谱为岛津lc-2030系列高效液相色谱仪,色谱柱型号为agilent zorbax eclipse plus c18(4.6
×
250mm,5.0μm)流动相为水:乙腈。对照菌株jh100在10l发酵罐上发酵312h,发酵液中a82846b的效价为1363mg/l,a/b=1.43。
[0111]
本领域技术人员可根据上述各实施例所列举的操作流程及各项技术参数进行符合本领域常识的重新组合和变通,这些变通等同于本发明所举实施例的自然延伸,仍属于本发明权利要求书的限定范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

