1.本发明涉及一株产血红素的基因工程菌及其构建方法和应用,属于分子生物学以及微生物发酵技术领域。
背景技术:
2.血红素(heme),是存在于生物体内重要的含铁卟啉化合物。因血红素卟啉环中心含有亚铁离子,具备结合氧气的能力,成为呼吸作用以及电子传递链中相关蛋白质的重要组成成分。研究发现,血红素可以在转录、翻译和蛋白质修饰等方面对基因的表达进行不同程度的调控。基于其重要功能,它在生物,食品和医药等领域具有巨大的潜在应用价值。例如,血红素可用作食品添加剂以替代传统化学色素。另外,血红素中的铁离子极易被人体所吸收,可以开发成治疗缺铁性贫血的药物。随着市场需求不断扩大,当前以化学合成和动植物提取等方法获得的血红素已经无法满足日益增加的应用需求。近年来,合成生物学的快速发展为微生物利用可再生资源合成血红素提供了新的机遇,以期弥补传统化学合成和动植物提取法的不足。为解决上述问题,相关研究利用大肠杆菌作为底盘微生物,异源表达血红素合成途径基因,并且通过微生物发酵技术直接获得相应产量的血红素,但目前合成血红素的细胞工厂产量较低,成本高昂,无法满足市场需求。
技术实现要素:
3.本发明针对目前血红素合成技术中存在原料成本高、产量极低以及遗传稳定性较差等诸多问题,提供一种合成血红素基因工程菌的构建方法与应用。本发明通过构建多顺反子表达载体,之后导入宿主菌bacillus amyloliquefaciens nb,获得生产血红素的基因工程菌株。同时利用代谢工程技术针对整体代谢网络进行优化,利用crispr
‑
cas9技术对主要副产物合成途径的关键基因进行敲除以将代谢流最大程度集中到血红素合成途径中,使该菌株利用低廉生物质资源—菊芋粗提液作为发酵原料生产血红素,大幅降低生产成本。
4.本发明的第一个目的是提供一种合成血红素的重组解淀粉芽孢杆菌,以可合成聚谷氨酸的解淀粉芽孢杆菌为宿主,表达了血红素途径基因gltx、hema、heml、hemb、hemc、hemd、 heme、hemf、hemg和hemh基因。
5.在一种实施方式中,所述gltx、hema、heml、hemb、hemc基因在pma5载体上表达。
6.在一种实施方式中,所述hemd、heme、hemf、hemg和hemh基因在phy300plk载体上表达。
7.在一种实施方式中,所述gltx、hema、heml、hemb、hemc基因的gene id分别为946906、 945777、946892、945017、947759;所述hemd、heme、hemf、hemg和hemh基因的gene id 分别为948587、948497、946908、948331、947532。
8.在一种实施方式中,所述解淀粉芽孢杆菌nb还表达了血红素胞外转运蛋白的基因簇 ccmabc,由gene id分别为946714、946692、946703的基因ccma、ccmb和ccmc组成。
9.在一种实施方式中,所述解淀粉芽孢杆菌敲除了副产物途径关键基因。
g/l, kh2po
43‑
5 g/l,na2hpo4·
12h2o 13
‑
18g/l,mgso4·
7h2o 1
‑
3g/l,mnso4·
7h2o 0.02
‑
0.1g/l。
26.在一种实施方式中,所述发酵是将所述重组解淀粉芽孢杆菌从甘油管中取3μl菌液在含有硫酸卡那霉素和氯霉素的平板上划线,37℃培养12h,挑取单菌落接种到5ml含有硫酸卡那霉素和氯霉素的液体lb中,37℃,200rpm,培养12h,获得种子液,再将种子液按照 1%的接种量接种到发酵培养基中,于37℃,200rpm发酵。
27.本发明还提供所述重组解淀粉芽孢杆菌在生产含血红素的产品中的应用。
28.与现有技术相比,本发明的有益及有益效果为:
29.(1)本发明提供的生产血红素工程菌株能够利用低廉生物质资源—菊芋作为底物,与现有的以葡萄糖为碳源的额发酵方法相比,显著降低了生产成本,且发酵用的菌株无致病性,血红素产量可达254.6mg/l。
30.(2)本发明的菌株构建具有操作简便、成本低以及稳定性好等优点,容易实现产业化。
31.(3)本发明菌株利用代谢工程敲除本菌株中合成副产物的关键基因,降低副产物浓度且有效提高血红素产量。
32.(4)本发明菌株通过表达血红素胞外转运蛋白,促进血红素的外排,提高血红素产量以及简化下游提取工艺。
附图说明
33.图1显示nb在lb平板上的菌落形态;
34.图2显示质粒构建示意图;
35.图3显示本发明菌株发酵图片;
36.图4显示本发明中菌株zsl
‑
3血红素产量。
具体实施方式
37.本发明实施过程中使用材料与方法如下:
38.1、引物及序列:
39.所有引物皆由通用生物系统有限公司合成。
40.所有质粒及dna测序工作由通用生物系统有限公司进行测序。
41.质粒提取选用南京诺唯赞生物科技股份有限公司提供的质粒提取试剂盒。
42.dna片段回收选用南京诺唯赞生物科技股份有限公司提供的产物纯化试剂盒。
43.细菌基因提取选用南京诺唯赞生物科技股份有限公司提供的基因组提取试剂盒。
44.dna片段pcr选用南京诺唯赞生物科技股份有限公司提供的2
×
phanta max master mix 进行pcr扩增。
45.载体与基因片段的连接选用南京诺唯赞生物科技股份有限公司提供的一步克隆连接酶。
46.限制性内切酶选用takara公司提供的限制性内切酶。
47.dh5α感受态购自通用生物系统有限公司。
48.pdr质粒作为大肠杆菌与解淀粉芽孢杆菌的穿梭质粒,拥有两套复制子,在大肠杆
菌中的筛选标记为氨苄青霉素,在解淀粉芽孢杆菌中的筛选标记为盐酸壮观霉素。pdr载体的启动子为组成型启动子,载体骨架的酶切位点为salⅰ和xhoⅰ。
49.pht01质粒作为大肠杆菌与解淀粉芽孢杆菌的穿梭质粒,拥有两套复制子,在大肠杆菌中的筛选标记为氨苄青霉素,在解淀粉芽孢杆菌中的筛选标记为氯霉素。pht01载体的启动子为诱导性启动子,其诱导剂为iptg。
50.pma5质粒作为大肠杆菌与解淀粉芽孢杆菌的穿梭质粒,拥有两套复制子,在大肠杆菌中的筛选标记为氨苄青霉素,在解淀粉芽孢杆菌中的筛选标记为硫酸卡那霉素。pma5载体的启动子为组成型强启动子,载体骨架的酶切位点为ndeⅰ和bamhⅰ。
51.phy质粒作为大肠杆菌与解淀粉芽孢杆菌的穿梭质粒,拥有两套复制子,在大肠杆菌中的筛选标记为氨苄青霉素,在解淀粉芽孢杆菌中的筛选标记为氯霉素。phy载体的启动子为组成型强启动子,载体骨架的酶切位点为xhoⅰ和salⅰ。
52.2、培养基:
53.菊芋粗提液:新鲜的菊芋块茎在80℃的电热恒温干燥箱中洗涤、切片和干燥7h。经过粉碎机制备成粉末后,使用40目筛子得到粗菊粉。粗菊粉按照1:5的比例放入水中搅拌完全后置于75℃水浴加热浸提3h,通过纱布过滤的滤液即为菊粉粗提液。在配制培养基时,在115℃下灭菌20min,即可用作培养基的碳源。
54.lb培养基:酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,121℃,20min。
55.固体lb培养基:酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,琼脂粉20g/l,121℃, 20min。
56.发酵培养基:菊芋粗提液70
‑
90g/l,(nh4)2so417
‑
24 g/l,kh2po
43‑
5 g/l, na2hpo4·
12h2o 13
‑
18g/l,mgso4·
7h2o 1
‑
3g/l,mnso4·
7h2o 0.02
‑
0.1g/l。菊芋粗提液 115℃,25min。除此以外,所有成分120℃,20min。
57.培养基使用抗生素时,氨苄青霉素终浓度为100μg/ml。硫酸卡那霉素终浓度为50 μg/ml。氯霉素终浓度为30μg/ml。壮观霉素终浓度100μg/ml。
58.感受态制备培养基:蛋白胨10g/l,酵母粉5g/l,nacl 10g/l,山梨醇0.5m,121℃, 20min。
59.复苏培养基:蛋白胨10g/l,酵母粉5g/l,nacl 10g/l,山梨醇0.5m,甘露醇0.38m, 121℃,20min。
60.电击缓冲液:山梨醇0.5m,甘露醇0.5m,甘油10%,121℃,20min。
61.感受态细胞悬浮液:山梨醇0.5m,甘露醇0.5m,甘油10%,peg
‑
600014%,121℃, 20min。
62.3、大肠杆菌gm2163感受态制备:
63.(1)从甘油管中取10μl菌液在lb上划线,37℃过夜。
64.(2)挑单菌落于10ml的lb培养基中(50ml摇瓶),37℃200rpm过夜培养。
65.(3)以1%的接种量转接到lb培养基中,培养至od
600
=0.6左右,分装到预冷的50ml 离心管中,冰浴20min。
66.(4)4℃,4000rpm,离心10min,弃上清。
67.(5)加入4ml 0.1m cacl2,轻轻混匀,冰浴30min。
68.(6)4℃,4000rpm,离心10min,弃上清。
69.(7)加入1ml预冷0.1m cacl2和1ml预冷40%甘油,分装,
‑
80℃保藏。
70.4、解淀粉芽孢杆菌nb感受态的制备:
71.(1)从甘油管中取10μl菌液在lb上划线,32℃过夜。
72.(2)挑单菌落于10ml的感受态制备培养基中(50ml摇瓶),32℃,200rpm过夜培养。
73.(3)以1%的接种量转接到感受态制备培养基中,培养至od
600
=0.6左右,分装到预冷的 50ml离心管中,冰浴20min。
74.(4)4℃,8000rpm,离心10min,弃上清。
75.(5)加入20ml电转缓冲液,轻轻混匀,4℃,8000rpm,离心10min,弃上清。
76.(6)重复步骤5两次
77.(7)加入1.5ml左右的悬浮缓冲液,轻轻将菌泥悬浮,100μl分装,
‑
80℃保藏。
78.5、解淀粉芽孢杆菌电转步骤:
79.(1)10μl的质粒加入到100μl的感受态中,轻轻混匀。转移至预冷的电转杯中。
80.(2)2.9kv 4ms电击,电击后立刻加入1ml的复苏培养基,32℃200rpm复苏2h。
81.(3)将复苏结束的所有菌液转移至4ml液体lb中,加入相应抗性,32℃200rpm培养12h进行富集。
82.(4)若摇瓶中有菌生长,吸取少量菌落在相应抗性的平板上进行划线,挑取单菌落进行菌落pcr验证。
83.6、引物:
84.本发明中所述血红素途径构建相关引物名称及核苷酸序列如下表所示
85.表1途径构建所需引物及核苷酸序列
86.[0087][0088]
本发明中所述利用crispr
‑
cas9技术敲除副产物途径关键基因所需引物名称及核苷酸序列如表2所示:
[0089]
表2基因敲除所需引物及核苷酸序列
[0090]
[0091][0092]
7、本发明所述pcr反应体系如下:2
×
phanta max master mix高保真酶25μl,f 2μl, r 2μl,模板2μl,ddh2o 19μl。
[0093]
8、本发明所述重叠pcr反应体系为:2
×
phanta max master mix高保真酶25μl,f 2μl, r 2μl,模板12μl,模板22μl,ddh2o 17μl。
[0094]
9、血红素检测方法:血红素浓度的检测方法采用高效液相色谱法,仪器选用agilentinfinitylab lc series1260 infinityⅱquaternary system,色谱柱选用赛默飞公司hypers11 ods250
×
4.6mm 5μm液相色谱柱。
[0095]
hplc检测条件为:波长:400nm,温度:30℃,流动相a:100%甲醇加0.1%三氟乙酸。流动相b:100%纯水加0.1%三氟乙酸。a/b:50%/50%,流速:0.4ml/min。
[0096]
10、本发明所述双酶切条件如下:50μl体系,限制性内切酶12μl,限制性内切酶22μl, 10
×
buffer 5μl,质粒41μl。
[0097]
实施例1血红素合成菌株zsl
‑
1的构建
[0098]
为在解淀粉芽孢杆菌nb中构建血红素合成的完整通路,查阅相关文献并在ncbi中获得大肠杆菌mg1655中血红素合成途径从谷氨酸到血红素所需的基因,包括gltx、hema、heml、hemb、hemc、hemd、heme、hemf、hemg和hemh基因(核苷酸序列分别如seq id no.1~seqid no.10所示)。利用表1中的相应引物,通过引物在相邻的基因之间插入核糖体结合位点的核苷酸序列aaaggagcgatttacatatg以提高翻译效率,利用pcr获得相应基因片段,之后通
过重叠pcr将不同基因片段组装,获得gltx
‑
hema
‑
heml
‑
hemb
‑
hemc和 hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh多基因片段。之后,分别利用限制性内切酶ndeⅰ与bamhⅰ以及xhoⅰ和salⅰ对pma5质粒和phy300plk质粒进行双酶切线性化,从而获得线性化载体。下一步通过一步克隆将gltx
‑
hema
‑
heml
‑
hemb
‑
hemc基因片段与pma5线性化载体连接,将基因片段hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh与phy300plk线性化载体连接,将两个连接载体分别转化进入dh5α中进行验证。由于质粒需要去甲基化才可以在解淀粉芽孢杆菌的正常表达,因此在获得多顺反子重组质粒后,需要将质粒转化到大肠杆菌gm2163中进行去甲基化。之后将pma5
‑
gltx
‑
hema
‑
heml
‑
hemb
‑
hemc和phy
‑
hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh通过电转导入宿主菌株解淀粉芽孢杆菌nb中。获得产血红素的基因工程菌株zsl
‑
1。引物核苷酸序列、双酶切条件、一步克隆条件以及pcr条件如上所述。
[0099]
实施例2血红素合成菌株zsl
‑
2的构建
[0100]
为降低副产物,集中代谢流以提高血红素产量,查阅相关文献并对本发明菌株的基因组序列进行分析,在基因组中获得pgsbca、prob、nas、ldh和pta相应基因的核苷酸序列,其中,pgsbca的核苷酸序列如seq id no.15所示、prob的核苷酸序列如seq id no.14所示、 nas的核苷酸序列如seq id no.11所示、ldh的核苷酸序列如seq id no.12所示,pta的核苷酸序列如seq id no.13所示。利用crispr
‑
cas9技术设计相应敲除所需的sgrna,敲除所需引物如表2所示。并利用pcr获得sgrna的基因片段,之后利用salⅰ和xhoⅰ对pdr 质粒进行双酶切线性化,从而获得线性化载体。同样,通过一步克隆的方法将不同的sgrna 与线性化pdr载体相连接并转化到dh5α中进行验证,其中,sgpgsbca的核苷酸序列如seqid no.16所示,sgprob的核苷酸序列如seq id no.17所示,sgldh的核苷酸序列如seq idno.18所示,sgnas的核苷酸序列如seq id no.19所示,sgpta的核苷酸序列如seq id no.20 所示。由于质粒需要去甲基化才可以在解淀粉芽孢杆菌的正常表达,因此在获得含有sgrna 的重组质粒后,需要将质粒转化到大肠杆菌gm2163中进行去甲基化,最后通过电转将 pdr
‑
sgrna和pht01
‑
cas9质粒导入本发明的起始菌株nb中。在crispr
‑
cas9系统的双质粒转入菌株中以后,将该菌株接种到5ml液体lb培养基中,37℃,200rpm培养3h后,加入iptg诱导敲除,最终通过pcr验证基因的敲除结果。
[0101]
在基因敲除成功后,需要更换不同的sgrna以针对性敲除不同基因,因此需要在宿主中导入不同pdr质粒。由于pdr是温敏型质粒,高温下结构不稳定易丢失,因此在基因敲除后,将菌株在42℃以及仅加入氯霉素抗性的条件下,加快pdr质粒的丢失。培养24h后通过pcr验证质粒已丢失。之后依次将pgsbca、prob、nas、ldh和pta基因进行敲除并将所有质粒丢失后,获得nbδpgsbcaδprobδnasδldhδpta。在叠加敲除所有副产物关键基因后,将 pma5
‑
gltx
‑
hema
‑
heml
‑
hemb
‑
hemc和phy
‑
hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh通过电转导入 nbδpgsbcaδprobδnasδldhδpta中,获得产血红素的基因工程菌株zsl
‑
2。
[0102]
实施例3血红素合成菌株zsl
‑
3的构建
[0103]
通过分析血红素合成途径,发现血红素存在胞外转运蛋白,可以及时将血红素转运到胞外,从而降低血红素对细胞造成的代谢压力以及提高产量。以大肠杆菌mg1655基因组为模板,通过pcr扩增获得大肠杆菌血红素转运蛋白基因簇ccmabc。下一步将该基因片段整合到phy
‑
hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh质粒上的hemh基因后,并在ccmabc前加入核糖体结合位点由于已插入的基因序列包含酶切位点,无法进行双酶切线性化,因此设计phy
‑
liner
‑
f 和phy
‑
liner
‑
r对质粒进行pcr线性化。之后利用一步克隆将基因片段与载体连接,并如上所述,获得去甲基化的质粒phy
‑‑
hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh
‑
ccmabc。将 pma5
‑
gltx
‑
hema
‑
heml
‑
hemb
‑
hemc和phy
‑
hemd
‑
heme
‑
hemf
‑
hemg
‑
hemh
‑
ccmabc通过电转导入实施例2构建的nbδpgsbcaδprobδnasδldhδpta中,即得zsl
‑
3。
[0104]
实施例4基因工程菌株的发酵
[0105]
种子培养基:lb培养基;
[0106]
发酵培养基:菊芋粗提液70
‑
90g/l,(nh4)2so417
‑
24 g/l,kh2po
43‑
5 g/l, na2hpo4·
12h2o 13
‑
18g/l,mgso4·
7h2o 1
‑
3g/l,mnso4·
7h2o 0.02
‑
0.1g/l。
[0107]
分别从平板挑取基因工程菌zsl
‑
1、zsl
‑
2和zsl
‑
3的单菌落,分别接种于10ml同时含有50μg/ml硫酸卡那霉素和30μg/ml氯霉素的液体lb中,200rpm,37℃培养12h。以 1%的接种量转接于200ml的发酵培养基中,置于200rpm,37℃避光培养。在第0h、12h、 24h、36h、48h、60h和72h每个时间点取样1ml,避光保存于
‑
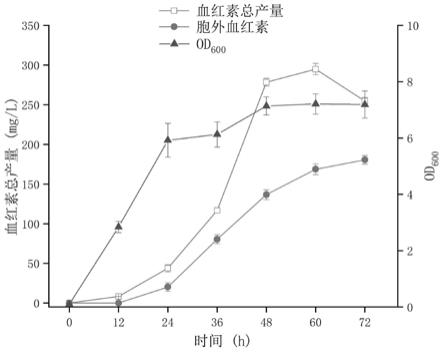
80℃。发酵结束后,所有样品离心取上清测胞外血红素产量,细胞采用相同体积1mnaoh进行重悬并超声破碎通过高效液相色谱法检测胞内血红素产量。如图4所示,发酵60h,重组菌株zsl
‑
3的胞外血红素产量达到180.5mg/l,胞内血红素为126.2mg/l,血红素总产量达到294.9mg/l。发酵72h 胞外血红素产量为180.5mg/l,胞内血红素为74.1mg/l,血红素总产量为254.6mg/l。
[0108]
zsl
‑
1发酵60h产量最高,胞外血红素产量为5.1mg/l,胞内血红素为35.2mg/l,血红素总产量为40.3mg/l。zsl
‑
2发酵60h胞外血红素产量达到20.6mg/l,胞内血红素为87.8 mg/l,血红素总产量为108.4mg/l。
[0109]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

