一种注射用卡巴他赛组合物及其制备方法
1.相关申请的交叉引用
2.本技术为2018年1月11日递交的申请号为“201810025193.4”、发明名称为“一种注射用卡巴他赛组合物及其制备方法”的发明专利申请的分案申请,该申请在此全文引入作为参考。
发明领域
3.本发明涉及药物制剂技术领域,具体涉及一种注射用卡巴他赛组合物及其制备方法。
技术背景
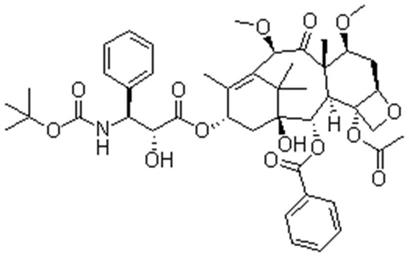
4.卡巴他赛(cabazitaxel)为白色或类白色粉末,几乎不溶于水,可溶于乙醇,且在碱性条件下不稳定。化学名称为(1s,2s,3r,4s,7r,9s,10s,12r,15s)
‑4‑
乙酰氧基
‑
15
‑
{[(2r,3s)
‑3‑
{[(叔丁氧基)羰基氨基]}
‑2‑
羟基
‑3‑
苯基丙酰基]氧基}
‑1‑
羟基
‑
9,12
‑
二甲氧基
‑
10,14,17,17
‑
四甲基
‑
11
‑
氧代
‑6‑
氧杂四环[11.3.1.0
3;10
.0
4;7
]十七碳
‑
13
‑
烯
‑2‑
基苯甲酸酯。分子式c
45
h
57
n
14
,分子量835.93,结构式如下:
[0005][0006]
卡巴他赛是新一代紫杉烷类抗肿瘤药物,可通过由红豆杉萃取的前体半合成制得,其抗癌作用机制和特点与多西他赛相似,属于抗微管类药物。卡巴他赛通过与微管蛋白结合,促进其组装成微管,同时可阻止这些已组装好了的微管解体,使微管稳定,进而抑制细胞的有丝分裂和间期细胞功能的发挥。与紫杉醇和多西他赛相比,卡巴他赛抑制肿瘤细胞增殖的能力更强,并对多西他赛耐药的肿瘤患者有效。2010年美国fda批准由赛诺菲
‑
安万特(sanofi
‑
aventis)公司开发生产的卡巴他赛药物制剂用于激素难治疗转移性前列腺癌的治疗,是fda批准的第一个用于对多西他赛产生耐受的前列腺癌的治疗药物,能够显著延长晚期前列腺癌患者的生存期。
[0007]
卡巴他赛亲脂性强,几乎不溶于水,其商用制剂采用表面活性剂聚山梨酯80(吐温80)作为增溶剂并且采用乙醇作为稀释剂。制剂包装规格含两个小药瓶:(a)注射剂,60mg卡巴他赛溶于1.5ml聚山梨酯80;(b)稀释剂,13%(w/w)的乙醇溶液约5.7ml。这种制剂在向病人给药前还需两步配制过程:第一步将(a)注射剂与(b)稀释剂混合,浓度约10mg/ml;第二步将上步混合液稀释入含有注射用0.9%氯化
钠溶液或5%葡萄糖溶液的250ml容器(非pvc)。最终配制的输注液中卡巴他赛的浓度应为0.1mg/ml~0.26mg/ml。
[0008]
聚山梨酯(吐温)为非离子型表面活性剂,有异臭,温暖而微苦,系一系列聚氧乙烯去水山梨醇的部分脂肪酸酯。广泛用作乳化剂和油类物质的增溶剂。聚山梨酯通常被认为是无毒、无刺激性的材料,常用作注射型难溶性药物的增溶辅料,但由于吐温注射给药的副作用,低浓度(0.01~2.0%)时即可产生溶血作用,在局部和肌注时,出现过敏反应,严重时会产生全身性皮疹/红斑、低血压和/或支气管痉挛或非常少见的致命性过敏反应的此类反应甚至死亡的个例,为了降低聚山梨酯的副作用,临床需要给病人抗组胺药(antihistamine)、皮质类固醇(corticosteroid)和h2拮抗剂(h2antagonist)预防给药,大大降低了临床使用的顺应性。
[0009]
聚山梨酯80在中的存在可能导致严重副作用,已经报道了在患者中特征为全身性皮疹/红斑、低血压和/或支气管痉挛或非常少见的致命性过敏反应的此类反应。为了降低由聚山梨酯80诱导的副作用,反应。为了降低由聚山梨酯80诱导的副作用,静脉给药前30分钟应给病人以抗组胺药(antihistamine)、皮质类固醇(corticosteroid)和h2拮抗剂(h2antagonist)事先用药。同时临床使用前需要进行两步稀释:即先用13%(w/w)的乙醇液稀释,再用0.9%氯化钠溶液或5%葡萄糖溶液稀释后方可给药,使用步骤繁琐,存在用药方面的安全隐患。另外,采用13%(w/w)的乙醇溶液做稀释剂,然而乙醇在注射给药时会产生较大的刺激以及成瘾性等副作用。
[0010]
因此,需要卡巴他赛的新制剂在临床应用中尽可能少副作用、无前驱给药需求以及使用步骤更简单、安全、易操作。
[0011]
药用辅料环糊精有一个中空的疏水立体手性内腔,其“内疏水,外亲水”的结构特性能包封多种空间尺寸适合的有机小分子(底物),形成非共价主
‑
客体复合物(包合物),其最显著的药学作用便是增加难溶药的水溶性和增加药物的稳定性。如valery alakhov等人的发明申请ca2900508a1(us20150325321a1)公开了卡巴他赛(cabazitaxel)与磺丁基醚倍他环糊精(sbe
‑
β
‑
cd)重量比在1:30~1:1000的组合物,其实验结果显示在40%浓度的sbe
‑
β
‑
cd水溶液中cabazitaxel的溶解度为4.17mg/ml。但是本发明申请人在实验研究sbe
‑
β
‑
cd对cabazitaxel增溶作用时发现40%浓度的sbe
‑
β
‑
cd水溶液中cabazitaxel的溶解度约1mg/ml,无法达到ca2900508a1专利所述的4.17mg/ml的浓度,即使能达到该浓度,也很难实现制备合乎市售制剂浓度规格的cabazitaxel注射剂。如规格为60mg/1.5ml,按40%浓度的sbe
‑
β
‑
cd水溶液中cabazitaxel的溶解度约1mg/ml计算,溶解60mg的cabazitaxel需要60ml该溶液;若按溶解度为4.17mg/ml计算,溶解60mg的cabazitaxel也需要约15ml该溶液,相比每小瓶1.5ml的体积实在相差太多,这样从制备工艺、成本、包装、运输、储存等方面考虑都是难以工业化生产的。同时需要考虑的是cabazitaxel注射剂在用输注溶液0.9%氯化钠溶液或5%葡萄糖溶液稀释到输注浓度范围内时是否稳定、不析出晶体或沉淀物。
[0012]
基于市售制剂的配方含有聚山梨酯和乙醇以及ca2900508a1(us20150325321a1)专利的配方含有高比例(大于1:30)环糊精的启发,一种显而易见的结果是,继续提高环糊精的比例和/或者增加配方中的乙醇量才能满足替代聚山梨酯的制剂
配方,但本发明人的这种尝试得到的结果是,无论是提高环糊精含量还是增加乙醇用量都不能提高卡巴他赛溶解度,以满足临床用药的需求。
技术实现要素:
[0013]
考虑到现有技术的种种缺陷,本技术的发明人突破了现有技术的偏见,对已有认知的逆向试验,降低环糊精的用量同时放弃使用刺激强的乙醇溶剂和有副反应的吐温80。具体而言,本技术的发明人向700mg/mlpeg300、290mg/mlsbe
‑
β
‑
cd、80mg/mlpvpk12及适量水(约100mg)组成的溶液体系中加入注射用附加剂:如柠檬酸、亚硫酸氢钠、依地酸二钠等,并充入适量的氮气,结果发现,制备得到的组合物既能使卡巴他赛的溶解度≥40mg/ml,同时又能大大提高卡巴他赛在该体系中稳定性。
[0014]
换句话说,根据本技术的发明人的逆向试验,得到一种非显而易见、甚至出乎意料的结果:卡巴他赛、环糊精、聚乙二醇(peg)、聚维酮(pvp)及注射用附加剂组成的新的组合物,并且该组合物不含聚山梨酯和乙醇,可以显著改进卡巴他赛制剂特性,并能有效地增加卡巴他赛的溶解度和稳定性。
[0015]
研究表明,卡巴他赛、环糊精、peg、pvp组成的不含聚山梨酯和乙醇的组合物体系,既可以克服现有市售制剂含聚山梨酯而导致的副作用,又能大大降低制剂的注射刺激性以及用药的成瘾性,并且使得卡巴他赛制剂稳定性大大提高。该技术方案克服了专利ca2900508a1大量使用环糊精但并不能显著提高卡巴他赛的溶解度,最高只能增加到4.17mg/ml的缺陷,并且克服了ca2900508a1中形成的卡巴他赛组合物稳定性不高,难以满足临床使用的实用性问题。
[0016]
为此,本发明的目的在于:针对现有技术中存在的不足,开发不含聚山梨酯以及乙醇,单小瓶即用型,无需两步稀释,性质稳定、满足临床用药需求并保证用药的安全性有效性的注射用卡巴他赛。
[0017]
定义
[0018]
单小瓶即用型是指在单个小药瓶中的无菌液体或冻干物,其在用输注溶液稀释或溶解稀释到临床应用浓度范围内后可以通过静脉向患者给药,无需两步稀释。
[0019]
输注溶液是指通常贮存在袋或瓶中的用于稀释或溶解稀释注射用制剂后可以向患者给药的无菌等渗溶液,如0.9%氯化钠溶液或5%葡萄糖溶液。
[0020]
技术方案
[0021]
为实现上述目的,本发明采用如下技术方案:
[0022]
一方面,本发明提供一种注射用卡巴他赛组合物,所述组合物包括如下重量份的组分:卡巴他赛:1份、环糊精:1~100份、助溶剂:10~200份、聚维酮(pvp):1~60份、附加剂0.02~1.0份,且该组合物不含聚山梨酯和乙醇。
[0023]
优选地,所述组合物包括如下重量份的组分:卡巴他赛:1份、环糊精:10~30份、助溶剂:30~150份、聚维酮(pvp):1~15份、附加剂0.05~0.8份,且该组合物不含聚山梨酯和乙醇。
[0024]
更优选地,所述组合物包括如下重量份的组分:卡巴他赛:1份、环糊精:25~29份、助溶剂:50~90份、聚维酮(pvp):7~15份、附加剂0.05~0.8份,且该组合物不含聚山梨酯和乙醇。
[0025]
进一步优选地,所述组合物包括如下重量份数的组分:卡巴他赛:1份、环糊精:26~29份、助溶剂:60~80份、聚维酮(pvp):7~10份、附加剂0.1~0.7份,且该组合物不含聚山梨酯和乙醇。
[0026]
优选地,所述环糊精包括但不限于磺丁基醚倍他环糊精(sbe
‑
β
‑
cd)、羟丙基倍他环糊精(hp
‑
β
‑
cd)和/或羟丙基磺丁基醚倍他环糊精(hp
‑
sbe
‑
β
‑
cd);优选为sbe
‑
β
‑
cd。
[0027]
优选地,所述助溶剂选自但不限于聚乙二醇(peg)、丙二醇和甘油中的一种或多种,优选为聚乙二醇(peg)。
[0028]
优选地,所述聚乙二醇(peg)选自但不限于peg200、peg300、peg400、peg600、peg800、peg1000、peg1500和peg2000中的一种或多种,优选为peg300和/或peg400。
[0029]
优选地,所述聚维酮(pvp)选自但不限于pvpk12、pvpk15、pvpk17、pvpk25、pvpk30、pvpk45、pvpk60、pvpk70、pvpk80、pvpk85、pvpk90、pvpk100、pvpk110、pvpk120和pvpk150中的一种或多种,优选为pvpk12和/或pvpk17。
[0030]
优选地,所述附加剂包括但不限于柠檬酸和/或酒石酸;和/或醋酸;和/或盐酸;和/或磷酸;和/或乳酸;和/或抗坏血酸;和/或l
‑
半胱氨酸;和/或亚硫酸氢钠;和/或焦亚硫酸钠;和/或依地酸二钠,优选为柠檬酸和/或亚硫酸氢钠。
[0031]
优选地,所述组合物为固体冻干物形式或适于储存的水溶液形式。
[0032]
另一方面,本发明提供前述的注射用卡巴他赛组合物(注射用卡巴他赛组合物固体冻干物)的制备方法,该制备方法包括以下步骤:
[0033]
(1)称取环糊精,加入助溶剂和水,搅拌溶解后加入聚维酮及附加剂,搅拌溶解,再加入卡巴他赛并充惰性气体(例如氮气)保护,搅拌溶解后继续搅拌30~240min,获得均一的混合溶液;
[0034]
(2)取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,半压塞,置冷冻干燥机中冷冻干燥,充氮,压塞,轧盖,贴标即得。
[0035]
优选地,在步骤(1)中,所述均一的混合溶液的ph值为2.0
‑
6.0。再一方面,本发明提供前述的注射用卡巴他赛组合物(注射用卡巴他赛组合物固体冻干物)的另一种制备方法,该制备方法包括以下步骤:
[0036]
(1)称取环糊精,加入助溶剂和水,搅拌溶解后加入聚维酮及附加剂,搅拌溶解,再加入卡巴他赛并充惰性气体(例如氮气)保护,搅拌溶解后继续搅拌30~240min,获得均一的混合溶液;
[0037]
(2)取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0038]
优选地,在步骤(1)中,所述均一的混合溶液的ph值为2.0~6.0。
[0039]
采用上述技术方案,由于助溶剂的溶解、环糊精的包合增溶以及聚维酮的结晶生长阻止剂的协同作用、附加剂调节形成的合适的ph低浓度金属离子以及氮气形成的低氧或近乎低氧体系环境,使得本发明得到注射用卡巴他赛的稳定性极佳、有关物质和复溶的稳定时间均好于现有的市售制剂。
[0040]
因此,本发明得到的组合物不含聚山梨酯和乙醇,低组胺释放,给药前无需使用抗组胺剂、皮质类固醇和h2拮抗剂,单小瓶即用型,无需两步稀释的新的组合物制剂,该制剂具有卡巴他赛溶解度高、稳定性高、制剂复溶稳定时间长、临床使用方便等特点,由于不含
聚山梨酯和乙醇,降低了过敏性、刺激性、成瘾性等副作用。同时,本发明还获得了一种该注射用卡巴他赛组合物的制备方法。
具体实施方式
[0041]
下面结合具体实施例对本发明做进一步的说明,但不用来限制本发明的范围。
[0042]
实施例1
[0043][0044]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0045]
实施例2
[0046][0047]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,22~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0048]
实施例3
[0049][0050]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,18~20℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌100min使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0051]
实施例4
[0052][0053]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,20~22℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌240min使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,半压塞,置冷冻干燥机中冷冻干燥,压塞,轧盖,贴标即得。
[0054]
实施例5
[0055][0056][0057]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg400和水,21~23℃下搅拌溶解,加入处
方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌30min使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0058]
实施例6
[0059][0060]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg400和水,19~22℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0061]
实施例7
[0062][0063]
称取处方量的hp
‑
β
‑
cd,加入处方量的peg300和水,18~20℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌180min使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0064]
实施例8
[0065][0066]
称取处方量的hp
‑
β
‑
cd,加入处方量的peg300和水,18~20℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0067]
实施例9
[0068][0069]
称取处方量的hp
‑
sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0070]
实施例10
[0071][0072]
称取处方量的hp
‑
sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的卡巴他赛,搅拌溶解后继续搅拌2h
使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,半压塞,置冷冻干燥机中冷冻干燥,压塞,轧盖,贴标即得。
[0073]
实施例11
[0074][0075]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0076]
实施例12
[0077][0078]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0079]
实施例13
[0080][0081]
称取处方量的sbe
‑
β
‑
cd,加入处方量的丙二醇和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0082]
实施例14
[0083][0084][0085]
称取处方量的sbe
‑
β
‑
cd,加入处方量的甘油和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0086]
实施例15
[0087][0088]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0089]
实施例16
[0090][0091][0092]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0093]
对比例1
[0094]
[0095]
称取处方量的sbe
‑
β
‑
cd,加入处方量的水,23~25℃下搅拌溶解,加入处方量的pvpk12、柠檬酸及亚硫酸氢钠,搅拌溶解后加入处方量的卡巴他赛,搅拌,不能完全溶解。
[0096]
对比例2
[0097][0098]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0099]
对比例3
[0100][0101]
称取处方量的sbe
‑
β
‑
cd,加入处方量的水,23~25℃下搅拌溶解,加入处方量的柠檬酸及亚硫酸氢钠,搅拌溶解后加入处方量的卡巴他赛,搅拌,不能完全溶解。
[0102]
对比例4
[0103][0104]
加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌溶解后加入处方量的亚硫酸氢钠和卡巴他赛,搅拌溶解后继续搅拌2h使溶液均匀。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧
盖,贴标即得。
[0105]
对比例5
[0106][0107][0108]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌,不能完全溶解,加入处方量的pvpk12及柠檬酸,搅拌,加入处方量的亚硫酸氢钠和卡巴他赛,继续搅拌2h。0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0109]
对比例6
[0110][0111]
称取处方量的sbe
‑
β
‑
cd,加入处方量的peg300和水,23~25℃下搅拌溶解,加入处方量的pvpk12及柠檬酸,搅拌不能全溶,加入处方量的亚硫酸氢钠和卡巴他赛,继续搅拌2h。取样测定ph值及含量,合格后,0.2μm聚四氟乙烯(ptfe)膜过滤,西林瓶分装,充氮,压塞,轧盖,贴标即得。
[0112]
实验例
[0113]
1、溶解度和复溶对比
[0114]
按不同的实施例中各物质的比例,制备不含api(卡巴他赛)的空白制剂,然后在分别加入过量的api,于室温避光条件下搅拌12h后,过滤、稀释、测定溶解度;同时按实施例与对比例的制备制剂,考察制剂复溶情况。溶解度及复溶情况对比结果如下:
[0115][0116][0117]
2、对环糊精用量的分析
[0118]
上表实施例1与对比例4及实施例1与实施例12结果比较可知,环糊精用量在本发明优选范围内(实施例1sbe
‑
β
‑
cd 29g)时,制剂澄清,复溶为澄明溶液,稳定时间约8h,之后析晶;制剂不含环糊精(对比例4无环糊精)或环糊精用量低于本发明的优选范围时(实施例12sbe
‑
β
‑
cd 10g),所得制剂在复溶时约1h析晶沉淀。
[0119]
上表实施例2与实施例3结果比较可知,环糊精用量在优选范围内(实施例2sbe
‑
β
‑
cd 29g)和环糊精用量超出优选范围时(实施例3sbe
‑
β
‑
cd40g),制剂都澄清,复溶为澄明溶液,稳定时间约8h,之后析晶,两处方制剂无明显差异。从药物制剂的安全考虑,药用辅料或添加剂使用量尽可能少的原则,环糊精用量在优选范围内和高于范围用量时效果等同,或者说增大用量无明显效果,那么环糊精用量在优选范围内则为更好的选择。
[0120]
综上,环糊精量少制剂复溶稳定不析出的时间较短,量多制剂无明显改善,优选范围内用量更合适。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。