功能性酵母蛋白质浓缩物
1.本发明涉及用于制备酵母蛋白质浓缩物的方法,所述方法包括在于裂解前经调整到特定ph的悬浮液中裂解酵母细胞,随后使从裂解获得的可溶性级分经受过滤,以减少小于30 kda的分子的含量,并且任选地使从过滤获得的溶液干燥。本发明进一步涉及可通过本发明的方法获得的酵母蛋白质浓缩物。酵母蛋白质浓缩物包含大量蛋白质,所述蛋白质仍然是折叠的,并且因此在加热后能够聚集以形成固体蛋白质基质。另外,本发明的酵母蛋白质浓缩物将具有不明显的味道,并且因此特别适用于制备食品,例如肉类替代产品。
背景技术:
2.世界卫生组织(who)假设2050年世界人口将增加三分之一,从而给食物和农业行业带来巨大问题。由于人口增加,预计全球肉类生产将两倍于其目前的水平,伴随对于环境的严重后果。当今,用于牲畜动物的饲料生产已经消耗了世界总陆地面积的约三分之一。对农业地区日益增长的需求将导致雨林的进一步破坏和温室气体的大量释放。
3.因此,对于可以以资源和气候友好的方式生产的食物产品存在巨大的需要。具体而言,由于肉类生产与相当大的资源浪费相关,肉类替代产品的开发将成为应对不断增长的世界人口的关键因素。已开发了基于植物蛋白的许多不同的肉类替代产品。然而,从植物如大豆生产蛋白质一般是费力且费时的,因为它需要在农作物用地上种植植物。因此,仍需要可以用于生产食物例如肉类替代产品的蛋白质的替代来源。
4.本发明基于以下发现:从酵母获得的蛋白质浓缩物能够形成具有特定质地和高稠度的特殊固体蛋白质凝胶。由于酵母细胞不需要复杂的营养素或生长条件,因此它们代表了用于生产富含蛋白质的组合物的特别有利的原材料,所述富含蛋白质的组合物可以进一步用于制备食物产品,且特别是肉类替代产品。本发明的蛋白质浓缩物可以为非gmo、无麸质的且适合于素食和纯素饮食,从而满足广泛范围的消费者需求。
技术实现要素:
5.在一个方面,本发明依赖以下认识:通过加热酵母蛋白质浓缩物产生的凝胶的硬度可以通过调整在蛋白质浓缩物的生产过程中施加的条件进行调节。特别地,发现了在浓缩物的生产过程中选择适当的ph强烈影响最终蛋白质浓缩物的胶凝行为。
6.依照本发明的方法生产的蛋白质浓缩物能够形成具有有利稠度的稳定蛋白质凝胶,所述稠度类似坚固的蛋白。本发明还提供了可以用于制备稳定蛋白质凝胶的新型蛋白质浓缩物。蛋白质浓缩物含有已基本维持其结构完整性的大量蛋白质。这通过在避免蛋白质解折叠的条件下制备浓缩物来实现。例如,该过程优选在以下温度下进行,所述温度足够低以避免蛋白质解折叠,并且同时减弱在裂解的酵母细胞悬浮液中的蛋白酶活性。
7.本发明的浓缩物可以是液体或干粉。如果浓缩物以干粉的形式提供,则它必须用水重构用于制备凝胶。当将水加入粉末中时,蛋白质溶解并在加热到50℃或更高后形成凝胶状蛋白质基质。由于酵母蛋白质浓缩物的味道是不明显的,因此它可以与不同的香味混合,以生产不同味道的食品。
8.因此,在第一个方面,本发明涉及用于制备包含折叠的酵母蛋白质分子的酵母蛋白质浓缩物的方法,所述方法包括:(a)提供包含酵母细胞的悬浮液;(b)将悬浮液的ph调整到6.5至8.5的值;(c)通过机械手段使酵母细胞裂解,优选在低于40℃的温度下进行;(d)使裂解物的可溶性级分经受过滤,以减少小于30 kda的分子的含量;和(e)任选地,使从步骤(d)中的过滤获得的溶液干燥,以获得蛋白质浓缩物粉末。
9.在上述方法的第一步中,提供了包含酵母细胞的悬浮液。在一个简单的实施方案中,酵母细胞悬浮液可以是用于培养酵母细胞的含有细胞的培养基的级分。这种含有细胞的培养基可以直接用作上述方法的步骤(a)的意义上的悬浮液。用于生长酵母的培养基和方法是本领域众所周知的。合适的培养基包括例如sigma aldrich(taufkirchen,德国)的ypd培养基。
10.在另一个实施方案中,步骤(a)中使用的悬浮液是酵母细胞在水中的悬浮液。为此,通过将细胞与培养基分离,在酵母细胞已生长至一定密度后,收获酵母细胞。例如,使含有细胞的培养基经受离心或分离,以便使细胞沉淀。任选地,可以用水或合适的缓冲液洗涤细胞,以去除培养基组分。随后将细胞沉淀重悬浮于水或合适的缓冲液中。已重悬浮于水或缓冲液中的酵母细胞随后代表上述方法的步骤(a)中的含有酵母细胞的悬浮液。
11.优选地,上述方法的步骤(a)中提供的细胞悬浮液具有至少100、至少200、至少300、至少400、至少500、至少600、至少700、至少800、至少900、至少1,000、至少5,000或至少10,000升的体积。优选地,悬浮液是含水悬浮液。
12.优选在步骤(a)中提供的酵母细胞悬浮液已调整到具有约4
‑
20%,优选约5
‑
16%,且甚至更优选约6
‑
14%,例如12%的干物质含量。本文列举的干物质百分比指基于悬浮液的总重量的重量%。悬浮液的干物质含量可以依照标准程序,使用商购可得的装置例如moisture analyzer(mettler
‑
toledo gmbh,gie
ß
en,德国)进行确定。一旦已确定了起始悬浮液的干物质含量,就可以通过使悬浮液稀释或浓缩将该悬浮液调整到预定值。
13.用于制备本发明的蛋白质浓缩物的酵母类型没有具体限制。可以用于本发明的方法的酵母细胞可以包含例如属于酵母属(saccharomyces)的酵母,例如酿酒酵母(s. cerevisiae)、薛瓦酵母(s. chevalieri)、布拉氏酵母(s. boulardii)、贝酵母(s. bayanus)、意大利酵母(s. italicus)、德尔布酵母(s. delbrueckii)、罗斯酵母(s. rosei)、微球酵母(s. microellipsodes)、卡尔斯伯酵母(s. carlsbergensis)、二孢酵母(s. bisporus)、发酵性酵母(s. fermentati)、鲁氏酵母(s. rouxii)或葡萄汁酵母(s. uvarum);属于裂殖酵母属(schizosaccharomyces)的酵母,例如日本裂殖酵母(s. japonicus)、s. kambucha、八孢裂殖酵母(s. octosporus)或粟酒裂殖酵母(s. pombe);属于汉逊酵母属(hansenula)的酵母,例如温奇汉逊酵母(h. wingei)、h. arni、亨氏汉逊酵母(h. henricii)、美洲汉逊酵母(h. americana)、加拿大汉逊酵母(h. canadiensis)、h. capsulata或多形汉逊酵母(h. polymorpha);属于假丝酵母属(candida)的酵母,例如白色假丝酵母(c. albicans)、产朊假丝酵母(c. utilis)、博伊丁假丝酵母(c. boidinii)、星形假丝酵母(c. stellatoidea)、无名假丝酵母(c. famata)、热带假丝酵母(c. tropicalis)、光滑假丝酵母(c. glabrata)或近平滑假丝酵母(c. parapsilosis);属于毕
赤酵母属(pichia)的酵母,例如巴斯德毕赤酵母(p. pastoris)、克鲁维毕赤酵母(p. kluyveri)、p. polymorpha、巴氏毕赤酵母(p. barkeri)、喜仙人掌毕赤酵母(p. cactophila)、罗丹毕赤酵母(p. rhodanensis)、p. cecembensis、p. cephalocereana、p. eremophilia、发酵毕赤酵母(p. fermentans)或库德毕赤酵母(p. kudriavzevii);属于克鲁维酵母属(kluyveromyces)的酵母,例如马克斯克鲁维酵母(k. marxianus);以及属于球拟酵母属(torulopsis)的酵母,例如牛球拟酵母(t. bovina)或光滑球拟酵母(t. glabrata)。
14.在一个特别优选的实施方案中,本发明的方法使用包含来自酵母属、更优选来自酿酒酵母的酵母细胞的悬浮液。
15.在本发明的另一个特别优选的实施方案中,细胞用碱性缓冲液,例如氢氧化钠缓冲液进行洗涤。这种洗涤步骤可用于减少酵母悬浮液的刺激性味道,并且因此有助于获得具有不明显味道的最终蛋白质浓缩物。如果本发明的方法包括用碱性缓冲液的洗涤步骤,则将至少一个随后的用水洗涤步骤包括到该方法内,以确保去除残留的碱性缓冲液。例如,如果酵母悬浮液用一定体积的碱性缓冲液洗涤,则它随后在裂解前用两倍体积的水洗涤。
16.在使细胞裂解之前,在上述方法的步骤(b)中,将悬浮液的ph调节到6.5至8.5的值。对于调整ph,可以使用标准的碱性试剂和酸性试剂,例如hcl和naoh。已发现了在6.5至8.5的范围内的ph对于改善最终蛋白质浓缩物的胶凝行为令人惊讶地有用。在一个优选的实施方案中,酵母细胞悬浮液的ph为约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4或约8.5。7.0至8.0或7.2至7.8,例如7.5的ph是特别优选的。
17.在本发明的另一个优选实施方案中,临在细胞裂解之前将核糖核酸酶(rna酶)加入悬浮液中。已发现rna酶的添加显著改善了在裂解后可溶性物质与不溶性物质的分离。rna酶可以从不同的制造商获得。合适的酶可以包括来自thermo fisher scientific(bremen,德国)的purelink rna酶a或来自sigma aldrich(taufkirchen,德国)的rna酶a。技术人员对于确定待加入酵母细胞悬浮液中的rna酶的最佳量将没有问题。rna酶的合适量按照干物质计通常在约0.1%至1%的范围内。
18.在已调整细胞悬浮液的ph后,在上述方法的步骤(c)中,使酵母细胞裂解,以释放酵母蛋白质。酵母物种如酿酒酵母具有厚细胞壁,这决定了其形状并保护其内部。酵母的细胞壁主要由共价连接的基质中的β
‑
葡聚糖、甘露糖蛋白和几丁质组成,并且它构成酵母总干物质的大约三分之一。在细胞壁下方,酵母细胞具有脂质双层。为了从细胞内部释放蛋白质,这两个保护屏障均需要被破坏。
19.根据本发明的方法,细胞裂解将机械地执行,因为通常用于酵母细胞裂解的蛋白酶或其它酶如例如葡聚糖酶的使用需要升高的温度。这进而导致蛋白质的快速分解。控制这一步中的温度是特别重要的。必须确保温度不超过40℃,因为更高的温度将诱导蛋白质的变性,这意味着蛋白质在加热后将不再能够形成稳定的网络。另外,酵母细胞含有能够将蛋白质水解成氨基酸的广泛多样的蛋白酶。当酵母细胞被破坏时,蛋白酶被释放并且可以分解由酵母细胞释放的其它蛋白质分子。由于通过本发明的方法制备的蛋白质浓缩物预期用于人食物产品中,因此应该避免蛋白酶阻断剂,如edta或pmsf的使用,因为这些化学制品对于用于人消费是不安全的。因此,根据本发明优选在低温下执行细胞裂解,以便减少蛋白
酶的活性。
20.优选地,本发明的方法的步骤(a)
‑
(d)在低于40℃,更优选低于30℃,且甚至更优选低于20℃的温度下执行。低于20℃例如15℃或10℃的温度是特别优选的,以避免蛋白质被从酵母细胞中释放的蛋白酶不希望的分解。
21.根据一个优选的实施方案,酵母细胞裂解通过使用珠磨机来实现。一方面,这确保蛋白质在细胞破裂后保持完整。另一方面,珠磨机的使用不需要可以损害所得到的蛋白质浓缩物的食品级质量的任何添加剂。珠磨机通常包括充满珠的腔室,所述珠通过一组叶轮翅片四处移动。当含有细胞的悬浮液穿过腔室时,细胞在与珠碰撞时被破坏。细胞破裂的效率可以通过常规措施进行调整,例如,通过改变决定酵母悬浮液多么快速地穿过珠磨机的腔室的流速。通常,低流速导致高裂解效率,因为细胞具有更多的时间与研磨珠碰撞。取决于珠磨机的腔室的体积,可以选择至少10 kg/h,例如至少20 kg/h、至少50 kg/h或至少100 kg/h的流速。特别优选在操作期间将珠磨机冷却至低于20℃例如18℃、16℃、14℃、12℃或10℃的温度。珠磨机由不同的制造商提供,例如来自willy a. bachofen ag(muttenz,瑞士)的dyno
®‑
mill multi lab wab。
22.对裂解效率具有直接影响的另一个因素是珠材料和尺寸。珠可以由不同的材料例如玻璃、陶瓷或塑料制成。已用氧化锆珠例如氧化钇稳定的氧化锆珠获得了特别良好的结果。另外,与玻璃珠相比,这些珠明显更耐用。用于破坏酵母细胞的珠,例如氧化锆珠,可能具有通常范围为0.2
‑
2.0 mm的不同尺寸。已发现对于破坏酵母细胞,0.25
‑
0.35 mm的珠尺寸导致特别良好的结果。因此,0.25
‑
0.35 mm的珠尺寸是特别优选的。可以使用30
‑
80%的珠填充体积,例如约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%或约75%。50
‑
60%的珠填充体积根据本发明是特别优选的。
23.影响细胞破裂效率的另一种方式是改变叶轮体系结构。叶轮通常安装有塑料翅片以移动珠。为了改善细胞破裂,例如有可能在转子上提供加速器。加速器设计为迫使珠更经常碰撞。叶轮转速是可以进行调整以改善细胞破裂的另一个参数。可以使用1
‑
20 m/s,例如约1 m/s、约2 m/s、约3 m/s、约4 m/s、约5 m/s、约6 m/s、约7 m/s、约8 m/s、约9 m/s、约10 m/s、约11 m/s、约12 m/s、约13 m/s、约14 m/s或约15 m/s的转子速度。技术人员通过常规实验将能够容易地找到用于破坏珠磨机中的酵母悬浮液的最佳参数。
24.使酵母细胞机械裂解的又一种方法使用高压匀浆(hph)。高压匀浆是制药、化学和食品工业中通常用于稳定乳状液等等的方法。然而,它也可以用于破坏细菌和酵母,以便从细胞中提取细胞内产物。在hph过程中,待破碎的细胞在高压下穿过窄缝。当酵母细胞穿过这个窄缝时,流速急剧增加,且压力突然降低。所得到的剪切力导致细胞破碎。
25.用于本发明的方法中的hph装置可以从不同的制造商获得。例如,可以使用avestin europe gmbh(mannheim,德国)的emulsiflex
‑
c3或spx flow technology germany gmbh(moers,德国)的1000/2000匀浆器。酵母悬浮液可以穿过hph装置一次或几次。如果悬浮液穿过装置几次,则细胞破裂的效率增加。装置的压力可以设定为至少1000巴的压力。优选地,压力将是至少1100巴、至少1200巴、至少1300巴、至少1400巴、至少1500巴、至少1600巴、至少1700巴、至少1800巴、至少1900巴、或至少2000巴或更多。
26.在如上所述破碎细胞后,裂解物的ph可能接近6.0或更低的值。优选将裂解物的ph重新调整到6.5至8.5的值。例如,将裂解物的ph重新调整到约6.5、约6.6、约6.7、约6.8、约
6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4或约8.5。7.0至8.0或7.2至7.8,例如7.5的ph是特别优选的。
27.在酵母细胞已破碎之后,优选将除其它组分外还含有折叠酵母蛋白质的可溶性级分与不溶性级分分离,后者主要含有细胞壁组分、细胞器和未裂解的细胞。可溶性级分与不溶性级分的分离可以通过不同的方法执行,所述方法包括离心、过滤和其它方法。在一个简单的实施方案中,使含有破碎细胞的裂解物(无论是否稀释)经受例如以2,000
‑
25,000 g的离心,以使不溶性物质沉淀。获得含有从细胞内部释放的可溶性细胞组分(包括折叠的蛋白质)的上清液,并且优选将其冷却至低于20℃直至进一步使用。
28.可替代地,可溶性级分与不溶性级分的分离通过使用保留不溶性物质的过滤材料的标准过滤技术来实现。例如,可以进行使用孔径为0.2
–
15 μm的过滤器的死端过滤。也可能是错流或切向流过滤,以避免过滤器的过早堵塞。截留分子量(mwco)应该大于300 kda,以允许所有蛋白质通过。
29.在上述方法的步骤(d)中,使裂解物的可溶性级分经受过滤步骤,其选择性地减少小于30 kda的分子的含量。优选地,相对于在上述方法的步骤(c)中获得的裂解物的可溶性级分中这些分子的含量,小于30 kda的分子的含量减少至少25%、更优选至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%。
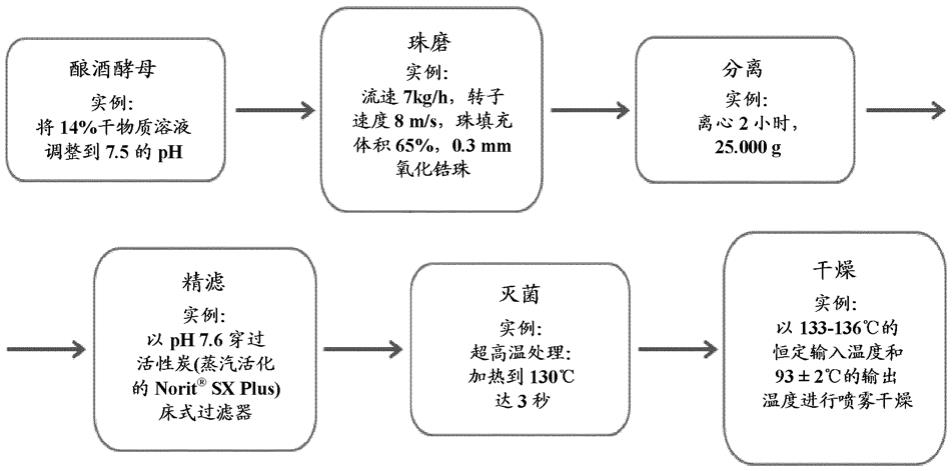
30.通过过滤步骤去除的分子优选小于20 kda,更优选小于10 kda,且甚至优选小于5 kda。
31.用于去除小于30 kda的分子的合适过滤方法是已知的,并且包括例如活性炭过滤、超滤或纳米过滤。活性炭过滤是这样的分离方法,其基于分子吸附至碳颗粒的表面、以及小分子截留在活性炭的凹痕和孔中。例如,流体可以穿过活性炭分子的过滤床,并且有机小分子被过滤床中的碳颗粒结合。可替代地,可以将活性炭直接加入流体中,伴随或不伴随混合温育一定时间,并且随后从碳中取出。
32.可替代地或另外,超滤和/或纳米过滤可以用于去除小于30 kda、优选小于20 kda、更优选小于10 kda并且甚至优选小于5 kda的分子。这些过滤技术使用充当具有特定尺寸的孔的物理屏障的膜。两种过滤技术均可以作为死端过滤或切向流过滤施加。膜设计为仅允许直径小于孔直径的颗粒通过。在过滤过程中,初始溶液被分成两个不同的级分:已通过膜的级分(渗透物)以及已被膜保留的级分(渗余物)。在超滤过程中使用的过滤器通常由其截留分子量(mwco)定义,所述截留分子量范围通常为0.1
‑
1,000 kda。在一个实施方案中,在上述方法的步骤(d)中使用截留分子量(mwco)为30 kda或更小、优选20 kda或更小、10 kda或更小且最优选5 kda或更小的膜,进行超滤。
33.任选地,将过滤后获得的蛋白质溶液灭菌或巴氏杀菌。优选在不加热产物的情况下,例如通过uv灭菌等等,将蛋白质溶液灭菌或巴氏杀菌。可替代地,可以通过使蛋白质溶液经受非常短的超高温处理来实现灭菌或巴氏杀菌。例如,可以将蛋白质溶液加热到120
‑
150
°
的温度3
‑
5秒。
34.在过滤步骤(d)后获得的溶液是在本发明的意义上的液体蛋白质浓缩物。液体浓缩物可以用于制备凝胶。为此,将浓缩物的等分试样加热到50℃或更高的温度。高温诱导浓缩物中的蛋白质解折叠并相互结合,从而形成凝胶。
35.在过滤步骤(d)后获得的溶液也可以进行干燥,从而提供蛋白质浓缩物粉末。该粉
末具有显著改善的贮存期限,因为粉末中的蛋白质不再易于被内源性或外源性蛋白酶分解。酵母蛋白质的分解将导致蛋白质浓缩物的胶凝性质减少。进一步的优点在于保护粉末免于可以影响食物安全的微生物污染物的生长。根据本发明,优选通过冷冻干燥或喷雾干燥来实现从过滤获得的溶液的干燥。
36.喷雾干燥的原理基于将溶液分散成细小的液滴,然后将所述液滴引入热空气流内。溶剂从基质液滴中蒸发,使得干燥的产物簇保留。在本发明的情况下,重要的是选择并不导致蛋白质变性的温度条件。虽然喷雾干燥在通常高于蛋白质的熔解温度的温度下执行,但这并不意味着蛋白质在喷雾干燥过程中完全解折叠。蛋白质变性不是即时事件,而是具有许多过渡阶段的过程。因此,通过限制在喷雾干燥期间的高温时间段,可以避免酵母蛋白质的变性。可以使用标准喷雾干燥装置,例如来自b
ü
chi labortechnik gmbh(essen,德国)的mini spray dryer b
‑
290或来自gea(berlin,德国)的mobile minor
™ꢀ
spray dryer。
37.冷冻干燥或冻干是从产物中去除水以延长贮存期限的过程。冷冻干燥包括使产物冷冻、减少压力且添加热,以允许材料中的冷冻水升华。可以施加各种方法用于使产物冷冻。例如,可以通过使用标准冷冻机或冷冻浴来实现冷冻。将产物冷却到低于其三相点确保在加热后发生升华。为了预防可能损坏待干燥产物的结构的大晶体形成,快速完成冷冻。当冷冻水升华时,去除产物中约95%的水。大多数材料可以干燥到1
‑
5%的残留水分。可以使用标准冷冻干燥装置,例如来自gea(berlin,德国)的lyovac
™
装置、来自christ(osterode am harz,德国)的gamma 2
‑
20 freeze dryer lcm
‑
1、或来自fisher scientific gmbh(schwerte,德国)的christ martin
™ꢀ
alpha 1
‑
2 lyophilisator。
38.在另一个方面,本发明提供了可通过如上所述的方法获得的酵母蛋白质浓缩物。
39.在又另一个方面,本发明提供了以液体或粉末形式的酵母蛋白质浓缩物,其包含解折叠蛋白质和折叠蛋白质的混合物,其中包含在蛋白质浓缩物中的折叠蛋白质在45℃至83℃的温度范围下解折叠。折叠蛋白质的存在及其分别的解折叠温度可以通过用于测量蛋白质稳定性和功能性的标准装置进行分析,所述装置例如tycho nt.6(nanotemper technologies gmbh,munich)。tycho nt.6通过光谱测量在330 nm和350 nm处的吸光度来定量在增加中的温度下的蛋白质解折叠。该比率的变化对应于蛋白质解折叠。当样品含有各种蛋白质的复杂混合物时,不存在明显的熔解温度,而是存在熔解范围。
40.根据本发明的一个优选实施方案,所述浓缩物中包含的至少40%的蛋白质具有大于5 kda的表观尺寸。优选地,蛋白质浓缩物中包含的至少50%、至少60%或至少70%的蛋白质具有大于5 kda的表观尺寸。
41.根据本发明的另一个优选实施方案,酵母蛋白质浓缩物中包含的至少40%的蛋白质具有大于10 kda的表观尺寸。优选地,蛋白质浓缩物中包含的至少50%、至少60%或至少70%的蛋白质具有大于10 kda的表观尺寸。
42.根据本发明的另一个优选实施方案,酵母蛋白质浓缩物中包含的至少40%的蛋白质具有大于20 kda的表观尺寸。优选地,蛋白质浓缩物中包含的至少50%或至少60%的蛋白质具有大于20 kda的表观尺寸。
43.根据本发明的另一个优选实施方案,酵母蛋白质浓缩物中包含的至少40%的蛋白质具有大于30 kda的表观尺寸。优选地,蛋白质浓缩物中包含的至少50%或至少60%的蛋白
质具有大于30 kda的表观尺寸。
44.根据本发明的另一个优选实施方案,酵母蛋白质浓缩物中包含的至少30%的蛋白质具有大于60 kda的表观尺寸。优选地,蛋白质浓缩物中包含的至少40%的蛋白质具有大于60 kda的表观尺寸。
45.根据本发明的另一个优选实施方案,酵母蛋白质浓缩物中包含的至少20%的蛋白质具有大于150 kda的表观尺寸。优选地,蛋白质浓缩物中包含的至少25%的蛋白质具有大于150 kda的表观尺寸。
46.根据本发明进一步优选的是,本发明的酵母蛋白质浓缩物含有少于45%的不是蛋白质的化合物。更优选地,蛋白质浓缩物中非蛋白质化合物的含量小于40%、小于35%或小于30%。
47.另外,本发明的蛋白质浓缩物具有特别少量的游离氨基酸和二肽或三肽。优选地,游离氨基酸、二肽和三肽的总量小于20%,更优选小于18%。
48.本发明的蛋白质浓缩物优选具有小于15% (w/w),更优选小于14%、小于13%、小于12%或小于11%的rna含量。游离核苷酸的量优选小于5% (w/w),更优选小于4%、小于3%或小于2%。
49.在又另一个方面,本发明提供了以液体或粉末形式的酵母浓缩物,其按照干物质计包含至少55% (w/w),且优选至少60% (w/w)、至少65% (w/w)、或至少70% (w/w)的总粗蛋白,并且其中浓缩物中至少40%的蛋白质具有大于60 kda的尺寸。
50.如本文使用的,优选通过经由常用的凯氏定氮法测量样品的氮含量,并且将结果乘以换算因子6.25来确定总粗蛋白含量。换言之,总粗蛋白含量通过下式进行确定:蛋白质 = 凯氏氮含量x 6.25。在此上下文中,术语“总粗蛋白”指示样品中除蛋白质外的含氮化合物可能在一定程度上促成该值,例如尿素或游离氨基酸。凯氏定氮法在现有技术中广泛周知为用于确定样品中的总粗蛋白含量的最常用程序。通过凯氏定氮法确定粗蛋白含量的全自动化装置由几个制造商销售,例如kjeltec
™ꢀ
8400装置(foss gmbh,hamburg,德国)。
51.如本文使用的,本发明的浓缩物按照干物质计包含至少55% (w/w)总粗蛋白,这意味着在干物质的基础上,1.0 g浓缩物包含至少0.55 g总粗蛋白。干物质指完全干燥的化合物的重量。优选地,总粗蛋白用kjeltec
™ꢀ
8400装置进行测量。
52.在包含所述量的按照干物质计至少55% (w/w)总粗蛋白的浓缩物中,至少40%的蛋白质具有大于60 kda的表观尺寸。换言之,本发明的浓缩物包含大量的较大蛋白质。浓缩物中蛋白质的表观尺寸可以通过常规方法,例如尺寸排阻层析(sec)进行测量。
53.优选根据本发明的酵母蛋白质浓缩物按照干物质计包含30% (w/w)或更少,优选25% (w/w)或更少,且更优选20% (w/w)或更少的β
‑
葡聚糖。换言之,在干物质的基础上,1.0 g浓缩物包含最多0.3 g β
‑
葡聚糖且优选更少。
54.在按照干物质计包含至少55% (w/w)总粗蛋白的蛋白质浓缩物中,优选至少40% (w/w),且更优选至少45% (w/w)或至少50% (w/w)的总干物质是可溶性粗蛋白。给定样品中可溶性粗蛋白的量可以通过以下进行确定:将样品离心以去除任何不溶性蛋白质组分,并且随后测量上清液的粗蛋白含量。可溶性粗蛋白的量优选通过下述程序确定。
55.在20℃下制备在去离子水中的1% (wt/wt)的蛋白质浓缩物溶液,并且轻轻搅拌30分钟。必须严格避免泡沫的形成。随后,将1.5 ml所述溶液转移到2 ml反应管内,并且将溶
液在4℃下以25,000 x g离心20分钟。取出1 ml上清液,并且通过凯氏定氮法测量所述上清液中按照干物质计的粗蛋白含量。测量进行3次,并且从该测量获得的平均结果反映了样品的按照干物质计的可溶性粗蛋白含量。
56.如通过凯氏定氮法测量的,本发明的蛋白质浓缩物按照干物质计具有至少40% (w/w)的可溶性粗蛋白含量。
57.特别优选的是,包含如上所示的按照干物质计至少40% (w/w)的可溶性粗蛋白含量的根据本发明的酵母蛋白质浓缩物,具有高比例的可以通过加热浓缩物而沉淀的可溶性粗蛋白。优选地,通过将浓缩物加热到90℃达10分钟,可以沉淀浓缩物中至少20% (w/w),且更优选至少25% (w/w)、至少30% (w/w)、至少35% (w/w)、至少40% (w/w)、至少45% (w/w)或至少50% (w/w)的可溶性粗蛋白。优选地,沉淀方法如下执行。
58.在20℃下制备在去离子水中的1% (wt/wt)的蛋白质浓缩物溶液,并且轻轻搅拌30分钟。必须严格避免泡沫的形成。随后,将1.5 ml所述溶液转移到2 ml反应管内。使管在90℃下的水浴中温育10分钟,然后置于冰上10分钟。随后,将管在4℃下以25,000 x g离心20分钟。取出1 ml上清液,并且通过凯氏定氮法测量所述上清液中按照干物质计的粗蛋白含量。
59.进行测量3次,并且从该测量获得的平均结果反映了在热处理后样品的可溶性粗蛋白含量。基于该值和样品的总可溶性蛋白含量,可以通过下式确定可以通过在90℃下的热处理而沉淀的可溶性粗蛋白的部分:技术人员对于确定通过如上所述的热处理而沉淀的可溶性粗蛋白的部分将没有问题。
60.在包含按照干物质计至少55% (w/w)总粗蛋白,且优选至少40% (w/w)可溶性粗蛋白的蛋白质浓缩物中,所包括的折叠蛋白质优选在45℃至83℃的温度范围内解折叠。进一步地,包含按照干物质计至少55% (w/w)总粗蛋白,且优选至少40% (w/w)可溶性粗蛋白的蛋白质浓缩物,优选包含小于20%,更优选小于18%的游离氨基酸、二肽和三肽的总量。进一步地,在包含按照干物质计至少55% (w/w)总粗蛋白,且优选至少40% (w/w)可溶性粗蛋白的蛋白质浓缩物中,优选至少40%的蛋白质具有大于5 kda的表观尺寸。
61.在一个优选的方面,本文所述的酵母蛋白质浓缩物是干物质含量为至少1%、至少1.5%、至少2%、至少2.5%、至少3%、至少3.5%、至少4%、至少4.5%或至少5%的液体。在另一个优选的方面,本文所述的酵母蛋白质浓缩物是干物质含量为至少90%、至少92%、至少94%或至少96%的粉末。
62.在另一个方面,本发明提供了用于制备蛋白质凝胶的方法,所述方法包括:(a)提供如上所述的液体酵母蛋白质浓缩物;(b)将浓缩物加热到至少55℃的温度,以提供蛋白质凝胶。
63.该方法包括提供液体酵母蛋白质浓缩物。为了制备凝胶,将液体浓缩物或其等分试样加热到至少55℃、至少60℃、至少65℃、至少70℃、至少75℃或至少80℃的温度。在此温度下,液体中的折叠蛋白质将变性并缠结在一起以形成凝胶。
64.在又另一个方面,本发明提供了用于制备蛋白质凝胶的方法,所述方法包括:
(a)提供如上所述的酵母蛋白质浓缩物粉末;(b)将酵母蛋白质浓缩物粉末与含水载液混合;(c)将混合物加热到至少55℃的温度,以提供蛋白质凝胶。
65.从干燥的浓缩物起始的方法包括将浓缩物粉末与含水载液混合。含水载液可以是水,例如自来水,或另一种合适的含水载体,例如缓冲溶液。优选进行粉末的重构,使得获得至少2% (w/w)、至少5%、至少10%、至少15%、至少20%或至少25%的溶液。酵母蛋白质浓缩物粉末和含水载液的混合可以在搅动下例如通过搅拌执行。
66.然后将所得到的混合物加热到至少55℃,且优选至少60℃、至少65℃、至少70℃、至少75℃或至少80℃的温度。在此温度下,混合物中的折叠蛋白质将变性并缠结在一起以形成凝胶。
67.在最后一个方面,本发明涉及如本文所述的酵母蛋白质浓缩物用于制备富含蛋白质的食物或饲料产品的用途。富含蛋白质的食物产品可以是甜点或布丁。进一步地,富含蛋白质的食物产品可以是肉类替代产品。
68.肉类替代产品可以包含照常规用于生产此类产品的另外的化合物,例如如来自稻、小麦、玉米、马铃薯、甘薯、大麦或高粱的淀粉,以及植物油,例如大豆油、橄榄油、菜籽油、棕榈油、花生油、玉米油、亚麻油、向日葵油、红花油或棉籽油。
附图说明
69.图1显示了根据本发明的用于制备酵母蛋白质浓缩物粉末的一个优选实施方案的示意性概述。
70.图2显示了依照本文下文所述的实施例1制备的干燥蛋白质浓缩物粉末样品中,蛋白质的表观分子量分布。
71.图3显示了如通过尺寸排阻层析(sec)确定的,来自本文下文所述的实施例2的超滤渗透物的表观分子量分布。
72.图4显示了蛋白质浓缩物的折叠蛋白质的熔解曲线。将干燥的蛋白质浓缩物以20% (w/w)溶解于水中,并且使用tycho nt.6(nanotemper technologies gmbh,munich)分析熔解曲线。
实施例
73.提供下述实施例以便说明本发明。然而,应当理解,本发明的范围并不受实施例的限制。技术人员将理解,可以进行若干修改而不偏离本发明的范围。
74.实施例1:使用炭过滤的制备方法从酵母细胞培养物中收获酿酒酵母a2w5酵母细胞并将其悬浮于水中。将干物质含量调整到14%。悬浮液具有1 l的体积。使用naoh将悬浮液的ph调整到ph 7.5。
75.使用尺寸为0.25
‑
0.35 mm的氧化钇稳定的氧化锆珠,在来自willy a. bachofen ag(muttenz,瑞士)的dyno
®‑
mill multi lab wab中执行细胞破裂。流速设定为7 kg/h,且转子速度设定为8 m/s。珠填充体积设定为65%。
76.通过使用kjeldahl,j. fresenius,zeitschrift f. anal. chemie (1883) 22:366的方法,测量蛋白质提取产率来确认细胞破裂的效率。
77.从珠磨机获得的裂解物的ph使用naoh调整到7.6。随后,使裂解物经受在heraeus multifuge x3r中以25000 x g的离心达120分钟。将上清液与沉积物分离,并且经受使用填充有蒸汽活化的norit
®ꢀ
sx plus的活性炭过滤筒(高度:5 cm,直径:6 cm)的活性炭过滤。
78.将从活性炭过滤获得的溶液在130℃的温度下灭菌3秒,并且随后使用来自b
ü
chi labortechnik gmbh(essen,德国)的mini spray dryer b
‑
290进行喷雾干燥,其中恒定输入温度为133
‑
136℃且输出温度为93
ꢀ±ꢀ
2℃。
79.对如此获得的粉末进行化学分析和游离氨基酸含量分析:游离氨基酸分析:
实施例2:使用超滤的制备方法重复实施例1中描述的实验,除了使用超滤代替活性炭过滤之外。超滤用mwco为10 kda的聚醚砜(pes) uf gr 81pp膜来完成。七块支撑板配备有止动盘,使得总共使用了14个过滤器。根据制造商的说明书洗涤过滤器装备。在开始时,渗余物流速为2.3 l/分钟,且渗透物流速为0.064 l/分钟。在20分钟后,渗余物以2.2 l/分钟流动,而渗透物以0.054 l/分钟流出。使用尺寸排阻层析(sec)分析渗透物。结果显示于图3中。可以看出,只有小于膜截断值的颗粒才能通过。这指示了酵母蛋白质保留在渗余物中,并且不存在显著的蛋白质损失。如上文实施例1中所述,将从超滤获得的溶液灭菌且喷雾干燥。
80.实施例3:蛋白质凝胶的制备测试实施例1和2中获得的粉末在水中重构后的胶凝性质。为此,将蛋白质粉末溶解于自来水中,以得到20% (w/w)的溶液。
81.接下来,使用tycho nt.6(nanotemper technologies gmbh,munich),在室温和95℃之间测量蛋白质浓缩物中蛋白质的熔解温度范围。图4显示了本发明产品内的蛋白质主要在45℃至83℃之间熔解。蛋白质凝胶通过至少7人的感官小组来评价凝胶硬度和风味特
征。小组内存在关于样品的主要感知的普遍共识。味道被描述为咸的、甜的和烘烤的。小组没有注意到强烈的酵母风味。同时,发现凝胶是坚固的,并且在其稠度方面类似煮熟的蛋白。
82.实施例4:总粗蛋白含量的确定分析实施例1中活性炭过滤后获得的液体酵母蛋白质浓缩物样品的按照干物质计的总粗蛋白含量。液体浓缩物具有5.3% (w/w)的干物质浓度。使用具有kjeltec
‑
sampler 8420的foss kjeltec
‑
analyser 8400、具有tecator
‑
scrubber的tecator
‑
digestor auto用于消化步骤,通过凯氏定氮法分析500 mg的等分试样的样品。为了计算总粗蛋白含量,使用换算因子6.25。结果,对于液体酵母蛋白质浓缩物,测量了按照干物质计70.5% (w/w)的总粗蛋白含量。
83.实施例5:可溶性粗蛋白含量的确定使用去离子水,将实施例1中活性炭过滤后获得的液体酵母蛋白质浓缩物样品稀释至1% (w/w)的干物质浓度。将该溶液在20℃下搅拌30分钟。2 ml
‑
eppendorf管填充有1.5 ml稀释的蛋白质溶液。将管在4℃下以25,000 x g离心20分钟。在离心后,从管中取出1 ml上清液,并且如实施例4中所述经受凯氏蛋白质测量。结果,测量了按照干物质计61.3% (w/w)的可溶性粗蛋白含量。
84.实施例6:热反应性蛋白质部分的确定通过在20℃下搅拌30分钟,如上所述使用实施例5中使用的干物质浓度为1% (w/w)的另一个样品等分试样。2 ml
‑
eppendorf管填充有1.5 ml稀释的蛋白质溶液。然后通过将管放入90℃的水浴内10分钟对管进行热处理。之后,将管置于冰上10分钟。随后,将管在4℃下以25,000 x g离心20分钟。在离心后,从管中取出1 ml上清液,并且如实施例4中所述经受凯氏蛋白质测量。结果,确定了在热处理后按照干物质计32.8% (w/w)的可溶性粗蛋白含量。可以通过加热而沉淀的可溶性粗蛋白的部分通过下式进行确定:在上式中使用实施例5中测量的可溶性粗蛋白含量和实施例6中测量的在热温育后的可溶性粗蛋白,获得下式:100%
ꢀ‑
(32.8% / 61.3 % x 100%)= 100%
‑ꢀ
53.5% = 46.5%因此,上述计算显示了,46.5%的可溶性粗蛋白可以通过如上所述的加热而沉淀。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

