涉及测试溶酶体贮积紊乱的方法
1.本技术是分案申请,原申请的申请日为2015年9月2日、申请号为2015800581144、发明名称为“涉及测试溶酶体贮积紊乱的方法”。
2.相关申请的交叉引用
3.本技术依赖于2014年9月2日提交的美国专利申请号14/474,524并要求其优先权,该申请的全部内容通过引用并入本文。
技术领域
4.本说明书涉及用于检测酶活性的分析试剂。提供了溶酶体酶活性的检测,其可以被用于检测一种或多种溶酶体贮积紊乱的筛选测定。
背景技术:
5.溶酶体贮积紊乱是特征在于体内缺乏特定酶的一组遗传性紊乱,其导致身体不能分解代谢物质。作为实例,法布里病是在每40,000人中有1人发病的溶酶体贮积紊乱。其由酶α
‑
半乳糖苷酶的缺乏引起,这导致身体不能分解被称为球形三酰神经酰胺(globotriaosylceramide)的特定脂肪物质。第二个实例是高歇病,一种由不能分解脂肪物质或脂质——被称为葡糖苷酰鞘氨醇类(也被称为葡糖脑苷脂类)——引起的溶酶体贮积紊乱。患有高歇病的个体不能制造葡糖脑苷脂酶——一种分解这些脂肪物质需要的酶。这些脂肪物质然后在肝细胞、脾细胞和骨髓细胞中累积。第三个实例是蓬珀病,一种由酶酸性α
‑
葡糖苷酶——其在分解被称为糖原的某些糖类中是需要的——的缺乏引起的溶酶体贮积紊乱。当酶酸性α
‑
葡糖苷酶缺失时,糖原在体内的各个组织和器官中累积。
6.在极大程度上,溶酶体贮积紊乱是儿童紊乱,但是在成年人中也会展现一些。在他们的大多数中,患者在出生时是正常的并且在随后的一些时间开始患有进行性神经恶化。临床表型取决于生化缺陷的类型和严重性。这些溶酶体紊乱中的一些,比如蓬珀病和克腊比病,主要在婴儿期展现。在开发在临床症状的开始之前检测这些紊乱使得治疗性干预可以发起的方法中存在着持续的努力。
7.大多数目前提供的用于溶酶体贮积紊乱(lsd)的筛选测试基于由zhang等(methods mol biol.2010;603:339
–
350)描述的质谱法和材料。该方法,对于六种lsd(蓬珀病、克腊比病、尼
‑
皮二氏病a&b、法布里病、高歇病和mps
‑
1),使用六种不同的条件在六个不同的器皿中进行六种酶活性测定。已经描述了用于相同紊乱的多重测定(scott等,j pediatr.2013年8月;163(2):498
‑
503;spazil等,clin chem.2013年3月;59(3):502
‑
11)。多重方法需要较少的实验室劳动和试剂,但是产生与非多重方法类似质量的测定结果通常是更困难的,在该非多重方法中测定条件需要代表支持目标酶的足够活性同时抑制任何混淆过程的折衷(compromise)。各种酶活性增强剂和抑制剂被添加至多重缓冲液以支持优化条件,其使得目标酶中的每一种可测量地作用于其特异性人工底物。
8.油酸已经被鉴定为galc酶的增强剂,galc酶的低活性与克腊比病相关联(zhang等,同上;zhang等,clin chem.2008;54(10):1725
‑
1728;li等,clin chem.2004;50(10):
1785
‑
1796)。该酸已经被加入到缓冲液中用于克腊比病筛选。但是,油酸在水性缓冲液中溶解是非常困难的,并且在测定缓冲液中得到的不同浓度已经导致测定结果具有差的再现性。由于该原因,用于克腊比病筛选的大多数出版的方案省略了油酸,因为再现性问题超过来自增强的酶活性的任何潜在性能优势。
9.因此,对于改善用于检测溶酶体紊乱的方法和组合物存在持续的需求。
技术实现要素:
10.提供下面的发明内容以促进对所提供方法特有的创新特征中的一些的理解,并且发明内容不意欲是充分描述。方法的各个方面的充分理解可以通过将整个说明书、权利要求书、附图和摘要作为整体来获得。
11.提供了使用检测系统比如质谱法检测酶反应的改善的组合物和方法。这些组合物和方法提供了与目标酶的改善的反应性,从而改善了测定效率、再现性和准确性。
12.提供了包括在可用于评估样本中溶酶体酶活性水平的测定中的化合物。溶酶体酶活性的测试是有用的,例如,当筛选新生儿中的代谢紊乱时,以及当评估患有影响酶活性的医学病症的个体或者经历医学治疗比如酶替代疗法、基因疗法或骨髓移植的个体时。如本文所描述,使用油酸盐或油酸烷基酯改善了针对合成底物的目标酶活性。
13.本发明的一个目标是提供一种或多种添加剂至适合于检测酶——说明性地是其缺乏导致溶酶体贮积紊乱的酶——活性的反应。添加剂任选地是油酸的盐,任选地油酸钠。添加剂任选地是油酸烷基酯,任选地油酸甲酯。一种或多种添加剂任选地在测定过程之前被加入至测定的一种或多种组分进行储存,或者任选地作为可溶性材料被加入至测定。因此,提供了如此方法,其用于检测酶的存在、不存在或水平,或用于检测对象中存在或不存在酶缺乏。酶任选地是酶缺乏导致溶酶体贮积紊乱的酶。在用于检测酶的存在、不存在或水平的方法中使用油酸盐或油酸烷基酯使得测定结果中改善的置信度,其来自由于添加剂而实现的改善的反应性和再现性。用于检测酶活性的方法包括将包含目标酶的样本与底物和添加剂在其中目标酶能够作用于底物以产生酶产物的条件下接触;和检测酶产物。任选地,所述目标酶是酸性β
‑
葡糖脑苷脂酶、酸性半乳糖脑苷脂β
‑
半乳糖苷酶或酸性
‑
β
‑
葡糖脑苷脂酶。
14.检测的步骤任选地是通过质谱法,或任选地通过多反应监测比如在ms/ms中。检测的步骤任选地是通过免疫测定、底物裂解荧光测定(substrate cleavage fluorescence assay)、hplc、质谱法、或其它适合的用于检测具有低于1000道尔顿的分子量的分子的方法。
附图说明
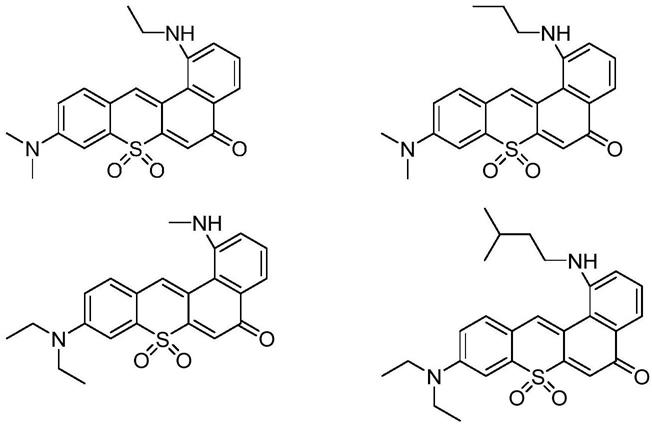
15.图1图解了在方法的一些实施方式中使用的示例性底物和内标物;
16.图2图解了当使用低的酶对照样本时加入和不加入油酸钠的情况下获得的酶活性;
17.图3图解了当使用中等的酶对照样本时加入和不加入油酸钠的情况下获得的酶活性,其中柱1代表abg,柱2代表asm,柱3代表galc,柱4代表idua,柱5代表gla和柱6代表gaa;
18.图4图解了当使用高的酶对照样本时加入和不加入油酸钠的情况下获得的酶活
性,其中柱1代表abg,柱2代表asm,柱3代表galc,柱4代表idua,柱5代表gla和柱6代表gaa;和
19.图5图解了加入和不加入油酸钠的情况下获得的比率(中等的对照dbs/低的对照dbs),其中柱1代表abg,柱2代表asm,柱3代表galc,柱4代表idua,柱5代表gla和柱6代表gaa。
具体实施方式
20.具体实施方式(一个或多个)的下列描述在本质上仅仅是示例性的,并且决不意欲限制方法的范围、其应用或用途,这些当然可以改变。组合物或方法根据本文包含的非限制性定义和术语描述。这些定义和术语不旨在起限制测定或测定系统的范围或实践的作用,而是仅出于说明性和描述性的目的被提出。虽然方法或组合物被描述为一定顺序的单个步骤或使用具体材料,但是应当理解步骤或材料可以是可互换的,使得描述可以包括如本领域技术人员容易理解的以许多方式布置的多个部分或步骤。
21.本文中使用的术语仅仅出于描述具体实施方式的目的并且不意欲是限制性的。如本文所使用,单数形式“一(a,an)”和“该(the)”意欲包括复数形式,包括“至少一个”,除非内容明确地另有指示。“或”意思是“和/或”。如本文所使用,术语“和/或”包括相关联的列举的项目的一个或多个的任何和所有组合。将进一步理解,术语“包括(comprise,comprising)”或“包含(include,including)”,当在本说明书中使用时,规定存在陈述的特征、区域、整数、步骤、操作、要素和/或组分,但是不排除存在或加入一种或多种其它特征、区域、整数、步骤、操作、要素、组分和/或其组。术语“或其组合”意思是包括前述要素中的至少一种的组合。
22.除非另有限定,本文中使用的所有术语(包括技术和科学术语)具有与本公开内容所属领域的普通技术人员通常理解的相同的含义。将进一步理解,术语,比如在通常使用的词典中定义的那些,应当被解释为具有与它们在相关领域和本公开内容的背景下的含义一致的含义,并且将不以理想化的或过度形式化的意义解释,除非在本文中明确地如此限定。
23.提供的组合物具有作为分析试剂用于检测水解酶活性——比如与溶酶体贮积紊乱相关联的溶酶体酶活性——的实用性。通过应用油酸的盐(油酸盐)或油酸烷基酯,出乎意料地发现检测系统是更加稳健和可再现的,使得检测与溶酶体贮积紊乱相关联的酶活性是更加实际的和更简单的。
24.提供了用于检测一种或多种水解酶的方法。水解酶的说明性实例包括:酸性α
‑
半乳糖苷酶a(gla)、酸性β
‑
葡糖脑苷脂酶(abg)、半乳糖脑苷脂酶(galc)、酸性α
‑
葡糖苷酶(gaa)、酸性鞘磷脂酶(sphingomylenase)(asm)和α
‑
l
‑
艾杜糖苷酸酶(idua)。这些酶对于底物的作用被用于测量样本中的相应酶活性并且因而该方法可被用于检测如下溶酶体贮积紊乱:法布里病(gla);高歇病(abg);克腊比病(galc);蓬珀病(gaa);尼
‑
皮二氏病(a或b)(asm);和粘多糖贮积病(idua)。
25.具体酶的活性通过其作用于关联底物以产生酶产物的能力或速度来评估。通过测定样本中酶产物的量,可以测定目标酶的活性。对于其中期望定量评估酶产物的应用,已知量的内标物可以包括在样本中。
26.检测酶活性的方法包括:将包含目标酶的样本与底物和一种或多种油酸盐接触,
所述接触步骤在其中目标酶能够作用于底物以产生酶产物的条件下;和检测酶产物。本发明人惊人地发现与油酸(oleaic acid)不同,使用油酸的盐产生改善的酶活性、更低酶量的检测和更大的再现性。考虑到油酸具有9.85的pka(kanicky jr和shah do,j colloid interface sci.2002年12月1日;256(1):201
‑
7),这是特别惊人的。因此,方法任选地排除在准备或进行测定的任何点处加入油酸。
27.方法包括将一种或多种油酸盐或一种或多种油酸烷基酯与目标酶组合。油酸盐任选地包括一价或多价盐。在一些实施方式中,油酸盐包括二价盐。油酸盐的说明性实例包括但不限于油酸钠、油酸钾、油酸锂、油酸镁、油酸钙、油酸锌或所述油酸盐的两种或多种的任意组合。任选地,包括1、2、3、4、5、6或更多种油酸盐。任选地,方法包括将一种或多种油酸烷基酯与目标酶组合。油酸烷基酯任选地是c1‑
c4油酸酯,其中c3或c4任选地是线性的或支化的。描述的剩余部分涉及术语油酸盐的使用,但是应当理解在每种情况下油酸烷基酯可以替代油酸盐或者加入到油酸盐。
28.油酸盐任选地在接触酶之前与底物、内标物或二者组合。在一些实施方式中,油酸盐与底物、内标物或二者接触以形成底物组分,并且该底物组分然后经历干燥步骤。干燥通过本领域中公认的任何一种或多种干燥方法实现。干燥任选地通过真空中蒸发、通过在氮气或其它惰性气体中蒸发、或通过冻干实现。干燥样本的方法在本领域中是熟知的。
29.油酸盐和底物——任选地底物组分的形式——任选地与目标酶组合。目标酶的说明性实例包括但不限于α
‑
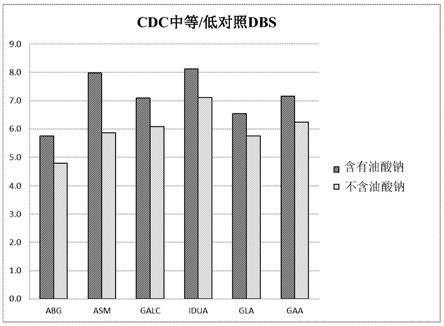
半乳糖苷酶a、酸性β
‑
葡糖脑苷脂酶、半乳糖脑苷脂酶、酸性α
‑
葡糖苷酶、酸性鞘磷脂酶、α
‑
l
‑
艾杜糖苷酸酶、或目标酶的两种或多种的组合。任选地,1、2、3、4、5、6或更多种目标酶被同时地或顺序地测定。在一些实施方式中,使用多重测定,其中两种或多种酶被同时测定。任选地,2、3、4、5、6或更多种酶被同时测定。任选地,1、2、3、4、5、6或更多种酶被单独地或顺序地测定。
30.个体的血管中的某些溶酶体酶的活性可以被用于测试个体是否患有溶酶体贮积紊乱。因此,对一种或多种目标酶特异的底物在方法中任选地被用作底物。这样的底物任选地适合用于检测医学病症,具体而言,溶酶体贮积紊乱,比如高歇病、克腊比病、尼
‑
皮二氏病、蓬珀病、法布里病或粘多糖贮积病。
31.虽然提供的方法不被如此限制,但是适合于包括在方法中的示例性底物和内标物在美国专利申请号:14/215,885;美国专利号:8,476,414;美国专利号:8,173,784;美国公布号:us 2012/0190043;wipo公布号:wo 2007/106816;gelb等,j inherit.metab.dis.,(2006)29:397
‑
404;li等,clinical chemistry,50;10:1785
–
1796(2004)等中描述。
32.方法任选地包括使用内标物,其在接触一种或多种酶之前任选地与底物和油酸盐组合。内标物起实验对照或标准的作用,其可用于评估样本或样本容器(receptacle)中酶产物的量。对于在质谱法中的使用,与具体底物对应的内标物任选地在结构上与其酶产物(例如,脂肪酸部分)相同——除了内标物在质荷(m/z)比方面不同。因此,内标物任选地包括修饰形式的酶产物,例如,酶产物的稳定同位素标记的类似物,其中一个或多个原子被对应的原子同位素替代,以产生与对应的酶产物区别地可检测的质量差。当内标物和酶产物通过质谱法分析时,所得波谱揭示了内标物和酶产物的空间分离——每种由其自己的峰表示。已知量的内标物由在其已知m/z比下的峰值反映。酶产物的量可以通过比较在其已知m/z下的峰值相对于内标物的峰值来评估。产生内标物的同位素标记的实例是用2h(即氘,d)
harbor press(1999);tietz textbook of clinical chemistry,第三版,burtis和ashwood编辑,w.b.saunders,philadelphia,(1999))。样本也可以被处理以消除或最小化干扰物质的存在。
37.当筛选来自新生儿和儿童患者的血液时,通常使用以干血斑形式的样本。为了制备这些样本,收集血液并保留在滤纸上。为了分析,干血任选地从滤纸的一部分洗脱进入水溶液,所述水溶液通常包含缓冲液比如磷酸盐缓冲盐水、hepes、tris、琥珀酸盐、或其它缓冲液,和任选地一种或多种蛋白酶抑制剂。蛋白酶抑制剂条件的特定实例包括例如如下的一种或多种:50到400μg/ml的终浓度的盐酸aebsf、0.2到25mg/ml的终浓度的edta二钠脱水物(dehydrate)、0.5到1μg/ml的终浓度的半硫酸抑酶醛肽和0.5到1μg/ml的终浓度的抑胃酶肽a。可以使用本领域中已知的通常使用的蛋白酶抑制剂混合物。使用通用测定溶液来提取单一干燥血液样本,或其它类型的样本,用于随后分配至多测定反应(multiple assay reaction)可以被用于自动和高通量筛选。干燥样本的单一提取避免了自相同样本获得几个样本穿孔物(punch)的需要,或者收集其它样本来源的等分试样的需要,并且因此降低了由滤纸上血液的不均匀分布引起的变化和样本转移中的误差。当使用干燥样本时,提取效率可以随着正在分析的不同酶而改变。在这些和其它类型的样本中,当包含在不同的测定溶液中时,目标酶可以具有不同的活性水平。任选地选择通用测定溶液的组成,使得待测试的每种酶是有活性的。
38.在一些实施方式中,干血斑或源自其的穿孔物被直接放置入包含一种或多种底物和油酸盐,和任选地内标物的测定缓冲液中,并被允许培育足以允许存在于样本中的酶将底物(一种或多种)转化为产物(一种或多种)的时间,然后通过一种或多种检测方法检测。
39.提供的底物和产物可以被用于多种测定形式中。当期望在酶测定期间观察底物时,底物可以在测定中被检测,同时当期望在酶测定期间观察其形成时,产物可以在测定中被检测。当期望从两种角度(perspective)观察酶反应以例如确认产生的产物的量与消耗的底物的量相关时,底物和产物二者可以被检测。
40.例如,底物或产物的量任选地使用建立的串联质谱法程序检测。采用质谱法的示例性酶测定任选地如下进行。将样本在水性测定缓冲液中与底物和油酸盐一起培育持续使得酶产物形成的时间段。在培育期期间,底物被存在于血液样本中的目标酶裂解以形成各自的产物。反应然后通过加入使蛋白组分沉淀的试剂而被猝灭。示例性的试剂包括醇、乙腈和稀三氟乙酸。一部分培育混合物然后被转移至新的测定器皿。任选地,稀释试剂比如甲醇、乙腈、水
‑
甲醇混合物或水
‑
乙腈可以被加入以稀释转移的部分。如此稀释的样本降低了内源性竞争材料的量从而相对增加了串联质谱法分析的灵敏度。由本领域技术人员选择其它类型的试剂以与通过许多种类的质谱法或其它检测系统的分析相容。
41.在一些实施方式中,利用自动进样器和液体处理器的帮助手动地或自动地将稀释的样本直接注入串联质谱仪。如果需要,可以在分析之前衍生化样本。选择试剂以对ms/ms系统是非敌对的。例如,适合的溶剂不存在洗涤剂和腐蚀剂,比如氯仿。纯的乙醇和纯的甲醇通常被使用,仅仅因为它们在机械干燥过程时容易蒸发。
42.串联质谱仪可以被设定以同时检测加入的底物、对应的所得酶产物和对应的内标物。这样的检测通过母离子扫描、先驱离子扫描或多反应监测扫描的方式完成。
43.在一些方面,在酶测定期间消耗的底物或形成的产物的量基于来自底物和/或产
物的荧光信号检测。用于溶酶体贮积紊乱的这类基于荧光的测定已经在文献中报道(参见,例如,n.a.chamoles等,clinical chemistry,2001;47(12):2098
‑
2102,和n.a.chamoles等,clinical chemistry,2001;47(4):780
‑
781)。这种途径的一般概要是将荧光标记的底物(例如,用4
‑
甲基伞形酮(4
‑
methyllumbelliferone)标记的底物)引入包含酶的测试样本并且培育足够的时间——通常在室温下或37℃下。加入停止液(stop solution)以停止测定并调节ph至10。然后使用荧光计读取样本。通过使用4
‑
mu标准曲线,将伴随测试样本记载的荧光强度转化为形成的产物的量。
44.在酶测定期间消耗的底物或形成的产物的量也可以使用抗体和其它目标特异性的结合分子检测。对于免疫测定,抗体可以被用于检测底物、产物或二者。在这样的方法中有用的抗体可以是特异性的,使得它们识别个别底物,或者非特异性的,使得它们识别许多或所有底物。底物或产物任选地包括标记比如生物素或抗生物素蛋白以允许特异性检测。
45.抗体说明性地在动物中产生,所述动物包括小鼠、大鼠、兔、马、驴、或其它适合用于产生抗体的动物。在一些应用中,用可检测的标记物比如荧光标记物来标记抗体是有用的。当使用未标记的抗体时,可以通过使用二次抗体进行检测,对于一次抗体的物种的igg特异的该二次抗体说明性地标记有荧光标志比如若丹明。在本领域中应当领会,其它抗体检测系统是类似可操作的,比如辣根过氧化物酶标记的抗体或碱性磷酸酶标记的抗体。
46.当通过提供多种酶特异性底物测试单一样本中的多种酶时,可以使用识别和区分底物或其产物的抗体。结合至酶特异性底物或其产物的抗体的复合物可以使用许多方法彼此区分。在一种方案中,包含目标酶的样本与连接至粒子的底物在测定溶液中接触。在该实例中,每种粒子连接至具体的底物,并且存在代表每种底物的多种粒子。识别特异性产物的抗体然后与测定溶液接触。抗体将结合至产物——如果在酶测定期间产生的话,以产生具有结合的抗体的粒子。为了区分在粒子上包含的不同的产物,具有不同产物特异性的抗体可以具有不同的可检测的部分,比如不同的荧光标记物。作为检测酶产物的可选方案,识别底物的抗体可以被用于检测在与酶一起培育之后在珠上剩余的底物。在这种情况下,如果酶反应发生,则任一产物将保持附连至珠。在任一情况下,选择的底物特异性抗体将不显著地与附连至珠的产物交叉反应。
47.在另一种方案中,包含目标酶的样本与连接至编码的粒子的底物在测定溶液中接触。编码的粒子具有特征,比如条形码或光学轮廓,其使得它们彼此有区别。例如,编码的粒子可以具有与不同目标酶底物对应的不同条形码。在测定中,目标酶作用于底物以产生产物。一种产物将保持结合至粒子,而其他产物(裂解部分)将被释放进入溶液,或反之亦然。识别特异性产物的抗体然后与测定溶液接触。因为粒子的编码指示哪种底物附连至粒子,所以抗体不需要对具体产物是特异性的,并且因而一种类型的抗体可以被用于检测源自多种不同底物的产物。这样的非特异性抗体将结合至产物——如果在酶测定期间产生的话,以产生具有结合的抗体的粒子。具有结合的抗体的粒子然后与不具有抗体的那些区分,例如,通过检测抗体上的标记物或粒子的物理性状。在抗体
‑
结合粒子上包含的不同产物可以基于每种粒子的编码来确定。
48.作为免疫测定形式的另一个实例,生成针对具体底物的抗体。在猝灭酶反应之后,将反应溶液转移至高结合微量滴定板,由此产物的一部分将结合至表面。酶和测定溶液组分通过洗涤去除。特异性一次抗体然后在每个测定孔中培育,接着是随后洗涤以去除未结
合的抗体。二次抗体被任选地用于检测和定量。每单位时间的起始反应形成的产物越多,测量的酶的活性越大。
49.抗体说明性地是未标记的并且在动物中产生,所述动物包括小鼠、大鼠、兔、马、驴、或其它适合的用于产生抗体的动物。对一次抗体的物种的igg特异的二次抗体说明性地标记有荧光标志比如若丹明,并随后被用于检测剩余底物。在本领域中应当理解,其它抗体检测系统是类似可操作的,比如辣根过氧化物酶标记的抗体或碱性磷酸酶标记的抗体。
50.在一些实施方式中,用于目标酶的测定通过首先获得说明性地包含下列的样本进行:血清、血浆、全血、尿、唾液、其它生物学体液或组织溶胞产物、溶液中的重组或天然纯化的酶、或生物学体液或液体培养基中的化学或功能修饰的酶。然后将滤纸样本的一部分剪切并沉积在加入测定溶液的未结合测定管或微量滴定板孔中。测定溶液包括一种或多种水性缓冲液、底物、标准品、油酸盐和任选地一种或多种蛋白酶抑制剂。然后,在30℃到41℃的范围内的具体温度下培育样本混合物持续30分钟到20小时的范围内的确定的时间段。一旦培育完成,酶反应通过加入停止液终止。停止液说明性地是以6x反应体积加入的0.4m甘氨酸/naoh ph 10.4。leonard r等,j.biol.chem.,2006;281:4867
‑
75;boot,rg等,j.biol.chem.,2006;282:1305
–
12。产物形成的量通过将已知体积的样本转移至高结合测定管或微量滴定板确定并培育5分钟至2小时。未结合的材料通过洗涤去除。完整底物或产物的检测说明性地使用偶联的过氧化物酶酶途径进行。
51.在使用包含糖的底物的进一步方案中,释放的葡萄糖或半乳糖产物的水平通过偶联的酶途径实时测量。非限制性的实例包括在高歇病的诊断中从对β
‑
葡糖脑苷脂酶(glucocereborsidase)特异的底物释放葡萄糖。在该测定方法中,葡萄糖与葡萄糖氧化酶反应,产生葡萄糖酸内酯并释放过氧化氢。释放的过氧化氢通过与过氧化物酶反应以产生在标准荧光计上测量的荧光分子进行检测。适合的过氧化物酶的实例是辣根过氧化物酶或本领域中已知的任何其它过氧化物酶。由葡萄糖氧化酶释放的过氧化氢与检测底物分子相互作用。过氧化物酶催化该底物转化为荧光产物。适合于与底物一起使用的检测分子包括被氧化以产生荧光产物试卤灵的amplex red。amplex red和用于检测游离葡萄糖的试剂盒可得自invitrogen corp。红色荧光产物的增加在荧光计上检测,该荧光计设置有571处的激发波长和585处的发射波长,通带设置为5nm。糖苷酶活性的量越大,产生红色荧光产物越快速。
52.在一些实施方式中,利用独特结构(一种或多种)生成不同溶酶体酶的多种底物。这防止一种酶的产物抑制,特别重要的是一种酶针对一种底物的催化活性应当比其它酶对其对应底物的催化活性更大。另外地,在其中单突变糖苷酶在6种或多种溶酶体酶的一系列底物中筛选的情况中,这是重要的。通过其它溶酶体酶形成的产物可以抑制较低活性酶的功能,使得其活性不被准确地测量。因此,底物和产物对每种酶的特异性被认为是任选地有区别的。
53.描述的用于使用底物和标准化合物测定酶的途径可以被扩展至在单一反应中同时测定多种酶,排除需要多个测定来帮助确认医学紊乱的诊断。当评价通过特定生物化学途径或用于监测生物化学信号传导途径的化学通量的速度时,该方法也可以被用于同时测量几种酶。由于使用本文描述的化合物可采用的高灵敏度的质谱法检测,其可以要求每次测定仅亚微克量的底物试剂,因此低克规模的几百种底物试剂的合成变得实际和经济。
54.在各个实施方式中,2、3、4、5、6或更多种溶酶体酶的活性通过使用提供的底物同时测量。
55.作为与提供的底物一起使用的另一个示例性形式,底物可以用相同的荧光团标记,但是具有彼此区分的显著的质量或电荷性质。在酶裂解反应之后产生的产物的量通过反相高效液相色谱法(hplc)检测。反应通过加入醇、乙腈或者稀三氟乙酸猝灭。培育混合物的一部分被转移至加入净溶液(neat solution)的新测定器皿,该净溶液比如甲醇、乙腈、水
‑
甲醇混合物或水
‑
乙腈。反应产物和未反应的底物在5μm粒子大小c
18 hplc柱上分离并且通过荧光检测器或检测器组来检测。产物的量基于使用增加量的相关产物生成的标准曲线计算。
56.在本领域中应当理解,多种酶的多种底物任选地通过色谱法同时检测。如果使用具有充分不同的质量或保留性质的底物,则每种产物例如在hplc柱上是可解析的并且可以在单一测定中定量。可选地,每种底物标记有具有不同的或相同的激发或发射性质的不同荧光团。检测可以通过一系列荧光检测器进行,这些荧光检测器可以同时定量来自彼此的个别产物和它们的对应的标记底物。其它检测方法是类似适合的并且在本领域中是已知的。
57.包括底物、酶产物和内标物的所有试剂可以任选地通过反相hplc纯化并通过esi
‑
ms表征——或者以在线hplc
‑
ms测定或者线下通过收集适合的级分。
58.方法包括在包含水性缓冲液的溶液中的接触步骤。水性缓冲液任选地具有在4和5之间的ph。ph任选地为4.5到5。ph任选地为4.5到4.7。ph任选地为4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0。可操作以作为期望ph范围内的缓冲液的任何适合的缓冲剂适合于用作水性缓冲液。缓冲液的说明性实例包括琥珀酸、醋酸盐、柠檬酸盐、pipes,或者任选地使用其他缓冲液。
59.在一些实施方式中,底物组分在将底物与目标酶接触的步骤之前形成。底物组分任选地包括底物、油酸盐、任选地内标物和水性缓冲液。干燥的底物、油酸盐和任选地内标物的组合任选地重悬浮在水性缓冲液中,并且在与样本或目标酶接触之前储存持续储存时间。储存时间任选地为从1分钟到8周。当在室温下避光储存时,所得的底物组分已经显示为稳定持续8周或更长。
60.在其中目标酶能够作用于底物以产生酶产物的条件下,底物组分任选地与可以包含或可以不包含一种或多种目标酶的样本接触。接触步骤任选地持续反应时间。反应时间任选地为1分钟到48小时或更长。任选地,反应时间为10到20小时。应当理解,当检测低数量的酶时,可以使用较长的反应时间。在反应时间之后,样本任选地被猝灭以停止反应。停止液任选地为50:50乙酸乙酯/甲醇或其它适合的猝灭溶液。
61.多个方面通过下面的非限制性实施例说明。实施例是出于说明性目的并且不是对本发明方法的任何实践的限制。将理解,在不背离本发明的精神和范围的情况下可以进行变化和修改。本文列举的试剂是商业可得的或者通过熟知的方法从容易商业得到的前体容易合成的,并且本领域普通技术人员容易理解这样的试剂可以从哪里获得。
62.实施例
63.实施例1:检测样本中的酶活性
64.将人工底物(s)和氘化内标物(is)(图1)以及油酸钠(carbosynth,97%,143
‑
19
‑
1)溶解在lc
‑
ms级甲醇中。将该预混合的母液的等分试样转移至40ml玻璃小瓶并且在savant speedvac concentrator(thermo fisher)上干透以产生包含在表1中指示的量的稳定材料的小瓶。
65.表1:用于产生足以分析960个样本的测定混合物的底物、内标物和油酸钠的量
66.每960个样本小瓶的量
[0067][0068]
在单独的60ml瓶中,制备40ml的85mm琥珀酸缓冲液,ph 4.7,其包含表2中列举的添加剂以产生工作琥珀酸缓冲液。测定混合物的制备通过将33ml的85mm工作琥珀酸缓冲液加入到包含干燥组分的玻璃小瓶中完成。将小瓶在水浴(vwr
‑
model 75d)中超声处理10分钟,然后轻轻振动20分钟直到所有的材料都充分溶解。将测定混合物的小瓶包裹在铝箔中并且远离光在室温下储存持续上至八周。
[0069]
表2:在85mm琥珀酸缓冲液,ph 4.7中使用的添加剂的浓度和供应商
[0070][0071][0072]
血液通过静脉穿刺术从同意的成人获得,并且印迹在滤纸上以形成干血斑。用于cdc对照的干血斑基本上如在jesus等,clinical chemistry,55:1(2009)158
‑
164中描述的
制造。简言之,将通过静脉穿刺术从同意的成人获得的不同比率的白血球降低的血液与不同水平下的未处理的脐带血组合以调节目标酶的量。这样的样本也可以获得自未被改变的成人血液或新生儿血液,任选地如获得自足跟采血(heel stick)的。将用于培育样本干血斑(dbs)的3mm直径的盘的板根据期望的板图(plate map)使用dbs穿孔机(perkinelmer 1296
‑
071)装载期望的dbs试样样本进入0.5ml 96
‑
孔聚丙烯nunc板(thermo,267245)。向每个孔加入30μl的测定混合物并且用粘合性铝箔(starseal,e2796
‑
9792)密封板。使用trinest震荡培养箱(perkinelmer,1296
‑
0050)在400rpm震荡的情况下在37℃下培育该板18小时。18小时之后,通过加入50:50乙酸乙酯/甲醇(lc
‑
ms级或等价的)混合物的100μl等分试样至每个孔然后用移液管混合10次对板进行猝灭。将培育溶液从0.5ml聚丙烯板转移至1ml深孔板(thermo nunc,260252),确保将所有的溶剂混合物转移至深孔板同时留下dbs。
[0073]
通过首先将400μl的乙酸乙酯(lc
‑
ms级或等价的)加入至培育溶液,然后加入200μl的水(1型或更好的)完成样本清洁。这两个层通过吸入20次进行混合直到观察到乳浊液。1ml深孔板用粘合性铝箔覆盖并在690x g下离心(rotanta 460r)5分钟。将在水层上分离的有机层的75μl等分试样转移至0.5ml nunc板(thermo,267245),并使用压缩空气干燥5
‑
10分钟。通过加入150μl的流动溶剂重建样本,该流动溶剂由含有0.1%甲酸的84%乙腈(jt baker,53673)和含有0.1%甲酸的16%水(jt baker,52116)组成。板用非粘合性铝箔密封,并且然后在400rpm下在室温下震荡10分钟。通过fia
‑
ms/ms(waters acquity tqd)使用表3中概述的变换(transition)以及表4中指出的整体调整参数(global tune parameter)和入口设置(inlet setting)分析样本。
[0074]
表3:该测定中检测到的内标物is和产物p的ms变换
disease control,laboratory quality assurance and standardization programs)的对照dbs的测定混合物获得的酶活性
[0081][0082]
使用来自疾病控制中心(cdc)的对照dbs,其中高对照使用来自假定的健康新生儿的混合脐带血样本制造,中等对照通过用红细胞浓缩物稀释脐带血制造,使得目标酶活性为高对照的目标酶活性的50%,并且低对照被进一步稀释以获得高对照的目标酶活性的5%的目标酶活性。对于神经酰胺,油酸钠的加入使低对照dbs与中等对照dbs之间的间隙变宽大约25%。这更好地在6
‑
重(6
‑
plex)测定中区分来自健康新生儿的lsd
(低活性)样本。
[0083]
在本说明书中提及的任何专利或出版物指示本发明所属领域的技术人员的水平。这些专利和出版物在此通过引用并入,其程度与如每个单独的出版物被具体地和单独地指示为通过引用完全并入相同。
[0084]
本领域技术人员将容易领会本发明的方法很好地适合于实施目标并获得提及的结果和优势,以及其中固有的那些。本发明的实施例连同本文描述的方法、程序、处理、分子和特定化合物是目前具体实施方式的代表,是示例性的,并且不意欲作为对方法的范围进行限制。将显而易见的是其他实施方式存在并且包括在由权利要求书的范围限定的公开内容的精神内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。