1.本发明涉及纳米材料和生物分析的技术领域,尤其涉及一种过渡金属氧化物纳米探针,这种探针的制备方法,以及该过渡金属氧化物纳米探针在细胞特定蛋白成像分析中的应用。
背景技术:
2.纳米探针是一类基于自身理化性质,可用于某一医学影像仪器辅助提升成像质量的纳米材料。目前用于单细胞水平蛋白质分子成像的纳米探针中的大多数纳米探针是基于使用抗体
‑
抗原免疫效应原理,通过信号选择最多可实现对5
‑
8种标志物的成像,但仅适合对高丰度表达蛋白的半定量分析。而基于无机金属元素标记的二抗标签能够实现几十种蛋白分子的表达分析,这种基于无机质谱的定量分析方法定量的灵敏度很高,但其破坏性的定量过程,导致蛋白的空间分布信息的缺失。同时,虽然采取二抗来识别一抗可以实现信号放大和成像,但是二抗对金属标签的载带量有限,且价格相对昂贵,并具有一抗物种选择性。因此,设计一种较低成本的、可实现单细胞水平特定蛋白质靶向的广谱成像的纳米探针是目前领域内研究人员广为开展的热点研究之一。
技术实现要素:
3.为克服现有技术的缺陷,本发明要解决的技术问题是提供了一种过渡金属氧化物纳米探针及其制备方法,其成本较低,可对特定蛋白进行荧光成像,并可用于多种蛋白同时成像。
4.本发明的技术方案是:这种过渡金属氧化物纳米探针,其包括:过渡金属氧化物纳米颗粒以及复合在过渡金属氧化物纳米颗粒表面的修饰分子,所述过渡金属氧化物包括铁、钴、镍三种元素的氧化物或氢氧化物,所述表面修饰分子包括生物蛋白分子、生物素分子、荧光素分子。
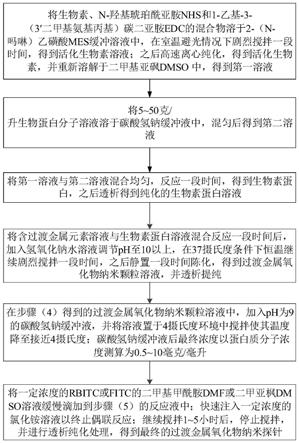
5.过渡金属氧化物纳米探针的制备方法,其包括以下步骤:
6.(1)将生物素、n
‑
羟基琥珀酰亚胺nhs和1
‑
乙基
‑3‑
(3
′
二甲基氨基丙基)碳二亚胺edc的混合物溶于2
‑
(n
‑
吗啉)乙磺酸mes缓冲溶液中,在室温避光情况下剧烈搅拌一段时间,得到活化生物素溶液;之后高速离心纯化,得到活化生物素,并重新溶解于二甲基亚砜dmso中,得到第一溶液;
7.(2)将5~50克/升生物蛋白分子溶液溶于碳酸氢钠缓冲液中,混匀后得到第二溶液;
8.(3)将第一溶液与第二溶液混合均匀,反应一段时间,得到生物素蛋白,之后透析得到纯化的生物素蛋白溶液;
9.(4)将含过渡金属元素溶液与生物素蛋白溶液混合反应一段时间后,加入氢氧化钠水溶液调节ph至10以上,在37摄氏度条件下恒温继续剧烈搅拌一段时间,之后静置一段时间陈化,得到过渡金属氧化物纳米颗粒溶液,并透析提纯;
10.(5)在步骤(4)得到的过渡金属氧化物纳米颗粒溶液中,加入ph为9的碳酸氢钠缓冲液,并将溶液置于4摄氏度环境中搅拌使其温度降至接近4摄氏度;碳酸氢钠缓冲液后最终浓度以蛋白质分子浓度测算为0.5~10毫克/毫升;
11.(6)将一定浓度的rbitc或fitc的二甲基甲酰胺dmf或二甲亚枫dmso溶液缓慢滴加到步骤(5)的反应液中;快速注入一定浓度的氯化铵溶液以终止偶联反应;继续搅拌1~5小时后,停止搅拌,并进行透析纯化处理,得到最终的过渡金属氧化物纳米探针。
12.与抗体作为修饰分子的纳米探针相比,本发明基于生物素与链霉亲和素之间的特异性结合的特点,使用更加廉价的生物素修饰与纳米颗粒表面,从而大大降低了探针的制备成本,同时,也摆脱了抗体仅特异性结合特定蛋白的束缚,可同时实现多种蛋白的共同成像,并可结合探针中过渡金属元素的含量,对特定蛋白在细胞中的表达量进行定量分析。
13.还提供了所述过渡金属氧化物纳米探针应用于荧光成像实验,方法为:对细胞特定蛋白进行成像分析时,先将所选用的细胞系消化后种于盖玻片上并固定后分别使用血清白蛋白和生物素封闭试剂盒对细胞进行封闭处理;接着与商业化的特定蛋白的生物素化抗体进行一抗共孵育12小时;孵育结束后,使用pbs冲洗三次,将处理的细胞与chromeo
tm 546链霉亲和素sc
‑
364714于37摄氏度环境中继续孵育1小时;随后使用pbs冲洗三次,将细胞继续与步骤(6)得到的纳米探针溶液于37摄氏度环境中继续孵育一段时间,使用pbs冲洗三次后,进行荧光成像实验。
附图说明
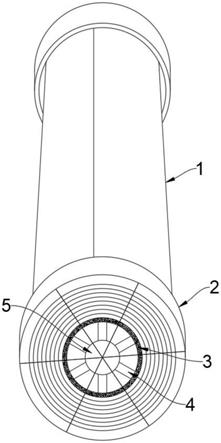
14.图1为本发明所制备的一系列功能性荧光纳米探针的合成与功能化示意图;
15.图2为本发明实施例1、2、3、4制备的一系列过渡金属氧化物纳米探针的动态光散射表征曲线图;
16.图3为本发明实施例5所述的使用本发明实施例1制备的氧化铁纳米探针用于her
‑
2蛋白荧光成像图;
17.图4为本发明实施例6所述的使用本发明实施例2制备的氢氧化钴纳米探针以及本发明实施例4制备的四氧化三铁纳米探针用于her
‑
2蛋白和ki67蛋白同时荧光成像图。
18.图5为根据本发明的过渡金属氧化物纳米探针的制备方法的流程图。
具体实施方式
19.这种过渡金属氧化物纳米探针,其包括:过渡金属氧化物纳米颗粒以及复合在过渡金属氧化物纳米颗粒表面的修饰分子,所述过渡金属氧化物包括铁、钴、镍三种元素的氧化物或氢氧化物,所述表面修饰分子包括生物蛋白分子、生物素分子、荧光素分子。
20.优选地,所述过渡金属氧化物纳米探针的水合粒径为10~50纳米。
21.优选地,所述过渡金属氧化物中的过渡金属元素与所述生物蛋白分子的摩尔比为1:a,a为0.005~0.1。
22.优选地,所述生物蛋白分子和生物素分子的摩尔比例是1:b,b为5~100;生物蛋白分子与荧光素分子摩尔比例为1:d,d为1~10
23.优选地,所述过渡金属氧化物纳米探针用于细胞内特定蛋白质原位成像时,将细胞进行生物素修饰的所述特定蛋白质的抗体标记处理,并进行链霉亲和素孵育处理。
24.优选地,所述生物蛋白分子是牛血清白蛋白、人血清白蛋白、铁红蛋白、纤连蛋白、蛋清蛋白中的一种或多种。
25.优选地,所述荧光素分子是罗丹明b异硫氰酸酯rbitc或异硫氰酸荧光素fitc。
26.如图5所示,还提供了这种过渡金属氧化物纳米探针的制备方法,其包括以下步骤:
27.(1)将生物素、n
‑
羟基琥珀酰亚胺nhs和1
‑
乙基
‑3‑
(3
′
二甲基氨基丙基)碳二亚胺edc的混合物溶于2
‑
(n
‑
吗啉)乙磺酸mes缓冲溶液中,在室温避光情况下剧烈搅拌一段时间,得到活化生物素溶液;之后高速离心纯化,得到活化生物素,并重新溶解于二甲基亚砜dmso中,得到第一溶液;
28.(2)将5~50克/升生物蛋白分子溶液溶于碳酸氢钠缓冲液中,混匀后得到第二溶液;
29.(3)将第一溶液与第二溶液混合均匀,反应一段时间,得到生物素蛋白,之后透析得到纯化的生物素蛋白溶液;
30.(4)将含过渡金属元素溶液与生物素蛋白溶液混合反应一段时间后,加入氢氧化钠水溶液调节ph至10以上,在37摄氏度条件下恒温继续剧烈搅拌一段时间,之后静置一段时间陈化,得到过渡金属氧化物纳米颗粒溶液,并透析提纯;
31.(5)在步骤(4)得到的过渡金属氧化物纳米颗粒溶液中,加入ph为9的碳酸氢钠缓冲液,并将溶液置于4摄氏度环境中搅拌使其温度降至接近4摄氏度;碳酸氢钠缓冲液后最终浓度以蛋白质分子浓度测算为0.5~10毫克/毫升;优选的浓度为1~5毫克/毫升,更优选的浓度为2~4毫克/毫升;
32.(6)将一定浓度的rbitc或fitc的二甲基甲酰胺dmf或二甲亚枫dmso溶液缓慢滴加到步骤(5)的反应液中;快速注入一定浓度的氯化铵溶液以终止偶联反应;继续搅拌1~5小时后,停止搅拌,并进行透析纯化处理,得到最终的过渡金属氧化物纳米探针。
33.与抗体作为修饰分子的纳米探针相比,本发明基于生物素与链霉亲和素之间的特异性结合的特点,使用更加廉价的生物素修饰与纳米颗粒表面,从而大大降低了探针的制备成本,同时,也摆脱了抗体仅特异性结合特定蛋白的束缚,可同时实现多种蛋白的共同成像,并可结合探针中过渡金属元素的含量,对特定蛋白在细胞中的表达量进行定量分析。
34.优选地,所述步骤(1)中,生物素∶edc∶nhs三者的投料摩尔比为1∶e∶1,e为1~1.2,生物素、edc、nhs三者混合反应的时间是0.5小时~12小时,所述离心纯化条件是8000~14000转每分种的速度离心5~30分钟;
35.所述步骤(3)中,生物蛋白分子和活化生物素分子的比例是1:b,b为5~100,反应条件为避光、剧烈搅拌,反应时间是2~24小时,透析条件为选取截留分子量3000~15000的透析袋,透析时间1~3天;
36.所述步骤(4)中,过渡金属元素溶液为铁、钴、镍三种金属元素的氯化物,硫酸盐,硝酸盐等无机盐或乙酸盐溶解于水中得到的含一定浓度过渡金属离子的溶液,过渡金属离子的浓度为0.05~1摩尔/升,生物素蛋白分子与过渡金属元素的比例是1:c,c为10~200,加入氢氧化钠水溶液后的搅拌反应时间为1~10小时,静置陈化时间为8
‑
24小时,纯化过渡金属氧化物溶液的透析条件为选取截留分子量3000~15000的透析袋,透析时间1~3天;
37.所述步骤(6)中,rbitc或fitc的dmf或dmso溶液浓度为2~20克/升,rbitc或fitc
与步骤(5)得到的过渡金属氧化物反应液中蛋白质分子的摩尔比为1:f,f为0.1~1,反应均于4摄氏度低温环境中完成,氯化铵溶液浓度为1~10摩尔/升,纯化时透析条件为选取截留分子量为3000~15000的透析袋,透析时间1~3天。
38.还提供了所述过渡金属氧化物纳米探针应用于荧光成像实验,方法为:对细胞特定蛋白进行成像分析时,先将所选用的细胞系消化后种于盖玻片上并固定后分别使用血清白蛋白和生物素封闭试剂盒对细胞进行封闭处理;接着与商业化的特定蛋白的生物素化抗体进行一抗共孵育12小时;孵育结束后,使用pbs冲洗三次,将处理的细胞与chromeo
tm 546链霉亲和素sc
‑
364714(santa cruz biotechnology,sc
‑
364714)于37摄氏度环境中继续孵育1小时;随后使用pbs冲洗三次,将细胞继续与步骤(6)得到的纳米探针溶液于37摄氏度环境中继续孵育一段时间,使用pbs冲洗三次后,进行荧光成像实验。
39.优选的细胞与生物素化抗体共孵育时浓度,依据细胞系及蛋白质种类的不同而不同,一般可选用细胞个数与抗体分子数比例为1:g,g为10~200。
40.优选的使用的链霉亲和素与生物素化抗体摩尔比为1:h,h为0.3~0.8。
41.优选的纳米探针溶液于37摄氏度环境中与处理的细胞继续孵育时间为15分钟~4小时,更优选的孵育时间是0.5~1小时。
42.优选的于37摄氏度环境中与处理的细胞继续孵育的纳米探针溶液浓度以蛋白质分子计算为2~50毫克每升,更优选的溶液浓度为5~20毫克每升。
43.实验结果表明,所构建的系列纳米探针,可特异性结合相关蛋白,并实现细胞原位成像,同时也可以用于两种及以上蛋白的同时原位成像。
44.下面结合附图对本发明的实施方式做详细说明。
45.实施例1
46.制备氧化铁探针
47.a)将生物素、nhs和edc按摩尔比例1:1:1混合于mes缓冲溶液中,在室温避光情况下剧烈搅拌30分钟,得到活化生物素溶液。随后于高速离心机中9000转每分种的速度离心5分钟,弃去上清液后,沉淀复溶于dmso中,得到反应液1。
48.b)将牛血清白蛋白(以下写为bsa)以最终为10克每升的浓度加入到0.1摩尔每升且ph为9的碳酸氢钠缓冲液中,记为反应液2;
49.c)将上述步骤a得到的溶液1与步骤b得到的溶液2混合均匀,其中bsa分子和活化生物素分子的比例是1:10,避光反应3小时,随后使用截留分子量为10000的透析袋透析3天后冻干,得到纯化的生物素蛋白。
50.d)称取无水氯化铁和六水合氯化亚铁,以fe
2
:fe
3
=2:1的摩尔比溶解于水中,使得最终得到的总铁元素的摩尔浓度为0.2摩尔每升。
51.e)将步骤d得到的氯化铁溶液0.6毫升与上述步骤c得到的生物素蛋白溶液(6毫升,20克每升)混合反应5分钟,加入0.3毫升的浓度为1摩尔每升的氢氧化钠溶液,随后37摄氏度条件下恒温继续剧烈搅拌12小时,随后使用截留分子量为10000的透析袋透析3天,得到氧化铁纳米颗粒探针。
52.f)于上述步骤e最终得到的氧化铁溶液中,加入0.1摩尔每升且ph为9的碳酸氢钠缓冲液,最终浓度以蛋白质分子浓度测算为3.6毫克每毫升,并将溶液置于4摄氏度环境中搅拌使其温度降至接近4摄氏度。
53.g)将10克每升的rbitc的dmf溶液缓慢滴加到上述步骤f的反应液中,使得最终rbitc与蛋白质分子的摩尔比为2:1。最后,快速注入4.6摩尔每升的氯化铵溶液以终止偶联反应。继续搅拌2小时后,停止搅拌,并使用截留分子量为10000的透析袋透析3天,冻干得到最终的氧化铁纳米探针。
54.实施例2
55.制备氢氧化钴探针
56.a)向10毫升浓度为20毫克每毫升的纤连蛋白溶液中加入2毫升浓度为50毫摩尔每毫升的硝酸钴溶液,搅拌5分钟使之混合均匀后,加入0.2毫升浓度为2摩尔每升的氢氧化钠溶液使最终ph升至10以上,剧烈搅拌2小时后,静置12小时陈化,后透析36小时并冻干,得到纤连蛋白矿化的氢氧化钴纳米颗粒。
57.b)将生物素、nhs和edc按摩尔比例1:1:1.2混合于mes缓冲溶液中,在室温避光情况下剧烈搅拌50分钟,得到活化生物素溶液。随后于高速离心机中7000转每分种的速度离心5分钟,弃去上清液后,沉淀复溶于dmso中。
58.c)将步骤a得到的纤连蛋白矿化的氢氧化钴纳米颗粒以纤连蛋白最终浓度为5克每升的浓度加入到0.1摩尔每升且ph为9的碳酸氢钠缓冲液中,并将步骤b得到的溶液混合,使得纤连蛋白与活化生物素分子的比例是1:20,避光反应3小时,随后使用截留分子量为13000的透析袋透析2天后冻干,得到纯化的生物素修饰的纤连蛋白氢氧化钴纳米探针。
59.d)于上述步骤e最终得到的生物素修饰的纤连蛋白氢氧化钴纳米探针配制的溶液中,加入0.1摩尔每升且ph为9的碳酸氢钠缓冲液,最终浓度以蛋白质分子浓度测算为2毫克每毫升,并将溶液置于4摄氏度环境中搅拌使其温度降至接近4摄氏度。
60.e)将10克每升的rbitc的dmf溶液缓慢滴加到上述步骤f的反应液中,使得最终rbitc与蛋白质分子的摩尔比为4:1。最后,快速注入4.6摩尔每升的氯化铵溶液以终止偶联反应。继续搅拌2小时后,停止搅拌,并使用截留分子量为10000的透析袋透析3天,冻干得到最终的氢氧化钴纳米探针。
61.实施例3
62.制备氧化镍探针
63.a)将生物素、nhs和edc按摩尔比例1:1:1.1混合于mes缓冲溶液中,在室温避光情况下剧烈搅拌30分钟,得到活化生物素溶液。随后于高速离心机中10000转每分种的速度离心10分钟,弃去上清液后,沉淀复溶于dmso中,得到反应液1。
64.b)将人血清白蛋白(以下写为hsa)以最终为15克每升的浓度加入到0.1摩尔每升且ph为9的碳酸氢钠缓冲液中,记为反应液2;
65.c)将上述步骤a得到的溶液1与步骤b得到的溶液2混合均匀,其中bsa分子和活化生物素分子的比例是1:10,避光反应3小时,随后使用截留分子量为8000的透析袋透析1天后冻干,得到纯化的生物素蛋白。
66.d)称取氯化镍溶解于水中,使得最终得到的镍元素的摩尔浓度为0.1摩尔每升。
67.e)将步骤d得到的氯化镍溶液1.2毫升与上述步骤c得到的生物素蛋白溶液(6毫升,20克每升)混合反应5分钟,加入0.5毫升的浓度为1摩尔每升的氢氧化钠溶液,随后37摄氏度条件下恒温继续剧烈搅拌12小时,随后使用截留分子量为15000的透析袋透析2天,得到氧化镍纳米颗粒探针。
68.f)于上述步骤e最终得到的氧化铁溶液中,加入0.1摩尔每升且ph为9的碳酸氢钠缓冲液,最终浓度以蛋白质分子浓度测算为5毫克每毫升,并将溶液置于4摄氏度环境中搅拌使其温度降至接近4摄氏度。
69.g)将10克每升的rbitc的dmf溶液缓慢滴加到上述步骤f的反应液中,使得最终rbitc与蛋白质分子的摩尔比为3:1。最后,快速注入4.6摩尔每升的氯化铵溶液以终止偶联反应。继续搅拌2小时后,停止搅拌,并使用截留分子量为10000的透析袋透析3天,冻干得到最终的氧化镍纳米探针。
70.实施例4
71.a)向10毫升浓度为50毫克每毫升的牛血清白蛋白溶液中加入5毫升总铁元素浓度为50毫摩尔每毫升的氯化铁与氯化亚铁比例为2:1的水溶液,搅拌5分钟使之混合均匀后,加入0.2毫升浓度为1摩尔每升的氢氧化钠溶液使最终ph升至10以上,剧烈搅拌12小时,后透析36小时并冻干,得到牛血清白蛋白矿化的四氧化三铁纳米颗粒。
72.b)将生物素、nhs和edc按摩尔比例1:1:1.2混合于mes缓冲溶液中,在室温避光情况下剧烈搅拌50分钟,得到活化生物素溶液。随后于高速离心机中7000转每分种的速度离心5分钟,弃去上清液后,沉淀复溶于dmso中。
73.c)将步骤a得到的蛋白矿化的四氧化三铁纳米颗粒以蛋白最终浓度为5克每升的浓度加入到0.1摩尔每升且ph为9的碳酸氢钠缓冲液中,并将步骤b得到的溶液混合,使得蛋白与活化生物素分子的比例是1:15,避光反应3小时,随后使用截留分子量为10000的透析袋透析3天后冻干,得到纯化的生物素修饰的牛血清白蛋白四氧化三铁纳米探针。
74.d)于上述步骤e最终得到的生物素修饰的牛血清白蛋白四氧化三铁纳米探针配制的溶液中,加入0.1摩尔每升且ph为9的碳酸氢钠缓冲液,最终浓度以蛋白质分子浓度测算为3毫克每毫升,并将溶液置于4摄氏度环境中搅拌使其温度降至接近4摄氏度。
75.e)将10克每升的fitc的dmf溶液缓慢滴加到上述步骤f的反应液中,使得最终fitc与蛋白质分子的摩尔比为4:1。最后,快速注入4.6摩尔每升的氯化铵溶液以终止偶联反应。继续搅拌2小时后,停止搅拌,并使用截留分子量为10000的透析袋透析3天,冻干得到最终的fitc修饰的氧化铁纳米探针。
76.参见图2,图2为本发明实施例1、2、3、4制备的一系列过渡金属氧化物纳米探针的动态光散射表征曲线图,其中a图为本发明实施例1制备的纳米探针的动态光散射表征曲线图、b图为本发明实施例2制备的纳米探针的动态光散射表征曲线图2、c图为本发明实施例3制备的纳米探针的动态光散射表征曲线图3、d图为本发明实施例4制备的纳米探针的动态光散射表征曲线图。由图2可知,本发明制备的过渡金属氧化物纳米探针的平均水合粒径为10
‑
50纳米。
77.实施例5
78.细胞特定蛋白成像
79.a)将乳腺腺癌sk
‑
br
‑
3细胞系胰酶消化后,种在盖玻片上,37摄氏度孵育12小时,除去培养基并用pbs洗涤细胞三遍后,用4%多聚甲醛溶液在室温下固定20分钟。
80.b)用pbs缓冲液配制的3%牛血清白蛋白(bsa)溶液将细胞封闭1小时,然后用内源性生物素封闭试剂盒将细胞内的生物素封闭,最后用pbs缓冲液把载玻片洗涤3次。
81.c)将载有细胞的载波片分别与生物素修饰的人表皮生长因子受体
‑
2(以下写为
her2)蛋白her2
‑
bio抗体(thermo fisher,ma5
‑
12995)按细胞个数与抗体摩尔数比例为1:100在4摄氏度冰箱内共孵育12小时,后用pbs缓冲液清洗三次。
82.d)将chromeo
tm 546链霉亲和素(santa cruz biotechnology,sc
‑
364714)稀释150倍,37摄氏度下与载有细胞的玻片共孵育1小时,其中链霉亲和素与生物素化抗体摩尔比为1:0.5。在避光下用pbs清洗3次,每次5分钟。
83.e)将细胞继续与实施例1得到的氧化铁纳米探针以浓度为10毫克每升的e溶液于37摄氏度环境中继续孵育50分钟,使用pbs冲洗三次后,进行荧光成像实验。
84.实验结果表明,实施例1所构建的氧化铁纳米探针,可特异性结合细胞表达的her
‑
2蛋白,并实现单细胞原位成像。
85.参见图3,图3为本发明实施例1制备的氧化铁纳米探针的her
‑
2蛋白荧光成像图。由图3可知,本发明实施例1制备的氧化铁纳米探针的可用于单细胞尺度her
‑
2蛋白荧光的成像,并清晰表明her
‑
2蛋白主要分布于细胞的细胞膜上。
86.实施例6
87.三种细胞内表达的两种特定蛋白共成像
88.a)将三种不同类型的人乳腺腺癌sk
‑
br
‑
3,mcf
‑
7,mda
‑
mb
‑
231细胞系胰酶消化后,分别种在盖玻片上,37摄氏度孵育12小时,并用pbs洗涤后室温下固定20分钟。
89.b)用3%的bsapbs溶液将细胞封闭1小时,然后用内源性生物素封闭试剂盒将细胞内的生物素封闭,最后用pbs缓冲液把载玻片洗涤3次。
90.c)将载有细胞的载波片分别与her2蛋白her2
‑
bio抗体(thermo fisher,ma5
‑
12995)按细胞个数与抗体摩尔数比例为1:100比例,或生物素修饰的增殖细胞的相关抗原(ki67
‑
bio相关抗体)按细胞个数与抗体摩尔数比例为1:20(novus,nb500
‑
170b)在4摄氏度冰箱内共孵育12小时,后用pbs缓冲液清洗三次。
91.d)将chromeo
tm 546链霉亲和素(santa cruz biotechnology,sc
‑
364714)稀释150倍,37摄氏度下与载有细胞的玻片共孵育1小时,其中链霉亲和素与生物素化抗体摩尔比为1:0.8。在避光下用pbs清洗3次,每次5分钟。
92.e)将细胞继续与实施例1得到的氧化铁纳米探针,和实施例4得到的四氧化三铁纳米探针以浓度为10毫克每升的溶液于37摄氏度环境中继续孵育50分钟,使用pbs冲洗三次后,加入细胞核染料(记为dapi)对细胞染色30分钟,使用pbs冲洗三次后,进行荧光成像实验。
93.参见图4,图4为本发明实施例1制备的氧化铁纳米探针以及本发明实施例4制备的四氧化三铁纳米探针用于her
‑
2蛋白和ki67蛋白同时荧光成像图。由图4可知,本发明实施例1制备的氧化铁纳米探针可特异性结合细胞表达的her
‑
2蛋白,且清晰表明her
‑
2蛋白主要以细胞膜分布为主;本发明实施例4制备的四氧化三铁纳米探针可特异性结合细胞表达的ki67蛋白,且位置与细胞核染料dapi重合清晰,表明ki67蛋白主要以细胞核聚集为主;且本发明实施例1与本发明实施例4构建的纳米荧光探针可以同时使用,且对其标记效果无有影响。
94.以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属本发明技术方案的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。