1.本技术属于保鲜技术领域,尤其涉及一种涂膜保鲜剂及其制备方法和应用。
背景技术:
2.鱼肉肉质细腻、味道鲜美、营养丰富,是重要的动物蛋白质和不饱和脂肪酸来源,受到消费者的广泛欢迎。但是鱼肉极易发生腐败变质,这是由于鱼肉中的蛋白质受微生物活动的影响会分解产生具有臭味的挥发性含氮化合物,且鱼肉中脂质也容易被氧化产生醛、酮等有害化合物。
3.由于鱼肉具有极易腐败的特性,目前鲜鱼捕捞后的销售方式仍以当地鲜销为主,但根据2019年中国渔业年鉴统计,我国海水鱼养殖产量为149.51万吨,淡水鱼养殖产量为2544.28万吨,总计2693.79万吨,大量的鲜鱼无法在短期内销售完毕,因此存在大量滞销的鲜鱼需要保藏。冷冻(
‑
18℃以下)是鱼肉的主要保藏手段,但鱼肉在长期冷冻过程中由于温度波动、冷链不完全等因素会出现反复冻融等现象,从而导致鱼肉的品质劣变,甚至导致鱼肉腐败;此外冷冻后的解冻过程也会给鱼肉造成一定的不利影响,例如汁液流失、质地变软以及蛋白质损失等。低温保藏(0
‑
8℃)可以使鱼肉维持接近鲜活的品质和状态,但是低温保藏条件下鱼肉中微生物的活动无法得到有效地抑制,从而导致低温保藏鱼肉的货架期要明显短于冷冻保藏鱼肉,因此如何提高低温保藏的保鲜效果使其与冷冻保藏相当一直是国内外研究人员所关注的问题。
4.综上所述,目前的保鲜技术存在工艺复杂、成本较高以及抗菌性能不足等问题,仍无法满足工业化生产和应用的需求。因此,研发一种提高低温保藏的保鲜效果的保鲜剂是本领域技术人员亟待解决的技术问题。
技术实现要素:
5.有鉴于此,本技术提供了一种涂膜保鲜剂及其制备方法和应用,能有效提高现有低温保藏的保鲜效果。
6.本技术第一方面提供了一种涂膜保鲜剂,其特征在于,以质量百分比计包括:
7.壳聚糖、苯乳酸、曲酸、茶多酚、增塑剂、乙酸和水。
8.另一实施例中,以质量百分比计,包括:
[0009][0010]
另一实施例中,所述增塑剂为甘油。
[0011]
另一实施例中,所述壳聚糖的脱乙酰度≥95%,粘度为100
‑
200mpa
·
s。
[0012]
另一实施例中,所述水为去离子水、纯净水、超纯水、蒸馏水等。
[0013]
本技术第二方面提供了所述的涂膜保鲜剂的制备方法,包括:
[0014]
步骤1、将壳聚糖与乙酸溶液混合,制得壳聚糖溶液;
[0015]
将苯乳酸、曲酸、茶多酚和水混合,制得苯乳酸、曲酸和茶多酚混合溶液;
[0016]
步骤2、将所述壳聚糖溶液、增塑剂和所述苯乳酸、曲酸和茶多酚混合溶液混合分散,制得涂膜保鲜剂。
[0017]
另一实施例中,步骤2中,所述混合分散包括:在45℃下搅拌30~60min,使溶液中的物质分散均匀,然后均质处理2~5min后,获得涂膜保鲜剂。
[0018]
另一实施例中,所述均质过程后还包括:过滤除去不溶性杂质。即在45℃下搅拌30~60min,使溶液中的物质分散均匀,然后高速均质处理2~5min后过滤除去不溶性杂质,获得涂膜保鲜剂。
[0019]
本技术第三方面公开了所述涂膜保鲜剂在低温保藏海鲜或/和河鲜中的应用。
[0020]
另一实施例中,所述涂膜保鲜剂在低温保藏海鲜或/和河鲜中的应用包括如下步骤:
[0021]
步骤一、将海鲜或/和河鲜宰杀后,置于4~10℃的水中放血处理30~60min;
[0022]
步骤二、将宰杀放血后的海鲜或/和河鲜去鳞、去内脏后,用水洗净后沥干,然后对所述海鲜或/和河鲜进行剖片处理,使所述海鲜或/和河鲜的厚度为1~2cm,得到预处理后的海鲜片或/和河鲜片;
[0023]
步骤三、将预处理后的海鲜片或/和河鲜片浸泡在4~10℃的涂膜保鲜剂中10~20min,然后取出风干至所述海鲜或/和河鲜无液滴滴下。
[0024]
另一实施例中,还包括步骤四,步骤四包括:将涂膜处理后的海鲜或/和河鲜真空包装后,置于0~8℃条件下保藏。
[0025]
具体的,本技术的涂膜保鲜剂的应用方法包括:鲜鱼经敲头击晕、宰杀后,置于4
‑
10℃的水中放血处理30min~60min;将宰杀放血后的鲜鱼去鳞、去内脏后,用水洗净后沥干,然后对鱼进行剖片处理,使鱼片厚度为1
‑
2cm;将预处理后的鱼片置于4
‑
10℃的涂膜保鲜剂浸泡10min~20min后捞出,然后置于冷风下风干至鱼片无液滴滴下;涂膜处理后的鱼片置于真空包装袋中真空包装后,置于0
‑
8℃条件下保藏。
[0026]
本技术的涂膜保鲜剂以具有良好成膜特性的高分子天然化合物(例如多糖、蛋白
质和脂质等)作为成膜基质,加入具有不同生物活性的有效成分后,以浸泡、喷淋等方式将成膜溶液均匀覆盖于海鲜或/和河鲜表面,从而在海鲜或/和河鲜表面形成一层具有阻水、阻气以及阻隔微生物污染作用的涂膜。此外涂膜还可以抑制海鲜或/和河鲜中微生物的生长、减弱空气中氧气对食品的氧化作用,从而更好地维持食品水分、新鲜度和品质。因此,本技术的涂膜保鲜剂应用于海鲜或/和河鲜中可有效弥补低温保藏条件下海鲜或/和河鲜易氧化、易腐败等缺点,在保证海鲜或/和河鲜的品质接近鲜活状态的前提下确保鱼肉具有较长的货架期。
[0027]
相比于现有技术,本技术具有如下优点:
[0028]
1、本技术中的涂膜保鲜剂以曲酸和苯乳酸作为抗菌活性成分,苯乳酸虽具有广谱抗菌活性,但对革兰氏阴性细菌的抑制能力较弱,而曲酸则对革兰氏阴性细菌具有较强的抑制效果,两者搭配可以有效拓宽抗菌谱,达到广谱抗菌的效果;此外,海鲜或/和河鲜中腐败菌主要为革兰氏阴性细菌,而联合抑菌效应的测定结果表明曲酸和苯乳酸对海鲜或/和河鲜中常见的革兰氏阴性致病菌和致腐菌都具有极强协同抑制效果,两者联用可以极大地提高抗菌效果,具体而言相较于苯乳酸和曲酸单独使用,两者联合使用可以在保持同等抑菌效果的同时将添加剂量降低4
‑
8倍。
[0029]
2、本技术针对海鲜或/和河鲜中不饱和脂肪酸含量高、易氧化的特点,选用曲酸和茶多酚作为涂膜保鲜剂主要的抗氧化活性成分,具有可观的抗氧化性能;
[0030]
3、本技术的涂膜保鲜剂选用来源丰富、天然无毒的壳聚糖作为涂膜保鲜剂的基质,并将壳聚糖和甘油在微酸性条件下共混合,使得壳聚糖和甘油可以产生交联作用,这将极大地提高涂膜保鲜剂的成膜能力,改善涂膜的机械阻隔性能,提高涂膜对海鲜或/和河鲜的保鲜能力;
[0031]
4、本技术中的涂膜保鲜剂具有原料来源广泛、应用操作方便、容易实现产业化等优势。
附图说明
[0032]
为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0033]
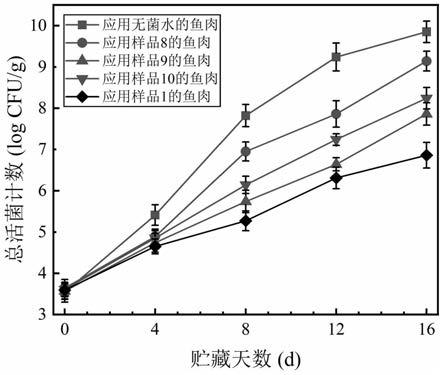
图1为本技术的实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水的鱼肉的贮藏期间的总活菌数变化情况;
[0034]
图2为本技术实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间的挥发性盐基氮(tvb
‑
n)的变化情况;
[0035]
图3为本技术实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间脂质氧化(tbars)的变化情况;
[0036]
图4为本技术实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间鲜度指标(k
‑
value)的变化情况。
具体实施方式
[0037]
本技术提供了一种涂膜保鲜剂及其制备方法和应用,用于解决现有低温保藏水产品中无法抑制微生物的技术缺陷。
[0038]
下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0039]
其中,以下实施例所用原料或试剂均为市售或自制。
[0040]
以下实施例和对比例的涂膜保鲜剂应用在鱼肉的方式具体为:
[0041]
鲜鱼经敲头击晕、宰杀后,置于4℃的水中放血处理30min~60min;将宰杀放血后的鲜鱼去鳞、去内脏后,用水洗净后沥干,然后对鱼进行剖片处理,使鱼片厚度为1
‑
2cm;将预处理后的鱼片置于4℃的涂膜保鲜剂浸泡10min后捞出,然后置于冷风下风干至鱼片无液滴滴下;涂膜处理后的鱼片置于真空包装袋中真空包装后,置于4℃条件下保藏。
[0042]
以下实施例的无菌水应用在鱼肉的方式具体为:
[0043]
鲜鱼经敲头击晕、宰杀后,置于4℃的水中放血处理30min~60min;将宰杀放血后的鲜鱼去鳞、去内脏后,用水洗净后沥干,然后对鱼进行剖片处理,使鱼片厚度为1
‑
2cm;将预处理后的鱼片置于4℃的无菌水浸泡10min后捞出,然后置于冷风下风干至鱼片无液滴滴下;涂膜处理后的鱼片置于真空包装袋中真空包装后,置于4℃条件下保藏。
[0044]
实施例1
[0045]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0046]
称取20g壳聚糖加入到900ml质量浓度为1.0%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0047]
称取2.0g苯乳酸、1.6g曲酸和1.0g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0048]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入10g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品1。
[0049]
实施例2
[0050]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0051]
称取10g壳聚糖加入到900ml质量浓度为0.5%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0052]
称取1.0g苯乳酸、0.8g曲酸和0.5g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0053]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入5g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品2。
[0054]
实施例3
[0055]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0056]
称取15g壳聚糖加入到900ml质量浓度为0.7%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0057]
称取1.5g苯乳酸、1.2g曲酸和0.8g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0058]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入7g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品3。
[0059]
实施例4
[0060]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0061]
称取20g壳聚糖加入到900ml质量浓度为0.9%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0062]
称取2.5g苯乳酸、2.0g曲酸和1.1g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0063]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入9g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品4。
[0064]
实施例5
[0065]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0066]
称取25g壳聚糖加入到900ml质量浓度为1.1%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0067]
称取3.0g苯乳酸、2.4g曲酸和1.4g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0068]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入11g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品5。
[0069]
实施例6
[0070]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0071]
称取30g壳聚糖加入到900ml质量浓度为1.3%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0072]
称取3.5g苯乳酸、2.8g曲酸和1.7g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0073]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入13g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品6。
[0074]
实施例7
[0075]
本技术实施例提供了一种涂膜保鲜剂,具体制备方法包括:
[0076]
称取30g壳聚糖加入到900ml质量浓度为1.5%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0077]
称取4.0g苯乳酸、3.2g曲酸和2.0g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸、曲酸和茶多酚混合溶液;
[0078]
将上述壳聚糖溶液和苯乳酸、曲酸和茶多酚混合溶液混合均匀,然后加入15g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品7。
[0079]
对比例1
[0080]
本技术对比例提供了一种涂膜保鲜剂,具体制备方法包括:
[0081]
称取20g壳聚糖加入到900ml质量浓度为1.0%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0082]
称取1.0g茶多酚加入100ml去离子水中,搅拌均匀后形成茶多酚溶液;
[0083]
将上述壳聚糖溶液和茶多酚溶液混合均匀,然后加入10g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品8。
[0084]
对比例2
[0085]
本技术对比例提供了一种涂膜保鲜剂,具体制备方法包括:
[0086]
称取20g壳聚糖加入到900ml质量浓度为1.0%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0087]
称取3.2g曲酸和1.0g茶多酚加入100ml去离子水中,搅拌均匀后形成曲酸和茶多酚混合溶液;
[0088]
将上述壳聚糖溶液和曲酸和茶多酚混合溶液混合均匀,然后加入10g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品9。
[0089]
对比例3
[0090]
本技术对比例提供了一种涂膜保鲜剂,具体制备方法包括:
[0091]
称取20g壳聚糖加入到900ml质量浓度为1.0%的乙酸溶液中,搅拌均匀后于避光处过夜溶解形成壳聚糖溶液;
[0092]
称取4.0g苯乳酸和1.0g茶多酚加入100ml去离子水中,搅拌均匀后形成苯乳酸和茶多酚混合溶液;
[0093]
将上述壳聚糖溶液和苯乳酸和茶多酚混合溶液混合均匀,然后加入10g甘油,在45℃下以200rpm的速度搅拌30min,使溶液中的物质分散均匀后,均质处理2min后过滤除去不溶性杂质,获得涂膜保鲜剂,标记为样品10。
[0094]
实施例8
[0095]
本技术实施例提供了样品1应用在鱼肉的贮藏的品质变化试验,具体包括:
[0096]
1、鲜鱼经敲头击晕、宰杀后,置于4℃的水中放血处理30min;将宰杀放血后的鲜鱼去鳞、去内脏后,用水洗净后沥干,然后对鱼进行剖片处理,使鱼片厚度为1
‑
2cm;将预处理后的鱼片置于4℃的涂膜保鲜剂浸泡10min后捞出,然后置于冷风下风干至鱼片无液滴滴下;涂膜处理后的鱼片置于真空包装袋中真空包装后,置于4℃条件下保藏,鱼肉样品标记为样品11。
[0097]
鲜鱼经敲头击晕、宰杀后,置于4℃的水中放血处理30min;将宰杀放血后的鲜鱼去鳞、去内脏后,用水洗净后沥干,然后对鱼进行剖片处理,使鱼片厚度为1
‑
2cm;将预处理后的鱼片置于4℃的涂膜保鲜剂浸泡20min后捞出,然后置于冷风下风干至鱼片无液滴滴下;涂膜处理后的鱼片置于真空包装袋中真空包装后,置于4℃条件下保藏,鱼肉样品标记为样品12。
[0098]
鲜鱼经敲头击晕、宰杀后,置于4℃的水中放血处理60min;将宰杀放血后的鲜鱼去
鳞、去内脏后,用水洗净后沥干,然后对鱼进行剖片处理,使鱼片厚度为1
‑
2cm;将预处理后的鱼片置于4℃的涂膜保鲜剂浸泡10min后捞出,然后置于冷风下风干至鱼片无液滴滴下;涂膜处理后的鱼片置于真空包装袋中真空包装后,置于4℃条件下保藏,鱼肉样品标记为样品13。
[0099]
2、检测上述步骤的鱼肉样品在贮藏期间品质的变化情况,包括:
[0100]
测定了上述步骤的中鱼肉样品在贮藏末期(第16d)的总活菌计数值、挥发性盐基氮值、硫代巴比妥酸反应物值、白度l*值以及新鲜度k值,具体测定方法与下述实施例相同。
[0101]
具体结果见表1,除了在白度指标上三组应用实施例的效果排序为:样品12=样品13>样品11,在其余指标上三组应用实施例的效果都呈现以下顺序,即样品12>样品11=样品13。以上结果表明,涂膜保鲜剂的浸泡时间显著影响涂膜保鲜技术的抗菌和抗氧化效果,从而显著影响鱼肉中微生物的增殖情况、脂质氧化情况,进而影响鱼肉中含氮化合物的分解和新鲜度的变化。但鲜鱼宰杀时的放血时间对涂膜保鲜剂的应用效果没有显著影响,仅对鱼肉贮藏期间的白度变化有着一定的影响,这可能由于不同放血时间会导致鱼肉中血红蛋白等化合物的含量不同,从而导致贮藏期间鱼肉的色度变化情况不同。
[0102]
表1不同鱼肉样品在贮藏期间品质的变化情况
[0103][0104]
注:不同的小写字母代表不同测试组在相同指标上存在显著性差异(p<0.05)
[0105]
实施例9
[0106]
本技术实施例提供了涂膜保鲜中主要抗菌成分(苯乳酸和曲酸)联合抑菌效应测定试验,具体包括:
[0107]
参考mun等人的微量稀释棋盘法来评估苯乳酸和曲酸对四株鱼肉中常见的致病菌和致腐菌的联合抑制效果(mun,s.h.,joung,d.k.,kim,y.s.,kang,o.h.,kim,s.b.,seo,y.s.,et al.(2013).synergistic antibacterial effect of curcumin against methicillin
‑
resistant staphylococcus aureus.phytomedicine,20(8
‑
9),714
‑
718.),受试细菌包括一株大肠杆菌o157:h7 atcc 35150、一株单核细胞增生李斯特菌cmcc(b)54002、一株腐败希瓦氏菌atcc 8071和一株荧光假单胞菌atcc 13525。
[0108]
本实施例首先测定两种抗菌剂单独及联合处理时对四株细菌的最小抑菌浓度,然后通过计算分级抑菌浓度指数来评估两种抗菌剂之间存在的联合抑菌效果,分级抑菌浓度指数的计算公式如下:
[0109][0110]
注:fici代表分级抑菌浓度指数;fica及ficb代表物质a和b的分级抑菌浓度;mica
(combined)及micb(combined)代表物质a和b联合处理时相应的最小抑菌浓度;mica(alone)及micb(alone)代表物质a和b单独处理时相应的最小抑菌浓度。其中分级抑菌浓度的解释规则为:fici≤0.5表明两者存在协同增效效应;0.5<fici≤1表明两者存在相加效应;1<fici≤4表明两者存在无关效应;fici>4表明两者存在拮抗效应。
[0111]
由表2可知,苯乳酸和曲酸对四株受试细菌的最小抑菌浓度分别在2.0
‑
4.0mg/ml和0.8
‑
2.0mg/ml之间;可以发现苯乳酸对单增李斯特菌的最小抑菌浓度为2.0mg/ml,显著低于其对其余三株细菌的最小抑菌浓度,这表明苯乳酸对革兰氏阳性细菌的抑制效果更强;相反,曲酸对革兰氏阴性细菌的最小抑菌浓度低于其对革兰氏阳性细菌的最小抑菌浓度,说明曲酸抑制革兰氏阴性细菌的能力更强;因此,苯乳酸和曲酸两者搭配可以有效拓宽其抗菌谱,达到广谱抑菌的效果;此外,当苯乳酸和曲酸联合使用时,可以发现两者对于三株革兰氏阴性细菌(大肠杆菌o157:h7、腐败希瓦氏菌和荧光假单胞菌)都具有较好的协同抑制效应,其中对大肠杆菌o157:h7的协同抑制效果最强,由此可以说明苯乳酸和曲酸对鱼肉中常见的革兰氏阴性致病菌和致腐菌具有极强的协同抑制效果,两者联用可以有效地提高抗菌性能,相较于单独使用苯乳酸和曲酸联合使用可以将添加剂量降低4
‑
8倍,较小的添加剂量可以确保更少的残留以及对冷鲜鱼肉感官品质的影响。sternisa等人的研究表明冷鲜鱼肉中常见的致腐菌主要为革兰氏阴性嗜冷菌,例如假单胞菌属和希瓦氏菌属等(sternia m,purgatorio c,paparella a,et al.combination of rosemary extract and buffered vinegar inhibits pseudomonas and shewanella growth in common carp(cyprinus carpio).journal of the science of food and agriculture,2020,100.),因此苯乳酸和曲酸作为复配抗菌剂用于冷鲜鱼肉防腐具有一定的针对性优势,可以有效地防止冷鲜鱼肉的腐败。
[0112]
表2苯乳酸和曲酸对冷鲜鱼肉中常见致病菌和腐败菌的联合抑制效果
[0113][0114]
实施例10
[0115]
本技术实施例提供了不同的涂膜保鲜剂的抗菌性能测试,具体包括:
[0116]
参考杨胜平等的牛津杯法对样品1、样品8、样品9和样品10的涂膜保鲜剂的抗菌性
能进行测试(杨胜平,章缜,程颖等.牛至精油对荧光假单胞菌的抑制作用及其对冷藏三文鱼品质的影响.食品科学,2020,41(1).),受试细菌与实施例9相同。具体方法为:将相应细菌的过夜培养物稀释至6log cfu/ml,吸取200μl该菌悬液均匀涂布于固体培养基上,然后将牛津杯放置于固体培养基上并轻轻按压,向牛津杯内加入200μl上述样品1、样品8、样品9和样品10的涂膜保鲜剂,以无菌水作为对照,将培养皿放入适宜温度培养48h后,测量抑菌圈直径,每组做三个平行,结果以平均值
±
标准差表示。
[0117]
由表3可知,除样品8的涂膜保鲜剂抑菌效果较弱以外,样品1、样品9的样品10的涂膜保鲜剂对四株受试细菌都有着较好的抑制效果。样品10在抑制单核细胞增生李斯特菌上的抑菌圈要大于样品9,而在抑制其余三株受试细菌上抑菌圈则要小于样品9,这表明苯乳酸在抑制革兰氏阳性细菌上更为有效,而曲酸则恰恰相反,对革兰氏阴性细菌的抑制效果更好,两者联合使用可以有效地拓宽复配保鲜剂的抗菌谱。此外,样品1对四株受试细菌的抑菌圈均显著大于制备样品9和样品10,再次证明了苯乳酸和曲酸具有较好的协同抗菌作用,两者联用可以在降低用量的同时达到更佳的防腐抑菌效果,因此本发明中的涂膜保鲜剂具有较强的应用优势。
[0118]
表3不同的涂膜保鲜剂作用于四株鱼肉中常见细菌的抑菌圈直径
[0119][0120]
实施例11
[0121]
本技术实施例提供了不同的涂膜保鲜剂应用在鱼肉的贮藏期间总活菌数的变化试验,具体包括:
[0122]
根据食品安全国家标准《食品微生物学检验菌落总数测定》(gb4789.2
‑
2016)对上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉中,然后对鱼肉贮藏期间(0
‑
16d)的总活菌数进行测定,样品每4d测定一次,每组样品重复三次。
[0123]
应用上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水的鱼肉的贮藏期间的总活菌数变化情况见图1。
[0124]
结果表明,五组鱼肉的总活菌数在贮藏期间都呈现上升趋势,应用样品1、样品8、样品9和样品10的鱼肉的总活菌数在整个贮藏期间都显著低于应用无菌水的鱼肉,证明四种涂膜保鲜剂都有着一定的抑菌效果。在贮藏的前四天内,应用样品1、样品8、样品9和样品10鱼肉中的总活菌数并没有显著差异(p>0.05);然而在之后的贮藏阶段,应用样品8鱼肉的总活菌数上升得最快,其次是应用样品9和样品10鱼肉,上升速度最慢的则是应用样品1的鱼肉;此外,根据国际食品微生物规范委员会(icmsf)规定的鱼肉总活菌数限值,鱼肉中总活菌数超过7log cfu/g时则认定为不可接受,可以发现应用无菌水的鱼肉在8d内即超过此
限值,应用样品8、样品9和样品10的鱼肉分别于>8d、>12d和16d才超过此限值,而应用样品1的鱼肉在整个贮藏阶段都未超过此限值,以上结果充分表明苯乳酸和曲酸可以作为优良的抗菌剂添加于壳聚糖涂膜保鲜液中以提高保鲜液的防腐能力,并且两者还具有极强的协同抗菌效果,同时添加苯乳酸和曲酸的涂膜保鲜液具有极强的抗菌效果,可以将冷鲜鲈鱼的货架期延长一倍有余。
[0125]
实施例12
[0126]
本技术实施例提供了不同的涂膜保鲜剂应用在鱼肉的贮藏期间挥发性盐基氮(tvb
‑
n)的变化试验,具体包括:
[0127]
根据食品安全国家标准《食品中挥发性盐基氮的测定》(gb5009.228
‑
2016)第二法“自动凯氏定氮仪法”对上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉,然后对鱼肉贮藏期间(0
‑
16d)的挥发性盐基氮进行测定,样品每4d测定一次,每组样品重复三次。
[0128]
上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间的挥发性盐基氮(tvb
‑
n)的变化情况见图2。
[0129]
结果表明,各组的tvb
‑
n在贮藏期间都呈现上升趋势,在贮藏前期(0
‑
4d)五组样品tvb
‑
n的增长速度均较慢,且各组之间无显著性差异(p>0.05);但是在贮藏中后期应用无菌水鱼肉的tvb
‑
n迅速上升至第12d的52.44mgn/100g,应用样品1、样品8、样品9和样品10的鱼肉的tvb
‑
n的上升速度虽然也有所提高,但此时应用样品8、样品9和样品10和样品1的鱼肉的tvb
‑
n值分别为40.25、28.96、35.48和22.66mgn/100g,均显著低于应用无菌水的鱼肉(p<0.05)。上述现象说明,五组样品在贮藏前期的微生物丰度都较低,导致各组样品的含氮化合物降解缓慢;随着贮藏时间的延长,应用无菌水的鱼肉中的微生物迅速增长至较高水平导致鱼肉中蛋白质和氨基酸迅速降解产生大量的挥发性含氮化合物;然而应用样品1、样品8、样品9和样品10的鱼肉中的微生物受到涂膜保鲜剂的抑制无法迅速增殖,从而导致四组样品的tvb
‑
n上升缓慢。其中样品8涂膜保鲜剂由于不含有苯乳酸和曲酸这两个抗菌组分,因此微生物抑制能力较弱;通过比较样品1、样品9和样品10的tvb
‑
n的上升速度可以发现,同时含苯乳酸和曲酸的涂膜保鲜剂在抑制鱼肉含氮化合物分解上的能力要显著优于仅含单一抗菌成分(苯乳酸或曲酸)的涂膜保鲜剂,再次证明了苯乳酸和曲酸优良的协同抑菌效应,以及本发明中涂膜保鲜剂的应用潜力和优势。
[0130]
实施例13
[0131]
本技术实施例提供了不同的涂膜保鲜剂应用在鱼肉的贮藏期间脂质氧化(tbars)的情况试验,具体包括:
[0132]
根据食品安全国家标准《食品中丙二醛的测定》(gb5009.181
‑
2016)第二法“分光光度法”对上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉,然后对鱼肉贮藏期间(0
‑
16d)的硫代巴比妥酸反应物(tbars)进行测定,样品每4d测定一次,每组样品重复三次。
[0133]
上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间脂质氧化的变化情况见图3。硫代巴比妥酸反应物(tbars)是脂质自氧化第二阶段的产物,反映了鱼肉中脂质的过氧化程度;一般认为,tbars值在0.2
‑
0.7mg/kg的肉品为良质肉,当肉的tbars值超过1mg/kg时则认为已严重氧化不可食用。
[0134]
结果显示,五组鱼肉样品的硫代巴比妥酸反应物(tbars)随着贮藏时间的延长逐渐增加,应用无菌水的鱼肉的tbars值在第8d即超过了1mg/kg,然而应用样品8、样品9、样品10和样品1的鱼肉分别于第12d、第16d、第12d和第16d才超过此限值,这是由于样品1的涂膜保鲜剂中的茶多酚具有较强的抗氧化能力,延缓了鱼肉中脂质氧化的速率。有趣的是,应用样品9和样品1的鱼肉的脂质氧化的平均速率要显著低于应用样品8和样品10的鱼肉,但四组涂膜保鲜剂中茶多酚浓度是一致的,以上结果表明曲酸的加入可以提高涂膜保鲜剂的抗氧化能力,这背后的原因是曲酸和茶多酚表现出了一定的协同抗氧化效应。
[0135]
实施例14
[0136]
本技术实施例提供了不同的涂膜保鲜剂应用在鱼肉的贮藏期间白度(l*)的变化试验,具体包括:
[0137]
采用matevue vs3200非接触成像分光光度计测定上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉中,然后对鱼肉在贮藏期间(0
‑
16d)白度(l*)的变化情况,选择cie的标准日光d65
‑
10作为照射光源,每组随机选取三个独立样品,每个样品随机选取五个点用于测量。
[0138]
上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间白度(l*)的变化情况见表4。结果显示,五组样品在贮藏期间的白度都呈现下降趋势,其中应用无菌水的鱼肉的下降速度最快,在贮藏前4d内就出现了极大幅度的下降,而应用样品8、样品9和样品10和样品1的鱼肉都可以在不同程度上抑制鱼肉样品白度的下降,在贮藏末期四个样品的黑变程度排序大致为:应用样品8的鱼肉>应用样品9的鱼肉>/=应用样品10的鱼肉>应用样品1的鱼肉。鱼肉的黑变主要与鱼肉中脂质的氧化以及微生物代谢产生硫化氢相关,结合上述实施例的总活菌计数和tbars值的结果可以得出结论,本技术中的涂膜保鲜剂在抑制鱼肉黑变上也具有较好的协同效果,这主要是由于涂膜保鲜剂中所含的苯乳酸和曲酸具有协同抑菌效应以及曲酸和茶多酚所具备的优良的抗氧化活性。
[0139]
表4不同的涂膜保鲜剂作用于鱼肉的贮藏期间白度(l*)的变化情况
[0140][0141]
实施例15
[0142]
本技术实施例提供了不同的涂膜保鲜剂应用在鱼肉的贮藏期间鲜度指标(k
‑
value)的变化情况试验,具体包括:
[0143]
根据中华人民共和国水产行业标准《鱼类鲜度指标k值的测定高效液相色谱法》
(sc/t 3048
‑
2014)对上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉,然后对鱼肉贮藏期间(0
‑
16d)的鲜度指标(k
‑
value)进行测定,样品每4d测定一次,每组样品重复三次。
[0144]
上述实施例和对比例(样品1、样品8、样品9和样品10)以及无菌水应用在鱼肉的贮藏期间鲜度指标(k
‑
value)的变化情况见图4。k值反映了鱼肉样品中atp关联化合物的比例,通常用于评估鱼肉的新鲜度;新鲜鱼肉的k值一般小于20%,当鱼肉的k值超过60%时认为鱼肉已经腐败需要舍弃。结果显示,应用无菌水的鱼肉、应用样品8、样品9和样品10的鱼肉的k值分别于第8d、第12d、第16d和第16d超过了60%,而应用样品1的鱼肉的k值则是在整个贮藏阶段都未超过60%,此结果与挥发性盐基氮和tbars的结果基本一致,证明本技术中的涂膜保鲜剂由于含有协同抗菌组分(苯乳酸和曲酸)以及联合抗氧化组分(曲酸和茶多酚),可以极为有效地延缓鱼肉鲜度的下降,并同时降低各组分的添加剂量,具有显著的应用优势和价值。
[0145]
实施例16
[0146]
本技术实施例提供了不同的涂膜保鲜剂的防腐保鲜能力测试,具体包括:
[0147]
参照上述实施例的方法测定应用样品2、样品3、样品4、样品5、样品6和样品7的鱼肉,以及应用无菌水的鱼肉在贮藏第8d的总活菌计数(tvc)、挥发性盐基氮(tvb
‑
n)、脂质氧化程度(tbars)、新鲜度(k值)以及白度的情况见表5。
[0148]
可以发现,应用无菌水的鱼肉(即未经涂膜保鲜剂处理的鱼肉样品),在贮藏第8d时各项指标(包括tvc、tvb
‑
n、tbars及k值)均超过或逼近了相应的限量值,样品的白度也出现了较大幅度的下降,表明未经处理的鱼肉在冷藏条件品质劣变速度较快,货架期大致在8d左右。相反,应用样品2、样品3、样品4、样品5、样品6和样品7的鱼肉由于受到涂膜保鲜剂中抗菌及抗氧化活性成分的保护,在贮藏第8d时各项指标仍在限量范围内,白度也维持在较高水平,这表明本技术中的涂膜保鲜剂具有较好的抗菌和抗氧化能力,能够显著地维持鱼肉的品质和货架期。此外,通过对比应用样品2、样品3、样品4、样品5、样品6和样品7的鱼肉的各项指标的劣变情况,还可以发现本技术中的涂膜保鲜剂的防腐保鲜能力会随着苯乳酸、曲酸以及茶多酚等抗菌和抗氧化活性成分含量的提高而增强,呈现一定的浓度依赖性。
[0149]
表5不同的涂膜保鲜剂作用于鱼肉的在贮藏第8d的品质的变化情况
[0150][0151]
本技术实施例涉及一种新型的涂膜保鲜剂及其在冷鲜鱼肉防腐保鲜上的应用,涂膜保鲜剂以壳聚糖作为基质,以苯乳酸和曲酸这一组具有协同增效效应的复配防腐剂作为主要的抗菌活性成分,以曲酸和茶多酚作为主要的抗氧化活性成分,并添加一定量的甘油作为增塑剂,所有物质在微酸性条件下混合并且均质化处理,随后将涂膜保鲜剂以浸泡的方式均匀覆盖于冷鲜鱼肉表面,待鱼肉表面风干至无液滴滴落后,将处理后的鱼肉真空包装并置于低温(0
‑
8℃)条件下保藏。涂膜保鲜剂可以有效抑制冷鲜鱼肉中微生物的生长、降低脂质氧化速率、减缓鲜度的下降,能够使冷鲜鱼肉获得较长的货架期并同时维持其良好的品质。采用本技术的涂膜保鲜的冷鲜鱼片在0
‑
8℃下贮藏,货架期可达到12
‑
16天。本技术的涂膜保鲜剂具有配方科学合理、使用方便、成本较低、有利于工业化生产和应用等优点。
[0152]
综上所述,本技术的涂膜保鲜剂中的抗菌活性成分(苯乳酸和曲酸)间具有极强的协同抗菌效应,因此能以较低的剂量有效地抑制鱼肉中微生物的生长和代谢,从而保护鱼肉中的蛋白质、氨基酸等含氮化合物不被微生物分解为挥发性的含氮物质,从而有效地延缓了鱼肉品质的劣变;此外,本技术的涂膜保鲜剂中的曲酸和茶多酚也具有一定的协同抗氧化活性,因此本保鲜剂也能有效地抑制鱼肉中脂质的过氧化,避免鱼肉中的不饱和脂肪酸被氧化为醛、酮、酸等有害物质。
[0153]
总体而言,本技术的涂膜保鲜剂配方科学合理,利用保鲜剂组分间的协同抗菌和抗氧化效应在降低剂量的同时从以上两个层面维持了冷鲜鱼肉的颜色、鲜度等品质,并显著延长了冷鲜鱼肉的货架期。
[0154]
以上所述仅是本技术的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。