1.本发明属于前体化合物领域,具体涉及一种阿比特龙前体化合物及其制备方法和应用。
背景技术:
2.前列腺癌是世界范围内最普遍的恶性致死性肿瘤,并且随年龄增长发病率升高。当前的人口老龄化趋势导致前列腺癌患者迅速增加,前列腺癌在我们国家最近10年增长率比较快,已位居男性发病的第六位。在美国男性发病率第一位,死亡率是第二位。根据美国癌症学会的数据,美国每年约有21.8万名男子被诊断患上前列腺癌,3.2万人因此死亡。
3.在中国,前列腺癌曾经是比较少见的疾病,但近年该病的发病率也呈上升趋势。流行病学数据显示,中国前列腺癌发病率从1993年的1.71人/10万男性人口增加到2005年的7.9人/10万男性人口。根据2014年国家癌症中心统计的数据,国内前列腺癌发病率约为9.80/10万男性人口,而且在以每年10%的速度攀升。也就是说,10年后,中国前列腺癌的发病率或将增加1倍,甚至更严重。随着中国社会老龄化现象日趋严重,未来10年,中国前列腺癌的发病可能会进入高峰期。中国人口基数大,老龄化速度也快。前列腺癌这种男性疾病也将变得越来越常见。
4.已经证明体内的一些疾病是由体内过高的雄激素导致的,如前列腺良性增生、前列腺癌等。雄激素在前列腺癌的发生、增长和扩散中起着重要作用。具体而言,最重要的两类雄激素是睾酮和二氢睾酮。其中,90%的睾酮由睾丸合成,剩下的10%由肾上腺合成。睾酮在一种还原酶(steroid 5α
‑
reductas)的作用下进一步转化为活性更强的二氢睾酮。体内微量的睾酮和二氢睾酮就能够刺激前列腺癌的增长。
5.cyp17(17α
‑
羟化酶/c17,20
‑
裂解酶)是一种细胞色素p450酶,位于睾丸和肾上腺及其它组织如前列腺肿瘤组织中。它是雄激素生物合成途径中的关键酶,催化睾酮生物合成的两个顺序反应:首先通过17α
‑
羟化酶活性将孕烯醇酮和孕酮转化为其17α
‑
羟基衍生物,随后通过c17,20
‑
裂解酶活性二者分别形成脱氢表雄酮(dhea)和雄烯二酮。dhea和雄烯二酮均为雄激素,是睾酮的前体。睾酮在一种还原酶(steroid 5α
‑
reductas)的作用下进一步转化为活性更强的二氢睾酮。
6.如果发生的肿瘤仅限于前列腺,病人可通过手术或放疗进行切除。在患前列腺肿瘤的男子中,大约15%的人癌症将会扩散。对于这些病人,目前并没有治愈的办法。治疗的目的是为了防止睾丸生成睾丸激素以及其它雄性激素,前列腺癌细胞的生长离不开这些激素。当患者用诸如根除性前列腺切除术或放射疗法失败时,前列腺癌的药物治疗成了非常重要的治疗手段。
7.cyp17酶抑制剂不仅能够抑制睾丸中雄激素的生物合成,还能抑制肾上腺及其他组织如前列腺肿瘤组织中雄激素的生物合成,相比目前临床上常用的去势疗法只能抑制睾丸中雄激素的生物合成具有更好的治疗作用。选择性高、作用强的cyp17酶抑制剂可以通过抑制雄激素生物合成中较初始环节,降低体内雄激素水平,在临床上用于治疗前列腺癌。
8.基于上述的流行病学和分子生物学认识,防治前列腺癌的工作已刻不容缓,而研究开发cyp17酶抑制剂是前列腺癌药物治疗的重要方向。作为新型cyp17酶抑制剂,醋酸阿比特龙被centocor ortho公司研发出来用于治疗前列腺癌。醋酸阿比特龙于2011年4月28日经美国fda批准上市,与泼尼松联用治疗去势抵抗性前列腺癌,其商品名为zytiga。2011年7月28日,zytiga获加拿大卫生部批准。对于前列腺癌患者,荷尔蒙睾丸激素可刺激肿瘤的生长,药物或手术治疗在内的去势治疗可减少睾丸激素的生成或阻断睾丸激素的作用,但这种治疗无法抑制身体其它部位产生雄激素,前列腺癌仍可以继续增长。阿比特龙靶向抑制调节雄激素生成的cyp17酶活性,减少雄激素的生成,从而减缓肿瘤生长。与安慰剂联用泼尼松相比,接受醋酸阿比特龙酯联用泼尼松治疗患者的中值存活期延长3.9个月(分别是14.8和10.9个月,p<0.0001),即死亡风险减少35%。
9.因此,为寻找新的阿比特龙酯前体药物,为临床提供的新的选择,值得进一步研究。
技术实现要素:
10.发明目的:针对上述技术问题,本发明提供了一种阿比特龙前体化合物及其制备方法和应用。该阿比特龙前体化合物是一种新型化合物,其可以与醋酸阿比特龙媲美,甚至在某些方面优于醋酸阿比特龙,具有很大的市场价值。
11.技术方案:为了达到上述发明目的,本发明所采用的技术方案如下:
12.本发明提供了一种式i所示化合物,或其药学上可接受的盐:
[0013][0014]
本发明进一步提供了式i化合物药学上可接受的盐,其结构式如下所示:
[0015][0016]
其中,ha为无机酸或者有机酸。
[0017]
优选的,所述式i化合物药学上可接受的盐,选自如下化合物:
[0018][0019][0020]
本发明还提供了一种制备化学式i所示化合物的方法,包括如下步骤:
[0021]
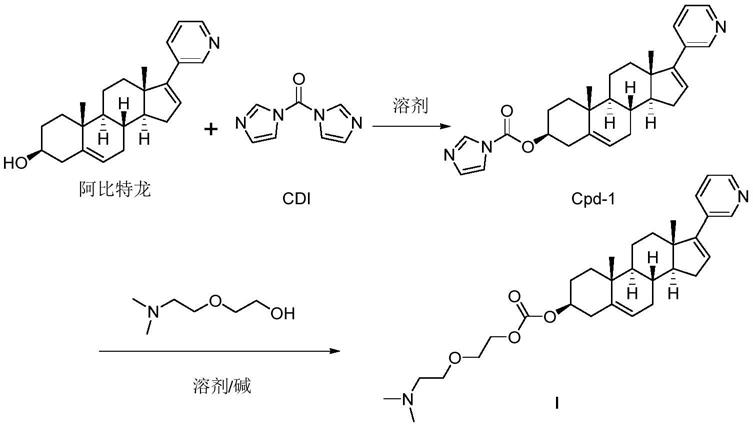
步骤一、将阿比特龙在溶剂中与n,n'
‑
羰基二咪唑反应,生成中间体cpd
‑
1。
[0022]
步骤二、中间体cpd
‑
1在溶剂中和碱的存在下与2
‑
[2
‑
(二甲基氨基)乙氧基]乙醇反应完毕后处理纯化获得式i化合物。
[0023]
本发明还提供了式i化合物药学上可接受的盐的制备方法,包括如下步骤:
[0024]
可选地,将式i化合物溶于溶剂中,加入等当量的酸,得到式i化合物的盐。
[0025]
随后将产物精制。
[0026]
式i所示化合物及其药学上可接受的盐的制备方法,如以下反应流程所示:
[0027][0028]
在制备过程中,第一步反应在室温下进行,较佳的室温(25℃),反应时间没有特别限制,通常为1分钟至24小时,较佳地为1
‑
20小时。所用溶剂通常为二氯甲烷、丙酮、乙酸乙酯、dmf、dms0、吡啶等。反应完毕后浓缩除去反应溶剂,加入合适的溶剂析晶,抽滤得到中间体。所用溶剂通常为四氢呋喃,乙腈,石油醚,甲叔醚等。
[0029]
第二步反应在室温至100℃条件下进行,较佳的温度为60℃,反应时间没有特别限制,通常为1分钟至24小时,较佳地为1
‑
20小时。所用溶剂通常为甲苯、dmso、二氧六环、四氢呋喃等。所用碱通常为碳酸钠、碳酸氢钠、碳酸钾、氢氧化钠、氢氧化钾、三乙胺、吡啶等。
[0030]
第三步反应在室温下进行,较佳的室温(25℃),反应时间没有特别限制,通常为1分钟至24小时,较佳地为1
‑
20小时。所用溶剂通常为二氯甲烷、丙酮、乙酸乙酯等。
[0031]
第四步精制在
‑
20℃
‑
100℃下进行。所用溶剂通常为石油醚、乙酸乙酯、甲醇、乙醇、甲基叔丁基醚、正己烷、四氢呋喃等。
[0032]
本发明提供一种药物组合物,其包含式i化合物或其药学上可接受的盐。
[0033]
优选的,所述药物组合物中,还包括一种以上药学上可接受的载体、稀释剂或赋形剂。
[0034]
本发明还提供了式i化合物或其药学上可接受的盐,或者上述药物组合物在制备cyp17酶抑制剂药物中的应用。
[0035]
本发明还提供了式i化合物或其药学上可接受的盐、或上述药物组合物在制备预防或治疗雄激素相关疾病的药物中的应用。
[0036]
进一步地,所述雄激素相关疾病包括泌尿生殖系统疾病(如泌尿生殖系统癌症或前列腺肥大等)或其他与雄激素相关的疾病(如雄激素性脱发、雄激素相关的非泌尿生殖系统癌症等);所述泌尿生殖系统癌症包括前列腺癌、乳腺癌、卵巢癌、其它泌尿生殖系癌症
等。
[0037]
本发明化合物的作用机理:本发明化合物通过动物实验证明有优异的前药特性,在体内被迅速吸收,再降解成有效成分阿比特龙,其余降解物从化学角度分析为相应的醇和二氧化碳,对人体安全有效。
[0038]
有益效果:相对于现有技术,本发明具有以下优势:
[0039]
1、临床研究表明,作为阿比特龙的前药,醋酸阿比特龙口服后能被人体吸收,在体内去乙酰化得到活性成分阿比特龙。本发明提供的式i化合物,同样具有前药的特性,在体内被迅速吸收,再降解成有效成分阿比特龙,其余降解物为相应的醇和二氧化碳,安全有效。
[0040]
2、从实施例10的体外细胞增殖毒性实验获知本发明的ic
50
优于现有醋酸阿比特龙。
[0041]
3、式i化合物药学上可接受的盐具有优良的水溶性。
[0042]
4、实施例12的beagle犬的药物动力学特性对比研究表明,lhy
‑
ab614给药后体内可同时检出式i化合物和阿比特龙,且阿比特龙的c
max
远高于式i化合物。醋酸阿比特龙给药后在体内只检出阿比特龙,说明它进入体内后均迅速代谢为阿比特龙。口服lhy
‑
ab614与醋酸阿比特龙相比,阿比特龙的c
max
显著增加,t
max
无变化,说明口服本发明化合物可在体内维持较长时间的高血药浓度,这在临床上具有很大优势。此外,与醋酸阿比特龙相比,lhy
‑
ab614口服的auc有明显增加,说明本发明化合物能够显著提高口服的生物利用度。
具体实施方式
[0043]
下面通过具体实施例对本发明所述的技术方案给予进一步详细的说明,但有必要指出以下实施例只用于对发明内容的描述,并不构成对本发明保护范围的限制。
[0044]
实施例1化合物lhy
‑
ab614的合成
[0045][0046]
取干燥的500ml圆底烧瓶,加入阿比特龙(10g,28.6mmol,1.0eq),用150ml的ch2cl2溶解,加入cdi(14g,85.8mmol,3.0eq),室温下反应。8h后tlc(pe:ea=1:1)检测反应情况,原料消失完全。浓缩反应液,加入100ml干燥的thf,室温下搅拌30min,抽滤,滤饼用干燥的thf(50ml*3)洗涤。收集固体,干燥,得到化合物cpd
‑
1(10g,22.6mmol),产率79%。
[0047]
取干燥的250ml圆底烧瓶,加入化合物cpd
‑
1(10g,22.6mmol,1.0eq)和koh(250mg,4.5mmol,0.2eq),加入100ml甲苯,最后加入2
‑
[2
‑
(二甲基氨基)乙氧基]乙醇(4.1ml,29.4mmol,1.3eq),60℃反应过夜,tlc检测反应情况,原料消失完全。旋干溶剂,水洗所得固体化合物,ch2cl2萃取,合并有机相,干燥,浓缩,柱层析纯化,得到式i产物(5.7g,11.2mmol),产率49%。1h nmr(400mhz,cdcl3)δ8.59(s,1h),8.43(d,j=3.9hz,1h),7.61(d,j=7.8hz,1h),7.19(dd,j=7.6,4.9hz,1h),5.96(s,1h),5.41(d,j=3.5hz,1h),4.52
–
4.40(m,1h),4.31
–
4.19(m,2h),3.72
–
3.61(m,2h),3.57(t,j=5.7hz,2h),2.50(t,j=5.6hz,2h),2.44
–
2.33(m,2h),2.25(s,7h),2.08
–
1.98(m,3h),1.94
–
1.84(m,2h),1.81
–
1.35(m,8h),1.16
–
1.08(m,1h),1.04(s,3h),1.02(s,3h).13c nmr(101mhz,cdcl3)δ154.57,151.69,148.00,147.96,139.77,133.70,132.97,129.27,123.08,122.65,77.83,69.33,68.83,66.73,58.77,57.51,50.25,47.36,45.91,38.09,36.82,36.78,35.23,31.85,31.56,30.43,27.70,20.88,19.28,16.65.ei
‑
ms:m/z calcd for c
31
h
44
n2o4[m h]
508.7found:509.3
[0048]
室温下将式i(10g)溶于100ml乙酸乙酯中,通入干燥得hcl气体,反应完全后,加入100ml石油醚,产物lhy
‑
ab614析出。弃去上清,干燥得lhy
‑
ab614粗品。
[0049]
室温下,将lhy
‑
ab614粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab614(800mg,纯度99.6%)。
[0050]
实施例2化合物lhy
‑
ab615的合成
[0051]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的磷酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab615析出。抽滤,干燥得lhy
‑
ab615粗品。
[0052]
室温下,将lhy
‑
ab615粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab615(820mg,纯度99.5%)。
[0053]
实施例3化合物lhy
‑
ab616的合成
[0054]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的甲磺酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab616析出。抽滤,干燥得lhy
‑
ab616粗品。
[0055]
室温下,将lhy
‑
ab616粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab616(790mg,纯度99.7%)。
[0056]
实施例4化合物lhy
‑
ab617的合成
[0057]
室温下将式i(1g)溶于10ml丙酮中,加入等当量的丙酮酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab617析出。抽滤,干燥得lhy
‑
ab617粗品。
[0058]
室温下,将lhy
‑
ab617粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab617(800mg,纯度99.7%)。
[0059]
实施例5化合物lhy
‑
ab618的合成
[0060]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的苯甲酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab618析出。抽滤,干燥得lhy
‑
ab618粗品。
[0061]
室温下,将lhy
‑
ab618粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab618(820mg,纯度99.6%)。
[0062]
实施例6化合物lhy
‑
ab619的合成
[0063]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的对甲苯磺酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab619析出。抽滤,干燥得lhy
‑
ab619粗品。
[0064]
室温下,将lhy
‑
ab619粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab619(800mg,纯度99.8%)。
[0065]
实施例7化合物lhy
‑
ab620的合成
[0066]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的马来酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab620析出。抽滤,干燥得lhy
‑
ab620粗品。
[0067]
室温下,将lhy
‑
ab620粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab620(840mg,纯度99.7%)。
[0068]
实施例8化合物lhy
‑
ab621的合成
[0069]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的丁二酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab621析出。抽滤,干燥得lhy
‑
ab621粗品。
[0070]
室温下,将lhy
‑
ab621粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab621(830mg,纯度99.8%)。
[0071]
实施例9化合物lhy
‑
ab622的合成
[0072]
室温下将式i(1g)溶于10ml乙酸乙酯中,加入等当量的苹果酸,反应完全后,加入20ml石油醚,产物lhy
‑
ab622析出。抽滤,干燥得lhy
‑
ab622粗品。
[0073]
室温下,将lhy
‑
ab622粗品(1g)溶于1.2ml甲醇中,缓慢滴加四氢呋喃25ml,室温剧
烈搅拌,析出白色固体,抽滤后滤饼干燥,得到较纯的lhy
‑
ab622(810mg,纯度99.7%)。
[0074]
实施例10阿比特龙羧酸酯前药细胞活性测试
[0075]
用化学发光细胞活率检测方法(即ctg方法)评估醋酸阿比特龙和lhy
‑
ab614在lncap clone fgc和vcap中的增殖的半数抑制浓度(ic
50
)。
[0076]
收集指数期细胞并进行活细胞计数。用相应培养基调整各细胞悬液至合适浓度。每孔加90μl细胞悬液于96孔细胞培养板,铺适量的细胞于板孔内,37℃、5%co2孵箱中培养24小时。
[0077]
以dmso溶解供试物为储存液,起始浓度为50μm,以培养基3倍倍比稀释为10x工作溶液,9个浓度点。cisplatin为参考化合物,以dmso溶解,起始浓度为100μm,以培养基3倍倍比稀释为10x工作溶液,9个浓度点。然后加入细胞中,每孔10μl。然后37℃、5%co2孵箱中培养72小时。
[0078]
于室温平衡96孔板约30分钟,然后每孔加入50μl ctg溶液。用微孔板震荡器混匀2分钟使细胞裂解。于室温放置20分钟稳定荧光信号。用envision2104读板仪测定荧光信号值。应用graphpad prism软件,使用非线性回归模型绘制s型剂量
‑
反应曲线并计算ic
50
值。结果如表1所示。lhy
‑
ab614对lncap细胞和vcap细胞的ic
50
值分别为3.2um和5.7um,显著优于醋酸阿比特龙。
[0079]
表1测试化合物和对照化合物对lncap细胞和vcap细胞的抑制
[0080][0081]
实施例11lhy
‑
ab614
‑
622溶解度测试
[0082]
称取200mg的lhy
‑
ab614
‑
622,加入1ml生理盐水。结果发现lhy
‑
ab614
‑
622能够很好的溶解。说明lhy
‑
ab614
‑
622在生理盐水中具有较好的溶解度,且>200mg/ml。
[0083]
称取2mg的醋酸阿比特龙,溶于1ml生理盐水,搅拌过夜。抽滤后将滤液进行hplc分析。醋酸阿比特龙溶于甲醇,配制成0.1mg/ml的溶液作为对照。结果发现醋酸阿比特龙极难溶于水,生理盐水中溶解度小于0.1mg/ml。
[0084]
实施例12lhy
‑
ab614比格犬的药物动力学特性对比研究
[0085]
为证明本发明的lhy
‑
ab614优于现有醋酸阿比特龙在体内的生物利用度,以醋酸阿比特龙为参比药物,进行生物利用度和生物等效性评价。4只健康beagle犬,体重范围6~8kg,实验前一天禁食12h,给药后统一进食低脂肪标准餐。在试验前两周及试验期间不得服用其它药物。将4只beagle犬随机分为a,b两组(每组2只)。lhy
‑
ab614按46.8mg/kg(折算成阿比特龙为32.2mg/kg)的剂量口服给药,醋酸阿比特龙按42.3mg/kg(折算成阿比特龙为37.8mg/kg)的剂量口服给药。服药前取空白血,服药后于0.25h,0.5h,1.0h,2.0h,4.0h,6.0h,8.0h,24.0h分别采血1ml于edta
‑
k2抗凝管中,与血液充分混合后,立即置于湿冰中并
尽快离心分离血浆,离心后分离得到的血浆装于标记好的ep管中。取50μl血浆样品,再加入300μl含有10ng/ml的卡马西平乙腈溶液进行蛋白沉淀,涡旋5min后,再将上述样品置于离心机中用5500g离心10min。从中取出100μl上清液,再向其中加入300μl50%
‑
甲醇水进行稀释,涡旋后5μl进样。用hplc
‑
ms/ms法测定lhy
‑
ab614、醋酸阿比特龙和阿比特龙的体内药物浓度。
[0086]
表2beagle犬口服lhy
‑
ab614后血浆中lhy
‑
ab614和阿比特龙的药动学参数
[0087][0088]
表3beagle犬口服醋酸阿比特龙后血浆中阿比特龙的药动学参数
[0089][0090]
结果发现,lhy
‑
ab614给药后体内可同时检出lhy
‑
ab614和阿比特龙,且阿比特龙的c
max
远高于lhy
‑
ab614。醋酸阿比特龙给药后在体内只检出阿比特龙,说明它进入体内后均迅速代谢为阿比特龙。口服lhy
‑
ab614与醋酸阿比特龙相比,阿比特龙的cmax显著增加,tmax无变化,说明口服本化合物可在体内维持较长时间的高血药浓度,这在临床上具有很大优势。此外,与醋酸阿比特龙相比,lhy
‑
ab614口服的auc有明显增加,说明本化合物能够显著提高口服的生物利用度。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

