分子氧促进谐二氟烯烃羟化磺酰酯化反应制备
β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法
技术领域
本发明涉及有机合成技术领域,具体涉及一种分子氧促进谐二氟烯烃羟化磺酰酯化反应制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法。
背景技术:
β
‑
羟基砜是一类重要的含砜化合物,在精细化工、医药、农药和有机功能材料中有着广泛的应用。β
‑
羟基砜衍生物是一种十分有用的有机中间体,它可以制备其他类型的砜(sulfone),如不饱和基团的砜;通过消去β
‑
oh和磺酰基可构建新的不饱和叁键化合物和多烯类化合物。另外,β
‑
羟基砜衍生物大多数具有光学活性,可以合成多种生物活性的物质;在药物合成中占有重要的地位。为了开发高效的β
‑
羟基砜衍生物的构建策略,许多科研工作者进行了大量工作。考虑到亚硫酸钠盐作为化学品的易得性、稳定性、易操作性和双重反应性(亲核试剂或亲电试剂),使用亚硫酸钠作为砜源来制备砜衍生物被证明是一种很有吸引力的方法。通过亚磺酸钠生成的砜自由基中间体对烯烃进行自由基双官能化已成为制备大量β
‑
羟基砜的可靠途径。一般情况下,该双官能化反应都是以电中性和富电子烯烃为起始原料。例如,雷爱文课题组报道了一种由苯亚磺酸合成二级和三级β
‑
羟基砜的分子间氧磺酰化方法记载了在好氧条件下由i2催化实现烯烃和亚磺酸钠合成β
‑
羟基砜。现有技术:(a)r.a.fromtling,drugs future,1989,14,1165
‑
1168;(b)s.oida,y.tajima,t.konosu,y.nakamura,a.somada,t.tanaka,s.habuki,t.harasaki,y.kamai,t.fukuoka,s.ohya and h.yasuda,synthesis and antifungal activities of r
‑
102557and related dioxane
‑
triazole derivatives.chem.pharm.bul.,2000,48,694
‑
707;(c)h.eto,y.kaneko,s.takeda,m.tokizawa,s.sato,k.yoshida,s.namiki,m.ogawa,k.maebashi,k.ishida,m.matsumoto and t.asaoka,new antifungal 1,2,4
‑
triazoles with difluoro(substituted sulfonyl)methyl moiety.chem.pharm.bul.,2001,49,173
‑
782.(d)d.joseph,m.a.idris,j.chen and s.lee,recent advances in the catalytic synthesis of arylsulfonyl compounds.acs catal.,2021,11,4169
‑
4204;(e)j.aziz,s.messaoudi,m.alami and a.hamze,sulfinate derivatives:dual and versatile partners in organic synthesis.org.biomol.chem.,2014,12,9743
‑
9759;(f)h.mei,p.romana,l.wang,z.li,g.
‑
v.roschenthaler and j.han,chemistry of electrochemical oxidative reactions of sulfinates salts.green chem.,2020,22,3028
‑
3059.
(g)q.lu,j.zhang,f.wei,y.qi,h.wang,z.liu and a.lei,aerobicoxysulfonylation of alkenes leading to secondary and tertiary beta
‑
hydroxysulfones.angew.chem.,int.ed.,2013,52,7156
‑
7159;(h)z.zhang,j.yan,d.ma and j.sun,electrochemical synthesis ofβ
‑
hydroxy
‑
,β
‑
alkoxy
‑
,andβ
‑
carbonyloxy sulfones by vicinal difunctionalization of olefins,chinese chem.let.,2019,30,1509
‑
1511;(i)a.kariya,t.yamaguchi,t.nobuta,n.tada,t.miura and a.itoh,molecular
‑
iodine
‑
catalyzed aerobic oxidative synthesis ofβ
‑
hydroxy sulfones from alkenes.rsc adv.,2014,4,13191
‑
13194;(j)q.jiang,y.liang,y.zhang and x.zhao,chalcogenide
‑
catalyzed intermolecular electrophilic thio
‑
and halofunctionalization of gem
‑
difluoroalkenes:construction of diverse difluoroalkyl sulfides and halides.org.let.,2020,22,7581
‑
7587;(k)n.taniguchi,aerobic nickel
‑
catalyzed hydroxysulfonylation of alkenes using sodium sulfinates.j.org.chem.,2015,80,7797
‑
7802;(f)q.p.s.b.freitas,r.a.g.lira,j.j.r.freitas,g.zeni and p.h.menezes,ultrasound
‑
promoted chemoselective oxysulfonylation of alkenes.j.braz.chem.soc.,2018,29,1167
‑
1174.(l)q.lu,j.zhang,f.wei,y.qi,h.wang,z.liu and a.lei,aerobic oxysulfonylation of alkenes leading to secondary and tertiary beta
‑
hydroxysulfones.angew.chem.,int.ed.,2013,52,7156
‑
7159(m)a.kariya,t.yamaguchi,t.nobuta,n.tada,t.miura and a.itoh,molecular
‑
iodine
‑
catalyzed aerobic oxidative synthesis ofβ
‑
hydroxy sulfones from alkenes.rsc adv.,2014,4,13191
‑
13194(n)w.wu and h.jiang,palladium
‑
catalyzed oxidation of unsaturated hydrocarbons using molecular oxygen.acc.chem.res.,2012,45,1736
‑
1748;(o)z.shi,c.zhang,c.tang and n.jiao,recent advances in transition
‑
metal catalyzed reactions using molecular oxygen as the oxidant.chem.soc.rev.,2012,41,3381
‑
3430;(p)t.punniyamurthy,s.velusamy and j.iqbal,recent advances in transition metal catalyzed oxidation of organic substrates with molecular oxygen.chem.rev.,2005,105,2329
‑
2363;(q)a.e.wendlandt,a.m.suess and s.s.stahl,copper
‑
catalyzed aerobic oxidative c
‑
h functionalizations:trends and mechanistic insights.angew.chem.int.ed.,2011,50,11062
‑
11087.此外,中国专利申请cn200410008484.0公开了一种制备β
‑
羟基砜衍生物的方法,制备步骤包括将磺酰氯溶于四氢呋喃溶剂中,然后加入烯烃和水或醇及催化量的酸,20℃
‑
70℃温度下反应1
‑
3天,经萃取、洗涤、有机相干燥、浓缩和提纯步骤后得到产品。本发明方法简便,选择性高,产物易于纯化。
中国专利申请cn201610861207.7公开了一种选择性合成芳基甲基砜和羟基砜衍生物的方法。该方法以亚磺酸钠盐和过氧化二叔丁基为原料,以水为绿色反应溶剂,无需任何添加剂和催化剂,通过控制反应温度选择性得到芳基甲基砜和羟基砜衍生物。该方法具有反应条件温和、操作简单、成本低、对环境友好、产物选择性和产率高等优点。目前,该领域但仍有两个问题亟待解决:(1)亚磺酸钠与谐二氟烯烃等缺电子烯烃的双官能化反应尚待研究,而含氟分子在药物开发中具有重要意义;(2)亚磺酸钠是否能实现被氧气氧化生成磺酰氧基自由基而不是磺酰自由基,然后进行烯烃的羟磺酰氧基化反应,这一问题尚待研究。有鉴于此,我们公开了一种分子氧促进谐二氟烯烃羟化磺酰酯化反应制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法,以无毒无害的氧气为氧化剂,可以高效合成β
‑
羟基
‑
谐二氟磺酰酯类化合物。
技术实现要素:
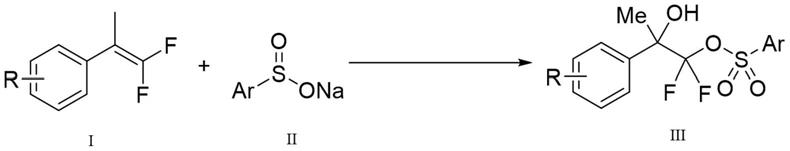
本发明的目的是提供一种环境友好、直接和新颖的分子氧促进谐二氟烯烃羟化磺酰酯化反应制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法,以谐二氟烯烃和苯亚磺酸钠为起始原料,以无毒无害的氧气为氧化剂,通过自由基双官能化反应最终以中等到较好的产率和较宽的底物范围获得一系列β
‑
羟基
‑
谐二氟磺酰酯类化合物。为实现上述发明目的,本发明的技术方案如下:一种制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法,所述β
‑
羟基
‑
谐二氟磺酰酯类化合物如下式iii所示,由化合物i和化合物ii反应得到。其中,r为芳基、具有取代基的芳基、杂芳基、具有取代基的杂芳基或c1
‑
5的烷氧基。更进一步优选的,r为芳基或c1
‑
5的烷氧基。更进一步优选的,r为苯基或甲氧基。最优选的,r为苯基。ar为芳基、具有取代基的芳基、杂芳基或具有取代基的杂芳基。更进一步优选的,ar为苯基、甲苯基、联苯基或卤代苯基。更进一步优选的,ar为苯基、甲苯基、二联苯基、氟代苯基、氯代苯基、溴代苯基或碘代苯基。最优选的,ar为苯基。进一步的,一种制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法,所述β
‑
羟基
‑
谐二氟磺酰酯类化合物如下式iii所示,由化合物i和化合物ii为反应物,氧分子为氧化剂促进反应得到。
r为芳基、具有取代基的芳基、杂芳基、具有取代基的杂芳基或c1
‑
5的烷氧基。更进一步优选的,r为芳基或c1
‑
5的烷氧基。更进一步优选的,r为苯基或甲氧基。最优选的,r为苯基。ar为芳基、具有取代基的芳基、杂芳基或具有取代基的杂芳基。更进一步优选的,ar为苯基或具有取代基的苯基。更进一步优选的,ar为苯基、甲苯基、二联苯基或氟代苯基、氯代苯基、溴代苯基或碘代苯基。最优选的,ar为苯基。进一步的,一种制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的方法,所述β
‑
羟基
‑
谐二氟磺酰酯类化合物如下式iii所示,由化合物i和化合物ii为反应物,氧分子为氧化剂促进反应得到。其中,r为芳基、具有取代基的芳基、杂芳基、具有取代基的杂芳基或c1
‑
5的烷氧基。更进一步优选的,r为芳基或c1
‑
5的烷氧基。更进一步优选的,r为苯基或甲氧基。最优选的,r为苯基。ar为芳基、具有取代基的芳基、杂芳基或具有取代基的杂芳基。更进一步优选的,ar为苯基或具有取代基的苯基。更进一步优选的,ar为苯基、甲苯基、联苯基或卤代苯基。更进一步优选的,ar为苯基、甲苯基、二联苯基或氟代苯基、氯代苯基、溴代苯基或碘代苯基。最优选的,ar为苯基。其中,所述添加剂为一种或多种质子酸。所述添加剂进一步优选为tfa(三氟乙酸)、pivoh(三甲基乙酸)、acoh(醋酸)中的至少一种。所述添加剂最优选为tfa。其中,
所述溶剂可选自芳香烃类溶剂如苯、甲苯、二甲苯等;脂肪烃类溶剂如戊烷、己烷、辛烷等;脂环烃类溶剂如环己烷、环己酮、甲苯环己酮等;卤化烃类溶剂如氯苯、二氯苯、二氯甲烷、二氯乙烷等;醇类溶剂如甲醇、乙醇、异丙醇等;醚类溶剂如乙醚、环氧丙烷等;酯类溶剂如醋酸甲酯、醋酸乙酯、醋酸丙酯、乙酸乙酯等;酮类溶剂如丙酮、甲基丁酮、甲基异丁酮等;二醇衍生物溶剂如乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;其他类溶剂如乙腈、吡啶、苯酚等。所述溶剂优选自卤化烃类溶剂、酯类溶剂、乙腈中的至少一种。所述溶剂进一步优选为dce(二氯乙烷)、mecn(乙腈)、dcm(二氯甲烷)、乙酸乙酯中的至少一种。所述溶剂最优选为dce。其中,所述反应的温度为50
‑
100℃,进一步优选为50℃。所述反应的时间为10
‑
15h,进一步优选为12h。所述化合物i和化合物ii的摩尔比为1:1.5
‑
4,进一步优选为1:2。所述化合物i和添加剂的摩尔比为1:1
‑
4,进一步优选为1:1。所述化合物i和溶剂的摩尔体积比为0.1
‑
0.5:1(mmol:ml),进一步优选为0.2:1(mmol:ml)。作为一种优选方案,所述方法具体包括以下步骤:将化合物i、化合物ii混合,然后依次加入添加剂,溶剂,加热,在氧气氛围下搅拌反应,分离得化合物iii。所属分离的方法可以采用对于本领域技术人员来说公知乃至周知的方法,例如旋干后用快速柱层析分离。通过上述方法分离得到的化合物iii即使不进行纯化也为充分高纯度,也可以通过水等的溶剂清洗进一步进行高纯度。作为纯化方法,可以采用:对于本领域技术人员来说公知乃至周知的方法即溶剂提取、蒸馏、升华、晶析、硅胶柱色谱法、制备薄层色谱法、制备液相色谱法、溶剂清洗等方法。纯化中使用的溶剂优选从化合物iii不分解的溶剂中选择,可以举出:二氯甲烷、氯仿、1,2
‑
二氯乙烷等卤素系溶剂;苯、甲苯、二甲苯、苯甲醚等芳香族系溶剂;乙醚、叔丁基甲基醚、二异丙基醚、1,2
‑
二甲氧基乙烷等醚系溶剂;甲醇、乙醇、异丙醇等醇系溶剂;庚烷、己烷、环己烷、甲基环己烷等烃系溶剂;乙酸乙酯、乙酸异丙酯、乙酸丁酯等酯系溶剂;乙腈、丙腈等腈系溶剂;和甲基异丁基酮等酮系溶剂、水等。溶剂可以仅为1种也可以为2种以上的混合溶剂。作为溶剂清洗中使用的溶剂,优选水。[术语定义]本说明书中,使用
“‑”
所表示的数值范围表示包含
“‑”
前后所述的数值分别作为最小值和最大值的范围。c1是指,碳数为1,其他数字也同样。“取代基”是公知的取代基,可以从不参与本发明的制造方法中的反应的基团中选择。
“
c1
‑
5的烷氧基”是指基团ro
‑
(此处,r为c1
‑
5的烷基),可以举出:甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、己氧基等。“芳基”是指碳数6~18的芳香族烃的一价基团,可以举出:苯基、萘基、蒽基等。“具有取代基的芳基”是指,前述芳基的氢原子的1个以上被取代基取代而成的基团。作为该取代基,可以举出:从不参与本发明的制造方法中的反应的基团中选择的、c1
‑
8的烷基、c1
‑
8的烷氧基、c3
‑
8的环烷基、c3
‑
8的环烷氧基、卤原子等。作为具有取代基的芳基的例子,可以举出:2
‑
甲基苯基(邻甲苯基)、3
‑
甲基苯基(间甲苯基)、4
‑
甲基苯基(对甲苯基)、2,4
‑
二叔丁基苯基、4
‑
甲氧基苯基、4
‑
氯苯基等。“杂芳基”是指,包含选自由氮原子、氧原子和硫原子组成的组中的至少1个杂原子的、3
‑
10元的1价芳香族杂环基,作为例子,可以举出:呋喃基、苯并呋喃基、二苯并呋喃基、噻吩基、苯并噻吩基、二苯并噻吩基、吡咯基、吲哚基、咔唑基、咪唑基、苯并咪唑基、吡唑基、噁唑基、苯并噁唑基、噻唑基、苯并噻唑基、呋吖基、吡啶基、吡喃基、吡嗪基、嘧啶基、哒嗪基、三嗪基、氮杂卓基(azepinyl)、喹啉基、吲哚啉基、噌啉基、嘌呤基、羰基、邻二氮杂菲基、咪唑并嘧啶基等。“具有取代基的杂芳基”是指,前述杂芳基的氢原子的1个以上被取代基取代而成的基团。作为该取代基,可以举出:从不参与本发明的制造方法中的反应的基团中选择的、c1
‑
8的烷基、c1
‑
8的烷氧基、c3
‑
8的环烷基、c3
‑
8的环烷氧基、卤原子、芳基等。作为“具有取代基的烷基”中的取代基,可以举出:从不参与本发明的制造方法中的反应的基团中选择的、选自由
‑
x
a
、
‑
or
b
、
‑
sr
b
、
‑
n(r
b
)(r
c
)、
‑
si(r
b
)(r
c
)(r
d
)3、
‑
coor
b
、
‑
(c=o)r
b
、
‑
cn和
‑
con(r
b
)(r
c
)组成的组中的基团(其中,r
b
、r
c
、r
d
分别独立地为氢原子或c1
‑
12的烷基。x
a
为氟原子或氯原子)。“卤原子”是指碘原子、溴原子、氯原子或氟原子。与现有技术相比,本发明的有益效果为:本发明提供了一种制备β
‑
羟基
‑
谐二氟磺酰酯类化合物的新方法,简单易于操作,反应底物适用范围广,区域选择性好,收率高,方法新颖、环境友好,在生物科学、制药工业和材料科学方面具有广阔的应用前景。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐明本发明,但下述实施例仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。下述实施例中,若无特殊说明,所用的操作方法均为常规操作方法,所用设备均为常规设备,各个实施例所用设备材料均相同。实施例1将46.0mg(0.2mmol)如下所示的谐二氟烯烃、65.9mg(0.4mmol)苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,78%产率。
1h nmr(400mhz,cdcl3)δ7.79
–
7.74(m,2h),7.59
–
7.55(m,3h),7.47(d,j=14.5hz,6h),7.43(d,j=4.4hz,1h),7.41
–
7.37(m,2h),2.26(s,1h),1.73(s,3h).13c nmr(100mhz,cdcl3)δ141.28,140.44,137.30,136.82,134.49,129.22,128.99,128.00,127.71,127.17,126.84,126.81,123.39(t,j=285.0hz),76.07(t,j=27.0hz),23.67.19f nmr(377mhz,cdcl3)δ
‑
82.31,
‑
82.42.hr
‑
dart
‑
ms(m/z):calcd for c21h22nf2o4s[m nh4] :422.1232,found:422.1231.实施例2将36.8mg(0.2mmol)如下所示的谐二氟烯烃、65.9mg(0.4mmol)苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,63%产率。1h nmr(400mhz,cdcl3)δ7.79(d,j=8.0hz,2h),7.67
–
7.61(m,1h),7.47(t,j=7.8hz,2h),7.35(d,j=8.6hz,2h),6.80(d,j=8.7hz,2h),3.80(s,3h),2.38(s,1h),1.68(s,3h).13c nmr(100mhz,cdcl3)δ159.40,139.95,136.84,134.51,129.25,129.19,128.03,123.38(t,j=285.0hz),118.60,113.88,112.33,76.08(t,j=27.0hz),55.35,23.81.19f nmr(377mhz,cdcl3)δ
‑
82.56,
‑
82.69.hr
‑
gc
‑
ms(m/z):calcd for c16h16f2o5s[m]:358.0687,found:358.0690.实施例3将36.8mg(0.2mmol)如下所示的谐二氟烯烃、65.9mg(0.4mmol)苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,65%产率。1h nmr(400mhz,cdcl3)δ7.80
–
7.76(m,2h),7.66
–
7.60(m,1h),7.46(t,j=7.8hz,2h),7.23
–
7.16(m,1h),7.00(dd,j=7.4,1.9hz,2h),6.85
–
6.81(m,1h),3.75(s,3h),1.68
(s,3h).13c nmr(100mhz,cdcl3)δ159.40,139.95,136.84,134.51,129.25,129.19,128.03,123.38(t,j=285.0hz),118.60,113.88,112.33,76.08(t,j=27.0hz),55.35,23.81.19f nmr(377mhz,cdcl3)δ
‑
82.12,
‑
82.18.hr
‑
gc
‑
ms(m/z):calcd for c16h16f2o5s[m]:358.0687,found:358.0687.实施例4将40.8mg(0.2mmol)如下所示的谐二氟烯烃、65.9mg(0.4mmol)苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,70%产率。1h nmr(400mhz,cdcl3)δ7.88(d,j=1.7hz,1h),7.83
–
7.75(m,2h),7.72(d,j=8.7hz,1h),7.64(d,j=7.8hz,2h),7.55
–
7.48(m,3h),7.44(t,j=7.4hz,1h),7.21(t,j=7.8hz,2h),2.61(s,1h),1.80(s,3h).13c nmr(100mhz,cdcl3)δ136.57,135.66,134.33,133.05,132.77,128.99,128.86,128.55,127.85,127.74,127.51,126.72,126.37,125.91,123.83(t,j=285.0hz),76.32(t,j=27.0hz),23.79.19f nmr(377mhz,cdcl3)δ
‑
82.09,
‑
82.21.hr
‑
gc
‑
ms(m/z):calcd for c19h16f2o4s[m]:378.0737,found:378.0739.实施例5将46.0mg(0.2mmol)如下所示的谐二氟烯烃、71.2mg(0.4mmol)对甲基苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,72%产率。1h nmr(400mhz,cdcl3)δ7.66(d,j=8.1hz,2h),7.59
–
7.55(m,2h),7.49(s,4h),7.45(t,j=7.7hz,2h),7.39
–
7.34(m,1h),7.20(d,j=8.1hz,2h),2.56(s,1h),2.34(s,3h),1.73(s,3h).13c nmr(100mhz,cdcl3)δ145.82,141.21,140.44,137.34,133.80,129.84,128.98,128.11,127.71,127.15,126.84,126.74,123.32(t,j=285.0hz),76.10(t,j=27.0hz),23.73,21.76.19f nmr(377mhz,cdcl3)δ
‑
82.47,
‑
82.57.hr
‑
gc
‑
ms(m/z):calcd for c22h20f2o4s[m]:418.1050,found:418.1055.
实施例6将46.0mg(0.2mmol)如下所示的谐二氟烯烃、96.0mg(0.4mmol)对苯基苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,67%产率。1h nmr(400mhz,cdcl3)δ7.77(d,j=8.3hz,2h),7.56(d,j=8.5hz,2h),7.52
–
7.47(m,6h),7.45
–
7.35(m,8h),2.56(s,1h),1.76(s,3h).13c nmr(100mhz,cdcl3)δ147.33,141.25,140.30,138.75,137.31,135.09,129.24,129.01,128.97,128.53,127.72,127.64,127.44,127.16,126.84,126.72,123.30(t,j=285.0hz),76.12(t,j=27.0hz),23.63.19f nmr(377mhz,cdcl3)δ
‑
82.48,
‑
82.53.hr
‑
gc
‑
ms(m/z):calcd for c27h22f2o4s[m]:480.1207,found:480.1212.实施例7将46.0mg(0.2mmol)如下所示的谐二氟烯烃、72.8mg(0.4mmol)对氟苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,58%产率。1h nmr(400mhz,cdcl3)δ7.80
–
7.75(m,2h),7.59
–
7.56(m,2h),7.53
–
7.44(m,6h),7.40
–
7.35(m,1h),7.08(t,j=8.5hz,2h),2.49(s,1h),1.75(s,3h).
[0051]
13c nmr(100mhz,cdcl3)δ166.12(d,j=258.0hz),141.44,140.31,137.16,132.74(d,j=3.3hz),131.05(d,j=9.8hz),129.05,128.99,127.81,127.17,126.83,123.36(t,j=285.0hz),116.64(d,j=23.0hz),76.06(t,j=27.0hz),23.67.
[0044]
19f nmr(377mhz,cdcl3)δ
‑
82.51,
‑
82.62,
‑
101.38hr
‑
gc
‑
ms(m/z):calcd for c21h17f3o4s[m]:422.0800,found:422.0787.实施例8将46.0mg(0.2mmol)如下所示的谐二氟烯烃、79.2mg(0.4mmol)对氯苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,64%产率。
1h nmr(400mhz,cdcl3)δ7.67(d,j=8.4hz,2h),7.60
–
7.57(m,2h),7.51
–
7.44(m,6h),7.40
–
7.35(m,3h),2.47(s,1h),1.75(s,3h).13c nmr(100mhz,cdcl3)δ141.48,141.32,140.29,137.12,135.21,129.57,129.45,129.05,127.82,127.21,126.83,126.52,123.39(t,j=285.0hz),76.07(t,j=27.0hz),23.66.19f nmr(377mhz,cdcl3)δ
‑
82.38,
‑
82.45.hr
‑
gc
‑
ms(m/z):calcd for c21h17clf2o4s[m]:438.0504,found:438.0503.实施例9将46.0mg(0.2mmol)如下所示的谐二氟烯烃、96.8mg(0.4mmol)对溴苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,61%产率。1h nmr(400mhz,cdcl3)δ7.61
–
7.56(m,4h),7.55
–
7.44(m,8h),7.38(t,j=7.4hz,1h),1.75(s,3h).13c nmr(100mhz,cdcl3)δ141.44,140.26,137.11,135.72,132.55,129.92,129.42,129.04,127.81,127.22,126.83,126.80,123.38(t,j=285.0hz),76.03(t,j=27.0hz),23.61.19f nmr(377mhz,cdcl3)δ
‑
82.38,
‑
82.45.hr
‑
gc
‑
ms(m/z):calcd for c21h17brf2o4s[m]:481.9999,found:482.0003.实施例10将46.0mg(0.2mmol)如下所示的谐二氟烯烃、83.2mg(0.4mmol)对氰基苯亚磺酸钠底物以及溶剂dce(2ml)加入带有搅拌子的反应管中,随后加入22.8mg(0.2mmol)添加剂三氟乙酸,加热至50℃,在氧气氛围下下搅拌12小时,旋干后用快速柱层析分离得到目标产物,56%产率。1h nmr(400mhz,cdcl3)δ7.80(d,j=8.2hz,2h),7.65(d,j=8.3hz,2h),7.59(d,j=7.4hz,2h),7.54
–
7.46(m,6h),7.40(t,j=7.4hz,1h),2.56(s,1h),1.77(s,3h).13c nmr(100mhz,cdcl3)δ141.55,140.78,139.99,136.94,132.89,129.20,128.54,128.01,127.08,126.90,126.78,123.54(t,j=285.0hz),118.03,116.81,75.96
(t,j=27.0hz),23.48.19f nmr(377mhz,cdcl3)δ
‑
82.03,
‑
82.20.hr
‑
gc
‑
ms(m/z):calcd for c22h17f2no4s[m]:429.0846,found:429.0850.上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

