1.本发明涉及一种甘露糖醛酸寡糖的制备方法及其中间体。
背景技术:
2.gv-971是从海洋褐藻胶中分离提取并经降解修饰而成的甘露糖醛酸寡糖混合物,由中国海洋大学、中科院上海药物研究所和上海绿谷制药有限公司联合开发。2005年,孔令娜,耿美玉等人在《药学学报》上发表酸性寡糖971改善阿尔茨海默(ad)模型小鼠学习记忆功能可能与dna损伤修复、神经生长、突触可塑性、免疫应答等相关基因的表达变化有一定关系(acta pharm.sin.,2005,40,1105-1109)。2017年,耿美玉等人在《中国药理学与毒理学杂志》报道gv-971的ⅱ期临床研究结果,其安全性好,能明显改善轻中度ad患者认知功能障碍(chin.j.pharmacol.toxicol.,2017,31,459-460)。2018年7月,gv-971顺利完成临床ⅲ期试验,在认知功能改善的主要疗效指标上达到预期,具有显著的统计学意义和临床意义,且不良反应事件发生率与安慰剂组相当,安全性好,适合长期服用。2018年11月,国家药品监督管理局接受gv-971新药上市申报,并于2019年11月2日正式批准。2019年9月,耿美玉等人利用ad小鼠模型发现,在ad发展进程中,肠道菌群失衡导致外周血中苯丙氨酸和异亮氨酸异常积累,诱导外周促炎性t helper 1(th1)细胞分化和增殖,并促进其脑内侵润。侵润入脑的th1细胞和脑内原有的m1型小胶质细胞共同活化,导致ad相关的神经炎症发生。研究团队认为gv-971治疗ad的作用机制为:通过重塑肠道菌群平衡,降低外周相关代谢产物苯丙氨酸和异亮氨酸的积累,减轻脑内神经炎症,进而改善认知障碍,达到治疗ad的效果(cell res.,2019,29,787-803)。
[0003][0004]
gv-971是一种还原端1位为羧基的甘露糖醛酸寡糖混合物,其结构特征是,该类寡糖由β-d-甘露糖醛酸通过1,4-beta型糖苷键连接,还原端为甘露寡糖二酸氧化断裂的产物。在最初的gv-971制备专利中,是采用菲林试剂进行氧化反应,生产的gv-971的还原端糖环未发生氧化断裂。2017年,新的gv-971合成专利改变了生产工艺,采用臭氧作为氧化剂,此工艺生产的gv-971的还原端糖环发生氧化断裂,结构较为复杂(中国专利申请号:201711482873.0和201711467596.6,结构式如下所示)。
[0005][0006]
在聚糖的合成化学中,构建甘露糖的β-糖苷键是一个难点,因为异头位效应和空
间位阻都倾向于生成α-糖苷键(acc.chem.res.,2010,43,1144-1153)。van der marel和cod
é
e等人发现用甘露糖醛酸给体进行糖苷化反应能够得到优异的β选择性(j.am.chem.soc.,2006,128,13066-13067;j.org.chem.,2009,74,38-47;j.carbohydr.chem.,2011,30,438-457)。然而,目前尚未有对gv-971类寡糖的合成研究的报道。合成结构明确的甘露糖醛酸寡糖可以更好地研究和理解,gv-971对于老年痴呆症的具体作用机制。同肝素类药物磺达肝癸钠一样,未来可能可以使用结构单一的gv-971类化合物作为老年痴呆症药物。
技术实现要素:
[0007]
本发明要解决的技术问题是为了克服甘露糖醛酸寡糖的制备方法单一的缺陷,而提供一种甘露糖醛酸寡糖的制备方法及其中间体。本发明的制备方法合成路线短,条件温和,收率高,生产成本低,可制备任意糖链的甘露糖醛酸寡糖化合物,并且适合工业化放大生产。
[0008]
本发明通过以下技术方案解决上述技术问题。
[0009]
本发明提供一种如式a所示化合物的制备方法,其包括下列步骤:有机溶剂中,在nbs的作用下,将如式ii所示化合物和水进行如下所示的羟基取代反应得到如式a所示化合物;
[0010][0011]
其中,n为0、1、2、3、4、5、6、7或8;
[0012]
r1和r2独立地为r
1-1
独立地为氢、甲氧基、甲基、硝基或卤素;
[0013]
r3独立地为r
3-1
、r
3-2
和r
3-3
独立地为c
1-c4烷基;
[0014]
lg独立地为r5为被一个或多个r
5-1
取代的苯基;r
5-1
独立地为c
1-c4烷基。
[0015]
在某些实施方案中,r1和r2独立地为
[0016]
在某些实施方案中,r
1-1
独立地为氢。
[0017]
在某些实施方案中,当r
1-1
独立地为卤素时,所述的卤素为氟、氯、溴或碘。
[0018]
在某些实施方案中,r
1-1
独立地为氢、4-甲氧基、4-甲基、4-硝基或4-卤素。
[0019]
在某些实施方案中,r
3-1
、r
3-2
和r
3-3
独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基或叔丁基。
[0020]
在某些实施方案中,r
5-1
独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲
丁基或叔丁基,例如甲基。
[0021]
在某些实施方案中,lg处于直立键。
[0022]
在某些实施方案中,所述的如式ii所示化合物为在某些实施方案中,所述的如式ii所示化合物为
[0023]
在所述的羟基取代反应中,所述的有机溶剂可为本领域该类反应常规的有机溶剂,本发明特别优选为酮类溶剂。所述的酮类溶剂可为丙酮。
[0024]
在所述的羟基取代反应中,所述的如式ii所示化合物在所述的有机溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.05mol/l-0.2mol/l,例如0.1mol/l-0.15mol/l,例如0.124mol/l。
[0025]
在所述的羟基取代反应中,所述的nbs与所述的如式ii所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1-10:1,例如2:1-6:1,例如4:1。
[0026]
在所述的羟基取代反应中,所述的水与所述的如式ii所示化合物的体积摩尔比可为本领域该类反应常规的体积摩尔比,本发明特别优选为1:1-10:1l/mol,例如1:1-2:1l/mol,例如1.24:1l/mol。
[0027]
在所述的羟基取代反应中,所述的反应的反应温度可为0到-40℃,例如-10℃到-30℃,例如-20℃。
[0028]
在所述的羟基取代反应中,所述的反应的反应时间可为0.5h-3h,例如0.5h-1.5h,例如1h。
[0029]
在所述的羟基取代反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括淬灭反应、萃取、洗涤、干燥、过滤、浓缩和纯化,得到如式a所示化合物。所述的淬灭反应所使用的试剂可为na2s2o3溶液和nahco3溶液。所述的萃取所使用的试剂可为二氯甲烷。所述的洗涤所使用的试剂可为饱和nacl溶液。所述的干燥所使用的试剂可为无水na2so4。所述的纯化的方式可为快速柱层析。
[0030]
在某些实施方案中,所述的羟基取代反应包括以下步骤:将所述的如式ii所示化合物、所述的有机溶剂和所述的水混合,再和所述的nbs混合进行所述的羟基取代反应即可。
[0031]
本发明提供一种如式b所示化合物的制备方法,其包括下列步骤:有机溶剂中,在碱的作用下,将如式a所示化合物和n-苯基三氟乙酰亚胺氯进行如下所示的亚胺化反应得到如式b所示化合物;
[0032][0033]
其中,n、r1、r2和r3同前所述。
[0034]
在某些实施方案中,所述的如式a所示化合物为
[0035][0036]
在某些实施方案中,所述的如式b所示化合物的制备方法还进一步包括按照上述如式a所示化合物的制备方法制备得到如式a所示化合物的步骤。
[0037]
在所述的亚胺化反应中,所述的有机溶剂可为本领域该类反应常规的有机溶剂,本发明特别优选为酮类溶剂。所述的酮类溶剂可为丙酮。
[0038]
在所述的亚胺化反应中,所述的如式a所示化合物在所述的有机溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.05mol/l-0.2mol/l,例如0.1mol/l-0.15mol/l,例如0.124mol/l。
[0039]
在所述的亚胺化反应中,所述的碱可为本领域该类反应常规的碱,本发明特别优选为碳酸盐。所述的碳酸盐可为碳酸钾。
[0040]
在所述的亚胺化反应中,所述的碱与所述的如式a所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1-2:1,例如1:1-1.5:1,例如1.3:1。
[0041]
在所述的亚胺化反应中,所述的n-苯基三氟乙酰亚胺氯与所述的如式a所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1-2:1,例如1:1-1.3:1,例如1.1:1。
[0042]
在所述的亚胺化反应中,所述的反应的反应温度可为室温。
[0043]
在所述的亚胺化反应中,所述的反应的反应时间可为1h-10h,例如3h-7h,例如5h。
[0044]
在所述的亚胺化反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括过滤和浓缩,得到所述的如式b所示化合物。优选地,所述的后处理步骤包括纯化步骤。
[0045]
在某些实施方案中,所述的亚胺化反应包括以下步骤:将所述的有机溶剂,所述的碱,所述的如式a所示化合物和所述的n-苯基三氟乙酰亚胺氯混合进行所述的亚胺化反应即可。
[0046]
本发明提供一种如式i所示化合物的制备方法,其包括下列步骤:在保护气体,有机溶剂中,在路易斯酸的作用下,将如式b所示化合物和如式iii所示化合物进行如下所示的缩合反应得到如式i所示化合物;
[0047][0048]
其中,n、r1、r2和r3同前所述;
[0049]
m为0、1、2、3、4、5、6、7或8;
[0050]
r4独立地为-s-r
4-1
;r
4-1
独立地为苯基、或、r
4-1-1
取代的苯基;r
4-1-1
独立地为c
1-c4烷基。
[0051]
在某些实施方案中,r
4-1-1
独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0052]
在某些实施方案中,所述的如式b所示化合物为
[0053][0054]
在某些实施方案中,所述的如式iii所示化合物为在某些实施方案中,所述的如式iii所示化合物为
[0055]
在某些实施方案中,所述的如式i所示化合物的制备方法还进一步包括按照上述如式b所示化合物的制备方法制备得到如式b所示化合物的步骤。
[0056]
在所述的缩合反应中,所述的保护气体可为本领域该类反应常规的保护气体,本发明特别优选为氩气。
[0057]
在所述的缩合反应中,所述的有机溶剂可为本领域该类反应常规的有机溶剂,本发明特别优选为卤代烃类溶剂,例如干燥的卤代烃类溶剂。所述的卤代烃类溶剂可为二氯甲烷,例如干燥二氯甲烷。
[0058]
在所述的缩合反应中,所述的如式b所示化合物在所述的有机溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.05mol/l-0.2mol/l,例如0.1mol/l-0.15mol/l,例如0.124mol/l。
[0059]
在所述的缩合反应中,所述的路易斯酸可为本领域该类反应常规的路易斯酸,本发明特别优选为三氟甲磺酸、tmsotf、tesotf、tbsotf、au-l-otf、au-l-ntf2、nis中的一种或多种,其中,l为三苯基膦、三丁基膦、三乙基膦或三金刚烷基膦。所述的路易斯酸进一步优选为tbsotf。
[0060]
在所述的缩合反应中,所述的路易斯酸与所述的如式b所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为0.001:1-2:1,例如0.1:1-0.5:1,例如0.2:1。
[0061]
在所述的缩合反应中,所述的如式iii所示化合物与所述的如式b所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为0.5:1-10:1,例如1:1-1.3:1,例如1.06:1。
[0062]
在所述的缩合反应中,所述的反应的反应温度可为-78℃到-30℃,例如-30℃到-50℃,例如-40℃。
[0063]
在所述的缩合反应中,所述的反应的反应时间可为1h-10h,例如3h-7h,例如5h。
[0064]
在某些实施方案中,在所述的缩合反应中,所述的反应的体系为无水体系。
[0065]
在所述的缩合反应中,所述的如式b所示化合物和如式iii所示化合物可为干燥的如式b所示化合物和如式iii所示化合物。所述的干燥的方式可为将所述的如式b所示化合物和如式iii所示化合物混合,甲苯带水三次,抽干。
[0066]
在所述的缩合反应中,所述的反应的体系中还可进一步包括干燥剂。所述的干燥剂优选为分子筛(例如酸洗的分子筛)、分子筛(例如酸洗的分子筛)、分子筛(例如酸洗的分子筛)、无水硫酸钠、无水硫酸钙、无水硫酸铜和无水硫酸镁中的一种或多种,进一步优选为活化的分子筛。所述的干燥剂和所述的如式b所示化合物的质量比可为1:1-3:1,例如5:3。
[0067]
在某些实施方案中,所述的缩合反应包括以下步骤:在所述的保护气体下,将所述的有机溶剂、所述的如式b所示化合物、所述的干燥剂和所述的如式iii所示化合物混合,再和所述的路易斯酸混合进行缩合反应即可。
[0068]
所述的缩合反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括淬灭反应、过滤、浓缩和纯化,得到如式i所示化合物。所述的淬灭反应所使用的试剂可为三乙胺。所述的纯化的方式可为快速柱层析。
[0069]
本发明提供一种如式c所示化合物的制备方法,其包括下列步骤:有机溶剂中,在nbs的作用下,将如式i所示化合物和水进行反应得到如式c所示化合物;
[0070][0071]
其中,n、m、r1、r2、r3和r4同前所述。
[0072]
在某些实施方案中,所述的如式i所示化合物为在某些实施方案中,所述的如式i所示化合物为
[0073]
在某些实施方案中,所述的如式c所示化合物的制备方法还进一步包括按照上述如式i所示化合物的制备方法制备得到如式i所示化合物的步骤。
[0074]
在所述的如式c所示化合物的制备方法中,所述的有机溶剂可为本领域该类反应常规的有机溶剂,本发明特别优选为酮类溶剂。所述的酮类溶剂可为丙酮。
[0075]
在所述的如式c所示化合物的制备方法中,所述的如式i所示化合物在所述的有机溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.05mol/l-0.2mol/l,例如0.05mol/l-0.12mol/l,例如0.095mol/l。
[0076]
在所述的如式c所示化合物的制备方法中,所述的nbs与所述的如式i所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1-10:1,例如2:1-6:1,例如4:1。
[0077]
在所述的如式c所示化合物的制备方法中,所述的水与所述的如式i所示化合物的体积摩尔比可为本领域该类反应常规的体积摩尔比,本发明特别优选为0.1:1-10:1,例如0.6:1-2:1,例如1.05:1l/mol。
[0078]
在所述的如式c所示化合物的制备方法中,所述的反应的反应温度可为0到-40℃,例如-10℃到-30℃,例如-20℃。
[0079]
在所述的如式c所示化合物的制备方法中,所述的反应的反应时间可为0.5h-3h,例如0.5h-1.5h,例如1h。
[0080]
在所述的如式c所示化合物的制备方法中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括淬灭反应、萃取、洗涤、干燥、过滤、浓缩和纯化,得到如式c所示化合物。所述的淬灭反应所使用的试剂可为na2s2o3溶液和nahco3溶液。所述的萃取所使用的试剂可为乙酸乙酯。所述的洗涤所使用的试剂可为饱和nacl溶液。所述的干燥所使用的试剂可为无水na2so4。所述的纯化的方式可为快速柱层析。
[0081]
在某些实施方案中,所述的如式c所示化合物的制备方法包括以下步骤:将所述的如式i所示化合物、所述的有机溶剂和所述的水混合,再和所述的nbs混合进行反应即可。
[0082]
本发明提供一种如式iv所示化合物的制备方法,其包括下列步骤:在保护气体下,有机溶剂中,在氧化剂的作用下,将如式c所示化合物进行如下所示的氧化反应,得到如式iv所示化合物;
[0083][0084]
其中,n、m、r1、r2和r3同前所述。
[0085]
在某些实施方案中,所述的如式c所示化合物为
[0086][0087]
在某些实施方案中,所述的如式iv所示化合物的制备方法还进一步包括按照上述如式c所示化合物的制备方法制备得到如式c所示化合物的步骤。
[0088]
在所述的氧化反应中,所述的保护气体可为本领域该类反应常规的保护气体,本发明特别优选为氩气。
[0089]
在所述的氧化反应中,所述的有机溶剂可为本领域该类反应常规的有机溶剂,本发明特别优选为砜类溶剂,例如二甲亚砜。
[0090]
在所述的氧化反应中,所述的如式c所示化合物在所述的有机溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.05mol/l-0.5mol/l,例如0.1mol/l-0.25mol/l,例如0.173mol/l。
[0091]
在所述的氧化反应中,所述的氧化剂可为本领域该类反应常规的氧化剂,本发明特别优选为二甲亚砜和乙酸酐的混合物;所述的混合物中二甲亚砜和乙酸酐的体积比可为10:1-2:1(例如11:3.6)。当氧化剂为二甲亚砜和乙酸酐的混合物时,所述的二甲亚砜可为所述的溶剂。
[0092]
在所述的氧化反应中,所述的氧化剂与所述的如式c所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1-40:1,例如15:1-25:1,例如20:1。
[0093]
在所述的氧化反应中,所述的反应的反应温度可为室温。
[0094]
在所述的氧化反应中,所述的反应的反应时间可为10h-48h,例如20h-30h,例如24h。
[0095]
在所述的氧化反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括淬灭反应、萃取、水洗、洗涤、干燥、过滤、浓缩和纯化,得到如式iv所示化合物。所述的淬灭反应所使用的试剂可为水。所述萃取所使用的试剂可为乙酸乙酯。所述的洗涤所使用的试剂可为饱和nahco3溶液和饱和nacl溶液。所述的干燥所使用的试剂可为无水na2so4。所述的纯化的方式可为快速柱层析。
[0096]
在某些实施方案中,所述的氧化反应包括以下步骤:将所述的溶剂,所述的氧化剂和所述的如式c所示化合物混合进行反应即可。
[0097]
本发明提供一种如式v所示化合物的制备方法,其包括下列步骤:溶剂中,在氟化氢吡啶络合物的作用下,将如式iv所示化合物进行如下所示的脱保护基反应得到如式v所
示化合物,
[0098][0099]
其中,n、m、r1、r2和r3同前所述。
[0100]
在某些实施方案中,所述的如式iv所示化合物为在某些实施方案中,所述的如式iv所示化合物为
[0101]
在某些实施方案中,所述的如式v所示化合物的制备方法还包括按照上述的如式iv所示化合物的制备方法制备得到如式iv所示化合物的步骤。
[0102]
在脱保护基反应中,所述的溶剂可为本领域该类反应常规的溶剂,本发明特别优选为醚类溶剂。所述的醚类溶剂可为四氢呋喃。
[0103]
在脱保护基反应中,所述的如式iv所示化合物在所述的溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.01mol/l-1mol/l,例如0.05mol/l-0.2mol/l,例如0.1mol/l。
[0104]
在脱保护基反应中,所述的氟化氢吡啶络合物与所述的如式iv所示化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为2:1-20:1,例如7:1-12:1,例如9:1。
[0105]
在脱保护基反应中,所述的反应的反应温度可为10℃到80℃,例如20℃到60℃,例如40℃。
[0106]
在脱保护基反应中,所述的反应的反应时间可为10h-36h,例如15h-25h,例如20h。
[0107]
在脱保护基反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括淬灭反应、萃取、洗涤、干燥、过滤、浓缩和纯化。所述的淬灭反应所使用的试剂可为饱和nahco3溶液。所述的萃取所使用的试剂可为二氯甲烷。所述的洗涤所使用的试剂可为饱和nacl溶液。所述的干燥所使用的试剂可为无水na2so4。所述的纯化的方式可为快速柱层析。
[0108]
在某些实施方案中,所述的脱保护基反应,其包括以下步骤:将所述的如式iv所示化合物和所述的溶剂混合,再和所述的氟化氢吡啶络合物混合进行反应即可。
[0109]
本发明提供一种如式d所示化合物的制备方法,其包括下列步骤:溶剂中,在催化
剂和氢源的作用下,将如式v所示化合物进行氢化反应得到如式d所示化合物;
[0110][0111]
其中,n、m、r1和r2同前所述。
[0112]
在某些实施方案中,所述的如式v所示化合物为在某些实施方案中,所述的如式v所示化合物为在某些实施方案中,所述的如式v所示化合物为
[0113]
在某些实施方案中,所述的如式d所示化合物的制备方法还包括按照上述的如式v所示化合物的制备方法制备得到如式v所示化合物的步骤。
[0114]
在所述的氢化反应中,所述的溶剂可为本领域该类反应常规的溶剂,本发明特别优选为醚类溶剂、水、醇类溶剂和有机酸类溶剂。所述的醚类溶剂可为四氢呋喃。所述的醇类溶剂可为叔丁醇。所述的有机酸类溶剂可为乙酸。所述的醚类溶剂、水、醇类溶剂和有机酸类溶剂的体积比可为5:5:1:0.1。
[0115]
在所述的氢化反应中,所述的如式v所示化合物在所述的溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.01mol/l-0.2mol/l,例如0.03mol/l-0.07mol/l,例如0.047mol/l。
[0116]
在所述的氢化反应中,所述的催化剂可为本领域该类反应常规的催化剂,本发明特别优选为钯碳和氢氧化钯碳。所述的钯碳可为含水量为55%的10%钯碳。所述的氢氧化钯碳可为含水量为50%的10%氢氧化钯碳。
[0117]
在所述的氢化反应中,所述的催化剂与所述的如式v所示化合物的质量摩尔比可为本领域该类反应常规的质量摩尔比,本发明特别优选为100:1g/mol-400:1g/mol,例如230:1g/mol-290:1g/mol,例如256:1g/mol。
[0118]
在所述的氢化反应中,所述的氢源可为本领域该类反应常规的氢源,本发明特别优选为氢气。所述的反应可在氢气氛围下进行,所述的反应的压力可为1atm。
[0119]
在所述的氢化反应中,所述的反应的反应温度可为室温。
[0120]
在所述的氢化反应中,所述的反应的反应时间可为10h-48h,例如20h-30h,例如24h。
[0121]
在所述的氢化反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括过滤和浓缩。
[0122]
在某些实施方案中,所述的氢化反应包括以下步骤:将所述的如式v所示化合物、所述的溶剂和所述的催化剂混合,在氢源下反应即可。
[0123]
本发明提供一种如式vi所示化合物的制备方法,其包括下列步骤:溶剂中,在碱的作用下,将如式d所示化合物进行如下所示的水解反应得到如式vi所示化合物;
[0124][0125]
其中,n、m同前所述,m
为氢离子或金属阳离子。
[0126]
在某些实施方案中,所述的如式d所示化合物为
[0127][0128]
在某些实施方案中,所述的如式vi所示化合物的制备方法还包括按照上述的如式d所示化合物的制备方法制备得到如式d所示化合物的步骤。
[0129]
在某些实施方案中,当m
为金属阳离子时,所述的金属阳离子为钠离子、钾离子或钙离子。
[0130]
所述的水解反应中,所述的溶剂可为本领域该类反应常规的溶剂,本发明特别优选为水。
[0131]
所述的水解反应中,所述的如式d所示化合物在所述的溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.01mol/l-0.2mol/l,例如0.03mol/l-0.07mol/l,例如0.062mol/l。
[0132]
所述的水解反应中,所述的碱可为本领域该类反应常规的碱,本发明特别优选为m
oh-,其中m
为所述的金属阳离子。所述的m
oh-可为氢氧化钠,例如1m的氢氧化钠。
[0133]
所述的水解反应中,所述的反应的体系的ph可为12~13。
[0134]
所述的水解反应中,所述的反应的反应温度可为室温。
[0135]
所述的水解反应中,所述的反应的反应时间可为10h-48h,例如20h-30h,例如24h。
[0136]
所述的水解反应中,所述的反应结束后还可进一步包括后处理步骤。所述的后处理步骤包括调节反应体系至中性,过滤,浓缩,重结晶,离心,洗涤和干燥。所述的调节反应体系至中性所使用的试剂可为h
离子交换树脂(例如型号50wx4,200-400目的h
离子交换树脂)。所述的重结晶所使用的试剂可为水和甲醇。所述的洗涤所使用的试剂可为甲醇。所述的干燥的方式可为晾干。
[0137]
在某些实施方案中,所述的水解反应包括以下步骤:将所述的如式d所示化合物、所述的溶剂和所述的碱混合反应即可。
[0138]
本发明还提供了一种如式vi所示化合物的制备方法,其包括下列步骤:
[0139][0140]
其中,n、lg、r1、r2、r3、m、r4、m
同前所述。
[0141]
在某些实施方案中,所述的如式a所示化合物、如式b所示化合物、如式i所示化合物、如式c所示化合物、如式iv所示化合物、如式v所示化合物、如式d所示化合物和如式vi所示化合物的制备条件同前所述。
[0142]
本发明提供了如式vi所示化合物,
[0143][0144]
其中,n和m同前所述;m
为金属阳离子。
[0145]
在某些实施方案中,所述的如式vi所示化合物为在某些实施方案中,所述的如式vi所示化合物为
[0146]
本发明提供了如式v所示化合物,
[0147][0148]
其中,n、m、r1和r2同前所述。
[0149]
在某些实施方案中,所述的如式v所示化合物为在某些实施方案中,所述的如式v所示化合物为
[0150]
本发明提供了如式iv所示化合物,
[0151][0152]
其中,n、m、r1、r2和r3同前所述。
[0153]
在某些实施方案中,所述的如式iv所示化合物为在某些实施方案中,所述的如式iv所示化合物为
[0154]
本发明提供了如式iii所示化合物,
[0155][0156]
m、r1、r2和r4同前所述。
[0157]
在某些实施方案中,所述的如式iii所示化合物为
[0158][0159]
本发明提供了如式ii所示化合物,
[0160][0161]
n、lg、r1、r2和r3同前所述。
[0162]
在某些实施方案中,所述的如式ii所示化合物为
[0163][0164]
本发明提供了如式i所示化合物,
[0165][0166]
其中,n、m、r1、r2、r3和r4同前所述。
[0167]
在某些实施方案中,所述的如式i所示化合物为在某些实施方案中,所述的如式i所示化合物为
[0168]
本发明提供了如式a所示化合物,
[0169][0170]
其中,n、r1、r2和r3同前所述。
[0171]
在某些实施方案中,所述的如式a所示化合物为
[0172][0173]
本发明提供了如式b所示化合物,
[0174][0175]
其中,n、r1、r2和r3同前所述。
[0176]
在某些实施方案中,所述的如式b所示化合物为
[0177][0178]
本发明提供了如式c所示化合物,
[0179][0180]
其中,n、m、r1、r2和r3同前所述。
[0181]
在某些实施方案中,所述的如式c所示化合物为
[0182][0183]
本发明提供了如式d所示化合物,
[0184][0185]
其中,n和m同前所述。
[0186]
在某些实施方案中,所述的如式d所示化合物为
[0187][0188]
本发明中,当m
中的“ ”应理解为和m的价态一致。例如当m为ca时,“ ”应当理解为“2 ”,即m
应当理解为m
2
。
[0189]
本发明中,室温为10℃到30℃。
[0190]
本发明中,糖基给体是通过将糖环的异头位(1位)衍生化得到糖苷化给体,方便进行糖苷化反应,进行糖链的拼接。
[0191]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0192]
本发明所用试剂和原料均市售可得。
[0193]
本发明的积极进步效果在于:本发明的制备方法合成路线短,条件温和,收率高,生产成本低,可制备任意糖链的甘露糖醛酸寡糖化合物,并且适合工业化放大生产。
具体实施方式
[0194]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0195]
实施例1化合物1-2的合成
[0196][0197]
以d-甘露糖为原料制备化合物1-1,具体可参照文献(org.lett.2011,13,16,4360-4363)。
[0198]
将1-1(14.7g,31.5mmol)溶于二氯甲烷(160ml)中,加入水(80ml)。冰浴冷却后,依次加入tempo(984mg,6.3mmol)和二乙酸碘苯(25.4g,78.8mmol),室温反应2h。冰浴下缓慢加入na2s2o3溶液淬灭,分出有机相,水相用1m盐酸酸化至ph=3,二氯甲烷萃取三次。合并有机相用饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩得到黄色糖浆(收率66%),直接用于下一步反应。esi-hrms理论值c
27
h
28
o6sna[m na]
503.1499,实测值503.1500。
[0199]
将上一步得到的黄色糖浆溶于干燥dmf(150ml)中,加入碳酸氢钾(7.9g,78.8mmol)和溴化苄(5.6ml,47.3mmol),室温反应过夜。缓慢滴加醋酸淬灭,水洗,乙酸乙酯萃取多次,合并有机相依次用饱和nahco3溶液和饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到黄色糖浆1-2(11.5g,单步97%)。
[0200]
化合物1-2:[α]
d25
=46.3(c 0.9,chcl3);1h nmr(500mhz,cdcl3)δ7.40
–
7.27(m,16h),7.05
–
7.01(m,2h),5.57(d,j=2.3hz,1h),5.22(q,j=12.4hz,2h),4.73
–
4.55(m,5h),4.44(t,j=9.0hz,1h),3.96(t,j=2.7hz,1h),3.74(dd,j=9.0,3.0hz,1h),2.33(s,3h);
13
c nmr(125mhz,cdcl3)δ169.79,138.05,138.03,137.81,135.33,132.43,129.93,129.80,128.68,128.58,128.50,128.44,128.23,128.06,127.98,127.95,127.89,86.50,78.35,75.75,72.60,72.40,68.67,67.29,21.24;esi-hrms理论值c
34
h
34
o6sna[m na]
593.1968,实测值593.1971。
[0201]
实施例2化合物1-3的合成
[0202]
[0203]
氩气保护下,将化合物1-2(8.7g,15.2mmol)溶于干燥二氯甲烷(100ml)中,冰浴下依次滴加2,6-二甲基吡啶(3.5ml,30.5mmol)和tbsotf(4.6ml,19.8mmol),室温反应3h。加甲醇淬灭,饱和nahco3溶液和饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到无色糖浆1-3(10.2g,98%)。
[0204]
化合物1-3:[α]
d25
=35.2(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.47(d,j=7.9hz,2h),7.35
–
7.24(m,15h),7.03
–
6.99(m,2h),5.68(d,j=7.6hz,1h),5.05(m,2h),4.61(d,j=11.9hz,1h),4.53
–
4.42(m,5h),3.81(dd,j=7.7,2.7hz,1h),3.58(dd,j=5.7,2.7hz,1h),2.32(s,3h),0.82(s,9h),0.02(s,3h),-0.05(s,3h);
13
c nmr(125mhz,cdcl3)δ169.39,138.12,138.00,137.13,135.50,132.06,129.97,129.63,128.58,128.45,128.39,128.35,128.28,128.17,128.04,127.82,127.80,76.62,73.84,72.49,69.87,66.96,25.82,21.22,18.06,-4.71,-5.10;esi-hrms理论值c
40
h
48
o6ssina[m na]
707.2833,实测值707.2834。
[0205]
实施例3化合物1-4的合成
[0206][0207]
将化合物1-3(10.2g,14.9mmol)溶于丙酮(120ml)中,加入水(12ml),降至-20℃,分批加入n-溴代丁二酰亚胺(10.6g,59.6mmol),保持-20℃反应1h。加入na2s2o3溶液和nahco3溶液淬灭,二氯甲烷萃取三次,合并有机相用饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到性状为白色固体的半缩醛(收率99%,esi-hrms理论值c
33
h
42
o7sina[m na]
601.2592,实测值601.2594),用于下一步给体的制备。
[0208]
氩气保护下,将上述半缩醛溶于丙酮(120ml)中,加入碳酸钾(2.68g,19.4mmol)和n-苯基三氟乙酰亚胺氯(2.4ml,16.4mmol),室温反应5h。滤去固体,浓缩得到性状为无色糖浆的给体(收率98%,esi-hrms理论值c
41
h
46
no7f3sina[m na]
772.2888,实测值772.2891),直接用于糖苷化反应。
[0209]
将上述给体和受体1-2(9.0g,15.8mmol)混合,甲苯带水三次,抽干。氩气保护下,溶于干燥二氯甲烷(120ml)中,加入活化的ms(15g),降至-40℃下搅拌20min,加入tbsotf(0.68ml,2.98mmol),保持-40℃反应4h。加三乙胺淬灭,滤去固体,浓缩,快速柱层析分离,得到无色糖浆1-4(14.7g,收率90%)和α异构体1-4-α(1.1g,收率6.7%)。
[0210]
化合物1-4:[α]
d25
=2.8(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.42
–
7.38(m,2h),7.37
–
7.34(m,2h),7.33
–
7.15(m,28h),6.91(d,j=8.0hz,2h),5.68(d,j=8.3hz,1h),5.17(d,j=12.4hz,1h),5.09(d,j=12.4hz,1h),4.98
–
4.86(m,2h),4.73(d,j=12.2hz,1h),4.62(s,1h),4.56(d,j=12.3hz,1h),4.54
–
4.48(m,3h),4.47
–
4.29(m,6h),4.07(s,1h),3.85(dd,j=2.9,0.9hz,1h),3.82(d,j=8.7hz,1h),3.67(dd,j=8.4,2.7hz,1h),3.26(dd,j=9.0,2.8hz,1h),2.23(s,3h),0.81(s,9h),0.01(d,j=6.6hz,6h);
13
c nmr
(150mhz,cdcl3)δ169.13,168.24,138.85,138.14,137.99,137.97,137.06,135.29,135.25,131.92,129.89,129.58,128.66,128.63,128.60,128.47,128.43,128.38,128.35,128.23,128.13,127.98,127.85,127.73,127.67,127.65,127.62,127.42,101.33,82.81,81.33,77.56,76.15,74.80,74.17,73.77,73.11,71.94,71.16,69.07,67.23,67.15,25.93,21.18,18.18,-3.85,-5.10;esi-hrms理论值c
67
h
74
o
12
ssina[m na]
1153.4562,实测值1153.4566。
[0211]
化合物1-4-α:[α]
d25
=32.1(c 1.4,chcl3);1h nmr(500mhz,cdcl3)δ7.49(d,j=7.6hz,2h),7.37
–
7.15(m,30h),7.02(d,j=7.9hz,2h),5.71(d,j=7.3hz,1h),5.43(d,j=5.7hz,1h),5.13(d,j=12.2hz,1h),5.05
–
4.96(m,2h),4.94
–
4.84(m,2h),4.71(m,1h),4.56
–
4.30(m,9h),4.25(d,j=4.5hz,1h),3.91
–
3.78(m,2h),3.61(ddd,j=13.0,5.8,2.7hz,2h),2.28(s,3h),0.81(s,9h),-0.01(s,3h),-0.05(s,3h);
13
c nmr(125mhz,cdcl3)δ169.28,168.83,138.54,138.10,138.03,137.87,137.04,135.54,135.50,132.00,129.95,129.59,128.52,128.42,128.33,128.24,128.19,128.06,127.82,127.69,127.65,127.57,127.54,99.13,78.44,76.04,75.26,74.86,74.36,72.93,72.39,72.15,72.08,69.75,66.90,66.87,25.83,21.15,18.08,-4.64,-5.11;esi-hrms理论值c
67
h
74
o
12
ssina[m na]
1153.4562,实测值1153.4567。
[0212]
实施例4化合物1-5的合成
[0213][0214]
将化合物1-4(2.15g,1.9mmol)溶于丙酮(20ml)中,加入水(2ml),降至-20℃,分批加入n-溴代丁二酰亚胺(1.35g,7.6mmol),保持-20℃反应1h。加入na2s2o3溶液和nahco3溶液淬灭,乙酸乙酯萃取三次,合并有机相用饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到白色泡沫状固体的半缩醛(收率99%,esi-hrms理论值c
60
h
68
o
13
sina[m na]
1047.4321,实测值1047.4324),用于下一步氧化。
[0215]
氩气保护下,将上述半缩醛溶于dmso(11ml)中,滴加乙酸酐(3.6ml),室温反应过夜。乙酸乙酯稀释,水洗三次,饱和nahco3溶液和饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到白色固体1-5(1.88g,收率97%)。
[0216]
化合物1-5:[α]
d25
=-29.3(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.37
–
7.15(m,30h),5.15(d,j=12.3hz,1h),5.05(d,j=12.3hz,1h),4.96(d,j=12.3hz,1h),4.89
–
4.78(m,3h),4.69(d,j=1.6hz,1h),4.62
–
4.53(m,5h),4.50
–
4.30(m,6h),3.88(d,j=7.6hz,1h),3.85(dd,j=2.7,1.5hz,1h),3.35(dd,j=8.2,2.7hz,1h),0.85(s,9h),0.05(d,j=8.7hz,6h);
13
c nmr(125mhz,cdcl3)δ168.76,168.04,167.48,138.34,137.89,137.63,137.54,135.21,134.98,128.67,128.59,128.51,128.44,128.41,128.37,128.36,128.32,128.28,128.14,127.82,127.79,127.78,127.76,127.74,127.73,127.47,100.91,80.55,
78.49,77.33,76.52,74.51,73.94,73.58,73.52,73.26,71.75,69.20,67.63,67.16,25.89,18.13,-4.02,-5.07;esi-hrms理论值c
60
h
66
o
13
sina[m na]
1045.4165,实测值1045.4169。
[0217]
实施例5化合物1-6的合成
[0218][0219]
将化合物1-5(1.88g,1.84mmol)溶于四氢呋喃(18ml)中,冰浴冷却,滴加氟化氢吡啶络合物(1.5ml),滴加完毕后,升至40℃反应20h。冰浴下,缓慢加入到饱和nahco3溶液中淬灭,二氯甲烷萃取三次,合并有机相用饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到无色糖浆1-6(1.56g,93%)。
[0220]
化合物1-6:[α]
d25
=-43.0(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.39
–
7.17(m,28h),7.14(m,2h),5.24(d,j=12.1hz,1h),5.14(d,j=12.1hz,1h),4.93(m,2h),4.77
–
4.72(m,2h),4.68
–
4.59(m,4h),4.57
–
4.47(m,4h),4.42
–
4.37(m,2h),4.31(t,j=9.5hz,1h),4.22(d,j=11.5hz,1h),3.81(d,j=2.9hz,1h),3.77(d,j=9.6hz,1h),3.34(dd,j=9.4,2.9hz,1h),3.07(s,1h);
13
c nmr(125mhz,cdcl3)δ168.87,168.64,167.35,138.11,137.85,137.52,137.42,134.88,134.80,128.81,128.80,128.68,128.64,128.58,128.50,128.46,128.33,128.32,128.31,128.25,128.12,128.04,127.91,127.86,127.82,101.90,80.17,78.89,77.48,77.20,75.03,74.68,74.27,74.21,73.72,73.25,72.45,68.27,67.76,67.68;esi-hrms理论值c
54
h
52
o
13
na[m na]
931.3300,实测值931.3303。
[0221]
实施例6化合物1-7的合成
[0222][0223]
将化合物1-6(1.42g,1.56mmol)溶于四氢呋喃/水/叔丁醇/乙酸(15/15/3/0.3ml)的混合溶剂中,加入10%钯碳(含55%水,200mg)和10%氢氧化钯碳(含50%水,200mg)。体系抽换氢气三次,在1atm的氢气氛围下室温反应24h。滤去固体,浓缩后直接用于下一步反应,收率97%。产物esi-hrms理论值c
12
h
14
o
13
[m-2h]
2-183.0223,实测值183.0217。
[0224]
将上一步化合物1-7-1溶于水(25ml)中,滴加1m氢氧化钠水溶液调节体系ph至12~13,室温反应过夜。加h
离子交换树脂(50wx4,200-400mesh)中和,过滤,旋干,用水(5ml)溶解,加甲醇析出固体,离心,甲醇洗涤,晾干得到白色固体1-7(670mg,收率98%)。
[0225]
化合物1-7:[α]
d25
=-51.3(c 1.0,h2o);1h nmr(500mhz,d2o)δ4.27(d,j=6.3hz,1h),4.18(d,j=8.5hz,1h),4.14(dd,j=6.3,1.8hz,1h),4.03(d,j=3.1hz,1h),3.90(dd,j=8.6,1.8hz,1h),3.78
–
3.65(m,3h);
13
c nmr(125mhz,d2o)δ179.77,178.60,176.28,
98.89,77.44,75.43,72.65,72.39,71.82,71.47,70.62,68.59;esi-hrms理论值c
12
h
16
o
14
[m-3na h]
2-192.0276,实测值192.0269。
[0226]
实施例7化合物1-8的合成
[0227][0228]
将化合物1-4(3.0g,2.65mmol)溶于四氢呋喃(25ml)中,冰浴冷却,滴加氟化氢吡啶络合物(2.2ml),滴加完毕后,升至40℃反应32h。冰浴下,缓慢加入到饱和nahco3溶液中淬灭,二氯甲烷萃取三次,合并有机相用饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到无色糖浆1-8(2.65g,98%)。
[0229]
化合物1-8:[α]
d25
=-13.2(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.45
–
7.38(m,4h),7.37
–
7.14(m,28h),6.92(d,j=7.9hz,2h),5.72(d,j=8.3hz,1h),5.24(d,j=12.2hz,1h),5.15(d,j=12.2hz,1h),4.97
–
4.86(m,2h),4.75(d,j=12.2hz,1h),4.66
–
4.42(m,10h),4.31(t,j=9.5hz,1h),4.17(s,1h),3.86(d,j=2.9hz,1h),3.81
–
3.72(m,2h),3.32(dd,j=9.5,3.0hz,1h),2.97(s,1h),2.23(s,3h);
13
c nmr(125mhz,cdcl3)δ169.07,168.98,138.46,138.12,137.89,137.89,137.09,135.17,135.04,131.96,129.77,129.56,128.70,128.61,128.58,128.48,128.45,128.40,128.37,128.30,128.06,128.04,127.94,127.81,127.72,127.65,101.76,80.10,76.65,75.20,74.49,74.00,73.14,71.93,71.85,68.18,67.47,67.25,21.14;esi-hrms理论值c
61
h
60
o
12
sna[m na]
1039.3698,实测值1039.3703。
[0230]
实施例8化合物1-9的合成
[0231][0232]
参考化合物1-4的制备方式,由二糖给体和二糖受体1-8制备化合物1-9(8.4g)和α异构体1-9-α(1g)。
[0233]
第一步收率97%,esi-hrms理论值c
60
h
68
o
13
sina[m na]
1047.4321实测值1047.4325。第二步收率99%,esi-hrms理论值c
68
h
72
no
13
f3sina[m na]
1218.4617,实测值1218.4622。第三步化合物1-9收率82%,α异构体1-9-α9%。
[0234]
化合物1-9:[α]
d25
=-26.5(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.43(d,j=8.0hz,2h),7.41
–
7.13(m,55h),6.94(d,j=7.9hz,2h),5.71(d,j=8.0hz,1h),5.13
–
5.05(m,3h),5.03(d,j=12.5hz,1h),4.96(d,j=12.3hz,1h),4.90(d,j=12.1hz,1h),4.86(d,
j=12.1hz,1h),4.82
–
4.64(m,8h),4.63
–
4.24(m,17h),4.11(s,1h),3.81(d,j=8.8hz,1h),3.77(d,j=3.0hz,1h),3.76
–
3.72(m,2h),3.64(d,j=3.0hz,1h),3.62(d,j=9.4hz,1h),3.51(d,j=9.2hz,1h),3.44(dd,j=9.1,2.9hz,1h),3.21(dd,j=9.1,2.9hz,1h),2.97(dd,j=9.2,2.8hz,1h),2.25(s,3h),0.83(s,9h),-0.01(d,j=1.9hz,6h);
13
c nmr(125mhz,cdcl3)δ169.05,168.26,168.17,167.83,139.34,139.16,139.08,138.91,138.52,138.18,138.06,137.96,137.04,135.43,135.36,135.18,135.15,131.91,129.85,129.54,128.76,128.71,128.62,128.59,128.54,128.44,128.42,128.36,128.30,128.28,128.26,128.23,128.19,128.13,128.11,128.08,128.00,127.92,127.66,127.60,127.58,127.50,127.48,127.47,127.36,127.27,127.22,127.14,102.48,102.00,101.08,81.40,79.32,79.10,77.51,77.27,77.24,76.49,76.31,75.30,75.11,75.01,74.57,74.52,74.36,74.17,73.54,73.05,73.03,72.76,72.00,70.72,68.79,67.19,67.10,66.87,66.85,25.88,21.14,18.11,-3.90,-5.18;maldi-hrms理论值c
121
h
126
o
24
ssina[m na]
2045.8021,实测值2045.8057。
[0235]
化合物1-9-α:[α]
d25
=-4.1(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.41
–
7.05(m,57h),6.88(d,j=7.9hz,2h),5.69(d,j=8.4hz,1h),5.50(s,1h),5.14
–
4.99(m,4h),4.96
–
4.84(m,4h),4.79(d,j=12.2hz,1h),4.69
–
4.48(m,8h),4.47
–
4.24(m,14h),4.14(d,j=6.4hz,1h),4.10(s,1h),3.99(s,1h),3.87(s,1h),3.80(d,j=2.8hz,1h),3.76(d,j=2.8hz,1h),3.67(dd,j=8.4,2.7hz,1h),3.61(d,j=9.0hz,1h),3.56(dd,j=4.7,2.8hz,1h),3.37(d,j=6.7hz,2h),3.06(d,j=8.0hz,1h),2.20(s,3h),0.79(s,9h),-0.03(d,j=2.6hz,6h);
13
c nmr(125mhz,cdcl3)δ169.10,169.07,168.20,167.65,139.12,138.92,138.57,138.54,138.15,137.96,137.92,136.92,135.55,135.48,135.29,135.21,131.81,129.92,129.51,128.67,128.60,128.57,128.50,128.43,128.41,128.38,128.31,128.28,128.25,128.20,128.18,128.17,128.11,128.00,127.94,127.80,127.68,127.65,127.60,127.56,127.52,127.48,127.41,127.32,127.17,101.94,100.68,99.24,81.35,80.43,77.38,76.67,76.34,76.11,75.82,74.83,74.59,74.25,74.11,73.80,73.27,73.01,72.99,72.36,71.76,71.64,70.83,68.90,67.16,66.97,66.92,25.89,21.13,18.12,-3.88,-5.17;maldi-hrms理论值c
121
h
126
o
24
ssina[m na]
2045.8021,实测值2045.8097。
[0236]
实施例9化合物1-10的合成
[0237][0238]
参考化合物1-5的制备方式,制备化合物1-10(1.76g)。第一步收率95%,maldi-hrms理论值c
114
h
120
o
25
sina[m na]
1939.7780,实测值1939.7811。第二步收率98%。
[0239]
化合物1-10:[α]
d25
=-39.7(c 0.9,chcl3);1h nmr(500mhz,cdcl3)δ7.42
–
7.15(m,61h),5.13
–
5.01(m,4h),4.96(d,j=12.3hz,1h),4.90(d,j=11.7hz,1h),4.85
–
4.26(m,
28h),3.90(d,j=7.2hz,1h),3.77(t,j=2.2hz,1h),3.75(d,j=2.8hz,1h),3.70(d,j=9.1hz,1h),3.67(d,j=2.9hz,1h),3.61(dd,j=7.9,2.7hz,1h),3.55(d,j=9.2hz,1h),3.30(dd,j=9.0,2.8hz,1h),3.01(dd,j=9.2,2.8hz,1h),0.82(s,9h),-0.01(s,6h);
13
c nmr(126mhz,cdcl3)δ168.85,168.31,168.14,167.79,167.56,139.30,139.08,138.92,138.78,138.08,138.07,137.76,137.59,135.36,135.34,135.08,134.99,128.81,128.80,128.78,128.64,128.57,128.49,128.41,128.41,128.34,128.33,128.31,128.30,128.26,128.20,128.16,128.15,128.13,127.99,127.84,127.82,127.76,127.72,127.68,127.60,127.54,127.42,127.34,127.21,102.47,101.87,100.50,81.49,79.20,78.49,77.99,77.47,77.31,77.21,76.67,76.17,75.31,74.69,74.67,74.61,74.44,74.41,74.38,73.71,73.47,73.41,73.16,73.08,70.88,68.84,67.62,67.25,67.01,66.96,25.90,18.14,-3.87,-5.14;maldi-hrms理论值c
114
h
118
o
25
sina[m na]
1937.7624,实测值1937.7659。
[0240]
实施例10化合物1-11的合成
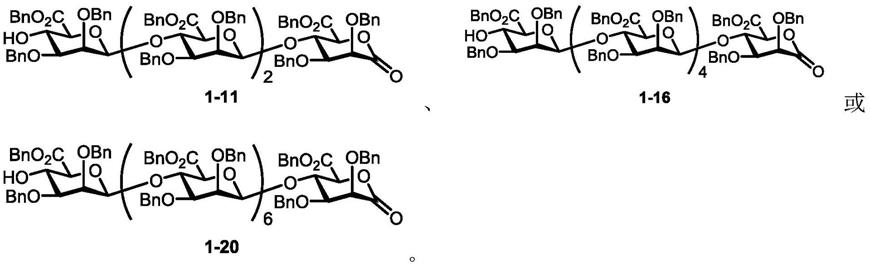
[0241][0242]
参考化合物1-6的制备方式,制备化合物1-11(1.53g,94%)。
[0243]
化合物1-11:[α]
d25
=-55.1(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.43
–
7.13(m,55h),5.16
–
5.01(m,4h),4.99
–
4.30(m,29h),4.20(t,j=9.6hz,1h),3.92(d,j=7.2hz,1h),3.81
–
3.70(m,4h),3.63(d,j=6.0hz,1h),3.50(d,j=9.6hz,1h),3.39(dd,j=9.0,2.9hz,1h),3.13(dd,j=9.5,2.9hz,1h),2.81(s,1h);
13
c nmr(125mhz,cdcl3)δ169.17,168.83,168.09,167.80,167.55,138.99,138.89,138.74,138.15,138.08,137.76,137.59,135.24,135.24,135.07,134.99,128.81,128.79,128.74,128.72,128.61,128.59,128.58,128.56,128.54,128.41,128.39,128.38,128.34,128.32,128.31,128.26,128.21,128.16,128.12,128.10,127.93,127.83,127.75,127.70,127.69,127.55,127.46,127.44,127.43,127.41,127.38,102.33,101.95,100.50,80.35,79.30,78.48,78.03,77.27,77.18,76.67,75.74,75.14,75.10,75.03,74.70,74.67,74.39,74.34,73.70,73.47,73.40,73.06,72.68,71.70,68.17,67.61,67.26,67.17,67.10;maldi-hrms理论值c
108
h
104
o
25
na[m na]
1823.6759,实测值1823.6782。
[0244]
实施例11化合物1-12的合成
[0245][0246]
参考化合物1-7的制备方式,制备化合物1-12(586mg)。第一步收率86%,esi-hrms理论值c
24
h
30
o
25
[m-2h]
2-359.0544,实测值359.0535。第二步收率97%。
[0247]
化合物1-12:[α]
d25
=-107.4(c 0.6,h2o);1h nmr(500mhz,d2o)δ4.83(s,1h),4.68(s,1h),4.64(s,1h),4.28(d,j=5.8hz,1h),4.17(d,j=8.2hz,1h),4.13(dd,j=5.8,
1.8hz,1h),4.09(d,j=3.3hz,1h),4.07(d,j=3.3hz,1h),4.00(d,j=3.6hz,1h),3.95
–
3.87(m,3h),3.82
–
3.75(m,4h),3.74
–
3.64(m,3h);
13
c nmr(150mhz,d2o)δ179.54,178.46,176.04,175.36,175.28,100.04,99.98,98.82,78.02,77.88,77.68,75.87,75.85,75.68,72.63,72.54,71.94,71.86,71.42,71.33,70.37,70.22,69.92,68.47;esi-hrms理论值c
24
h
31
o
26
[m-5na 2h]
3-245.0373,实测值245.0377。
[0248]
实施例12化合物1-13的合成
[0249][0250]
参考化合物1-8的制备方式,制备化合物1-13(2.12g,96%)。
[0251]
化合物1-13:[α]
d25
=-36.2(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.48
–
7.13(m,57h),6.94(d,j=7.9hz,2h),5.71(d,j=8.0hz,1h),5.16
–
4.29(m,31h),4.20(t,j=9.6hz,1h),4.11(s,1h),3.83(d,j=8.8hz,1h),3.78(d,j=2.9hz,1h),3.76
–
3.72(m,2h),3.71
–
3.67(m,2h),3.50
–
3.44(m,2h),3.30(dd,j=9.1,2.9hz,1h),3.10(dd,j=9.5,2.9hz,1h),2.82(s,1h),2.26(s,3h);
13
c nmr(125mhz,cdcl3)δ169.19,169.08,168.16,167.88,139.07,139.03,139.01,138.86,138.51,138.19,138.15,137.97,137.08,135.32,135.27,135.19,135.15,131.92,129.86,129.56,128.74,128.70,128.65,128.60,128.59,128.56,128.52,128.43,128.37,128.36,128.34,128.33,128.30,128.27,128.20,128.11,128.01,127.94,127.90,127.82,127.80,127.68,127.51,127.41,127.39,127.32,127.29,102.33,102.10,101.10,80.29,79.41,79.13,77.31,77.26,76.32,76.08,75.11,75.05,74.99,74.68,74.56,74.19,73.57,73.05,72.76,72.57,72.02,71.58,68.12,67.21,67.15,67.12,66.99,21.15;maldi-hrms理论值c
115
h
112
o
24
sna[m na]
1931.7156,实测值1931.7105。
[0252]
实施例13化合物1-14的合成
[0253][0254]
参考化合物1-4的制备方式,由二糖给体和四糖受体1-13制备化合物1-14(865mg)和α异构体1-14-α(70mg)。第一步收率97%,esi-hrms理论值c
60
h
68
o
13
sina[m na]
1047.4321实测值1047.4325。第二步收率99%,esi-hrms理论值c
68
h
72
no
13
f3sina[m na]
1218.4617,实测值1218.4622。第三步化合物1-14收率89%和α异构体1-14-α收率7%。
[0255]
化合物1-14:[α]
d25
=-43.0(c 1.0,chcl3);1h nmr(500mhz,chloroform-d)δ7.52
–
7.09(m,85h),6.97(d,j=7.9hz,2h),5.74(d,j=7.9hz,1h),5.17
–
4.19(m,48h),4.14(s,1h),3.86(d,j=8.8hz,1h),3.80(d,j=2.9hz,1h),3.79
–
3.74(m,2h),3.70(d,j=2.9hz,
1h),3.68
–
3.64(m,2h),3.62(d,j=3.0hz,1h),3.59
–
3.46(m,4h),3.28(dd,j=9.2,2.9hz,1h),3.18(dd,j=9.2,2.9hz,1h),3.13(dd,j=9.3,2.9hz,1h),2.97(dd,j=9.2,2.8hz,1h),2.29(s,3h),0.86(s,9h),0.02(d,j=2.4hz,6h);
13
c nmr(126mhz,cdcl3)δ169.06,168.28,168.19,168.08,168.04,167.88,139.36,139.31,139.23,139.17,139.15,139.14,139.06,138.87,138.52,138.19,138.08,137.98,137.06,135.51,135.37,135.35,135.29,135.20,135.16,131.93,129.87,129.55,128.73,128.72,128.65,128.63,128.62,128.59,128.57,128.55,128.53,128.44,128.42,128.35,128.31,128.28,128.25,128.22,128.20,128.18,128.11,128.09,128.00,127.91,127.89,127.83,127.82,127.66,127.59,127.58,127.51,127.46,127.39,127.34,127.30,127.27,127.26,127.21,127.17,127.13,102.50,102.15,102.10,102.07,101.10,81.38,79.59,79.48,79.19,79.13,77.51,77.37,77.28,77.22,76.51,76.43,76.36,75.24,75.07,74.63,74.60,74.55,74.36,74.19,73.55,73.06,72.88,72.86,72.78,72.74,72.03,70.68,68.78,67.18,67.13,66.96,66.86,66.83,66.73,25.88,21.13,18.11,-3.90,-5.18;maldi-hrms理论值c
175
h
178
o
36
ssina[m na]
2938.1480,实测值2938.1445。
[0256]
化合物1-14-α:[α]
d25
=-24.9(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.50
–
7.03(m,83h),6.93(d,j=7.8hz,2h),5.70(d,j=8.1hz,1h),5.46(s,1h),5.14
–
4.18(m,47h),4.12
–
4.06(m,2h),3.86
–
3.77(m,3h),3.76(d,j=2.9hz,1h),3.72(dd,j=8.1,2.5hz,1h),3.69(d,j=2.6hz,1h),3.64
–
3.54(m,5h),3.45
–
3.40(m,1h),3.18(dd,j=9.0,2.3hz,1h),3.08
–
3.01(m,2h),2.25(s,3h),0.82(s,9h),-0.01(s,6h);
13
c nmr(125mhz,cdcl3)δ169.18,169.11,168.25,168.21,167.89,167.63,139.26,139.17,139.12,139.09,138.96,138.71,138.59,138.25,138.04,138.04,137.10,135.68,135.61,135.46,135.37,135.25,135.21,131.96,129.94,129.58,128.75,128.70,128.67,128.63,128.61,128.58,128.51,128.45,128.42,128.39,128.34,128.34,128.32,128.29,128.27,128.23,128.21,128.19,128.17,128.13,128.04,128.00,127.96,127.90,127.77,127.69,127.63,127.58,127.52,127.39,127.33,127.29,127.25,127.24,127.23,127.14,102.25,102.16,102.04,101.12,99.25,81.40,81.22,79.30,79.15,77.67,77.32,76.59,76.44,76.39,75.69,75.24,75.17,74.77,74.63,74.34,74.32,74.23,73.36,73.10,72.99,72.82,72.37,72.08,71.32,70.77,68.92,67.22,67.14,66.97,66.89,66.86,25.93,21.17,18.16,-3.85,-5.13;maldi-hrms理论值c
175
h
178
o
36
ssina[m na]
2938.1480,实测值2938.1521。
[0257]
实施例14化合物1-15的合成
[0258][0259]
参考化合物1-5的制备方式,制备化合物1-15(726mg)。第一步收率96%,maldi-hrms理论值c
168
h
172
o
37
sina[m na]
2832.1239,实测值2832.1233。第二步收率99%
[0260]
化合物1-15:[α]
d25
=-58.6(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.45
–
7.13(m,
90h),5.12
–
4.71(m,25h),4.69(s,1h),4.67
–
4.40(m,15h),4.39
–
4.33(m,4h),4.32
–
4.20(m,5h),3.94(d,j=7.2hz,1h),3.80(t,j=2.2hz,1h),3.77
–
3.71(m,3h),3.68(d,j=2.9hz,1h),3.67
–
3.63(m,1h),3.63
–
3.58(m,2h),3.54(d,j=9.5hz,1h),3.50(d,j=9.2hz,1h),3.37(dd,j=9.0,2.6hz,1h),3.21(dd,j=9.2,2.8hz,1h),3.13(dd,j=9.2,2.9hz,1h),2.96(dd,j=9.2,2.8hz,1h),0.85(s,9h),0.01(d,j=2.1hz,6h);
13
c nmr(126mhz,cdcl3)δ168.82,168.29,168.16,168.01,167.99,167.76,167.51,139.31,139.25,139.14,139.09,139.07,139.05,138.83,138.68,138.04,138.01,137.70,137.53,135.46,135.32,135.27,135.15,135.01,134.93,128.77,128.75,128.73,128.67,128.63,128.59,128.53,128.43,128.38,128.31,128.29,128.28,128.25,128.24,128.23,128.22,128.13,128.12,128.09,127.92,127.84,127.83,127.82,127.79,127.73,127.67,127.56,127.53,127.46,127.41,127.36,127.33,127.30,127.26,127.24,127.18,127.16,127.13,102.47,102.11,102.05,101.93,100.48,81.31,79.47,79.43,79.14,78.44,77.98,77.48,77.34,77.29,77.09,76.63,76.44,76.35,75.92,75.21,75.04,75.02,74.60,74.58,74.49,74.41,74.34,74.28,73.67,73.42,73.36,73.03,72.91,72.88,72.79,70.64,68.74,67.59,67.24,67.06,66.87,66.73,25.86,18.09,-3.91,-5.20;maldi-hrms理论值c
168
h
170
o
37
sina[m na]
2830.1082,实测值2830.1078。
[0261]
实施例15化合物1-16的合成
[0262][0263]
参考化合物1-6的制备方式,制备化合物1-16(592mg,95%)。
[0264]
化合物1-16:[α]
d25
=-67.9(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.46
–
7.15(m,82h),5.17
–
4.27(m,49h),4.22(t,j=9.5hz,1h),3.95(d,j=7.2hz,1h),3.82(t,j=2.3hz,1h),3.78
–
3.72(m,3h),3.71
–
3.60(m,5h),3.49(d,j=9.6hz,1h),3.38(dd,j=9.0,2.6hz,1h),3.24(dt,j=9.2,2.7hz,2h),3.11(dd,j=9.5,2.9hz,1h);
13
c nmr(125mhz,cdcl3)δ169.15,168.77,168.11,168.02,167.97,167.75,167.48,139.16,139.06,139.04,139.02,138.98,138.82,138.67,138.11,138.01,137.69,137.52,135.33,135.25,135.22,135.14,135.00,134.92,128.74,128.72,128.65,128.63,128.58,128.55,128.50,128.46,128.35,128.30,128.28,128.26,128.22,128.20,128.15,128.11,128.07,128.06,127.89,127.80,127.78,127.76,127.73,127.70,127.65,127.62,127.50,127.39,127.34,127.32,127.28,127.26,127.21,127.18,102.27,102.12,102.10,101.89,100.45,80.21,79.45,79.39,79.23,78.41,77.96,77.29,77.23,77.09,76.60,76.27,76.02,75.93,75.01,74.92,74.60,74.57,74.54,74.39,74.31,73.67,73.40,73.33,73.01,72.89,72.74,72.36,71.47,68.05,67.55,67.21,67.04,66.87,66.83;maldi-hrms理论值c
162
h
156
o
37
na[m na]
2716.0218,实测值2716.0201。
[0265]
实施例16化合物1-17的合成
[0266][0267]
参考化合物1-7的制备方式,制备化合物1-17(196mg)。第一步收率79%,esi-hrms理论值c
36
h
45
o
37
[m-3h]
3-356.3885,实测值356.3871。第二步收率97%。
[0268]
化合物1-17:[α]
d25
=-73.7(c 1.0,h2o);1h nmr(500mhz,d2o)δ4.82(s,1h),4.68(s,1h),4.66(s,2h),4.64(s,1h),4.28(d,j=5.9hz,1h),4.16(d,j=8.3hz,1h),4.14
–
4.11(m,1h),4.09(d,j=3.3hz,1h),4.07
–
4.03(m,3h),3.99(d,j=3.2hz,1h),3.95
–
3.85(m,5h),3.82
–
3.63(m,11h);
13
c nmr(150mhz,d2o)δ179.58,178.47,176.04,175.36,175.27,175.23,100.04,99.97,99.90,98.83,78.05,77.88,77.76,77.68,75.87,75.85,75.77,75.69,72.61,72.54,71.96,71.78,71.43,71.34,71.28,70.37,70.23,69.92,69.90,68.47;esi-hrms理论值c
36
h
46
o
38
[m-7na 3h]
4-271.5422,实测值271.5392。
[0269]
实施例17化合物1-18的合成
[0270][0271]
参考化合物1-4的制备方式,由四糖给体和四糖受体1-13制备化合物1-18(3.84g)。第一步收率96%,maldi-hrms理论值c
114
h
120
o
25
sina[m na]
1939.7780,实测值1939.7747。第二步收率99%,maldi-hrms理论值c
122
h
124
no
25
f3sina[m na]
2110.8076,实测值2110.8024。第三步收率95%。
[0272]
化合物1-18:[α]
d25
=-52.4(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.49
–
7.08(m,111h),6.96(d,j=8.1hz,2h),5.73(d,j=8.0hz,1h),5.15
–
4.17(m,64h),4.13(s,1h),3.85(d,j=8.7hz,1h),3.79(d,j=2.8hz,1h),3.78
–
3.73(m,2h),3.69(d,j=2.9hz,1h),3.68
–
3.44(m,11h),3.27(dd,j=9.1,2.5hz,1h),3.20
–
3.08(m,4h),2.96(dd,j=9.2,2.9hz,1h),2.28(s,3h),0.84(s,9h),0.00(d,j=2.2hz,6h);
13
c nmr(125mhz,cdcl3)δ169.06,168.30,168.20,168.08,168.05,167.88,139.35,139.31,139.24,139.22,139.21,139.17,139.14,139.13,139.11,139.04,138.85,138.50,138.17,138.08,137.96,137.07,135.50,135.36,135.34,135.33,135.27,135.18,135.15,131.92,129.84,129.55,128.73,128.72,128.66,128.63,128.59,128.57,128.55,128.44,128.36,128.32,128.29,128.25,128.22,128.11,128.10,128.00,127.92,127.89,127.83,127.82,127.79,127.68,127.59,127.57,127.51,127.46,127.41,127.34,127.31,127.30,127.24,127.17,127.13,127.12,
102.50,102.17,102.11,102.08,101.10,81.34,79.57,79.46,79.44,79.16,79.13,77.51,77.37,77.27,76.47,76.41,76.33,75.22,75.05,75.01,74.62,74.59,74.52,74.36,74.19,73.52,73.04,72.86,72.84,72.77,72.69,72.68,72.66,72.02,70.65,68.77,67.20,67.14,66.97,66.87,66.81,66.72,25.88,21.15,18.11,-3.90,-5.19;maldi-hrms理论值c
229
h
230
o
48
ssina[m na]
3830.4939,实测值3830.4919。
[0273]
实施例18化合物1-19的合成
[0274][0275]
参考化合物1-5的制备方式,制备化合物1-19(1.42g)。第一步收率78%,maldi-hrms理论值c
222
h
224
o
49
sina[m na]
3724.4698,实测值3724.4502。第二步收率96%。
[0276]
化合物1-19:[α]
d25
=-66.3(c 1.1,chcl3);1h nmr(500mhz,cdcl3)δ7.46
–
7.07(m,111h),5.11
–
4.14(m,66h),3.92(d,j=7.2hz,1h),3.78(s,1h),3.74
–
3.44(m,13h),3.34(dd,j=9.0,2.8hz,1h),3.20(dd,j=9.2,2.9hz,1h),3.17
–
3.06(m,3h),2.93(dd,j=9.2,2.9hz,1h),0.82(s,9h),-0.02(d,j=1.8hz,6h);
13
c nmr(125mhz,cdcl3)δ168.84,168.32,168.20,168.08,168.07,168.05,168.01,167.78,167.54,139.34,139.31,139.23,139.20,139.17,139.13,139.10,139.09,139.06,138.85,138.70,138.08,138.02,137.73,137.55,135.50,135.35,135.33,135.29,135.17,135.03,134.95,128.80,128.77,128.75,128.70,128.68,128.64,128.62,128.60,128.55,128.45,128.41,128.33,128.32,128.31,128.28,128.26,128.25,128.23,128.16,128.14,128.12,127.94,127.85,127.81,127.80,127.75,127.70,127.59,127.57,127.47,127.44,127.39,127.36,127.33,127.30,127.29,127.27,127.24,127.19,127.15,127.13,102.50,102.16,102.08,101.96,100.51,81.33,79.50,79.47,79.44,79.15,78.48,78.00,77.51,77.36,77.34,77.12,76.66,76.45,76.40,76.33,76.30,75.94,75.21,75.04,75.02,74.99,74.63,74.60,74.51,74.43,74.37,74.31,73.70,73.46,73.39,73.07,72.93,72.87,72.78,72.69,70.65,68.76,67.62,67.27,67.09,66.93,66.89,66.83,66.74,25.88,18.12,-3.90,-5.19;maldi-hrms理论值c
222
h
222
o
49
sina[m na]
3722.4541,实测值3722.4368。
[0277]
实施例19化合物1-20的合成
[0278][0279]
参考化合物1-6的制备方式,制备化合物1-20(1.11g,92%)。
[0280]
化合物1-20:[α]
d25
=-70.3(c 1.0,chcl3);1h nmr(500mhz,cdcl3)δ7.49
–
7.14(m,107h),5.18
–
4.19(m,66h),3.96(d,j=7.1hz,1h),3.83(s,1h),3.79
–
3.54(m,12h),3.49(d,j=9.6hz,1h),3.39(dd,j=9.0,2.8hz,1h),3.28
–
3.15(m,4h),3.12(dd,j=9.5,2.9hz,1h);
13
c nmr(125mhz,cdcl3)δ169.16,168.76,168.12,168.04,168.02,167.97,167.74,167.47,139.19,139.16,139.08,139.06,139.06,139.05,139.03,139.02,138.98,
138.82,138.67,138.10,138.00,137.68,137.51,135.34,135.29,135.25,135.22,135.13,135.00,134.91,128.73,128.72,128.65,128.61,128.59,128.58,128.56,128.55,128.49,128.45,128.35,128.29,128.27,128.25,128.21,128.19,128.14,128.10,128.06,127.88,127.79,127.78,127.76,127.74,127.73,127.69,127.64,127.62,127.50,127.38,127.34,127.33,127.31,127.28,127.25,127.23,127.19,127.17,127.14,127.13,102.27,102.12,101.89,100.46,80.20,79.45,79.41,79.39,79.20,78.41,77.95,77.36,77.30,77.23,77.09,76.61,76.29,76.01,75.91,74.99,74.97,74.91,74.59,74.58,74.53,74.38,74.31,73.66,73.39,73.33,73.01,72.88,72.73,72.64,72.61,72.31,71.44,68.04,67.55,67.20,67.03,66.87,66.81;maldi-hrms理论值c
216
h
208
o
49
na[m na]
3608.3676,实测值3608.3700。
[0281]
实施例20化合物1-21的合成
[0282][0283]
参考化合物1-7的制备方式,制备化合物1-21(296mg)。第一步收率67%,esi-hrms理论值c
48
h
59
o
49
[m-5h]
5-283.8430,实测值283.8401。第二步收率91%。
[0284]
化合物1-21:[α]
d25
=-94.7(c 1.0,h2o);h nmr(500mhz,d2o)δ4.83(s,1h),4.68(s,1h),4.66(s,4h),4.64(s,1h),4.28(d,j=5.7hz,1h),4.17(d,j=8.1hz,1h),4.15
–
4.12(m,1h),4.09(d,j=3.4hz,1h),4.08
–
4.03(m,5h),4.00(d,j=3.2hz,1h),3.96
–
3.87(m,7h),3.82
–
3.65(m,15h);
13
c nmr(150mhz,d2o)δ179.54,178.45,176.04,175.37,175.27,175.24,100.02,99.95,99.87,98.81,77.98,77.83,77.71,75.88,75.84,75.76,75.68,72.64,72.55,71.93,71.87,71.41,71.32,71.27,70.36,70.23,69.91,68.47;esi-hrms理论值c
48
h
57
o
50
na3[m-6na]
6-250.3607,实测值250.3558。
[0285]
对比实施例1
[0286][0287]
将原料(122mg,0.125mmol)溶于四氢呋喃(2ml)中,加入tbaf(1m,0.25ml,0.25mmol),室温反应5h。二氯甲烷稀释,饱和nahco3溶液和饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到无色糖浆(45mg,76%)。esi-hrms理论值c
28
h
28
o5sna[m na]
499.1550,实测值499.1555。
[0288]
对比实施例2
[0289][0290]
氩气保护下,将水合肼(24μl,0.5mmol)与吡啶(0.15ml)、醋酸(0.1ml)混合均匀,
冰浴下滴加到原料(150mg,0.175mmol)的吡啶(2ml)溶液中,室温反应3h。加丙酮淬灭,二氯甲烷稀释,水洗,饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到产物(48mg,35%)。esi-hrms理论值c
42
h
48
n2o
13
na[m na]
811.3049,实测值811.3052。
[0291]
对比实施例3
[0292][0293]
将原料a’(20mg,0.026mmol)溶于四氢呋喃(1ml)中,慢慢加入事先混合好的30%双氧水(0.5ml)和1m lioh(2ml),室温搅拌12h。加入酸性树脂中和。抽滤,浓缩,hplc分离产物b’(8%),esi-hrms理论值c
40
h
41
o
14
[m-h]-745.2502,实测值745.2495;产物c’(26%),esi-hrms理论值c
20
h
21
o7[m-h]-373.1293,实测值373.1289;产物d’(21%),esi-hrms理论值c
20
h
19
o7[m-h]-371.1136,实测值371.1131。
[0294]
对比实施例4
[0295][0296]
将原料(53mg,0.061mmol)溶于四氢呋喃(3ml)中,冰浴冷却,滴加氟化氢吡啶络合物(0.2ml),滴加完毕后,维持0℃反应12h,再升至室温反应36h。冰浴下,缓慢加入到饱和nahco3溶液中淬灭,二氯甲烷萃取三次,合并有机相用饱和nacl溶液洗涤,无水na2so4干燥,抽滤,浓缩,快速柱层析分离,得到白色固体(6mg,12%)。esi-hrms理论值c42h44o13na[m na]
779.2674,实测值779.2674。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

