1.本发明涉及农业和动物检疫技术领域,具体涉及一种隐孢子虫、贾第虫、微孢子虫和溶组织阿米巴的检测方法,尤其涉及一种基于蜂巢芯片的高通量检测多种肠道原虫的多重pcr检测方法及试剂盒。此外,本发明涉及用于同时检测隐孢子虫、贾第虫、微孢子虫和溶组织阿米巴的特异性引物。
背景技术:
2.隐孢子虫、蓝氏贾第鞭毛虫(简称贾第虫)、毕氏肠微孢子虫和溶组织阿米巴为人兽共患新发肠道原虫,主要介水传播,引起消耗性腹泻,是全球面临的重要公共卫生问题,也是人类迄今为止面临的最困难的问题之一;可暴发流行,造成严重的突发公共卫生事件。人的感染主要是摄入被卵囊/包囊等污染的饮水和食物,引起的疾病以腹泻为主要临床症状,呈全球分布,也是艾滋病患者死亡的主要病因之一。免疫功能正常人群感染,常可引起急性、自限性腹泻,婴幼儿、免疫功能缺陷或免疫抑制人群感染,可引起慢性消耗性腹泻,甚至死亡。该类疾病可从动物传播到人,人传播到动物,并在动物与动物、人与人之间广泛传播,造成重大经济影响。每年全球有250万5岁以下的儿童因包括肠道原虫在内的肠道病原体感染引起的腹泻而死亡。
3.我国隐孢子虫感染率为0.5~13.5%,贾第虫感染率为2.52%,阿米巴感染率为3.55~4.5%,微孢子虫感染率为0.23~13.49%。其中隐孢子虫病已被who列入全球六大腹泻病之一,于1986年将隐孢子虫作为aids(艾滋病)患者的一项怀疑指标,并被who和美国cdc列入新发传染病,隐孢子虫病越来越引起关注,已被列为美国政府生物恐怖制剂名单的第三位(https://wwwn.cdc.gov/foodborneoutbreaks/default.aspx ),也是其中唯一的一种寄生虫病原。同时隐孢子虫也是美国foodnet食源性疾病监测十大病原之一,位列第二;而隐孢子虫和贾第虫是我国《生活饮用水卫生标准》水质必检指标之一,也是我国国家科技重大专项——国家传染病监测技术平台监测的病原。有资料显示只要含有1个卵囊就可引起隐孢子虫病传播流行。
4.贾第虫病被列为世界危害人类健康的10种主要寄生虫病之一。2004年世界卫生组织(who)将其归为一种容易被忽视的疾病(neglected diseases,nd)。我国首例贾第虫病病例在1924年由kessel等报道,人体贾第虫感染率由第1次(1988~1992年)全国寄生虫调查的2.52%,降低到第3次(2014~2015年)全国寄生虫调查的0.60%。在农村,污染源主要来自患病的人或动物的粪便及其污水以及供水系统管道年久失修,管壁泄漏将污物吸入管内造成的饮用自来水二次污染。在城市,主要是饮用水过滤消毒工艺无法彻底消除水中的贾第虫包囊,即使用过滤设备净化的自来水,由于包囊可改变形态,仍然可以穿过滤膜,存在于饮用水中。蔡炯等对成都5个原水和9个自来水的研究结果表明:原水中均检出贾第虫,密度为l~45个/10l;自来水中贾第虫检出率为22%,密度为1个/100 l。
5.全球约有5000万人感染溶组织内阿米巴,每年4~11万人死于阿米巴病,死亡率在寄生虫病中仅次于疟疾和血吸虫病,位居第三位。目前,我国人群溶组织内阿米巴感染率总
体呈现下降趋势,感染率由第1次(1988~1992年)全国寄生虫调查时的0.949%,降至第3次(2014~2015年)的0.06%(包括迪斯帕内阿米巴)。但是在一些省份和直辖市人群中抗溶组织内阿米巴抗体的阳性率为1.06%至14.39%;我国某些省市hiv/aids患者血清中抗溶组织内阿米巴抗体的阳性率明显高于非hiv感染者。
6.微孢子虫病是呈世界性分布,人体最常见的毕氏肠微孢子虫。1959年,subayasi等在日本首次报道了人体感染病例,证明了微孢子虫对人的致病性。发达国家hiv阳性腹泻患者的感染率为2%~78%;发展中国家,hiv阳性腹泻成人和儿童的感染率分别为2.5%~51%和17.4%~76.9%。1995年在香港首次发现我国人体微孢子虫感染病例,1997年再次在广州发现人体病例。2011年在吉林省首次发现人体毕氏肠微孢子虫感染病例,迄今,已在黑龙江、河南、吉林、河南、湖北、重庆、广西、云南及上海共8个省(直辖市)报道人体感染,调查人群主要为腹泻人群和艾滋病患者,感染率为0.2%~22.5%。
7.目前针对隐孢子虫、贾第虫和溶组织阿米巴原虫的检测基本仍采用形态学为主,易漏检、误检。微孢子虫的流行病学检测则以普通的pcr检测为主。然而快速检测工具的缺乏,无检测试剂盒,更无高通量检测技术,严重制约了对这类新发肠道原虫的监测和研究。
8.20世纪90年代发展起来的微流体学科是指操作微小网络通道(5-500微米)中流体的科学技术,是分子生物学技术、微加工技术、机械制造技术、计算机技术等多种现代技术的发展与融合,是基于大规模平行处理生物信息分子原理的微型装置,具有信息通量大、自动化、系统化的特点;其中微流体芯片用于操作,传输微升(10μl)至毫微微升(10mμl )量级的流体,可将生化反应的若干步骤包括上样、反应、检测、分析等集成在一块或几块微流体芯片上,其微通道孔径只有微米级大小,具有浓缩和富集的作用,可加速反应缩短测试时间,从而大大降低了测试成本。和常规的实验技术相比,上述技术极大降低了试剂的消耗量(至少3个数量级)、同时分析产生的废液极少;在微小范围内的能量传递、物质分散更快更均匀,热能传导快,也更易实现各种操控,因此反应快、收率高,污染少、成本低。目前,微流控芯片已从分离检测发展为包括复杂试样前处理的高功能全分析系统;从分析工具发展到包括在线检测的微型化学反应与合成手段。在微流控芯片上进行分子核酸分析,将微流控芯片的分析能力和核酸反应的特异性相结合,能有效的克服核酸的交叉污染的缺点,使得反应效率提高,操作步骤简化,检验时间缩短,样品、试剂和能量消耗大大降低。所述用于分子核酸分析的微流控芯片是运用微加工技术建立微米级的免疫反应空间,由于尺寸上的减小,加快了反应动力学过程,使得基于生物大分子扩散控制的免疫反应速度提高几个数量级。微流控芯片多种功能结合与集成化的特点也使微流控芯片上的分子生物学检测与常规巢式pcr核酸检测相比有很多潜在的优势,因此受到越来越多的关注。
9.伴随着分子生物学技术的发展,基于不同的分子标识,可实现对该类肠道原虫的检测和鉴定。但单一虫种检测,成本昂贵,费时费力。自2000年日本学者notomi在nucleic acids res杂志上公开了一种新的适用于基因诊断的恒温核酸扩增技术,lamp(loop-mediated isothermal amplification,lamp)技术。该技术已成功地应用于sars、禽流感、hiv等疾病的检测中,在2009年甲型h1n1流感事件中,日本荣研化学株式会社(以下简称“荣研公司”)接受who的邀请完成了h1n1环介导等温扩增法检测试剂盒的研制,通过早期快速诊断对防止该病症的快速蔓延起到积极作用。该技术已广泛应用于日本国内各种病毒、细菌、寄生虫等引起的疾病检测、食品化妆品安全检查及进出口快速诊断中,并得到了欧美国
家的认同。该技术的优势除了高特异性、高灵敏度外,操作十分简单,对仪器设备要求低,一台水浴锅或恒温箱就能实现反应,结果的检测也很简单,不需要像pcr那样进行凝胶电泳,环介导等温扩增反应的结果通过肉眼观察白色浑浊或绿色荧光的生成来判断,简便快捷,适合基层快速诊断。是一种新型的核酸扩增方法,其特点是针对靶基因的6个区域设计4种特异引物,在链置换dna聚合酶(bst dna polymerase)的作用下,60
--
65℃恒温扩增,15-60分钟左右即可实现10^9~10^10倍的核酸扩增,具有操作简单、特异性强、产物易检测等特点。在dna合成时,从脱氧核糖核酸三磷酸底物(dntps)中析出的焦磷酸离子与反应溶液中的镁离子反应,产生大量焦磷酸镁沉淀,呈现白色。因此,可以把浑浊度作为反应的指标,只用肉眼观察白色浑浊沉淀,就能鉴定扩增与否,而不需要繁琐的电泳和紫外观察。由于环介导等温扩增反应不需要pcr仪和昂贵的试剂,有着广泛的应用前景。由于该技术灵敏度高,但存在一旦开盖容易形成气溶胶污染的问题,目前国内大多数实验室不能严格分区,假阳性问题比较严重。
10.因此,本发明在降低污染方面进行改进,采用微流控体系集成在一个蜂巢芯片上,一方面便于高通量快速检测,另一方面锚定了引物在芯片上,具有微流控的毛细管而降低污染。在肠道原虫检测中,仍停留在lamp的单管检测病原体,尚未进行固相载体制备相关的针对肠道原虫的基因芯片。本发明可以同时检测粪便样本中多个肠道原虫并针对隐孢子虫亚种鉴定的高效检测方法。
技术实现要素:
本发明要解决的技术问题之一在于提供一种基于蜂巢芯片的高通量检测多种肠道原虫的试剂盒。本发明以隐孢子虫、贾第虫、阿米巴和微孢子虫四种原虫为研究对象,建立了一种快速,敏感,特异的检测试剂盒。
11.本发明要解决的技术问题之二在于提供一种隐孢子虫、贾第虫、溶组织阿米巴和毕氏肠微孢子虫四种原虫的微流控偶联lamp的检测方法。四种肠道原虫lamp的特异性引物合成,解决了进行多次pcr检测的繁琐步骤,一次反应可以达到同时检测多个基因,明确病原体的作用,大大减轻了工作量,缩短了检测时间,降低了检测成本,具备更大的发展趋势。
12.本发明要解决的技术问题之三在于提供一种肠道原虫分子生物核酸检测方法,是提高检测通量和检测效率、降低检测成本和样品耗费的基于毛细管微阵列的核酸高通量检测方法。
13.本发明是通过以下技术方案实现的:在本发明的第一方面,提供一种基于蜂巢芯片的高通量检测肠道原虫的试剂盒,其采用微流控体系集成在一个蜂巢芯片上,用于检测隐孢子虫、贾第虫、微孢子虫和溶组织阿米巴,该试剂盒包括如下8组引物中的任意一组或任意多组组合:第1组,隐孢子虫的特异性引物(cry):cry-f3: 5
′-
cttactccttcagcacctta-3
′
,seq id no.1;cry
ꢀ-
b3: 5
′-
caagaaagagctatcaatctgt-3
′
,seq id no.2;cry
ꢀ-
fip: 5
′-
cgtcaattcctttaagtttcagcctgagaaatcaaagtctttgggtt-3
′
,seq id no.3;cry
ꢀ-
bip:5
′-
cctgcggcttaatttgactcacaatccttcctatgtctggac-3
′
,seq id no.4;
cry
ꢀ-
lf: 5
’-
tgcgaccatactcccccca-3’,seq id no.5;cry
ꢀ-
lb: 5
’-
acacgggaaaactcaccag-3’,seq id no.6;第2组,人隐孢子虫的特异性引物(ch):ch-f3: 5
’-
ggcaatcaggttgagtca-3
’ꢀ
,seq id no.7;ch-b3: 5
’-
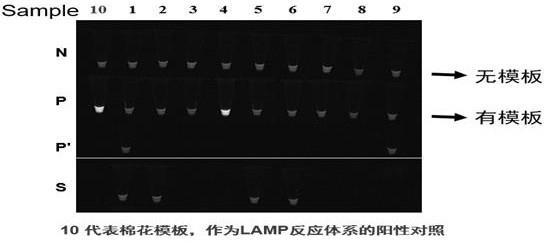
cggtatagaaagcactatcgt-3
’ꢀ
,seq id no.8;ch-fip:5
’-
aggcaaacaaatcgacggttg-agatcaagaagatcactcaca-3
’ꢀ
,seq id no.9;ch-bip: 5
’-
acccttaatggtggtaagagaattgcaaccaaactgtacttgtctc-3
’ꢀ
,seq id no.10;第3组,微小隐孢子虫的特异性引物 (cp):cp-f3: 5
’-
tcgcac cagcaa ata agg c-3
’ꢀ
,seq id no.11;cp-b3: 5
’-
gccgca ttc ttc ttt tggag-3
’ꢀ
,seq id no.12;cp-fip: 5
’-
accctggctaccagaagcttcagaactggagacgcagaa-3
’ꢀ
,seq id no.13;cp-bip:5
’-
ggccaaactagtgctgcttcccgtttcggtagttgcgcctt-3
’ꢀ
,seq id no.14;cp-lf: 5
’-
gtaccactagaatcttgactgcc-3
’ꢀ
,seq id no.15;cp-lb: 5
’-
aacccactactccagctcaaagt-3
’ꢀ
,seq id no.16;第4组,火鸡隐孢子虫的特异性引物(cm):cm-f3:5
’-
cctttgaaaacgaatcaagttct-3
’ꢀ
,seq id no.17;cm
-ꢀ
b3:5
’-ꢀ
caattcttttaccaccttgga-3
’ꢀ
,seq id no.18;cm-fip:5
’-
gtcattttctgttggggaatttgaatacaataaaaatcaaggttgacg-3
’ꢀ
,seq id no.19 ;cm-bip: 5
’-
gtctgaggaaagcttgtctagatcagcacatcaacagttccag-3
’ꢀ
,seq id no.20;第5组,安氏隐孢子虫的特异性引物(ca):ca-f3: 5
’-
cgtgcaaagagaacactttc-3
’ꢀ
,seq id no.21;ca-b3: 5
’-
cctactaatacaacatcatgtact-3
’ꢀ
,seq id no.22;ca-fip: 5
’-
tcctcaaatcttgcacgacttatwgattcatctacwcaagcaacaat-3
’ꢀ
,seq id no.23;ca-bip: 5
’-
gttctgattatttccgtggcacactcttatccattccagaatc-3
’ꢀ
,seq id no.24;ca-lf: 5
’-
caaagtagtcaataccttcgaac-3
’ꢀ
,seq id no.25;ca-lr: 5
’-
tagctccagtagagaaggtatt-3
’ꢀ
,seq id no.26;第6组,贾第虫的特异性引物(gd):gd-f3: 5
’-
tcgtcgagtggatcccg-3
’ꢀ
,seq id no.27;gd-b3: 5
’-ꢀ
ccatctcgtccatcccctc
ꢀ-3’ꢀ
,seq id no.28;gd-fip3: 5
’-ꢀ
gatgaaggtcgcggccatcttgaacaacatgaaggtcagcgt
ꢀ-3’ꢀ
,seq id no.29;gd-bip3: 5
’-ꢀ
gcatccaggagctcttcaagcgtgtaccagtggaggaaggc
ꢀ-3’ꢀ
,seq id no.30;第7组,阿米巴的特异性引物(e. histolytica):eh-f3: 5
’-ꢀ
gca cta tac ttgaac gga ttg
ꢀ-3’ꢀ
,seq id no.31;eh-b3: 5
’-ꢀ
gtt tga caa gat gttgag tga
ꢀ-3’ꢀ
,seq id no.32;eh-fip3: 5
’-
tcg ccc tat act caa ata tga caa gac ttt ggt
ggaaga ttc acg
ꢀ-3’ꢀ
,seq id no.33;eh-bip3: 5
’-ꢀ
atc tag tag ctg gttcca cct gaacac cta atc att atc ttt acc aat c
ꢀ-3’ꢀ
,seq id no.34;第8组,毕氏肠微孢子虫的特异性引物(enw):enw-f3: 5
’-ꢀ
tcggaatgtrtdgtaggtga
ꢀ-3’ꢀ
,seq id no.35;enw
ꢀ-
b3: 5
’-ꢀ
cgacggatccaagtgatc
ꢀ-3’ꢀ
,seq id no.36;enw
ꢀ-
fip3: 5
’-ꢀ
ttggtacgtgatggttggatgggcaacctccgattttcct
ꢀ-3’ꢀ
,seq id no.37;enw
ꢀ-
bip3: 5
’-ꢀ
ggaaccacctctaactcactgctgtaggcgtgagagtgtat
ꢀ-3’ꢀ
,seq id no.38。
14.作为本发明优选的技术方案,该试剂盒还包括lamp反应体系如下:作为本发明优选的技术方案,所述引物冻干后固化到芯片上,制成蜂巢芯片;所述试剂盒还包括显色剂,例如,钙黄绿素等。
15.在本发明的第二方面,提供一种基于蜂巢芯片的高通量检测肠道原虫的pcr检测方法,具体步骤包括如下:(1)不同虫株的dna提取,所述虫株包括如权利要求1所述的隐孢子虫、人隐孢子虫、微小隐孢子虫、火鸡隐孢子虫、安氏隐孢子虫、贾第虫、阿米巴、毕氏肠微孢子虫;(2)引物设计与筛选:所述设计的引物序列为权利要求1所述的引物序列;(3)质粒构建:采用基因合成作为模板,并构建质粒,作为验证;每个虫株具有各自的模板;(4)建立单管lamp方法,对所设计的引物进行lamp检测,得到有效的扩增引物;(5)按照步骤(4)的lamp反应条件进行基因芯片扩增特异性验证;(6)按照建立的巢氏pcr方法对样本进行检测和可行性验证。
16.作为本发明优选的技术方案,步骤(3)具体为:根据ncbi的数据库进行每个虫株的序列下载,同一个虫株的不同分离株序列比对后,选择合适的区域进行模板合成;构建质粒,经测序与靶序列一致;一共8个模板质粒:
(1)cry-403bp,核苷酸序列如seq id no.39所示;(2)ch-244bp,核苷酸序列如seq id no.40所示;(3)cp-221bp,核苷酸序列如seq id no.41所示;(4)cm-408bp,核苷酸序列如seq id no.42所示;(5)ca-230bp,核苷酸序列如seq id no.43所示;(6)gd-810bp,核苷酸序列如seq id no.44所示; (7) e.his-266bp,核苷酸序列如seq id no.45所示;(8)enw-310bp,核苷酸序列如seq id no.46所示。
17.作为本发明优选的技术方案,步骤(4)和步骤(5)中,所述的lamp反应条件为:以上混合后,放置恒温加热仪60℃50分钟,然后观察荧光(也可电泳与荧光结果印证)。
18.在本发明的第三方面,提供用于检测隐孢子虫、贾第虫、微孢子虫和溶组织阿米巴的引物组,选自以下8组引物中的任意一组或任意多组组合:第1组,隐孢子虫的特异性引物(cry):cry-f3: 5
′-
cttactccttcagcacctta-3
′
,seq id no.1;cry
ꢀ-
b3: 5
′-
caagaaagagctatcaatctgt-3
′
,seq id no.2;cry
ꢀ-
fip: 5
′-
cgtcaattcctttaagtttcagcctgagaaatcaaagtctttgggtt-3
′
,seq id no.3;cry
ꢀ-
bip:5
′-
cctgcggcttaatttgactcacaatccttcctatgtctggac-3
′
,seq id no.4;cry
ꢀ-
lf: 5
’-
tgcgaccatactcccccca-3’,seq id no.5;cry
ꢀ-
lb: 5
’-
acacgggaaaactcaccag-3’,seq id no.6;第2组,人隐孢子虫的特异性引物(ch):ch-f3: 5
’-
ggcaatcaggttgagtca-3
’ꢀ
,seq id no.7;ch-b3: 5
’-
cggtatagaaagcactatcgt-3
’ꢀ
,seq id no.8;ch-fip:5
’-
aggcaaacaaatcgacggttg-agatcaagaagatcactcaca-3
’ꢀ
,seq id no.9;ch-bip: 5
’-
acccttaatggtggtaagagaattgcaaccaaactgtacttgtctc-3
’ꢀ
,seq id no.10;第3组,微小隐孢子虫的特异性引物 (cp):
no.38。
19.在本发明的第四方面,提供上述引物组在制备基于蜂巢芯片的高通量检测肠道原虫的试剂盒中的应用。
20.在本发明的第五方面,提供一种肠道原虫分子生物核酸检测方法,包括如下步骤:(1)将上述任一组引物冻干后固化到芯片上,制成lamp微流控芯片;(2)选择合适的lamp反应体系,添加显色剂,加入芯片中;(3)反应结果通过肉眼或仪器判读。
21.作为本发明优先的技术方案,步骤(1)具体为:采用若干根毛细管组装至定制基座中进行固定形成lamp微流控芯片;然后,选择所述任一组引物溶于引物固定液,分别吸取针对不同靶标的引物固定液,按照预先设计好的排列顺序加入到毛细管芯片上所对应的毛细管反应孔中;留出两根毛细管,其中一根固定阳性对照引物组,作为阳性对照孔,最后一根不固定引物组,作为阴性对照孔;将毛细管进行干燥处理,使引物固定于毛细管内壁。
22.作为本发明优先的技术方案,步骤(2)具体为: 将待检测样本、lamp反应试剂及显色剂加入微阵列芯片的反应孔中,63℃反应1小时。
23.作为本发明优先的技术方案,步骤(3)中所述反应结果检测及数据分析具体为:lamp反应结束后,通过紫外荧光检测芯片上所有反应孔的显色情况,在阳性对照孔显色,而阴性对照孔不显色的情况下,判读所检测结果为“阳性”或“阴性”。
24.与现有技术相比,本发明具有如下有益效果:1、本发明的肠道原虫分子生物核酸检测方法,是提高检测通量和检测效率、降低检测成本和样品耗费的基于毛细管微阵列的核酸高通量检测方法。本发明检测任一虫种的时间和可操作性优于现有的传统pcr技术,快速便捷;同时不需要高端精密的仪器,优于荧光定量pcr的操作,方便肠道原虫的现场快速检测。此外,传统的lamp技术易发生操作空间的气溶胶假阳性的污染,本发明基于微流控平台,可以降低空气气溶胶的污染,减少假阳性的发生率。
25.2、本发明的检测肠道原虫的蜂巢芯片,针对这6种肠道原虫进行生物信息学分析,设计出可以同时区别出各自虫种的引物,可大大节约了时间成本,降低了操作难度。
26.3、 本发明引物具有良好的特异性,可以区分不同的肠道原虫的靶标。
27.4、 本发明中蜂巢芯片检测方法可用于快速高效的检测出实际样本中的靶标,有利于方便快捷的进行肠道原虫感染的样本筛选。
附图说明
28.图1是本发明实施例4中验证隐孢子虫引物特异性的结果示意图。图1中,1-9的引物来自文献,进行检验,1-9采用相应的实际样本,检测的样本是实际样本牛隐孢子虫;1和2代表人隐孢子虫,3代表安氏隐孢子虫,4代表牛隐孢子虫,5和6代表贾第虫,7和8代表溶组织阿米巴,9代表微孢子虫,10代表棉花模板,作为单管检测的反应体系阳性对照。
29.图2是本发明实施例4中验证微孢子虫引物特异性的结果示意图。图2中,1代表贾第虫的文献引物检测相应质粒,2 代表溶组织阿米巴的文献引物检测相应质粒,3代表经过重新设计一条引物的微孢子虫引物检验相应质粒,4代表新设计的环孢子虫引物检测对应质粒,5代表文献来源的引物检测实际样本安氏隐孢子虫,6代表文献涟源的引物检测实际
样本微小隐孢子虫,7-9代表隐孢子虫通用引物可检测不同的实际样本,10代表棉花模板,作为单管检测的反应体系阳性对照。
30.图3是本发明实施例4中验证贾第虫引物特异性的结果示意图。图3中,1-5代表贾第虫的引物验证;6-7代表溶组织阿米巴的引物验证;8代表安氏隐孢子虫文献引物对应检测相应的质粒;9代表微小隐孢子虫文献引物对应检测相应的质粒;10代表棉花模板,作为单管检测的反应体系阳性对照。
31.图4是本发明实施例4中验证人隐孢子虫引物特异性的结果示意图。图4中,1代表棉花模板,作为单管检测的反应体系阳性对照;2-3代表人隐孢子虫的引物验证;4-6代表火鸡隐孢子虫的引物验证.图5是本发明实施例4中八种寄生虫靶标的单管验证结果示意图;其中1代表隐孢子虫通用引物,2代表人隐孢子虫引物,3代表微小隐孢子虫引物,4代表安氏隐孢子虫引物,5代表火鸡隐孢子虫引物,6代表贾第虫引物,7代表溶组织阿米巴引物,8代表微孢子虫引物。
32.图6是本发明实施例4中靶标在芯片上的分布及特异性验证结果示意图。
33.图7是本发明实施例6中采用证实含有相应病原体的实际样本用于蜂巢芯片的检测结果示意图。
具体实施方式
34.下面对本发明的实施例作详细说明:本实施例在本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如j.sambrook等在《分子克隆实验指南》(科学出版社,1992)中所述的条件,或按照制造厂商所建议的条件。
35.实验平台本发明依托的检测平台是上海交通大学提供的蜂巢芯片(平台),其具体内容参见专利申请号为201510901558.1,发明名称为一种基于毛细管微阵列的核酸高通量快速检测方法的发明专利申请公开的内容。该蜂巢芯片(平台)利用毛细管组装、浇铸、机械加工等方式加工出微阵列,内含若干亲水性垂直微管道,阵列的外表面采用化学方法进行超疏水性修饰;将若干组核酸扩增引物分别加入若干微管道中并干燥固定,将微阵列置于反应管中;然后利用特殊加样装置通过虹吸方式将核酸扩增反应组分一次性引入各微管道中,放入温控装置中进行扩增反应;通过在反应中连续测量或反应后一次测量微管道内的荧光信号分别实现实时检测和终点检测;扩增产物也可回收用于后续其它用途。该平台的优势是可在一次反应中快速方便地实现对多个核酸靶标的检测,在核酸多重检测、现场检测等领域有广泛的应用。
36.本发明中的蜂巢芯片(平台),可非常简单地在微小体系内实现核酸扩增试剂的快速并行进样及扩增反应的快速并行进行。相比较现有方法,有其特有的优点如,检测通量高、实验操作简单、样品耗费少、检测费用低、无需昂贵设备等。可以在传染病快速诊断、出入境检验检疫、转基因作物产品现场检测、食品水源微生物现场检测、犯罪现场证物鉴定及生物反恐等领域得到广泛的应用。
37.蜂巢芯片(平台)的具体检测方法为:
(1)将若干组核酸扩增引物分别加入毛细管微阵列上的若干微管道中,干燥,方便核酸扩增引物附于微管道内壁,再将毛细管微阵列固定于透明反应管中;(2)将含有样品核酸的核酸扩增反应组分加入微管道中,形成核酸扩增体系,封住反应管口;(3)将装有核酸扩增体系的反应管置于控温条件下进行扩增反应;(4)通过对扩增反应连续荧光信号测量实现实时检测或对扩增反应结束后一次荧光信号测量实现终点检测。
38.其中,毛细管微阵列中若干个微管道以阵列方式贯穿排布于基底上,并且微管道端部有少部分露出基底表面;基底的上表面、微管道露出基底部分的外表面以及微管道底端内表面均为疏水性表面;所述疏水性表面可通过在相应表面涂覆一层疏水性涂料来实现。所述基底的材质包括塑料、玻璃、金属及其它高分子材料;其中,所述其它高分子材料如聚二甲基硅氧烷、聚甲基丙烯酸甲酯、聚四氟乙烯、橡胶等;微管道为亲水性毛细管,微管道露出基底的部分及微管道的底端表面为疏水的,而微管道本身的材质为亲水的。所述(1)加入具体指将核酸扩增引物溶于交联剂中后再加入微管道中;所述交联剂为以下三种混合液中的任意一种:a、质量百分比为0.1-1%的壳聚糖的乙酸水溶液,ph为4.5-6.0;b、质量百分比为0.1-1%的明胶水溶液;c、质量百分比为0.05-5%的聚乙二醇水溶液。
39.所述(1)加入的反应组分具体指通过倒置虹吸方式将其引入各微管道中。倒置虹吸方式是指:将充满核酸扩增反应组分溶液的加样装置样品池朝下插入反应管中,核酸扩增反应组分与亲水性微管道内壁顶端接触后靠虹吸作用迅速充满亲水性管道,之后再移除加样装置。所述(4)测量可以是借助荧光检测设备或光度检测设备进行检测,也可以是通过肉眼辨别颜色或亮度差异,即每次测量前需用相应发射波长的光源照射微管道内反应物,再进行测量。所述方法中,(3)中的温控的装置及(4)的所述测量可集成于一个自动化装置,由软件程序控制其自动运行。所述方法既可以在单个反应管中单独实现,也可以在集成的8连管、96孔板或384孔板中并行实现。
40.该平台的优势是:(1)利用毛细管微阵列和亲疏水特性,采用特殊设计的加样装置可快速便捷地将反应液一次性加入多个微管道中,从而提高了一次检测的通量和检测效率;(2)采用微管道作为反应腔也大大减小了试剂样品用量,从而降低了检测成本;(3)适用于各种核酸高通量快速检测领域,如传染病快速检测、出入境检验检疫、食品安全和转基因检测、刑侦鉴定等。
41.实施例1 不同虫株的dna提取。
42.(1)隐孢子虫、贾第虫、溶组织阿米巴和微孢子虫阳性样本为实验室分离获得,重铬酸钾,4℃保存。
43.(2)现场样本采自上海、江苏等地医院腹泻患者及动物粪便样本。
44.i: 粪便dna提取试剂盒购自美国qiagen公司,pcr mix购自bio-serve公司。
45.ii: 样本核酸按照《腹泻症候群检测技术方案》进行相关病原的分子检测,并经测序、比对证实该样本的虫种。
46.实施例2 5种肠道原虫的检测引物自主设计和筛选
(1)依据生物信息学分析,分别采用不同的目标基因进行靶标设计。
47.(2)引物设计。
48.(3)引物筛选筛选策略:每个虫株先进行文献检索,选择文献报道引物进行验证,如引物有效,则作为芯片的备用引物;如引物无法特异扩增,根据文献的序列,进行多个序列比对,设计可能的引物进行逐一验证,获得有效的特异扩增引物。
49.其中人隐孢子虫、火鸡隐孢子虫、贾第虫、阿米巴的序列是自主设计合成;隐孢子虫通用引物(关联了2条环引物)、微小隐孢子虫、安氏隐孢子虫采用文献引物;微孢子虫的1条引物设计为兼并引物。引物具体见下:第1组,隐孢子虫的特异性引物(cry):cry-f3: 5
′-
cttactccttcagcacctta-3
′
,seq id no.1;cry
ꢀ-
b3: 5
′-
caagaaagagctatcaatctgt-3
′
,seq id no.2;cry
ꢀ-
fip: 5
′-
cgtcaattcctttaagtttcagcctgagaaatcaaagtctttgggtt-3
′
,seq id no.3;cry
ꢀ-
bip:5
′-
cctgcggcttaatttgactcacaatccttcctatgtctggac-3
′
,seq id no.4;cry
ꢀ-
lf: 5
’-
tgcgaccatactcccccca-3’,seq id no.5;cry
ꢀ-
lb: 5
’-
acacgggaaaactcaccag-3’,seq id no.6;第2组,人隐孢子虫的特异性引物(ch):ch-f3: 5
’-
ggcaatcaggttgagtca-3
’ꢀ
,seq id no.7;ch-b3: 5
’-
cggtatagaaagcactatcgt-3
’ꢀ
,seq id no.8;ch-fip:5
’-
aggcaaacaaatcgacggttg-agatcaagaagatcactcaca-3
’ꢀ
,seq id no.9;ch-bip: 5
’-
acccttaatggtggtaagagaattgcaaccaaactgtacttgtctc-3
’ꢀ
,seq id no.10;第3组,微小隐孢子虫的特异性引物 (cp):cp-f3: 5
’-
tcgcac cagcaa ata agg c-3
’ꢀ
,seq id no.11;cp-b3: 5
’-
gccgca ttc ttc ttt tggag-3
’ꢀ
,seq id no.12;cp-fip: 5
’-
accctggctaccagaagcttcagaactggagacgcagaa-3
’ꢀ
,seq id no.13;cp-bip:5
’-
ggccaaactagtgctgcttcccgtttcggtagttgcgcctt-3
’ꢀ
,seq id no.14;cp-lf: 5
’-
gtaccactagaatcttgactgcc-3
’ꢀ
,seq id no.15;cp-lb: 5
’-
aacccactactccagctcaaagt-3
’ꢀ
,seq id no.16;第4组,火鸡隐孢子虫的特异性引物(cm):cm-f3:5
’-
cctttgaaaacgaatcaagttct-3
’ꢀ
,seq id no.17;cm
-ꢀ
b3:5
’-ꢀ
caattcttttaccaccttgga-3
’ꢀ
,seq id no.18;cm-fip:5
’-
gtcattttctgttggggaatttgaatacaataaaaatcaaggttgacg-3
’ꢀ
,seq id no.19 ;cm-bip: 5
’-
gtctgaggaaagcttgtctagatcagcacatcaacagttccag-3
’ꢀ
,seq id no.20;第5组,安氏隐孢子虫的特异性引物(ca):ca-f3: 5
’-
cgtgcaaagagaacactttc-3
’ꢀ
,seq id no.21;ca-b3: 5
’-
cctactaatacaacatcatgtact-3
’ꢀ
,seq id no.22;
ca-fip: 5
’-
tcctcaaatcttgcacgacttatwgattcatctacwcaagcaacaat-3
’ꢀ
,seq id no.23;ca-bip: 5
’-
gttctgattatttccgtggcacactcttatccattccagaatc-3
’ꢀ
,seq id no.24;ca-lf: 5
’-
caaagtagtcaataccttcgaac-3
’ꢀ
,seq id no.25;ca-lr: 5
’-
tagctccagtagagaaggtatt-3
’ꢀ
,seq id no.26;第6组,贾第虫的特异性引物(gd):gd-f3: 5
’-
tcgtcgagtggatcccg-3
’ꢀ
,seq id no.27;gd-b3: 5
’-ꢀ
ccatctcgtccatcccctc
ꢀ-3’ꢀ
,seq id no.28;gd-fip3: 5
’-ꢀ
gatgaaggtcgcggccatcttgaacaacatgaaggtcagcgt
ꢀ-3’ꢀ
,seq id no.29;gd-bip3: 5
’-ꢀ
gcatccaggagctcttcaagcgtgtaccagtggaggaaggc
ꢀ-3’ꢀ
,seq id no.30;第7组,阿米巴的特异性引物(e. histolytica):eh-f3: 5
’-ꢀ
gca cta tac ttgaac gga ttg
ꢀ-3’ꢀ
,seq id no.31;eh-b3: 5
’-ꢀ
gtt tga caa gat gttgag tga
ꢀ-3’ꢀ
,seq id no.32;eh-fip3: 5
’-
tcg ccc tat act caa ata tga caa gac ttt ggtggaaga ttc acg
ꢀ-3’ꢀ
,seq id no.33;eh-bip3: 5
’-ꢀ
atc tag tag ctg gttcca cct gaacac cta atc att atc ttt acc aat c
ꢀ-3’ꢀ
,seq id no.34;第8组,毕氏肠微孢子虫的特异性引物(enw):enw-f3: 5
’-ꢀ
tcggaatgtrtdgtaggtga
ꢀ-3’ꢀ
,seq id no.35;enw
ꢀ-
b3: 5
’-ꢀ
cgacggatccaagtgatc
ꢀ-3’ꢀ
,seq id no.36;enw
ꢀ-
fip3: 5
’-ꢀ
ttggtacgtgatggttggatgggcaacctccgattttcct
ꢀ-3’ꢀ
,seq id no.37;enw
ꢀ-
bip3: 5
’-ꢀ
ggaaccacctctaactcactgctgtaggcgtgagagtgtat
ꢀ-3’ꢀ
,seq id no.38。
50.实施例3 质粒构建根据ncbi的数据库进行每个虫株的序列下载,同一个虫株的不同分离株序列比对后,选择合适的区域进行模板合成;构建质粒,经测序与靶序列一致;一共8个模板质粒:(1)cry-403bp,核苷酸序列如seq id no.39所示;(2)ch-244bp,核苷酸序列如seq id no.40所示;(3)cp-221bp,核苷酸序列如seq id no.41所示;(4)cm-408bp,核苷酸序列如seq id no.42所示;(5)ca-230bp,核苷酸序列如seq id no.43所示;(6)gd-810bp,核苷酸序列如seq id no.44所示;(7)e.his-266bp,核苷酸序列如seq id no.45所示;(8)enw-310bp,核苷酸序列如seq id no.46所示。
51.实施例4 单管lamp的验证引物有效性一、单管lamp的验证引物有效性的具体实验步骤
(1)将任一虫种的核酸扩增引物分别加入0.2ml pcr管中,体系如下:(2)将含有样品核酸的核酸扩增反应组分1μl加入0.2ml pcr管中,形成完整的核酸扩增体系,封住反应管口;(3)将装有核酸扩增体系的反应管置于控温条件下进行扩增反应;(4)通过对扩增反应连续荧光信号测量实现实时检测或对扩增反应结束后一次荧光信号测量实现终点检测。
52.(5)反应管中的反应产物进行电泳验证,每个样本采用阴性对照和阳性反应进行对比电泳,呈现特征性的大小不同的dna片段图,即为阳性扩增。
53.二、单管lamp和蜂巢芯片验证引物特异性1、实验方法:pcr反应条件优化具体方法为:lamp反应体系所采用lamp反应体系如下:以上混合后,放置pcr仪器的60℃1小时,然后观察荧光,及电泳。
54.结果:以上8种虫种的引物均有效,标记红色的引物是具有自主原创性。
55.2、实验结果:
(1)cry可有效扩增牛隐孢子虫。
56.如图1所示,s4是隐孢子虫(cry)的引物,检测牛隐孢子虫的实际样本进行引物验证。图1中,1-9的引物来自文献,进行检验,1-9采用相应的实际样本,1和2代表人隐孢子虫,3代表安氏隐孢子虫,4代表牛隐孢子虫,5和6代表贾第虫,7和8代表溶组织阿米巴,9代表微孢子虫,10代表棉花模板,作为单管检测的反应体系阳性对照。从图1的结果可以证实隐孢子虫(cry)引物的特异性。
57.(2) 微孢子虫(enw)引物及安氏隐孢子虫、微小隐孢子虫的有效扩增如图2所示,微孢子虫的引物经过生物信息分析后更新一条引物,检测质粒获得证实;同时安氏隐孢子和微小隐孢子虫的文献引物可有效检测实际样本;隐孢子虫的通用引物可以在3个实际样本中检测隐孢子虫。
58.图2中,1代表贾第虫的文献引物检测相应质粒,2 代表溶组织阿米巴的文献引物检测相应质粒,3代表经过重新设计微孢子虫的引物fib后并检验相应质粒,4代表新设计的环孢子虫引物检测对应质粒,5代表文献来源的引物检测实际样本安氏隐孢子虫,6代表文献来源的引物检测实际样本微小隐孢子虫,7-9代表隐孢子虫通用引物可检测不同的实际样本,10代表棉花模板,作为单管检测的反应体系阳性对照。
59.(3)贾第虫和溶组织阿米巴的设计引物有效及安氏隐孢子虫、微小隐孢子虫引物可有效检测对应的质粒图3验证所设计的5组贾第虫的引物,其中一组引物可以有效检测对应的质粒;所设计2组溶组织阿米巴的引物,证明一组有效;图3中,1-5代表贾第虫的引物验证;6-7代表溶组织阿米巴的引物验证;8代表安氏隐孢子虫文献引物对应检测相应的质粒;9代表微小隐孢子虫文献引物对应检测相应的质粒;10代表棉花模板,作为单管检测的反应体系阳性对照。
60.(4) 设计人隐孢子虫(c. hominis)和火鸡隐孢子虫(c. meleagridis)引物的验证如图4所示,所设计的2组人隐孢子虫的引物,其中一组引物可以有效检测对应的质粒;设计3组火鸡隐孢子虫的引物,均有效。
61.图4中,1代表棉花模板,作为单管检测的反应体系阳性对照;2-3代表人隐孢子虫的引物验证;4-6代表火鸡隐孢子虫的引物验证。
62.(5) 8种寄生虫引物均有效扩增结果如表1和图5所示,表1中列出本发明实施例4中八种寄生虫靶标的单管验证结果示意图(图5);其中1代表隐孢子虫通用引物,2代表人隐孢子虫引物,3代表微小隐孢子虫引物,4代表安氏隐孢子虫引物,5代表火鸡隐孢子虫引物,6代表贾第虫引物,7代表溶组织阿米巴引物,8代表微孢子虫引物。这些特异引物均可以有效检测对应的质粒。
63.表1
(6)按照上述lamp反应条件进行基因芯片扩增特异性验证芯片组成如图6放置6个靶标;芯片反应采用在芯片上进行各自的质粒验证引物特异性。图 6是本发明实施例4中靶标在芯片上的分布及特异性验证结果示意图。把6种特异性虫种引物锚 定在微流体蜂巢芯片中,进行检测,结果证实了各引物均具有特异性。
64.实施例5 采用实际样本的检测现场样本采自上海、江苏等地医院腹泻患者及动物粪便样本。粪便dna提取试剂盒购自使用德国qiagen 公司qiaamp dna 粪便提取试剂盒提取dna,按试剂盒说明书操作,-20℃保存。pcr mix购自bio-serve公司。
65.样本按照腹泻症候群监测技术方案(2019版)中涉及的如下引物(表2)采用巢式pcr依照表3的反应体系和表4的反应程序进行实际样本中所感染的病原体确认。
66.表2: 巢氏pcr引物验证实际样本四种原虫的pcr反应体系相同表3,反应程序见表4。
67.表3:单个基因pcr扩增反应体系
表4:巢氏pcr循环参数pcr产物鉴定:取5μl pcr产物于2%琼脂胶上进行电泳分析(120v/40min)。
68.注意:每个样品至少用平行pcr扩增3次,每次均用阳性、阴性对照。获得的阳性检测样本进行测序证实为隐孢子虫、贾第虫、微孢子虫和溶组织阿米巴。
69.实施例6 一种肠道原虫分子生物核酸检测方法采用如下步骤:(1)lamp微流控芯片的制作及处理:将10根疏水化处理后的毛细管组装至定制基座中,并进行固定处理、备用;(2)引物固定:分别选择实施例2中任意一组引物溶于引物固定液,分别吸取针对不同靶标的引物固定液,按照预先设计好的排列顺序加入到毛细管芯片上所对应的毛细管反应孔中;留出两根毛细管,其中一根固定阳性对照引物组,作为阳性对照孔,最后一根不固定引物组,作为阴性对照孔。将毛细管进行干燥处理,使引物固定于毛细管内壁;(3)芯片上的lamp反应:将待检测样本、lamp反应试剂及钙黄绿素通过辅助加样装置加入微阵列芯片的反应孔中,63℃反应1小时;(4)结果检测及数据分析:lamp反应结束后,通过紫外荧光检测芯片上所有反应孔的显色情况,在阳性对照孔显色,而阴性对照孔不显色的情况下,判读所检测结果为“阳性”或“阴性”。
70.(5)图7是本发明采用实施例5中证实含有相应病原体的实际样本用于蜂巢芯片的检测结果示意图。如图7所示分别采用人隐孢子虫、安氏隐孢子虫、火鸡隐孢子虫、贾第虫、溶组织阿米巴、微孢子虫的样本进行验证,获得准确验证。按照图7进行排列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

