一种egcg
‑
葡萄糖加合物及其制备方法和应用
技术领域
1.本发明涉及掩味剂技术领域,特别涉及一种egcg
‑
葡萄糖加合物及其制备方法和应用。
背景技术:
2.茶叶作为世界三大无酒精饮料之一,其独特的风味受到广大消费者的喜爱。而烘焙是茶叶加工过程中非常重要的加工工序,不仅可以减少茶叶的水分便于储存,还能改善茶叶的风味。茶叶经80~160℃下高温烘焙后,苦味和涩味显著降低,锅巴香或烘烤香显著提升,滋味变得浓厚醇和。
3.有研究发现,茶叶在烘焙过程中的滋味变化与具有苦涩味的儿茶素的转化密不可分。如能模拟茶叶烘焙过程,获得对茶叶或茶饮料的苦味或者涩味具有显著抑制作用的化学成分,将会对食品或饮料领域做出重要贡献。
技术实现要素:
4.有鉴于此,本发明目的在于提供一种egcg
‑
葡萄糖加合物及其制备方法和应用。本发明所得egcg
‑
葡萄糖加合物对苦味或涩味具有良好的掩盖作用。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种egcg
‑
葡萄糖加合物,具有式i、式ii、式iii或式iv所示结构:
[0007][0008][0009]
本发明提供了上述egcg
‑
葡萄糖加合物的制备方法,包括以下步骤:
[0010]
(1)将表没食子儿茶素没食子酸酯、葡萄糖与水混合,在加热条件下进行亲核加成
反应,得到亲核加成产物,所述亲核加成产物包括式i、式ii、式iii和式iv所示结构的egcg
‑
葡萄糖加合物;
[0011]
(2)对所述亲核加成产物进行分离纯化,分别得到具有式i、式ii、式iii或式iv所示结构的egcg
‑
葡萄糖加合物。
[0012]
优选的,所述表没食子儿茶素没食子酸酯和葡萄糖的质量比为(1~5):(1~5);
[0013]
所述水的质量为表没食子儿茶素没食子酸酯和葡萄糖总质量的10%~200%。
[0014]
优选的,所述加热的温度为100~200℃。
[0015]
优选的,所述亲核加成反应的时间为10~120min。
[0016]
优选的,所述分离纯化包括以下步骤:
[0017]
将所述亲核加成产物与极性溶剂混合,混合后进行浓缩,得到待分离液;
[0018]
将所述待分离液进行第一次柱层析分离,得到第一次柱层析分离产物,所述第一次柱层析分离的填料为sephadex lh
‑
20凝胶,洗脱条件为甲醇等度洗脱;
[0019]
对所述第一次柱层析分离产物进行薄层色谱分离,显色后合并流分,依次得到薄层色谱分离组分1、薄层色谱分离组分2、薄层色谱分离组分3和薄层色谱分离组分4,所述薄层色谱分离的展开剂为氯仿、丙酮和甲酸的混合溶液,所述混合溶液中氯仿、丙酮和甲酸的体积比为(11~13):(6~8):(1~3);
[0020]
对所述薄层色谱分离组分1进行第二次柱层析分离,继续经薄层色谱分离及显色后依次得到第二次柱层析分离组分1、第二次柱层析分离组分2和第二次柱层析分离组分3,所述第二次柱层析分离的填料为硅胶,洗脱液为氯仿、丙酮和甲酸的混合溶液,所述混合溶液中氯仿、丙酮和甲酸的体积比为(11
‑
13):(6
‑
8):(1
‑
3);
[0021]
对所述第二次柱层析分离组分2进行高效液相色谱分离,依次得到具有式i、式ii、式iii和式iv所示结构的egcg
‑
葡萄糖加合物;
[0022]
所述高效液相色谱分离的色谱柱为agilent zorbax sb
‑
aq c
18
色谱柱,流动相包括a相和b相,所述a相为0.2%甲酸水,b相为甲醇;
[0023]
所述高效液相色谱分离的洗脱条件为:
[0024]
0~4分钟,5%甲醇水~20%甲醇水;
[0025]
4~16分钟,20%甲醇水~23%甲醇水;
[0026]
16~19分钟,23%甲醇水;
[0027]
19~20分钟,23%甲醇水~42%甲醇水;
[0028]
20~21分钟,42%甲醇水~100%甲醇;
[0029]
21~22分钟,100%甲醇~5%甲醇水;
[0030]
22~28分钟,5%甲醇水。
[0031]
本发明提供了上述egcg
‑
葡萄糖加合物作为苦涩味掩味剂的应用。
[0032]
优选的,所述掩味剂为茶叶或茶饮料的掩味剂。
[0033]
本发明提供了一种掩味剂、包括上述egcg
‑
葡萄糖加合物和食用辅料。
[0034]
优选的,所述egcg
‑
葡萄糖加合物和食用辅料的质量比为1:1~300。
[0035]
本发明提供了一种egcg
‑
葡萄糖加合物,具有式i、式ii、式iii或式iv所示结构。本发明提供的egcg
‑
葡萄糖加合物能够对茶叶或茶饮料的苦味或涩味有明显的抑制或掩盖作用,能够作为苦涩味掩味剂用于食品、饮料领域。
[0036]
本发明提供了上述egcg
‑
葡萄糖加合物的制备方法,本发明通过模拟茶叶的烘焙过程,在加热的条件下,egcg中a环6位上的c和8位上的c与葡萄糖结合,发生亲核加成反应,在进一步的加热过程中,egcg的c6和c8位上连接的葡萄糖基团还会脱水环化,经分离纯化后得到具有式i、式ii、式iii或式iv所示结构的egcg
‑
葡萄糖加合物。同时,本发明提供的制备方法操作简单,容易实施,成本较低。
附图说明
[0037]
图1为实施例1的分离纯化的流程图;
[0038]
图2为egcg和葡萄糖烘焙前后样品进行苦味和涩味强度评价结果;
[0039]
图3为egcg
‑
葡萄糖加合物1的碎片离子图;
[0040]
图4为egcg
‑
葡萄糖加合物2的碎片离子图;
[0041]
图5为egcg
‑
葡萄糖加合物3的碎片离子图;
[0042]
图6为egcg
‑
葡萄糖加合物4的碎片离子图;
[0043]
图7为实施例1所得亲核加成产物和黄大茶样品的uplc
‑
ms检测结果;
[0044]
图8为egcg
‑
葡萄糖加合物苦涩味抑制测试的评审结果。
具体实施方式
[0045]
本发明提供了一种egcg
‑
葡萄糖加合物,具有式i、式ii、式iii或式iv所示结构:
[0046][0047][0048]
本发明提供了上述egcg
‑
葡萄糖加合物的制备方法,包括以下步骤:
[0049]
(1)将表没食子儿茶素没食子酸酯、葡萄糖与水混合,在加热条件下进行亲核加成反应,得到亲核加成产物,所述亲核加成产物包括式i、式ii、式iii和式iv所示结构的egcg
‑
葡萄糖加合物;
[0050]
(2)对所述亲核加成产物进行分离纯化,分别得到具有式i、式ii、式iii或式iv所
示结构的egcg
‑
葡萄糖加合物。
[0051]
本发明将表没食子儿茶素没食子酸酯、葡萄糖与水混合,在加热条件下进行亲核加成反应,得到亲核加成产物,所述亲核加成产物包括式i、式ii、式iii和式iv所示结构的egcg
‑
葡萄糖加合物。在本发明中,所述表没食子儿茶素没食子酸酯和葡萄糖的纯度优选为分析纯,纯度优选≥97%。
[0052]
在本发明中,所述表没食子儿茶素没食子酸酯和葡萄糖的质量比优选为(1~5):(1~5),更优选为1:1。在本发明中,所述水的质量为表没食子儿茶素没食子酸酯和葡萄糖总质量的10%~200%,更优选为30~100%。
[0053]
在本发明中,所述混合的方式优选包括依次进行的涡旋混合和超声混合。在本发明中,所述涡旋混合的速率优选为500r/min,时间优选为2~3min,更优选为2.5min。在本发明中,所述超声混合的功率优选为200w,频率优选为40khz,时间优选为2~3min,更优选为2.5min。本发明通过所述涡旋混合和超声混合,有利于促进原料的溶解。
[0054]
在本发明中,所述加热的方式优选为油浴加热,所述加热的温度优选为100~200℃,更优选为120~150℃。
[0055]
在本发明中,所述亲核加成反应的时间优选为10~120min,更优选为30~90min。在本发明中,在加热的条件下,egcg中a环6位上的c和8位上的c与葡萄糖结合,发生亲核加成反应,在进一步的加热过程中,egcg的c6和c8位上连接的葡萄糖基团还会脱水环化,经分离纯化后得到具有式i、式ii、式iii或式iv所示结构的egcg
‑
葡萄糖加合物。
[0056]
得到所述亲核加成产物后,本发明对所述亲核加成产物进行分离纯化,得到具有式i、式ii、式iii或式iv所示结构的egcg
‑
葡萄糖加合物。在本发明中,所述分离纯化优选包括以下步骤:
[0057]
将所述亲核加成产物与极性溶剂混合,进行浓缩,得到待分离液。
[0058]
在本发明中,所述极性溶剂优选为甲醇、乙醇、乙酸乙酯、丙酮和水中的一种或几种,更优选为甲醇。本发明利用所述极性溶剂来溶解所述亲核加成产物。
[0059]
在本发明中,所述亲核加成产物与极性溶剂的体积比优选为1:5。在本发明中,所述浓缩优选为将所述极性溶剂的体积浓缩为原体积的20~30%。
[0060]
得到所述待分离液后,本发明将所述待分离液进行第一次柱层析分离,得到第一次柱层析分离产物。
[0061]
在本发明中,第一次柱层析分离时,所述待分离液的上样总体积优选为10ml,上样优选分3次进行,每次上样体积优选为3~4ml。
[0062]
在本发明中,所述第一次柱层析分离的填料为sephadex lh
‑
20凝胶,洗脱条件为甲醇等度洗脱。
[0063]
得到所述第一次柱层析分离产物后,本发明对所述第一次柱层析分离产物进行薄层色谱分离,显色后依次得到薄层色谱分离组分1、薄层色谱分离组分2、薄层色谱分离组分3和薄层色谱分离组分4。
[0064]
在本发明中,所述薄层色谱分离的展开剂优选为氯仿、丙酮和甲酸的混合溶液,所述混合溶液中氯仿、丙酮和甲酸的体积比优选为(11~13):(6~8):(1~3),更优选为12:7:2。在本发明中,所述显色使用的显色剂优选为香草醛硫酸乙醇溶液,所述香草醛硫酸乙醇溶液的质量浓度优选为5%。
[0065]
本发明对所述薄层色谱分离组分1进行第二次柱层析分离,显色后依次得到第二次柱层析分离组分1、第二次柱层析分离组分2和第二次柱层析分离组分3。
[0066]
在本发明中,所述第二次柱层析分离的填料优选为硅胶,所述硅胶的粒径优选为100~200目。在本发明中,所述第二次柱层析分离的洗脱相优选为氯仿、丙酮和甲酸的混合溶液,所述混合溶液中氯仿、丙酮和甲酸的体积比优选为(11~13):(6~8):(1~3),更优选为12:7:2。在本发明中,所述显色使用的显色剂优选为香草醛硫酸乙醇溶液,所述香草醛硫酸乙醇溶液的质量浓度优选为5%。
[0067]
本发明对所述第二次柱层析分离组分2进行高效液相色谱分离,依次得到具有式i、式ii、式iii和式iv所示结构的egcg
‑
葡萄糖加合物。
[0068]
在本发明中,所述高效液相色谱分离的色谱柱为agilent zorbax sb
‑
aq c
18
色谱柱,所述色谱柱的尺寸为250
×
4.6mm,柱径为5μm。在本发明中,高效液相色谱分离的流速优选为1ml/min。
[0069]
在本发明中,所述高效液相色谱分离的流动相包括a相和b相,所述a相为体积浓度为0.2%的甲酸水,b相为甲醇;
[0070]
所述高效液相色谱分离的洗脱条件为:
[0071]
0~4分钟,5%甲醇水~20%甲醇水;
[0072]
4~16分钟,20%甲醇水~23%甲醇水;
[0073]
16~19分钟,23%甲醇水;
[0074]
19~20分钟,23%甲醇水~42%甲醇水;
[0075]
20~21分钟,42%甲醇水~100%甲醇;
[0076]
21~22分钟,100%甲醇~5%甲醇水;
[0077]
22~28分钟,5%甲醇水;
[0078]
所述甲醇水的浓度为体积浓度。
[0079]
作为本发明的一个具体实施例,所述高效液相色谱分离过程中,13.046min洗脱样品为式ⅰ所示结构表示的egcg
‑
葡萄糖加合物;15.147min洗脱样品为式ⅱ所示结构表示的egcg
‑
葡萄糖加合物;18.709min洗脱样品为式ⅲ所示结构表示的egcg
‑
葡萄糖加合物;20.237min洗脱样品为式ⅳ所示结构表示的egcg
‑
葡萄糖加合物。
[0080]
在本发明中,所述egcg
‑
葡萄糖加合物的检测方法优选为uplc
‑
ms法,检测时的流速优选为1ml/min,流动相:a相为0.2%甲酸水,b相为甲醇,洗脱条件:
[0081]
0~5分钟,5%甲醇水~20%甲醇水;
[0082]
5~16分钟,20%甲醇水
‑
25%甲醇水;
[0083]
16~25分钟,25%甲醇水;
[0084]
25~38分钟,25%甲醇水~45%甲醇水;
[0085]
38~40分钟,45%甲醇水~100%甲醇;
[0086]
40~42分钟,100%甲醇~5%甲醇水;
[0087]
42~55分钟,5%甲醇水;
[0088]
所述甲醇水的浓度为体积浓度。
[0089]
本发明提供了上述egcg
‑
葡萄糖加合物作为苦涩味掩味剂的应用。在本发明中,所述掩味剂优选为茶叶或茶饮料的掩味剂。
[0090]
本发明提供了一种掩味剂、包括上述egcg
‑
葡萄糖加合物和食用辅料。
[0091]
在本发明中,所述食用辅料优选为淀粉、糊精、乳糖、甘露醇和纤维素中的一种或几种。在本发明中,所述egcg
‑
葡萄糖加合物和食用辅料的质量比优选为1:1~300,更优选为1:10~200,进一步优选为1:50~100。
[0092]
下面结合实施例对本发明提供的egcg
‑
葡萄糖加合物及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0093]
实施例1
[0094]
(一)egcg
‑
葡萄糖加合物的制备
[0095]
(1)分别称取5g的egcg和5g的葡萄糖(分析级标准品,纯度95%)于试管中,加入10毫升纯水(ph=8),涡旋3分钟,并超声3分钟,然后转移到150℃的油浴锅中加热60分钟;
[0096]
(2)将egcg和葡萄糖的亲核加成产物用纯甲醇溶液溶解,甲醇溶液溶解时少量多次,将产物溶解完全,合并甲醇溶液,并进行减压浓缩至10毫升,得到亲核加成产物;
[0097]
(3)将egcg和葡萄糖的亲核加成产物用纯甲醇溶液溶解后,将甲醇溶液溶解后的亲核加成产物过sephadex lh
‑
20凝胶柱,分3次上样,每次上样体积为3~4毫升;sephadex lh
‑
20凝胶柱使用纯甲醇溶液进行等度洗脱,然后将甲醇洗脱得到的不同组分样品通过薄层层析板快速分离,以氯仿/丙酮/甲酸(12:7:2,v/v/v)作为展开剂,通过硫酸乙醇溶液进行显色,通过对显色后硅胶板上的斑点进行合并处理,共得到组分4个组分(fr.1~fr4)。然后将组分fr.1通过干法上样,过硅胶柱(100~200目),硅胶柱的洗脱液为氯仿/丙酮/甲酸(12:7:2,v/v/v),对洗脱液洗脱后的样品通过薄层层析板快速分离,并用香草醛硫酸乙醇溶液进行显色,通过对显色后硅胶板上的斑点进行合并处理,得到组分fr.1~fr3。最后将硅胶柱分离得到的组分fr.2用高效液相设备分离,高效液相设备采用的分离色谱柱为agilentzorbax sb
‑
aq c
18
(250
×
4.6mm,5μm)柱,流速1毫升/分钟,流动相为甲醇(b相)和0.2%甲酸水(a相),洗脱条件为:梯度洗脱0
‑
4分钟,5%甲醇水
‑
20%甲醇水;4
‑
16分钟,20%甲醇水
‑
23%甲醇水;16
‑
19分钟,23%甲醇水;19
‑
20分钟,23%甲醇水
‑
42%甲醇水;20
‑
21分钟,42%甲醇水
‑
100%甲醇;21
‑
22分钟,100%甲醇
‑
5%甲醇水;22
‑
28分钟,5%甲醇水。
[0098]
依次得到egcg
‑
葡萄糖加合物1(6
‑
c
‑
substituted product of(
‑
)
‑
epigallocatechin
‑3‑
o
‑
gallate)(保留时间13.046分钟,质量6.1毫克),egcg
‑
葡萄糖加合物2(8
‑
c
‑
substitutedproduct of(
‑
)
‑
epigallocatechin
‑3‑
o
‑
gallate)(保留时间15.147分钟,质量10.0毫克),egcg
‑
葡萄糖加合物3(8
‑
c
‑
glucosyl
‑
(
‑
)
‑
epigallocatechin
‑3‑
o
‑
gallate)(保留时间18.709分钟,质量6.3毫克),egcg
‑
葡萄糖加合物4(6/8
‑
c
‑
glucosyl
‑
(
‑
)
‑
epigallocatechin
‑3‑
o
‑
gallate)(保留时间20.237分钟,质量17.5毫克)。
[0099]
分离纯化的流程图如图1所示。
[0100]
(二)egcg
‑
葡萄糖加合物的性状验证
[0101]
egcg
‑
葡萄糖加合物1的特性如下:
[0102]
1)、可溶于甲醇和氘代丙酮,棕黄色无定型粉末;
[0103]
2)、uvλ
max
(nm):240,280;
[0104]
3)、lc
‑
ms(负离子模式):m/z=763.1728([m
‑
h]
‑
,c
34
h
36
o
20
‑
理论计算值为763.1799);
[0105]
4)、核磁共振光谱数据见表1。
[0106]
egcg
‑
葡萄糖加合物2的特性如下:
[0107]
1)、可溶于甲醇和氘代丙酮,棕黄色无定型粉末;
[0108]
2)、uvλ
max
(nm):240,280;
[0109]
3)、lc
‑
ms(负离子模式):m/z=763.1741([m
‑
h]
‑
,c
34
h
36
o
20
‑
理论计算值为763.1799);
[0110]
4)、核磁共振波谱数据见表1。
[0111]
egcg
‑
葡萄糖加合物3的特性如下:
[0112]
1)、可溶于甲醇和氘代丙酮,棕黄色无定型粉末;
[0113]
2)、uvλmax(nm):240,280;
[0114]
4)、lc
‑
ms(负离子模式):m/z=619.1304([m
‑
h]
‑
,c
28
h
28
o
16
‑
理论计算值为619.1377);
[0115]
egcg
‑
葡萄糖加合物4的特性如下:
[0116]
1)、可溶于甲醇和氘代丙酮,棕黄色无定型粉末;
[0117]
2)、uvλ
max
(nm):240,280;
[0118]
3)、lc
‑
ms(负离子模式):m/z=781.1862([m
‑
h]
‑
,c
34
h
38
o
21
‑
理论计算值为781.1905);
[0119]
4)、核磁共振波谱数据见表1。
[0120]
表1 egcg
‑
葡萄糖加合物的核磁共振波谱数据
[0121]
[0122][0123]
注:1h nmr和
13
c nmr在600mhz条件下测试,δ单位为ppm,溶剂为氘代丙酮和氘代重水,表格的空白处说明此处无数据。
[0124]
由表1可以看出,egcg
‑
葡萄糖加合物1、egcg
‑
葡萄糖加合物2、egcg
‑
葡萄糖加合物3、egcg
‑
葡萄糖加合物4的结构与式i、式ii、式iii、式iv所示结构相对应。
[0125]
性能测试
[0126]
egcg
‑
葡萄糖加合物对苦味和涩味强度抑制实验
[0127]
滋味审评小组的组建:根据中国传统茶叶感官评价标准(gb/t23776
‑
2018),由10名经过培训的小组成员对egcg
‑
葡萄糖模拟烘焙前后样品的苦味和涩味强度进行评价。进行审评前,所有小组成员在3周内进行了9次培训。为了更准确的评价苦味和涩味强度,便于量化,采用不同浓度(0、1、2、3、4、5mm)的egcg水溶液进行苦味和涩味审评训练,对应的苦味和涩味分值分别为0、1、2、3、4、5分。
[0128]
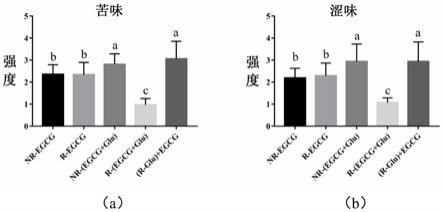
egcg和葡萄糖的烘焙反应:
[0129]
样品组1,称取50毫克的egcg于试管中,加入200微升的纯水,涡旋2~3分钟,使其充分溶解混匀,将样品转移到150℃油浴锅中加热60分钟,然后立即取出,待其冷却后使用纯水溶解,并转移到50毫升的容量瓶中,然后进行定容(命名为r
‑
egcg);以未烘焙egcg为对照,用纯水溶解并定容到50毫升的容量瓶中(命名为nr
‑
egcg)。
[0130]
样品组2,分别称取50毫克的egcg和葡萄糖于试管中,加入200微升的纯水,涡旋2~3分钟,使其充分溶解混匀,将样品转移到150℃油浴锅中加热60分钟,然后立即取出,待其冷却后使用纯水溶解,并转移到50毫升的容量瓶中,然后进行定容(命名为r
‑
(egcg glu));以未烘焙egcg和葡萄糖为对照,用纯水溶解并定容到50毫升的容量瓶中(命名为(nr
‑
(egcg glu))。
[0131]
样品组3,称取50毫克的葡萄糖于试管中,加入200微升的纯水,涡旋2~3分钟,使其充分溶解混匀,将样品转移到150℃油浴锅中加热60分钟,然后立即取出,待其冷却后使用纯水溶解,并转移到50毫升的容量瓶中,并加入50毫克的egcg,然后进行溶解定容(命名为(r
‑
glu) egcg)。对egcg和葡萄糖烘焙前后样品进行苦味和涩味强度评价,结果见图2。图2中(a)为egcg
‑
葡萄糖烘焙前后苦味强度变化图,(b)为egcg
‑
葡萄糖烘焙前后涩味强度变化图。
[0132]
滋味评价结果表明,egcg和葡萄糖烘焙前后的苦味和涩味均有显著差异,烘焙后苦味和涩味显著降低。而egcg烘焙前后的苦味和涩味强度均不显著,说明egcg烘焙后降解或异构化产物对苦味和涩味影响不大。为了证明egcg和葡萄糖经过烘焙后的苦味和涩味强度显著降低,并不是由于葡萄糖烘焙后的产物对egcg的苦味和涩味强度有抑制或掩盖作用。将烘焙后的葡萄糖溶于水中,加入等量的egcg重新评价苦味和涩味强度,发现苦味和涩味强度变化不显著。而r
‑
(egcg glu)样品的苦味和涩味明显低于(r
‑
glu) egcg样品。因此,egcg和葡萄糖在烘焙后的苦味和涩味显著降低是由于在烘焙处理后形成了egcg
‑
葡萄糖加合物。茶叶经高温烘焙后,苦味和涩味显著降低,可能是由于具有较高强度苦味和涩味的儿茶素类物质(egcg)与糖(葡萄糖)形成了儿茶素
‑
糖的加合物,抑制或屏蔽了茶叶的苦味和涩味。而茶饮料在加工的过程中也会有高温加热的过程,在茶饮料中也可能形成儿茶素
‑
糖的加合物,抑制或掩蔽茶饮料的苦味和涩味。由此可知,egcg
‑
葡萄糖加合物可开发为一种对茶叶或茶饮料苦味或涩味的抑制剂或掩蔽剂,在食品或饮料领域具有广泛的应用前景。
[0133]
egcg
‑
葡萄糖加合物的检测
[0134]
分别称取黄大茶茶叶(粉末)各100毫克,置于5毫升离心管,加入3毫升的70%甲醇溶液,涡旋均匀,常温超声提取10分钟,5000转/分钟离心10分钟,取上清液至10毫升容量瓶。茶渣用70%甲醇再提取两次,重复以上步骤,合并提取液,用70%甲醇定容至10毫升容
量瓶,摇匀,过0.22微米有机微孔滤膜,作为母液,待测,每个样品三个平行。
[0135]
采用uplc
‑
ms检测方法,流速1毫升/分钟(因流速较大,进行检测分析时需要接三通),流动相:a相为0.2%甲酸水,b相为甲醇,洗脱条件:0~5分钟,5%甲醇水~20%甲醇水;5~16分钟,20%甲醇水~25%甲醇水;16~25分钟,25%甲醇水;25~38分钟,25%甲醇水~45%甲醇水;38~40分钟,45%甲醇水~100%甲醇;40~42分钟,100%甲醇~5%甲醇水;42~55分钟,5%甲醇水。
[0136]
以egcg
‑
葡萄糖加合物1、egcg
‑
葡萄糖加合物2、egcg
‑
葡萄糖加合物3和egcg
‑
葡萄糖加合物4为标品,对实施例1所得亲核加成产物和黄大茶样品进行uplc
‑
ms检测,其中egcg
‑
葡萄糖加合物1的碎片离子图如图3所示,egcg
‑
葡萄糖加合物2的碎片离子图如图4所示,egcg
‑
葡萄糖加合物3的碎片离子图如图5所示,egcg
‑
葡萄糖加合物4的碎片离子图如图6所示,亲核加成产物和黄大茶样品的uplc
‑
ms检测如图7所示。由图7可以看出,在负离子模式下,茶叶中检测到上述egcg
‑
葡萄糖加合物1的质荷比为763.1728,保留时间12.453分钟;egcg
‑
葡萄糖加合物2的质荷比为763.1741,保留时间14.326分钟;egcg
‑
葡萄糖加合物3的质荷比为619.1304,保留时间17.636分钟;egcg
‑
葡萄糖加合物4的质荷比为781.1862,保留时间18.300分钟。
[0137]
茶汤苦味和涩味抑制测试
[0138]
称取3g的绿茶于审评杯中,加入150ml的开水冲泡5分钟后进行茶水分离,待茶汤冷却后,加入10mg/ml的egcg
‑
葡萄糖加合物水溶液(水溶液中egcg
‑
葡萄糖加合物1、egcg
‑
葡萄糖加合物2、egcg
‑
葡萄糖加合物3、egcg
‑
葡萄糖加合物4的质量比为1:1:1:1)各4、8和12ml,以茶汤加12ml纯水作为对照,搅拌混匀后分别对每个样品进行苦味和涩味评分(n=3)。审评结果如图8所示,图8中(a)为苦味评审结果,(b)为涩味评审结果。从图8中可以看出,随着egcg
‑
葡萄糖加合物加入量的增多,茶汤的苦味和涩味都显著降低。说明egcg
‑
葡萄糖加合物对茶汤的苦味和涩味强度确实具有掩盖或抑制作用。
[0139]
咖啡碱、egcg和奎宁酸苦味和涩味抑制测试
[0140]
分别配制5mm的咖啡碱、egcg和奎宁酸溶液各100ml;以及配制5mm的egcg加合物1、egcg加合物2、egcg加合物3和egcg加合物4溶液各25ml。参照上述egcg苦味和涩味的强度的评分方法,5mm的咖啡碱、egcg和奎宁酸溶液对应的苦味或涩味的分值为5。然后将咖啡碱、egcg和奎宁酸溶液分别与egcg
‑
葡萄糖加合物溶液按照体积比为5:1进行混合,然后审评小组成员分别对各混合样品进行苦味或涩味审评。由于咖啡碱主要为苦味、奎宁酸主要为涩味,而egcg主要为苦味和涩味,所以对咖啡碱、egcg和奎宁酸苦味和涩味抑制测试审评结果如表2所示。从表2中可看出,egcg
‑
葡萄糖加合物能显著抑制咖啡碱的苦味、egcg的苦味和涩味以及奎宁酸的涩味;并且egcg
‑
葡萄糖加合物3和egcg
‑
葡萄糖加合物4的抑制效果较好。说明egcg
‑
葡萄糖加合物对咖啡碱、egcg和奎宁酸苦味和涩味确实具有掩盖或抑制作用。
[0141]
表2 egcg
‑
葡萄糖加合物对咖啡碱、egcg和奎宁酸苦味或涩味抑制审评结果
[0142][0143]
注:表中空白处表示无数据。表中上表的a,b,c分别表示p<0.05,p<0.01,p<0.001。
[0144]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润、饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

