1.本发明属于药物合成领域,具体涉及一种含氮杂芳类衍生物的盐及其晶型、其制备方法和应用。
背景技术:
2.shp
‑
2(src homology
‑
2domain
‑
containing phosphatase 2),又称ptpn11(tyrosine
‑
protein phosphatase non
‑
receptor type 11),由ptpn11基因编码,隶属于蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,ptps)家族。作为细胞因子、生长因子及其他胞外刺激因素的下游信号分子,shp
‑
2广泛表达于机体各组织和细胞,参与细胞信号转导,调节细胞生长、分化、迁移、代谢、基因转录和免疫应答等。
3.shp
‑
2主要有3个组成部分:sh
‑
2结构域(n
‑
sh2和c
‑
sh2)、ptp活性结构域、c
‑
末端(含酪氨酸磷酸化位点)。其中sh2结构域高度保守,是磷酸酪氨酸结合位点,并介导ptp结构域与其配体的结合。
4.shp
‑
2在机体内主要有2种状态:失活与激活。在失活状态下,shp
‑
2内部n
‑
sh2与ptp结构域相互结合,由于ptp结构域被占领,使shp
‑
2失活。而当n
‑
sh2与磷酸化酪氨酸残基配体特异性结合时,ptp结构域重新暴露,shp
‑
2恢复活性。据最新研究表明,shp
‑
2还能在体内形成二聚体,同样也可导致shp
‑
2失活。
5.shp
‑
2主要通过调节erk/mapk、jak
‑
stat、pi3k/akt、hippo、wnt/β
‑
catenin等信号通路发挥功能,以此维持生物体发育和体内动态平衡。具体研究表明,shp
‑
2通过直接与酪氨酸激酶受体(receptor tyrosine kinase,rtks)或scaffold结合,参与激活erk/mapk通路。除此之外,活化的shp
‑
2还能招募grb2/sos,间接促进ras信号通路的激活。此外,shp
‑
2还参与抑制免疫反应的信号传导,如shp
‑
2与shp
‑
1能够结合并激活免疫抑制受体(如pd
‑
1),阻断t细胞激活。
6.作为一类重要的细胞信号因子,shp
‑
2突变与多种疾病密切相关。研究发现:在神经母细胞瘤、aml(4%)、乳腺癌、nsclc(10%)、肺腺癌(30%)、食道癌、头颈部肿瘤、黑色素瘤和胃癌中,发现存在shp
‑
2突变。
7.shp
‑
2的突变位点多发生在n
‑
sh2、ptp活性区域,解除了n
‑
ch2/ptp结构域的相互抑制,产生高活性的shp
‑
2,如cys459ser mutant、e76k mutant等突变均会影响shp
‑
2活性。有研究表明,高活性的shp
‑
2与炎症、肝硬化、幽门螺旋杆菌所分泌的毒素caga等密切相关,能够导致肿瘤的再生与发展,相当于原癌基因。随着对shp
‑
2认识的不断深入,shp
‑
2已经作为肿瘤治疗靶点进行药物的开发。
8.目前已有多个shp
‑
2的变构抑制剂进入临床研究阶段,如novartis公司开发的tno
‑
155,revolution medicine公司开发的rmc
‑
4630,以及北京加科思的jab
‑
3068都已经进入临床i期研究阶段。但还没有一款开发上市的shp
‑
2抑制剂用于制备治疗努南氏症候群、豹皮症候群、白血病、神经母细胞瘤、黑色素瘤、乳腺癌、食道癌、头颈部肿瘤、肺癌及其结肠癌。因此迫切需要开发一类成药性好的shp
‑
2抑制剂药物。
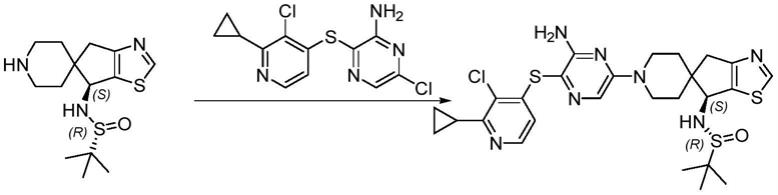
9.pct专利(申请号:pct/cn2019/110314)中公开了一系列含氮杂芳类衍生物抑制剂的结构,在后续的研发中,为了产物易于处理、过滤和干燥,寻求适合的便于储存、产品长期稳定、生物利用度高等特点,本发明对上述物质的自由碱的不同酸式盐进行了全面的研究,致力于得到最适合的晶型。
技术实现要素:
10.专利pct/cn2019/110314所涉及的所有内容均以引证的方式添加到本发明中。
11.本发明的目的在于提供一种通式(i)所示化合物的酸式盐,其结构如下:
[0012][0013]
其中:
[0014]
r1选自氢、卤素、c1‑6烷基、c1‑6烷氧基、c1‑6羟烷基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基或5
‑
12元杂芳基,其中所述的c1‑6烷基、c1‑6烷氧基、c1‑6羟烷基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基,任选进一步被氘、卤素、氨基、硝基、羟基、氰基、氧代基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6羟烷基、c1‑6卤代烷氧基、c2‑6烯基、c2‑6炔基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基中的一个或多个取代基所取代;
[0015]
r2选自氢、氨基或c1‑6烷基;
[0016]
r3选自氢、卤素、氨基、氰基、c1‑6烷基、c1‑6烷氧基、c1‑6羟烷基、c3‑8环烷基或3
‑
12元杂环基,其中所述的c1‑6烷基、c1‑6烷氧基、c1‑6羟烷基、c3‑8环烷基和3
‑
12元杂环基,任选进一步被氘、卤素、氨基、硝基、羟基、氰基、氧代基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6羟烷基、c1‑6卤代烷氧基、c2‑6烯基、c2‑6炔基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基中的一个或多个取代基所取代;
[0017]
r4选自氢、氘、卤素、氨基、硝基、羟基、氰基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6羟烷基、c1‑6卤代烷氧基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基或5
‑
12元杂芳基;
[0018]
r5和r6各自独立地选自氢、氘、卤素、氨基、硝基、羟基、氰基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6卤代烷氧基、c1‑6羟烷基、c2‑6烯基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基或5
‑
12元杂芳基,其中所述的c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6卤代烷氧基、c1‑6羟烷基、c2‑6烯基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基,任选进一步被氘、卤素、氨基、硝基、羟基、氰基、氧代基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6羟烷基、c1‑6卤代烷氧基、c2‑6烯基、c2‑6炔基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基中的一个或多个取代基所取代;
[0019]
或者,r5和r6链接形成一个c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基或5
‑
12元杂芳基,其中所述的c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基,任选进一步被选自氘、卤素、氨基、硝基、羟基、氰基、氧代基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6羟
烷基、c1‑6卤代烷氧基、c2‑6烯基、c2‑6炔基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基和5
‑
12元杂芳基中的一个或多个取代基所取代;
[0020]
m为无机酸或有机酸,其中所述无机酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸或磷酸;有机酸选自2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙烷磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲苯磺酸或l
‑
苹果酸;且
[0021]
y为1、2或3。
[0022]
在本发明进一步优选的实施方式中,r1选自氢、卤素、c1‑6烷基、c1‑6羟烷基、c3‑8环烷基或3
‑
12元杂环基,其中所述的c1‑6烷基、c1‑6羟烷基、c3‑8环烷基和3
‑
12元杂环基,任选进一步被氘、卤素、羟基、氧代基、c1‑6烷基和c3‑8环烷基中的一个或多个取代基所取代;更优选氢、卤素、c1‑3烷基、c1‑3羟烷基、c3‑6环烷基或3
‑
6元杂环基,其中所述的c1‑3烷基、c1‑3羟烷基、c3‑6环烷基和3
‑
6元杂环基,任选进一步被氘、卤素、羟基、氧代基、c1‑3烷基和c3‑6环烷基中的一个或多个取代基所取代;进一步优选氢、氟、溴、甲基、羟乙基、一个或多个取代基所取代;进一步优选氢、氟、溴、甲基、羟乙基、
[0023]
在本发明进一步优选的实施方式中,r2选自氢、氨基或c1‑6烷基;优选氢、氨基或c1‑3烷基;更优选氢、氨基、甲基、乙基或丙基;进一步优选氢、氨基或甲基。
[0024]
在本发明进一步优选的实施方式中,r3选自氢、卤素、氨基、c1‑6烷基、c3‑8环烷基或3
‑
12元杂环基,其中所述的c1‑6烷基、c3‑8环烷基和3
‑
12元杂环基,任选进一步被氘、卤素、氧代基中的一个或多个取代基所取代;优选氢、卤素、氨基、c1‑3烷基、c3‑6环烷基或3
‑
6元杂环基,其中所述的c1‑3烷基、c3‑6环烷基和3
‑
6元杂环基,任选进一步被氘、卤素、氧代基中的一个或多个取代基所取代;进一步优选氨基、氯、环丙基、氮杂环丁基、四氢吡咯基、吗啡啉基、丁基、四氢吡咯基、吗啡啉基、
[0025]
在本发明进一步优选的实施方式中,r4选自氢、卤素、c1‑6烷基或c3‑8环烷基;优选氢、卤素、c1‑3烷基或c3‑6环烷基;进一步优选氢、氟、氯、甲基或环丙基。
[0026]
在本发明进一步优选的实施方式中,r5和r6各自独立地选自氢、c1‑6烷基、c1‑6卤代烷基、c2‑6烯基或c3‑8环烷基,其中所述的c1‑6烷基、c1‑6卤代烷基、c2‑6烯基和c3‑8环烷基,任选进一步被氘、卤素、c1‑6烷基中的一个或多个取代基所取代;优选氢、c1‑3烷基、c2‑4烯基或c3‑6环烷基,其中所述的c1‑3烷基、c2‑4烯基和c3‑6环烷基,任选进一步被氘、卤素、c1‑3烷基中的一
个或多个取代基所取代;进一步优选氢、甲基、乙基、异丙基、乙烯基、环丙基、
[0027]
或者,r5和r6链接形成一个c3‑8环烷基、6
‑
12芳基或5
‑
12元杂芳基,其中所述的c3‑8环烷基、6
‑
12芳基和5
‑
12元杂芳基,任选进一步被选自氘、卤素或c1‑6烷基中的一个或多个取代基所取代;优选c3‑6环烷基、苯基或5
‑
6元杂芳基,其中所述的c3‑6环烷基、苯基和5
‑
6元杂芳基,任选进一步被选自氘、卤素或c1‑3烷基中的一个或多个取代基所取代;进一步优选烷基中的一个或多个取代基所取代;进一步优选
[0028]
在本发明进一步优选的实施方式中,m选自盐酸、磷酸、醋酸、苯甲酸、对甲苯磺酸、琥珀酸、酒石酸、乙烷磺酸、苯磺酸、富马酸、羟乙基磺酸、草酸、氢溴酸或龙胆酸;优选盐酸、乙烷磺酸、苯磺酸、富马酸、羟乙基磺酸、草酸、氢溴酸或龙胆酸;进一步优选盐酸或乙烷磺酸;且
[0029]
y为1或2。
[0030]
在本发明进一步优选的实施方式中,所述化合物结构如式(ii)所示:
[0031][0032]
其中:
[0033]
环a选自c3‑8环烷基、3
‑
12元杂环基、c6‑
10
芳基或5
‑
12元杂芳基;
[0034]
r
a
选自氢、氘、卤素、氨基、硝基、羟基、氰基、c1‑6烷基、c1‑6氘代烷基、c1‑6卤代烷基、c1‑6烷氧基、c1‑6羟烷基、c1‑6卤代烷氧基、c2‑6烯基、c2‑6炔基、c3‑8环烷基、3
‑
12元杂环基、c6‑
12
芳基或5
‑
12元杂芳基;且
[0035]
x为0、1、2或3。
[0036]
在本发明进一步优选的实施方式中,所述环a为苯基。
[0037]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的酸式盐,优选盐酸盐、乙烷磺酸盐、苯磺酸盐、富马酸盐、羟乙基磺酸盐、草酸盐、氢溴酸盐或龙胆酸盐,所述化合物为式(iii)所示:
[0038][0039]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡
啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐。
[0040]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙烷磺酸盐。
[0041]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的苯磺酸盐。
[0042]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的富马酸盐。
[0043]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的羟乙基磺酸盐。
[0044]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的草酸盐。
[0045]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的氢溴酸盐。
[0046]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的龙胆酸盐。
[0047]
在本发明进一步优选的实施方式中,所述酸式盐中,酸的个数为1
‑
3,优选1、1.5、2、2.5或3,更优选1或2。
[0048]
本发明进一步提供了一种制备所述酸式盐的方法,具体包括如下步骤:
[0049]
1)称取适量的化合物自由碱,用良性溶剂溶解;
[0050]
2)将酸m用有机溶剂溶解;酸m的量优选2当量;
[0051]
3)将步骤1)和2)得到的两种溶液合并,得盐溶液,搅拌析出或滴加不良溶剂后搅拌析出;
[0052]
4)快速离心或静置吹干得目标产物;
[0053]
其中:
[0054]
所述步骤1)的良性溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、乙腈、2
‑
丁酮、3
‑
戊酮、四氢呋喃、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选甲醇或乙醇;
[0055]
所述步骤2)的有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈;
[0056]
所述步骤1)的良性溶剂和步骤2)有机溶液使用时需互溶;
[0057]
所述步骤3)的不良溶剂选自庚烷、水、甲基叔丁基醚、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈;优选水、甲基叔丁基醚或异丙醚。
[0058]
或者,
[0059]
1)称取适量的自由碱,用良性溶剂溶解,
[0060]
2)称取适量的酸,用有机溶剂溶解;酸的量优选1.2当量,
[0061]
3)把上述两种溶液合并,搅拌析出或滴加不良溶剂后搅拌析出,
[0062]
4)干燥得目标产物,
[0063]
其中:
[0064]
良性溶剂选自甲醇、二氯甲烷、1,4
‑
二氧六环、丙酮、四氢呋喃、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选甲醇或四氢呋喃,
[0065]
有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈;上述良性溶剂和有机溶液使用时需互溶,
[0066]
不良溶剂选自庚烷、水、甲基叔丁基醚、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈;优选水、甲基叔丁基醚、异丙醚;
[0067]
或者,
[0068]
1)称取适量的自由碱,用不良溶剂1混悬,
[0069]
2)称取适量的酸,用有机溶剂溶解;酸的量优选1.2当量,
[0070]
3)把上述两种溶液合并搅拌溶解,继续搅拌析出或滴加不良溶剂2后搅拌析出,
[0071]
4)干燥得目标产物,
[0072]
不良溶剂1选自乙酸乙酯、丙酮、二氯甲烷、乙腈、四氢呋喃、2
‑
甲基
‑
四氢呋喃、2
‑
丁酮、3
‑
戊酮、1,4
‑
二氧六环、乙醇;优选乙酸乙酯、丙酮、乙腈、2
‑
甲基
‑
四氢呋喃、乙醇,
[0073]
有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈;上述良性溶剂和有机溶液使用时需互溶,
[0074]
不良溶剂2选自庚烷、水、甲基叔丁基醚、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈;优选水、甲基叔丁基醚、异丙醚;
[0075]
酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙烷磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲苯磺酸或l
‑
苹果酸;优选富马酸、对甲苯磺酸或丁二酸;最优选对甲苯磺酸。
[0076]
在本发明进一步优选的实施方式中,所述的式(i)为晶型或无定型。
[0077]
在本发明进一步优选的实施方式中,所述的式(i)为水合物或无水物,优选无水物。
[0078]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的酸式盐晶型,优选盐酸盐、乙烷磺酸盐、苯磺酸盐、富马酸盐、羟乙基磺酸盐、草酸盐、氢溴酸盐或龙胆酸盐晶型。
[0079]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型。
[0080]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙烷磺酸盐晶型。
[0081]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的苯磺酸盐晶型。
[0082]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的富马酸盐晶型。
[0083]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的羟乙基磺酸盐晶型。
[0084]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的草酸盐晶型。
[0085]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的氢溴酸盐晶型。
[0086]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的龙胆酸盐晶型。
[0087]
在本发明进一步优选的实施方式中,所述酸式盐晶型中,酸的个数为1
‑
3,优选1、1.5、2、2.5或3。
[0088]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的酸式盐,优选甲磺酸盐、羟乙基磺酸盐、富马酸盐、对甲苯磺酸盐、乙烷磺酸盐、丁二酸盐、氢溴酸盐、盐酸盐、马来酸盐、酒石酸盐或硫酸盐,
[0089]
其中,所述对甲苯磺酸盐成盐的酸的个数为1,富马酸盐成盐的酸的个数为0.5,丁二酸盐成盐的酸的个数为0.5。
[0090]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的甲磺酸盐晶型。
[0091]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型。
[0092]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型。
[0093]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型。
[0094]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型。
[0095]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型。
[0096]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型。
[0097]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型。
[0098]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡
啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型。
[0099]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的酒石酸盐晶型。
[0100]
在本发明进一步优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型。
[0101]
在本发明进一步优选的实施方式中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型,其为盐酸盐晶型a,所述盐酸的个数为1或2,优选式(iii)化合物与乙烷磺酸成盐比为1:1。经esld检测分析盐酸中游离碱与氯离子含量摩尔比为1:1,可见(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺游离碱与盐酸的成盐比可以为1:1。
[0102]
其中,x
‑
射线粉末衍射图谱在2θ为15.1
°
、21.0
°
、22.6
°
和23.7
°
处具有衍射峰;还包含在2θ为8.4
°
、9.4
°
、16.7
°
、18.4
°
和25.5
°
处具有衍射峰;进一步包含在2θ为14.5
°
、19.2
°
、20.5
°
、24.8
°
、25.1
°
、27.8
°
和31.4
°
处具有衍射峰;更进一步包含在2θ为11.3
°
、16.3
°
、23.4
°
、24.1
°
、26.4
°
、28.2
°
、29.0
°
、30.6
°
、32.3
°
、32.8
°
、35.6
°
和37.0
°
处具有衍射峰。最优选地,其xrpd图谱基本如图1所示。
[0103]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表1所示。
[0104]
表1
[0105][0106][0107]
本发明化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型a,其dsc图谱基本如图2所示;其tga图谱基本如图3所示。
[0108]
在本发明的一个优选实施例方案中,化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型,其盐酸盐晶型b,所述盐酸的个数为1或2,优选1。
[0109]
其中,x
‑
射线粉末衍射图谱在2θ为6.9
°
、13.8
°
、18.0
°
和21.7
°
处具有衍射峰;进一步包含在2θ为8.8
°
、9.1
°
、13.6
°
和23.9
°
处具有衍射峰;更进一步包含在2θ为18.5
°
、25.0
°
、26.2
°
和27.5
°
处具有衍射峰。
[0110]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表2所示。
[0111]
表2
[0112][0113]
本发明化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型b,其dsc图谱基本如图4所示;其tga图谱基本如图5所示。
[0114]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙烷磺酸盐晶型,其晶型a,所述乙烷磺酸的个数为1或2,优选式(iii)化合物与乙烷磺酸成盐比为1:2。通过乙烷磺酸盐核磁标定含量的图谱(图17),谱图分析结果:δ1.07
‑
1.11ppm处有一组三重峰,归属于乙烷磺酸甲基,单质子吸收峰面积为4.820/3=1.607,式(iii)化合物平均单质子吸收峰面积约为0.783,乙烷磺酸盐成盐比为1.607/0.783≈2,通过计算式(iii)化合物:乙烷磺酸=1:2。可见式(iii)化合物游离碱与乙烷磺酸的成盐比可以为1:2。
[0115]
其中,x
‑
射线粉末衍射图谱在2θ为8.3
°
、11.6
°
和18.3
°
处具有衍射峰;还包含在2θ为13.4
°
、15.3
°
、18.5
°
、20.4
°
、21.0
°
和23.4
°
处具有衍射峰;进一步包含在2θ为10.7
°
、12.6
°
、14.1
°
、21.9
°
、22.5
°
和25.3
°
处具有衍射峰。优选地,其xrpd图谱基本如图6所示。
[0116]
本发明所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙烷磺酸盐晶型a,其dsc图谱基本如图7所示;其tga图谱基本如图8所示。
[0117]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的苯磺酸盐晶型,其为晶型a,所述苯磺酸的个数为1或2。
[0118]
其中,x
‑
射线粉末衍射图谱在2θ为12.8
°
、15.3
°
、21.4
°
和25.8
°
处具有衍射峰;还包含在2θ为7.4
°
、11.1
°
和22.3
°
处具有衍射峰;进一步包含在2θ为14.8
°
、16.2
°
、18.1
°
、19.8
°
、20.9
°
、23.8
°
和24.7
°
处具有衍射峰;更进一步包含在2θ为15.9
°
、16.5
°
、19.0
°
、22.8
°
、27.3
°
和28.3
°
处具有衍射峰。
[0119]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表4所示。
[0120]
表3
[0121][0122][0123]
本发明所述的通式(i)所示化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的苯磺酸盐晶型a其dsc图谱基本如图9所示;其tga图谱基本如图10所示。
[0124]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的富马酸盐晶型,其为晶型a,所述富马酸的个数为1或2。
[0125]
其中,x
‑
射线粉末衍射图谱在2θ为8.6
°
和16.9
°
处具有衍射峰;还包含在2θ为11.5
°
、13.0
°
和22.1
°
处具有衍射峰;进一步包含在2θ为4.1
°
、18.6
°
、23.2
°
、23.9
°
和26.8
°
处具有衍射峰;更进一步包含在2θ为19.5
°
、23.5
°
和26.0
°
处具有衍射峰。
[0126]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表5所示。
[0127]
表4
[0128][0129]
本发明所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的富马酸盐晶型a,其dsc图谱基本如图11所示;其tga图谱基本如图12所示。
[0130]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的羟乙基磺酸盐晶型,其为晶型a,所述羟乙基磺酸的个数为1或2。
[0131]
其中,x
‑
射线粉末衍射图谱在2θ为12.3
°
、16.5
°
和24.8
°
处具有衍射峰;还包含在2θ为15.0
°
、18.8
°
、26.1
°
和27.5
°
处具有衍射峰;进一步包含在2θ为14.0
°
、16.2
°
和18.7
°
处具有衍射峰。
[0132]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表6所示。
[0133]
表5
[0134][0135]
本发明所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的羟乙基磺酸盐晶型a,其dsc图谱基本如图13所示;其tga图谱基本如图14所示。
[0136]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的草酸盐晶型,其为晶型a,所述草酸的个数为1或2。
[0137]
其中,x
‑
射线粉末衍射图谱在2θ为14.3
°
、17.8
°
和23.3
°
处具有衍射峰;还包含在2θ为6.6
°
、11.9
°
、20.2
°
和26.1
°
处具有衍射峰;进一步包含在2θ为8.7
°
、15.7
°
、24.5
°
、27.6
°
和28.9
°
处具有衍射峰。
[0138]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表7所示。
[0139]
表6
[0140][0141][0142]
本发明所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的草酸盐晶型a其dsc图谱基本如图15所示;其
tga图谱基本如图16所示。
[0143]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的氢溴盐晶型,其为晶型a,所述酸的个数为1或2。
[0144]
其中,x
‑
射线粉末衍射图谱在2θ为13.0
°
、19.3
°
和25.2
°
处具有衍射峰;还包含在2θ为7.1
°
、24.3
°
、26.6
°
和27.1
°
处具有衍射峰;进一步包含在2θ为6.0
°
、12.7
°
、14.0
°
、19.9
°
、21.6
°
、22.0
°
、25.7
°
和26.3
°
处具有衍射峰;更进一步包含在2θ为11.1
°
、12.0
°
、20.3
°
、22.5
°
、27.9
°
和30.5
°
处具有衍射峰。
[0145]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表8所示。
[0146]
表7
[0147][0148][0149]
在本发明的一个优选实施例方案中,所述化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的龙胆酸盐晶型,其为晶型a,所述龙胆酸的个数为1或2。
[0150]
其中,x
‑
射线粉末衍射图谱在2θ为12.4
°
、17.6
°
、20.8
°
和22.2
°
处具有衍射峰;还包含在2θ为7.5
°
、8.5
°
、15.8
°
和25.8
°
处具有衍射峰;进一步包含在2θ为5.7
°
、10.6
°
、14.8
°
、17.1
°
、18.9
°
和24.9
°
处具有衍射峰。
[0151]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表9所示。
[0152]
表8
[0153][0154][0155]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的甲磺酸盐晶型a。
[0156]
其中,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱在20.0
±
0.2
°
处具有衍射峰;或者在17.8
±
0.2
°
处具有衍射峰;或者在24.2
±
0.2
°
处具有衍射峰;或者在22.2
±
0.2
°
处具有衍射峰;或者在24.6
±
0.2
°
处具有衍射峰;或者在12.5
±
0.2
°
处具有衍射峰;或者在28.6
±
0.2
°
处具有衍射峰;或者在18.8
±
0.2
°
处具有衍射峰;或者在11.0
±
0.2
°
处具有衍射峰;或者在14.2
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0157]
优选的,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为20.0
±
0.2
°
、
17.8
±
0.2
°
、24.2
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
、18.8
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0158]
例如,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0159]
20.0
±
0.2
°
和17.8
±
0.2
°
处,
[0160]
或者,17.8
±
0.2
°
和24.2
±
0.2
°
处,
[0161]
或者,20.0
±
0.2
°
和24.2
±
0.2
°
处,
[0162]
或者,20.0
±
0.2
°
、17.8
±
0.2
°
和24.2
±
0.2
°
处,
[0163]
或者,17.8
±
0.2
°
、24.2
±
0.2
°
和22.2
±
0.2
°
处,
[0164]
或者,20.0
±
0.2
°
、17.8
±
0.2
°
、24.2
±
0.2
°
和22.2
±
0.2
°
处,
[0165]
或者,17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
和24.6
±
0.2
°
处,
[0166]
或者,20.0
±
0.2
°
、17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
和24.6
±
0.2
°
处,
[0167]
或者,17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
和12.5
±
0.2
°
处,
[0168]
更优选的,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为11.0
±
0.2
°
、14.2
±
0.2
°
、28.2
±
0.2
°
、21.9
±
0.2
°
、26.6
±
0.2
°
、21.2
±
0.2
°
、29.7
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0169]
例如,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0170]
11.0
±
0.2
°
、14.2
±
0.2
°
、28.2
±
0.2
°
、21.9
±
0.2
°
、26.6
±
0.2
°
和21.2
±
0.2
°
处,
[0171]
或者14.2
±
0.2
°
、28.2
±
0.2
°
、21.9
±
0.2
°
、26.6
±
0.2
°
、21.2
±
0.2
°
和29.7
±
0.2
°
处,
[0172]
或者11.0
±
0.2
°
、14.2
±
0.2
°
、21.9
±
0.2
°
、26.6
±
0.2
°
、21.2
±
0.2
°
和29.7
±
0.2
°
处,
[0173]
进一步优选的,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为20.0
±
0.2
°
、17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
、18.8
±
0.2
°
、11.0
±
0.2
°
、14.2
±
0.2
°
、28.2
±
0.2
°
、21.9
±
0.2
°
、26.6
±
0.2
°
、21.2
±
0.2
°
、29.7
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0174]
例如,甲磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0175]
20.0
±
0.2
°
、17.8
±
0.2
°
、24.2
±
0.2
°
和29.7
±
0.2
°
处,
[0176]
或者17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
和21.2
±
0.2
°
处,
[0177]
或者24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
和28.6
±
0.2
°
处,
[0178]
或者22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
和18.8
±
0.2
°
处,
[0179]
或者20.0
±
0.2
°
、17.8
±
0.2
°
、24.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
和28.6
±
0.2
°
处,
[0180]
或者17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
、28.6
±
0.2
°
和18.8
±
0.2
°
处,
[0181]
或者24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
、18.8
±
0.2
°
、11.0
±
0.2
°
和14.2
±
0.2
°
处,
[0182]
或者22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
、18.8
±
0.2
°
、11.0
±
0.2
°
、14.2
±
0.2
°
和28.2
±
0.2
°
处,
[0183]
或者20.0
±
0.2
°
、17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
、18.8
±
0.2
°
、11.0
±
0.2
°
和14.2
±
0.2
°
处,
[0184]
或者17.8
±
0.2
°
、24.2
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
、12.5
±
0.2
°
、28.6
±
0.2
°
、18.8
±
0.2
°
、11.0
±
0.2
°
、14.2
±
0.2
°
和28.2
±
0.2
°
处。
[0185]
最优选的,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表9所示。
[0186]
表9
[0187][0188]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的甲磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图25所示;其dsc图谱基本如图26所示。
[0189]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a。
[0190]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱在20.1
±
0.2
°
处具有衍射峰;或者在18.7
±
0.2
°
处具有衍射峰;或者在23.4
±
0.2
°
处具有衍射峰;或者在18.1
±
0.2
°
处具有衍射峰;或者在20.9
±
0.2
°
处具有衍射峰;或者在23.2
±
0.2
°
处具有衍射峰;或者在12.6
±
0.2
°
处具有衍射峰;或者在13.3
±
0.2
°
处具有衍射峰;或者在
11.6
±
0.2
°
处具有衍射峰;或者在10.4
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0191]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为20.1
±
0.2
°
、18.7
±
0.2
°
、23.4
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
、13.3
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0192]
例如,羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0193]
20.1
±
0.2
°
和18.7
±
0.2
°
处,
[0194]
或者,18.7
±
0.2
°
和23.4
±
0.2
°
处,
[0195]
或者,20.1
±
0.2
°
、18.7
±
0.2
°
和23.4
±
0.2
°
处,
[0196]
或者,18.7
±
0.2
°
、23.4
±
0.2
°
和18.1
±
0.2
°
处,
[0197]
或者,20.1
±
0.2
°
、18.7
±
0.2
°
、23.4
±
0.2
°
和18.1
±
0.2
°
处,
[0198]
或者,18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
和20.9
±
0.2
°
处,
[0199]
或者,20.1
±
0.2
°
、18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
和20.9
±
0.2
°
处,
[0200]
或者,18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
和23.2
±
0.2
°
处,
[0201]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为11.6
±
0.2
°
、10.4
±
0.2
°
、16.8
±
0.2
°
、19.8
±
0.2
°
、24.5
±
0.2
°
、28.0
±
0.2
°
、24.9
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0202]
例如,羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0203]
11.6
±
0.2
°
、10.4
±
0.2
°
、16.8
±
0.2
°
、19.8
±
0.2
°
、24.5
±
0.2
°
和28.0
±
0.2
°
处,
[0204]
或者10.4
±
0.2
°
、16.8
±
0.2
°
、19.8
±
0.2
°
、24.5
±
0.2
°
、28.0
±
0.2
°
和24.9
±
0.2
°
处,
[0205]
或者11.6
±
0.2
°
、10.4
±
0.2
°
、19.8
±
0.2
°
、24.5
±
0.2
°
、28.0
±
0.2
°
和24.9
±
0.2
°
处,
[0206]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为20.1
±
0.2
°
、18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
、13.3
±
0.2
°
、11.6
±
0.2
°
、10.4
±
0.2
°
、16.8
±
0.2
°
、19.8
±
0.2
°
、24.5
±
0.2
°
、28.0
±
0.2
°
、24.9
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0207]
例如,羟乙基磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0208]
20.1
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
和23.2
±
0.2
°
处,
[0209]
或者18.7
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
和23.2
±
0.2
°
处,
[0210]
或者23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
和12.6
±
0.2
°
处,
[0211]
或者18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
和13.3
±
0.2
°
处,
[0212]
或者20.1
±
0.2
°
、18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
和23.2
±
0.2
°
处,
[0213]
或者18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
和12.6
±
0.2
°
处,
[0214]
或者23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
、13.3
±
0.2
°
、11.6
±
0.2
°
和10.4
±
0.2
°
处,
[0215]
或者18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
、13.3
±
0.2
°
、11.6
±
0.2
°
、10.4
±
0.2
°
和16.8
±
0.2
°
处,
[0216]
或者20.1
±
0.2
°
、18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
、13.3
±
0.2
°
、11.6
±
0.2
°
和10.4
±
0.2
°
处,
[0217]
或者18.7
±
0.2
°
、23.4
±
0.2
°
、18.1
±
0.2
°
、20.9
±
0.2
°
、23.2
±
0.2
°
、12.6
±
0.2
°
、13.3
±
0.2
°
、11.6
±
0.2
°
、10.4
±
0.2
°
和16.8
±
0.2
°
处。
[0218]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表10所示。
[0219]
表10
[0220][0221][0222]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的羟乙基磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本
如图27所示;其dsc图谱基本如图28所示。
[0223]
在本发明优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的的富马酸盐晶型,其为的富马酸盐晶型a,所述的富马酸的个数为1。
[0224]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a。
[0225]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a的x
‑
射线粉末衍射图谱在18.7
±
0.2
°
处具有衍射峰;或者在23.1
±
0.2
°
处具有衍射峰;或者在20.1
±
0.2
°
处具有衍射峰;或者在11.3
±
0.2
°
处具有衍射峰;或者在25.0
±
0.2
°
处具有衍射峰;或者在12.6
±
0.2
°
处具有衍射峰;或者在22.0
±
0.2
°
处具有衍射峰;或者在18.2
±
0.2
°
处具有衍射峰;或者在27.8
±
0.2
°
处具有衍射峰;或者在14.6
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0226]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为18.7
±
0.2
°
、23.1
±
0.2
°
、20.1
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
、18.2
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0227]
例如,富马酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0228]
18.7
±
0.2
°
和23.1
±
0.2
°
处,
[0229]
或者,23.1
±
0.2
°
和20.1
±
0.2
°
处,
[0230]
或者,18.7
±
0.2
°
、23.1
±
0.2
°
和20.1
±
0.2
°
处,
[0231]
或者,23.1
±
0.2
°
、20.1
±
0.2
°
和11.3
±
0.2
°
处,
[0232]
或者,18.7
±
0.2
°
、23.1
±
0.2
°
、20.1
±
0.2
°
和11.3
±
0.2
°
处,
[0233]
或者,23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
和25.0
±
0.2
°
处,
[0234]
或者,18.7
±
0.2
°
、23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
和25.0
±
0.2
°
处,
[0235]
或者,23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
和12.6
±
0.2
°
处,
[0236]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为27.8
±
0.2
°
、14.6
±
0.2
°
、5.1
±
0.2
°
、15.4
±
0.2
°
、28.8
±
0.2
°
、13.9
±
0.2
°
、20.5
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0237]
例如,富马酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0238]
27.8
±
0.2
°
、14.6
±
0.2
°
、5.1
±
0.2
°
、15.4
±
0.2
°
、28.8
±
0.2
°
和13.9
±
0.2
°
处,
[0239]
或者14.6
±
0.2
°
、5.1
±
0.2
°
、15.4
±
0.2
°
、28.8
±
0.2
°
、13.9
±
0.2
°
和20.5
±
0.2
°
处,
[0240]
或者27.8
±
0.2
°
、14.6
±
0.2
°
、15.4
±
0.2
°
、28.8
±
0.2
°
、13.9
±
0.2
°
和20.5
±
0.2
°
处,
[0241]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为18.7
±
0.2
°
、23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
、18.2
±
0.2
°
、27.8
±
0.2
°
、14.6
±
0.2
°
、5.1
±
0.2
°
、15.4
±
0.2
°
、28.8
±
0.2
°
、13.9
±
0.2
°
、20.5
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0242]
例如,富马酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0243]
18.7
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
和25.0
±
0.2
°
处,
[0244]
或者23.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
和12.6
±
0.2
°
处,
[0245]
或者20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
和22.0
±
0.2
°
处,
[0246]
或者11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
和18.2
±
0.2
°
处,
[0247]
或者18.7
±
0.2
°
、23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
和12.6
±
0.2
°
处,
[0248]
或者23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
和22.0
±
0.2
°
处,
[0249]
或者20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
、18.2
±
0.2
°
、27.8
±
0.2
°
和14.6
±
0.2
°
处,
[0250]
或者11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
、18.2
±
0.2
°
、27.8
±
0.2
°
、14.6
±
0.2
°
和5.1
±
0.2
°
处,
[0251]
或者18.7
±
0.2
°
、23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
、18.2
±
0.2
°
、27.8
±
0.2
°
和14.6
±
0.2
°
处,
[0252]
或者23.1
±
0.2
°
、20.1
±
0.2
°
、11.3
±
0.2
°
、25.0
±
0.2
°
、12.6
±
0.2
°
、22.0
±
0.2
°
、18.2
±
0.2
°
、27.8
±
0.2
°
、14.6
±
0.2
°
和5.1
±
0.2
°
处。
[0253]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表11所示。
[0254]
表11
[0255][0256][0257]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的富马酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图29所示;其dsc图谱基本如图30所示。
[0258]
在本发明优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型,其为对甲苯磺酸盐晶型a,所述对甲苯磺酸的个数为1。
[0259]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a。
[0260]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱在23.2
±
0.2
°
处具有衍射峰;或者在11.2
±
0.2
°
处具有衍射峰;或者在19.4
±
0.2
°
处具有衍射峰;或者在16.6
±
0.2
°
处具有衍射峰;或者在21.1
±
0.2
°
处具有衍射峰;或者在17.3
±
0.2
°
处具有衍射峰;或者在16.8
±
0.2
°
处具有衍射峰;或者在4.3
±
0.2
°
处具有衍射峰;或者在18.2
±
0.2
°
处具有衍射峰;或者在22.0
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0261]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
2
‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为23.2
±
0.2
°
、11.2
±
0.2
°
、19.4
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
、4.3
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0262]
例如,对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0263]
23.2
±
0.2
°
和11.2
±
0.2
°
处,
[0264]
或者,11.2
±
0.2
°
和19.4
±
0.2
°
处,
[0265]
或者,23.2
±
0.2
°
、11.2
±
0.2
°
和19.4
±
0.2
°
处,
[0266]
或者,11.2
±
0.2
°
、19.4
±
0.2
°
和16.6
±
0.2
°
处,
[0267]
或者,23.2
±
0.2
°
、11.2
±
0.2
°
、19.4
±
0.2
°
和16.6
±
0.2
°
处,
[0268]
或者,11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
和21.1
±
0.2
°
处,
[0269]
或者,23.2
±
0.2
°
、11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
和21.1
±
0.2
°
处,
[0270]
或者,11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
和17.3
±
0.2
°
处,
[0271]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为18.2
±
0.2
°
、22.0
±
0.2
°
、29.2
±
0.2
°
、20.7
±
0.2
°
、9.6
±
0.2
°
、26.9
±
0.2
°
、13.2
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0272]
例如,对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0273]
18.2
±
0.2
°
、22.0
±
0.2
°
、29.2
±
0.2
°
、20.7
±
0.2
°
、9.6
±
0.2
°
和26.9
±
0.2
°
处,
[0274]
或者22.0
±
0.2
°
、29.2
±
0.2
°
、20.7
±
0.2
°
、9.6
±
0.2
°
、26.9
±
0.2
°
和13.2
±
0.2
°
处,
[0275]
或者18.2
±
0.2
°
、22.0
±
0.2
°
、20.7
±
0.2
°
、9.6
±
0.2
°
、26.9
±
0.2
°
和13.2
±
0.2
°
处,
[0276]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为23.2
±
0.2
°
、11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
、4.3
±
0.2
°
、18.2
±
0.2
°
、22.0
±
0.2
°
、29.2
±
0.2
°
、20.7
±
0.2
°
、9.6
±
0.2
°
、26.9
±
0.2
°
、13.2
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0277]
例如,对甲苯磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0278]
23.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
和21.1
±
0.2
°
处,
[0279]
或者11.2
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
和17.3
±
0.2
°
处,
[0280]
或者19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
和16.8
±
0.2
°
处,
[0281]
或者16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
和4.3
±
0.2
°
处,
[0282]
或者23.2
±
0.2
°
、11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
和17.3
±
0.2
°
处,
[0283]
或者11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
和16.8
±
0.2
°
处,
[0284]
或者19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
、4.3
±
0.2
°
、18.2
±
0.2
°
和22.0
±
0.2
°
处,
[0285]
或者16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
、4.3
±
0.2
°
、18.2
±
0.2
°
、22.0
±
0.2
°
和29.2
±
0.2
°
处,
[0286]
或者23.2
±
0.2
°
、11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
、4.3
±
0.2
°
、18.2
±
0.2
°
和22.0
±
0.2
°
处,
[0287]
或者11.2
±
0.2
°
、19.4
±
0.2
°
、16.6
±
0.2
°
、21.1
±
0.2
°
、17.3
±
0.2
°
、16.8
±
0.2
°
、4.3
±
0.2
°
、18.2
±
0.2
°
、22.0
±
0.2
°
和29.2
±
0.2
°
处。
[0288]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表12所示。
[0289]
表12
[0290][0291]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的对甲苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图31所示;其dsc图谱基本如图32所示。
[0292]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a。
[0293]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱在17.3
±
0.2
°
处具有衍射峰;或者在19.5
±
0.2
°
处具有衍射峰;或者在21.6
±
0.2
°
处具有衍射峰;或者在18.5
±
0.2
°
处具有衍射峰;或者在23.9
±
0.2
°
处具有衍射峰;或者在10.6
±
0.2
°
处具有衍射峰;或者在22.2
±
0.2
°
处具有衍射峰;或者在13.9
±
0.2
°
处具有衍射峰;或者在26.1
±
0.2
°
处具有衍射峰;或者在12.3
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0294]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为17.3
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0295]
例如,乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0296]
17.3
±
0.2
°
和19.5
±
0.2
°
处,
[0297]
或者,19.5
±
0.2
°
和21.6
±
0.2
°
处,
[0298]
或者,17.3
±
0.2
°
、19.5
±
0.2
°
和21.6
±
0.2
°
处,
[0299]
或者,19.5
±
0.2
°
、21.6
±
0.2
°
和18.5
±
0.2
°
处,
[0300]
或者,17.3
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
和18.5
±
0.2
°
处,
[0301]
或者,19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
和23.9
±
0.2
°
处,
[0302]
或者,17.3
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
和23.9
±
0.2
°
处,
[0303]
或者,19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
和10.6
±
0.2
°
处,
[0304]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为26.1
±
0.2
°
、12.3
±
0.2
°
、20.7
±
0.2
°
、21.3
±
0.2
°
、19.0
±
0.2
°
、28.1
±
0.2
°
、13.6
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0305]
例如,乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0306]
26.1
±
0.2
°
、12.3
±
0.2
°
、20.7
±
0.2
°
、21.3
±
0.2
°
、19.0
±
0.2
°
和28.1
±
0.2
°
,
[0307]
或者12.3
±
0.2
°
、20.7
±
0.2
°
、21.3
±
0.2
°
、19.0
±
0.2
°
、28.1
±
0.2
°
和13.6
±
0.2
°
处,
[0308]
或者26.1
±
0.2
°
、12.3
±
0.2
°
、21.3
±
0.2
°
、19.0
±
0.2
°
、28.1
±
0.2
°
和13.6
±
0.2
°
处,
[0309]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为17.3
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
、26.1
±
0.2
°
、12.3
±
0.2
°
、20.7
±
0.2
°
、21.3
±
0.2
°
、19.0
±
0.2
°
、28.1
±
0.2
°
、13.6
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0310]
例如,乙烷磺酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0311]
17.3
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
和23.9
±
0.2
°
处,
[0312]
或者19.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
和22.2
±
0.2
°
处,
[0313]
或者21.6
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
和13.9
±
0.2
°
处,
[0314]
或者18.5
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
和26.1
±
0.2
°
处,
[0315]
或者17.3
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
和13.9
±
0.2
°
处,
[0316]
或者19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
和26.1
±
0.2
°
处,
[0317]
或者21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
、26.1
±
0.2
°
和12.3
±
0.2
°°
处,
[0318]
或者18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
、26.1
±
0.2
°
、12.3
±
0.2
°
和20.7
±
0.2
°
处,
[0319]
或者17.3
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
、26.1
±
0.2
°
和12.3
±
0.2
°
处,
[0320]
或者19.5
±
0.2
°
、21.6
±
0.2
°
、18.5
±
0.2
°
、23.9
±
0.2
°
、10.6
±
0.2
°
、22.2
±
0.2
°
、13.9
±
0.2
°
、26.1
±
0.2
°
、12.3
±
0.2
°
和20.7
±
0.2
°
处。
[0321]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表13所示。
[0322]
表13
[0323][0324]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的乙烷磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图33所示;其dsc图谱基本如图34所示。
[0325]
在本发明优选的实施方式中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型,其为丁二酸盐晶型a,所述丁二酸的个数为0.5。
[0326]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a。
[0327]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a的x
‑
射线粉末衍射图谱在22.8
±
0.2
°
处具有衍射峰;或者在19.9
±
0.2
°
处具有衍射峰;或者在18.3
±
0.2
°
处具有衍射峰;或者在12.3
±
0.2
°
处具有衍射峰;或者在21.7
±
0.2
°
处具有衍射峰;或者在24.7
±
0.2
°
处具有衍射峰;或者在11.0
±
0.2
°
处具有衍射峰;或者在15.2
±
0.2
°
处具有衍射峰;或者在27.4
±
0.2
°
处具有衍射峰;或者在20.2
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0328]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a的x
‑
射线粉末衍射图谱至少包含
位于2θ为22.8
±
0.2
°
、19.9
±
0.2
°
、18.3
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
、15.2
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0329]
例如,丁二酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0330]
22.8
±
0.2
°
和19.9
±
0.2
°
处,
[0331]
或者,19.9
±
0.2
°
和18.3
±
0.2
°
处,
[0332]
或者,22.8
±
0.2
°
、19.9
±
0.2
°
和18.3
±
0.2
°
处,
[0333]
或者,19.9
±
0.2
°
、18.3
±
0.2
°
和12.3
±
0.2
°
处,
[0334]
或者,22.8
±
0.2
°
、19.9
±
0.2
°
、18.3
±
0.2
°
和12.3
±
0.2
°
处,
[0335]
或者,19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
和21.7
±
0.2
°
处,
[0336]
或者,22.8
±
0.2
°
、19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
和21.7
±
0.2
°
处,
[0337]
或者,19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
和24.7
±
0.2
°
处,
[0338]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为27.4
±
0.2
°
、20.2
±
0.2
°
、14.3
±
0.2
°
、20.9
±
0.2
°
、28.5
±
0.2
°
、32.2
±
0.2
°
、13.7
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0339]
例如,丁二酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0340]
27.4
±
0.2
°
、20.2
±
0.2
°
、14.3
±
0.2
°
、20.9
±
0.2
°
、28.5
±
0.2
°
和32.2
±
0.2
°
,
[0341]
或者20.2
±
0.2
°
、14.3
±
0.2
°
、20.9
±
0.2
°
、28.5
±
0.2
°
、32.2
±
0.2
°
和13.7
±
0.2
°
处,
[0342]
或者27.4
±
0.2
°
、20.2
±
0.2
°
、20.9
±
0.2
°
、28.5
±
0.2
°
、32.2
±
0.2
°
和13.7
±
0.2
°
处,
[0343]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为22.8
±
0.2
°
、19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
、15.2
±
0.2
°
、27.4
±
0.2
°
、20.2
±
0.2
°
、14.3
±
0.2
°
、20.9
±
0.2
°
、28.5
±
0.2
°
、32.2
±
0.2
°
、13.7
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0344]
例如,丁二酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0345]
22.8
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
和24.7
±
0.2
°
处,
[0346]
或者19.9
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
和11.0
±
0.2
°
处,
[0347]
或者18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
和11.0
±
0.2
°
处,
[0348]
或者12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
和15.2
±
0.2
°
处,
[0349]
或者22.8
±
0.2
°
、19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
和15.2
±
0.2
°
处,
[0350]
或者19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
和14.3
±
0.2
°
处,
[0351]
或者18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
、15.2
±
0.2
°
、27.4
±
0.2
°
和20.2
±
0.2
°
处,
[0352]
或者12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
、15.2
±
0.2
°
、27.4
±
0.2
°
、20.2
±
0.2
°
和14.3
±
0.2
°
处,
[0353]
或者22.8
±
0.2
°
、19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
、15.2
±
0.2
°
、27.4
±
0.2
°
和11.0
±
0.2
°
处,
[0354]
或者19.9
±
0.2
°
、18.3
±
0.2
°
、12.3
±
0.2
°
、21.7
±
0.2
°
、24.7
±
0.2
°
、11.0
±
0.2
°
、15.2
±
0.2
°
、27.4
±
0.2
°
、20.2
±
0.2
°
和14.3
±
0.2
°
处。
[0355]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表14所示。
[0356]
表14
[0357][0358][0359]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的丁二酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图35所示;其dsc图谱基本如图36所示。
[0360]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a,
[0361]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a的x
‑
射线粉末衍射图谱在21.9
±
0.2
°
处具有衍射峰;或者在20.3
±
0.2
°
处具有衍射峰;或者在18.3
±
0.2
°
处具有衍射峰;或者在12.0
±
0.2
°
处具有衍射峰;或者在24.6
±
0.2
°
处具有衍射峰;或者在16.8
±
0.2
°
处具有衍射峰;或者在19.7
±
0.2
°
处具有衍射峰;或者在21.4
±
0.2
°
处具有衍射峰;或者在14.2
±
0.2
°
处具有衍射峰;或者在32.2
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0362]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为21.9
±
0.2
°
、20.3
±
0.2
°
、18.3
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
、21.4
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0363]
例如,氢溴酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0364]
21.9
±
0.2
°
和20.3
±
0.2
°
处,
[0365]
或者,20.3
±
0.2
°
和18.3
±
0.2
°
处,
[0366]
或者,21.9
±
0.2
°
、20.3
±
0.2
°
和18.3
±
0.2
°
处,
[0367]
或者,20.3
±
0.2
°
、18.3
±
0.2
°
和12.0
±
0.2
°
处,
[0368]
或者,21.9
±
0.2
°
、20.3
±
0.2
°
、18.3
±
0.2
°
和12.0
±
0.2
°
处,
[0369]
或者,20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
和24.6
±
0.2
°
处,
[0370]
或者,21.9
±
0.2
°
、20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
和24.6
±
0.2
°
处,
[0371]
或者,20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
和16.8
±
0.2
°
处,
[0372]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为14.2
±
0.2
°
、32.2
±
0.2
°
、17.5
±
0.2
°
、22.4
±
0.2
°
、25.8
±
0.2
°
、12.4
±
0.2
°
、13.0
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0373]
例如,氢溴酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0374]
14.2
±
0.2
°
、32.2
±
0.2
°
、17.5
±
0.2
°
、22.4
±
0.2
°
、25.8
±
0.2
°
和12.4
±
0.2
°
,
[0375]
或者32.2
±
0.2
°
、17.5
±
0.2
°
、22.4
±
0.2
°
、25.8
±
0.2
°
、12.4
±
0.2
°
和13.0
±
0.2
°
处,
[0376]
或者14.2
±
0.2
°
、32.2
±
0.2
°
、22.4
±
0.2
°
、25.8
±
0.2
°
、12.4
±
0.2
°
和13.0
±
0.2
°
处,
[0377]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为21.9
±
0.2
°
、20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
、21.4
±
0.2
°
、14.2
±
0.2
°
、32.2
±
0.2
°
、17.5
±
0.2
°
、22.4
±
0.2
°
、25.8
±
0.2
°
、12.4
±
0.2
°
、13.0
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0378]
例如,氢溴酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0379]
21.9
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
和24.6
±
0.2
°
处,
[0380]
或者20.3
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
和19.7
±
0.2
°
处,
[0381]
或者18.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
和21.4
±
0.2
°
处,
[0382]
或者12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
和14.2
±
0.2
°
处,
[0383]
或者21.9
±
0.2
°
、20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
、16.8
±
0.2
°
和19.7
±
0.2
°
处,
[0384]
或者20.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
和32.2
±
0.2
°
处,
[0385]
或者18.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
、21.4
±
0.2
°
、14.2
±
0.2
°
和17.5
±
0.2
°
处,
[0386]
或者12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
、21.4
±
0.2
°
、14.2
±
0.2
°
、32.2
±
0.2
°
和17.5
±
0.2
°
处,
[0387]
或者21.9
±
0.2
°
、20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
、21.4
±
0.2
°
、14.2
±
0.2
°
和32.2
±
0.2
°
处,
[0388]
或者20.3
±
0.2
°
、18.3
±
0.2
°
、12.0
±
0.2
°
、24.6
±
0.2
°
、16.8
±
0.2
°
、19.7
±
0.2
°
、21.4
±
0.2
°
、14.2
±
0.2
°
、32.2
±
0.2
°
和17.5
±
0.2
°
处。
[0389]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表15所示。
[0390]
表15
[0391]
[0392][0393]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的氢溴酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图37所示;其dsc图谱基本如图38所示。
[0394]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a,
[0395]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a的x
‑
射线粉末衍射图谱在22.5
±
0.2
°
处具有衍射峰;或者在20.2
±
0.2
°
处具有衍射峰;或者在12.2
±
0.2
°
处具有衍射峰;或者在17.0
±
0.2
°
处具有衍射峰;或者在28.7
±
0.2
°
处具有衍射峰;或者在21.4
±
0.2
°
处具有衍射峰;或者在18.7
±
0.2
°
处具有衍射峰;或者在14.5
±
0.2
°
处具有衍射峰;或者在18.0
±
0.2
°
处具有衍射峰;或者在25.5
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0396]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为22.5
±
0.2
°
、20.2
±
0.2
°
、12.2
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
、14.5
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0397]
例如,盐酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0398]
22.5
±
0.2
°
和20.2
±
0.2
°°
处,
[0399]
或者,20.2
±
0.2
°
和12.2
±
0.2
°
处,
[0400]
或者,22.5
±
0.2
°
、20.2
±
0.2
°
和12.2
±
0.2
°
处,
[0401]
或者,20.2
±
0.2
°
、12.2
±
0.2
°
和17.0
±
0.2
°
处,
[0402]
或者,22.5
±
0.2
°
、20.2
±
0.2
°
、12.2
±
0.2
°
和17.0
±
0.2
°
处,
[0403]
或者,20.2
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
和28.7
±
0.2
°
处,
[0404]
或者,22.5
±
0.2
°
、20.2
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
和28.7
±
0.2
°
处,
[0405]
或者,20.2
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
和21.4
±
0.2
°
处,
[0406]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为18.0
±
0.2
°
、25.5
±
0.2
°
、28.3
±
0.2
°
、23.8
±
0.2
°
、12.6
±
0.2
°
、24.8
±
0.2
°
、13.3
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0407]
例如,盐酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0408]
18.0
±
0.2
°
、25.5
±
0.2
°
、28.3
±
0.2
°
、23.8
±
0.2
°
、12.6
±
0.2
°
和24.8
±
0.2
°
,
[0409]
或者25.5
±
0.2
°
、28.3
±
0.2
°
、23.8
±
0.2
°
、12.6
±
0.2
°
、24.8
±
0.2
°
和13.3
±
0.2
°
处,
[0410]
或者18.0
±
0.2
°
、25.5
±
0.2
°
、23.8
±
0.2
°
、12.6
±
0.2
°
、24.8
±
0.2
°
和13.3
±
0.2
°
处,
[0411]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为22.5
±
0.2
°
、20.2
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
、14.5
±
0.2
°
、18.0
±
0.2
°
、25.5
±
0.2
°
、28.3
±
0.2
°
、23.8
±
0.2
°
、12.6
±
0.2
°
、24.8
±
0.2
°
、13.3
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0412]
例如,盐酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0413]
22.5
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
和28.7
±
0.2
°
处,
[0414]
或者20.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
和21.4
±
0.2
°
处,
[0415]
或者12.2
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
和14.5
±
0.2
°
处,
[0416]
或者17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
和14.5
±
0.2
°
处,
[0417]
或者22.5
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
和18.7
±
0.2
°
处,
[0418]
或者20.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
和14.5
±
0.2
°
处,
[0419]
或者12.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
、14.5
±
0.2
°
、18.0
±
0.2
°
和25.5
±
0.2
°
处,
[0420]
或者17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
、14.5
±
0.2
°
、18.0
±
0.2
°
、25.5
±
0.2
°
和28.3
±
0.2
°
处,
[0421]
或者22.5
±
0.2
°
、20.2
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
、14.5
±
0.2
°
、18.0
±
0.2
°
和25.5
±
0.2
°
处,
[0422]
或者20.2
±
0.2
°
、12.2
±
0.2
°
、17.0
±
0.2
°
、28.7
±
0.2
°
、21.4
±
0.2
°
、18.7
±
0.2
°
、14.5
±
0.2
°
、18.0
±
0.2
°
、25.5
±
0.2
°
和28.3
±
0.2
°
处。
[0423]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表16所示。
[0424]
表16
[0425][0426]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的盐酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图39所示;其dsc图谱基本如图40所示。
[0427]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a。
[0428]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a的x
‑
射线粉末衍射图谱在21.4
±
0.2
°
处具有衍射峰;或者在17.4
±
0.2
°
处具有衍射峰;或者在20.0
±
0.2
°
处具有衍射峰;或者在25.6
±
0.2
°
处具有衍射峰;或者在13.8
±
0.2
°
处具有衍射峰;或者在18.3
±
0.2
°
处具有衍射峰;或者在16.2
±
0.2
°
处具有衍射峰;或者在20.3
±
0.2
°
处具有衍射峰;或者在22.9
±
0.2
°
处具有衍射峰;或者在13.3
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0429]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为21.4
±
0.2
°
、17.4
±
0.2
°
、20.0
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为25.6
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0430]
例如,马来酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0431]
21.4
±
0.2
°
和17.4
±
0.2
°
处,
[0432]
或者,17.4
±
0.2
°
和20.0
±
0.2
°
处,
[0433]
或者,21.4
±
0.2
°
、17.4
±
0.2
°
和20.0
±
0.2
°
处,
[0434]
或者,17.4
±
0.2
°
、20.0
±
0.2
°
和25.6
±
0.2
°
处,
[0435]
或者,21.4
±
0.2
°
、17.4
±
0.2
°
、20.0
±
0.2
°
和25.6
±
0.2
°
处,
[0436]
或者,17.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
和13.8
±
0.2
°
处,
[0437]
或者,21.4
±
0.2
°
、17.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
和13.8
±
0.2
°
处,
[0438]
或者,17.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
和18.3
±
0.2
°
处,
[0439]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为22.9
±
0.2
°
、13.3
±
0.2
°
、22.5
±
0.2
°
、25.9
±
0.2
°
、10.9
±
0.2
°
、27.6
±
0.2
°
、23.5
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0440]
例如,马来酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0441]
22.9
±
0.2
°
、13.3
±
0.2
°
、22.5
±
0.2
°
、25.9
±
0.2
°
、10.9
±
0.2
°
和27.6
±
0.2
°
,
[0442]
或者13.3
±
0.2
°
、22.5
±
0.2
°
、25.9
±
0.2
°
、10.9
±
0.2
°
、27.6
±
0.2
°
和23.5
±
0.2
°
处,
[0443]
或者22.9
±
0.2
°
、13.3
±
0.2
°
、25.9
±
0.2
°
、10.9
±
0.2
°
、27.6
±
0.2
°
和23.5
±
0.2
°
处,
[0444]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为21.4
±
0.2
°
、17.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
、22.9
±
0.2
°
、13.3
±
0.2
°
、22.5
±
0.2
°
、25.9
±
0.2
°
、10.9
±
0.2
°
、27.6
±
0.2
°
、23.5
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0445]
例如,马来酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0446]
21.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
和13.8
±
0.2
°
处,
[0447]
或者17.4
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
和18.3
±
0.2
°
处,
[0448]
或者20.0
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
和20.3
±
0.2
°
处,
[0449]
或者25.6
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
和22.9
±
0.2
°
处,
[0450]
或者21.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
和16.2
±
0.2
°
处,
[0451]
或者17.4
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
和20.3
±
0.2
°
处,
[0452]
或者20.0
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
、22.9
±
0.2
°
、13.3
±
0.2
°
和22.5
±
0.2
°
处,
[0453]
或者25.6
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
、22.9
±
0.2
°
、13.3
±
0.2
°
、22.5
±
0.2
°
和25.9
±
0.2
°
处,
[0454]
或者21.4
±
0.2
°
、17.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
、22.9
±
0.2
°
和13.3
±
0.2
°
处,
[0455]
或者17.4
±
0.2
°
、20.0
±
0.2
°
、25.6
±
0.2
°
、13.8
±
0.2
°
、18.3
±
0.2
°
、16.2
±
0.2
°
、20.3
±
0.2
°
、22.9
±
0.2
°
、13.3
±
0.2
°
和22.5
±
0.2
°
处。
[0456]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表17所示。
[0457]
表17
[0458][0459][0460]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的马来酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图41所示;其dsc图谱基本如图42所示。
[0461]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的酒石酸盐晶型a,
[0462]
其中,酒石酸盐晶型a的x
‑
射线粉末衍射图谱在20.1
±
0.2
°
处具有衍射峰;或者在22.8
±
0.2
°
处具有衍射峰;或者在12.6
±
0.2
°
处具有衍射峰;或者在18.4
±
0.2
°
处具有衍射峰;或者在18.1
±
0.2
°
处具有衍射峰;或者在24.5
±
0.2
°
处具有衍射峰;或者在11.2
±
0.2
°
处具有衍射峰;或者在29.0
±
0.2
°
处具有衍射峰;或者在20.7
±
0.2
°
处具有衍射峰;或
者在21.6
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0463]
优选的,酒石酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为20.1
±
0.2
°
、22.8
±
0.2
°
、12.6
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0464]
例如,酒石酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0465]
20.1
±
0.2
°
和22.8
±
0.2
°
处,
[0466]
或者,22.8
±
0.2
°
和12.6
±
0.2
°
处,
[0467]
或者,20.1
±
0.2
°
、22.8
±
0.2
°
和12.6
±
0.2
°
处,
[0468]
或者,22.8
±
0.2
°
、12.6
±
0.2
°
和18.4
±
0.2
°
处,
[0469]
或者,20.1
±
0.2
°
、22.8
±
0.2
°
、12.6
±
0.2
°
和18.4
±
0.2
°
处,
[0470]
或者,22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
和18.1
±
0.2
°
处,
[0471]
或者,20.1
±
0.2
°
、22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
和18.1
±
0.2
°
处,
[0472]
或者,22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
和24.5
±
0.2
°
处,
[0473]
更优选的,酒石酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为20.7
±
0.2
°
、21.6
±
0.2
°
、33.7
±
0.2
°
、22.1
±
0.2
°
、13.9
±
0.2
°
、15.3
±
0.2
°
、27.4
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0474]
例如,酒石酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0475]
20.7
±
0.2
°
、21.6
±
0.2
°
、33.7
±
0.2
°
、22.1
±
0.2
°
、13.9
±
0.2
°
和15.3
±
0.2
°
,
[0476]
或者21.6
±
0.2
°
、33.7
±
0.2
°
、22.1
±
0.2
°
、13.9
±
0.2
°
、15.3
±
0.2
°
和27.4
±
0.2
°
处,
[0477]
或者20.7
±
0.2
°
、21.6
±
0.2
°
、33.7
±
0.2
°
、13.9
±
0.2
°
、15.3
±
0.2
°
和27.4
±
0.2
°
处,
[0478]
进一步优选的,酒石酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为20.1
±
0.2
°
、22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
、20.7
±
0.2
°
、21.6
±
0.2
°
、33.7
±
0.2
°
、22.1
±
0.2
°
、13.9
±
0.2
°
、15.3
±
0.2
°
、27.4
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0479]
例如,酒石酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0480]
20.1
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
和18.1
±
0.2
°
处,
[0481]
或者22.8
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
和24.5
±
0.2
°
处,
[0482]
或者12.6
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
和20.7
±
0.2
°
处,
[0483]
或者18.4
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
和20.7
±
0.2
°
处,
[0484]
或者20.1
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
和11.2
±
0.2
°
处,
[0485]
或者22.8
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
和29.0
±
0.2
°
处,
[0486]
或者20.1
±
0.2
°
、22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
和29.0
±
0.2
°
处,
[0487]
或者22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
和20.7
±
0.2
°
处,
[0488]
或者20.1
±
0.2
°
、22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
、20.7
±
0.2
°
和21.6
±
0.2
°
处,
[0489]
或者22.8
±
0.2
°
、12.6
±
0.2
°
、18.4
±
0.2
°
、18.1
±
0.2
°
、24.5
±
0.2
°
、11.2
±
0.2
°
、29.0
±
0.2
°
、20.7
±
0.2
°
、21.6
±
0.2
°
和33.7
±
0.2
°
处。
[0490]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的酒石酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表18所示。
[0491]
表18
[0492][0493]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的酒石酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图43所示;其dsc图谱基本如图44所示。
[0494]
在本发明进一步优选的实施方式中,提供化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a。
[0495]
其中,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a的x
‑
射线粉末衍射图谱在21.6
±
0.2
°
处具有衍射峰;或者在23.8
±
0.2
°
处具有衍射峰;或者在17.5
±
0.2
°
处具有衍射峰;或者在19.7
±
0.2
°
处具有衍射峰;或者在19.0
±
0.2
°
处具有衍射峰;或者在10.5
±
0.2
°
处具有衍
射峰;或者在26.1
±
0.2
°
处具有衍射峰;或者在18.5
±
0.2
°
处具有衍射峰;或者在22.5
±
0.2
°
处具有衍射峰;或者在13.5
±
0.2
°
处具有衍射峰;优选包含上述衍射峰中的任意2
‑
5处,或者3
‑
5处,或者3
‑
6处,或者3
‑
8处,或者5
‑
8处,或者6
‑
8处,更优选包含其中任意6处、7处或8处;
[0496]
优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a的x
‑
射线粉末衍射图谱至少包含位于2θ为21.6
±
0.2
°
、23.8
±
0.2
°
、17.5
±
0.2
°
中的一处或多处衍射峰,优选包含其中2处,更优选包含3处;任选的,进一步还可以包含2θ为19.7
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
中的至少一处,优选包含其中2处、3处、4处或5处,
[0497]
例如,硫酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0498]
21.6
±
0.2
°
和23.8
±
0.2
°
处,
[0499]
或者,23.8
±
0.2
°
和17.5
±
0.2
°
处,
[0500]
或者,21.6
±
0.2
°
、23.8
±
0.2
°
和17.5
±
0.2
°
处,
[0501]
或者,23.8
±
0.2
°
、17.5
±
0.2
°
和19.7
±
0.2
°
处,
[0502]
或者,21.6
±
0.2
°
、23.8
±
0.2
°
、17.5
±
0.2
°
和19.7
±
0.2
°
处,
[0503]
或者,23.8
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
和19.0
±
0.2
°
处,
[0504]
或者,21.6
±
0.2
°
、23.8
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
和19.0
±
0.2
°
处,
[0505]
或者,23.8
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
和10.5
±
0.2
°
处,
[0506]
更优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a的x
‑
射线粉末衍射图谱任选还包含位于2θ为22.5
±
0.2
°
、13.5
±
0.2
°
、14.0
±
0.2
°
、20.6
±
0.2
°
、12.3
±
0.2
°
、20.9
±
0.2
°
、31.7
±
0.2
°
中的一处或多处衍射峰;优选至少包含其中任意2
‑
3处,或者4
‑
5处,或者6
‑
7处;进一步优选,包含其中任意2处、3处、4处、5处、6处、7处,
[0507]
例如,硫酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0508]
22.5
±
0.2
°
、13.5
±
0.2
°
、14.0
±
0.2
°
、20.6
±
0.2
°
、12.3
±
0.2
°
和20.9
±
0.2
°
,
[0509]
或者13.5
±
0.2
°
、14.0
±
0.2
°
、20.6
±
0.2
°
、12.3
±
0.2
°
、20.9
±
0.2
°
和31.7
±
0.2
°
处,
[0510]
或者22.5
±
0.2
°
、13.5
±
0.2
°
、20.6
±
0.2
°
、12.3
±
0.2
°
、20.9
±
0.2
°
和31.7
±
0.2
°
处,
[0511]
进一步优选的,化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a的x
‑
射线粉末衍射图谱包含位于2θ为21.6
±
0.2
°
、23.8
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
、22.5
±
0.2
°
、13.5
±
0.2
°
、14.0
±
0.2
°
、20.6
±
0.2
°
、12.3
±
0.2
°
、20.9
±
0.2
°
、31.7
±
0.2
°
中的一处或多处具有衍射峰;优选的,包含其中任选的4处、5处、6处、8处、10处有衍射峰,
[0512]
例如,硫酸盐晶型a的x
‑
射线粉末衍射图谱在2θ为以下位置处有衍射峰:
[0513]
21.6
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
和19.0
±
0.2
°
处,
[0514]
或者23.8
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
和10.5
±
0.2
°
处,
[0515]
或者17.5
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
和18.5
±
0.2
°
处,
[0516]
或者19.7
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
和22.5
±
0.2
°
处,
[0517]
或者21.6
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
和26.1
±
0.2
°
处,
[0518]
或者23.8
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
和18.5
±
0.2
°
处,
[0519]
或者17.5
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
、22.5
±
0.2
°
、13.5
±
0.2
°
和14.0
±
0.2
°°
处,
[0520]
或者19.7
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
、22.5
±
0.2
°
、13.5
±
0.2
°
、14.0
±
0.2
°
和20.6
±
0.2
°
处,
[0521]
或者21.6
±
0.2
°
、23.8
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
、22.5
±
0.2
°
和13.5
±
0.2
°
处,
[0522]
或者23.8
±
0.2
°
、17.5
±
0.2
°
、19.7
±
0.2
°
、19.0
±
0.2
°
、10.5
±
0.2
°
、26.1
±
0.2
°
、18.5
±
0.2
°
、22.5
±
0.2
°
、13.5
±
0.2
°
和14.0
±
0.2
°
处。
[0523]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a,使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表19所示。
[0524]
表19
[0525][0526][0527]
本发明化合物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的硫酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图45所示;其dsc图谱基本如图46所示。
[0528]
本发明进一步提供了一种制备所述晶型的方法,具体包括如下步骤:
[0529]
1)称取适量的自由碱,用良性溶剂溶解;
[0530]
2)将酸m用有机溶剂溶解;酸m的量优选1.2当量;
[0531]
3)将步骤1)和2)得到的两种溶液混合均匀后挥发,待溶剂挥干后,加入不良溶剂,搅拌析晶;
[0532]
4)快速离心或静置吹干得目标产物;
[0533]
其中:
[0534]
所述步骤1)的良性溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、乙腈、2
‑
丁酮、3
‑
戊酮、四氢呋喃、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选甲醇或乙醇;
[0535]
所述步骤2)的有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈;
[0536]
所述的步骤1)的良性溶剂和步骤2)有机溶液使用时需互溶;
[0537]
所述步骤3)的不良溶剂选自乙酸乙酯、丙酮、二氯甲烷、乙腈、四氢呋喃、2
‑
丁酮、3
‑
戊酮、1,4
‑
二氧六环;优选乙酸乙酯、丙酮或乙腈。
[0538]
本发明进一步提供了一种制备所述晶型的方法,具体包括如下步骤:
[0539]
1)称取适量的化合物盐,用不良溶剂混悬,得到混悬液;悬浮密度优选为50~100mg/ml;
[0540]
2)将步骤1)得到的混悬液在25~40℃下振摇1~10d;
[0541]
3)将步骤2)得到的混悬液快速离心,去除上清液,剩余固体放入40℃真空干燥箱中烘干至恒重得到目标产物;
[0542]
其中:
[0543]
所述步骤1)的不良性溶剂选自丙酮、乙酸乙酯、乙腈、乙醇、88%丙酮、四氢呋喃、1,4
‑
二氧六环、苯、甲苯、异丙醇、正丁醇、异丁醇、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、正丙醇、叔丁醇或2
‑
丁酮。
[0544]
本发明进一步提供了一种制备所述晶型的方法,具体包括如下步骤:
[0545]
1)称取适量的化合物盐,用良性溶剂溶解;
[0546]
2)将步骤1)所得溶液降温搅拌固体析出,温度优选
‑
20℃~5℃;
[0547]
3)将步骤2)所得混悬液快速离心,去除上清液,剩余固体放入40℃真空干燥箱中烘干至恒重得到目标产物;
[0548]
其中:
[0549]
所述的良性溶剂选自甲醇、乙醇、88%丙酮、四氢呋喃、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选甲醇或88%丙酮。
[0550]
本发明进一步提供了一种制备所述晶型的方法,具体包括如下步骤:
[0551]
1)称取适量的自由碱,用良性溶剂溶解;
[0552]
2)称取适量的反离子酸,用有机溶剂溶解;反离子酸的量优选1.2当量;
[0553]
3)把上述两种溶液合并,搅拌析出或滴加不良溶剂1后搅拌析出;
[0554]
4)干燥得目标产物;
[0555]
其中:
[0556]
良性溶剂选自甲醇、二氯甲烷、1,4
‑
二氧六环、丙酮、四氢呋喃、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选甲醇、四氢呋喃;
[0557]
有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈;上述良性溶剂和有机溶液使用时需互溶;
[0558]
不良溶剂1选自庚烷、水、甲基叔丁基醚、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈;优选水、甲基叔丁基醚、异丙醚;
[0559]
反离子酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙烷磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲基苯磺酸或l
‑
苹果酸;优选富马酸盐、对甲苯磺酸盐或丁二酸盐;最优选对甲苯磺酸盐;
[0560]
或者,具体包括如下步骤:
[0561]
1)称取适量的自由碱,用不良溶剂2混悬;
[0562]
2)称取适量的反离子酸,用有机溶剂溶解;反离子酸的量优选1.2当量;
[0563]
3)把上述两种溶液合并搅拌溶解,继续搅拌析出或滴加不良溶剂3后搅拌析出;
[0564]
4)干燥得目标产物;
[0565]
不良溶剂2选自乙酸乙酯、丙酮、二氯甲烷、乙腈、四氢呋喃、2
‑
甲基
‑
四氢呋喃、2
‑
丁酮、3
‑
戊酮、1,4
‑
二氧六环、乙醇;优选乙酸乙酯、丙酮、乙腈、2
‑
甲基
‑
四氢呋喃、乙醇;
[0566]
有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈;上述良性溶剂和有机溶液使用时需互溶;
[0567]
不良溶剂3选自庚烷、水、甲基叔丁基醚、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈;优选水、甲基叔丁基醚、异丙醚;
[0568]
反离子酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙烷
磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲苯磺酸或l
‑
苹果酸;优选富马酸盐、对甲苯磺酸盐或丁二酸盐;最优选对甲苯磺酸盐。
[0569]
本发明的目的还在于提供了一种药物组合物,其含有治疗有效量通式(i)所述的酸式盐,以及一种或多种药学上可接受的载体、稀释剂或赋形剂。
[0570]
本发明的目的还在于提供了一种通式(i)所述的酸式盐以及其药物组合物在制备shp
‑
2抑制剂药物中的应用。
[0571]
本发明的目的还在于提供了一种药物组合物,其含有治疗有效量通式(i)所述的盐的晶型,以及一种或多种药学上可接受的载体、稀释剂或赋形剂。
[0572]
本发明的目的还在于提供了一种通式(i)所述的盐的晶型,以及其药物组合物在制备shp
‑
2抑制剂药物中的应用。
[0573]
以上所述的用途,其中所述的应用为在制备治疗努南氏症候群、豹皮症候群、白血病、神经母细胞瘤、黑色素瘤、食管癌、头颈部肿瘤、乳腺癌、肺癌及其结肠癌等疾病或病症的用途;优选非小细胞肺癌、食管癌和头颈部肿瘤。
附图说明
[0574]
图1为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a的xrpd图示。
[0575]
图2为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a的dsc图示。
[0576]
图3为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a的tga图示。
[0577]
图4为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型b的dsc图示。
[0578]
图5为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型b的tga图示。
[0579]
图6为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺乙烷磺酸盐晶型a的xrpd图示。
[0580]
图7为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺乙烷磺酸盐晶型a的dsc图示。
[0581]
图8为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺乙烷磺酸盐晶型a的tga图示。
[0582]
图9为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺苯磺酸盐晶型a的dsc图示。
[0583]
图10为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺苯磺酸盐晶型a的tga图示。
[0584]
图11为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,
3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺富马酸盐晶型a的dsc图示。
[0585]
图12为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺富马酸盐晶型a的tga图示。
[0586]
图13为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺羟乙基磺酸盐晶型a的dsc图示。
[0587]
图14为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺羟乙基磺酸盐晶型a的tga图示。
[0588]
图15为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺草酸盐晶型a的dsc图示。
[0589]
图16为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺草酸盐晶型a的tga图示。
[0590]
图17为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺乙烷磺酸盐核磁标定含量图谱。
[0591]
图18为(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐成盐含量elsd检测图示。
[0592]
图19为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺自由碱晶型a的xrpd图示。
[0593]
图20为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺自由碱晶型a的dsc
‑
tga图示。
[0594]
图21为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺自由碱晶型b的xrpd图示。
[0595]
图22为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺自由碱晶型b的dsc图示。
[0596]
图23为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺自由碱晶型c的xrpd图示。
[0597]
图24为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺自由碱晶型c的dsc图示。
[0598]
图25为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺甲磺酸盐晶型a的xrpd图示。
[0599]
图26为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺甲磺酸盐晶型a的dsc图示。
[0600]
图27为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺羟乙基磺酸盐晶型a的xrpd图示。
[0601]
图28为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺羟乙基磺酸盐晶型a的dsc图示。
[0602]
图29为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺富马酸盐晶型a的xrpd图示。
[0603]
图30为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺富马酸盐晶型a的dsc图示。
[0604]
图31为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺对甲苯磺酸盐晶型a的xrpd图示。
[0605]
图32为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺对甲苯磺酸盐晶型a的dsc图示。
[0606]
图33为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺乙烷磺酸盐晶型a的xrpd图示。
[0607]
图34为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺乙烷磺酸盐晶型a的dsc图示。
[0608]
图35为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺丁二酸盐晶型a的xrpd图示。
[0609]
图36为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺丁二酸盐晶型a的dsc图示。
[0610]
图37为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺氢溴酸盐晶型a的xrpd图示。
[0611]
图38为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺氢溴酸盐晶型a的dsc图示。
[0612]
图39为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺盐酸盐晶型a的xrpd图示。
[0613]
图40为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺盐酸盐晶型a的dsc图示。
[0614]
图41为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺马来酸盐晶型a的xrpd图示。
[0615]
图42为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺马来酸盐晶型a的dsc图示。
[0616]
图43为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺酒石酸盐晶型a的xrpd图示。
[0617]
图44为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺酒石酸盐晶型a的dsc图示。
[0618]
图45为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺硫酸盐晶型a的xrpd图示。
[0619]
图46为(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺硫酸盐晶型a的dsc图示。
具体实施方式
[0620]
除非有相反陈述,在说明书和权利要求书中使用的术语具有下述含义。
[0621]
术语“烷基”指饱和脂肪族烃基团,其为包含1至20个碳原子的直链或支链基团,优选含有1至8个碳原子的烷基,更优选1至6个碳原子的烷基,最更优选1至3个碳原子的烷基。非限制性实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1
‑
二甲基丙基、1,2
‑
二甲基丙基、2,2
‑
二甲基丙基、1
‑
乙基丙基、2
‑
甲基丁基、3
‑
甲基丁基、
正己基、1
‑
乙基
‑2‑
甲基丙基、1,1,2
‑
三甲基丙基、1,1
‑
二甲基丁基、1,2
‑
二甲基丁基、2,2
‑
二甲基丁基、1,3
‑
二甲基丁基、2
‑
乙基丁基、2
‑
甲基戊基、3
‑
甲基戊基、4
‑
甲基戊基、2,3
‑
二甲基丁基、正庚基、2
‑
甲基己基、3
‑
甲基己基、4
‑
甲基己基、5
‑
甲基己基、2,3
‑
二甲基戊基、2,4
‑
二甲基戊基、2,2
‑
二甲基戊基、3,3
‑
二甲基戊基、2
‑
乙基戊基、3
‑
乙基戊基、正辛基、2,3
‑
二甲基己基、2,4
‑
二甲基己基、2,5
‑
二甲基己基、2,2
‑
二甲基己基、3,3
‑
二甲基己基、4,4
‑
二甲基己基、2
‑
乙基己基、3
‑
乙基己基、4
‑
乙基己基、2
‑
甲基
‑2‑
乙基戊基、2
‑
甲基
‑3‑
乙基戊基、正壬基、2
‑
甲基
‑2‑
乙基己基、2
‑
甲基
‑3‑
乙基己基、2,2
‑
二乙基戊基、正癸基、3,3
‑
二乙基己基、2,2
‑
二乙基己基及其各种支链异构体等。烷基可以是取代的或非取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,所述取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基,本发明优选甲基、乙基、异丙基、叔丁基、卤代烷基、氘代烷基、烷氧基取代的烷基、羟基取代的烷基和氰基取代的烷基。
[0622]
术语“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,环烷基环包含3至20个碳原子,优选包含3至8个碳原子,更优选包含3至6个碳原子。单环环烷基的非限制性实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等;多环环烷基包括螺环、稠环和桥环的环烷基,优选环丙基、环丁基、环己基、环戊基和环庚基。所述环烷基环可以稠合于芳基、杂芳基或杂环烷基环上,其中与母体结构连接在一起的环为环烷基,非限制性实例包括茚满基、四氢萘基、苯并环庚烷基等。环烷基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基。
[0623]
术语“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或s(o)
m
(其中m是整数0至2)的杂原子,但不包括
‑
o
‑
o
‑
、
‑
o
‑
s
‑
或
‑
s
‑
s
‑
的环部分,其余环原子为碳。优选包含3至12个环原子,其中1~4个是杂原子;更优选包含3至8个环原子;最优选包含3至8个环原子。单环杂环基的非限制性实例包括氧杂环丁烷基、吡咯烷基、吡咯烷酮基、咪唑烷基、四氢呋喃基、四氢噻吩基、二氢咪唑基、二氢呋喃基、二氢吡唑基、二氢吡咯基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基、吡喃基等,优选氧杂环丁烷基、吡咯烷酮基、四氢呋喃基、吡唑烷基、吗啉基、哌嗪基和吡喃基。多环杂环基包括螺环、稠环和桥环的杂环基;其中涉及到的螺环、稠环和桥环的杂环基任选与其他基团通过单键相连接,或者通过环上的任意两个或者两个以上的原子与其他环烷基、杂环基、芳基和杂芳基进一步并环连接。杂环基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基。
[0624]
术语“芳基”指具有共轭的π电子体系的6至14元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选为6至10元,例如苯基和萘基。更优选苯基。所述芳基环可以稠合于杂芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为芳基环。芳基可以
是取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0625]
术语“杂芳基”指包含1至4个杂原子、5至14个环原子的杂芳族体系,其中杂原子选自氧、硫和氮。杂芳基优选为5至10元,更优选为5元或6元,例如咪唑基、呋喃基、噻吩基、噻唑基、吡唑基、噁唑基、吡咯基、三唑基、四唑基、吡啶基、嘧啶基、噻二唑、噁二唑、吡嗪基等,优选为噁唑基、噁二唑、四氮唑、三氮唑基、噻吩基、咪唑基、吡啶基、吡唑基、嘧啶基或噻唑基;更有选噁唑基、噁二唑、四氮唑、三氮唑基、噻吩基、吡啶基、噻唑基和嘧啶基。所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环。杂芳基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0626]
术语“烷氧基”指
‑
o
‑
(烷基)和
‑
o
‑
(非取代的环烷基),其中烷基的定义如上所述。优选含有1至8个碳原子的烷氧基,更优选1至6个碳原子的烷氧基,最更优选1至3个碳原子的烷氧基。烷氧基的非限制性实例包括:甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基。烷氧基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0627]“卤代烷基”指被一个或多个卤素取代的烷基,其中烷基如上所定义。
[0628]“卤代烷氧基”指被一个或多个卤素取代的烷氧基,其中烷氧基如上所定义。
[0629]“羟烷基”指被羟基取代的烷基,其中烷基如上所定义。
[0630]“烯基”指链烯基,又称烯烃基,其中所述的烯基可以进一步被其他相关基团取代,例如:烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0631]“羟基”指
‑
oh基团。
[0632]“卤素”指氟、氯、溴或碘。
[0633]“氨基”指
‑
nh2。
[0634]“氰基”指
‑
cn。
[0635]“硝基”指
‑
no2。
[0636]“thf”指四氢呋喃。
[0637]“etoac”或“ea”指乙酸乙酯。
[0638]“dmso”指二甲基亚砜。
[0639]“lda”指二异丙基胺基锂。
[0640]“dmap”指4
‑
二甲氨基吡啶。
[0641]“etmgbr”指乙基溴化镁。
[0642]“hosu”指n
‑
羟基琥珀酰亚胺。
[0643]“edcl”指1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐。
[0644]“ipa”指异丙醇。
[0645]“meoh”指甲醇。
[0646]“etoh”指乙醇。
[0647]“dmf”指n、n
‑
二甲基甲酰胺。
[0648]“dipea”指n,n
‑
二异丙基乙胺。
[0649]“hepes”指4
‑
羟乙基哌嗪乙磺酸。
[0650]“x选自a、b、或c”、“x选自a、b和c”、“x为a、b或c”、“x为a、b和c”等不同用语均表达了相同的意义,即表示x可以是a、b、c中的任意一种或几种。
[0651]“任选”或“任选地”意味着随后所描述的事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生的场合。
[0652]“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1~3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。例如,具有游离氢的氨基或羟基与具有不饱和(如烯属)键的碳原子结合时可能是不稳定的。
[0653]“立体异构”包含几何异构(顺反异构)、旋光异构、构象异构三类。
[0654]
本发明所述的氢原子均可被其同位素氘所取代,本发明涉及的实施例化合物中的任一氢原子也均可被氘原子取代。
[0655]“药物组合物”表示含有一种或多种本文所述化合物或其生理学上/可药用的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
[0656]“可药用盐”是指本发明化合物的盐,这类盐用于哺乳动物体内时具有安全性和有效性,且具有应有的生物活性。
[0657]
x
‑
射线粉末衍射图谱(xrpd),是指实验观测到的衍射图或源自其的参数,通过峰位置(横坐标)及峰强度(纵坐标)表征x
‑
射线粉末衍射图谱。本领域技术人员能够理解,其中的实验误差取决于仪器的条件、样品的准备和样品的纯度。特别是,本领域技术人员公知,x射线衍射图通常会随着仪器的条件而有所改变,本领域技术人员应理解xrpd合适的误差容限可以为:2θ
±
0.5
°
;2θ
±
0.4
°
;2θ
±
0.3
°
;2θ
±
0.2
°
。特别需要指出的是,x射线衍射图的相对强度也可能随着实验条件的变化而变化,所以峰强度的顺序不能作为唯一或决定性因素。另外,由于样品高度等实验因素的影响,会造成峰角度的整体偏移,通常允许一定的偏移。因而,本领域技术人员可以理解的是,任何具有与本发明图谱的特征峰相同或相似的晶型均属于本发明的范畴之内。
[0658]“tga”是指热重分析(tga)实验。
[0659]“dsc”是指差示扫描量热法(dsc)实验。
[0660]“hplc”是指高效液相色谱(hplc)实验。
[0661]“pk”是指药物代谢动力学(pk)实验。
[0662]
以下结合实施例进一步描述本发明,但这些实施例并非限制着本发明的范围。
[0663]
一、化合物的制备
[0664]
本发明的化合物结构是通过核磁共振(nmr)或/和液质联用色谱(lc
‑
ms)来确定
的。nmr化学位移(δ)以百万分之一(ppm)的单位给出。nmr的测定是用bruker avance
‑
400核磁仪,测定溶剂为氘代二甲基亚砜(dmso
‑
d6),氘代甲醇(cd3od)和氘代氯仿(cdcl3),内标为四甲基硅烷(tms)。
[0665]
液质联用色谱lc
‑
ms的测定用agilent 1200infinity series质谱仪。hplc的测定使用安捷伦1200dad高压液相色谱仪(sunfire c18 150
×
4.6mm色谱柱)和waters 2695
‑
2996高压液相色谱仪(gimini c
18 150
×
4.6mm色谱柱)。
[0666]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,tlc采用的规格是0.15mm~0.20mm,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0667]
本发明实施例中的起始原料是已知的并且可以在市场上买到,或者可以采用或按照本领域已知的方法来合成。
[0668]
在无特殊说明的情况下,本发明的所有反应均在连续的磁力搅拌下,在干燥氮气或氩气氛下进行,溶剂为干燥溶剂,反应温度单位为摄氏度。
[0669]
实施例1
[0670]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0671][0672]
第一步:3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯的制备
[0673][0674]
将3
‑
氯
‑4‑
碘吡啶
‑2‑
胺(800mg,3.15mmol),3
‑
巯基丙酸
‑2‑
乙基己酯(687mg,3.15mmol)溶于1,4
‑
二氧六环(7ml),置于微波反应管中,加入dipea(813mg,6.3mmol)、醋酸钯(35mg,0.16mmol)以及xantphos(109mg,0.19mmol),氮气鼓泡3分钟后,微波加热至100℃反应1小时。待反应液冷却后,将反应液用20ml乙酸乙酯稀释,用硅藻土过滤除去不溶物,滤液旋干后柱层析纯化(15~25%乙酸乙酯/石油醚),得棕色固体产物(1.03g,产率95%)。
[0675]
ms m/z(esi):345.1[m h]
.
[0676]
第二步:3
‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯的制备
[0677][0678]
将3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯(500mg,1.45mmol)溶于甲苯和水的(甲苯/水=10ml/1ml)混合溶剂,置于封管中,加入环丙基三氟硼酸钾(280mg,1.89mmol)、正丁基二(1
‑
金刚烷基)膦(52mg,0.145mmol)、醋酸钯(16mg,0.073mmol)以及碳
酸铯(1.41g,4.35mmol),氮气鼓泡3分钟后,加热至100℃反应5小时。待反应液冷却至室温,向反应液中加入20ml饱和nh4cl溶液,用乙酸乙酯萃取(20ml
×
3);乙酸乙酯层用饱和氯化钠溶液洗涤后,用无水硫酸钠干燥,柱层析(50%乙酸乙酯/石油醚)纯化,得棕色油状产物(220mg,产率43%)。
[0679]
ms m/z(esi):350.1[m h]
.
[0680]
第三步:2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
硫醇酸钾的制备
[0681][0682]
将3
‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯(220mg,0.63mmol)溶于10ml乙醇中,加入叔丁醇钾(74mg,0.66mmol),室温搅拌1小时。将反应液浓缩至干,直接用于下一步反应。
[0683]
ms m/z(esi):165.1[m
‑
h]
‑
.
[0684]
第四步:3
‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺的制备
[0685][0686]
将2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
硫醇酸钾(128mg,0.63mmol)、2
‑
氨基
‑3‑
溴
‑6‑
氯吡嗪(149mg,0.72mmol)溶于7ml 1,4
‑
二氧六环,置于微波反应管中,加入三(二亚苄基丙酮)二钯(33mg,0.036mmol)、xantphos(42mg,0.072mmol)以及dipea(279mg,2.16mmol),氮气鼓泡3分钟。将反应液微波加热至110℃反应1小时;待反应液冷却至室温后,用20ml乙酸乙酯稀释,用硅藻土过滤后,滤液旋干,柱层析(50~70%乙酸乙酯/石油醚)纯化,得棕色固体产物(50mg,产率24%)。
[0687]
ms m/z(esi):294.1[m h]
.
[0688]
第五步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0689][0690]
取(s)
‑1‑
(((r)
‑
叔丁基亚硫酰基)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(69mg,0.17mmol)溶于3ml二氯甲烷,加入1ml三氟乙酸,室温下反应1小时。将此反应液浓缩至干,用5ml dmf溶解后,加入碳酸钾(352mg,2.55mmol)、3
‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(50mg,0.17mmol),氮气保护下加热至100℃反应12小时。待反应液冷却后,加入20ml水,用乙酸乙酯萃取(20ml
×
3);乙酸乙酯层用饱和氯化钠溶液洗涤(20ml
×
3),无水硫酸钠干燥后柱层析(75~80%乙酸乙酯/石油醚)纯化,得油状产物
(20mg,产率21%)。ms m/z(esi):564.1[m h]
.
[0691]
第六步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0692][0693]
将(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(20mg,0.035mmol)溶于5ml二氯甲烷,加入1ml 4m hcl的二氧六环溶液,于室温反应1小时。将反应液浓缩至干,用5ml甲醇溶解后,用7m nh3的甲醇溶液调节ph至碱性,将此反应液旋干后柱层析(0~10%meoh in dcm),所得粗品用薄层层析纯化(二氯甲烷:甲醇=10:1)得棕色固体产物(9.0mg,产率56%)。
[0694]1h nmr(400mhz,methanol
‑
d4)δ7.90(d,j=5.4hz,1h),7.61(s,1h),7.40
–
7.33(m,1h),7.27
–
7.16(m,3h),6.57(d,j=5.4hz,1h),4.28(d,j=13.6hz,2h),3.96(s,1h),3.30
–
3.19(m,2h),3.15(d,j=15.7hz,1h),2.81(d,j=15.7hz,1h),1.90
–
1.78(m,2h),1.82
–
1.70(m,1h),1.58(d,j=13.5hz,1h),1.43(d,j=13.1hz,1h),1.26
–
1.15(m,2h),0.94
–
0.85(m,2h).
[0695]
ms m/z(esi):460.1[m h]
.
[0696]
实施例2
[0697]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氯
‑3‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0698][0699]
实施例2参考实施例1实验方案制备。
[0700]1h nmr(400mhz,methanol
‑
d4)δ7.88(d,j=5.5hz,1h),7.60(s,1h),7.38
–
7.30(m,1h),7.25
–
7.15(m,3h),6.54(d,j=5.5hz,1h),4.26(d,j=13.7hz,2h),3.95(s,1h),3.28
–
3.17(m,2h),3.13(d,j=15.6hz,1h),2.79(d,j=15.6hz,1h),1.88
–
1.74(m,2h),1.80
–
1.70(m,1h),1.56(d,j=13.7hz,1h),1.43(d,j=13.1hz,1h),1.24
–
1.13(m,2h),0.93
–
0.83(m,2h).
[0701]
ms m/z(esi):479.1[m h]
,481.1[m 2 h]
.
[0702]
实施例3
[0703]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0704][0705]
第一步:3
‑
((2,3
‑
二氯吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯的制备
[0706][0707]
将2,3
‑
二氯
‑4‑
碘吡啶(1.0g,3.65mmol),3
‑
巯基丙酸
‑2‑
乙基己酯(0.88g,4.03mmol)溶于7ml 1,4
‑
二氧六环,置于微波反应管中,加入dipea(0.95g,7.34mmol)、醋酸钯(41mg,0.18mmol)以及xantphos(127mg,0.22mmol),氮气鼓泡3分钟后,微波加热至100℃反应1小时。待反应液冷却后,将反应液用20ml乙酸乙酯稀释,用硅藻土过滤除去不溶物,滤液旋干后柱层析(10~15%乙酸乙酯/石油醚),得棕色油状物(1.29g,产率97%)。
[0708]
ms m/z(esi):364.1[m h]
.
[0709]
第二步:3
‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯的制备
[0710][0711]
将3
‑
((2,3
‑
二氯吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯(1.29g,3.54mmol)溶于甲苯和水的(甲苯/水=20ml/2ml)混合溶剂,置于封管中,加入环丙基三氟硼酸钾(624mg,4.25mmol)、正丁基二(1
‑
金刚烷基)膦(95mg,0.267mmol)、醋酸钯(40mg,0.178mmol)以及碳酸铯(3.43g,3.54mmol),氮气鼓泡3分钟后,加热至100℃反应5小时。待反应液冷却至室温,向反应液中加入20ml饱和nh4cl溶液,用乙酸乙酯萃取(20ml
×
3);乙酸乙酯层用饱和氯化钠溶液洗涤后,用无水硫酸钠干燥,柱层析(5~8%乙酸乙酯/石油醚),得黄色油状物(600mg,产率45%)。
[0712]
ms m/z(esi):370.1[m h]
.
[0713]
第三步:3
‑
氯
‑2‑
环丙基吡啶
‑4‑
硫醇酸钾的制备
[0714][0715]
将2
‑
乙基己基3
‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)丙酸酯(600mg,1.62mmol)溶于15ml乙醇中,加入叔丁醇钾(190mg,1.70mmol),室温搅拌1小时。将反应液浓缩至干,直接用于下一步反应。
[0716]
ms m/z(esi):186.1[m h]
。
[0717]
第四步:6
‑
氯
‑3‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
胺的制备
[0718][0719]
将3
‑
氯
‑2‑
环丙基吡啶
‑4‑
硫醇酸钾(120mg,0.54mmol)、2
‑
氨基
‑3‑
溴
‑6‑
氯吡嗪(112mg,0.54mmol)溶于5ml 1,4
‑
二氧六环,置于微波反应管中,加入三(二亚苄基丙酮)二钯(25mg,0.027mmol)、xantphos(31mg,0.054mmol)以及dipea(209mg,1.62mmol),氮气鼓泡3分钟。将反应液微波加热至110℃反应1小时;待反应液冷却至室温后,用20ml乙酸乙酯稀释,用硅藻土过滤后,滤液旋干柱层析(10~20%乙酸乙酯/石油醚),得灰白色固体产物(135mg,产率80%)。
[0720]
ms m/z(esi):313.1[m h]
.
[0721]
第五步:叔丁基1
‑
羰基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸酯的制备
[0722][0723]
将1
‑
茚酮(5.14g,38.9mmol)、n,n
‑
双(2
‑
氯乙基)氨基甲酸叔丁酯(9.42g,38.9mmol)溶于100ml dmf中,冰浴下分批加入60%氢化钠(3.89g,97.3mmol)。将反应液转至油浴,氮气保护下加热至60℃反应过夜。待反应液冷却后,向反应液中加入250ml饱和氯化钠溶液,用乙酸乙酯萃取(150ml
×
2);乙酸乙酯层用饱和氯化钠溶液洗涤(100ml
×
3),无水mgso4干燥后,柱层析(10~20%乙酸乙酯/石油醚),得棕色油状物粗品(2.80g,产率23%)。
[0724]
ms m/z(esi):202.1[m
‑
boc h]
.
[0725]
第六步:(r,e)
‑1‑
((叔丁基亚硫酰基)亚氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯的制备
[0726][0727]
将钛酸四乙酯(40ml)加热至90℃,加入1
‑
羰基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(2.80g,9.27mmol)、(r)
‑
( )
‑
叔丁基亚磺酰胺(3.36g,27.8mmol);氮气保护下90℃反应24小时。待反应完毕后将反应液倒入400ml乙酸乙酯中,搅拌下缓慢加入400ml饱和氯化钠溶液,并于室温搅拌20分钟。用硅藻土将析出的固体过滤,所得滤液分层后将乙酸乙酯层用无水硫酸镁干燥,柱层析(20~30%乙酸乙酯/石油醚),得棕色油状产物(2.20g,产率59%)。
[0728]
ms m/z(esi):405.1[m h]
.
[0729]
第七步:(s)
‑1‑
(((r)
‑
叔丁基亚硫酰基)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯的制备
[0730][0731]
将(r,e)
‑1‑
((叔丁基亚硫酰基)亚氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(2.20g,5.44mmol)溶于30ml四氢呋喃,置于
‑
78℃,于此温度下分批加入硼氢化钠(308mg,8.16mmol),氮气保护下令反应液逐渐升温至室温并搅拌过夜。向反应液中加入200ml饱和氯化钠溶液,用乙酸乙酯萃取(100ml
×
2),乙酸乙酯层用饱和氯化钠溶液洗涤(100ml),无水硫酸钠干燥后,柱层析(20~35%乙酸乙酯/石油醚),得棕色泡沫状固体(1.21g,产率54%)。
[0732]
ms m/z(esi):407.1[m h]
.
[0733]
第八步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0734][0735]
取(s)
‑1‑
(((r)
‑
叔丁基亚硫酰基)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(100mg,0.25mmol)溶于3ml二氯甲烷,加入1ml三氟乙酸,室温下反应1小时。将此反应液浓缩至干,用5ml dmf溶解后,加入碳酸钾(517mg,3.75mmol)、6
‑
氯
‑3‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
胺(78mg,0.25mmol),氮气保护下加热至100℃反应12小时。待反应液冷却后,加入20ml水,用乙酸乙酯萃取(20ml
×
3);乙酸乙酯层用饱和氯化钠溶液洗涤(20ml
×
3),无水硫酸钠干燥后柱层析(50%乙酸乙酯/石油醚),得油状产物(26mg,产率18%)。
[0736]
ms m/z(esi):583.1[m h]
.
[0737]
第九步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0738][0739]
将(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(26mg,0.044mmol)溶于5ml二氯甲烷,加入1ml 4m hcl的二氧六环溶液,于室温反应1小时。将反应液浓缩至干,用5ml甲醇溶解后,用7m nh3的甲醇溶液调节ph至碱性,将此反应液旋干后柱层析(5~8%meoh in dcm),得淡黄色固体产物(12mg,产率57%)。
[0740]1h nmr(400mhz,chloroform
‑
d)δ8.03(d,j=5.2hz,1h),7.67(s,1h),7.44
–
7.37(m,1h),7.24(dd,j=6.4,3.9hz,3h),6.39(d,j=5.2hz,1h),4.85(s,2h),4.21
–
4.13(m,2h),4.07(s,1h),3.23
–
3.21(m,2h),3.13(d,j=15.8hz,1h),2.79(d,j=15.7hz,1h),2.57
–
2.48(m,1h),1.88
–
1.73(m,2h),1.63
–
1.56(m,1h),1.50
–
1.42(m,1h),1.09
–
1.00(m,4h).
[0741]
ms m/z(esi):479.1[m h]
.
[0742]
实施例4
[0743]
(2r)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)螺[二环[3.1.0]己烷
‑
3,4'
‑
哌啶]
‑2‑
胺的制备
[0744][0745]1h nmr(400mhz,methanol
‑
d4)δ7.73
–
7.67(m,1h),7.65
–
7.60(m,1h),6.08
–
6.01(m,1h),4.53
–
4.41(m,2h),3.63
–
3.51(m,2h),3.14(p,j=9.6hz,1h),2.41
–
2.33(m,1h),1.56
–
1.40(m,3h),1.44
–
1.35(m,1h),1.39
–
1.19(m,4h),0.89
–
0.81(m,2h),0.76
–
0.60(m,2h),0.44
–
0.28(m,2h).
[0746]
ms m/z(esi):424.1[m h]
.
[0747]
实施例4参考实施例1实验方案制备。
[0748]
实施例5
[0749]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
溴吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺制备
[0750][0751]
第一步:3
‑
((3
‑
氨基
‑5‑
氯吡嗪
‑2‑
基)硫代)丙酸(2
‑
乙基)己酯的制备
[0752][0753]3‑
溴
‑6‑
氯吡嗪
‑2‑
胺(4g,20mmol),3
‑
巯基丙酸(2
‑
乙基)己酯(5.2g,24mmol),三(二亚苄基丙酮)二钯(916mg,1mmol),4,5
‑
双(二苯基膦)
‑
9,9
‑
二甲基氧杂蒽(1.16g,2mmol)和n,n
‑
二异丙基乙胺(5.12g,40mmol)在二氧六环(35ml)中100℃搅拌18小时。过滤反应液,滤饼用乙酸乙酯(30ml)洗两次,浓缩滤液后柱层析[洗脱剂:石油醚~石油醚/乙酸乙酯(90:10)]纯化得到3
‑
((3
‑
氨基
‑5‑
氯吡嗪
‑2‑
基)硫代)丙酸(2
‑
乙基)己酯(5.5g,产率82%)棕色油状物。
[0754]
ms m/z(esi):146.1[m h]
,148.1[m 2 h]
.
[0755]
第二步:3
‑
氨基
‑5‑
氯吡嗪
‑2‑
硫醇的制备
[0756][0757]
往2
‑
乙基己基3
‑
((3
‑
氨基
‑5‑
氯吡嗪
‑2‑
基)硫代)丙酸酯(5.5g,15.9mmol)的乙醇(100ml)溶液中加叔丁醇钾(2.7g,23.9mmol),加完室温搅拌3小时。旋掉大约50ml乙醇,再把剩下的反应液倒入氯化铵水溶液(100ml),用乙酸乙酯(100ml)萃取两遍,二氯甲烷(100ml)萃取两遍,浓缩有机相,然后柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(95:5)]纯化得到3
‑
氨基
‑5‑
氯吡嗪
‑2‑
硫醇(1.8g,产率70%)墨绿色固体。
[0758]
ms m/z(esi):162.0[m h]
,164.0[m 2 h]
[0759]
第三步:3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺的制备
[0760][0761]3‑
氨基
‑5‑
氯吡嗪
‑2‑
硫醇(500mg,3.1mmol),3
‑
氯
‑4‑
碘吡啶
‑2‑
胺(789mg,3.1mmol),三(二亚苄基丙酮)二钯(142mg,0.16mmol),4,5
‑
双(二苯基膦)
‑
9,9
‑
二甲基氧杂蒽(179mg,0.31mmol)和n,n
‑
二异丙基乙胺(1.2g,9.3mmol)在二氧六环(10ml)中130℃微波搅拌1小时。浓缩反应液,柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(99:1)]纯化得到粗品1g。用乙醇(5ml)打浆,过滤得到3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(580mg,产率65%)灰色固体。
[0762]
ms m/z(esi):288.0[m h]
,290.0[m 2 h]
.
[0763]
第四步:n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0764][0765]
往叔
‑
丁基(1s)
‑1‑
((叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸酯(150mg,0.37mmol)的二氯甲烷(3ml)溶液里加三氟乙酸(1ml),加完室温搅拌2小时。浓缩反应液得到n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺盐酸盐(150mg,产率100%)淡黄色固体。
[0766]
ms m/z(esi):307.2[m h]
.
[0767]
[α]
20d
=1.773.
[0768]
第五步:n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0769]
[0770]
n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺盐酸盐(150mg,0.37mmol),3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(100mg,0.35mmol)和碳酸钾(335mg,2.43mmol)在n,n
‑
二甲基甲酰胺(4ml)中100℃搅拌18小时。浓缩反应液,柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(97:3)]纯化得到n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(100mg,产率52%)紫色固体。
[0771]
ms m/z(esi):558.1[m h]
,560.2[m 2 h]
.
[0772]
第六步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
溴吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0773][0774]
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(100mg,0.18mmol),n
‑
溴代琥珀酰亚胺(64mg,0.36mmol)在n,n
‑
二甲基甲酰胺(1ml)中室温搅拌18小时后,将反应液浓缩得粗品,柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(95:5)]纯化得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
溴吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(80mg,产率84%)土黄色固体。
[0775]1h nmr(400mhz,dmso
‑
d6)δ7.72
‑
7.64(m,1h),7.36(d,j=4hz,1h),7.27
‑
7.16(m,3h),6.58(s,2h),6.33(s,2h),5.80(d,j=4hz,1h),3.99(s,1h),3.94
‑
3.83(m,2h),3.17(d,j=4hz,1h),3.14
‑
2.98(m,3h),2.77
‑
2.64(m,1h),1.97
‑
1.74(m,2h),1.55(d,j=12hz,1h).
[0776]
ms m/z(esi):532.0[m h]
,534.0[m 2 h]
.
[0777]
实施例6
[0778]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺制备
[0779][0780]
第一步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0781][0782]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
溴吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(30mg,0.056mmol),三甲基环三硼氧烷(789mg,3.1mmol),[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(4mg,0.0056mmol),和碳酸钾(15mg,0.11mmol)在n,n
‑
二
甲基甲酰胺(10ml)中130℃微波搅拌1小时。浓缩反应液,高效液相色谱分离纯化得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(0.7mg,产率3%)灰色固体。
[0783]1h nmr(400mhz,dmso)δ7.73
‑
7.62(m,1h),7.35(d,j=4hz,1h),7.28
‑
7.16(m,3h),6.57(s,2h),6.32(s,2h),5.78(d,j=4hz,1h),3.97(s,1h),3.94
‑
3.81(m,2h),3.15(d,j=4hz,1h),3.12
‑
2.95(m,3h),2.75
‑
2.64(m,1h),2.41(s,3h),1.99
‑
1.75(m,2h),1.58(d,j=12hz,1h).
[0784]
ms m/z(esi):468.1[m h]
,470.1[m 2 h]
.
[0785]
实施例7
[0786]
(s)
‑
1'
‑
(5
‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0787][0788]
第一步:2
‑
氯
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪的制备
[0789][0790]
将3
‑
氯
‑2‑
环丙基吡啶
‑4‑
硫醇酸钾(120mg,0.54mmol)、2
‑
溴
‑5‑
氯吡嗪(104mg,0.54mmol)溶于5ml二氧六环,置于微波反应管中,加入三(二亚苄基丙酮)二钯(25mg,0027mmol)、xantphos(31mg,0.054mmol)以及dipea(209mg,1.62mmol),氮气鼓泡3分钟。将反应液微波加热至110℃反应1小时;待反应液冷却至室温后,用20ml乙酸乙酯稀释,用硅藻土过滤后,滤液旋干柱层析(10~20%乙酸乙酯/石油醚),得淡黄色油状物(120mg,产率74%)。
[0791]
ms m/z(esi):298.0[m h]
.
[0792]
第二步:(r)
‑
n
‑
((s)
‑
1'
‑
(5
‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0793][0794]
取叔丁基(s)
‑1‑
(((r)
‑
叔丁基亚硫酰基)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸酯(81mg,0.20mmol)溶于3ml二氯甲烷,加入1ml三氟乙酸,室温下反应1小时。将此反应液浓缩至干,用5ml dmf溶解后,加入碳酸钾(373mg,2.70mmol)、2
‑
氯
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪(55mg,0.18mmol),氮气保护下加热至100℃反应12小时。待反应液冷
却后,加入20ml水,用乙酸乙酯萃取(20ml
×
3);乙酸乙酯层用饱和氯化钠溶液洗涤(20ml
×
3),无水硫酸钠干燥后柱层析(50%乙酸乙酯/石油醚),得油状产物(48mg,产率47%)。
[0795]
ms m/z(esi):568.1[m h]
.
[0796]
第三步:(s)
‑
1'
‑
(5
‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0797][0798]
将(r)
‑
n
‑
((s)
‑
1'
‑
(5
‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(48mg,0.085mmol)溶于5ml二氯甲烷,加入1ml 4m hcl的二氧六环溶液,于室温反应1小时。将反应液浓缩至干,用5ml甲醇溶解后,用7m nh3的甲醇溶液调节ph至碱性,将此反应液旋干后柱层析(0~10%meoh in dcm),得淡黄色固体产物(23mg,产率58%)。
[0799]1h nmr(400mhz,methanol
‑
d4)δ8.36(s,1h),8.30(s,1h),7.98(d,j=5.3hz,1h),7.42(d,j=6.8hz,1h),7.32
–
7.21(m,3h),6.43(d,j=5.3hz,1h),4.44
–
4.29(m,2h),4.14(s,1h),3.41
–
3.30(m,2h),3.19(d,j=15.9hz,1h),2.96(d,j=15.9hz,1h),2.60
–
2.49(m,1h),1.90
–
1.76(m,2h),1.67
–
1.54(m,2h),1.09
–
0.99(m,4h).
[0800]
ms m/z(esi):464.1[m h]
.
[0801]
实施例8
[0802]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0803][0804]
第一步:叔
‑
丁基(5
‑
溴
‑
1,3,4
‑
噻二唑
‑2‑
基)氨基甲酸酯的制备
[0805][0806]
将乙基2
‑
氯噻唑
‑4‑
羧酸酯(9.0g,46.97mmol)溶于150ml甲醇中,室温搅拌,加入nabh4(7.1g,分三批加入),搅拌直至原料消失。然后,将反应液缓慢加入搅动的食盐水中,淬灭反应液,将其中的溶剂蒸出,乙酸乙酯萃取(200ml)萃取三次,合并有机层,无水硫酸钠干燥,浓缩得到粗品,柱层析(乙酸乙酯/石油醚=3:1)纯化得到无色油状液体目标产物(2
‑
氯噻唑
‑4‑
基)甲醇(4.2g,产率60%)。
[0807]1h nmr(400mhz,cdcl3)δ7.11(s,1h),4.71(s,2h),2.22(s,1h).
[0808]
ms m/z(esi):150.0[m h]
,152.0[m 2 h]
.
[0809]
第二步:(2
‑
氯噻唑
‑4‑
基)甲基甲磺酸酯的制备
[0810][0811]
将(2
‑
氯噻唑
‑4‑
基)甲醇(2.6g,17.4mmol)溶于40ml二氯甲烷中,氮气保护下,冰水浴条件下,滴加甲磺酰氯(1.6ml,20.88mmol,d=1.48g/ml),冰水浴条件下搅拌30min。反应结束,将反应液滴加到饱和氯化钠(100ml)中,二氯甲烷(100ml)萃取三次,合并有机层,无水硫酸钠干燥,浓缩得到白色固体目标产物(2
‑
氯噻唑
‑4‑
基)甲基甲磺酸酯(3.9g,产率97%)。
[0812]1h nmr(400mhz,cdcl3)δ7.35(s,1h),5.25(s,2h),3.07(s,3h).
[0813]
第三步:4
‑
((2
‑
氯噻唑
‑4‑
基)甲基)哌啶
‑
1,4
‑
二羧酸1
‑
(叔
‑
丁基)
‑4‑
乙酯的制备
[0814][0815]
将哌啶
‑
1,4
‑
二羧酸1
‑
(叔
‑
丁基)
‑4‑
乙酯(4.8g,18.59mmol)溶于thf(40ml)中,氮气保护下,冷却到
‑
60℃,滴加二异丙基氨基锂(12.7ml,25.35mmol),滴加完毕,反应液在
‑
60℃到
‑
50℃条件下,搅拌30min。然后滴加(2
‑
氯噻唑
‑4‑
基)甲基甲磺酸酯的thf(15ml)溶液。滴加完毕,在
‑
60℃条件下搅拌30min,然后缓慢升温到室温搅拌2小时。反应结束,将反应液滴加到饱和食盐水(150ml)中。乙酸乙酯(100ml)萃取三次。合并有机层,无水硫酸钠干燥,浓缩浓缩得到粗品,柱层析(乙酸乙酯/石油醚=3:1)纯化得到黄色液体目标产物4
‑
((2
‑
氯噻唑
‑4‑
基)甲基)哌啶
‑
1,4
‑
二羧酸1
‑
(叔
‑
丁基)
‑4‑
乙酯(3.7g,产率56%)。
[0816]1h nmr(400mhz,cdcl3)δ6.79(s,1h),4.14(dd,j=7.1,3.1hz,2h),3.91
–
3.85(m,2h),2.92(s,2h),2.86(dd,j=16.3,13.6hz,2h),2.10(d,j=13.5hz,2h),1.53(s,2h),1.44(s,9h),1.25
–
1.22(m,3h).
[0817]
ms m/z(esi):289[m
‑
100 h]
.
[0818]
第四步:2
‑
氯
‑6‑
羰基
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯的制备
[0819][0820]
将4
‑
乙基4
‑
((2
‑
氯噻唑
‑4‑
基)甲基)哌啶
‑
1,4
‑
二羧酸1
‑
(叔
‑
丁基)
‑4‑
乙酯(4.1g,10.6mmol)溶于thf(40ml)中,氮气保护下,冷却到
‑
70℃,滴加二异丙基氨基锂(13.4ml,26.5mmol),滴加完毕,反应液在
‑
70℃条件下,搅拌30min。反应结束,将反应液滴加到饱和食盐水(150ml)中,乙酸乙酯(100ml)萃取三次。合并有机层,无水硫酸钠干燥,浓缩得到粗品,柱层析(乙酸乙酯/石油醚=3:1)纯化得到黄色固体目标产物叔
‑
丁基2
‑
氯
‑6‑
羰基
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸酯(1.2g,产率33%)。
[0821]1h nmr(400mhz,cdcl3)δ4.15(s,4h),3.05(s,2h),2.06
–
1.93(m,2h),1.60(d,j=12.7hz,2h),1.48(s,9h).
[0822]
ms m/z(esi):243[m
‑
100 h]
.
[0823]
第五步:(r,z)
‑6‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯的制备
[0824][0825]
将叔
‑
丁基2
‑
氯
‑6‑
羰基
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸酯(1.2g,3.5mmol)溶于thf(10ml)中,加入ti(oet)4(10ml),氮气保护下,加热到95℃条件下,搅拌10小时。冷却到室温,用乙酸乙酯(200ml)稀释反应液,搅拌条件下,加入水(20ml),继续搅拌至浑浊,往其中加入无水硫酸钠,至混合物中固体呈沙状。过滤,滤液浓缩得到粗品,柱层析(pe/ea=5:1)纯化得到黄色固体目标产物(r,z)
‑6‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(1.1g,产率75%)。
[0826]1h nmr(400mhz,cdcl3)δ4.13(dd,j=22.7,15.6hz,4h),2.92(d,j=2.9hz,2h),2.05(s,2h),1.57(s,2h),1.48(s,9h),1.29
–
1.22(m,9h).
[0827]
ms m/z(esi):346[m
‑
100 h]
.
[0828]
第六步:(s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸酯和叔
‑
丁基(s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯的制备
[0829]
将(r,z)
‑6‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(600mg,1.35mmol)溶于无水thf(10ml)中,置于50ml三口瓶中,氮气保护下,冷却到
‑
70℃,滴加bh3/thf(4.0ml,d=1m),滴加完毕,缓慢升温至室温,搅拌10小时。将反应液滴加到水中,用碳酸氢钠饱和溶液条件至ph=9,乙酸乙酯(100ml)萃取三次。合并有机层,无水硫酸钠干燥,浓缩得到粗品,柱层析(pe/ea=1:1)纯化得到黄色液体目标产物叔
‑
丁基(s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸酯(112mg,产率20%)和黄色液体(s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(56mg,产率9%)。
[0830]
ms m/z(esi):414.0[m h]
;
[0831]
ms m/z(esi):448.1[m h]
,450.1[m h 2]
.
[0832]
第七步:(r)
‑
n
‑
((s)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0833][0834]
将(s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(112mg,0.27mmol)溶于无水ch2cl2(5ml)中,加入三氟乙酸(1.0ml),室温搅拌2小时,浓缩反应液得到黄色液体粗品(r)
‑
n
‑
((s)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(67mg,产率76%)。
[0835]
ms m/z(esi):314.0[m h]
.
[0836]
第八步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0837][0838]
将(r)
‑
n
‑
((s)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(67mg,0.21mmol),6
‑
氯
‑3‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
胺(78mg,0.25mmol)和dipea(0.4ml)溶于dmf(2.0ml),加热到110℃,搅拌10小时。将反应液溶于乙酸乙酯(100ml),水洗(50ml)两次,饱和食盐水(50ml)洗三次。合并有机层,无水硫酸钠干燥,浓缩得到粗品,柱层析(etoac)纯化得到黄色液体目标产物(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(30mg,产率19%)。
[0839]
ms m/z(esi):590.0[m h]
.
[0840]
第九步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0841][0842]
将(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(30mg,0.05mmol)溶于无水甲醇(3.0ml)中,加入盐酸/1,4
‑
二氧六环(1.0ml),室温搅拌0.5小时,浓缩反应液得到粗品,溶于水中,用碳酸氢钠饱和溶液调节ph=10,二氯甲烷(50ml)萃取两次。合并有机层,无水硫酸钠干燥,浓缩得到粗品,制备hplc纯化得到黄色固体目标产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺(3.4mg,产率49%)。
[0843]1h nmr(500mhz,cdcl3)δ8.77(s,1h),8.48(s,1h),7.45(d,j=9.7hz,2h),4.45(s,1h),3.38(d,j=61.4hz,4h),2.91(s,2h),2.22(s,1h),1.92(s,1h),1.71(s,1h),1.52(s,2h),1.33
–
0.92(m,8h).
[0844]
ms m/z(esi):486[m h]
.
[0845]
实施例9
[0846]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0847][0848]
第一步:(r)
‑
n
‑
((s)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0849][0850]
将(s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(56mg,0.13mmol)溶于无水ch2cl2(5ml)中,加入三氟乙酸(1.0ml),室温搅拌2小时,浓缩反应液得到黄色液体粗品(r)
‑
n
‑
((s)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(40mg,产率100%)。
[0851]
ms m/z(esi):348.0[m h]
.
[0852]
第二步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0853]
将(r)
‑
n
‑
((s)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(40mg,0.1mmol),6
‑
氯
‑3‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
胺(15mg,0.05mmol)和dipea(0.1ml)溶于dmf(0.8ml),加热到110℃,搅拌10小时。将反应液溶于乙酸乙酯(100ml),水洗(50ml)两次,饱和食盐水(50ml)三次。合并有机层,无水硫酸钠干燥,浓缩得到粗品,柱层析(etoac)纯化得到黄色液体目标产物(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(8.2mg,产率26%)。
[0854]
ms m/z(esi):624.1[m h]
.
[0855]
第三步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0856][0857]
将(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(8.2mg,0.01mmol)溶于无水甲醇(2.0ml)中,加入盐酸/二氧六环(0.5ml),室温搅拌0.5小时,浓缩反应液得到粗品,溶于水中,用碳酸氢钠饱和溶液调节ph=10,二氯甲烷(50ml)萃取两次,合并有机层,无水硫酸钠干燥,浓缩得到粗品,制备hplc纯化得到黄色固体目标产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
氯
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺(1.5mg,产率22%)。
[0858]1h nmr(500mhz,cdcl3)δ8.48(s,1h),7.45(d,j=10.3hz,2h),4.71(s,1h),3.41(d,j=74.5hz,4h),2.92(s,2h),2.16(d,j=56.0hz,2h),1.74(s,1h),1.52(s,2h),1.26(d,j=15.5hz,4h),1.03(d,j=39.0hz,4h).
[0859]
ms m/z(esi):520.1[m h]
.
[0860]
实施例10
[0861]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0862][0863]
第一步:2
‑
乙基己基3
‑
((2,3
‑
二氯吡啶
‑4‑
基)硫代)丙酸酯的制备
[0864][0865]
将2,3
‑
二氯
‑4‑
碘吡啶(2.0g,7.31mmol),2
‑
乙基己基3
‑
巯基丙酸酯(1.8g,8.24mmol),醋酸钯(82mg,0.37mmol),xantphos(254mg,0.44mmol),二异丙基乙胺(1.9g,14.70mmol)于15ml二氧六环,氮气下100℃搅拌5h,冷至室温,加乙酸乙酯,过滤,浓缩至干,柱层析(石油醚/乙酸乙酯=3:1)纯化得到目标产物2
‑
乙基己基3
‑
((2,3
‑
二氯吡啶
‑4‑
基)硫代)丙酸酯(910mg,产率34%)。
[0866]
ms m/z(esi):364.1[m h]
[0867]
第二步:2
‑
乙基己基3
‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸酯的制备
[0868][0869]2‑
乙基己基3
‑
((2,3
‑
二氯吡啶
‑4‑
基)硫代)丙酸酯(200mg,0.55mmol),氮杂环丁烷(63mg,1.10mmol),1,4
‑
二氧六环(5ml),于120℃下微波搅拌3h。浓缩至干,加水,二氯甲烷提取,浓缩至干,柱层析(石油醚/乙酸乙酯=3:1)得到产物(130mg,产率62%)。
[0870]
ms m/z(esi):385.1[m h]
.
[0871]
第三步:2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
硫醇的制备
[0872][0873]3‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基己)酯(130mg,0.34mmol),叔丁醇钾(38mg,0.34mmol)于无水乙醇(5ml)中,室温搅拌1h,浓缩至干得到产物,直接用于下一步反应。
[0874]
ms m/z(esi):201.0[m h]
.
[0875]
第四步:3
‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺的制备
[0876][0877]2‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
硫醇(上一步所得)、3
‑
溴
‑6‑
氯吡嗪
‑2‑
胺(84mg,0.40mmol)、pd2(dba)3(15mg,0.016mmol)、xantphos(20mg,0.035mmol),二异丙基乙胺(87mg,0.67mmol)加于5ml 1,4
‑
二氧六环中,氮气下100℃搅拌过夜,冷至室温,浓缩至干,柱层析(石油醚/乙酸乙酯=1:1)纯化得到浅黄色固体(71mg,产率64%)。
[0878]
ms m/z(esi):328.0[m h]
.
[0879]
第五步:(r)
‑
n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0880][0881]
(s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
羧酸叔丁酯(100mg,0.25mmol)溶于二氯甲烷(1ml),加1ml三氟乙酸,室温搅拌1h,浓缩至干得到油状物,直接用于下一步反应。
[0882]
ms m/z(esi):307.1[m h]
.
[0883]
[α]
20d
=1.773.
[0884]
第六步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0885][0886]3‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(71mg,0.22mmol)、(r)
‑
n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(上一步反应所得)、碳酸钾(299mg,2.16mmol)于dmf(5ml)中,氮气下100℃微波搅拌2h,加水,乙酸乙酯提取。无水硫酸钠干燥,浓缩至干得到油状物,直接用于下一步反应。
[0887]
ms m/z(esi):598.2[m h]
.
[0888]
第七步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0889][0890]
(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(上一步反应所得)溶于甲醇(5ml),加4m hcl/1,4
‑
二氧六环(5ml)室温搅拌1h,浓缩至干,柱层析纯化得到目标产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(8.7mg,收率8%)。
[0891]1h nmr(400mhz,methanol
‑
d4)δ7.69(d,j=5.4hz,1h),7.58(s,1h),7.42
–
7.32(m,1h),7.28
–
7.14(m,3h),5.97(d,j=5.5hz,1h),4.35
–
4.16(m,6h),3.96(s,1h),3.28
–
3.19(m,2h),3.15(d,j=15.7hz,1h),2.81(d,j=15.7hz,1h),2.32(q,j=7.5hz,2h),1.80(dtd,j=32.3,12.6,4.3hz,2h),1.58(d,j=13.4hz,1h),1.42(d,j=13.4hz,1h),1.31(d,j=16.2hz,1h).
[0892]
ms m/z(esi):494.1[m h]
.
[0893]
实施例11
[0894]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0895][0896]
第一步:3
‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯的制备
[0897][0898]
将3
‑
((2,3
‑
二氯吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯(200mg,0.55mmol),吗啉(96mg,1.10mmol)和1,4
‑
二氧六环(5ml)于120℃下微波搅拌8h。浓缩至干,加水,二氯甲烷提取。浓缩至干,柱层析(石油醚/乙酸乙酯=3:1)得到产物(152mg,产率67%)。
[0899]
ms m/z(esi):415.2[m h]
.
[0900]
第二步:3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
硫醇钾的制备
[0901][0902]3‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)丙酸(2
‑
乙基)己酯(100mg,0.24mmol),叔丁醇钾(27mg,0.24mmol)于无水乙醇(5ml)中室温搅拌1h。浓缩至干得到产物,直接用于下一步反应。
[0903]
ms m/z(esi):231.0[m h]
.
[0904]
第三步:6
‑
氯
‑3‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
胺的制备
[0905][0906]
将3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
硫醇钾(上一步所得)、3
‑
溴
‑6‑
氯吡嗪
‑2‑
胺(60mg,0.29mmol)、pd2(dba)3(11mg,0.012mmol)、xantphos(14mg,0.024mmol)和二异丙基乙胺(62mg,0.48mmol)于5ml二氧六环中,氮气下100℃搅拌过夜。冷至室温,浓缩至干,柱层析(石油醚/乙酸乙酯=1:1)纯化得到浅黄色固体(60mg,产率70%)。
[0907]
ms m/z(esi):358.0[m h]
.
[0908]
第四步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[0909][0910]
将6
‑
氯
‑3‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
胺(60mg,0.22mmol)、(r)
‑
n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(76mg,0.25mmol)、碳酸钾(231mg,1.67mmol)溶于dmf(5ml)中,氮气下100℃微波搅拌2h,加水,乙酸乙酯提取。无
水硫酸钠干燥,浓缩至干得到油状物,直接用于下一步反应。
[0911]
ms m/z(esi):628.2[m h]
.
[0912]
第五步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0913][0914]
(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(上一步反应所得)溶于甲醇(5ml),加4m hcl/1,4
‑
二氧六环(5ml),室温搅拌1h,浓缩至干,柱层析纯化得到目标产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(6mg,2步收率5%)。
[0915]
ms m/z(esi):524.1[m h]
.
[0916]
实施例12
[0917]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(3,3
‑
二氟吖丁啶
‑1‑
基)吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0918][0919]
实施例12的制备方法参考实施例11实验方案。
[0920]
ms m/z(esi):530.1[m h]
,532.1[m 2 h]
.
[0921]
实施例13
[0922]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(吡咯烷
‑1‑
基)吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0923][0924]
实施例13的制备方法参考实施例11实验方案。
[0925]
ms m/z(esi):508.1[m h]
,510.1[m 2 h]
.
[0926]
实施例14
[0927]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0928][0929]
实施例14的制备方法参考实施例11实验方案。
[0930]
ms m/z(esi):508.1[m h]
,510.1[m 2 h]
.
[0931]
实施例15
[0932]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑1‑
甲基
‑
4,6
‑
二氢
‑
1h
‑
螺[环戊二烯并[d]咪唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0933][0934]
实施例15的制备方法参考实施例11实验方案。
[0935]
ms m/z(esi):498.1[m h]
,500.1[m 2 h]
.
[0936]
实施例16
[0937]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
(吖丁啶
‑1‑
基)
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
甲基
‑
2,6
‑
二氢
‑
4h
‑
螺[环戊二烯并[c]吡唑
‑
5,4'
‑
哌啶]
‑4‑
胺的制备
[0938][0939]
实施例16的制备方法参考实施例11实验方案。
[0940]
ms m/z(esi):498.1[m h]
,500.1[m 2 h]
.
[0941]
实施例17
[0942]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0943][0944]
实施例17的制备方法参考实施例6实验方案。
[0945]
ms m/z(esi):538.1[m h]
,540.1[m 2 h]
.
[0946]
实施例18
[0947]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(吡咯烷
‑1‑
基)吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[0948][0949]
实施例18的制备方法参考实施例6实验方案。
[0950]
ms m/z(esi):522.1[m h]
,524.1[m 2 h]
.
[0951]
实施例19
[0952]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(吡咯烷
‑1‑
基)吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0953][0954]
实施例19的制备方法参考实施例6实验方案。
[0955]
ms m/z(esi):529.1[m h]
,531.1[m 2 h]
.
[0956]
实施例20
[0957]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(吡咯烷
‑1‑
基)吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0958][0959]
实施例20的制备方法参考实施例6实验方案。
[0960]
ms m/z(esi):513.1[m h]
,515.1[m 2 h]
.
[0961]
实施例21
[0962]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(吡咯烷
‑1‑
基)吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑1‑
甲基
‑
4,6
‑
二氢
‑
1h
‑
螺[环戊二烯并[d]咪唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0963][0964]
实施例21的制备方法参考实施例6实验方案。
[0965]
ms m/z(esi):526.1[m h]
,528.1[m 2 h]
.
[0966]
实施例22
[0967]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
(吡咯烷
‑1‑
基)吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
甲基
‑
2,6
‑
二氢
‑
4h
‑
螺[环戊二烯并[c]吡唑
‑
5,4'
‑
哌啶]
‑4‑
胺的制备
[0968][0969]
实施例22的制备方法参考实施例6实验方案。
[0970]
ms m/z(esi):526.1[m h]
,528.1[m 2 h]
.
[0971]
实施例23
[0972]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0973][0974]
实施例23的制备方法参考实施例6实验方案。
[0975]
ms m/z(esi):529.1[m h]
,531.1[m 2 h]
.
[0976]
实施例24
[0977]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
吗啉代吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
甲基
‑
2,6
‑
二氢
‑
4h
‑
螺[环戊二烯并[c]吡唑
‑
5,4'
‑
哌啶]
‑4‑
胺的制备
[0978][0979]
实施例24的制备方法参考实施例6实验方案。
[0980]
ms m/z(esi):542.1[m h]
,544.1[m 2 h]
.
[0981]
实施例25
[0982]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0983][0984]
实施例25的制备方法参考实施例6实验方案。
[0985]
ms m/z(esi):484.1[m h]
,486.1[m 2 h]
.
[0986]
实施例26
[0987]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0988][0989]
实施例26的制备方法参考实施例1实验方案。
[0990]
ms m/z(esi):470.1[m h]
,472.1[m 2 h]
.
[0991]
实施例27
[0992]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0993][0994]
实施例27的制备方法参考实施例1实验方案。
[0995]
ms m/z(esi):436.1[m h]
.
[0996]
实施例28
[0997]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
环丙基
‑3‑
甲基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[0998][0999]
实施例28的制备方法参考实施例1实验方案。
[1000]
ms m/z(esi):450.1[m h]
.
[1001]
实施例29
[1002]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
环丙基
‑3‑
氟吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[1003][1004]
实施例29的制备方法参考实施例1实验方案。
[1005]
ms m/z(esi):454.1[m h]
.
[1006]
实施例30
[1007]
(s)
‑1‑
(4
‑
((3
‑
氨基
‑5‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)吡嗪
‑2‑
基)硫代)
‑3‑
氯吡啶
‑2‑
基)吖丁啶
‑2‑
酮的制备
[1008][1009]
实施例30的制备方法参考实施例1实验方案。
[1010]
ms m/z(esi):508.1[m h]
,510.1[m 2 h]
.
[1011]
实施例31
[1012]
(s)
‑1‑
(4
‑
((3
‑
氨基
‑5‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)吡嗪
‑2‑
基)硫代)
‑3‑
氯吡啶
‑2‑
基)吡咯烷
‑2‑
酮的制备
[1013][1014]
实施例31的制备方法参考实施例1实验方案。
[1015]
ms m/z(esi):522.1[m h]
,524.1[m 2 h]
.
[1016]
实施例32
[1017]
(s)
‑1‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
环丙基吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1018][1019]
第一步:(s)
‑1‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
环丙基吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1020][1021]
0℃下,往(s)
‑3‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
(2
‑
环丙基吡啶
‑4‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯(50mg,0.10mmol)的thf(10ml)溶液里滴加乙基溴化镁(0.1ml,0.30mmol,3m)和钛酸四异丙酯(43mg,0.15mmol),升至室温搅拌5小时。用饱和nh4cl水溶液淬灭反应,用二氯甲烷(3*20ml)萃取,无水硫酸钠干燥,浓缩有机相,制备hplc纯化得到(s)
‑1‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
环丙基吡啶
‑4‑
基)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇(5mg,产率10%)白色固体。
[1022]
ms m/z(esi):500.1[m h]
.
[1023]
实施例33
[1024]
(s)
‑1‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1025]
[1026]
实施例33的制备方法参考实施例32实验方案。
[1027]
ms m/z(esi):534.1[m h]
,536.1[m 2 h]
.
[1028]
实施例34
[1029]
(s)
‑1‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1030][1031]
实施例34的制备方法参考实施例32实验方案。
[1032]
ms m/z(esi):509.1[m h]
,511.1[m 2 h]
.
[1033]
实施例35
[1034]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺制备
[1035][1036]
第一步:叔
‑
丁基4
‑
烯丙基
‑4‑
甲酰基哌啶
‑1‑
羧酸酯的制备
[1037][1038]
在0℃下,往叔
‑
丁基4
‑
甲酰基哌啶
‑1‑
羧酸酯(30g,14.1mmol)的n,n
‑
二甲基甲酰胺(300ml)中加叔丁醇锂(13.5g,16.9mmol),加完搅拌30分钟,再加烯丙基溴(19g,16.2mmol),加完0℃搅拌2小时。把反应液倒入氯化铵水溶液(1l)里,用乙酸乙酯萃取(1l
×
2),乙酸乙酯层用饱和氯化钠水溶液(500ml)洗涤,无水硫酸钠干燥后柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到2%]纯化得到无色油状产物叔
‑
丁基4
‑
烯丙基
‑4‑
甲酰基哌啶
‑1‑
羧酸酯(15g,产率42%)。
[1039]
第二步:叔
‑
丁基4
‑
烯丙基
‑4‑
(1
‑
羟基烯丙基)哌啶
‑1‑
羧酸酯的制备
[1040][1041]
在
‑
78℃下,往叔
‑
丁基4
‑
烯丙基
‑4‑
甲酰基哌啶
‑1‑
羧酸酯(25g,99mmol)的四氢呋喃(300ml)溶液中滴加乙烯基氯化镁(65ml,123.5mmol),加完慢慢升至室温搅拌30分钟。把反应液倒入氯化铵水溶液(1l)里,用乙酸乙酯萃取(1l
×
2),乙酸乙酯层用饱和氯化钠水溶液(500ml)洗涤,无水硫酸钠干燥后柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到5%]纯化得到无色油状产物叔
‑
丁基4
‑
烯丙基
‑4‑
(1
‑
羟基烯丙基)哌啶
‑1‑
羧酸酯(25g,产率90%)。
[1042]
第三步:叔
‑
丁基4
‑
丙烯酰
‑4‑
烯丙基哌啶
‑1‑
羧酸酯的制备
[1043][1044]
在0℃下往叔
‑
丁基4
‑
烯丙基
‑4‑
(1
‑
羟基烯丙基)哌啶
‑1‑
羧酸酯(25g,89mmol)的二氯甲烷(400ml)溶液里加戴斯马丁试剂(41.5g,98mmol),加完40℃搅拌1小时。把反应液慢慢倒入碳酸氢钠/亚硫酸钠水溶液(1/1,1l)里,用二氯甲烷萃取(1l
×
2),二氯甲烷层用饱和氯化钠水溶液(500ml)洗涤,无水硫酸钠干燥后旋干,再加正庚烷(200ml),搅拌5分钟,过滤掉不溶物,浓缩滤液得到无色油状产物叔
‑
丁基4
‑
丙烯酰
‑4‑
烯丙基哌啶
‑1‑
羧酸酯(24.8g,产率100%),快速投下一步。
[1045]
第四步:叔
‑
丁基1
‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯的制备
[1046][1047]
叔
‑
丁基4
‑
丙烯酰
‑4‑
烯丙基哌啶
‑1‑
羧酸酯(24.8g,89mmol)和二氯(邻异丙氧基苯基亚甲基)(三环己基膦)钌(ii)(1.2g,1.4mmol)在甲苯(700ml)中90℃搅拌2小时。待反应液冷却后,浓缩反应液,柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到20%]纯化得到红黑色固体产物叔
‑
丁基1
‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(13g,产率58%)。
[1048]
ms m/z(esi):252.1[m h]
.
[1049]
第五步:叔
‑
丁基2
‑
溴
‑1‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯的制备
[1050][1051]
往叔
‑
丁基1
‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(13g,51.8 51.8mmol)的乙腈(300ml)溶液里加吡啶氮氧化物(11g,116mmol),再加n
‑
溴代丁二酰亚胺(28g,157mmol),加完80℃搅拌18小时。待反应液冷却后,浓缩反应液,柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到20%]纯化得到黄色固体产物叔
‑
丁基2
‑
溴
‑1‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(4.2g,产率25%)。
[1052]
ms m/z(esi):330.1[m h]
,332.1[m 2 h]
.
[1053]
第六步:叔
‑
丁基2
‑
环丙基
‑1‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯的制备
[1054][1055]
叔
‑
丁基2
‑
溴
‑1‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(4.2g,12.8mmol),环丙基三氟硼酸钾(3.79g,25.6mmol),碳酸铯(12.5g,38.4mmol)和[1,1'
‑
双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(731mg,0.9mmol)在二氧六环(100ml)和水(10ml)中100℃搅拌18小时。往反应液里加水淬灭(150ml),用乙酸乙酯(150ml
×
2)萃取,乙酸乙酯层用饱和氯化钠水溶液(50ml)洗涤,无水硫酸钠干燥后柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到12%]纯化得到黄色油状产物叔
‑
丁基2
‑
环丙基
‑1‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(1g,产率27%)。
[1056]
ms m/z(esi):292.2[m h]
[1057]
第七步:叔
‑
丁基(r,z)
‑1‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯的制备
[1058][1059]
叔
‑
丁基2
‑
环丙基
‑1‑
羰基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(1g,3.4mmol)和(r)
‑
( )
‑
叔丁基亚磺酰胺(2g,17.2mmol)在钛酸四乙酯(30ml)中100℃搅拌18小时。冷却后,往反应液里加乙酸乙酯(100ml),再倒入水(150ml)中,有大量白色固体析出,通过硅藻土过滤,分液,有机相旋干,柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到50%]纯化得到黄色油状产物叔
‑
丁基(r,z)
‑1‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(190mg,产率14%)。
[1060]
ms m/z(esi):395.2[m h]
.
[1061]
第八步:叔
‑
丁基(s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯的制备
[1062][1063]
‑
78℃往叔
‑
丁基(r,z)
‑1‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(210mg,0.53mmol)的四氢呋喃(10ml)滴加二异丁基氢化铝(0.9ml,1mmol),加完搅拌15分钟。在
‑
78℃用十水硫酸钠淬灭反应,搅拌10分钟,过滤反应液,把滤液浓缩后柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到5%]纯化得到无色油状产物叔
‑
丁基(s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(105mg,产率50%)。
[1064]
ms m/z(esi):397.2[m h]
.
[1065]
第九步:(s)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1066][1067]
往叔
‑
丁基(s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
羧酸酯(105mg,0.27mmol)的甲醇(3ml)溶液里加盐酸二氧六环(15ml,60mmol),加完室温搅拌1小时。旋干反应液得到白色固体产物(s)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺(105mg,产率100%)。
[1068]
ms m/z(esi):193.2[m h]
.
[1069]
第十步:(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1070][1071]3‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(76mg,0.26mmol),(s)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺(80mg,0.2mmol)和碳酸钾(167mg,1.2mmol)在n,n
‑
二甲基甲酰胺(8ml)中100℃搅拌7小时。往反应液里加水(60ml),用乙酸乙酯(50ml
×
2)萃取,乙酸乙酯层用饱和氯化钠水溶液(20ml)洗涤,无水硫酸钠干燥后爬板[洗脱剂:二氯甲烷/甲醇=7/1]纯化得到黄色油状产物(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺(37mg,产率41%)。
[1072]1h nmr(400mhz,meod)δ7.67
–
7.51(m,2h),5.92(d,j=8hz,1h),5.27(s,1h),4.26
–
4.04(m,2h),3.33(s,1h),3.27
–
3.08(m,2h),2.44
–
2.18(m,2h),1.81
–
1.69(m,1h),1.68
–
1.47(m,2h),1.42
–
1.24(m,2h),0.81
–
0.60(m,2h),0.57
–
0.28(m,2h).
[1073]
ms m/z(esi):444.1[m h]
,446.1[m 2 h]
.
[1074]
实施例36
[1075]
(s)
‑8‑
(5
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1076][1077]
第一步:3
‑
氯
‑4‑
((5
‑
氯吡嗪
‑2‑
基)硫代)吡啶
‑2‑
胺的制备
[1078][1079]2‑
氨基
‑3‑
氯吡啶
‑4‑
硫醇酸钾(1g,2.64mmol),2
‑
溴
‑5‑
氯吡嗪(597mg,3.11mmol),三(二亚苄基丙酮)二钯(284mg,0.311mmol)、氯[(4,5
‑
双(二苯基膦)
‑
9,9
‑
二甲基氧杂蒽)
‑2‑
(2
‑
氨基联苯)]钯(ii)(360mg,0.622mmol)以及n,n
‑
二异丙基乙胺(1.2g,9.33mmol)在n,n
‑
二甲基甲酰胺(10ml)中90℃微波搅拌1小时,旋干后柱层析[洗脱剂:石油醚~乙酸乙酯/石油醚从0%到30%]纯化得到白色固体产物3
‑
氯
‑4‑
((5
‑
氯吡嗪
‑2‑
基)硫代)吡啶
‑2‑
胺(250mg,产率35%)。
[1080]
ms m/z(esi):273.0[m h]
,275.0[m 2 h]
。
[1081]
第二步:(s)
‑8‑
(5
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1082][1083]3‑
氯
‑4‑
((5
‑
氯吡嗪
‑2‑
基)硫代)吡啶
‑2‑
胺(100mg,0.368mmol),(s)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺盐酸盐(105mg,0.265mmol)和碳酸钾(254mg,1.84mmol)在n,n
‑
二甲基甲酰胺(8ml)中100℃搅拌6小时。往反应液加水(40ml),用乙酸乙酯(40ml*2)萃
取,浓缩有机相,薄层层析纯化(二氯甲烷/甲醇=10/1)得到黄色固体产物(s)
‑8‑
(5
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺(40mg,产率35%)。
[1084]1h nmr(400mhz,meod)δ8.29(d,j=16hz,2h),7.60(d,j=4hz,1h),5.93(d,j=4hz,1h),5.31(s,1h),4.34
–
4.14(m,2h),3.43
–
3.35(m,2h),3.28
–
3.21(m,1h),2.45
–
2.21(m,2h),1.86
–
1.49(m,3h),1.44
–
1.22(m,2h),0.82
–
0.61(m,2h),0.58
–
0.30(m,2h).
[1085]
ms m/z(esi):429.1[m h]
,431.1[m 2 h]
.
[1086]
实施例37
[1087]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
甲基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1088][1089]
实施例37的制备方法参考实施例6实验方案。
[1090]
ms m/z(esi):432.1[m h]
,434.1[m 2 h]
.
[1091]
实施例38
[1092]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
乙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1093][1094]
实施例38的制备方法参考实施例6实验方案。
[1095]
ms m/z(esi):446.1[m h]
,448.1[m 2 h]
.
[1096]
实施例39
[1097]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
异丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1098][1099]
实施例39的制备方法参考实施例6实验方案。
[1100]
ms m/z(esi):460.1[m h]
,462.1[m 2 h]
.
[1101]
实施例40
[1102]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
环丙
基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1103][1104]
实施例40的制备方法参考实施例6实验方案。
[1105]
ms m/z(esi):458.1[m h]
,460.1[m 2 h]
.
[1106]
实施例41
[1107]
(s)
‑1‑
(6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(6
‑
氨基
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1108][1109]
实施例41的制备方法参考实施例32实验方案。
[1110]
ms m/z(esi):500.1[m h]
,502.1[m 2 h]
.
[1111]
实施例42
[1112]
(r)
‑1‑
(6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(1
‑
氨基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
基)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1113][1114]
实施例42的制备方法参考实施例32实验方案。
[1115]
ms m/z(esi):459.1[m h]
,461.1[m 2 h]
.
[1116]
实施例43
[1117]
(s)
‑1‑
(3
‑
(1
‑
氨基
‑2‑
甲基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1118][1119]
实施例43的制备方法参考实施例32实验方案。
[1120]
ms m/z(esi):473.1[m h]
,475.1[m 2 h]
.
[1121]
实施例44
[1122]
(s)
‑1‑
(3
‑
(1
‑
氨基
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)环丙烷
‑1‑
醇的制备
[1123][1124]
实施例44的制备方法参考实施例32实验方案。
[1125]
ms m/z(esi):499.1[m h]
,501.1[m 2 h]
.
[1126]
实施例45
[1127]
(s)
‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)甲醇制备
[1128][1129]
第一步:2
‑
乙基己基3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸酯的制备
[1130][1131]3‑
氯
‑4‑
碘吡啶
‑2‑
胺(3g,11.8mmol),2
‑
乙基己基3
‑
巯基丙酸酯(2.9g,14.2mmol),醋酸鈀(132mg,0.59mmol),4,5
‑
双(二苯基膦)
‑
9,9
‑
二甲基氧杂蒽(683mg,1.18mmol)和n,n
‑
二异丙基乙胺(561mg,4.3mmol)在二氧六环(80ml)中100℃搅拌18小时。过滤反应液,浓缩滤液后柱层析[洗脱剂:石油醚~石油醚/乙酸乙酯60:40)]纯化得到2
‑
乙基己基3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸酯淡黄色固体(3.8g,产率94%)。
[1132]
ms m/z(esi):345.1[m h]
,347.0[m 2 h]
.
[1133]
第二步:2
‑
氨基
‑3‑
氯吡啶
‑4‑
硫醇钾的制备
[1134][1135]
往2
‑
乙基己基3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)丙酸酯(500mg,1.5mmol)的乙醇(30ml)溶液中加叔丁醇钾(174mg,1.53mmol),加完40℃搅拌2小时。浓缩反应液得到2
‑
氨基
‑3‑
氯吡啶
‑4‑
硫醇钾(500mg)黄色固体,粗品直接投下一步。
[1136]
ms m/z(esi):161.0[m h]
,163.0[m 2 h]
.
[1137]
第三步:乙基6
‑
溴
‑3‑
((s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯的制备
[1138][1139]6‑
溴
‑3‑
氯
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯(840mg,3mmol),(s)
‑
n
‑
(1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)特戊酰茚二酮酰胺三氟乙酸盐(1.5g,3.6mmol)和碳酸钾(1.7g,12mmol)在乙腈(40ml)中55℃搅拌18小时。过滤反应液,浓缩滤液后柱层析[洗脱剂:石油醚~石油醚/乙酸乙酯60:40)]纯化得到6
‑
溴
‑3‑
((s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯黄色固体(1.5g,产率91%)。
[1140]
ms m/z(esi):549.2[m h]
,551.2[m 2 h]
.
[1141]
第四步:6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯的制备
[1142]6‑
溴
‑3‑
((s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯(798mg,1.45mmol),2
‑
氨基
‑3‑
氯吡啶
‑4‑
硫醇钾(500mg,1.45mmol,粗品),三(二亚苄基丙酮)二钯(66mg,0.073mmol),4,5
‑
双(二苯基膦)
‑
9,9
‑
二甲基氧杂蒽(84mg,0.145mmol)和n,n
‑
二异丙基乙胺(561mg,4.35mmol)在n,n
‑
二甲基甲酰胺(15ml)中100℃微波搅拌1.5小时。过滤反应液,滤液浓缩后柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(98.5:1.5)]纯化得到6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯黄色固体(500mg,产率55%)。
[1143]
ms m/z(esi):629.1[m h]
,631.1[m 2 h]
.
[1144]
第五步:(r)
‑
n
‑
((s)
‑
1'
‑
(5
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(羟甲基)
‑6‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[1145][1146]
0℃往6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑1‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸乙酯(500mg,0.795mmol)的四氢呋喃(30ml)溶液里滴加四氢锂铝(0.7ml,2.5m),0℃搅拌30分钟。用十水硫酸钠淬灭反应,搅拌10分钟。通过硅藻土过滤,滤饼用四氢呋喃(50ml)洗两遍,浓缩滤液,
柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(95:5)]纯化得到(r)
‑
n
‑
((s)
‑
1'
‑
(5
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(羟甲基)
‑6‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺黄色固体(220mg,产率47%)。
[1147]
ms m/z(esi):587.1[m h]
,589.1[m 2 h]
.
[1148]
第六步:(s)
‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)甲醇的制备
[1149][1150]
往(r)
‑
n
‑
((s)
‑
1'
‑
(5
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(羟甲基)
‑6‑
甲基吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(220mg,0.375mmol)的甲醇(3ml)溶液里加盐酸二氧六环(20ml,4.0m),室温搅拌30分钟。浓缩反应液,再加甲醇(10ml)溶解,氨水调碱,旋干后柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇(1%nh3
‑
h2o)(95:5)]纯化得到(s)
‑
(3
‑
(1
‑
氨基
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑
1'
‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)甲醇(115mg,产率63%)白色固体。
[1151]1h nmr(400mhz,meod)δ7.59(d,j=4hz,1h),7.41
–
7.34(m,1h),7.27
–
7.16(m,3h),5.89(d,j=4hz,1h),4.64(s,2h),4.00(s,1h),3.88(d,j=12hz,2h),3.28
–
3.20(m,2h),3.14(d,j=16hz,1h),2.82(d,j=16hz,1h),2.48(s,3h),2.01
–
1.85(m,2h),1.67
–
1.58(m,1h),1.52
–
1.43(m,1h).
[1152]
ms m/z(esi):483.2[m h]
,485.2[m 2 h]
.
[1153]
实施例46
[1154]
(s)
‑
(6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(6
‑
氨基
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
基)甲醇的制备
[1155][1156]
第一步:乙基6
‑
溴
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯的制备
[1157][1158]
将(r)
‑
n
‑
((s)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙
烷
‑2‑
亚磺酰胺(470mg,1.5mmol,1.0eq),乙基6
‑
溴
‑3‑
氯
‑5‑
甲基吡嗪
‑2‑
羧酸酯(398mg,1.43mmol,0.95eq)和碳酸钾(1.04g,7.5mmol,5.0eq)溶于dmf(4.0ml)中。氮气保护下,加热到60℃,搅拌反应3小时。反应结束,浓缩除去dmf,粗品柱层析纯化(100%etoac in petro ether),得到黄色固体产物乙基6
‑
溴
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯(600mg,产率72%)。
[1159]
ms m/z(esi):556.1[m h]
,558.1[m h 2]
.
[1160]
第二步:乙基6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯的制备
[1161][1162]
将乙基6
‑
溴
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯(600mg,1.08mmol,1.0eq),2
‑
氨基
‑3‑
氯吡啶
‑4‑
硫醇酸钾(536mg,2.70mmol,2.5eq)溶于10ml dmf,置于微波反应管中,加入三(二亚苄基丙酮)二钯(50mg,0.054mmol,0.05eq)、xantphos(62mg,0.11mmol,0.1eq)以及dipea(419mg,3.24mmol,3.0eq),氮气鼓泡3分钟。将反应液微波加热至105℃反应75min;待反应液冷却至室温后,用20ml乙酸乙酯稀释,用硅藻土过滤后,浓缩,粗品柱层析纯化(10%meoh in ch2cl2),得黄色固体产物乙基6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯(360mg,产率52%)。
[1163]
ms m/z(esi):636.0[m h]
,638.0[m h 2]
.
[1164]
第三步:乙基6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯的制备
[1165][1166]
将乙基6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯(360mg,0.57mmol,1.0eq)溶于40ml无水thf,氮气置换保护下。冷却到0℃,滴加lialh4的四氢呋喃溶液(0.6ml,1.14mmol,2.0eq.,d=2m)。滴加完毕,缓慢升到室温搅拌3小时。反应结束,将反应液用乙酸乙酯(100ml)稀释,冷却到0℃,滴加2ml水,加入4ml 15%氢氧化钠水溶液,然后再加入6ml水,升到室温搅拌30分钟,加入适量无水硫酸钠,搅拌15分钟,过滤除去固体,滤液浓缩,粗品柱层析纯化(10%meoh in ch2cl2),得到黄色固体产物乙基6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯(150mg,产率44%)。
[1167]
ms m/z(esi):594.1[m h]
,596.1[m h 2]
.
[1168]
第四步:(s)
‑
(6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(6
‑
氨基
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
基)甲醇的制备
[1169][1170]
将乙基6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
((s)
‑6‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
羧酸酯(150mg,0.25mmol,1.0eq)溶于meoh(5ml),加入盐酸的二氧六环溶液(1.0ml,4m),于室温反应1小时。将反应液浓缩至干,用5ml甲醇溶解后,用7m nh3的甲醇溶液调节ph至碱性,浓缩反应液,先用正相柱纯化(10%meoh in ch2cl2),然后用反相柱纯化(30%mecn in h2o(0.1%nh3.h2o)),得灰色固体目标化合物(s)
‑
(6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(6
‑
氨基
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
基)甲醇(52mg,产率42%)。
[1171]1h nmr(400mhz,dmso)δ8.93(s,1h),7.62(s,1h),6.31(s,1h),5.72(s,1h),5.41(s,1h),4.45(s,2h),3.98(s,1h),3.84(s,2h),2.76(dd,j=47.2,16.9hz,4h),2.37(s,3h),1.60(dd,j=165.2,116.4hz,7h).
[1172]
ms m/z(esi):490.1[m h]
,492.1[m h 2]
.
[1173]
实施例47
[1174]
(s)
‑
(6
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
(6
‑
氨基
‑
4,6
‑
二氢螺[环戊二烯并[d]噁唑
‑
5,4'
‑
哌啶]
‑
1'
‑
基)
‑5‑
甲基吡嗪
‑2‑
基)甲醇的制备
[1175][1176]
实施例47的制备方法参考实施例46实验方案。
[1177]
ms m/z(esi):474.1[m h]
,476.1[m 2 h]
.
[1178]
实施例48
[1179]
(r)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
亚甲基
‑8‑
氮杂螺[4.5]癸烷
‑1‑
胺的制备
[1180][1181]
实施例48的制备方法参考实施例1实验方案。
[1182]
ms m/z(esi):418.1[m h]
,420.1[m 2 h]
.
[1183]
实施例49
[1184]
(s,e)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
亚乙基
‑8‑
氮杂螺[4.5]癸烷
‑1‑
胺的制备
[1185][1186]
实施例49的制备方法参考实施例1实验方案。
[1187]
ms m/z(esi):432.1[m h]
,434.1[m 2 h]
.
[1188]
实施例50
[1189]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
(丙烷
‑2‑
亚基)
‑8‑
氮杂螺[4.5]癸烷
‑1‑
胺的制备
[1190][1191]
实施例50的制备方法参考实施例1实验方案。
[1192]
ms m/z(esi):446.1[m h]
,448.1[m 2 h]
.
[1193]
实施例51
[1194]
(s,e)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
亚乙基
‑8‑
氮杂螺[4.5]癸烷
‑1‑
胺的制备
[1195][1196]
实施例51的制备方法参考实施例6实验方案。
[1197]
ms m/z(esi):446.1[m h]
,448.1[m 2 h]
.
[1198]
实施例52
[1199]
(r)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
甲基吡嗪
‑2‑
基)
‑2‑
亚甲
基
‑8‑
氮杂螺[4.5]癸烷
‑1‑
胺的制备
[1200][1201]
实施例52的制备方法参考实施例6实验方案。
[1202]
ms m/z(esi):432.1[m h]
,434.1[m 2 h]
.
[1203]
实施例53
[1204]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[1205][1206]
第一步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[1207][1208]3‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(200mg,0.694mmol),(r)
‑
n
‑
((s)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(350mg,0.833mmol,[α]
20d
=1.773)和碳酸钾(479mg,3.47mmol)在n,n
‑
二甲基甲酰胺(7ml)中100℃搅拌8小时。待反应液冷却后,加入40ml水,用乙酸乙酯萃取(40ml
×
2);乙酸乙酯层用饱和氯化钠水溶液(20ml)洗涤,无水硫酸钠干燥后柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇从0%到3%]纯化得到橘黄色固体产物(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(200mg,产率52%)。
[1209]
ms m/z(esi):558.2[m h]
。
[1210]
第二步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[1211][1212]
往(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(188mg,0.337mmol)的甲醇(5ml)溶液里加盐酸二氧六环溶液(20ml,80mmol),室温搅拌1小时。将反应液浓缩至干,用5ml甲
醇溶解后,氨水调节ph至碱性,浓缩后柱层析[洗脱剂:二氯甲烷~二氯甲烷/甲醇从0%到7.5%]纯化得到白色固体产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(130mg,产率85%)。
[1213]
ms m/z(esi):454.2[m h]
。
[1214]
第三步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[1215][1216]
在
‑
10℃下往(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(100mg,0.22mmol)的乙腈(10ml)溶液里加n
‑
氟代双苯磺酰胺(69mg,0.22mmol),加完慢慢升至室温,搅拌7小时。旋干反应液,薄层层析(二氯甲烷/甲醇=10/1)纯化得到土黄色固体产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺(28mg,产率27%)。
[1217]1h nmr(400mhz,meod)δ7.62(d,j=4hz,1h),7.42
–
7.33(m,1h),7.26
–
7.15(m,3h),6.00(d,j=4hz,1h),4.67
–
4.54(m,2h),4.30(d,j=16hz,2h),3.97(s,1h),3.16(d,j=16hz,1h),2.82(d,j=16hz,1h),1.95
–
1.78(m,2h),1.65
–
1.53(m,1h),1.48
–
1.38(m,1h).
[1218]
ms m/z(esi):472.1[m h]
,474.1[m 2 h]
.
[1219]
[α]
20d
=
‑
36.893.
[1220]
实施例54
[1221]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺
[1222][1223]
第一步:3
‑
溴
‑2‑
(氯甲基)吡啶的制备
[1224][1225]
将(3
‑
溴吡啶
‑2‑
基)甲醇(7.5g,40mmol)溶于二氯甲烷(20ml)中,反应液均匀混合后,在冰浴条件下滴加socl2(9.5g,80mmol),搅拌1小时。反应液减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到无色液体目标化合物3
‑
溴
‑2‑
(氯甲基)吡啶(5g,产率:61%)。
[1226]
ms m/z(esi):205.9[m h]
.
[1227]
第二步:1
‑
(叔
‑
丁基)4
‑
甲基4
‑
((3
‑
溴吡啶
‑2‑
基)甲基)哌啶
‑
1,4
‑
二羧酸酯的制备
[1228][1229]
将1
‑
(叔
‑
丁基)4
‑
甲基哌啶
‑
1,4
‑
二羧酸酯(7.7g,31.7mmol)、lda(18.3ml,36.6mmol)加入thf(20ml)中,反应液在
‑
60℃条件下反应1小时,3
‑
溴
‑2‑
(氯甲基)吡啶(5g,24.4mmol)加入反应液中,温度不变条件下继续反应2小时,减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到淡黄色固体目标化合物1
‑
(叔
‑
丁基)4
‑
甲基4
‑
((3
‑
溴吡啶
‑2‑
基)甲基)哌啶
‑
1,4
‑
二羧酸酯(9g,产率:89%)。
[1230]
ms m/z(esi):413.0[m h]
.
[1231]
第三步:叔
‑
丁基5
‑
羰基
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯的制备
[1232][1233]
向1
‑
(叔
‑
丁基)4
‑
甲基4
‑
((3
‑
溴吡啶
‑2‑
基)甲基)哌啶
‑
1,4
‑
二羧酸酯(9g,21.84mmol)中加入thf(100ml),反应液温度降至
‑
78℃后,缓慢将正丁基锂溶液(1.6n,17ml)滴入反应液中,在
‑
78℃下继续反应1小时,加入氯化铵水溶液淬灭,乙酸乙酯萃取,有机相用无水硫酸钠干燥,过滤,减压浓缩。所得粗品用快速硅胶柱层析分离纯化得到淡黄色固体目标化合物叔
‑
丁基5
‑
羰基
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯(3g,产率:45%)。
[1234]
ms m/z(esi):303.1[m h]
.
[1235]
第四步:叔
‑
丁基(r,z)
‑5‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯的制备
[1236][1237]
将叔
‑
丁基5
‑
羰基
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯(3g,9.93mmol),(r)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(3.6g,29.8mmol)加入钛酸乙酯(50ml)中,反应液搅拌均匀,在110℃条件下反应13小时,反应温度降至常温,缓慢滴加水(100ml),有固体产生,再加入乙酸乙酯(200ml),过滤,有机相减压浓缩,所得目标化合物叔
‑
丁基(r,z)
‑5‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯(3g,产率:75%),直接用于下一步反应。
[1238]
ms m/z(esi):406.1[m h]
.
[1239]
第五步:叔
‑
丁基(s)
‑5‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
5,7
‑
二氢螺[戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯的制备
[1240][1241]
将叔
‑
丁基(r,z)
‑5‑
((叔
‑
丁基亚硫酰基<亚磺酰>)亚氨基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯(3g,7.41mmol)加入thf(40ml)中,在温度降至0℃条件下,向反应液中缓慢滴加bh3(7.5ml,2n in thf),滴加完毕后,保持温度,反应2小时。向反应液滴加甲醇(10ml)。减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到淡黄色固体目标化合物叔
‑
丁基(s)
‑5‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
5,7
‑
二氢螺[戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯(2.5g,产率83%)。
[1242]
ms m/z(esi):408.1[m h]
.
[1243]
第六步:(s)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺的制备
[1244][1245]
将叔
‑
丁基(s)
‑5‑
(((r)
‑
叔
‑
丁基亚硫酰基<亚磺酰>)氨基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑
1'
‑
羧酸酯(2.5g,6.14mmol)、盐酸二氧六环(10ml,4n)加入ch2cl2(40ml)中,反应液在室温下,搅拌3小时,减压浓缩,所得目标化合物(s)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺(1.5g),直接用于下一步反应。
[1246]
ms m/z(esi):204.1[m h]
.
[1247]
第七步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺的制备
[1248][1249]
将(s)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺(1.5g,7.39mmol)、3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
溴吡嗪
‑2‑
胺(3.7g,11.09mmol)、碳酸铯(7.2g,22.17mmol)加入dmf(50ml)中,在90℃条件下,反应13小时。反应液减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到淡黄色固体目标化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺(1g,产率29%)。
[1250]
ms m/z(esi):455.1[m h]
,457.1[m h 2]
.
[1251]
第八步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺的制备
[1252][1253]
将(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺(600mg,1.32mmol)、nfsi(830mg,2.64mmol)加入thf(10ml)中。反应液在室温反应3小时,减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到白色固体目标化合物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
5,7
‑
二氢螺[环戊二烯并[b]吡啶
‑
6,4'
‑
哌啶]
‑5‑
胺(90mg,产率14%)。
[1254]
ms m/z(esi):473.0[m h]
,475.1[m h 2]
.
[1255]1h nmr(400mhz,meoh
‑
d4)δ8.33(d,j=4.8hz,1h),7.82(d,j=7.2hz,1h),7.62(d,j=5.6hz,1h),7.28
‑
7.25(m,1h),6.01(d,j=5.6hz,1h),4.35
‑
4.31(m,2h),4.03(s,1h),3.36
‑
3.31(m,2h),3.25
‑
3.21(m,1h),2.92(d,j=16.8hz,1h),1.98
‑
1.84(m,2h),1.64
‑
1.60(m,1h),1.42
‑
1.39(m,1h).
[1256]
实施例55
[1257]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[1258][1259]
第一步:(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺的制备
[1260][1261]
将(r)
‑
n
‑
((s)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(260mg,0.83mmol,1.0eq),3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺(227mg,0.79mmol,0.95eq)和碳酸钾(574mg,4.15mmol,5.0eq)溶于dmf(2ml)中。氮气保护下,加热到105℃,搅拌反应10小时。反应结束,浓缩除去dmf,粗品柱层析(8%meoh in ch2cl2),得到黄色固体产物(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(340mg,产率76%)。
[1262]
ms m/z(esi):565.1[m h]
,567.1[m h 2]
。
[1263]
第二步:((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[1264][1265]
将(r)
‑
n
‑
((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((3
‑
氯
‑2‑
环丙基吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
基)
‑2‑
甲基丙烷
‑2‑
亚磺酰胺(340mg,0.60mmol,1.0eq)溶于meoh(5ml),加入hcl的二氧六环溶液(1.0ml,4m),于室温反应1小时。将反应液浓缩至干,用5ml甲醇溶解后,用7m nh3的甲醇溶液调节ph至碱性,浓缩反应液,先用正相柱纯化(10%meoh in ch2cl2),然后用反相柱纯化(40%mecn in h2o(0.1%nh3.h2o),得到灰色固体目标化合物((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺(220mg,产率80%)。
[1266]
ms m/z(esi):461.1[m h]
,463.1[m h 2]
。
[1267]
第三步:(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺的制备
[1268][1269]
将((s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺(220mg,0.48mmol,1.0eq)溶于无水dmf(2ml)和无水mecn(10ml)中,氮气置换三次,氮气保护下分批加入试剂n
‑
氟
‑
n
‑
(苯磺酰)苯磺酰胺(159mg,0.5mmol,1.05eq.)。加料完毕,室温搅拌3小时,反应液滴加到搅拌的meoh(50ml)中,后加入1ml水。将反应液浓缩,得到粗品,用制备hplc纯化得到灰色固体产物(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
4,6
‑
二氢螺[环戊二烯并[d]噻唑
‑
5,4'
‑
哌啶]
‑6‑
胺(40mg,产率17%)。
[1270]1h nmr(400mhz,dmso)δ8.96(s,1h),7.67(d,j=5.3hz,1h),6.28(s,2h),6.17(s,2h),5.86(d,j=5.4hz,1h),4.10(s,2h),3.98(s,1h),2.81(dd,j=52.7,15.2hz,4h),1.88(s,2h),1.75
–
1.52(m,4h).
[1271]
19
f nmr(376mhz,dmso)δ
‑
88.17(s).
[1272]
ms m/z(esi):479.0[m h]
,481.0[m h 2]
.
[1273]
实施例56
[1274]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1275]
[1276]
第一步:(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1277][1278]
在25℃下,往(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺(35mg,0.085mmol)的四氢呋喃(18ml)溶液里加n
‑
氟代双苯磺酰胺(40mg,0.128mmol),加完搅拌1小时。tlc显示没反应完,补加n
‑
氟代双苯磺酰胺(27mg,0.085mmol),加完继续搅拌1小时。tlc显示没反应完,再补加n
‑
氟代双苯磺酰胺(27mg,0.085mmol),搅拌1小时。tlc显示有杂质出现,反应液用盐酸(40ml,0.5n)萃灭,用乙酸乙酯(20ml*2)洗涤,水相用碳酸钠调节至ph约为8,乙酸乙酯(30ml*2)萃取,旋干有机相,制备色谱(二氯甲烷/甲醇=10/1)纯化得到浅黄色固体(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺(28mg,产率:27%)。
[1279]1h nmr(400mhz,meod)δ7.61(d,j=8hz,1h),5.99(d,j=8hz,1h),5.36(s,1h),4.31
–
4.13(m,2h),3.45(s,1h),3.30
–
3.15(m,2h),2.43
–
2.24(m,2h),1.89
–
1.48(m,5h),0.84
–
0.65(m,2h),0.57
–
0.36(m,2h).
[1280]
ms m/z(esi):462.1[m h]
,474.1[m 2 h]
.
[1281]
实施例57
[1282]
(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑2‑
甲基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺的制备
[1283][1284]
实施例57的制备方法参考实施例53实验方案。
[1285]
ms m/z(esi):436.1[m h]
,438.1[m 2 h]
.
[1286]
实施例58
[1287]
(s)
‑
(3
‑
(1
‑
氨基
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑8‑
基)
‑6‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑5‑
甲基吡嗪
‑2‑
基)甲醇的制备
[1288][1289]
实施例58的制备方法参考实施例45实验方案。
[1290]
ms m/z(esi):473.1[m h]
,475.1[m 2 h]
.
[1291]
实施例59
[1292]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的制备
[1293][1294]
实施例59的制备方法参考实施例53实验方案。
[1295]1h nmr(400mhz,meod)δ7.66
–
7.54(m,2h),7.42
–
7.33(m,1h),7.29
–
7.16(m,3h),5.93(d,j=5.5hz,1h),4.37
–
4.19(m,2h),3.98(s,1h),3.29
–
3.20(m,2h),3.15(d,j=16hz,1h),2.83(d,j=16hz,1h),1.91
–
1.68(m,2h),1.65
–
1.53(m,1h),1.50
–
1.39(m,1h).
[1296]
ms m/z(esi):454.1[m h]
,456.1[m 2 h]
.
[1297]
二、化合物生物学测试评价
[1298]
以下结合测试例进一步描述解释本发明,但这些实施例并非意味着限制本发明的范围。
[1299]
测试例1、本发明化合物对shp
‑
2激酶活性抑制作用的测定
[1300]
实验目的:
[1301]
本测试的目的是测量化合物对shp
‑
2全长蛋白变构活性的抑制能力。
[1302]
实验仪器:离心机(5810r)购自eppendorf公司,移液器购自eppendorf或rainin公司,酶标仪购自美国biotek公司,型号为synergyh1全功能酶标仪。
[1303]
实验方法:使用homogeneous full length shp
‑
2assay kit(bps bioscience,#79330)进行体外shp
‑
2活性检测。首先在96孔低吸附微孔板(nunc,#267342)中加入18μl的master mix,即在终浓度为1
×
的反应缓冲液中包含0.5μm的shp
‑
2activating peptide和5mm的dtt,离心后再加入每孔5μl的待测化合物/dmso(终dmso含量为1%,v/v,将待测化合物在dmso中溶解成1mm,进行三倍系列稀释,10个浓度,反应体系终浓度范围从1μm至0.05nm),将shp
‑
2在1
×
的反应缓冲液中稀释至终浓度为0.06nm后,加入反应微孔板中,每孔2μl,在反应板上设置全活性对照(化合物只加dmso)和全抑制对照(不加shp
‑
2)离心后在室温下孵育该反应混合物60分钟。
[1304]
孵育结束后,加入每孔25μl的substrate solution,包含终浓度为10μm的substrate和5mm的dtt,离心后室温继续孵育30分钟。反应结束后,在synergy h1全功能酶标仪(biotek)酶标仪上设置激发波长340nm,发射波长455nm,增益值75进行读数。
[1305]
实验数据处理方法:
[1306]
根据全活性对照和全抑制对照作为max和min的数值,通过反应板上阳性对照孔(dmso对照孔)和阴性对照孔(不添加激酶)计算使用化合物处理的孔的百分比抑制比率数据{%抑制率=100
‑
[(测试化合物
‑
min平均值)/(max平均值
‑
min平均值)]
×
100}。使用graphpad prism拟合百分比抑制率和十点浓度数据至4参数非线性逻辑公式计算出测试化合物的ic
50
值。
[1307]
实验结论:
[1308]
通过以上方案得出本发明所示的实施例化合物在shp
‑
2激酶活性试验中显示出如下表2.1的生物活性,
[1309]
表2.1:化合物对shp
‑
2激酶活性抑制相对ic
50
值
[1310][1311]
以上数据显示,本发明所示的实施例化合物在shp
‑
2激酶活性抑制方面具有良好的活性。
[1312]
测试例2、本发明化合物对kyse520细胞增殖抑制活性的测定
[1313]
该测试例的目的是为了测定本发明中的化合物对肿瘤细胞增殖活性的抑制作用。化合物对肿瘤细胞增殖抑制活性通过celltiter
‑
glo的方法进行测定,并得出化合物抑制细胞增殖活性的半数抑制浓度ic
50
。在96孔细胞培养板(corning,#3610)中每孔接种2000个细胞,90μl的细胞悬液,将培养板于培养箱培养过夜(37℃,5%co2)。次日向培养板细胞中加入梯度稀释的待测化合物溶液(终dmso含量为0.1%,v/v,反应体系终浓度范围从100μm至45nm),每孔10μl。同时在反应板上设置全活性对照(化合物只加dmso)和全抑制对照(不加细胞),将培养板在培养箱孵育3天(37℃,5%co2)。
[1314]
孵育结束后在细胞培养板中每孔加入50μl celltiter
‑
glo试剂,室温静置10分钟。于synergy h1全功能酶标仪(biotek)酶标仪上读取化学发光信号值。根据全活性对照
和全抑制对照作为max和min的数值,计算使用化合物处理的孔的百分比抑制比率数据{%抑制率=100
‑
[(测试化合物
‑
min平均值)/(max平均值
‑
min平均值)]
×
100}。使用graphpad prism拟合百分比抑制率和8点浓度数据至4参数非线性逻辑公式计算出测试化合物的ic
50
值。
[1315]
通过以上方案得出:本发明所示的化合物在kyse520细胞增殖抑制活性试验中显示出约0.1nm至200nm(ic
50
)的生物活性。
[1316]
在一些实施方案中,本发明的化合物对于kyse520细胞增殖抑制活性的ic
50
小于约200nm、优选化合物小于约100nm、进一步优选小于约10nm、更优选小于约1nm,本发明所列示的化合物中最优选小于1nm。
[1317]
测试例3、本发明化合物对nci
‑
h358细胞增殖抑制活性的测定
[1318]
实验目的:该测试例的目的是为了测定本发明中的化合物对肿瘤细胞增殖活性的抑制作用。
[1319]
实验仪器:离心机(5810r)购自eppendorf公司,二氧化碳培养箱购自thermo公司,生物安全柜购自上海博讯公司,移液器购自eppendorf或rainin公司,酶标仪购自美国biotek公司,型号为synergyh1全功能酶标仪。
[1320]
实验方法:在96孔细胞培养板(corning,#3610)中每孔接种3000个细胞,90μl的细胞悬液,将培养板于培养箱培养过夜(37℃,5%co2)。次日向培养板细胞中加入梯度稀释的待测化合物溶液(终dmso含量为0.2%,v/v,反应体系终浓度范围从10μm至4.5nm),每孔10μl。同时在反应板上设置全活性对照(化合物只加dmso)和全抑制对照(不加细胞),将培养板在培养箱孵育3天(37℃,5%co2)。
[1321]
孵育结束后在细胞培养板中每孔加入50μl celltiter
‑
glo试剂,室温静置10分钟。于synergy h1全功能酶标仪(biotek)酶标仪上读取化学发光信号值。根据全活性对照和全抑制对照作为max和min的数值,计算使用化合物处理的孔的百分比抑制比率数据{%抑制率=100
‑
[(测试化合物
‑
min平均值)/(max平均值
‑
min平均值)]
×
100}。使用graphpad prism拟合百分比抑制率和8点浓度数据至4参数非线性逻辑公式计算出测试化合物的ic
50
值。
[1322]
实验数据处理方法:
[1323]
通过于板上溶媒对照孔计算使用实施例化合物处理的孔的百分比抑制数据{%抑制率=100
‑
(测试化合物值/溶媒对照值)
×
100}。使用graphpad prism拟合不同浓度和相应百分比抑制率数据至4参数非线性逻辑公式计算出ic
50
值。
[1324]
实验结论:
[1325]
通过以上方案得出本发明所示的实施例化合物对nci
‑
h358细胞的增殖抑制的活性试验中显示出如下表2.2的生物活性。
[1326]
表2.2:化合物对nci
‑
h358细胞增殖抑制活性的ic
50
值
[1327][1328]
以上数据显示,本发明所示的实施例化合物在nci
‑
h358细胞增殖抑制活性方面具有良好的活性。
[1329]
测试例4、小鼠药代动力学测定
[1330]
4.1.研究目的:
[1331]
以balb/c小鼠为受试动物,研究化合物实施例36、实施例46、实施例53、实施例54和实施例55,口服给药在小鼠体内(血浆)的药代动力学行为。
[1332]
4.2.试验方案
[1333]
4.2.1试验药品:
[1334]
本发明实施例36、实施例46、实施例53、实施例54和实施例55,自制;
[1335]
4.2.2试验动物:
[1336]
balb/c小鼠,雄性,购自上海杰思捷实验动物有限公司,动物生产许可证号(scxk(沪)2013
‑
0006n0.311620400001794)。
[1337]
4.2.3药物配制:
[1338]
称取5g羟乙基纤维素(hec,cmc
‑
na,粘度:800
‑
1200cps),溶于1000ml纯净水,加入10g tween80。混合均匀成澄清溶液。
[1339]
称取1.2mg实施例36、实施例46、实施例53、实施例54和实施例55,分别加入4
‑
ml玻璃瓶,加入2.4ml该溶液,超声10分钟,得到无色澄清溶液,浓度为0.5mg/ml。
[1340]
4.2.4给药:
[1341]
balb/c小鼠,雄性;禁食一夜后分别口服给药,剂量为5mg/kg,给药体积10ml/kg。
[1342]
4.2.5样品采集:
[1343]
于给药前和给药后0.25h、0.5h、1h、2h、4h、6h、8h、24h采血,血液置于edta
‑
2k试管中,4℃6000rpm离心6min分离血浆,于负80℃保存;给药后4h进食。
[1344]
4.2.6测定结果:
[1345]
应用lcms/ms方法得到最后测定结果见表2.3
[1346]
表2.3:化合物的小鼠药代动力学参数
[1347][1348]
以上数据显示:5mg/kg剂量下,本发明实施例化合物显示出良好的代谢活性。
[1349]
测试例5、大鼠药代动力学测定
[1350]
5.1.研究目的:
[1351]
以sd大鼠为受试动物,研究实施例36、实施例46、实施例53、实施例54、实施例55和实施例59,口服给药在大鼠体内(血浆)的药代动力学行为。
[1352]
5.2.试验方案
[1353]
5.2.1试验药品:
[1354]
本发明实施例36、实施例46、实施例53、实施例54、实施例55和实施例59,自制。
[1355]
5.2.2试验动物:
[1356]
sd大鼠每组3只,雄性。上海杰思捷实验动物有限公司,动物生产许可证号(scxk(沪)2013
‑
0006n0.311620400001794)。
[1357]
5.2.3药物配制:
[1358]
称取5g羟乙基纤维素(hec,cmc
‑
na,粘度:800
‑
1200cps),溶于1000ml纯净水,加入10g tween80。混合均匀成澄清溶液。
[1359]
称取3.9mg实施例36、实施例46、实施例53、实施例54、实施例55和实施例59,分别溶于该溶液中,摇匀,超声15分钟,得到无色澄清溶液,浓度为0.5mg/ml。
[1360]
5.2.4给药:
[1361]
sd大鼠每组3只,雄性,禁食一夜后分别口服给药,剂量为5mg/kg,给药体积10ml/kg。
[1362]
5.2.5样品采集:
[1363]
于给药前和给药后0.5h,1.0h,2.0h,4.0h,6.0h,8.0h,24.0h颈静脉采血0.2ml,置于edta
‑
2k试管中,4℃6000rpm离心6min分离血浆,于
‑
80℃保存;给药后4h进食。
[1364]
5.3实验结果:应用lcms/ms方法得到最后测定结果,见表2.4
[1365]
表2.4:本发明化合物的大鼠药代动力学参数
[1366][1367]
实验结论:表中数据显示,在口服给药剂量为5mg/kg时,本发明的实施例化合物在大鼠血浆中都达到相对较高的暴露量;另外,实施例59在大鼠药代动力学实验中观察到肛周污染,说明实施例59有胃肠道毒性。
[1368]
测试例6、miapaca 2移植瘤模型上对肿瘤的抑制实验
[1369]
6.1实验目的:
[1370]
以balb/c裸小鼠为受试动物,采用人胰腺癌细胞miapaca 2异种移植瘤(cdx)模型进行体内药效实验,评价受试化合物抗肿瘤作用。
[1371]
6.2实验仪器与试剂:
[1372]
6.2.1仪器:
[1373]
超净工作台(bsc
‑
1300ii a2,上海博讯实业有限公司医疗设备厂)
[1374]
co2培养箱(thermo
‑
311,thermo)
[1375]
离心机(centrifuge 5720r,eppendorf)
[1376]
全自动细胞计数仪(countess ii,life technologies)
[1377]
移液器(10
‑
20μl,eppendorf)
[1378]
显微镜(ts 2,尼康)
[1379]
游标卡尺(cd
‑
6”ax,日本三丰)
[1380]
细胞培养瓶(t25/t75/t225,corning)
[1381]
恒温水槽(hws12,上海一恒科学)
[1382]
6.2.2试剂:
[1383]
dmem(11995
‑
065,gibco)
[1384]
胎牛血清(fbs)(10091
‑
148,gibco)
[1385]
0.25%胰蛋白酶(25200
‑
056,gibco)
[1386]
青链霉素双抗(p/s)(sv30010,ge)
[1387]
磷酸盐缓冲液(pbs)(10010
‑
023,gibco)
[1388]
matrigel(356234,corning)
[1389]
gln(25030
‑
081,gibco)
[1390]
6.3实验操作:
[1391]
从细胞库中取出miapaca 2细胞,复苏后加入dmem培养基(含10%fbs、1%glu、1%p/s)置于co2培养箱中培养(培养箱温度为37℃,co2浓度为5%)。待细胞铺满培养瓶底部80
‑
90%后传代,传代后细胞继续置于co2培养箱中培养。重复该过程直到细胞数满足体内药效接种需求量,开始收集对数生长期的细胞,用全自动细胞计数仪计数,根据计数结果用pbs和matrigel(体积比为1:1)重悬细胞,制成细胞悬液(密度8
×
107/ml),置于冰盒中待用。
[1392]
使用动物为balb/c裸小鼠,雌性,6
‑
8周龄,体重约为18
‑
22克。将小鼠保持在一个无特殊病原体的环境中,且在单个通风笼中,每笼5只小鼠。所有的笼子、垫料和水在使用前进行消毒,所有动物可以自由获取标准认证的商业实验室饮食。实验开始前用一次性大小鼠通用耳标标记裸鼠,接种前用75%医用酒精消毒接种部位皮肤,每只小鼠在右后背皮下接种0.1ml(含8*106个细胞)miapaca2肿瘤细胞。当平均肿瘤体积达到100
‑
200mm3时开始分组给药。受试化合物每日经口灌胃给药,给药剂量、给药频次及实验结束时各组药效情况见表5。每周两次用游标卡尺测量肿瘤体积(mm3),计算公式为:v=0.5*d*d*d,其中d和d分别是肿瘤的长径和短径。抗肿瘤药效是通过化合物处理过的动物的平均肿瘤增加体积除以未处理过动物的平均肿瘤增加体积来确定。抑瘤率计算公式为:tgi(%)=1
‑
[(vt
‑
v0)给药组/(vt
‑
v0)溶剂对照组]*100%。实验结束后将所有动物安乐死。
[1393]
6.4实验结果:
[1394]
表2.5:化合物的移植瘤小鼠药效参数
[1395][1396]
注:括号中的数据表示,该实施例对应vehicle qd x 3w组(即对照组)在相应时间(即分别为0天和21天)的肿瘤体积
[1397]
实验结论:以上数据显示,口服连续给药21天后,本发明实施例化合物在3
‑
10mg/kg qd给药条件下都能显著抑制miapaca 2裸小鼠移植瘤生长。
[1398]
测试例7、荷瘤小鼠药代动力学测定
[1399]
7.1.研究目的:
[1400]
以miapaca 2荷瘤小鼠为受试动物,研究化合物实施例化合物53在6mg/kg剂量下口服给药在小鼠体内(血浆,肿瘤组织和肠道)的药代动力学行为。
[1401]
7.2.试验方案
[1402]
7.2.1试验药品:
[1403]
本发明实施例化合物53,自制。
[1404]
7.2.2试验动物:
[1405]
miapaca 2荷瘤小鼠24只,雌性。每个时间点3只(0h、1h、2h、4h、6h、8h、16h、24h)。上海西普尔
‑
必凯实验动物有限公司,动物生产许可证号(scxk(沪)2018
‑
0006。
[1406]
7.2.3药物配制:
[1407]
称取5g羟甲基纤维素,溶于1000ml纯净水,加入10g tween80。混合均匀成澄清溶液。
[1408]
称取4.57mg实施例化合物53,22.6mg溶于该溶液中,摇匀,超声15分钟,得到均匀混悬液,浓度为0.6mg/ml。
[1409]
7.2.4给药:
[1410]
miapaca 2荷瘤小鼠禁食后分别按体重p.o.(0h点动物不给药),剂量为6mg/kg,给药体积10ml/kg。
[1411]
7.2.5样品采集:
[1412]
小鼠给药前和给药后,co2处死,心脏采血0.5ml,置于edta
‑
2k试管中,4℃ 6000rpm离心6min分离血浆,于
‑
80℃保存;肿瘤组织称重后,置于2ml离心管中,于
‑
80℃保存。十二指肠、回肠、结肠组织取适量长度用剪刀剪开,去除内容物并用pbs清洗2遍,用吸水纸吸干水分后称重,置于2ml离心管中,于
‑
80℃保存。
[1413]
7.3实验结果:应用lcms/ms方法得到最后测定结果,见表2.6:
[1414]
表2.6:本发明化合物的小鼠药代动力学参数
[1415][1416]
实验结论:如表中数据所显示,6mg/kg剂量下,本发明实施例化合物在小鼠肿瘤里的暴露量达到很高的水平,在肿瘤里的暴露量明显高于血液里。而从tmax和mrt可以看出来,化合物在肿瘤里的浓度是一个逐渐增加的过程,而且t1/2更长,说明化合物会逐渐蓄积在肿瘤里,并一直在肿瘤里保持较高的浓度,从而保证更好的抑瘤效果。
[1417]
测试例8、herg钾离子通道抑制活性测试
[1418]
8.1细胞准备
[1419]
8.1.1cho
‑
herg细胞培养于175cm2培养瓶中,待细胞密度生长到60~80%,移走培养液,用7ml pbs洗一遍,然后加入3ml detachin消化。
[1420]
8.1.2待消化完全后加入7ml培养液中和,然后离心,吸走上清液,再加入5ml培养液重悬,以确保细胞密度为2~5
×
106/ml。
[1421]
8.2溶液配制
[1422]
表2.7:细胞内液和外液的组成成分
[1423][1424]
8.3电生理记录过程
[1425]
单细胞高阻抗封接和全细胞模式形成过程全部由qpatch仪器自动完成,在获得全细胞记录模式后,细胞钳制在
‑
80毫伏,在给予一个5秒的 40毫伏去极化刺激前,先给予一个50毫秒的
‑
50毫伏前置电压,然后复极化到
‑
50毫伏维持5秒,再回到
‑
80毫伏。每15秒施加此电压刺激,记录2分钟后给予细胞外液记录5分钟,然后开始给药过程,化合物浓度从最低测试浓度开始,每个测试浓度给予2.5分钟,连续给完所有浓度后,给予阳性对照化合物3m cisapride。每个浓度至少测试3个细胞(n≥3)。
[1426]
8.4化合物准备
[1427]
8.4.1将20mm的化合物母液用细胞外液进行稀释,取5μl 20mm的化合物母液加入2495μl细胞外液,500倍稀释至40μm,然后在含0.2%dmso的细胞外液中依次进行3倍连续稀释得到需要测试的最终浓度。
[1428]
8.4.2最高测试浓度为40μm,依次分别为40,13.33,4.44,1.48,0.49,0.16μm共6个浓度。
[1429]
8.4.3最终测试浓度中的dmso含量不超过0.2%,此浓度的dmso对herg钾通道没有影响。
[1430]
8.5数据分析
[1431]
实验数据由xlfit软件进行分析。
[1432]
8.6质量控制
[1433]
环境:湿度20~50%,温度22~25℃
[1434]
试剂:所用实验试剂购买于sigma公司,纯度>98%
[1435]
报告中的实验数据必须满足以下标准:
[1436]
全细胞封接阻抗>100mω
[1437]
尾电流幅度>400pa
[1438]
药理学参数:
[1439]
多浓度cisapride对herg通道的抑制效应设为阳性对照。
[1440]
8.7实验结果
[1441]
实施例化合物在多浓度对herg电流的抑制结果:
[1442]
表2.8:实施例在多浓度对herg电流的抑制结果
[1443]
实施例编号herg(um)实施例65.24
实施例356.17实施例362.34实施例4618.78实施例534.51实施例5521.91
[1444]
实验结论:药物对于心脏herg钾离子通道的抑制是药物导致qt延长综合症的主要原因。从实验结果可以看出,本发明实施例化合物对于心脏herg钾离子通道没有明显抑制作用,可以避免高剂量时的心脏毒副作用。
[1445]
测试例9、小鼠药代动力学测定
[1446]
9.1.研究目的:
[1447]
以balb/c mouse为受试动物,研究化合物实施例53和实施例59,单次静脉注射给药在mouse体内(血浆)的药代动力学行为。
[1448]
9.2.试验方案
[1449]
9.2.1试验药品:
[1450]
本发明实施例53和实施例59,自制;
[1451]
9.2.2试验动物:
[1452]
balb/c小鼠,雄性,购自上海杰思捷实验动物有限公司,动物生产许可证号(scxk(沪)2013
‑
0006n0.311620400001794)。
[1453]
9.2.3药物配制:
[1454]
含10%solutol hs15水溶液:取solutol hs15 10g,加入注射用纯化水,搅拌使溶解后,用注射用纯化水稀释至100ml,摇匀,即得;
[1455]
含20%hp
‑
β
‑
cd水溶液:取hp
‑
β
‑
cd 20g,加入注射用纯化水,搅拌使溶解后,用注射用纯化水稀释至100ml,摇匀,即得;
[1456]
混合0.5ml的dmso,8.5ml的20%hp
‑
β
‑
cd水溶液和1ml的10%solutol hs15水溶液,摇匀,得澄清溶液。
[1457]
称取0.234mg实施例53和实施例59,加入1.17ml的该溶液,超声使溶解,得澄清溶液,用0.22μm的水系滤器过滤,取滤液为iv给药制剂。浓度为0.2mg/ml。
[1458]
9.2.4给药:
[1459]
balb/c mouse,雄性;禁食一夜后分别静脉注射给药,剂量为1mg/kg,给药体积5ml/kg。
[1460]
9.2.5样品采集:
[1461]
于给药前和给药后0min,5min,15min,0.5h,1.0h,2.0h,4.0h,8.0h,24.0h采血,血液置于edta
‑
2k试管中,4℃6000rpm离心6min分离血浆,于负80℃保存;给药后4h进食。
[1462]
9.3实验结果:应用lcms/ms方法得到最后测定结果见表2.9
[1463]
表2.9:化合物的小鼠药代动力学参数
[1464][1465]
实验结论:1mg/kg剂量下,本发明实施例化合物在小鼠体内显示出良好的代谢特征。
[1466]
测试例10、大鼠药代动力学测定
[1467]
10.1.研究目的:
[1468]
以sd大鼠为受试动物,研究实施例53和实施例59,单次静脉注射给药在大鼠体内(血浆)的药代动力学行为。
[1469]
10.2.试验方案
[1470]
10.2.1试验药品:
[1471]
本发明实施例53和实施例59,自制。
[1472]
10.2.2试验动物:
[1473]
sd大鼠每组3只,雄性。上海杰思捷实验动物有限公司,动物生产许可证号(scxk(沪)2013
‑
0006n0.311620400001794)。
[1474]
10.2.3药物配制:
[1475]
含10%solutol hs15水溶液:取solutol hs15 10g,加入注射用纯化水,搅拌使溶解后,用注射用纯化水稀释至100ml,摇匀,即得;
[1476]
含20%hp
‑
β
‑
cd水溶液:取hp
‑
β
‑
cd 20g,加入注射用纯化水,搅拌使溶解后,用注射用纯化水稀释至100ml,摇匀,即得;
[1477]
混合0.5ml的dmso,8.5ml的20%hp
‑
β
‑
cd水溶液和1ml的10%solutol hs15水溶液,摇匀,得澄清溶液。
[1478]
称取0.78mg实施例53和实施例59,加入3.9ml的该溶液,超声使溶解,得澄清溶液,用0.22μm的水系滤器过滤,取滤液为iv给药制剂。浓度为0.2mg/ml。
[1479]
10.2.4给药:
[1480]
sd大鼠每组3只,雄性,禁食一夜后分别静脉注射给药,剂量为1mg/kg,给药体积5ml/kg。
[1481]
10.2.5样品采集:
[1482]
于给药前和给药后0min,5min,15min,0.5h,1.0h,2.0h,4.0h,8.0h,24.0h颈静脉采血0.2ml,置于edta
‑
2k试管中,4℃ 6000rpm离心6min分离血浆,于
‑
80℃保存;给药后4h进食。
[1483]
10.3实验结果:应用lcms/ms方法得到最后测定结果,见表2.10
[1484]
表2.10:本发明化合物的大鼠药代动力学参数
[1485]
[1486]
实验结论:1mg/kg剂量下,本发明实施例化合物在大鼠体内显示出良好的代谢特征。
[1487]
测试例11、小鼠耐受性测定
[1488]
11.1.研究目的:
[1489]
以balb/c小鼠为受试动物,研究化合物实施例53和实施例59,口服给药在雌雄小鼠中的耐受性。
[1490]
11.2.试验方案
[1491]
11.2.1试验药品:
[1492]
本发明实施例53和实施例59,自制;
[1493]
11.2.2试验动物:
[1494]
balb/c小鼠,雄性9只,雌性9只,购自上海杰思捷实验动物有限公司,动物生产许可证号(scxk(沪)2013
‑
0006n0.311620400001794)。
[1495]
11.2.3药物配制:
[1496]
称取5g羟乙基纤维素(hec,cmc
‑
na,粘度:800
‑
1200cps),溶于1000ml纯净水,加入10g tween80。混合均匀成澄清溶液。
[1497]
称取41.0mg实施例53和25.9mg实施例59,分别加入100
‑
ml玻璃瓶,加入41.0ml和25.9ml该溶液,超声10分钟,得到无色澄清溶液,浓度为1mg/ml。
[1498]
11.2.4给药:
[1499]
balb/c小鼠,雄性3只,雌性3只;禁食一夜后分别口服给药,剂量为10mg/kg,给药体积10ml/kg。
[1500]
11.2.5数据收集:
[1501]
于给药前和给药后每天称量小鼠体重,观察异常反应;给药后4h进食。
[1502]
11.2.6测定结果:
[1503]
应用天平称量得到最后结果见表2.11。
[1504]
表2.11:小鼠体重变化对比
[1505][1506]
实验结论:以上数据显示,10mg/kg剂量下,本发明实施例化合物显示出良好的小鼠耐受性,而实施例59表现出稀便,便血,体重明显下降等特征,耐受性较差。
[1507]
总之,本发明提供了一系列具有新颖结构的高活性,高选择性shp2激酶抑制剂;在大鼠和小鼠上都显示出很好的药代动力学性质,在miapaca2荷瘤小鼠模型上也体现出了良好的药效;有很大的潜力被开发成针对肿瘤类疾病的单药或联合用药类药物。
[1508]
三、(s)
‑8‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺盐型及晶型研究
[1509]
1.1实验仪器
[1510]
1.1.1物理化学检测仪器的一些参数
[1511]
[1512][1513]
1.2仪器和液相分析条件
[1514]
1.2.1仪器与设备
[1515]
仪器名称型号分析天平sartorius bsa224s
‑
cw纯水机milli
‑
q plus,millipore高效液相色谱仪agilent1260泵agilent g1311b进样器g1329b柱温箱g1316a检测器g1315d
[1516]
1.2.2色谱条件
[1517]
色谱柱:bonus
‑
rp,3.5μm,4.6*75mm
[1518]
流速:1ml/min
[1519]
柱温:40℃
[1520]
检测波长:275nm
[1521]
进样体积:5.0μl
[1522]
运行时间:15min
[1523]
稀释剂:acn
‑
水(v/v,1:1)
[1524]
流动相:a:水(0.05%三氟乙酸);b:乙腈(0.05%三氟乙酸)
[1525]
t(min)a(%)b(%)0.0095510.00604013.00208012.01901015.009010
[1526]
1.2.3色谱条件
[1527]
色谱柱:waters xbridge c18(4.6mm*150mm,3.5μm)
[1528]
流速:1ml/min
[1529]
柱温:40℃
[1530]
检测波长:275nm
[1531]
进样体积:5.0μl
[1532]
运行时间:30min
[1533]
稀释剂:dmso
[1534]
流动相:a:水(0.05%三氟乙酸);b:乙腈(0.05%三氟乙酸)
[1535]
t(min)a(%)b(%)0.00901015.00703025.00307025.01901030.009010
[1536]
2.化合物式(v)自由碱不同晶型的制备
[1537]
⑴
晶型a的制备
[1538]
将5g(s)
‑2‑
环丙基
‑8‑
氮杂螺[4.5]癸
‑2‑
烯
‑1‑
胺盐酸盐加入到75ml nmp,氮气保护,调整温度20
‑
30℃;加入3.17g nahco3,搅拌10min;加入4.35g 3
‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑6‑
氯吡嗪
‑2‑
胺和5.2g k2co3,氮气鼓泡30min;升温至85℃,并搅拌8h,冷却至室温,加入120ml dcm,150ml纯水;搅拌后分液,120ml dcm萃取一次;合并有机相,纯水洗5次洗去nmp,15%氯化钠水溶液洗一次,每次各180ml;加入0.75g活性碳至dcm相中,搅拌1h;过滤,用30ml thf淋洗,滤液中加入1g巯基硅胶,搅拌3h,过滤,thf 30ml淋洗,滤液浓缩至干得到9g黄色油状固体;加入30ml(ea/mtbe=1/1),加热至50℃打浆0.5h,自然降温至20℃,搅拌4h,过滤,mtbe淋洗,真空干燥得到3.6g淡黄色固体。经检测分析,其有如下如图19所示的xrpd图、如图20所示的dsc图。
[1539]
⑵
晶型b的制备
[1540]
称量约20mg的游离碱晶型a,加入0.6ml2
‑
甲基
‑
四氢呋喃于70℃下加热溶清,快速放入2℃下搅拌12h析出固体。最后固体快速离心,去除上清液,40℃真空干燥,得到晶型b。经检测分析,其有如下如图21所示的xrpd图、如图22所示的dsc图。
[1541]
⑶
晶型c的制备
[1542]
称量约20mg的游离碱晶型a到2ml的玻璃瓶中,加入200μlnmp室温搅拌溶清,然后加入0.6ml异丙醚混浊,室温搅拌12h后析出较多固体,最后固体快速离心,去除上清液,40℃真空干燥,得到晶型c。经检测分析,其有如下如图23所示的xrpd图及如图24所示的dsc图。
[1543]
3.化合物盐型晶型筛选
[1544]
3.1化合物盐型筛选
[1545]
3.1.1实验目的:
[1546]
选择不同的反离子酸,通过合适的结晶方法,检测哪些反离子酸可以形成化合物盐。
[1547]
3.1.2实验步骤:
[1548]
1)仪器和设备
[1549]
名称型号来源分析天平bsa224s
‑
cwsartorius
超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1550]
2)操作程序
[1551]
①
采用甲醇、乙醇混合溶剂自然挥干法
[1552]
称取260mg游离碱(无定型),加入3.4ml乙醇室温未完全溶清,再加入1.7ml甲醇仍未完全澄清,过滤,将过滤后的滤液均分,每份加入一定量的酸(碱:酸=1:1.2的摩尔反应比),然后室温敞口挥发溶剂,挥发后将得到的固体表征xrd,成油的样品及xrd显示结晶度差的样品各加200μlea打浆。具体如下:
[1553]
编号酸加酸后现象挥发结果打浆结果11m盐酸in etoh仍澄清成油无定型固体21m对甲苯磺酸in etoh仍澄清有固体,结晶度差结晶度差30.25m富马酸in etoh仍澄清有固体,结晶度差结晶度差41m丁二酸in meoh仍澄清有固体,样品粘,未表征结晶度差5/仍澄清有固体,结晶度好,游离碱
‑
[1554]
结果与讨论:以上实验得到无定型的盐酸盐、对甲苯磺酸盐、富马酸盐、丁二酸酸盐及游离碱的一种晶型。
[1555]
②
采用acetone为溶剂固
‑
液反应结晶
[1556]
称取10mg游离碱(无定型),加入0.1mlacetone,室温搅拌白色混悬,向混悬液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1557][1558][1559]
结果与讨论:以上实验得到盐酸盐、磷酸盐、硫酸盐及对甲苯磺酸盐。
[1560]
③
采用ea为溶剂固
‑
液反应结晶
[1561]
称取10mg游离碱(晶型a),加入0.1mlea,室温搅拌混悬,向混悬液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1562][1563]
结果与讨论:以上实验最终均得到固体,形成酸式盐。
[1564]
④
采用thf为溶剂液
‑
液反应结晶(部分较强酸盐)
[1565]
称取10mg游离碱(晶型a),加入0.1mlthf,50℃搅拌溶清,向溶液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1566][1567]
结果与讨论:以上实验得到结晶性能较好的盐酸盐、羟乙基磺酸盐、富马酸盐及几乎无定型的磷酸盐。
[1568]
⑤
采用acn为溶剂固
‑
液反应结晶
[1569]
称取10mg游离碱(晶型a),加入0.1mlacn,室温搅拌混悬,向混悬液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1570]
编号酸加酸后现象后处理结果11m盐酸in etoh反应成油,贴壁室温搅拌过夜结晶性较好21m对甲苯磺酸in etoh一些贴壁室温搅拌过夜结晶性较好31m苯磺酸in etoh快溶清,少量不溶贴壁室温搅拌过夜结晶性较好41m乙烷磺酸in etoh快溶清,少量不溶贴壁室温搅拌过夜结晶性较好
[1571]
结果与讨论:以上实验得到结晶性较好的盐酸盐、对甲苯磺酸盐、苯磺酸盐、乙烷磺酸盐。
[1572]
⑥
采用thf为溶剂液
‑
液反应结晶(部分较弱酸盐)
[1573]
称取10mg游离碱(晶型a),加入0.1mlthf,50℃搅拌溶清,向溶液中加酸(碱:酸=
1:1.2的摩尔反应比)进行反应,具体如下:
[1574]
编号酸加酸后现象后处理结果10.5m丁二酸in etoh浑浊50℃搅拌过夜结晶性能好
[1575]
结果与讨论:以上实验得到丁二酸盐且结晶性能好。
[1576]
⑦
采用etoh为溶剂固
‑
液反应结晶(部分较强酸盐)
[1577]
称取20mg游离碱(晶型a),加入0.1mletoh,室温搅拌白色混悬液,向混悬液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1578]
编号酸加酸后现象后处理结果11m盐酸in etoh仍混悬,颜色变深室温搅拌2h结晶性较好21m氢溴酸in etoh溶清后析出固体室温搅拌2h结晶性一般31m对甲苯磺酸in etoh溶清后析出固体室温搅拌2h结晶性一般
[1579]
结果与讨论:以上实验得到盐酸盐、氢溴酸盐及对甲苯磺酸盐。
[1580]
⑧
采用thf为溶剂液
‑
液反应结晶(盐酸盐及磷酸盐)
[1581]
称取20mg游离碱(晶型a),加入0.2mlthf,50℃加热搅拌溶清,向溶液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1582][1583]
结果与讨论:以上实验得到盐酸盐晶型一致。
[1584]
⑨
采用etoh为溶剂固
‑
液反应结晶(部分较弱酸盐)
[1585]
称取20mg游离碱(晶型a),加入0.1ml etoh,50℃搅拌白色混悬液,向混悬液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应,具体如下:
[1586][1587][1588]
结果与讨论:以上实验得到酒石酸盐及马来酸盐。
[1589]
3.1.3实验结果
[1590]
通过盐型筛选实验,得到有晶型的盐型为甲磺酸盐、羟乙基磺酸盐、富马酸盐、对甲苯磺酸盐、乙烷磺酸盐、丁二酸盐、氢溴酸盐、盐酸盐、马来酸盐、酒石酸盐及硫酸盐共11个盐;在盐筛选过程中均得到一种晶型,各自命名为晶型a。
[1591]
4引湿性实验
[1592]
4.1实验目的
[1593]
考察化合物不同盐在不同相对湿度条件下的引湿性,为化合物盐筛选与贮存提供依据。
[1594]
4.2实验方案:
[1595]
将化合物盐置于不同相对湿度的饱和水蒸气中,使化合物与水蒸气达到动态平衡,并计算平衡后化合物吸湿增重的百分数。
[1596]
4.3实验结果:
[1597]
4.3.1化合物式(v)盐的引湿性
[1598]
1)甲磺酸盐晶型a在rh80%条件下吸湿增重3.794%,具有引湿性。经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,甲磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1599]
2)羟乙基磺酸盐晶型a在rh80%条件下吸湿增重7.40%,具有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,羟乙基磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1600]
3)富马酸盐晶型a在rh80%条件下吸湿增重1.819%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,富马酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1601]
4)对甲苯磺酸盐晶型a在rh80%条件下吸湿增重1.482%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,对甲苯磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1602]
5)丁二酸盐晶型a在rh80%条件下吸湿增重1.429%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,丁二酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1603]
6)氢溴酸盐晶型a在rh80%条件下吸湿增重4.245%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,氢溴酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1604]
7)盐酸盐晶型a在rh80%条件下吸湿增重3.317%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,盐酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1605]
8)马来酸盐晶型a在rh80%条件下吸湿增重3.465%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,马来酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1606]
5.固体稳定性实验
[1607]
5.1实验目的:
[1608]
考察不同盐型在高温60℃、高湿rh=92.5%及高温50℃,高湿rh=75%下,化合物的物理化学稳定性,为盐型筛选与化合物盐贮存提供依据。
[1609]
5.2实验方案:
[1610]
取不同盐约2mg,于烘箱高温60℃、高湿rh=92.5%及高温50℃,高湿rh=75%,考察5天、10天,用hplc,外标法测定盐的含量,并采用色谱峰面积归一化法计算盐有关物质的变化(色谱条件为见1.2.2)。
[1611]
5.3实验结果:
[1612][1613][1614]
rrt/area%1.001.021.191.241.62盐酸盐
‑
0天64.4034.28<0.05<0.05<0.0560℃
‑
5天64.7933.730.120.060.06
60℃
‑
10天47.1951.620.110.07<0.05rh=92.5%
‑
5天65.2833.390.030.040.0550℃,rh=75%
‑
5天64.7133.950.080.080.0550℃,rh=75%
‑
10天//0.10/0.12氢溴酸盐
‑
0天64.5433.47//0.1060℃
‑
5天64.6733.56/0.040.09rh=92.5%
‑
5天64.5933.42/0.040.1050℃,rh=75%
‑
5天64.6133.62/0.150.11富马酸盐
‑
0天64.1134.060.03/0.0960℃
‑
5天63.3534.96//0.08rh=92.5%
‑
5天64.1834.230.03/0.0950℃,rh=75%
‑
5天64.3633.990.03/0.09对甲苯磺酸盐
‑
0天62.6835.75//0.0860℃
‑
5天62.7335.61//0.10rh=92.5%
‑
5天62.8435.51//0.0850℃,rh=75%
‑
5天62.7935.55//0.09
[1615]
5.4实验结论
[1616]
液相方法中采用的稀释剂会产生溶剂效应,导致主峰分叉成两个峰,通过积分,对比杂质增加情况可以看出,富马酸盐、对甲苯磺酸盐及丁二酸盐在各条件下均较稳定,无明显杂质增加。
[1617]
6.不同介质中溶解度实验
[1618]
6.1实验目的
[1619]
比较对甲苯磺酸盐晶型a、富马酸盐晶型a及丁二酸盐晶型a在不同ph值介质、水、人工模拟胃液(sgf)、禁食人工模拟肠液(fassif)及非禁食人工模拟肠液(fessif)等媒介中溶解度大小,为盐可成药性评估提供依据。
[1620]
6.2实验方案:
[1621]
将约2mg化合物混悬到不同介质中24小时,用hplc,外标法测定化合物37℃下的热力学溶解度。
[1622]
6.3实验结果:
[1623] 对甲苯磺酸盐晶型a富马酸盐晶型a丁二酸盐晶型a溶媒溶解度mg/ml溶解度mg/ml溶解度mg/mlph 1.0缓冲液>1.331
‑‑
ph 2.0缓冲液>1.24
‑‑
ph 3.0缓冲液0.495
‑‑
ph 4.0缓冲液0.385
‑‑
ph 5.0缓冲液0.203
‑‑
ph 6.0缓冲液0.724
‑‑
ph 7.0缓冲液0.525
‑‑
ph 8.0缓冲液0.069
‑‑
水0.7640.1530.214fassgf>1.812>1.888>1.803fassif0.1820.1140.118fessif0.3030.6130.641
[1624]
7.不同盐型大鼠pk研究
[1625]
7.1实验目的
[1626]
以sd大鼠为受试动物,研究对甲苯磺酸盐晶型a、富马酸盐晶型a及丁二酸盐晶型a单次口服给药在大鼠体内(血浆)的药代动力学行为,比较暴露量的变化;研究富马酸盐晶型a单次静脉给药的药代动力学,计算对甲苯磺酸盐晶型a、富马酸盐晶型a及丁二酸盐晶型a口服给药的生物利用度。
[1627]
7.2实验方案:
[1628]
对甲苯磺酸盐晶型a、富马酸盐晶型a及丁二酸盐晶型a用含0.5%的hpmc k4m的水溶液混悬均匀后,灌胃,大鼠给药,平行三只大鼠,给药剂量均为10mg/kg为混悬液);富马酸盐晶型a用含20%hp
‑
β
‑
cd的生理盐水溶液溶清,滤膜过滤后,静脉注射,大鼠给药,平行三只大鼠。
[1629]
7.3实验结果:
[1630][1631][1632]
8.固体稳定性实验
[1633]
8.1实验目的:
[1634]
考察对甲苯磺酸盐晶型a、富马酸盐晶型a及丁二酸盐晶型a在高温(60℃),室温高湿(rh=92.5%)及高温高湿(50℃,rh=75%)三个条件下稳定性对比,为盐型筛选与化合物盐贮存提供依据。
[1635]
8.2实验方案:
[1636]
取对甲苯磺酸盐晶型a、富马酸盐晶型a及丁二酸盐晶型a约2mg,于烘箱高温(60℃),室温高湿(rh=92.5%)及高温高湿(50℃,rh=75%),考察7天、14天,用hplc,外标法测定盐的含量,并采用色谱峰面积归一化法计算盐有关物质的变化(色谱条件为见1.2.3)。
[1637]
8.3实验结果:
[1638][1639][1640]
8.4实验结论:
[1641]
对甲苯磺酸盐少量杂质增加小于0.1%。
[1642]
四、(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐型及晶型研究
[1643]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的无定形形式(实施例53)放大生产
[1644]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺和thf加入反应釜,再加入n
‑
氟代双苯磺酰胺(nfsi),室温反应2小时,加入2l的0.5mol/l的盐酸溶液,再加入2l的ea搅拌萃取,分液,有机相中加入3l的0.25mol/l的盐酸溶液,再加入11l的ea搅拌萃取,分液,合并水相,舍去有机相,水相中加入1.5l*2的ea萃取除杂后,水相加入2.65l的thf,搅拌,加入碳酸钠固体调节ph=9~10,分液,水相用1.5l的2
‑
甲基四氢呋喃萃取,合并有机相,干燥、过滤、浓缩,得73.4g黄褐色固
体,固体加入四氢呋喃溶清,依次用ea:pe=20%,60%,含有0.005%三乙胺的ea,甲醇:dcm=5%(甲醇中含有5%的三乙胺)淋洗得到产品,减压浓缩缓冲液,得41.1g黄色固体,备用。
[1645]
(一)化合物盐型研究
[1646]
1.化合物盐型筛选
[1647]
1.1实验目的:
[1648]
选择不同的反离子酸,通过合适的结晶方法,检测哪些反离子酸可以形成化合物盐。
[1649]
1.2实验步骤:
[1650]
3)仪器和设备
[1651]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1652]
2)操作程序
[1653]
①
采用乙醇为溶剂自然挥干法
[1654]
称取160mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入3ml乙醇加热50℃完全溶清,将(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙醇溶液平均分成16份,每份加入一定量的酸(碱:酸=1:1.2的摩尔反应比),然后室温敞口挥发溶剂,挥发后成油,各加200μl ea打浆。分别采用盐酸、硫酸、磷酸、氢溴酸、对甲苯磺酸、甲磺酸、苯甲酸、柠檬酸、富马酸、马来酸、苹果酸、琥珀酸、酒石酸、乙烷磺酸、草酸和羟乙基磺酸成盐。
[1655]
②
采用ea为溶剂液
‑
液反应结晶
[1656]
称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml ea,室温搅拌溶清,向溶液中加酸(碱:酸=1:1.2的摩尔反应比)进行反应。采用盐酸、硫酸、磷酸、氢溴酸、对甲苯磺酸、甲磺酸、苯磺酸、柠檬酸、富马酸、马来酸、苹果酸、琥珀酸、酒石酸、乙烷磺酸、草酸和羟乙基磺酸成盐。
③
采用自然挥干法
[1657]
称取约120mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型加入2.4ml etoh,0.8ml meoh室温溶清,滤膜过滤,滤液平均分成7份,分别加入以下酸,室温敞口挥发溶剂。采用乳酸、丙二酸、苯甲酸、己二酸、马尿酸、醋酸和乙醇酸成盐。
④
采用乙腈为溶剂反应结晶称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml acn,室温搅拌未完全溶清,向体系中加酸(碱:酸=1:1.2的摩尔反应比)进行反应。采用氢溴酸、羟乙基磺酸、龙胆酸和富马酸成盐。
[1658]
2.乙烷磺酸盐溶剂残留考察
[1659]
照残留溶剂测定法(中国药典2015年版四部通则0861第三法)测定甲醇、乙醇、丙酮、二氯甲烷、叔丁基甲基醚、乙酸乙酯、四氢呋喃与2
‑
甲基四氢呋喃的溶剂残留情况,结果如下表所示,
[1660]
表4.1溶剂残留检测结果汇总
[1661][1662]
实验结论:由以上数据可知,乙烷磺酸盐各残留溶剂均符合国家药典标准规定
[1663]
4乙烷磺酸盐稳定性考察
[1664]
分别称取(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙烷磺酸盐约100mg,考察在不同条件下的稳定性,分别考察5天和10天,照高效液相色谱法(中国药典2015年版四部通则0512)测定,结果如下:
[1665]
表4.2稳定性考察结果汇总
[1666][1667]
实验结论:由以上数据可知,乙烷磺酸盐总杂方面,高温、高湿、光照条件下10天均无明显变化;单杂方面,高温条件下基本无变化,高湿条件下rrt为0.64的单杂略有降解。
[1668]
5.盐酸盐成盐含量确认
[1669]
试验方法:
[1670]
称取不同量的nacl,加入一定量的稀释剂ch3cn:h2o=1:1使其溶清,得到浓度的nacl溶液,elsd检测分析不同浓度的cl
‑
含量。将cl
‑
浓度为横坐标,elsd检测所得对应cl
‑
峰
面积为纵坐标做标曲。另外精确称量一定量的盐酸盐晶型a加入一定量的稀释剂ch3cn:h2o=1:1使其溶清,将所得溶液elsd检测分析,将所得结果根据标曲及称样量,准确算出cl
‑
含量。
[1671]
分析方法:
[1672][1673]
结果:
[1674]
经esld检测分析盐酸中游离碱与氯离子含量摩尔比为1:1,可见(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺游离碱与盐酸的成盐比可以为1:1。
[1675]
(三)化合物盐晶型研究
[1676]
1.化合物盐晶型筛选
[1677]
1.1实验目的:
[1678]
根据盐型筛选的结果,选择合适的结晶方法,筛选不同盐的不同晶型。
[1679]
1.2实验仪器
[1680]
1.2.1物理化学检测仪器的一些参数
[1681][1682]
1.3仪器和液相分析条件
[1683]
1.3.1仪器与设备
[1684]
仪器名称型号分析天平sartorius bsa224s
‑
cw纯水机milli
‑
q plus,millipore高效液相色谱仪agilent1260泵agilent g1311b进样器g1329b柱温箱g1316a检测器g1315d
[1685]
1.3.2色谱条件
[1686]
色谱柱:zorbax(sb
‑
c8,3.5μm,4.6*75mm)
[1687]
流速:1ml/min
[1688]
柱温:40℃
[1689]
检测波长:275nm
[1690]
进样体积:5.0μl
[1691]
运行时间:13min
[1692]
稀释剂:acn
‑
水(v/v,1:1)
[1693]
流动相:a:水(0.05%三氟乙酸);b:乙腈(0.05%三氟乙酸)
[1694]
[1695][1696]
1.4操作程序
[1697]
①
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型a的制备
[1698]
称取200mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入2ml乙醇于50℃下搅拌为澄清溶液,向体系中缓慢加入0.467ml 1m盐酸的乙醇溶液,在加酸过程中析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a。经检测分析,其具有如图1所示的xrpd射线衍射数据、如图2所示的dsc图及如图3所示的tga图。
[1699]
②
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型b的制备
[1700]
称取20mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a,加入0.6ml 88%丙酮于75℃下加热溶清,然后快速降温至0℃下搅拌2h析出固体,最后过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型b。经检测分析,其具有如表2所示的xrpd射线衍射数据、如图4所示的dsc图及如图5所示的tga图。
[1701]
③
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的乙烷磺酸盐晶型a的制备
[1702]
称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.1ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.0255ml 1m乙烷磺酸的甲醇溶液,加完酸后成油搅拌析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺乙烷磺酸盐晶型a。经检测分析,其具有如图6所示的xrpd射线衍射数据、如图7所示的dsc图及如图8所示的tga图。
[1703]
④
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的苯磺酸盐晶型a的制备
[1704]
称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.0255ml 1m苯磺酸的甲醇溶液,加完酸后成油搅拌析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺苯磺酸盐晶型a。经检测分析,其具有如表3所示的xrpd射线衍射数据、如图9所示的dsc图及如图10所示的tga图。
[1705]
⑤
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的富马酸盐晶型a的制备
[1706]
称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.102ml 0.25m富马酸的乙醇溶液,加完酸后成油搅拌析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺富马酸盐晶型a。经检测分析,其具有如表4所示的xrpd射线衍射数据、如图11所示的dsc图及如图12所示的tga图。
[1707]
⑥
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的羟乙基磺酸盐晶型a的制备
[1708]
称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.0255ml 1m羟乙基磺酸的甲醇溶液,加完酸后成油搅拌析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺羟乙基磺酸盐晶型a。经检测分析,其具有如表5所示的xrpd射线衍射数据、如图13所示的dsc图及如图14所示的tga图。
[1709]
⑦
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的草酸盐晶型a的制备
[1710]
称取10mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.0255ml 1m草酸的甲醇溶液,加完酸后搅拌析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺草酸盐晶型a。经检测分析,其具有如表6所示的xrpd射线衍射数据、如图15所示的dsc图及如图16所示的tga图。
[1711]
⑧
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的氢溴酸盐晶型a的制备
[1712]
称取20mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.2ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.04ml 1m氢溴酸的乙醇溶液,加完酸后搅拌析出大量固体,最后在50℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺氢溴酸盐晶型a。经检测分析,其具有如表7所示的xrpd射线衍射数据。
[1713]
⑨
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的龙胆酸盐晶型a的制备
[1714]
称取50mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺无定型,加入0.25ml乙酸乙酯于50℃下搅拌为澄清溶液,向体系中缓慢加入0.128ml 1m龙胆酸的乙醇溶液,加完酸后搅拌析出大量固体,最后在50
℃下搅拌反应2h后降温过滤干燥,最后得到(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺氢龙胆酸盐晶型a。经检测分析,其具有如表8所示的xrpd射线衍射数据。
[1715]
2.固体稳定性实验
[1716]
2.1实验目的:
[1717]
考察(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型a在光照条件下,化合物的物理化学稳定性,为盐型筛选与化合物盐贮存提供依据。
[1718]
2.2实验方案:
[1719]
称取(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型a、约2mg,于光照箱(5000lx
±
500lx)中,考察5天、10天,用hplc,外标法测定盐的含量,并采用色谱峰面积归一化法计算盐有关物质的变化。
[1720]
2.3实验结果:
[1721]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型a的物理化学稳定性结果如表4.3所示:
[1722]
表4.3
[1723][1724]
2.4实验结论
[1725]
(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐晶型a在光照条件下10天总杂增量小于2%。
[1726]
3.引湿性实验
[1727]
3.1实验目的
[1728]
考察(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺不同盐在不同相对湿度条件下的引湿性,为盐型筛选与贮存提供依据。
[1729]
3.2实验方案:
[1730]
将(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺不同盐置于不同相对湿度的饱和水蒸气中,使化合物与水蒸气达到动态平衡,并计算平衡后化合物吸湿增重的百分数。
[1731]
3.3实验结果:
[1732]
3.3.1(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺不同盐的引湿性结果如下:
[1733]
1)(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a在rh80%条件下吸湿增重1.148%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a的xrpd谱图
未发生改变,即晶型未转变。
[1734]
2)(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺苯磺酸盐晶型a在rh80%条件下吸湿增重1.631%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环1次,(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺苯磺酸晶型a的xrpd谱图未发生改变,即晶型未转变。
[1735]
4.不同介质中溶解度实验
[1736]
4.1实验目的
[1737]
比较(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺盐酸盐晶型a在不同ph值介质、水、人工模拟胃液(sgf)、禁食人工模拟肠液(fassif)及非禁食人工模拟肠液(fessif)等媒介中溶解度大小,为盐可成药性评估提供依据。
[1738]
4.2实验方案:
[1739]
将约2mg(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺混悬到不同介质中24小时,用hplc,外标法测定化合物37℃下的热力学溶解度。
[1740]
4.3实验结果:如表4.4所示
[1741]
表4.4
[1742][1743]
4.4实验结论
[1744]
成盐后的(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺在水介质中溶解度明显提高,结合人体内实际情况,综合考虑,(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺成盐具有一定优势。
[1745]
5.多晶筛选实验
[1746]
5.1实验目的:
[1747]
通过多晶筛选,找到比较稳定的盐酸盐的晶型。
[1748]
5.2实验方案:
[1749]
选择有一定溶解度的有机溶剂、水,将(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺悬浮于溶剂体系中,室温搅拌打浆1周后,离心,弃掉上清液,固体在40℃条件真空干燥(
‑
0.1mpa)过夜后,测定固体的xrpd,并与(s)
‑
1'
‑
(6
‑
氨基
‑5‑
((2
‑
氨基
‑3‑
氯吡啶
‑4‑
基)硫代)
‑3‑
氟吡嗪
‑2‑
基)
‑
1,3
‑
二氢螺[茚
‑
2,4'
‑
哌啶]
‑1‑
胺的盐酸盐的xrpd比较。
[1750]
5.3实验结果:
[1751]
通过打浆,改变结晶溶剂、结晶方式等只得到两种晶型的盐酸盐,分别为晶型a、晶型b。对比两个晶型的dsc图谱,可以判断出晶型a为热力学稳定晶型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

