一种
β
‑
半乳糖苷酶及其在乳糖降解中的应用
技术领域
1.本发明涉及一种β
‑
半乳糖苷酶及其在乳糖降解中的应用,属于生物技术领域。
背景技术:
2.β
‑
半乳糖苷酶(ec3.2.1.23,乳糖酶)是水解β
‑
d
‑
半乳糖苷键产生游离d
‑
半乳糖的活性酶。其作为一种重要的医用酶,广泛存在于微生物和动植物中。β
‑
半乳糖苷酶还可以用于制造低聚半乳糖(具有半乳糖残基的低聚糖),同时可以作为乳糖不耐症的潜在治疗选择。
3.现已知米曲霉(aspergillus oryzae)、乳酸克鲁维酵母(kluyveromyces lactis)、马克斯克鲁维酵母(k.marxinus)和细菌环状芽孢杆菌(bacillus circulans)等微生物可产生β
‑
半乳糖苷酶。其中,来自环状芽孢杆菌的β
‑
半乳糖苷酶(专利文献1,非专利文献1)是能够用乳糖生成低聚半乳糖的酶,是工业上制造低聚半乳糖的重要的酶(例如,以“biolacta”的商品名销售β
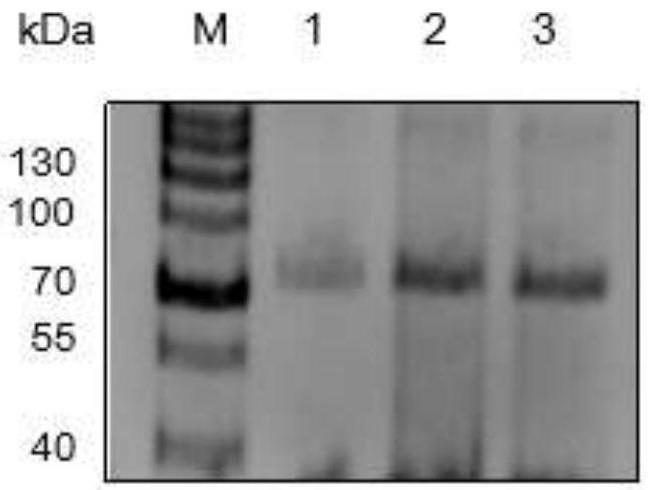
‑
半乳糖苷酶制剂)。
4.专利文献
5.专利文献1:国际公开第2010/140435号小册子
6.非专利文献
7.非专利文献1:song,j.;abe,k.;imanaka,h.;imamura,k.;minoda,m.;yamaguchi,s.;nakanishi,k.causes of the production of multiple forms ofβ
‑
galactosidase by bacillus circulans.bioscience,biotechnology,and biochemistry 2011,75,268
‑
278,doi:10.1271/bbb.100574.
8.在工业上,向底物乳糖添加乳糖酶,通常需要加热进行。在酶反应中,为了提高底物的溶解度以及抑制杂菌的生长,提高反应温度是一种简单易行的方法。目前,报道的糖苷酶活力较低且耐热性有待提高,严重限制了其工业化应用前景。
技术实现要素:
9.本发明针对现有技术的不足,提供了一种新型β
‑
半乳糖苷酶gal39及其制备方法。本发明的β
‑
半乳糖苷酶gal39为结构与功能新颖的乳糖水解酶,其氨基酸序列与已有性质报道的β
‑
半乳糖苷酶序列相似度仅为79.28%,是一个新酶。本发明所述β
‑
半乳糖苷酶gal39最适反应温度为40℃,最适反应ph为7.5;其具有耐热性,在60℃下孵育1小时仍可保持56.2%的活性,利于提高底物的溶解度以及防止杂菌污染。该酶产量大,是用于制造低聚半乳糖的理想选择。
10.一方面,本发明提供一种新型β
‑
半乳糖苷酶gal39,其氨基酸序列如seq id no.1所示。
11.seq id no.1:
12.mtifygigdynpeqwpeatwhedvtlmqeagvnnllvsvaifawsklepepgrfdfgwldrlldllhehgigvclatataapppwlahqhpeslpvtatgvrlgvgsrqqyspsspaykeaaarlvraiaerykghpalklwhv
nneygchvyesfdedsaaafrawlrarygtlealalnaawgtafwsqlyhhweeitppraaptflnptqqldwrrfcsdallalyerdilrevtpevpittnfigvhkpidawrwaealdlvandaypdpsdpeapihaafasdvmrslkggapwllmeqapnqvqwrprnalkapgvmrlwslqalargargvmffqwrqskagaekfhsgmvphggtetrtwhevkalgqelkglgellestlrsdvavvldwdtwwaleldakpsdgvryletlyapyaelwrrnigvtfvrrspdadlspyklvvapnlylvtdeaaanlesyvrgggvlvmgffsgivdehdqvrlggypapfrqllglrveefdalpsalpagarlsvrlpagdvsaetwadvihlegaealgtfgagfyaggpavtrhrfgrgvsfyigtrlaaeglawvlaeacreagvapvletppgveavartrggarylalfnhsdetvtvalperftalgsgalqeaagtlelaardavflrarsathaqepaererspstvpl。
13.另一方面,本发明还提供一种新型β
‑
半乳糖苷酶gal39对应的核酸序列,如seq id no.2所示。
14.seq id no.2:
15.atgaccattttttatggcattggcgattataacccggaacagtggccggaagcgacctggcatgaagatgtgaccctgatgcaggaagcgggcgtgaacaacctgctggtgagcgtggcgatttttgcgtggagcaaactggaaccggaaccgggccgctttgattttggctggctggatcgcctgctggatctgctgcatgaacatggcattggcgtgtgcctggcgaccgcgaccgcggcgccgccgccgtggctggcgcatcagcatccggaaagcctgccggtgaccgcgaccggcgtgcgcctgggcgtgggcagccgccagcagtatagcccgagcagcccggcgtataaagaagcggcggcgcgcctggtgcgcgcgattgcggaacgctataaaggccatccggcgctgaaactgtggcatgtgaacaacgaatatggctgccatgtgtatgaaagctttgatgaagatagcgcggcggcgtttcgcgcgtggctgcgcgcgcgctatggcaccctggaagcgctggcgctgaacgcggcgtggggcaccgcgttttggagccagctgtatcatcattgggaagaaattaccccgccgcgcgcggcgccgacctttctgaacccgacccagcagctggattggcgccgcttttgcagcgatgcgctgctggcgctgtatgaacgcgatattctgcgcgaagtgaccccggaagtgccgattaccaccaactttattggcgtgcataaaccgattgatgcgtggcgctgggcggaagcgctggatctggtggcgaacgatgcgtatccggatccgagcgatccggaagcgccgattcatgcggcgtttgcgagcgatgtgatgcgcagcctgaaaggcggcgcgccgtggctgctgatggaacaggcgccgaaccaggtgcagtggcgcccgcgcaacgcgctgaaagcgccgggcgtgatgcgcctgtggagcctgcaggcgctggcgcgcggcgcgcgcggcgtgatgttttttcagtggcgccagagcaaagcgggcgcggaaaaatttcatagcggcatggtgccgcatggcggcaccgaaacccgcacctggcatgaagtgaaagcgctgggccaggaactgaaaggcctgggcgaactgctggaaagcaccctgcgcagcgatgtggcggtggtgctggattgggatacctggtgggcgctggaactggatgcgaaaccgagcgatggcgtgcgctatctggaaaccctgtatgcgccgtatgcggaactgtggcgccgcaacattggcgtgacctttgtgcgccgcagcccggatgcggatctgagcccgtataaactggtggtggcgccgaacctgtatctggtgaccgatgaagcggcggcgaacctggaaagctatgtgcgcggcggcggcgtgctggtgatgggcttttttagcggcattgtggatgaacatgatcaggtgcgcctgggcggctatccggcgccgtttcgccagctgctgggcctgcgcgtggaagaatttgatgcgctgccgagcgcgctgccggcgggcgcgcgcctgagcgtgcgcctgccggcgggcgatgtgagcgcggaaacctgggcggatgtgattcatctggaaggcgcggaagcgctgggcacctttggcgcgggcttttatgcgggcggcccggcggtgacccgccatcgctttggccgcggcgtgagcttttatattggcacccgcctggcggcggaaggcctggcgtgggtgctggcggaagcgtgccgcgaagcgggcgtggcgccggtgctggaaaccccgccgggcgtggaagcggtggcgcgcacccgcggcggcgcgcgctatctggcgctgtttaaccatagcgatgaaaccgtgaccgtggcgctgccggaacgctttaccgcgctgggcagcggcgcgctgcaggaagcggcgggcaccctggaactggcggcgcgcgatgcggtgtttctgcgcgcgcgcagcgcgacccatgcgcaggaaccggcggaacgcgaacgcagcccgagcaccgtgccgctg。
16.另一方面,本发明还提供一种β
‑
半乳糖苷酶gal39的制备与纯化方法。
17.另一方面,本发明还提供了所述β
‑
半乳糖苷酶gal39在降解乳糖中的应用。
18.另一方面,一种降解乳糖的方法,所选用的β
‑
半乳糖苷酶为gal39。
19.优选:所述降解条件中反应温度为0~70℃。最适反应温度为40℃。
20.优选:所述降解条件中反应ph为5.5~10.5。最适反应ph为7.5。
21.有益效果:
22.1.本发明的β
‑
半乳糖苷酶gal39为结构与功能新颖的乳糖水解酶,其氨基酸序列与已有性质报道的β
‑
半乳糖苷酶序列相似度仅为79.28%。
23.2.本发明提供了一种制备β
‑
半乳糖苷酶gal39的方法,即利用基因工程的技术方法,将gal39的基因序列异源重组表达到大肠杆菌,经发酵后,发酵液酶活力高达366.2u/ml,具有工业化生产的潜质。该酶纯化方法简单,可利用镍柱对其进行一步亲和纯化。
24.3.本发明的β
‑
半乳糖苷酶gal39具有优良的理化性质,该酶最适反应温度和ph分别为40℃和7.5,其具有热稳定的特性,在60℃下孵育1小时仍可保持56.2%的活性。本发明所述的β
‑
半乳糖苷酶gal39具有良好的工业化应用前景。
附图说明
25.图1为本发明β
‑
半乳糖苷酶gal39蛋白质分离纯化图(m,蛋白质标准品;1
‑
3,纯化所得β
‑
半乳糖苷酶gal39);
26.图2为本发明β
‑
半乳糖苷酶gal39的温度和ph适应性分析(a,β
‑
半乳糖苷酶gal39的最适反应温度;b,β
‑
半乳糖苷酶gal39的最适反应ph;
27.图3为本发明β
‑
半乳糖苷酶gal39的热稳定性分析;
28.图4为薄层层析(tlc)法检测本发明β
‑
半乳糖苷酶gal39的酶解产物(m,半乳糖标准品;0和1为空白;2为该酶降解乳糖60min);
具体实施方式
29.实施例1β
‑
半乳糖苷酶gal39的序列分析及重组表达
30.本发明所述β
‑
半乳糖苷酶gal39的产酶基因gal39来源于海洋细菌baciliius sp.by39,包含有2070个碱基序列,编码690个氨基酸序列。利用national center for biotechnology information(ncbi)中的保守结构域分析conserved domain(cdd)和多重序列比对basic local alignment search tool(blast)发现,该序列包含有一段多糖水解酶gh家族的β
‑
半乳糖苷酶保守区。已经报道的β
‑
半乳糖苷酶中,与gal39氨基酸序列相似度最高的为多糖水解酶第42家族(gh42)的β
‑
半乳糖苷酶(genbank cp002049.1),两者之间的氨基酸序列相似度(identity)为79.28%。该发明所述的β
‑
半乳糖苷酶gal39归属于多糖水解酶(gh42)家族。本发明所述β
‑
半乳糖苷酶gal39序列新颖,与其他同一家族序列相比,长度较短,含有3个独立的结构域,利用同源模建和分子对接发现,本发明所述β
‑
半乳糖苷酶gal39催化腔与乳糖分子的结合能力强。
31.将β
‑
半乳糖苷酶gal39的产酶序列以限制性内切酶nco i和xho i为酶切位点,设计重组引物如下(下划线为限制性内切酶位点,斜体为限制性内切酶保护碱基):
32.正向引物:seq id no.3:pgal39
‑
f:
[0033]5’‑
catgccatggaagttgtcttgtatcgct
‑3’
(nco i)
[0034]
反向引物:seq id no.4:pgal39
‑
r:
[0035]5’‑
ccgctcgagcttgatttcgtatgggtca
‑3’
(xho i)
[0036]
pcr扩增条件为:94℃预变性3min;94℃变性30秒,55℃退火30秒,72℃延伸1min,共30个循环;72℃延伸5min;4℃稳定15min。pcr反应所用dna聚合酶为primerstar hs购自大连宝生物公司。
[0037]
pcr产物用限制性内切酶nco i和xho i进行双酶切,通过琼脂糖凝胶电泳回收酶切后的pcr产物。pet28a( )质粒dna(美国invitrogen公司),同样用限制性内切酶nco i和xho i进行双酶切,进行琼脂糖凝胶电泳并回收酶切后的产物片段。酶切所用酶和底物反应体系(温度、时间、dna用量等)均参照大连宝生物提供的产品说明操作。
[0038]
双酶切处理的pcr产物和pet
‑
28a( )质粒载体参照dna连接酶(大连宝生物公司)说明书进行连接反应;连接产物转化至大肠杆菌dh5α菌株(美国invitrogen公司),涂布在luria
‑
bertani(lb)培养基固体平板上(含有50μg/ml卡那霉素),37℃温箱中培养12
‑
16小时后,挑取单克隆;将单克隆转接至lb液体培养基中(含有50μg/ml卡那霉素),转速为160rpm的37℃摇床中培养过夜。将单克隆进行序列测定,选择阳性克隆,并将其命名为pet28a
‑
gal39。重组质粒转化至大肠杆菌bl21(de3)(购自大连宝生物公司),将重组大肠菌株命名为bl21(de3)/pet28a
‑
gal39,保存在
‑
80℃备用。
[0039]
需要说明的是,在本发明公开了壳聚糖酶csnh的氨基酸序列的前提下,本领域普通技术人员可以推导出对应的核苷酸序列,这些核苷酸序列都应理解为在本发明保护范围内。利用人工合成的手段获得氨基酸序列和核苷酸序列是本领域成熟的技术手段。
[0040]
实施例2β
‑
半乳糖苷酶gal39的制备及纯化方法
[0041]
将重组菌株bl21(de3)/pet28a
‑
gal39在100ml的lb液体培养基中(50μg/ml卡那霉素),在37℃摇床中160rpm震荡培养至od
600
=0.6,加入终浓度为0.1mm的诱导剂异丙基
‑
β
‑
d
‑
硫代半乳糖苷(iptg),在20℃诱导24h。β
‑
半乳糖苷酶活性测定方法为:50μl酶液加入450μl 10mm邻
‑
硝基酚
‑
β
‑
d
‑
半乳糖苷(onpg)底物(20mm磷酸盐缓冲液,ph=8.0),在40℃下反应10min,加入500μl的na2co3试剂终止反应。将混合物以10,000rpm离心10min,在od420下检测其吸光度。酶活力定义为1u为每min产生1μm onp所需要的酶量。经检测,发酵液中壳聚糖酶活力可达366.2u/ml。
[0042]
发酵停止后,12000rpm离心10min,弃上清液后收集菌体。将菌体重悬于20mm磷酸盐缓冲液中,使用超声细胞破碎仪破碎菌体(全程操作在冰上,保持低温)。最后,将细菌裂解物离心并收集上清液,使用akta150 fplc纯化系统进行纯化。将收集的上清液上样于经过预平衡的5ml镍离子亲和层析柱上,上样流速为5ml/min。洗涤缓冲液(500mm nacl,20mm磷酸缓冲液,ph7.6)用于去除杂质蛋白,使用洗脱缓冲液(500mm咪唑,500mm nacl,20mm磷酸缓冲液,ph7.6)用于活性成分。将活性成分透析去除咪唑,分装储存在
‑
20℃备用。纯化所得β
‑
半乳糖苷酶进行聚丙烯酰胺凝胶电泳(sds
‑
page),如图1所示,纯化所得β
‑
半乳糖苷酶gal39的分子量为76kda,与序列分析中预测的蛋白大小一致。
[0043]
实施例3β
‑
半乳糖苷酶gal39的最适温度和ph测定
[0044]
将实施例2中纯化所得β
‑
半乳糖苷酶gal39在不同条件下进行酶活力测定,检测不同温度和ph对酶活力的影响。在不同温度(0
‑
80℃)下反应10min,检测不同反应温度对酶活
力的影响,以最高酶活力为100%,计算不同温度下gal39的相对酶活力。如图2a所示,β
‑
半乳糖苷酶gal39的最适反应温度为40℃。
[0045]
将实施例2中纯化所得β
‑
半乳糖苷酶gal39与britton
‑
robinson缓冲液体系(ph5.5
‑
10.5)的乳糖底物反应。该缓冲液由磷酸,硼酸和乙酸组成,可以添加不同量的氢氧化钠以形成具有宽ph范围的缓冲溶液。在最适温度下检测活性,酶活性最高值为100%。如图2b所示,β
‑
半乳糖苷酶gal39的最适反应ph为7.5。
[0046]
实施例4β
‑
半乳糖苷酶gal39的热稳定性测定
[0047]
将实施例2中纯化所得β
‑
半乳糖苷酶gal39在不同温度(0
‑
80℃)下孵育1h,然后检测其酶活力。以不孵育酶液的活力为100%;检测不同孵育温度对其热稳定性的影响;如图3所示,β
‑
半乳糖苷酶gal39在最适温度40℃下孵育1小时,保持83.6%的活性;在60℃孵育1小时,仍可保持56.2%的活性。
[0048]
实施例5β
‑
半乳糖苷酶gal39酶解产物薄层层析分析
[0049]
将实施例2中纯化所得β
‑
半乳糖苷酶gal39纯酶与乳糖在40℃下进行反应,检测其酶解产物。将100μl纯化的gal39和900μl乳糖底物(5mg/ml)在200mm磷酸盐缓冲液(ph 7.5)中于40℃下孵育6小时,在不同的时间点收集产物,并通过煮沸10分钟使酶失活,然后在高效薄层层析板(hptlc)检测。具体为:将hptlc层析板裁剪成7cm宽合适大小的样本,将4μl样品点样在硅胶tlc板原点处,置于有展开剂(正丁醇:冰醋酸:水=2:2:1)的展缸中30min,吹干层析板,浸入显色剂(0.5%茚三酮乙醇溶液)中2s,取出吹干,80℃烘烤,至样品出现。如图4所示,与标准品迁徙率比较发现,β
‑
半乳糖苷酶gal39酶解主产物为葡萄糖和半乳糖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

