1.本发明属于药物合成技术领域,具体涉及一种盐酸布替萘芬的合成方法。
背景技术:
2.盐酸布替萘芬(butenafine hydrochloride),化学名为n-(4-叔丁基苯基)-n-甲基-1-萘甲胺盐酸盐,是由日本科研株式会社研发的烯丙胺类抗真菌药,并于1992年在日本首次上市,商品名mentax。本品能高选择性地抑制真菌角鲨烯环氧化酶活性,并抑制真菌体内角鲨烯和麦角固醇的生物合成,从而破坏真菌细胞膜生成,导致真菌死亡。具有抗菌谱广、抗菌活性高、复发率低、副作用小等特点,并被广泛应用于临床。其化学结构如下所示:
[0003][0004]
目前报道的关于布替萘芬的合成工艺主要有以下几种:
[0005]
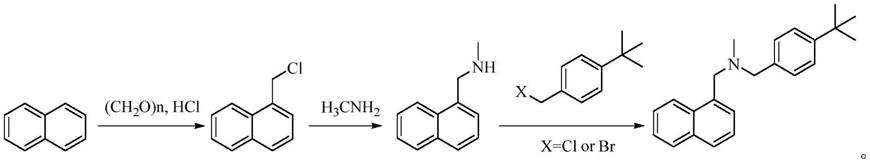
主流工艺是采用专利ep221781,cn1597660a、cn1727325a、cn101077858a及文献yakugaku zasshi,1991,111(2):126-137、中国医药工业杂志,1999,(3):102-103等报道的方法。该工艺采用萘(或其下游中间体)为原料先经氯甲基化合成1-氯甲基萘,再与甲胺反应生成n-甲基萘甲胺,后与对叔丁基卤苄经取代、成盐等反应制得得盐酸布替萘芬。路线如下:
[0006][0007]
该路线虽然具有原料易得、操作简单等优点。但反应多在干燥dmf中用无水碳酸钠或无水碳酸钾作缚酸剂进行反应。dmf沸点较高,回收不便;对叔丁基溴苄通常由对甲基叔丁苯溴代而得,制备时副产物多,污染较大,成本较高,为对其进行精制,常涉及减压蒸馏等苛刻操作,不适合工业化车间生产。同时由于n-烷基化反应时所用侧链卤代烃过量且反应温度较高,使得极易生成二取代杂质,进而生成季铵盐结构中间体,同时成品合成时也容易生成季铵盐杂质,不仅产品纯度较低,同时通过进一步精制后,总收率也较低(杂质相关结构如下所示)。
[0008][0009]
德国应用化学angew.chem.int.ed.,2014,53(41),11010-11014报道了以1-萘甲醛和4-叔丁基苄胺为原料,以二氧化碳为碳源,在钌催化下制备目标产物。路线如下:
[0010][0011]
但是,该方法中的整个过程操作复杂,而且伴有大量无机盐副产物生成。而且,上述终产物的转化过程需要在很高的压力[co2/h2(20/60bar)]下进行,对设备操作要求性较高。此外,由于使用贵金属钌参与催化,钌催化剂价格昂贵,使得生产成本较高。
[0012]
j.org.chem.,2018,83,11886-11895则在硒化镉/硫化镉、可见光催化条件下,经4-氟苯硫醇还原,再在偶氮二甲酸二异丙酯(diad)及三苯基膦。存在下,与碘甲烷反应制得目标产品。路线如下:
[0013][0014]
但该工艺用到毒性较大的重金属镉化合物合成关键中间体,其限量要求极低;制备目标产品时以毒性较大,沸点较低的碘甲烷为碳源引入甲基,同样会引入n-多烃化的季铵盐杂质,此外反应后生成的三苯基氧膦由于溶解性较差,反复精制后的收率较低。
[0015]
此外,近年来原料药质量控制越来越重视对遗传毒性(或称基因毒性)杂质的研究。遗传毒性杂质很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤的发生。因此在生产工艺中严格控制相关基因毒性杂质的含量具有重要的现实意义。而上述工艺中反应物料单卤代烷烃以及萘甲醛具有基因毒性警示结构,需要对其进行风险评估及严格限度要求。
[0016]
专利us5021458则以1-萘甲酸为原料,经氯化亚砜氯化得1-萘甲酰氯,再与1-(4-叔丁基苯)-n-甲基甲胺缩合得n-(4-叔丁基苄)-n-甲基-1-萘甲酰胺,最后经氢化铝锂还原、成盐,制得盐酸布替萘芬。路线如下:
[0017]
[0018]
此外,该专利还报道了以对叔丁基苯甲酸为原料,经氯化亚砜氯化得对叔丁基苯酰氯,与n-甲基萘甲胺缩合得4-叔丁基-n-甲基-n-(甲基萘)苯甲酰胺,后经氢化铝锂还原、成盐,制得盐酸布替萘芬的方法。路线如下:
[0019][0020]
但这两种方法均需要用到毒性、刺激性较大的酰氯,对设备要求较高,需要在特种反应间进行;同时还原反应需要用到活性较强的氢化铝锂,不仅操作危险性较强,同时生产成本较高,不适合大规模制备。
[0021]
专利cn105130823b公开了一种以4-叔丁基苄胺为原料,与1-萘甲酰氯和甲酸在有机溶剂中,以有机硅烷化合物[二苯基硅烷、二乙基硅烷、聚(甲基氢硅氧烷)、苯基硅烷]为还原剂,在非金属硼类化合物[三乙基硼、三(五氟苯基硼)]为催化剂下发生n-甲基化反应,同时酰胺键被还原,而得到布替萘芬的方法。路线如下:
[0022][0023]
文献angew.chem.int.ed.,2015,54,9042-9046则以1-萘甲酸为原料,经苯硼酸催化后再经有机硅烷化合物及非金属硼类化合物还原后,以甲酸为碳源制得布替萘芬。路线如下:
[0024][0025]
但是,该类方法进行还原反应时应用到价格较高的有机硅烷化合物和非金属硼类化合物,使得生产成本较高,同时后者反应温度较高,反应时间较长,不适合工业化生产。
[0026]
综上所述,在已经被报道的制备布替萘芬的技术方法中,主要存在以下问题:
[0027]
(1)以卤代烷烃进行n-烷基化反应,容易产生n-过烷基化杂质,需要进一步精制;
[0028]
(2)还原氨化过程需要应用价格昂贵的钌作为催化剂,使得生产成本较高;
[0029]
(3)n-烷基化反应物料单卤代烷烃以及萘甲醛具有基因毒性警示结构,需要对其进行风险评估及严格限度要求;
[0030]
(4)通过酰胺还原引入n-烷基侧链,但需要应用到氢化铝锂或者有机硅烷化合物/非金属硼类化合物为还原剂,不仅反应条件较苛刻,同时使得生产成本较高;
[0031]
(5)还原氨化过程需要应用毒性较大的重金属镉化合物,使得成品检测限度极低。
[0032]
鉴于现有技术存在的较多问题,研究寻找一条反应条件温和,操作过程简便,产品
收率高、纯度高,生产成本低的适合工业化生产布替萘芬的制备方法仍是目前需要解决的问题。
技术实现要素:
[0033]
针对目前布替萘芬制备技术存在的问题,本发明提供了一种盐酸布替萘芬的合成方法。该方法可有效避免n-过烷基化杂质及相关基因毒性警示结构杂质,并且所制得的目标产品具有较高的纯度、收率。
[0034]
本发明的具体技术方案如下:
[0035]
一种盐酸布替萘芬的合成方法,n-甲基-1-萘甲胺与对叔丁基苄醇反应后得到盐酸布替萘芬,反应式如下:
[0036][0037]
一种盐酸布替萘芬的合成方法,具体包括以下步骤:
[0038]
惰性气体保护下,将催化剂、n-甲基-1-萘甲胺、对叔丁基苄醇、反应溶剂加入密封装置中,密封控温至反应结束后,经萃取剂萃取,萃取液减压浓缩后,经hcl/有机溶剂成盐酸盐,过滤,滤饼减压干燥后即为盐酸布替萘芬。
[0039]
所述催化剂为:cp*ir络合物催化剂与碱组合体系;其中cp*ir络合物优选[cp*iri2]2、[cp*ircl2]2中的一种;其中特别优选[cp*ircl2]2与碱组合体系。
[0040]
优选地,所述碱为nahco3,na2co3,k2co3,acona,tea中的一种或其组合,其中特别优选nahco3。碱可配成碱的水溶液,或直接加入反应均可。
[0041]
在另一优选方案中所述催化剂为rh类络合物催化剂;优选为rhcl(pph3)3,rhh(pph3)4中的一种;
[0042]
优选地,所述n-甲基-1-萘甲胺与对叔丁基苄醇投料摩尔比为1:1.0~1.1。
[0043]
优选地,所述n-甲基-1-萘甲胺、cp*ir络合物催化剂、碱的投料摩尔比为1:0.5%~5%:1%~10%。其中特别优选1:2%:5%。
[0044]
优选地,所述n-甲基-1-萘甲胺、rh类络合物催化剂的投料摩尔比为1:0.5%~5%,其中特别优选1:2%。
[0045]
优选地,所述反应溶剂为去离子水,苯、甲苯,二甲苯,1,4-二氧六环,乙腈中的一种或其组合,其中特别优选去离子水。
[0046]
优选地,所述控温反应,可将密封装置置于温度为100~150℃加热设备中。所述加热装置可选用油浴加热,电热套,蒸汽加热,电炉等加热设备。所述密封设备可选用密封玻璃管,密封性能好的不锈钢反应釜,密封schlenk装置等设备。本发明优选schlenk装置进行验证。
[0047]
优选地,控温反应时间为5~10小时;也可进行检测确定。
[0048]
优选地,所述萃取溶剂为二氯甲烷,氯仿,乙酸乙酯中的一种或其组合。
[0049]
优选地,所述hcl/有机溶剂为hcl/甲醇,hcl/乙醇,hcl/异丙醇,hcl/1,4-二氧六
环,hcl/乙酸乙酯中的一种或其组合,其中特别优选hcl/甲醇;
[0050]
优选地,所述hcl/有机溶剂中盐酸的浓度为0.5~4mol/l,其中特别优选2mol/l。
[0051]
本发明中,所述的惰性气体通常选择氮气、氩气,其中特别优选氩气。
[0052]
与现有技术相比,本发明取得的技术效果是:
[0053]
(1)本发明催化剂的使用使对叔丁基苄醇与n-甲基-1-萘甲胺的n-烷基化单取代反应进行,有效避免了n-过烷基化杂质,且本发明催化剂用量少,大大降低了生产成本,所得产品收率和纯度都有所提高。
[0054]
(2)经过一步成盐,对粗品进行精制的同时得到目标产品,反应步骤少,后处理简单,更适于工业化生产。
具体实施方式
[0055]
下面通过实施例来进一步说明本发明,应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属于本发明要求保护的范围。
[0056]
实验所用物料:化合物n-甲基-1-萘甲胺可购买,也可参照现有公开的技术制备;化合物对叔丁基苄醇可购买,也可参照现有公开的技术制备;其他实验所用物料未标明来源和规格的均为市售分析纯或化学纯。
[0057]
本发明采用hplc测定布替萘芬的纯度,色谱条件如下:
[0058]
色谱柱:welch ultimate xb-c
18
(4.6mm
×
150mm,3.0μm);
[0059]
流动相:醋酸盐缓冲液(取醋酸钠18.0g,冰醋酸9.8ml,用水稀释至1000ml)-甲醇-异丙醇(17:70:13);
[0060]
柱温:30℃;
[0061]
检测波长:282nm;
[0062]
流速:1.0ml/min;
[0063]
进样量:10μl。
[0064]
以下各实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
[0065]
实施例1
[0066]
氩气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.42g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、去离子水(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应8小时,反应结束,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液并减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率96.3%,hplc:99.89%。
[0067]
实施例2
[0068]
氮气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.42g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(18.07g,0.11mol)、去离子水(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应8小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液并减压浓缩至干,加入hcl/甲醇(300ml,0.5mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率96.8%,hplc:
99.80%。
[0069]
实施例3
[0070]
氩气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.42g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(18.89g,0.115mol)、去离子水(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应8小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液并减压浓缩至干,加入hcl/1,4-二氧六环(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率95.8%,hplc:99.76%。
[0071]
实施例4
[0072]
氩气保护下,将[cp*ircl2]2(0.40g,0.0005mol)、碳酸钾(0.69g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、甲苯(150ml)加入schlenk装置中,密封置于控温130℃油浴中至反应10小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液并减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率90.9%,hplc:99.75%。
[0073]
实施例5
[0074]
氩气保护下,将[cp*ircl2]2(3.98g,0.005mol)、碳酸氢钠(0.42g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、去离子水(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应5小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液减压浓缩至干,加入hcl/异丙醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率92.6%,hplc:99.73%。
[0075]
实施例6
[0076]
氩气保护下,将[cp*iri2]2(2.32g,0.002mol)、三乙胺(0.51g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、去离子水(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应7小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液减压浓缩至干,加入hcl/乙醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率95.8%,hplc:99.84%。
[0077]
实施例7
[0078]
氩气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.084g,0.001mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、去离子水(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应9小时,反应结束后,反应液降至室温,加入乙酸乙酯(50ml
×
4)萃取,合并萃取液减压浓缩至干,加入hcl/乙酸乙酯(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率90.1%,hplc:99.75%。
[0079]
实施例8
[0080]
氩气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.84g,0.01mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、去离子水(150ml)加入
schlenk装置中,密封置于控温110℃油浴中至反应6小时,反应结束后,反应液降至室温,加入氯仿(50ml
×
3)萃取,合并萃取液减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率89.2%,hplc:99.72%。
[0081]
实施例9
[0082]
氩气保护下,将rhcl(pph3)3(1.85g,0.002mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、1,4-二氧六环(150ml)加入不锈钢反应釜中,密封置于控温150℃的油浴中至反应5小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率94.5%,hplc:99.85%。
[0083]
实施例10
[0084]
氩气保护下,将rhh(pph3)4(2.31g,0.002mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、乙腈(150ml)加入schlenk装置中,密封置于控温120℃油浴中至反应6小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率96.1%,hplc:99.81%。
[0085]
实施例11
[0086]
氩气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.42g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、苯(150ml)加入schlenk装置中,密封置于控温110℃油浴中至反应8小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液并减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率94.2%,hplc:99.87%。
[0087]
实施例12
[0088]
氩气保护下,将[cp*ircl2]2(1.59g,0.002mol)、碳酸氢钠(0.42g,0.005mol)、n-甲基-1-萘甲胺(17.12g,0.10mol)、对叔丁基苄醇(16.42g,0.10mol)、二甲苯(150ml)加入玻璃管中,封管后置于控温140℃电炉中至反应5小时,反应结束后,反应液降至室温,加入二氯甲烷(50ml
×
3)萃取,合并萃取液并减压浓缩至干,加入hcl/甲醇(150ml,2mol/l)成盐,继续搅拌析晶2~3h后过滤,滤饼减压干燥后即为盐酸布替萘芬,收率95.4%,hplc:99.85%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

