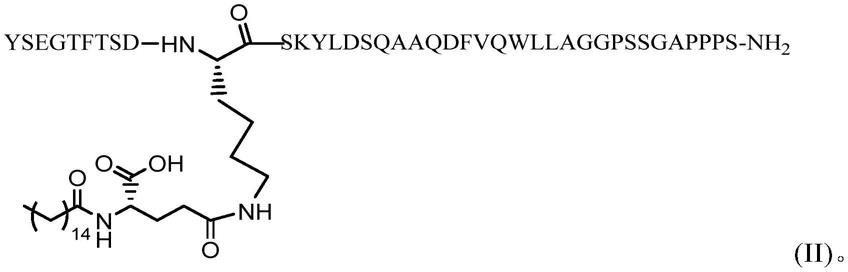
1.本发明涉及生物技术领域,更具体地,本发明涉及一种肠促胰岛素类似物及其制备方法和用途。
背景技术:
2.高血糖是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。在临床上糖尿病一般分为一型糖尿病,二型糖尿病等。糖尿病时长期存在高血糖症状,严重高血糖时会导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍,威胁人类健康。尤其是随着生活方式的改变以及人口老龄化加剧,糖尿病及其并发症越来越成为人类健康的重要威胁。
3.现有技术中二型糖尿病的临床治疗药物的主要类别包括:双胍类糖尿病药物(二甲双胍、或苯乙双胍)、磺酰脲类糖尿病药物(格列本脲、格列吡嗪、格列齐持、格列波脲、格列美脲、或格列喹酮)、葡萄糖苷酶抑制剂类药物(阿卡波糖、伏格利波糖、或米格列醇)、胰岛素增敏类药物(环格列酮、曲格列酮、罗格列酮、或吡格列酮)、醛糖还原酶抑制剂类药物(阿司他丁、依帕司他、波拉司他、或托瑞司他)、促胰岛素释放类药物(瑞格列奈)、或那格列奈)。尽管已经开发了多种类的糖尿病治疗药物,但是,也有较多的负面因素制约着一些药物的应用。
4.目前上市的蛋白类药物中,用于治疗二型糖尿病的主要是人胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor;glp-1r)激动剂,如利拉鲁肽(liraglutide,商品名及)、索玛鲁肽(semeglutide,商品名)等。利拉鲁肽是一种化学修饰的glp-1类似物,脂肪酸(十六烷酸)通过γ-glu连接至glp-1蛋白骨架的第26位赖氨酸上,脂肪酸可与血清白蛋白结合,临床上每天给药一次,分别用于降糖及减重两个适应症。索玛鲁肽从结构上看,是glp-1(7-37)链上8位的aib取代了ala,34位的arg取代了lys,26位的lys接上十八烷脂肪酸链。与利拉鲁肽相比,索玛鲁肽的脂肪酸链更长,与血清白蛋白的亲和力更高,在临床上每周1次皮下注射。
5.糖尿病患者普遍肥胖,体重减轻对于糖尿病有显著改善。因此对于glp-1类似物,减重是个重要指标。利拉鲁肽虽然被获批用于治疗肥胖,然而实际上其体重减轻大概只有5.6公斤。而临床上索玛鲁肽(0.5mg)、索玛鲁肽(1.0mg)治疗组的平均减重为4.2kg和5.5kg。目前用于肥胖的药物减重一般在5
–
10%左右(与安慰剂相比),即整体上平均减重的比例不超过患者体重的10%(rudolph l.leibel等,diabetes,64(7):2299-2309,2015)。
6.目前,尽管不少制药公司和科研单位正在开发基于天然肠促胰岛素序列的多特异性药物,但尚缺少在临床上效果优异的药物,本领域还需要在这方面进行进一步的研究和开拓。
技术实现要素:
7.本发明的目的在于提供一种肠促胰岛素类似物及其制备方法和用途。
8.在本发明的第一方面,提供一种肠促胰岛素类似物,其包括类胰高血糖素多肽以及与之相连的长链脂肪酸;其中,所述的类胰高血糖素多肽的氨基酸序列如式(i):
9.ysegtftsdx
10
skyldsqaaqdfvqwllaggpssgapppsx
40
(i);
10.式(i)中,x
10
为氨基酸k,x
40
选自基团oh或nh2。
11.在一个优选例中,所述的长链脂肪酸为含有14~20个碳的脂肪酸;较佳地为含有16~18个碳的脂肪酸;更佳地所述长链脂肪酸为直链饱和一元羧酸;更佳地,所述的长链脂肪酸为棕榈酸。
12.在另一优选例中,所述长链脂肪酸连接于所述类胰高血糖素多肽的肽链的氨基酸k上;较佳地,连接于x
10
的氨基酸上;较佳地,所述的连接为交联。
13.在一个优选例中,所述类胰高血糖素多肽与所述长链脂肪酸通过接头连接;较佳地,所述接头是能与氨基酸k反应,且能与长链脂肪酸的活性基团反应的接头。
14.在一个优选例中,所述的接头为包含至少1个(如1~6个)单位的-γ谷氨酰-(-γglu-)的接头。
15.在一个优选例中,所述肠促胰岛素类似物的结构如式(ii):
[0016][0017]
在本发明的另一方面,提供所述的肠促胰岛素类似物在制备组合物中的用途,所述的组合物用于:
[0018]
激活人胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor;glp-1r),葡萄糖依赖性促胰岛素多肽受体(gipr)和/或胰高血糖素受体(gcgr);
[0019]
预防、缓解或治疗代谢性疾病;或
[0020]
减少食物摄入、降低脂肪、降低体重或降低血糖。
[0021]
在一个优选例中,所述的减少食物摄入、降低脂肪、降低体重或降低血糖可以是以非治疗为目的的情形。
[0022]
在一个优选例中,所述的代谢性疾病包括:高血糖相关的代谢性疾病或高血脂相关的代谢性疾病。
[0023]
在另一优选例中,所述高血糖相关的代谢性疾病包括:糖尿病或与糖尿病相关的代谢综合征;较佳地,所述与糖尿病相关的代谢综合征包括胰岛素抵抗、葡萄糖耐受不良。
[0024]
在另一优选例中,所述高血脂相关的代谢性疾病包括:肥胖、高血脂、脂肪肝、高甘油三酯血症、高胆固醇血症、低hdl胆固醇、高ldl胆固醇;较佳地,所述的脂肪肝包括非酒精性脂肪肝病(nafld),更佳地包括非酒精性脂肪肝炎(nash)。
[0025]
在本发明的另一方面,提供一种组合物,其包括前面所述的肠促胰岛素类似物,以及载体;所述的载体为药学上、食品学上或保健品学上可接受的载体。
[0026]
在一个优选例中,所述的肠促胰岛素类似物是有效量的。
[0027]
在另一优选例中,所述的组合物包括但不限于:药物组合物、食物组合物或保健品组合物等。
[0028]
在本发明的另一方面,提供一种用于制备权利要求1所述的肠促胰岛素类似物的类胰高血糖素多肽,其氨基酸序列如式(i):
[0029]
ysegtftsdx
10
skyldsqaaqdfvqwllaggpssgapppsx
40
(i);
[0030]
式(i)中,x
10
为氨基酸k,x
40
选自基团oh或nh2。
[0031]
在本发明的另一方面,提供编码所述的类胰高血糖素多肽的多核苷酸,含有所述多核苷酸的表达载体和/或含有所述多核苷酸的重组细胞。
[0032]
在本发明的另一方面,提供一种制备所述的肠促胰岛素类似物的方法,包括:将所述的类胰高血糖素多肽与长链脂肪酸相连。
[0033]
在本发明的另一方面,提供一种非治疗性地减少食物摄入、降低脂肪、降低体重或降低血糖的方法,包括给予需要减少食物摄入、降低脂肪、降低体重或降低血糖的受试者所述的肠促胰岛素类似物,或所述的组合物。
[0034]
在本发明的另一方面,提供一种药盒,其中包含:所述的肠促胰岛素类似物;或包括所述的组合物。
[0035]
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
[0036]
图1为肠促胰岛素类似物p3yelan质谱分析结果图。
[0037]
图2为肠促胰岛素类似物p3yelan体外glp-1r激动活性的测定结果;以杜拉鲁肽作为对照。
[0038]
图3为肠促胰岛素类似物p3yelan体外gipr激动活性的测定结果。
[0039]
图4为肠促胰岛素类似物p3yelan体外gcgr激动活性的测定结果。
[0040]
图5为肠促胰岛素类似物p3yelan体外血清稳定性的测定结果;以yelan和杜拉鲁肽作为对照。
[0041]
图6为肠促胰岛素类似物p3yelan在db/db小鼠体内的随机血糖变化结果;以杜拉鲁肽作为阳性对照;正常对照(normal control)为正常未患病动物;阴性对照(negative control)为溶剂对照(不给予p3yelan或阳性对照药)。
[0042]
图7为肠促胰岛素类似物p3yelan在dio小鼠体内的体重变化结果;以利拉鲁肽作为阳性对照;正常对照(normal control)为正常未诱导肥胖动物;阴性对照(negative control)为溶剂对照(不给予p3yelan或阳性对照药)。
[0043]
图8为肠促胰岛素类似物p3yelan在dio小鼠体内的累计摄食变化结果;以利拉鲁肽作为阳性对照;正常对照(normal control)为正常未诱导肥胖动物;阴性对照(negative control)为溶剂对照(不给予p3yelan或阳性对照药)。
[0044]
图9为肠促胰岛素类似物p3yelan在dio小鼠体内的空腹血糖检测结果;以利拉鲁肽作为阳性对照;正常对照(normal control)为正常未诱导肥胖动物;阴性对照(negative control)为溶剂对照(不给予p3yelan或阳性对照药)。
具体实施方式
[0045]
鉴于现有技术中肠促胰岛素类药物尚存在一些不足,本发明人在深入研究的基础上,提供一种肠促胰岛素类似物,其兼具glp-1r/gipr/gcgr激动活性,为三效激动剂,其在降糖、减脂以及减重方面效果显著。本发明还提供了其制备方法和用途。
[0046]
肠促胰岛素类似物及其制备
[0047]
本发明提供一种肠促胰岛素类似物,其包括类胰高血糖素多肽以及与之相连的长链脂肪酸。
[0048]
用于建立所述肠促胰岛素类似物的类胰高血糖素多肽的序列为(seq id no:2):
[0049]
ysegt ftsdx
10
skyld sqaaq dfvqw llagg pssga pppsx
40
(i)
[0050]
其中,x
10
=k,x
40
为oh或nh2。
[0051]
本发明的类胰高血糖素多肽可以是重组多肽、合成多肽。其可以是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。
[0052]
本发明还包括seq id no:2所示的类胰高血糖素多肽的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持该类胰高血糖素多肽相同的生物学功能或活性的多肽。所述多肽片段、衍生物或类似物可以是(i)有一个或多个(如1-5个,1-3个或1-2个)保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是或不是由遗传密码编码的,或(ii)在一个或多个(如1-5个,1-3个或1-2个)氨基酸残基中具有取代基团的多肽,或(iii)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
[0053]
本发明中,也包括与seq id no:2所示的类胰高血糖素多肽的氨基酸序列有至少75%(较佳地至少80%,85%,90%,95%)序列一致性(sequence identity),且具有该所示类胰高血糖素多肽的功能的多肽。
[0054]
本发明中,也包括为了增加多肽的稳定性、半衰期、促进功效而对一个或几个氨基酸加以修饰后构成的修饰形式的多肽(通常不改变一级结构),包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了抗水解性能或优化了溶解性能的多肽。
[0055]
本发明还提供了编码本发明类胰高血糖素多肽或其保守性变异多肽的多核苷酸序列。本发明的多核苷酸可以是dna形式或rna形式。dna可以是编码链或非编码链。也即,“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0056]
本发明也涉及包含本发明的多核苷酸的表达载体,以及用所述表达载体或类胰高血糖素多肽的编码序列经基因工程产生的宿主细胞,以及经重组技术产生所述多肽的方法。
[0057]
本发明还提供了所述的类胰高血糖素多肽的应用,用于制备本发明所述的肠促胰岛素类似物。
[0058]
用于建立所述肠促胰岛素类似物的长链脂肪酸,为含有14~20个碳的脂肪酸,较佳地其为含有16~18个碳的脂肪酸。本发明中,也包括所述长链脂肪酸的酯、醚或衍生物,以及也包括所述长链脂肪酸的盐(例如钠盐)。在本发明的优选方式中,所述长链脂肪酸为直链饱和一元羧酸。
[0059]
作为本发明的优选方式,所述的连接为化学交联。为了达到化学交联的目的,本发明人在多肽原始序列的基础上引入氨基酸k或c,并将脂肪酸交联至k或c上。
[0060]
所述类胰高血糖素多肽与长链脂肪酸交联后,其活性明显提高且药物在体内的半衰期显著延长。优选的,将第10位y突变为k(式ⅰ中:x
10
=k),从而可以通过k将脂肪酸链交联至肠促胰岛素类似物多肽片段上。
[0061]
在本发明的优选实施方式中,本发明所提供的肠促胰岛素类似物中,所述脂肪酸链为棕榈酸(c16),为直链一元羧酸,其化学结构式为如下所示的基团:
[0062][0063]
本发明所提供的肠促胰岛素类似物中,所述类胰高血糖素多肽片段和长效载体之间还可以设有接头。所述接头通常可以分别与类胰高血糖素多肽片段上的赖氨酸残基k和/或半胱氨酸残基c、以及长效载体上的活性基团(例如,接头中可以包括羧基、马来酰亚胺等活性基团)发生反应,以使得接头两端分别连接长效载体和肠促胰岛素类似物多肽片段,以实现长效载体与肠促胰岛素类似物多肽片段的交联,例如,可以是各种类型的缩合反应。
[0064]
所述接头可以是本领域各种适合用于连接肠促胰岛素类似物多肽片段和长效载体的接头,在本发明一些具体实施例中,所述接头可以是-γglu-(-γ-谷氨酰-)。化学结构式如下所示的基团:
[0065][0066]
如上所述,本发明所提供的肠促胰岛素类似物c末端氨基酸可以被修饰,比如酰胺化。所述酰胺化通常指将c末端的-cooh基团转变为-conh2基团,例如式(i)中:x
40
为nh2。
[0067]
在本发明一些具体实施例中,所述肠促胰岛素类似物的具体序列如表1中seq id no:6所示。表1中,也呈现了该多肽片段和glucagon(seq id no:1,简称gcg)、glp-1(seq id no:3)以及gip(seq id no:4)的序列对比。
[0068]
表1
[0069][0070]
表1中,-γe-即-γglu(-γ-谷氨酰-),“γe-c16”表示棕榈酰基通过-γ-谷氨酰-接头缀合到赖氨酸的ε氮上。“2xoeg”表示2个-oeg-(-2-(2-(2-氨基乙氧基)乙氧基)乙酰-)相连。
[0071]
本发明还提供了所述肠促胰岛素类似物的制备方法,包括将所述的类胰高血糖素多肽与长链脂肪酸相连。
[0072]
所述制备方法可以包括:利用化学合成方法制备所述肠促胰岛素类似物;所述制备方法也可以包括:在合适的条件下培养合适的宿主细胞,使之表达所述肠促胰岛素类似物多肽片段,分离、纯化获得所述肠促胰岛素类似物多肽片段,再将所述长效载体化学交联至所述肠促胰岛素类似物多肽片段。本发明的肠促胰岛素类似物可通过标准肽合成方法进行制备,例如,通过标准固相或液相方法,逐步或通过片段组装,并分离和纯化最终的肠促胰岛素类似物多肽片段、肠促胰岛素类似物产物,或通过重组和合成方法任意组合。
[0073]
肠促胰岛素类似物的应用
[0074]
本发明还提供了所述肠促胰岛素类似物在制备用于治疗代谢性疾病、glp-1r/gipr/gcgr多效激动剂的药物中的用途。所述代谢性疾病具体可以选自糖尿病、肥胖、血脂失调、非酒精性脂肪肝病(nafld)/非酒精性脂肪肝炎(nash)、与糖尿病相关的其他代谢综合征,包括甘油三酯过高、低hdl胆固醇及高ldl胆固醇、胰岛素抗性、肥胖症或葡萄糖耐受不良等。
[0075]
本发明还提供了一种疾病的治疗方法,包括步骤:向个体施用本发明第一方面提供的肠促胰岛素类似物。在随机血糖检测试验中,施用了本发明肠促胰岛素类似物的糖尿病模型小鼠降糖效果和减重效果明显优于对照组样品。
[0076]
除了应用于疾病的预防、缓解或治疗方面,本发明的肠促胰岛素类似物还可被应
用于一些非治疗性的方面。根据本发明的实施例的部分结果可见,所述肠促胰岛素类似物能够非常显著地减少食物摄入、降低脂肪、降低体重或降低血糖。由此,对于一些身体尚没有疾病特征、但是有需要控制食物摄入、减少脂肪以及减重的受试者,本发明的肠促胰岛素类似物也是可被应用的。
[0077]
虽然在现有技术中,本领域已在研究开发具有多重激动活性的分子,但真正要获得一个理想的这类药物,实际上却是非常困难的。首先是安全性问题,特别是免疫原性问题。降糖减肥类药物需要长期使用,对安全性要求极高。为了设计获得一个具有高多重激动活性、并且体内稳定的多肽,现有的技术方案都往往都引入了较多的突变位点,并且经常引入非天然氨基酸及其他修饰。这些突变及非天然氨基酸的引入,都增加了潜在免疫原性的风险。而对于治疗糖尿病,肥胖这类疾病的药物,安全性是极其重要的。此外,对于glp-1,glucagon这类30个氨基酸长度左右的小肽,序列的改变对其活性变化是极其敏感的;而对于多重活性多肽,由于涉及对多个不同受体的激动,其变化就更加复杂,根本无法预测任何一个氨基酸改变后对受体激动活性会是什么样的后果。例如joseph chabenne等报道(joseph chabenne等,molecular metabolism,3:293-300,2014)在对gcg进行丙氨酸扫描(ala scan),gcg的各个位点独立地被丙氨酸取代后,相对残留活性保留跨度从0.2%-100%,并表示gcg的第1、2、3、4、6-12、14、15、22、23、25-27、29位突变都会使gcgr激动活性大幅减弱(文章中的表4)。然而从其他的报道中可以看到,在上述这些位点中取单个或若干个位点同时进行突变,用其他的氨基酸取代时,活性的变化并不总是与丙氨酸扫描的结果一致。如jonathan w day等(jonathan w day等,nature chemical biology,5:749-757,2009)报道,对gcg的16位进行16s
→
g、16s
→
t、16s
→
h、16s
→
e等不同突变,其gcgr激动活性反而是提高的,这与joseph chabenne的丙氨酸扫描结果完全矛盾。其次,joseph chabenne研究认为在23位用丙氨酸取代,将导致gcgr激动活性几乎完全丧失(仅保留1.1%);但是jonathan w day等将23位突变成ile,其gcg活性并没有下降。又比如丙氨酸扫描结果认为第二位s对保留gcg活性是非常重要的(突变为ala时活性仅保留了1/3),但是brian finan等报道(finan b等,nat med.2015;21:27-36.),对gcg第二位氨基酸分别进行2s
→
aib、2s
→
dser、2s
→
g、2s
→
dala替代突变,再组合其他位点的突变后,gcgr的相对激动活性反而提高为200%~640%。在本发明人的研究中也发现,把一些有利于提高glp-1,gcg或gip活性的突变组合引入时,很多时候其效果与单个位点突变时是完全不一致的。并且,glp-1、exendin-4、gcg或gip这类多肽,在n及c末端增加或减少氨基酸都会影响其生物学活性。如n端去掉一个或两个氨基酸,glp-1、gcg等的激动活性就会完全丧失。如oxyntomodulin只比glucagon的c末端多了krnrnnia这8个氨基酸,其gcgr激动活性就丧失了90%左右(alessandro pocai等,diabetes;58(10):2258-2266,2009;henderson sj等,diabetes obes metab,2016)。
[0078]
本发明所提供的肠促胰岛素类似物具有极高的glp-1r及gipr激动活性以及稍弱的gcgr激动活性,令人惊讶的是,肠促胰岛素类似物多肽在脂肪酸交联前后,体外活性更是具有显著的变化。
[0079]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离
本发明的精神下进行各种修饰或改变。
[0080]
组合物
[0081]
本发明还提供了一种组合物,其含有有效量的本发明所述的肠促胰岛素类似物以及载体;所述的载体为药学上、食品学上或保健品学上可接受的载体。所述的组合物包括但不限于:药物组合物、食物组合物或保健品组合物等。
[0082]
在本发明中,所述的药物组合物可以含有按照重量比例为0.01-95%(如0.1%,1%,5%,10%,20%,30%,50%,80%等)的所述的肠促胰岛素类似物。
[0083]
如本文所用,“药学上、食品学上或保健品学上可接受的”的成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质;如本领域常用的药物载体或赋形剂。
[0084]
如本文所用,“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的如本文所用。
[0085]
本发明所述的药物组合物的剂型可以是多种多样的,只要是能够使活性成分有效地到达哺乳动物机体的剂型都是可以的。比如可选自:凝胶剂、气雾剂、片剂、胶囊、粉末、颗粒、糖浆、溶液、或悬浮液。根据本发明的化合物所治疗的疾病类型,本领域人员可以选择方便应用的剂型。
[0086]
合适的药学上可接受的载体是本领域普通技术人员所熟知的。在remington’s pharmaceutical sciences(mack pub.co.,n.j.1991)中可找到关于药学上可接受的载体的充分说明。在组合物中药学上可接受的载体可含有液体,如水、磷酸盐缓冲液、ringer溶液、生理盐水、平衡盐溶液、甘油或山梨醇等。另外,这些载体中还可能存在辅助性的物质,如润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质和稳定剂,如白蛋白等。
[0087]
从易于制备和给药的立场看,优选的药物组合物是固态组合物,尤其是片剂和固体填充或液体填充的胶囊。本发明的化合物或其药物组合物也可储存在适宜于注射或滴注的消毒器具中。
[0088]
本发明所述的肠促胰岛素类似物作为活性成分的有效施用剂量可随给药的模式和待治疗的疾病的严重程度而变化,例如每天以约0.00001-10mg/kg体重的剂量给予。也可调整用药时间,例如涉及为缓释形式给药,可隔天或间隔若干天给一次药。可调节剂量方案以提供最佳治疗应答。
[0089]
所述的组合物应用于大动物和病人时,可按小动物使用剂量通过相应的专业换算公式,换算出大动物或人的有效使用剂量(包括固态或溶液态的剂量换算)。本发明的具体实施例中,给出了一些针对动物如鼠的给药方案。从动物如鼠的给药剂量换算为适用于人类的给药剂量是本领域技术人员易于作出的,例如可根据meeh-rubner公式来进行计算:meeh-rubner公式:a=k
×
(w2/3)/10,000。式中a为体表面积,以m2计算;w为体重,以g计算;k为常数,随动物种类而不同,一般而言,小鼠和大鼠9.1,豚鼠9.8,兔10.1,猫9.9,狗11.2,猴11.8,人10.6。应理解,根据药物以及临床情形的不同,根据有经验的药师的评估,给药剂量的换算是可以变化的。
[0090]
本发明还提供了一种药盒或试剂盒,其中包括:所述的肠促胰岛素类似物;或所述的药物组合物。为了便于临床应用,本发明的药盒或试剂盒中,还可包含其它辅助配件,例如注射器等。所述药盒或试剂盒中,还可包括使用说明书,以利于本领域技术人员按照正确
的方式使用。
[0091]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
[0092]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0093]
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecular cloning:a laboratory manual,second edition,cold spring harbor laboratory press,1989and third edition,2001;ausubel等,current protocols in molecular biology,john wiley&sons,new york,1987and periodic updates;the series methods in enzymology,academic press,san diego;wolffe,chromatin structure and function,third edition,academic press,san diego,1998;methods in enzymology,vol.304,chromatin(p.m.wassarman and a.p.wolffe,eds.),academic press,san diego,1999;和methods in molecular biology,vol.119,chromatin protocols(p.b.becker,ed.)humana press,totowa,1999等。
[0094]
实施例中所涉及的缩写含义具体如下:
[0095]
rt:室温;
[0096]
dmf:n,n-二甲基甲酰胺;
[0097]
fmoc:9h-芴-9-基甲氧基羰基;
[0098]
trt:三苯甲基;
[0099]
boc:叔丁氧羰基;
[0100]
hobt:1-羟基苯并三唑;
[0101]
tbu:叔丁基;
[0102]
dcm:二氯甲烷;
[0103]
dblk:20%n,n-二甲基甲酰胺哌啶;
[0104]
dic:n,n
’-
二异丙基碳二亚胺;
[0105]
meoh:甲醇;
[0106]
tfa:三氟乙酸;
[0107]
fmoc-lys(pal-glu-otbu)-oh:n
α-芴甲氧羰基-(n
ε
–
(γ-谷氨酰基(n
α-十六烷基,α-叔丁酯)))赖氨酸;
[0108]-γe-:-γ-谷氨酰-;
[0109]-oeg-:-2-(2-(2-氨基乙氧基)乙氧基)乙酰-[0110]
diea:n,n-二异丙基乙胺;
[0129]
x
10
=k(棕榈酰基-γe)。fmoc-ser(tbu)-rink amide mbha树脂的合成:
[0130]
称取替代度为0.38mmol/g的rink amide mbha树脂(天津南开和成科技有限公司)2.65g,加入到固相反应柱中,加入10ml dcm溶胀树脂30分钟后,用dmf洗涤3次,每次10ml。往反应柱中加入15ml dblk溶液,反应5分钟,抽滤,用20ml dmf洗涤一次,再加入15ml dblk溶液,反应10分钟,kaiser检测为阳性。抽滤,用dmf洗涤3次,每次20ml。
[0131]
另取1.91g fmoc-ser(tbu)-oh和0.81g hobt用10mldmf溶解,5~8℃下加入0.69g dic活化5min后,加入上述装有树脂的反应柱中,反应2小时。kaiser检测为阴性后,直接用于下步肽树脂的合成。
[0132]
肽树脂的合成:
[0133]
称取上述树脂fmoc-ser(tbu)-rink amide mbha树脂(1.0mmol),加入反应柱中用20ml dcm溶胀30分钟后,用dmf洗涤3次,每次20ml。洗涤完成后,往反应柱中加入10ml dblk溶液(20%哌啶/dmf(v/v)),反应5分钟,抽滤,用20ml dmf洗涤一次,再加入10ml dblk溶液(20%哌啶/dmf(v/v)),反应10分钟,kaiser检测为阳性。抽滤,用dmf洗涤3次,每次20ml。另取fmoc-pro-oh(1.69g,5.0eq)、hobt(0.81g,6.0eq)加入10ml dmf中溶解,5-8℃下加入dic(0.69g,5.5eq)活化5min后,加入反应柱中,反应1小时,kaiser检测为阴性,反应完全,用dmf洗涤3次,每次20ml。重复上述去保护和偶联操作,根据肽的序列依次完成其他氨基酸的偶联,其中x
10
采用fmoc-lys(pal-glu-otbu)-oh(成都郑源生化科技有限公司)进行偶联。最后一个氨基酸偶联完成后,按上述去保护方法去保护,去保护完全后依次dmf洗涤2次,meoh洗涤2次、dcm洗2次和meoh洗涤2次,每次洗涤溶剂为20ml。收料、常温减压干燥得到目标肽树脂。
[0134]
粗肽的切割:
[0135]
称取上述肽树脂5.02g,20-30℃缓慢加入至60ml裂解液(三氟乙酸:苯甲硫醚:苯甲醚:乙二硫醇=90:5:3:2)中,加毕反应2小时。反应完成后,过滤除去树脂,剧烈搅拌下,将滤液倒入事先预冷的甲叔醚(600ml)中,得到的混合溶液放置冰箱沉降2小时。除去上清液,用预冷的甲叔醚离心洗涤5次,每次400ml。完成后收料,常温减压干燥得到粗肽2.23g。
[0136]
粗肽的纯化:
[0137]
使用制备液相(北京创新通恒,lc3000),经多步纯化对粗肽进行精制:第一步:固定相:c18(daisogel:sp-120-40/60-c18-rps),流动相0.1%tfa,乙腈;第二步:固定相:c8(daisogel:sp-120-10-c8-p),流动相:0.5%磷酸,乙腈,第三步:固定相:c8(daisogel:sp-120-10-c8-p),流动相:50mm乙酸铵、0.3%醋酸,乙腈,最后冻干(冻干机北京博医康,fd-2a)得到精肽(98.0%)。最后采用ms对精肽测定精确分子量:m/z4455.69(m h)
。ms如图1所示。
[0138]
2、胰高血糖素衍生物p5yelan的制备
[0139]
胰高血糖素衍生物p5yelan的结构式如下:
[0140]
[0141]
即:ysegt ftsdx
10 skyld sqaaq dfvqw llagg pssga ppps-nh2 x
10
=k(((十八烷二酸单酰基)-γe)-2xoeg)
[0142]
固相法合成带支链的保护氨基酸w1:alloc-lys((octadecanedioic acid mono-tert-butylester)-glu-otbu)-oeg-oeg)-oh,结构如下:
[0143][0144]
w1的合成:
[0145]
称取取代度为1.0mmol/g的2-ctc树脂20g,加入到固相反应柱中,加入到固相反应柱中,用dmf洗涤1次,用dmf溶胀树脂30分钟后,取8.53g alloc-lys(fmoc)-oh(20mmol)用dmf溶解,冰水浴下加入7.5ml diea(45mmol)活化后,加入上述装有树脂的反应柱中,反应2小时后,加入30ml无水甲醇封闭1小时,用dmf洗涤3次。用dmf:吡啶体积比为4:1的混合溶液脱去fmoc保护,然后用dmf洗涤6次,称取15.42g[2-[2-(fmoc-氨基)乙氧基]乙氧基]乙酸、5.41g hobt加入dmf溶解,冰水浴下加入6.2ml dic活化后,加入上述装有树脂的反应柱中,室温下反应2小时。重复上述脱除fmoc保护和加入相应物料偶联的步骤,按照支链片段顺序,依次完成[2-[2-(fmoc-氨基)乙氧基]乙氧基]乙酸、fmoc-glu-otbu、十八烷二酸单叔丁酯。偶联完毕,将树脂用dmf洗涤3次,meoh洗涤5次,抽干。将树脂加入400ml tfea/dcm=1:4中室温下反应4h。过滤树脂后,滤液旋除dcm,将其加入500mlmtbe中沉降,离心干燥后得到目标化合物19.43g,m/z 1242.51(m h)
。
[0146]
多肽的合成同p3yelan,x
10
采用w1进行偶联,并采用pd(pph3)4脱除alloc基团。得到到的粗肽采用rp-hplc进行纯化,最后冻干得到精肽(96.5%)。ms对精肽进行精确分子量测定:m/z 4804.13(m h)
。
[0147]
3、胰高血糖素衍生物p9yelan的制备:
[0148]
胰高血糖素衍生物p9yelan的结构式如下:
[0149][0150]
即:ysegt ftsdx
10 skyld sqaaq dfvqw llagg pssga ppps-nh
2 x
10
=k(((二十烷二酸单酰基)-γe)-2xoeg)
[0151]
带支链的保护氨基酸合成同p5yelan,先固相法合成带支链的保护氨基酸w2:alloc-lys((eicosanedioic acid mono-tert-butylester)-glu-otbu)-oeg-oeg)-oh(其中脂肪酸偶联采用二十烷二酸单叔丁酯),结构如下:
[0152]
[0153]
再进行多肽合成,多肽合成同p3yelan,其中x
10
采用w2进行偶联,并采用pd(pph3)4脱除alloc基团。得到的粗肽采用rp-hplc进行纯化得到精肽(97.1%)。ms对精肽测定精确分子量:m/z 4832.50(m h)
。
[0154]
实施例2、体外细胞学活性测定
[0155]
(一)glp-1r激动活性测定
[0156]
glp-1r激动活性检测采用荧光素酶报告基因检测法(jonathan w day等:nat chem biol.2009oct;5(10):749-57)。将人源glp-1r基因克隆至哺乳动物细胞表达质粒pcdna3.1中,构建成重组表达质粒pcdna3.1-glp-1r,同时荧光素酶(luciferase)全长基因克隆至pcre质粒得到pcre-luc重组质粒。pcdna3.1-glp-1r和pcre-luc质粒按摩尔比1:10的比例转染cho-k1细胞,筛选稳转表达株。
[0157]
在9-cm细胞培养皿中用含10%fbs和300μg/ml g418的dmem/f12培养基培养细胞,等汇合度至90%左右时,弃去培养上清,加入2ml胰酶消化3min后,加入2ml含10%fbs和300μg/ml g418的dmem/f12培养基中和,转移至15ml离心管中,1000rpm离心5min后,弃去上清,加入2ml含10%fbs和300μg/ml g418的dmem/f12培养基重悬,计数。用含10%fbs的dmem/f12培养基稀释细胞至1
×
105/ml,96孔板中每孔铺100μl,即1
×
104/孔,贴壁后换成含0.2%fbs的dmem/f12培养基培养。铺在96孔板的细胞弃去上清后,将纯化的胰高血糖素衍生物(阳性对照组:杜拉鲁肽(dulaglutide,商品名))用含1%bsa的dmem/f12培养基稀释至一系列指定浓度,加入到细胞培养孔中,100μl/孔,刺激6h后检测。根据lucifersae reporter kit(ray biotech,cat:68-lucir-s200)说明书进行检测。每个样品的测活重复3次。
[0158]
(二)gipr激动活性检测方法
[0159]
gipr激动活性检测同样也采用荧光素酶报告基因检测法。将人源gipr基因克隆至哺乳动物细胞表达质粒pcdna3.1中,构建成重组表达质粒pcdna3.1-gipr,转染cho-k1,稳转细胞株的筛选构建同上。测活步骤同上(阳性对照组:天然人源gip肽),每个样品的测活重复3次。
[0160]
(三)gcgr激动活性检测方法
[0161]
gcgr激动活性检测同样也采用荧光素酶报告基因检测法。将人源gcgr基因克隆至哺乳动物细胞表达质粒pcdna3.1中,构建成重组表达质粒pcdna3.1-gcgr,转染cho-k1,稳转细胞株的筛选构建同上。测活步骤同上(阳性对照组:天然人源gcg肽),每个样品的测活重复3次。
[0162]
(四)测活结果
[0163]
图2、3、4分别为glp-1r、gipr和gcgr的激动活性结果图,具体ec50如表3所示。
[0164]
表3
[0165][0166]
上述结果说明,本发明的p3yelan具有很高的glp-1r及gipr激动活性,同时也具有显著的gcgr激动活性。但是,具有相同肽序列的p5yelan和p9yelan由于连接的脂肪酸链不同,细胞激动活性大幅下降。
[0167]
实施例3、血清稳定性
[0168]
本实施例中,采用如下的步骤测定肠促胰岛素类似物p3yelan的血清稳定性:
[0169]
(1)肠促胰岛素类似物p3yelan、yelan及对照品(dulaglutide)用5mm tris-hcl,ph8.5,0.02%tween-80溶液配制成浓度为1.0mg/ml的溶液,除菌过滤(0.22μm,millipore slgp033rb)后,用大鼠血清稀释10倍,混匀,分装到无菌离心管中;
[0170]
(2)上述样品各取3管于-20℃冻存作为对照,其余置37℃恒温箱,于0小时、12小时、24小时及72小时取样检测活性;
[0171]
(3)检测glp-1r激动活性。相对活性:以0小时的活性值为100%,后续时间点测得的值与之相比而获得。
[0172]
图5为肠促胰岛素类似物p3yelan随着时间变化的活性残留结果。结果显示,与yelan及dulaglutide相比,p3yelan在很长的时间内保持更高的glp-1r激动活性。
[0173]
实施例4、db/db小鼠给药后随机血糖检测
[0174]
瘦素受体缺陷二型糖尿病(db/db)小鼠中的降糖实验。db/db小鼠主要按照体重、非空腹血糖,药前ogtt反应三个指标进行筛选并均衡分组,每组6只,排除过大或者过小的个体,非空腹血糖要大于15mm。p3yelan溶解于50mm磷酸盐缓冲液(ph 7.4),5%山梨醇,0.02%v/v tween-80,皮下注射杜拉鲁肽或p3yelan(多次给药),杜拉鲁肽剂量为10nmol/kg/4d,p3yelan采用低(1nmol/kg/d)、中(3nmol/kg/d)、高剂量(6nmol/kg/d)。day0-day4每天监测所有动物随机血糖,后续每4天测量一次随机血糖,测量日期安排在day6、10、14、18、22、26、30、34。
[0175]
血糖变化趋势如图6所示。结果显示,给药剂量在3nmol/kg/d或者6nmol/kg/d时,给予p3yelan的受试动物的血糖水平远低于杜拉鲁肽(10nmol/kg/4d)。
[0176]
实施例5、饮食诱导肥胖(dio)小鼠中的减重实验
[0177]
dio鼠模型的制备:约7周龄雄性c57bl/6j雄性小鼠给予高脂饲料(60%kcal from fat)继续饲养约16周(共23周),到体重约为45g时进行试验。dio小鼠随机分为组,每组6只,基础体重无差异,每天称重。皮下注射p3yelan、利拉鲁肽或pbs。利拉鲁肽(liraglutide)给药剂量为40nmol/kg/d;胰高血糖素衍生物采用低(5nmol/kg/d),高剂量(20nmol/kg/d)。首
次给药日开始称量体重,并持续到实验结束day30,每天记录食物摄取和称重,保持一致。实验结束以后,检测血脂以及空腹血糖。day28晚上禁食,day29测空腹血糖。
[0178]
受试动物体重变化的测定结果如图7,结果显示三个剂量组的p3yelan均能显著地降低受试动物的体重,其降低体重的效果优于利拉鲁肽。
[0179]
受试动物的摄食测定结果如图8,结果显示三个剂量组的p3yelan均能显著地降低受试动物的食物摄入量,其降低食物摄入量的效果优于利拉鲁肽。
[0180]
受试动物的空腹血糖测定结果如图9,结果显示三个剂量组的p3yelan均能显著地降低受试动物的空腹血糖,其降低空腹血糖的效果优于利拉鲁肽。
[0181]
综上所述,本发明的p3yelan肽有效克服了现有技术中的一些技术缺陷,具有良好的产业应用价值。
[0182]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

