1.本发明涉及生物技术领域,特别是涉及一种融合蛋白及其制备方法和用途,所述融合蛋白可以用于治疗眼部血管新生疾病,且具有显著延长的半衰期。
背景技术:
2.血管新生,一种从原有血管组织中形成新血管组织的生理过程,在发育和疾病的过程中,起着重要的作用。一些严重的眼部病变,比如湿性老年性黄斑变性、视网膜静脉阻塞、增殖性的糖尿病引发的黄斑水肿,它们的发生机制与血管新生密切相关。以湿性的老年性黄斑变性(wet amd)为例,随着年龄的增大,脉络膜清除衰老、死亡的细胞的能力减弱,残留的细胞碎片在黄斑附近的视网膜和脉络膜之间瘀集,形成玻璃疣,影响眼部供血,进而引起刺激产生炎症反应和血管新生。因为受到缺氧压力的影响,这种异常的血管新生产生的新的血管壁非常脆弱,且极易渗透,这会导致眼球体液流失和出血。
3.随着人口的老龄化,眼部抗血管新生的治疗需求非常迫切,但有效的治疗手段比较少。仍以湿性amd为例,若3年内无法及时治疗,致盲率将从近20%升至75%。目前我国湿性amd患者接近50万,每年新增患者约4万人。目前治疗湿性amd,主要有激光凝固法、光动力学疗法、玻璃体切除手术、抗血管新生化药的注射、抗血管新生多肽或蛋白的注射以及干细胞/rna干扰的注射。
4.新生血管抑制类产品,尤其是多靶点联合抑制剂是目前国内外眼科临床上的热点。
5.vegf(血管内皮生长因子),是一种在血管再生、血管新生、内皮细胞生长等过程中具有活性的生长因子。对于内皮细胞,它可以诱导增殖,促进迁移,抑制凋亡,以及增加血管通透性。vegf有a、b、c、d四种亚型,它的受体vegfr有3种,属于酪氨酸激酶。其中,a、b亚型可以结合vegfr1(flt1),a、c、d亚型可以结合vegfr2(kdr),c、d亚型可以结合vegfr3(flt4)。vegf结合受体后,受体通过同二聚或异二聚以激活下游信号通路,并实现上述的生理功能。vegf-a是单抗类药物的主要靶点,在血管内皮细胞和外周血单核细胞中特异性表达。它有多种异构体:vegf-a 121可自由分泌;vegf-a 165可结合肝素,有相当一部分可结合细胞,不过大部分可自由分泌;vegf-a 189分泌后可结合细胞,与肝素和细胞外基质的结合力强,它也可以通过肝素、肝素酶、纤溶酶,以可溶形式释放。另外,还有vegf-a 206和vegf-a 145,表达比较少。
6.目前上市的用于治疗上述眼底疾病的重组融合蛋白或抗体类药物(bevacizumab、ranibizumab、aflibercept、conbercept(只在中国上市)和brolucizumab)都是抗vegf类药物,需要通过玻璃体直接注射给药,平均给药周期为1-3个月。玻璃体穿刺注射,不仅操作复杂,而且打破了眼球原来完全封闭的结构,每次注射都有一定的感染风险,因此这种给药方式给患者和医师带来了不小的挑战。同样的疗效下,怎样实现注射次数更少,使患者有更好的依从性是目前的研发关键,例如,如果将给药周期延长至4-6个月甚至更长,情况将会得到显著改善。
技术实现要素:
7.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种半衰期显著延长的治疗眼部血管新生疾病的融合蛋白及其制备方法和用途,用于解决现有技术中的问题。
8.为实现上述目的及其他相关目的,本发明一方面提供一种融合蛋白,所述融合蛋白包括亲水性重复序列片段、拮抗vegf片段、免疫球蛋白fc片段。
9.在本发明一些实施方式中,所述亲水性重复序列片段选自类明胶蛋白片段、或多肽复合单元片段。
10.在本发明一些实施方式中,所述亲水性重复序列片段包括:
11.a)氨基酸序列如seq id no.28~29其中之一所示的多肽片段;
12.或,b)氨基酸序列与seq id no.28~29其中之一具有90%以上序列一致性且具有a)限定的多肽片段的功能的多肽片段;或,
13.c)氨基酸序列如seq id no.30所示的多肽片段;
14.或,d)氨基酸序列与seq id no.30具有90%以上序列一致性且具有c)限定的多肽片段的功能的多肽片段。
15.在本发明一些实施方式中,所述拮抗vegf片段包括:
16.e)氨基酸序列如seq id no.1~7其中之一所示的多肽片段;或,
17.f)氨基酸序列与seq id no.1~7其中之一具有90%以上序列一致性且具有e)限定的多肽片段的功能的多肽片段。
18.在本发明一些实施方式中,所述免疫球蛋白fc片段包括:
19.g)氨基酸序列如seq id no.33~41其中之一所示的多肽片段;或,
20.h)氨基酸序列与seq id no.33~41其中之一具有90%以上序列一致性且具有g)限定的多肽片段的功能的多肽片段;
21.所述免疫球蛋白fc片段为人源的。
22.在本发明一些实施方式中,所述融合蛋白还包括连接肽片段,优选的,所述连接肽片段富含g、s和/或a。
23.在本发明一些实施方式中,所述连接肽片段包括氨基酸序列如seq id no.42-43其中之一所示的多肽片段。
24.在本发明一些实施方式中,所述融合蛋白还包括拮抗ang片段,所述拮抗ang片段选自拮抗ang-1片段、或拮抗ang-2片段。
25.在本发明一些实施方式中,所述亲水性重复序列片段位于融合蛋白的n端和/或c端,所述拮抗vegf片段位于免疫球蛋白fc片段的n端或c端;
26.在本发明一些实施方式中,拮抗vegf片段、或拮抗ang片段独立地位于免疫球蛋白fc片段的n端或c端,优选的,拮抗vegf片段、拮抗ang片段分别位于免疫球蛋白fc片段的n端和c端。
27.在本发明一些实施方式中,所述融合蛋白的氨基酸序列包括seq id no.11-12、seq id no.15-16、seq id no.18-19其中之一所示的序列;
28.或,所述融合蛋白的氨基酸序列包括seq id no.20和seq id no.21所示的序列、seq id no.22和seq id no.24所示的序列、seq id no.23和seq id no.24所示的序列、seq id no.25和seq id no.7所示的序列、或seq id no.26和seq id no.27所示的序列。
29.本发明另一方面提供一种分离的多核苷酸,编码所述的融合蛋白。
30.本发明另一方面提供一种构建体,所述构建体含有所述的分离的多核苷酸。
31.本发明另一方面提供一种表达系统,所述表达系统含有所述的构建体或基因组中整合有外源的所述的多核苷酸。
32.本发明另一方面提供所述的融合蛋白的制备方法,包括:在合适的条件下培养所述的表达系统,使之表达所述融合蛋白,分离、纯化以提供所述融合蛋白。
33.本发明另一方面提供一种药物组合物,包括所述的融合蛋白或所述的表达系统的培养物。
34.本发明另一方面提供所述的融合蛋白、所述的药物组合物在制备药物中的用途。
35.在本发明一些实施方式中,所述药物选自用于眼部血管新生相关疾病的药物。
附图说明
36.图1a显示为本发明实施例6组别1在新西兰大白兔玻璃体内的药代动力学结果示意图。
37.图1b显示为本发明实施例6组别2在新西兰大白兔玻璃体内的药代动力学结果示意图。
38.图1c显示为本发明实施例6组别3在新西兰大白兔玻璃体内的药代动力学结果示意图。
39.图1d显示为本发明实施例6组别4在新西兰大白兔玻璃体内的药代动力学结果示意图。
40.图2显示为本发明实施例7中各组别4级光斑平均渗漏面积改善率示意图。
41.图3显示为本发明实施例7中各组别视网膜下高反射信号物质(shrm)平均厚度改善率示意图。
42.图4显示为本发明实施例7中dr301abb4对光斑率及渗漏面积改善情况示意图。
具体实施方式
43.本发明发明人经过大量探索研究,意外发现亲水性重复序列片段、拮抗vegf片段、免疫球蛋白fc片段所构成的融合蛋白,通过玻璃体注射给药,在血清中具有更短的半衰期,而在玻璃体中则表现出良好的半衰期,从而使得融合蛋白具有更佳的靶向性,具有良好的产业化前景,在此基础上完成了本发明。
44.本发明第一方面提供一种融合蛋白,所述融合蛋白包括亲水性重复序列片段、拮抗vegf片段、免疫球蛋白fc片段。本发明所提供的融合蛋白通常指通过dna重组技术得到的多个基因重组后的表达产物。所述融合蛋白可以是线性的,其所包括的拮抗vegf片段则可以是线性的结构域;所述融合蛋白也可以是单克隆抗体类似的结构,其所包括的拮抗vegf片段也则可以来自单克隆抗体的fab区域(由轻链和fd链组成)。在本发明中,当拮抗vegf片段为线性结构域时,所述融合蛋白也是线性的,从而可以包括多个结构域片段,并可以通过免疫球蛋白fc片段形成二聚体,并可以在形成的二聚体的n或c端包括有亲水性重复序列片段,以形成包括亲水性重复序列片段、拮抗vegf片段、免疫球蛋白fc片段的融合蛋白。当所述的拮抗vegf片段来自单克隆抗体的fab区域时,即所述融合蛋白具有类似单克隆抗体的
结构时,可以通过fd链与免疫球蛋白fc片段融合形成二聚体,即所述融合蛋白具有单克隆抗体类似的结构,并可以在该结构的基础上进一步融合亲水性重复序列片段,例如融合在单克隆抗体类似结构的轻链或重链两端(n或c端),以形成包括亲水性重复序列片段、拮抗vegf片段、免疫球蛋白fc片段的融合蛋白。
45.本发明所提供的融合蛋白中,可以包括亲水性重复序列片段,所述亲水性重复序列片段通常不含丝氨酸(s)和苏氨酸(t),在原核或真核表达系统的制备过程中,均不会出现糖基化的问题。另外,由于asn(n)及gln(q)的脱酰胺化造成的不均一现象以及由于氨基酸种类较多导致的潜在蛋白酶位点增多而引起的产物不均一等问题,在本发明所提供的亲水性重复序列片段中均不会出现。
46.本发明所提供的融合蛋白中,所述亲水性重复序列可以为类明胶蛋白片段。所述类明胶蛋白片段通常主要由甘氨酸(g)、脯氨酸(p)、丙氨酸(a)和谷氨酸(e)组成,并具有明胶特征性的g-x-y三元单体(triplet)的结构,其中g代表甘氨酸(g),x和y分别独立地选自脯氨酸(p)、丙氨酸(a)或谷氨酸(e)。通常来说,所述类明胶蛋白片段如果分子量太大,重组表达制备困难,相反,分子量太小起不到显著延长半衰期的作用。优选的,所述类明胶蛋白片段的氨基酸长度可以为100-500;更优选的,所述类明胶蛋白片段的氨基酸长度可以为150-500;进一步优选的,所述类明胶蛋白片段的氨基酸长度可以为200-400。在本发明一具体实施例中,所述亲水性重复序列片段包括:
47.a)氨基酸序列如seq id no.28~29其中之一所示的多肽片段;
48.b)氨基酸序列与seq id no.28~29其中之一具有90%以上序列一致性且具有a)限定的多肽片段的功能的多肽片段。具体的,所述b)中的氨基酸序列具体指:如seq id no.28~29其中之一所示的氨基酸序列经过取代、缺失或者添加一个或多个(具体可以是1-50、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,或者在n-末端和/或c-末端添加一个或多个(具体可以是1-50个、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,且具有氨基酸如seq id no.28~29其中之一所示的多肽片段的功能的多肽片段,例如,所述亲水性重复序列通常具有较高的高亲水性,可以显著增大蛋白水合半径及表观分子量,在玻璃体给药后,更大的表观分子量可以支持了更长的眼内半衰期,减少给药次数。所述b)中的氨基酸序列可与seq id no.28~29其中之一具有90%、93%、95%、97%、或99%以上的一致性(sequence identity)。
49.本文中,序列一致性(sequence identity)指参与对比的序列中相同残基的百分比。可采用本领域周知的计算软件计算两条或多条目的序列的序列一致性,这些软件可获自如ncbi。
50.本发明所提供的融合蛋白中,所述亲水性重复序列可以为多肽复合单元片段。所述多肽复合单元片段通常是一类由脯氨酸(p)、丙氨酸(a)和谷氨酸(e)三种氨基酸构成的柔性多肽或者蛋白,例如,可以是包括一个或多个氨基酸序列如seq id no.31或seq id no.32所示的多肽单元的多肽片段。通常来说,所述多肽复合单元片段需要具有合适的分子量,如果分子量太大,重组表达制备困难,相反,分子量太小则无法显著增大表观分子量并延长半衰期。优选的,所述多肽复合单元片段的氨基酸长度可以为100-500;更优选的,所述多肽复合单元片段的氨基酸长度可以为150-500;进一步优选的,所述多肽复合单元片段的氨基酸长度可以为200-400。在本发明一具体实施例中,所述多肽复合单元片段包括:
51.c)氨基酸序列如seq id no.30所示的多肽片段;
52.d)氨基酸序列与seq id no.30具有90%以上序列一致性且具有c)限定的多肽片段的功能的多肽片段。具体的,所述d)中的氨基酸序列具体指:如seq id no.30所示的氨基酸序列经过取代、缺失或者添加一个或多个(具体可以是1-50、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,或者在n-末端和/或c-末端添加一个或多个(具体可以是1-50个、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,且具有氨基酸如seq id no.30所示的多肽片段的功能的多肽片段,例如,可以增大蛋白的水合半径。所述d)中的氨基酸序列可与seq id no.30具有90%、93%、95%、97%、或99%以上的一致性(sequence identity)。
53.本发明所提供的融合蛋白中,可以包括拮抗vegf片段。所述拮抗vegf片段通常可以是能够拮抗vegf的多肽或蛋白片段,例如,所述拮抗vegf片段可以是vegfr的胞外区(例如,aflibercept和conbercept);具有拮抗vegf功能的结构域蛋白,包括但不限于:darpin、anticalin、scfv(例如,brolucizumab等)、fab(例如,ranibizumab等)、单域抗体等。在本发明一具体实施例中,所述拮抗vegf片段可以包括:
54.e)氨基酸序列如seq id no.1~7其中之一所示的多肽片段;
55.f)氨基酸序列与seq id no.1~7其中之一具有90%以上序列一致性且具有e)限定的多肽片段的功能的多肽片段。具体的,所述f)中的氨基酸序列具体指:如seq id no.1~7其中之一所示的氨基酸序列经过取代、缺失或者添加一个或多个(具体可以是1-50、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,或者在n-末端和/或c-末端添加一个或多个(具体可以是1-50个、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,且具有氨基酸如seq id no.1~7其中之一所示的多肽片段的功能的多肽片段,例如,可以拮抗vegf。所述f)中的氨基酸序列可与seq id no.1~7其中之一具有90%、93%、95%、97%、或99%以上的一致性(sequence identity)。所述拮抗vegf片段通常是人源的。
56.本发明所提供的融合蛋白中,可以包括免疫球蛋白fc片段。所述免疫球蛋白fc片段通常是免疫球蛋白的重链恒定区或其中的一部分,无抗原结合活性,是抗体分子与效应分子和细胞相互作用的部位。例如,所述免疫球蛋白fc片段可以包括igg1的一个ch2结构域、一个ch3结构域和一个免疫球蛋白铰链区,铰链区起始氨基酸位置对于本领域技术人员来说是可以调整的。在本发明一具体实施例中,所述免疫球蛋白fc片段可以包括:
57.g)氨基酸序列如seq id no.33~41其中之一所示的多肽片段;
58.h)氨基酸序列与seq id no.33~41其中之一具有90%以上序列一致性且具有g)限定的多肽片段的功能的多肽片段。具体的,所述h)中的氨基酸序列具体指:如seq id no.33~41其中之一所示的氨基酸序列经过取代、缺失或者添加一个或多个(具体可以是1-50、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,或者在n-末端和/或c-末端添加一个或多个(具体可以是1-50个、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,且具有氨基酸如seq id no.33~41其中之一所示的多肽片段的功能的多肽片段,例如,可以使得抗体天然会形成二聚体,从而可以形成二价以提高蛋白活性,并可以通过fc与通过fcrn结合的机制使得抗体的半衰期被有效提升。所述h)中的氨基酸序列可与seq id no.33~41其中之一具有90%、93%、95%、97%、或99%以上的
一致性(sequence identity)。所述免疫球蛋白fc片段通常是人源的。
59.本发明所提供的融合蛋白中,还可以包括连接肽片段。所述融合蛋白中,通常可以包括多个连接肽片段,例如,至少部分的结构域或各结构域之间均可以设有连接肽片段。所述连接肽片段通常可以为一段长度合适的由甘氨酸(g)、丝氨酸(s)和/或丙氨酸(a)构成的柔性多肽,从而使相邻的蛋白质结构域可相对于彼此自由移动,例如,所述连接肽片段的氨基酸序列可以包括如(gs)n、(ggs)n、(ggsg)n、(gggs)na、(ggggs)na、(gggga)na、(ggggg)na等序列,其中,n选自1-10之间的整数。在本发明一具体实施例中,所述连接肽片段的氨基酸序列的长度可以为5-26。在本发明一更优选的具体实施例中,所述连接肽片段可以包括氨基酸序列如seq id no.42-43其中之一所示的多肽片段。
60.本发明所提供的融合蛋白中,当所述融合蛋白是线性的,所述亲水性重复序列片段可以独立或同时位于融合蛋白的n端和/或c端,所述拮抗vegf片段可以位于免疫球蛋白fc片段的n端或c端。当所述的拮抗vegf片段来自单克隆抗体的fab区域时,即所述融合蛋白具有单克隆抗体类似的结构时,所述亲水性重复序列片段可以融合于抗体的合适位置,例如,可以独立或同时位于fab区轻链的n端和/或c端、fab区fd链的n端、或者位于免疫球蛋白fc片段的c端。在本发明一具体实施例中,所述融合蛋白的氨基酸序列可以包括seq id no.11-12、seq id no.15-16、seq id no.18-19其中之一所示的序列;或,所述融合蛋白的氨基酸序列可以包括seq id no.20和seq id no.21所示的序列、seq id no.22和seq id no.24所示的序列、seq id no.23和seq id no.24所示的序列、seq id no.25和seq id no.7所示的序列、或seq id no.26和seq id no.27所示的序列。
61.本发明所提供的融合蛋白与未融合亲水性重复序列的蛋白相比,表观分子量显著增大,尤其是当亲水性重复序列分别与双价的拮抗vegf的多肽或蛋白结构域融合时,形成的复合物表观分子量极大。在本发明一具体实施例中,通过dls结果可知,包括亲水性重复序列片段的融合蛋白比未融合亲水性重复序列的融合蛋白表观分子量显著增大。理论上,包括亲水性重复序列片段的融合蛋白在血清中的半衰期应该具有叠加效应,例如,如果将aflibercept和亲水性重复序列融合,fc能通过结合外周单核细胞或内皮细胞表面的fcrn而减少降解,亲水性重复序列会引起水合半径增大(减少肾小球过滤),应该会获得血清半衰期远比aflibercept长的复合物。然而,本发明人意外发现,在aflibercept的n端融合亲水性重复序列片段以后(seq id no.16),反而影响了aflibercept的血清半衰期,说明亲水性重复序列片段与免疫球蛋白fc片段的组合,并不会进一步延长fc融合蛋白或抗体的半衰期,反而可能影响了fc与fcrn的结合,加速代谢。但是,令人意想不到的是,当把包括亲水性重复序列片段和aflibercept的融合蛋白(seq id no.16)注射到动物玻璃体内时,半衰期却远比单独的aflibercept长得多,而该融合蛋白在血清中半衰期缩短,则有利于在血清中的快速清除。
62.已有研究显示,抑制新生血管类药物用来治疗眼底新生血管增生类疾病,其作用部位在视网膜下的脉络膜血管层(choriocapillaris)和布鲁赫膜(bruch’s membrane),因此药物需要有效到达这些部位,才能发挥其药效。已有研究显示,跟分子量较小的fab(约50kd)相比,分子量较大的完整抗体(约150kd)并不能有效穿过视网膜,到达起效部位(mordenti,j.等,toxicologic pathology,1999,27(5),536
–
544.)。但是令人惊讶的是,按本发明所提供的融合蛋白,即使表观分子量高达500kd,玻璃体注射后仍然体现了很好的抑
制新生血管的生长。
63.同样地,在本发明的另一具体实施例中,当拮抗vegf片段为ranibizumab时,在其轻链n端和c端分别融合所述亲水性重复序列,形成的融合蛋白在血清中的半衰期不但没有进一步延长,反而明显缩短,而在玻璃体中的半衰期却大大延长了。
64.本发明所提供的融合蛋白中,还可以包括拮抗angiopoietin(血管生成素,ang)片段,所述拮抗ang片段可以与拮抗vegf片段形成靶向vegf/ang-1/2的双特异性融合蛋白。所述拮抗ang片段可以是拮抗ang-1(血管生成素1)片段、或拮抗ang-2(血管生成素2)片段。所述拮抗ang-1片段可以是能够拮抗ang-1的多肽或蛋白结构域,所述拮抗ang-2片段可以是能够拮抗ang-2的多肽或蛋白结构域。ang-2可以在血管新生以及内皮细胞的生存、增殖、迁移、黏附、骨架重构等方面起到调节作用,同时能够维持血管稳定性。ang-2结合受体tek/tie2,通过诱导同二聚化激活酪氨酸激酶活性。ang-1在胚胎发育过程中,为血管新生和心脏发育所必须,在不同条件下,激活或抑制血管新生,调节血管的成熟度和稳定性,以及内皮细胞和基质、间质的相互作用。ang-2与ang-1可以竞争性结合tek/tie2,调节ang-1的信号通路。同时,ang-1/2能够与vegf协同作用,促进内皮细胞的迁移和增殖,因此也是一种血管生成信号。在本发明一具体实施例中,所述拮抗ang片段可以包括:
65.i)氨基酸序列如seq id no.8-9其中之一所示的多肽片段;
66.j)氨基酸序列与seq id no.8-9其中之一具有90%以上序列一致性且具有g)限定的多肽片段的功能的多肽片段。具体的,所述j)中的氨基酸序列具体指:如seq id no.8-9其中之一所示的氨基酸序列经过取代、缺失或者添加一个或多个(具体可以是1-50、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,或者在n-末端和/或c-末端添加一个或多个(具体可以是1-50个、1-30个、1-20个、1-10个、1-5个、1-3个、1个、2个、或3个)氨基酸而得到的,且具有氨基酸如seq id no.8-9其中之一所示的多肽片段的功能的多肽片段,例如,可以拮抗ang-1和/或ang-2。所述j)中的氨基酸序列可与seq id no.8-9其中之一具有90%、93%、95%、97%、或99%以上的一致性。
67.本发明所提供的融合蛋白中,当融合蛋白为双特异性融合蛋白时,如果融合蛋白是线性的,拮抗vegf片段和拮抗ang片段可以独立地位于免疫球蛋白fc片段的n端或c端。优选的,拮抗vegf片段、拮抗ang片段可以分别位于免疫球蛋白fc片段的n端和c端。所述亲水性重复序列片段可以独立或同时位于融合蛋白的n端和/或c端。如果拮抗vegf片段来自单克隆抗体的fab区域,即所述融合蛋白具有类似单克隆抗体的结构时,则拮抗ang片段可以位于免疫球蛋白fc片段的c端,所述亲水性重复序列片段可以独立或同时位于融合蛋白的合适位置,例如,可以位于fab区轻链的n端和/或c端、fab区fd链的n端、或者位于免疫球蛋白fc片段的c端。
68.在本发明一具体实施例中,所述融合蛋白的氨基酸序列可以包括seq id no.15、seq id no.18、seq id no.19其中之一所示的序列;或,所述融合蛋白的氨基酸序列可以包括seq id no.22和seq id no.24所示的序列、seq id no.23和seq id no.24所示的序列、或seq id no.26和seq id no.27所示的序列。
69.本发明所提供的融合蛋白(双特异性融合蛋白)包括亲水性重复序列片段,所形成的融合蛋白同样在血清中的半衰期不但没有进一步延长,反而明显缩短,而在玻璃体中的半衰期却大大延长了。
70.本发明所提供的融合蛋白中,为了获得自动分泌到宿主细胞外的重组蛋白、或利于重组蛋白的纯化,还可以将一些氨基酸(例如,包括但不限于,适合的接头肽、信号肽、前导肽、末端延伸等)添加至重组蛋白的n-末端、c-末端和/或该蛋白内的其它合适区域内。例如,所述融合蛋白的n端和/或c端还可以包括一个或多个多肽片段,这些多肽片段可以是蛋白标签等。具体可以是例如flag、ha、poly-his、gst、mbp、c-myc等,这些标签可用于对蛋白进行纯化或检测。
71.本发明第二方面提供一种分离的多核苷酸,编码本发明第一方面所提供的融合蛋白。
72.本发明第三方面提供一种构建体,所述构建体含有本发明第二方面所提供的分离的多核苷酸。所述构建体通常可以通过将所述分离的多核苷酸插入合适的载体中构建获得,本领域技术人员可选择合适的表达载体。例如,所述载体的类型可以是包括但不限于质粒、噬菌粒、噬菌体衍生物、动物病毒和粘粒等。再例如,所述载体可以是表达载体,也可以是克隆载体。通常,合适的载体包含在至少一种有机体中起作用的复制起点、启动子序列、方便的限制酶位点和一个或多个可选择的标记。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、毕赤酵母的甲醇氧化酶启动子和其它一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。标记基因可用于提供用于选择转化的宿主细胞的表型性状,包括但不限于真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。当本文所述的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列,则将会使转录得到增强,增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。
73.本发明第四方面提供一种表达系统,所述表达系统含有本发明第三方面所提供的构建体或基因组中整合有外源的本发明第二方面所提供的多核苷酸,从而可表达所述的融合蛋白。所述表达系统可以是宿主细胞,所述宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;丝状真菌细胞、或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母、丝状真菌、植物细胞;果蝇s2或sf9的昆虫细胞;cho、cos、293细胞、或bowes黑素瘤细胞的动物细胞等。将构建体导入宿主细胞的方法对于本领域技术人员来说应该是已知的,例如,可以显微注射法、基因枪法、电穿孔法、病毒介导的转化法、电子轰击法、磷酸钙沉淀法等方法。
74.本发明第五方面提供本发明第一方面所提供的融合蛋白的制备方法,本领域技术人员可选择合适的方法以制备所述融合蛋白,例如,所述制备方法可以包括:在合适的条件下培养本发明第四方面所提供的表达系统,使之表达所述融合蛋白,收集含有所述融合蛋白的培养物,而后分离及纯化以提供所述融合蛋白。
75.本发明第六方面提供一种药物组合物,包括本发明第一方面所提供的融合蛋白或本发明第四方面所提供的表达系统的培养物。所述药物组合物中,所述融合蛋白或培养物的含量通常为治疗有效量的。本发明中,“治疗有效量”通常指一用量在经过适当的给药期间后,能够达到治疗如上所列出的疾病的效果。优选的治疗有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:本发明融合蛋白的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重
程度、患者的体重、患者的免疫状况、给药的途径等。优选所述制剂具有从2.0至10.0的ph值。所述药物组合物还可以包括药学上可接受的载体。所述载体可以包括各种赋形剂和稀释剂,这些载体本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体对于本领域技术人员来说应该是熟知的,例如,在remington's pharmaceutical sciences(mack pub.co.,n.j.,1991)中可找到关于药学上可接受的载体的充分讨论。在本发明一优选具体实施例中,所述药物组合物可以通过注射途径来给药,尤其是玻璃体腔内注射,因此所述药物组合物优选是粉针剂(如冻干粉针剂)和液体制剂。
76.本发明第七方面提供本发明第一方面所提供的融合蛋白、本发明第六方面所提供的药物组合物在制备药物中的用途,所述药物可以选自用于治疗眼部血管新生相关疾病的药物。眼部血管新生相关疾病通常指由于在眼部的角膜、虹膜、脉络膜、视网膜、视盘等成熟组织中出现新生血管,从而导致眼部结构和功能的破坏的相关疾病。具体来说,眼部血管新生相关疾病可以是与角膜新生血管相关疾病、虹膜新生血管相关疾病、视网膜新生血管相关疾病、脉络膜新生血管相关疾病等,更具体可以是视网膜静脉阻塞、新生血管性青光眼、视网膜脱离、视网膜创伤、视网膜黄斑变性、黄斑水肿等。在本发明一具体实例中,本发明所提供的融合蛋白在血清中具有更短的半衰期,而在玻璃体中则表现出良好的半衰期,从而使得融合蛋白具有更佳的靶向性,安全性更高,可以被应用于眼部血管新生相关疾病的治疗。
77.本发明第八方面提供一种治疗方法包括:向个体施用治疗有效量的本发明第一方面所提供的融合蛋白、本发明第四方面所提供的表达系统的培养物、或本发明第六方面所提供的药物组合物。
78.本发明中,“治疗”一词包括可导致欲求的药学和/或生理效果的预防性、治愈性或缓和性处置。该效果较佳是指医疗上可减少疾病的一种或多种症状或者完全消除疾病,或阻滞、延迟疾病的发生和/或降低疾病发展或恶化的风险。
79.本发明中,“个体”通常包括人类、非人类的灵长类,或其他哺乳动物(如狗、猫、马、羊、猪、牛等),其可因利用所述制剂、试剂盒或联合制剂进行治疗而获益。
80.本发明所提供的融合蛋白在血清中具有更短的半衰期,而在玻璃体中则表现出良好的半衰期,从而使得融合蛋白具有更佳的靶向性,被证明相比目前现有技术中的药物具有更优越的半衰期和良好的药理学性质。此外,本发明所提供的融合蛋白还具有良好的稳定性、较低的粘度,从而具有良好的产业化前景。
81.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
82.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
83.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、
材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
84.除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecular cloning:a laboratory manual,second edition,cold spring harbor laboratory press,1989and third edition,2001;ausubel等,current protocols in molecular biology,john wiley&sons,new york,1987and periodic updates;the series methods in enzymology,academic press,san diego;wolffe,chromatin structure and function,third edition,academic press,san diego,1998;methods in enzymology,vol.304,chromatin(p.m.wassarman and a.p.wolffe,eds.),academic press,san diego,1999;和methods in molecular biology,vol.119,chromatin protocols(p.b.becker,ed.)humana press,totowa,1999等。
85.实施例1
86.融合蛋白的基因构建:
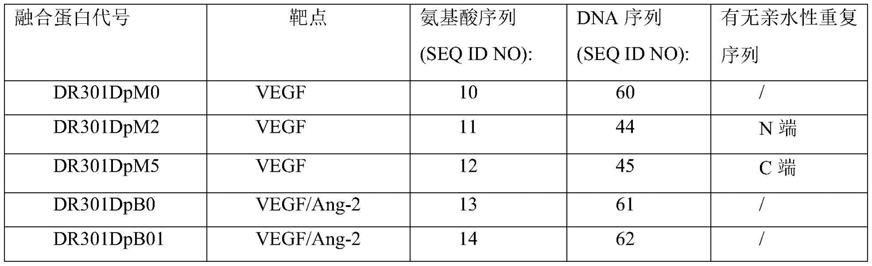
87.表1融合蛋白序列
[0088][0089][0090]
注:表中括号内l代表轻链,h代表重链。
[0091]
(1)根据融合蛋白序列及氨基酸密码子表,设计其dna序列(表1)。分别制备对应的
多核苷酸dna片段,各dna片段均可由常规的固相合成技术合成拼接;
[0092]
(2)设计引物进行巢式pcr扩增,获得目的基因,pcr拼接技术(包括引物设计、pcr引入突变及酶切等)为本领域技术人员所熟知的公知技术。本领域技术人员应当知晓,本实施例的pcr拼接过程并非是唯一的方法,例如,通过基因合成也可以获得目的基因。成功获得目的基因后,将目的基因克隆至哺乳动物细胞表达载体ptt5(yves durocher),转化大肠杆菌top10f’;阳性克隆鉴定后,接种于500ml lb培养基中,过夜培养,离心收集菌体,使用omegaendo-free plasmid maxi kit或类似方法提取质粒。
[0093]
(3)取1.0mg质粒,使用freestyle
tm 293 expression medium(thermofisher)稀释至25ml;取3.0mg pei(线性,25kd,polysciences),使用freestyle
tm 293 expression medium稀释至25ml,加入到质粒溶液中,混匀,室温孵育30分钟;与此同时,取2.5x 109个对数期生长的hek293f细胞(活率>95%),1200rpm离心10分钟,弃上清;使用50ml freestyle
tm 293 expression medium重悬细胞,pei质粒混合液孵育结束后,加入到细胞悬液中,37℃,5%co2,140rpm震荡培养过夜后,补加500ml cd02培养基(中山康天晟合生物技术有限公司),继续培养7天。
[0094]
(4)重组蛋白的纯化:将细胞培养液以8000rpm,高速离心10min,得到上清上样到预先用平衡液(20mm pb,0.5m nacl,ph7.0)平衡好的protein a柱(博格隆(上海)生物技术有限公司),再次平衡后,100%洗脱(洗脱液为0.1m gly-hcl,ph3.0);收集管中预先加入中和液为(1m tris-hcl,ph8.0),收集洗脱样品;最后加中和液到洗脱样品体积的1/10,并采用常规bradford法测定蛋白浓度。
[0095]
实施例2
[0096]
融合蛋白的纯化:
[0097]
实施例1中制备的融合蛋白经过如下步骤进行纯化:
[0098]
对于不含亲水性重复序列的融合蛋白:用0.1m naoh以2ml/min流速处理50ml protein a层析柱(耐碱protein a,博格隆,aa0273),以除去柱上残留的蛋白;100mm glycine 20mm cit ph3.2平衡至少2个柱体积,然后用150mm nacl 20mm pb(ph6.7)平衡至少2个柱体积,直至ph达到6.7,电导在15ms/cm;同时,取培养基上清1l,5000rcf离心20分钟,分离沉淀,取上清;再用0.22μm微孔滤膜过滤除去细胞碎片,检测样品浊度在20ntu以下,留样1ml;将培养基滤液以10ml/min的流速经过protein a层析柱,柱上停留时间约5min;150mm nacl 20mm pb(ph6.7)平衡至少5个柱体积,直至280nm吸收到3mau以下;用10mm pb(ph7.0)平衡至少2个柱体积,直至电导到2.5ms/cm以下;用100%的100mm glycine0.02m cit(ph3.2)洗脱,根据280nm吸收值收集洗脱峰;得到的样品,按10%的体积加入1.0m naoac/hoac(ph5.3),轻轻混匀后,室温静置15分钟;0.22μm无菌过滤,然后4℃或-20℃保存。
[0099]
对于含亲水性重复序列的融合蛋白:在经过上述protein a纯化后,再进一步经50ml阴离子层析纯化(q bestarose ff,博格隆,ai0024)。用500mm nacl 20mm cit ph6.0平衡至少2个柱体积,然后用20mm citna ph6.0平衡至少5个柱体积,直至ph达到6.0,电导在3ms/cm左右;将protein a纯化样品,以10ml/min的流速经过q bestarose ff层析柱,柱上停留时间约5min;用20mm citna ph6.0平衡至少5个柱体积,直至280nm吸收到3mau以下;用40%的500mm nacl 20mm cit ph6.0洗脱,即200mm nacl,根据280nm吸收值收集洗脱峰;
用100%的500mm nacl 20mm cit ph6.0洗脱,根据280nm吸收值收集洗脱峰,4℃或-20℃保存。
[0100]
实施例3
[0101]
融合蛋白的dls测定:
[0102]
使用马尔文zetasizer nano zs检测分子的粒径,吸取1~1.5mg样品(约1~1.5ml体积,由实施例1和2制备获得)于比色皿中,参数设置为material:protein;扩散介质:水;检测温度25℃。用173度光散射检测器进行测定,每个样品重复检测三次。
[0103]
表2融合蛋白的dls测定结果
[0104]
样品名称pdi体积分布,单体峰粒径(d.nm)bevacizumab0.42
±
0.139.82
±
0.16dr301dpb010.494
±
0.149.383
±
0.33dr301dpb20.788
±
0.1819.13
±
0.63dr301dpm20.493
±
0.1519.28
±
0.11dr301dpm50.424
±
0.0417.46
±
1.15dr301ltb10.418
±
0.0718.71
±
0.49dr301abb40.611
±
0.1019.51
±
0.21dr301abb80.524
±
0.0819.09
±
0.80
[0105]
从dls结果看,融合了亲水性重复序列后,表观分子量显著增大。
[0106]
实施例4
[0107]
融合蛋白的体外活性检测:
[0108]
1.vegf受体包被(竞争法):
[0109]
elisa板中加入5μg/ml的人源vegf受体kdr(abcam,ab155628),每孔50μl,在37℃中放置2h。用1%bsa/tbs封闭,37℃放置2h。将融合蛋白和对照品bevacizumab(seq id no.6/7)分别用pbst作3倍梯度稀释,将稀释好的样品80μl与等体积的1μg/ml的vegf混合,37℃放置1h。将包被kdr的elisa板洗板两次,拍干后,将梯度稀释后的混合物样品依次转移至该elisa板中,37℃放置1h,然后洗板5次。向elisa板中各孔加入1:1000稀释的鼠抗人vegf抗体(sigma,v4758),每孔50μl,37℃放置1h,然后洗板5次。再加入1:1000稀释的hrp标记的羊抗鼠二抗(thermofisher,货号31432),每孔50μl,37℃放置1h,然后洗板5次。反应完后加入显色液,37℃避光显色15min,加入终止液终止显色反应,在酶标仪中检测od450,具体结果如表3所示。
[0110]
2.ang-2包被:
[0111]
取ang-2蛋白(10691-h08h,sino biological inc),用50mm nahco
3 ph9.6缓冲液稀释到1ug/ml。取96孔高吸附elisa检测板,每孔加入100ul稀释后的ang-2蛋白,包被过夜。洗板5次,在25℃,用5%脱脂奶粉溶于pbs(含0.01%tween-20)ph7.4封闭。加入梯度稀释(pbs含0.01%tween-20和1%bsa)的融合蛋白,25℃孵育1小时。洗板5次,最后用0.1ug/ml的hrp标记羊抗人igg抗体,25℃孵育1小时,洗板5次。反应完后加入显色液,37℃避光显色15min,加入终止液终止显色反应,在酶标仪中检测od450,具体结果如表3所示。
[0112]
3.huvec细胞增殖拮抗法检测:
[0113]
160ng/ml vegf-a
165
(终浓度为80ng/ml)与各指定浓度融合蛋白等比混合后,每孔
50μl加入到96孔板中,放在37℃培养箱中拮抗1h;10-cm dish中的huvec细胞(sciencecell,cat#8000)用1.5ml胰酶消化2min后,弃去胰酶,加入4ml ecm 1%培养基(sciencecell,cat#1001,含fbs,100xps和ecgs)吹打细胞,转移至离心管中,800rpm/5min后,弃去上清,用5mlecm 1%培养基重悬,细胞计数;取4000/50μ/孔l细胞加入到已经拮抗1h的96孔培养板中;刺激72h后,每孔中加入10μl 5mg/ml的celltiter-试剂(promega,g7571),酶标仪检测rlu值,具体结果如表3所示。
[0114]
表3融合蛋白的活性
[0115][0116][0117]
实施例5
[0118]
融合蛋白静脉注射在sd大鼠中的药代动力学:
[0119]
sd大鼠随机均分组,每组5只,分别皮下注射表4中融合蛋白,2mg/kg,融合蛋白给药组在注射前和注射后3h,8h,12h,24h,36h,48h,72h,96h,120h,144h,168h取血,分离获得血清。用夹心elisa方法检测融合蛋白在大鼠体内的药代情况。100ng/孔的harg1 vegf包被过夜,pbst洗涤3次。5%脱脂奶粉封闭后,pbst洗涤3次,各时间点的血清稀释至指定的倍数,按100μl/孔加入到elisa酶标板中,在37℃孵育2h后,pbst洗涤3次,加入anti-ang-2兔多抗(自制),37℃孵育2小时,pbst洗涤3次,最后hrp标记的链霉亲和素稀释5万倍后加入到
elisa板中,37℃孵育1小时后用常规tmb法检测,读取od450值,具体结果如表4所示。
[0120]
表4融合蛋白在大鼠体内的药代动力学
[0121][0122]
注:组别1、2、3和4为四次独立实验。
[0123]
从表4中所给出的实验结果,可以惊讶地发现在融合蛋白与亲水性重复序列融合后明显降低了其血清半衰期。
[0124]
实施例6
[0125]
融合蛋白玻璃体注射在新西兰大白兔中的药代动力学:
[0126]
选取健康新西兰大白兔,要求雌雄各半、体重3kg左右、检疫合格、体重相近、年龄与体重相仿。分组并进行编号,每组4只,动物分别单剂量双眼给药:aflibercept、dr301abb4,dr301abb8、dr301ltb2、dr301bvm5、dr301bvb1,50ug/50ul/眼,玻璃体腔注射。在14天和28天分别取样测定玻璃体中药物浓度。
[0127]
从图1a-图1d可以看到,与sd大鼠中的血清半衰期结果相反,融合了亲水性重复序列后显著延长融合蛋白在玻璃体中的半衰期,表现在14天和28天相对药物浓度都比未融合亲水性重复序列的融合蛋白高得多。
[0128]
实施例7
[0129]
模型药效学研究
[0130]
筛选体重3-5kg,年龄3-5岁的食蟹猴,雌雄各半。day 0双眼眼底激光诱导构建cnv模型,每只眼激光灼烧数量为6-8个,激光参数:波长532nm;功率500mw;光斑直径50um;曝光时间100ms。day 15经ffa判定成模后,按性别及四级光斑的渗漏面积将食蟹猴均匀分组,每组6只动物,按照下表组别与剂量进行药物干预,注射方式:玻璃体腔注射,50μl/眼,给药前以及给药后一周、两周时对各组动物进行眼底照相(fp)、ffa及光相干断层成像(oct)检测,测量4级光斑渗漏面积及视网膜下高反射信号物质(shrm)平均厚度,计算平均渗漏改善率及视网膜下高反射信号物质(shrm)平均厚度改善率,判断对食蟹猴cnv模型的药效改善情况。
[0131]
表5激光光凝诱导食蟹猴脉络膜新生血管模型分组情况
[0132][0133]
各组别的4级光斑平均渗漏面积改善率的实验结果具体如图2所示,其中,(平均渗漏面积减少量=给药前平均渗漏面积-给药后平均渗漏面积;平均渗漏面积改善率(%)=平均渗漏面积减少量/给药前平均渗漏面积
×
100%)。由图2可知,各组别相对于对照组均获得了更好的4级光斑平均渗漏面积改善率,且基本达到或更加优于阳性对照组的水平,说明本技术所提供的各组别药物能够显著降低对食蟹猴cnv模型的渗漏。
[0134]
各组别的视网膜下高反射信号物质(shrm)平均厚度改善率如图3所示,其中,shrm平均厚度减少量=给药前shrm平均厚度-给药后shrm平均厚度,shrm平均厚度改善率(%)=shrm平均厚度减少量/给药前shrm平均厚度
×
100%。由图3可知,各组别相对于对照组均获得了更好的shrm平均厚度改善率,且基本达到或更加优于阳性对照组的水平,说明本技术所提供的各组别药物对食蟹猴cnv模型具有良好的药效。
[0135]
图4示例性地给出了dr301abb4对光斑率及渗漏面积改善情况。由图4可知,dr301abb4能够显著减少4级光斑的数量,并改善渗漏面积(随着时间延长,逐渐缩小)。
[0136]
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0137]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

