一种基于raa-crispr-cas13a检测hbv cccdna的试剂盒
技术领域
1.本发明属于生物医药技术领域,具体涉及一种基于raa-crispr-cas13a检测hbv cccdna的试剂盒。
背景技术:
2.乙型肝炎病毒(hepatitis b virus,hbv)是引起乙型肝炎(简称乙肝)的病原体,属嗜肝dna病毒科。在乙型肝炎病毒的复制过程中,病毒dna进入宿主细胞核,在dna聚合酶的作用下,两条链的缺口均被补齐,形成超螺旋的共价、闭合、环状dna分子(covalently closed circulardna,cccdna)。细胞外乙型肝炎病毒dna是一种松弛环状的双链dna(relaxed circulardna,rcdna)分子。cccdna是乙型肝炎病毒前基因组rna复制的原始模板,虽然其含量较少,每个肝细胞内只有约5~50个拷贝,但对乙型肝炎病毒的复制以及感染状态的建立具有十分重要的意义,只有清除了细胞核内的cccdna,才能彻底消除乙肝患者病毒携带状态,是抗病毒治疗的目标。
3.全球hbv慢性感染者约为2.57亿人,由hbv感染引起的失代偿肝硬化、肝衰竭和肝癌导致约90万人死亡,我国人群整体携带率为6.1%,约占全球的1/3。慢性乙型肝炎难以治愈的关键因素是未能彻底清除的hbv cccdna,它是病毒复制产生的所有rna和子代病毒合成的模板,可以在肝细胞核内持续、稳定地存在,且目前现有的抗病毒药均不能清除cccdna,故hbv cccdna的存在被认为是hbv感染慢性化及抗hbv治疗停止后肝炎复发最主要原因,解析cccdna的调控机制被国内外专家公认为是慢乙肝治愈策略中需要优先解决的重要科学问题。因此,hbv cccdna的检测对深入研究hbv致病机制、评价乙肝患者药物疗效等方面具有重要意义。
4.hbv cccdna在患者肝脏中的水平极低,每个肝细胞内只有约5~50个拷贝,对检测技术的灵敏度提出了较高要求。rcdna与ccc dna序列的高度同源性,又需要检测技术同时具有高度特异性。
5.目前hbv cccdna常用检测技术包括:
①
southern印迹杂交:该方法定性检测较为准确,但操作繁琐、敏感性较低且不能准确定量,需标本量也较大,故在临床上应用较少;
②
套式或选择性聚合酶链式反应(pcr):检测敏感性比较好,但是由于需要多次扩增,并且对pcr产物进行再次扩增,导致假阳性;
③
实时荧光定量pcr法:该检测方法的特异性比选择性pcr进一步提高,可以消除高rcdna背景可能产生的非特异性扩增,灵敏度也明显提高,但仍不能完全排除rcdna非特异性扩增存在;
④
微滴式数字pcr(ddpcr)方法:ddpcr方法能够检测到血清、单细胞和ffpe肿瘤组织中的cccdna,与southern blot及其他方法相比,检测cccdna的灵敏性提高,但是价格昂贵,不利于广泛推广。
6.重组酶聚合酶扩增(recombinase polymerase amplification,rpa)于2006年由asm scientific有限公司的niall armes首次推出,被认为是能够代替pcr的核酸检测技术。在此基础上,国内研发了重组酶介导等温核酸扩增技术(recombinase-aid amplification,raa),主要依赖于三种酶:能结合单链核酸的重组酶、单链dna结合蛋白
(ssb)和dna聚合酶。在raa等温扩增过程中重组酶与引物结合构成的蛋白-dna复合物,在双链dna中寻找同源序列,一旦引物定位了同源序列,就会产生链交换反应并启动dna合成,对模板上的目的序列进行指数式扩增,被替换的dna链与ssb结合,避免进一步替换。与pcr相比raa技术不需要繁琐的操作步骤,其反应的最适温度在37℃-42℃之间,无需变性,在常温下即可进行,大大缩短了核酸检测时间。此外,因为不需要温控设备,raa能够实现便携式的快速核酸检测。同时raa检测的灵敏度很高,可以将痕量的核酸模板扩增到能够检出的水平。
7.2017年,《science》报道张峰实验室利用crispr-cas13检测技术结合重组酶聚合酶扩增技术建立了灵敏度达到单碱基的痕量核酸检测技术,且该技术具有检测成本低,检测速度快等优点。
技术实现要素:
8.本发明的目的是提供一种基于raa-crispr-cas13a检测hbv cccdna的试剂盒。
9.hbv cccdna又称为乙型肝炎病毒共价闭合环状dna。
10.本发明提供了一种核酸分子组合物,由引物f1、引物r1和特异crrna组成;引物f1为序列表的序列1所示的单链dna分子;引物r1为序列表的序列2所示的单链dna分子;特异crrna为序列表的序列3所示的单链rna分子。
11.引物f1和引物r1为跨缺口引物,用于raa扩增。
12.本发明还保护一种用于检测hbv cccdna的试剂盒,包括所述核酸分子组合物。
13.所述试剂盒还包括不降解质粒的atp依赖的dna酶。
14.所述试剂盒还包括lwcas13a蛋白。所述试剂盒还包括t7 rna聚合酶。所述试剂盒还包括rna酶抑制剂。所述试剂盒还包括报告rna。
15.所述试剂盒还包括用于raa扩增的试剂或试剂盒。
16.所述试剂盒还包括记载有检测方法的载体;所述检测方法包括如下步骤:
17.(1)提取受试者肝脏组织的总dna,然后进行psad消化;
18.(2)取步骤(1)的产物溶液,作为模板溶液,采用引物f1和引物r1组成的引物对进行raa扩增;引物f1为序列表的序列1所示的单链dna分子,引物r1为序列表的序列2所示的单链dna分子;
19.(3)取步骤(2)的产物溶液,进行基于crispr-cas13a系统的可视化检测;所述crispr-cas13a系统中的crrna如序列表的序列3所示。
20.本发明还保护所述核酸分子组合物在制备试剂盒中的应用;所述试剂盒的用途为检测hbv cccdna。
21.本发明还保护组件1、组件2、组件3和组件4在在制备试剂盒中的应用;所述试剂盒的用途为检测hbv cccdna;
22.所述组件1为所述核酸分子组合物;
23.所述组件2为不降解质粒的atp依赖的dna酶;
24.所述组件3为lwcas13a蛋白;
25.所述组件4为用于raa扩增的试剂或试剂盒。
26.本发明还保护所述核酸分子组合物在检测hbv cccdna中的应用。
27.本发明还保护一种检测hbv cccdna的方法,包括如下步骤:
28.(1)提取受试者肝脏组织的总dna,然后进行psad消化;
29.(2)取步骤(1)的产物溶液,作为模板溶液,采用引物f1和引物r1组成的引物对进行raa扩增;引物f1为序列表的序列1所示的单链dna分子,引物r1为序列表的序列2所示的单链dna分子;
30.(3)取步骤(2)的产物溶液,进行基于crispr-cas13a系统的可视化检测;所述crispr-cas13a系统中的crrna如序列表的序列3所示。
31.psad消化的反应体系(11.7μl):总dna(dna的含量约为1μg)8.5μl、psad0.4μl(含4u)、psad buffer 2μl、atp溶液0.8μl。
32.psad消化的反应条件:37℃水浴12小时,随后加热至70℃反应30分钟(酶灭活)。
33.基于crispr-cas13a系统的可视化检测的反应体系(25μl):5μl步骤(2)的产物溶液、1μl cas13蛋白溶液(含125ng蛋白)、2.5μl ntpmix、0.4μl t7 rna聚合酶(含20u)、1μl rna酶抑制剂、1μl特异crrna(含45ng)、1.6μl报告rna、2.5μl 10
×
buffer,余量为无rna酶水。
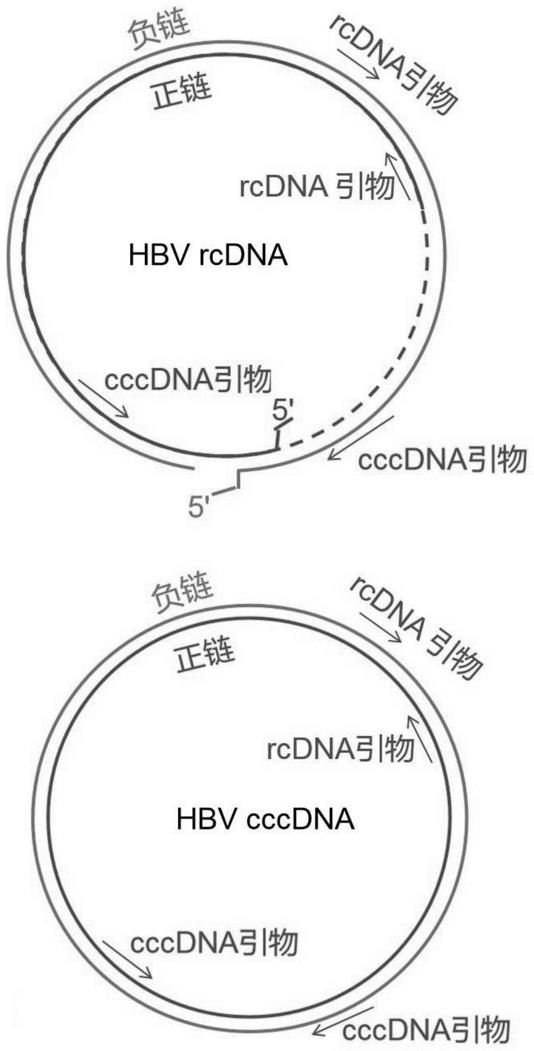
34.基于crispr-cas13a系统的可视化检测的反应条件:37℃,每2min为一个循环(读取荧光值),循环30次。
35.基于crispr-cas13a系统的可视化检测通过荧光信号判断受试者肝脏组织中是否含有hbv cccdna。荧光信号越强说明hbv cccdna的含量越高。
36.lwcas13a蛋白如序列表的序列6第151-1302位氨基酸残基所示。
37.基于crispr-cas13a系统的可视化检测具有如下优点:可实现对痕量核酸的快速检测;检测全过程在37℃条件下完成,不依赖仪器设备,可实现对特定病原核酸的床旁快速检测。
38.本发明将跨缺口引物、raa扩增和基于crispr-cas13a系统的可视化检测结合在一起用于hbv cccdna检测,扩增速度快、稳定性高、特异性强、灵敏度高、通量高、成本低,能实现对乙肝的早期检测和药物疗效的有效监测,从而为改善乙肝患者在治疗疗效、用药监测等方面的问题,为乙肝的个体化治疗奠定坚实的基础。本发明具有着非常重要的临床应用前景和开发价值。
附图说明
39.图1为跨缺口引物的工作原理示意图。
40.图2为实施例2中试验一的电泳图。
41.图3为实施例2中试验二的电泳图。
42.图4为实施例3中4个引物对的raa扩增效果比较的电泳图。
43.图5为实施例5中2个引物对的raa-crispr-cas13a检测效果比较结果图。
44.图6为实施例6中raa产物转录及crispr-cas13a检测的结果图。
45.图7为实施例7中raa产物转录及crispr-cas13a检测的结果图。
具体实施方式
46.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验
方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。如无特殊说明,核酸分子均为5
’→3’
方向。
47.实施例1、raa扩增引物的制备
48.设计大量基于raa的扩增引物,通过预实验,筛选得到最佳引物组合,由引物f1和引物r1组成。引物f1(序列表的序列1所示的单链dna分子)为针对hbv基因组正链缺口上游的特异性引物。引物r1(序列表的序列2所示的单链dna分子)由两个区段组成,一个区段为t7启动子(见下划线标注),另一个区段为针对hbv基因组负链缺口下游的特异性引物。引物f1和引物r1的靶序列长度为285bp。跨缺口引物的工作原理示意图见图1。人工合成引物f1和引物r1。引物f1和引物r1即实施例3的引物对4。
49.引物f1:5
’-
cttcgcttcacctctgcacgtcgcatggagacc-3’;
50.引物r1:5
’-
taatacgactcactatagggcttgaacagtaggacatgaacatgagatgattaggc-3’。
51.实施例2、psad消化的效果验证
52.psad消化,全称为不降解质粒的atp依赖的dna酶消化。不降解质粒的atp依赖的dna酶即plasmid-safe atp-dependent dnase(psad)。
53.5个样本:三甲医院已确诊的5例hbv患者的肝脏组织。
54.一、提取肝脏dna并进行psad消化。
55.1、取肝脏组织,提取总dna。
56.2、取步骤1得到的总dna,进行psad消化。
57.psad消化的反应体系(11.7μl):步骤1得到的总dna(dna的含量约为1μg)8.5μl、psad 0.4μl(含4u)、psad buffer 2μl、atp溶液0.8μl。
58.pasd(plasmid-safe
tm atp-dependent dnase):lucigen公司,货号e3110k。psad buffer(plasmid-safe
tm 10x reaction buffer)和atp溶液(25mm atp solution)为pasd的配套组件。
59.psad消化的反应条件:37℃水浴12小时,随后加热至70℃反应30分钟(酶灭活)。
60.二、试验一
61.完成步骤一后,取产物溶液,将产物溶液作为模板溶液(设置用等体积水代替产物溶液的空白对照),分别进行两个pcr扩增,然后进行琼脂糖凝胶电泳。第一个pcr扩增采用hbvs-f和hbvs-r组成的引物对,靶序列位于hbv表面抗原的s基因(150bp)。第二个pcr扩增采用a1at-f和a1at-r组成的引物对,靶序列位于人细胞染色体的a1at基因。
62.hbvs-f:5
’-
tcacaataccgcagagtc-3’;
63.hbvs-r:5
’-
acatccagcgataaccag-3’。
64.a1at-f:5
’-
ttccctggtctgaatgtgtg-3’;
65.a1at-r:5
’-
actgtcccaggtcagtggtg-3’。
66.电泳图结果见图2。图2中,1-5分别代表5个样本,6代表空白对照。采用hbvs-f和hbvs-r组成的引物对扩增,可以观察到100bp-250bp之间的扩增产物。采用a1at-f和a1at-r组成的引物对扩增,没有扩增产物。结果表明,线性dna已完全被psad消化。
67.三、试验二
68.完成步骤一后,取产物溶液,将产物溶液作为模板溶液(设置用等体积水代替产物溶液的空白对照),进行pcr扩增,然后进行琼脂糖凝胶电泳。pcr扩增采用hbv-f和hbv-r组成的引物对,靶序列位于hbv cccdna的跨缺口区。
69.hbv-f:5
’-
ggggcgcacctctcttta-3’;
70.hbv-r:5
’-
aggcacagcttggaggc-3’。
71.电泳图结果见图3。图3中,1-5分别代表5个样本,6代表空白对照。结果表明,psad消化后产物中存在hbv cccdna。
72.实施例3、4个引物对的raa扩增效果比较
73.在筛选raa扩增引物时,以hbv cccdna的跨缺口序列片段为靶序列,鉴于raa扩增最佳序列长度在300bp以内,从中选择部分序列作为靶序列,存在多种引物序列。示例性的,本实施例对4对扩增引物的效果进行比较。
74.引物对1如下:
75.ccc-raa-1-f:5
’-
cctctctttacgcggactccccgtctgtgcc-3’;
76.ccc-raa-1-r:5
’-
taatacgactcactatagggcctacagcctcctagtacaaagacctttaacc-3’。
77.引物对2如下:
78.ccc-raa-2-f:5
’-
ctccccgtctgtgccttctcatctgccggaccg-3’;
79.ccc-raa-2-r:5
’-
taatacgactcactatagggcctcctagtacaaagacctttaacctactctcc-3’。
80.引物对3如下:
81.ccc-raa-3-f:5
’-
ccttctcatctgccggaccgtgtgcacttcgc-3’;
82.ccc-raa-3-r:5
’-
taatacgactcactatagggccaatttatgcctacagcctcctagtacaaagacc-3’。
83.引物对4如下:
84.ccc-raa-4-f:5
’-
cttcgcttcacctctgcacgtcgcatggagacc-3’;
85.ccc-raa-4-r:5
’-
taatacgactcactatagggcttgaacagtaggacatgaacatgagatgattaggc-3’。
86.一、提取肝脏dna并进行psad消化。
87.1、取三甲医院已确诊的hbv患者的肝脏组织,提取总dna。
88.2、取步骤1得到的总dna,进行psad消化。
89.方法同实施例2的步骤一的2。
90.二、raa扩增。
91.完成步骤一后,取产物溶液,将产物溶液作为模板溶液,分别采用引物对1、引物对2、引物对3和引物对4进行raa扩增,然后进行琼脂糖凝胶电泳。
92.raa扩增采用raa核酸检测试剂盒并按试剂盒说明书进行操作。raa核酸检测试剂盒:江苏奇天基因生物科技有限公司,产品编号为b00000。raa核酸检测试剂盒中具有阳性质控品和阴性质控品,均按说明书操作。
93.结果见图4。图4中,1至4依次代表引物对1至引物对4的扩增产物,阳性对应阳性质控品,阴性对应阴性质控品。结果表明,引物对1和引物对4均可以实现有效扩增。
94.实施例4、crrna的制备
95.1、合成三条单链dna分子,hbv-f、t7-f和hbv-r。t7-f中,第1-20位核苷酸组成t7启动子。
96.hbv-f:
97.ggggatttagactaccccaaaaacgaaggggactaaaacaactttttcacctctgcctaatcatctc;
98.t7-f:taatacgactcactataggggatttagactaccccaa;
99.hbv-r:gagatgattaggcagaggtg。
100.2、制备反应体系并进行pcr扩增。
101.反应体系(50μl):2μl hbv-f溶液、2μl t7-f溶液、2μl hbv-r溶液、25μl2
×
taq pcr mastermix,余量为水。hbv-f溶液提供的有效成分为hbv-f,hbv-f溶液中的hbv-f浓度为10μm。t7-f溶液提供的有效成分为t7-f,t7-f溶液中的t7-f浓度为10μm。hbv-r溶液提供的有效成分为hbv-r,hbv-r溶液中的hbv-r浓度为10μm。
[0102]2×
taq pcr mastermix:博迈德公司,货号mt211-02。
[0103]
反应条件:95℃预变性5min;95℃30s、60℃30s、72℃15s,循环38次;72℃延伸10min。
[0104]
3、完成步骤2后,回收pcr扩增产物,采用t7 quick high yield rna synthesis kit进行反转录,然后用agencourt rnaclean xp回收rna,得到crrna。
[0105]
crrna序列(序列表的序列3所示的单链rna分子)如下:
[0106]
ggggauuuagacuaccccaaaaacgaaggggacuaaaacaacuuuuucaccucugccuaaucaucuc。
[0107]
crrna中包括包括scaford序列和cccdna跨缺口区序列。crrna序列中,下划线标注的是引导区域(位于hbv cccdna跨缺口区)。crrna序列中,粗体标注的39nt为与lwcas13a蛋白结合的区域,也就是scaford序列。
[0108]
实施例5、2个引物对的raa-crispr-cas13a检测效果比较
[0109]
raa-crispr-cas13a检测原理:如果生物样本中存在hbv cccdna,可以得到具有跨缺口序列片段的raa扩增产物,该扩增产物在t7转录酶的作用下转录为rna(命名为转录rna),转录rna上具有crrna中的引导区域反向互补的区段,因此可以激活lwcas13a的非特异性切割,从而切割报告rna并释放荧光信号。
[0110]
一、提取肝脏dna并进行psad消化。
[0111]
1、取三甲医院已确诊的hbv患者的肝脏组织,提取总dna。
[0112]
2、取步骤1得到的总dna,进行psad消化。
[0113]
方法同实施例2的步骤一的2。
[0114]
二、raa扩增
[0115]
完成步骤一后,取产物溶液,将产物溶液作为模板溶液,分别采用引物对1和引物对4进行raa扩增。引物对1和引物对4见实施例3。
[0116]
raa扩增采用raa核酸检测试剂盒并按试剂盒说明书进行操作。raa核酸检测试剂盒:江苏奇天基因生物科技有限公司,产品编号为b00000。raa核酸检测试剂盒中具有阴性质控品,按说明书操作。
[0117]
三、raa产物转录及crispr-cas13a检测
[0118]
反应体系(25μl):5μl步骤二的产物溶液、1μl cas13蛋白溶液(含125ng蛋白)、2.5
μl ntpmix、0.4μl t7 rna聚合酶(含20u)、1μl rna酶抑制剂、1μl实施例4制备的crrna(含45ng)、1.6μl报告rna、2.5μl 10
×
buffer,余量为无rna酶水。
[0119]
报告rna为rnasealert
tm qc system v2中的substrate v2。
[0120]
rnasealert
tm qc system v2:invitrogen
tm
公司,货号4479769。
[0121]
t7 rna聚合酶为hiscribe t7快速高效rna合成试剂盒中的t7 rna聚合酶混合液。ntpmix为hiscribe t7快速高效rna合成试剂盒中的ntp缓冲液混合液。hiscribe t7快速高效rna合成试剂盒:neb产品,货号e2050s。
[0122]
rna酶抑制剂为小鼠rnase抑制剂(规格为40000units/ml):neb产品,货号m0314s。
[0123]
cas13a蛋白溶液,又称为lwcas13a蛋白溶液,制备方法见实施例8。
[0124]
10
×
buffer(ph7.3):含400mm tris-hcl、600mm氯化钠、60mm mgcl2,余量为水。
[0125]
反应条件:37℃,每2min为一个循环(读取荧光值),循环30次。
[0126]
结果见图5。结果表明,引物对4的效果极其显著的优于引物对1。
[0127]
实施例6、以标准品质粒为模板时的灵敏度和重复性
[0128]
一、制备质粒溶液
[0129]
标准品质粒:将序列表的序列4所示的双链dna分子插入pmd19t质粒,得到标准品质粒。hbv全基因组如序列表的序列4所示。
[0130]
取标准品质粒,用水进行稀释,得到浓度为104copy/μl、103copy/μl、102copy/μl、10copy/μl或1copy/μl的质粒溶液。
[0131]
二、raa扩增
[0132]
取步骤一制备的质粒溶液,将质粒溶液作为模板溶液,采用实施例1制备的引物f1和引物r1组成的引物对进行raa扩增。
[0133]
raa扩增采用raa核酸检测试剂盒并按试剂盒说明书进行操作。raa核酸检测试剂盒:江苏奇天基因生物科技有限公司,产品编号为b00000。raa核酸检测试剂盒中具有阴性质控品,按说明书操作。
[0134]
三、完成步骤二后,将raa扩增产物进行琼脂糖凝胶电泳。凝胶电泳的检测下限为浓度103copy/μl的质粒溶液。
[0135]
四、raa产物转录及crispr-cas13a检测
[0136]
同实施例5的步骤三。
[0137]
结果见图6。即便是浓度低至1copy/μl的质粒溶液,也可观察到与阴性质控品的荧光值发生显著差异,提示本发明的方法的灵敏度良好,灵敏度可低至1copy/μl。
[0138]
五、重复性
[0139]
依次按照步骤一、步骤二和步骤四的顺序进行操作。每种质粒溶液进行5次重复实验,组间组内无显著性差异(p<0.05)。
[0140]
实施例7、对临床样本的检测
[0141]
8份临床hbv阳性样本(三甲医院已确诊的8位hbv患者的肝脏组织)。3份临床对照样本(三甲医院已确诊的非hbv患者的肝脏组织)。
[0142]
一、提取肝脏dna并进行psad消化。
[0143]
1、取肝脏组织,提取总dna。
[0144]
2、取步骤1得到的总dna,进行psad消化。
[0145]
方法同实施例2的步骤一的2。
[0146]
二、raa扩增
[0147]
完成步骤一后,取产物溶液,将产物溶液作为模板溶液,采用实施例1制备的引物f1和引物r1组成的引物对进行raa扩增。
[0148]
raa扩增采用raa核酸检测试剂盒并按试剂盒说明书进行操作。raa核酸检测试剂盒:江苏奇天基因生物科技有限公司,产品编号为b00000。。
[0149]
三、raa产物转录及crispr-cas13a检测
[0150]
同实施例5的步骤三。
[0151]
结果见图7。
[0152]
每个样本进行3次重复检测,组间组内无显著性差异(p<0.05)。
[0153]
结果表明,本发明方法的稳定性及可重复性较好。
[0154]
对于临床样本结果判断来说,crispr-cas13a检测中反应30min后,如果待测样本(待测患者的肝脏组织)的荧光强度高于有统计学意义的阴性对照样本(健康者的肝脏组织)的荧光强度的平均值加3倍标准差,则判断待测样本为含有hbv cccdna的阳性样本,荧光信号越强说明hbv cccdna的含量越高。
[0155]
实施例8、lwcas13a蛋白的制备
[0156]
一、制备重组菌
[0157]
将质粒pc013-twinstrep-sumo-hulwcas13a导入transb(de3)chemically comptent cell,得到重组菌。
[0158]
质粒pc013-twinstrep-sumo-hulwcas13a:addgene,产品id为90097;https://www.addgene.org/browse/sequence/181127/。
[0159]
质粒pc013-twinstrep-sumo-hulwcas13a如序列表的序列5所示。序列表的序列5中,第2751-6659位核苷酸的反向互补序列编码融合蛋白。融合蛋白如序列表的序列6所示。序列表的序列6中,第5-10位氨基酸残基组成his6标签,第24-51位氨基酸残基组成strep标签,第52-148位氨基酸残基组成sumo蛋白,第151-1302位氨基酸残基组成lwcas13a蛋白。在sumo蛋白酶的作用下,融合蛋白被切割并释放lwcas13a蛋白。
[0160]
transb(de3)chemically comptent cell即transb(de3)化学感受态细胞。
[0161]
二、制备cas13a蛋白
[0162]
1、采用液体lb培养基培养步骤一制备的重组菌,直至培养体系的od
600nm
值=0.6,然后加入iptg并使其在体系中的浓度为500μm,然后18℃、200-220rpm诱导培养16h,然后5200g离心15min,收集菌体,
[0163]
2、取步骤1得到的菌体,加入裂解液(裂解液:含20mm tris-hcl、500mm氯化钠、1mm二硫苏糖醇,余量为水),然后进行超声破碎(超声5s,停10s,总时间为1.5h),然后4℃、12000rpm离心10min,收集上清液。
[0164]
3、取步骤2得到的上清液,加入咪唑并使其浓度为10mm,然后采用0.22μm滤膜过滤,收集滤液。
[0165]
4、取步骤3得到的滤液,采用镍柱(histrap hp column)分离纯化具有his6标签的融合蛋白。
[0166]
5、收集步骤4得到的过柱后溶液,转移到透析袋中,将透析袋放入sumo缓冲液中进
行透析(4℃搅拌,约1h换液一次,换液3次)。sumo缓冲液:含30mm tris-hcl、500mm氯化钠、1mm二硫苏糖醇、0.15%np-40,余量为水。
[0167]
6、完成步骤5后,收集透析袋内的液体,采用sumo蛋白酶进行酶切。
[0168]
sumo蛋白酶:索莱宝公司,货号p2070。
[0169]
7、完成步骤6后,取酶切产物溶液,进行离子交换层析。
[0170]
离子交换层析柱:unigel-50sp(nano-micro tech)。
[0171]
离子交换柱平衡后上样酶切产物溶液,依次用200mm氯化钠水溶液、500mm氯化钠水溶液、1m氯化钠水溶液和0.5m naoh水溶液洗脱,收集各个蛋白峰对应的过柱后溶液并进行电泳检测(lwcas13a蛋白的预期分子量为138.5kda)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

