一种ezh2的原核表达载体及其构建方法
技术领域
1.本发明涉及基因工程技术领域,具体涉及一种ezh2的原核表达载体及其构建方法。
背景技术:
2.作为养禽行业的领导者,我国的家禽数量和禽产品产量一直远超其他国家,这之中尤其以养鸡业最为突出;但是在我国养鸡业飞速发展的同时,也仍然存在一些问题,比如禽产品质量仍有待提高,疾病控制力度仍有待加强、饲养管理环境仍有待完善;在这之中,如何有效的控制疾病仍然是养殖业的首要解决问题,虽然我们已经在免疫程序、疫苗生产和其他一些疾病预防方面取得了突出的研究进展,但疾病带来的危害仍不容忽视,疾病的治疗依然刻不容缓;
3.随着科学研究的发展,一些传染性疾病和普通疾病相继得到了控制,因此,作为严重危害养鸡业的重要疾病之一—肿瘤性疾病,显得越发重要;由于肿瘤的发病机制在基因水平上得到了阐明,肿瘤的基因治疗方法得到了迅速发展;通过对肿瘤性疾病的基因治疗方法,可以进一步了解肿瘤性疾病,我们也能够更好的控制肿瘤性疾病的发生、发展以及传播,促进养禽业的健康发展;ezh2(enhancer ofzeste homolog 2)是聚硫蛋白复合物基因家族(pcg)重要成员之一,通过对核小体的修饰、染色体的重塑及干扰其他转录因子的转录调节,在胚胎的发育、细胞增殖及周期调节中起着重要作用,因此ezh2基因的发现给抗肿瘤的基因治疗带来了新的转机;
4.而在实际治疗过程中,如很能够快速且准确的获得能够表达ezh2的原核表达载体变成了本领域的一个技术难点,目前尚无成形的ezh2的原核表达载体的构建方法。
技术实现要素:
5.针对上述存在的问题,本发明旨在提供一种ezh2的原核表达载体及其构建方法,通过本方法成功构建了重组原核表达载体pet
‑
32a
‑
ezh2,为下一步获得ezh2原核表达蛋白奠定基础,也可为探究ezh2基因在鸡肿瘤性疾病中的作用机制提供材料。
6.为了实现上述目的,本发明所采用的技术方案如下:
7.一种ezh2的原核表达载体的构建方法,包括步骤
8.s1.获取目的基因,并对目的基因的rna进行反转录和pcr反应,回收2300bp左右的目的片段;
9.s2.利用回收的2300bp左右的目的片段重组克隆载体pmd18
‑
t
‑
ezh2;
10.s3.对克隆载体pmd18
‑
t
‑
ezh2进行pcr扩增与鉴定;
11.s4.对克隆载体pmd18
‑
t
‑
ezh2进行酶切鉴定;
12.s5.获取目的片段,并回收2200~5900bp之间的目的片段;
13.s6.利用回收2300bp左右的目的片段和5900bp左右的片段进行连接,构建原核表达载体pet
‑
32a
‑
ezh2;
14.s7.原核表达载体pet
‑
32a
‑
ezh2的pcr扩增鉴定;
15.s8.原核表达载体pet
‑
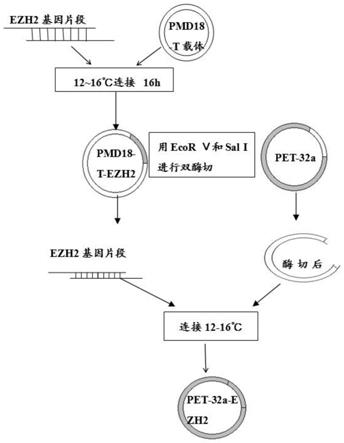
32a
‑
ezh2的酶切鉴定。
16.优选的,步骤s1所述的获取目的基因的获取过程包括:
17.s101.采用试剂盒从鸡脾脏中提取总rna;
18.s102.对提取到的总rna进行template rna变性及反转录反应;
19.s103.配制反应液,对反转录结束后的dna片段进行pcr反应;
20.s104.将pcr后的产物,进行凝胶电泳;
21.s105.回收2300bp左右的目的片段。
22.优选的,步骤s2所述的克隆载体pmd18
‑
t
‑
ezh2的重组过程包括:
23.s201.将回收所得的2300bp左右的目的片段与pmd18
‑
t进行连接;
24.s202.利用感受态细胞对重组克隆载体pmd18
‑
t
‑
ezh2进行转化;
25.s203.提取重组质粒pmd18
‑
t
‑
ezh2。
26.优选的,步骤s3所述的克隆载体pmd18
‑
t
‑
ezh2的pcr的扩增与鉴定过程和步骤和步骤s7所述的pet
‑
32a
‑
ezh2的pcr扩增鉴定过程均包括:
27.(1)配制pcr扩增鉴定酶反应体系,进行pcr扩增鉴定酶反应过程,并在加完样品后,用旋涡混合器混匀、瞬离;
28.(2)根据pcr反应条件,在梯度pcr仪上进行pcr反应。
29.优选的,在步骤(1)所述的pcr扩增鉴定酶反应体系中,所使用的引物为:
30.forward pimer:gggatatcatgggtcaaacaggaaa
31.reverse primer:ctcgagttactgtcgacaagggatttccatttctc。
32.优选的,(1)步骤s4所述的对克隆载体pmd18
‑
t
‑
ezh2进行酶切鉴定的过程需要用限制性内切酶ecor
ꢀⅴ
和xho i对pmd18
‑
t
‑
ezh2进行酶切鉴定;
33.(2)步骤s8所述的原核表达载体pet
‑
32a
‑
ezh2的酶切鉴定的过程需要用ecor
ꢀⅴ
和sal i对pet
‑
32a
‑
ezh2进行双酶切。
34.优选的,步骤s5所述的目的片段的获取过程包括:
35.s501.用限制性内切酶ecor
ꢀⅴ
和sai i分别对pmd18
‑
t
‑
ezh2和pet
‑
32a进行双酶切,37℃水浴1h;
36.s502.凝胶电泳,回收2300bp左右和5900bp左右的目的片段。
37.优选的,步骤s6所述的原核表达载体pet
‑
32a
‑
ezh2的构建过程包括:
38.s601.目的片段的连接:将回收所得的5900bp左右的片段与2300bp左右的片段进行连接;
39.s602.混匀后,12~16℃,16h过夜;
40.s603.第二天在连接管内加入2ul solution
ꢀⅲ
,混匀后取10ul转化至rosetta感受态细胞中,得到原核表达载体pet
‑
32a
‑
ezh2。
41.一种ezh2的原核表达载体,所述ezh2的原核表达载体pet
‑
32a
‑
ezh2与ezh2的核苷酸序列一致,同源性为100%,其核苷酸序列如seq id no.1所示。
42.本发明的有益效果是:本发明公开了一种ezh2的原核表达载体及其构建方法,与现有技术相比,本发明的改进之处在于:
43.针对现有技术存在的问题,本发明提出了一种ezh2的原核表达载体及其构建方
法,本方法通过在体外培养和构建,成功构建了ezh2的原核表达载体pet
‑
32a
‑
ezh2,经测序得到原核表达载体pet
‑
32a
‑
ezh2与ezh2的核苷酸序列相同,为下一步获得ezh2原核表达蛋白奠定基础;同时可利用得到的ezh2的原核表达载体pet
‑
32a
‑
ezh2来制备抗鸡肿瘤性疾病相关的药物,为探究ezh2基因在鸡肿瘤性疾病中的作用机制提供材料,为鸡肿瘤性疾病的生物治疗提供了可能。
附图说明
44.图1为本发明实施例1pet
‑
32a
‑
ezh2构建策略图。
45.图2为本发明实施例1ezh2的扩增鉴定结果图。
46.图3为本发明实施例1pmd18
‑
t
‑
ezh2的pcr鉴定结果图。
47.图4为本发明实施例1pmd18
‑
t
‑
ezh2的酶切鉴定结果图。
48.图5为本发明实施例1pet
‑
32a
‑
ezh2的pcr鉴定结果图。
49.图6为本发明实施例1pet
‑
32a
‑
ezh2的酶切鉴定图。
50.其中:在图2中:m代表1kb dna ladder(dye plus);1,2,3,4分别代表肝,法,胸,脾中ezh2的扩增鉴定结果;
51.在图3中:m代表1kb dna ladder(dye plus);1,2,3,4,5,6,7分别代表pmd18
‑
t
‑
ezh2的pcr鉴定结果;
52.在图4中:m代表1kb dna ladder(dye plus);1,2,3,4,5分别代表pmd18
‑
t
‑
ezh2的酶切鉴定结果;
53.在图5中:m代表1kb dna ladder(dye plus);1,2,3,4,5分别代表pet
‑
32a
‑
ezh2的pcr鉴定结果;
54.在图6中:m代表1kb dna ladder(dye plus);1,2,3,4,5分别代表pet
‑
32a
‑
ezh2的酶切鉴定结果。
具体实施方式
55.为了使本领域的普通技术人员能更好的理解本发明的技术方案,下面结合附图和实施例对本发明的技术方案做进一步的描述。
56.实施例1:
57.参照附图1
‑
6所示的一种ezh2的原核表达载体及其构建方法,其中所述ezh2的原核表达载体的构建方法具体包括材料的准备和制备过程:
58.(一)材料准备:
59.1.材料
60.1.1菌株与质粒
61.由河南科技大学提供所需菌株和质粒,见表1:
62.表1:实验中所用的菌株与质粒
[0063][0064]
1.2主要实验器材,如表2所示:
[0065]
表2:实验仪器及其来源
[0066][0067][0068]
1.3主要试剂,本实验所用试剂及其来源,见表3:
[0069]
表3:主要试剂及其来源
[0070][0071][0072]
1.4主要培养基及试剂配制,主要培养基及试剂配制方法,见表4:
[0073]
表4:主要培养基及试剂配制
[0074]
[0075]
1.5引物
[0076]
primers for ezh2
[0077]
forward pimer:gggatatcatgggtcaaacaggaaa
[0078]
ecor v
[0079]
reverse primer:
[0080]
ctcgagttactgtcgacaagggatttccatttctc
[0081]
xho i sal i
[0082]
1.6原核表达质粒pet
‑
32a
‑
ezh2的构建策略图
[0083]
构建策略:(1)首先扩增基因ezh2,并克隆至pmd18
‑
t载体中,构建重组克隆载体pmd18
‑
t
‑
ezh2;(2)然后用ecor
ꢀⅴ
和sal i对pmd18
‑
t
‑
ezh2和pet
‑
32a进行双酶切,获得目的片段;(3)将获得的目的片段进行连接,得到pet
‑
32a
‑
ezh2;(4)最后提取重组质粒对pet
‑
32a
‑
ezh2进行pcr和酶切鉴定,其具体流程图如图1所示。
[0084]
(二)方法
[0085]
1.感受态细胞的制备
[0086]
在构建克隆载体和原核表达载体的过程中均需要用到感受态细胞,应提前制备好,制备过程如下:
[0087]
①
无菌环蘸取所保存菌液,在lb固体平板上划线,37℃温箱培养过夜,然后挑单菌落接种到3ml lb液体中37℃培养过夜;
[0088]
②
过夜培养物以1:100的比例转接到100ml lb液体的锥形瓶中,37℃250r/min振摇培养2h左右到对数生长期(约2
‑
3h);
[0089]
③
将培养物转移至无菌冰预冷的2个50ml聚丙烯管中,在冰浴上10min,使之冷却至0℃;
[0090]
④
4℃4000r/min离心10min,倒出培养液弃上清,将试管倒置60s,以使弃液完全流出;
[0091]
⑤
用50/25/12.5ml预冷的0.1mol/l cacl2重悬菌体3次,4℃4000r/min离心10min,弃去上清倒置60s;
[0092]
⑥
每50ml初始培养物用2ml无菌冰预冷的混合物(1.8ml 0.1mol/l cacl2和0.2ml甘油)重悬,分装为0.2ml/管,于
‑
70℃保存备用。
[0093]
2.ezh2的原核表达载体的构建,包括步骤
[0094]
s1.获取目的基因:
[0095]
s101.从鸡脾脏、肝脏、法氏囊和胸腺中提取总rna,采用试剂盒提取,具体操作如下:
[0096]
①
取3日龄雏鸡脾脏脾脏、肝脏、法氏囊和胸腺,加0.2ml buffer r
‑ⅰ
研磨,8000
×
g离心3min;
②
取0.15ml上清于1.5ml ep管,加0.25ml buffer r
‑ⅰ
,反复抽吸;
③
加0.15ml buffer r
‑ⅱ
,振荡,12000
×
g离心5min;
④
取上清,加0.25ml异丙醇,混合均匀;
⑤
将制备管置于2ml ep管中,转移步骤
④
中混合液于制备管中,6000
×
g离心1min;
⑥
弃滤液,加0.5ml bufferw1a,12000
×
g离心1min;
⑦
弃滤液,加0.7ml bufferw2,12000
×
g离心1min,重复步骤
⑦
一次;
⑧
弃滤液,空离,12000
×
g离心60s;
⑨
将制备管放入新的1.5ml ep管中,在制备膜中央加20~30ul buffer te(dnase&rnase
‑
free)或rnase
‑
free水;
⑩
室温静置1min,
12000
×
g离心1min,洗脱得rna。
[0097]
s102.对提取到的总rna进行template rna变性及反转录反应,具体操作如下:
[0098]
(1)按表5配制反应混合液
[0099]
表5:反应混合液
[0100][0101]
(2)在pcr仪上设置温度:
[0102]
65℃
ꢀꢀ
5min;
[0103]
4℃
ꢀꢀꢀ
∞
[0104]
(3)按表6配制下列反转录反应液:
[0105]
表6:反转录反应液
[0106][0107]
(4)在pcr仪上设置温度:
[0108]
42℃
ꢀꢀ
15~30min;
[0109]
95℃
ꢀꢀ
5min;
[0110]
4℃
ꢀꢀꢀ
∞;反应条件如表7所示
[0111]
表7:反转录反应条件
[0112][0113][0114]
s103.对反转录结束后的dna片段进行pcr反应,具体操作如下:
[0115]
(1)按表8配制pcr反应液,
[0116]
表8:pcr反应液
[0117][0118]
(2)在pcr仪上执行如下程序:70℃,15min;95℃,5min;95℃,1min;55℃,1min;72℃,2min 30s;返回第三步循环30次;72℃,10min;4℃,保存;反应条件如表9所示;
[0119]
表9:反应条件
[0120][0121][0122]
s104.将pcr后的产物,进行凝胶电泳,具体操作如下:
[0123]
①
将有机玻璃内槽置于底托中,水平放置,插上梳子;
②
将琼脂糖凝胶于微波炉中加热1分30秒,取出后倒胶约至梳子的1/3~2/3处;
③
待胶凝固后,拔出梳子,内槽放入电泳槽,向电泳槽中加tbe缓冲液至没过胶面;
④
把5ul loading buffer与20ul样品混匀,加样;
⑤
加marker,起标尺的作用;
⑥
打开开关,按run,进行电泳;
⑦
跑20~30分钟,关闭开关;
⑧
取出凝胶,观察是否出现目的条带。
[0124]
s105.回收2300bp左右的目的片段(回收过程中离心转速均为12000
×
g,时间均为1min):
[0125]
①
切胶,在切胶仪上尽可能小的切下含有目的dna的凝胶,称凝胶重量,以该重量作为一个凝胶单位(0.1g=0.1ml体积);
②
加入3倍凝胶单位的bufferde
‑
a,混合均匀后于
75℃加热,间断混合至凝胶完全融化;
[0126]
③
加入1.5倍凝胶单位的bufferde
‑
b,混合均匀,若目的片段<400bp,则需要加入1个凝胶体积的异丙醇;
④
将步骤
③
中的液体转移至dna制备管中,离心后弃滤液;
⑤
加0.5ml bufferw1缓冲液,离心后弃滤液;
⑥
加0.7ml bufferw2缓冲液,离心后弃滤液,重复步骤
⑥
一次;
⑦
空离,离心后弃滤液;
⑧
将制备管置入新的1.5ml的ep管中,向制备膜中央加25~30ul eluent或去离子水(eluent用前放65℃烘箱,以提高dna的洗脱效率),室温静置1min,离心,洗脱dna。
[0127]
s2.利用回收的2300bp左右的目的片段构建重组克隆载体pmd18
‑
t
‑
ezh2,其具体包括:
[0128]
s201.t载体连接:将回收所得的2300bp之间的片段与pmd18
‑
t进行连接,10ul连接反应体系如表10:
[0129]
表10:pmd18
‑
t载体片段与ezh2的连接反应体系
[0130][0131]
混匀后于16℃反应1h;
[0132]
s202.利用如上述步骤1得到的感受态细胞对重组克隆载体pmd18
‑
t
‑
ezh2进行转化,具体包括:
①
将感受态细胞dh5α在冰水混合物中融化;
②
将连接产物pmd18
‑
t
‑
ezh2加入dh5α中,冰浴30min;
③
将上述产物置于42℃热应激90s;
④
将上述产物在冰水混合物上2min;
⑤
在试管中加入0.5ml的lb液体,放置于摇床上,37℃培养1h;
⑥
取0.15ml凃板,板为lb amp固体平板,37℃过夜培养,第二日观察长菌情况。
[0133]
s203.提取重组质粒pmd18
‑
t
‑
ezh2(提质粒过程中离心转速均为12000
×
g,时间未特殊标明均为1min):
①
取1~4ml在lb液体中过夜的菌液置于ep管中,离心弃上清;
②
加0.25ml buffer s1将沉淀悬浮混匀,不应留有小的菌块;
③
加0.25ml buffer s2,温和并充分地上下翻转7~8次,混合均匀,使菌体充分裂解,直至形成透亮的溶液,此步骤不应超过5min;
④
加0.35ml buffer s3,温和并充分地上下翻转9~10次,离心10min;
⑤
吸取离心之后的上清液并转移到制备管中,离心后弃滤液;
⑥
加0.5ml的bufferw1,离心后弃滤液;
⑦
加0.7ml的bufferw2,离心后弃滤液;以同样的方法再用0.7ml bufferw2洗涤一次,弃滤液;
⑧
空离;
⑨
将制备管置入新的1.5ml ep管中,在制备膜中央加60~80ul eluent或去离子水,室温静置60s,离心,洗脱得质粒。
[0134]
s3.对克隆载体pmd18
‑
t
‑
ezh2进行pcr扩增与鉴定,其具体包括:
[0135]
s301.pcr反应体系如表11所示:
[0136]
表11:pcr扩增鉴定酶反应体系
[0137][0138]
s302.加完样品后,用旋涡混合器混匀,瞬离后,在pcr仪上执行如下程序:95℃,5min;95℃,1min;55℃,1min;72℃,2min30s;返回第二步循环30次;72℃,10min;4℃,保存。然后将扩增产物跑琼脂糖凝胶电泳,在凝胶成像系统下进行观察和拍照,见表12:
[0139]
表12:pcr反应条件
[0140][0141]
s4.对克隆载体pmd18
‑
t
‑
ezh2进行酶切鉴定,其具体过程包括:
[0142]
用限制性内切酶ecor
ꢀⅴ
和xho i对pmd18
‑
t
‑
ezh2进行酶切鉴定。20ul酶切反应体系如表13:
[0143]
表13:pmd18
‑
t
‑
ezh2酶切反应体系
[0144][0145]
样品加完后,混匀,37℃水浴1h,产物跑电泳观察存图。
[0146]
s5.获取目的片段,具体包括:
[0147]
s501.用限制性内切酶ecor
ꢀⅴ
和sal i分别对pmd18
‑
t
‑
ezh2和pet
‑
32a进行双酶切,37℃水浴1h;20ul酶切反应体系如表14所示:
[0148]
表14:pmd18
‑
t
‑
ezh2双酶切反应体系
[0149][0150]
s502.凝胶电泳,回收2300bp左右和5900bp左右的片段,电泳及回收步骤如s105所示。
[0151]
利用回收的2300bp和5900bp左右的片段构建原核表达载体pet
‑
32a
‑
ezh2,具体包括:
[0152]
s601.目的片段的连接:将回收所得的5900bp左右的片段与2300bp左右的片段进行连接,20ul连接反应体系如表15:
[0153]
表15:pet
‑
32a载体片段与ezh2的连接反应体系
[0154][0155]
s602.混匀后,12~16℃,16h过夜;
[0156]
s603.第二天在连接管内加入2ul solution
ꢀⅲ
混匀后取10ul转化至rosetta感受
态细胞中,转化过程如步骤s202所示,得到原核表达载体pet
‑
32a
‑
ezh2。
[0157]
s7.原核表达载体pet
‑
32a
‑
ezh2的pcr扩增鉴定,其过程包括与步骤s3相同。
[0158]
s8.原核表达载体pet
‑
32a
‑
ezh2的酶切鉴定,其具体过程包括:
[0159]
s801.pet
‑
32a
‑
ezh2的酶切鉴定:用ecor
ꢀⅴ
和sal i对pet
‑
32a
‑
ezh2进行双酶切,20ul酶切反应体系如表16:
[0160]
表16:酶切反应体系
[0161][0162]
s802.样品加完后,混匀,37℃水浴1h;
[0163]
s803.酶切产物跑电泳观察存图,看是否出现5900bp左右和2300bp左右的两个条带。
[0164]
(三)电泳及扩增结果
[0165]
1.ezh2的扩增鉴定结果
[0166]
提取雏鸡肝脏、脾脏、法氏囊和胸腺总rna,然后利用rt
‑
pcr扩增鸡ezh2后经琼脂糖凝胶电泳出现约2300bp的目的片段符合预期片段大小,如图2所示;
[0167]
2.pmd18
‑
t
‑
ezh2的鉴定结果
[0168]
2.1pmd18
‑
t
‑
ezh2的pcr鉴定结果:挑取转化后的单个菌落进行pcr鉴定,产物跑电泳后,出现2300bp左右的目的片段,符合预期片段大小,如图3所示;
[0169]
2.2pmd18
‑
t
‑
ezh2的酶切鉴定结果:pcr鉴定正确的菌落摇菌培养提质粒,用ecor
ꢀⅴ
、xho i进行双酶切后出现2300bp和2600bp左右的片段,用bamh i酶切后出现4000bp和400bp大小的片段,符合预期片段大小,见图4所示;
[0170]
2.3pmd18
‑
t
‑
ezh2的测序结果:从鸡脾脏中扩增并构建的pmd18
‑
t
‑
ezh2的测序结果与ezh2基因序列一致,同源性为100%,其核苷酸序列如seq id no.1所示;
[0171]
3.pet
‑
32a
‑
ezh2的鉴定结果:
[0172]
3.1pet
‑
32a
‑
ezh2的pcr鉴定结果
[0173]
挑转化后的单个菌落进行菌落pcr鉴定,pcr产物跑电泳后,出现2300bp左右的片段,如图5所示;
[0174]
3.2pet
‑
32a
‑
ezh2的酶切鉴定结果
[0175]
pcr鉴定正确的菌落接菌培养提质粒,用ecor
ꢀⅴ
和sal i进行双酶切鉴定,酶切鉴定结果出现位于2300bp左右的条带和5900bp左右的质粒条带,见图6所示;
[0176]
3.3pet
‑
32a
‑
ezh2的测序结果
[0177]
测序结果表明ezh2基因核苷酸序列完全正确,说明克隆片段为ezh2基因序列。
[0178]
通过上述结果表明:提取雏鸡肝脏、脾脏、法氏囊和胸腺总rna,然后利用rt
‑
pcr扩增约2300bp的目的片段,与ezh2基因大小一致;将其克隆入pmd18
‑
t载体,构建克隆载体pmd18
‑
t
‑
ezh2,pcr和酶切均可见2300bp左右的目的条带,进一步测序结果显示鸡脾脏中扩增并克隆构建的重组质粒中ezh2基因核苷酸序列完全正确;对构建好的重组质粒pmd18
‑
t
‑
ezh2和原核表达载体pet
‑
32a分别进行双酶切,将所得目的片段进行连接,构建重组原核表达载体pet
‑
32a
‑
ezh2,用eocr v和sal i酶切可见2300bp左右的目的带和5900bp左右的质粒条带,进一步测序结果显示重组质粒中ezh2基因核苷酸序列完全正确;以上结果证实,本实验成功构建了ezh2原核表达载体pet
‑
32a
‑
ezh2,为下一步获得ezh2原核表达蛋白奠定基础,也可为探究ezh2基因在鸡肿瘤性疾病中的作用机制提供材料。ezh2是聚硫蛋白复合物基因家族的重要成员之一,通过对核小体的修饰、染色体的重塑及干扰其他转录因子的转录调节,在胚胎的发育、细胞增殖及周期调节中起着重要作用,因此,通过本发明所述方法构建的ezh2的原核表达载体pet
‑
32a
‑
ezh2能够应用于鸡肿瘤性疾病药物的制备。
[0179]
(四)通过上述ezh2的原核表达载体的构建方法,可以得出:
[0180]
1.在本实验中,我们首先获取鸡脾脏、肝脏、法氏囊和胸腺总rna,以不同组织cdna为模板开始扩增ezh2片段,pcr扩增出大小约2300bp产物,克隆至pmd18
‑
t载体后,将8个阳性克隆分别送去测序确认,其中脾脏中获取的dna序列完全正确,得到了预期大小的dna序列;
[0181]
2.本实验成功扩增出鸡ezh2基因,然后成功构建出重组克隆载体pmd18
‑
t
‑
ezh2,然后利用ecor
ꢀⅴ
和sal i分别对pmd18
‑
t
‑
ezh2和pet
‑
32a进行双酶切,获得目的片段,最后对目的片段进行连接,并将重组质粒转化入rosetta感受态,成功构建出了原核表达载体pet
‑
32a
‑
ezh2,为下一步获得ezh2原核表达蛋白奠定基础,便于后续实验和研究;
[0182]
3.本实验包括提rna、反转录、提质粒、酶切、回收、连接、转化等一系列步骤,每一步操作不当都会对最终结果产生一定的影响。
[0183]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

