1.本发明涉及通过作用于与植物的根共生的丛枝菌根真菌而提高共生能力的共生促进剂和共生促进方法、以及植物的栽培方法。
背景技术:
2.已知丛枝菌根真菌是与植物的根共生的菌类,其共生于陆地植物的约80%中。根据结构上的特征,丛枝菌根真菌有时也被称为va菌根(vesicular
‑
arbuscular mycorrhiza,泡囊丛枝菌根)。丛枝菌根真菌由属于球囊菌门(glomeromycota)的约150种特殊菌类形成。丛枝菌根真菌与植物的根共生时,发挥促进磷等营养性成分的吸收、提高耐病性、促进水分吸收这样的功能,其结果是,对共生的植物显示出生长促进效果。因此,丛枝菌根真菌被期待作为微生物肥料进行农业利用。
3.关于丛枝菌根真菌,如非专利文献1中所记载的那样,已知通过脱落酸与pp2a(蛋白磷酸酶2a)形成复合物而促进菌丝丛枝的形成。即,如非专利文献1中所记载的那样,暗示了:通过使脱落酸作用于植物,能够促进丛枝菌根真菌的共生。
4.另外,专利文献1中公开了通过将赤霉素合成抑制剂以作为植物的生长抑制剂使用的量或比此更少的量进行施用而对植物促进菌根真菌的共生的方法。赤霉素合成抑制剂作用于植物而抑制作为植物激素之一的赤霉素的合成,由此能够促进菌根真菌的共生。
5.需要说明的是,丛枝菌根真菌具有无法在一般的培养基中进行培养、若不与植物共生则无法生长的性质。但是,如专利文献2中所记载的那样,已知可以通过在培养基中添加肉豆蔻酸、棕榈酸等脂肪酸而对丛枝菌根真菌进行培养的技术。
6.现有技术文献
7.非专利文献
8.非专利文献1:plant physiology,december 2014,vol.166,pp.2077
‑
2090
9.专利文献
10.专利文献1:日本特开2017
‑
38562号公报
11.专利文献2:日本特开2018
‑
170973号公报
技术实现要素:
12.发明所要解决的问题
13.如上所述,非专利文献1和专利文献1中公开了通过作用于植物而能够促进丛枝菌根真菌的共生,但是并未公开作用于丛枝菌根真菌的技术。专利文献2中公开了使脂肪酸作用于丛枝菌根真菌,但并不是提高丛枝菌根真菌的共生能力的技术。
14.因此,鉴于上述实际情况,本发明的目的在于提供通过作用于丛枝菌根真菌而能够提高丛枝菌根真菌的共生能力的共生促进剂和共生促进方法以及植物的栽培方法。
15.用于解决问题的方法
16.为了实现上述目的,本发明人进行了深入研究,结果发现,通过使氧化型谷胱甘肽
或胱硫醚作用于丛枝菌根真菌,能够大幅提高丛枝菌根真菌的共生能力,从而完成了本发明。
17.本发明包含下述内容。
18.(1)一种针对丛枝菌根真菌的共生促进剂,其以氧化型谷胱甘肽和/或胱硫醚作为有效成分。
19.(2)一种共生促进方法,其特征在于,使氧化型谷胱甘肽和/或胱硫醚与丛枝菌根真菌接触。
20.(3)一种微生物接种剂,其包含上述(1)的共生促进剂和丛枝菌根真菌。
21.(4)一种植物的栽培方法,其中,使被氧化型谷胱甘肽和/或胱硫醚作用后的丛枝菌根真菌与作为栽培对象的植物的根共生。
22.发明效果
23.本发明的共生促进剂和共生促进方法对丛枝菌根真菌起作用,能够提高丛枝菌根真菌的对植物的共生能力。因此,本发明的共生促进剂和共生促进方法与对植物的根起作用的物质或方法不同,能够更简便且高效率地使丛枝菌根真菌与植物共生。
24.本发明的植物的栽培方法使用共生能力提高了的丛枝菌根真菌,因此,能够充分发挥由丛枝菌根真菌产生的植物生长促进效果,能够制造生长得到促进的植物。
附图说明
25.图1是示出氧化型谷胱甘肽对丛枝菌根真菌的菌丝伸长促进效果的特性图。
26.图2是示出由氧化型谷胱甘肽带来的丛枝菌根真菌对双子叶植物的感染率提高效果的特性图。
27.图3是示出由氧化型谷胱甘肽带来的丛枝菌根真菌对单子叶植物的感染率提高效果的特性图。
28.图4是示出由胱硫醚带来的丛枝菌根真菌对植物的感染率提高效果的特性图。
29.图5是示出氧化型谷胱甘肽对根瘤菌的根瘤数、感染丝的效果的特性图。
30.图6是示出还原型谷胱甘肽和phoron对丛枝菌根真菌的共生能力的效果的特性图。
31.图7是示出还原型谷胱甘肽对丛枝菌根真菌的菌丝伸长的效果的特性图。
具体实施方式
32.以下,详细地对本发明进行说明。
33.<共生促进剂>
34.本发明的共生促进剂(以下简称为“共生促进剂”)含有氧化型谷胱甘肽和/或胱硫醚作为有效成分。共生促进剂作用于丛枝菌根真菌,具有促进丛枝菌根真菌的菌丝伸长的功能。接触了该共生促进剂的丛枝菌根真菌与未接触共生促进剂的丛枝菌根真菌相比,对植物的感染率显著提高。
35.在此,氧化型谷胱甘肽(以下有时简称为gssg)具有2分子还原型谷胱甘肽(有时简称为gsh;n
‑
(n
‑
γ
‑
l
‑
谷氨酰
‑
l
‑
半胱氨酰)甘氨酸)借助二硫键结合而成的结构。另外,氧化型谷胱甘肽也可以是与其他物质(酸、碱)结合而成的盐,也可以以该盐的水合物、它们的混
合物的形式含有。
36.作为gssg盐,没有特别限定,可以例示铵盐、钙盐、镁盐、钠盐、锂盐等。特别是作为gssg盐,可以优选为选自由铵盐、钙盐和镁盐组成的组中的一种以上的盐。
37.在使共生促进剂含有gssg的情况下,关于ggsg的浓度没有特别限定,例如可以设定为1μm~1mm,优选设定为10μm~500μm,优选设定为10μm~300μm,优选设定为10μm~100μm。
38.在此,胱硫醚是半胱氨酸合成的中间体,由高半胱氨酸和丝氨酸在胱硫醚β
‑
合酶的催化下形成。胱硫醚具有化学式:c7h
14
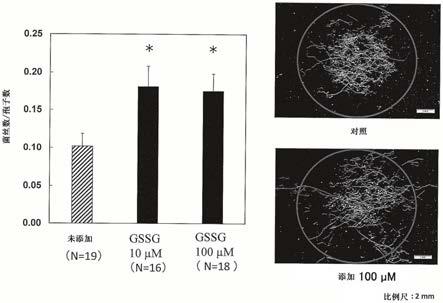
n2o4s,为2
‑
氨基
‑4‑
(2
‑
氨基
‑2‑
羧基乙基)硫代
‑
丁酸。另外,胱硫醚包括l型的胱硫醚、d型的胱硫醚、胱硫醚盐或各种形态的胱硫醚混合物。
39.在使共生促进剂含有胱硫醚的情况下,关于胱硫醚的浓度没有特别限定,例如可以设定为100nm~100μm,优选设定为500nm~10μm,优选设定为700nm~5μm。
40.<丛枝菌根真菌>
41.通过共生促进剂提高共生能力的丛枝菌根真菌(arbuscular mycorrhizal fungus)没有特别限定,可以为属于球囊菌门(glomeromycota)的全部菌根真菌。特别是作为丛枝菌根真菌,可以列举属于根孢囊霉(rhizophagus)属、巨孢囊霉(giga
‑
spora)属和球囊霉(glomus)属的真菌。其中,作为根孢囊霉(rhizophagus)属真菌的示例,可以列举阿拉伯根孢囊霉(rhizophagus arabicus)、明根孢囊霉(rhizophagus clarus)、护卫根孢囊霉(rhizophagus custos)、透光根孢囊霉(rhizophagus diaphanum)、聚生根孢囊霉(rhizophagus fasciculatus)、根内根孢囊霉(rhizophagus intraradices)、伊朗根孢囊霉(rhizophagus iranicus)、异形根孢囊霉(rhizophagus irregularis)、木薯根孢囊霉(rhizophagus manihotis)、多育根孢囊霉(rhizophagus proliferus)等。
42.丛枝菌根真菌在土壤中附着于作为共生对象的植物的根上时,一边通过细胞间隙一边伸出内生菌丝并侵入根的内部,在植物的细胞内形成被称为丛枝的共生器官。丛枝菌根真菌通过使菌丝布满根的内部而将从土壤中收集的磷、水分等经由丛枝供给至植物,另一方面,接受植物的光合产物,将其作为自身的能源加以利用。
43.<微生物接种剂>
44.利用上述共生促进剂和丛枝菌根真菌,能够提供使植物的生物质的量增产的微生物接种剂。通过使用该微生物接种剂,可以期待对作为栽培对象的植物的生物质增产效果。微生物接种剂含有上述共生促进剂和丛枝菌根真菌。另外,微生物接种剂除了含有这些共生促进剂和丛枝菌根真菌以外,可以还含有这些共生促进剂和丛枝菌根真菌的载体、乳化剂、分散剂、消泡剂、辅助剂等。
45.在此,微生物接种剂可以在单一的载体上保持有共生促进剂和丛枝菌根真菌,也可以包含保持有共生促进剂的载体和保持有丛枝菌根真菌的载体。
46.作为载体,可以列举磷酸缓冲液、碳酸缓冲液、生理盐水等液体载体。另外,作为载体,可以列举高岭土、粘土、滑石、膨润土、白垩、石英、硅镁土、蒙脱土、白炭黑、硅藻土等天然矿物粉末、硅酸、氧化铝、硅酸盐等合成矿物粉末、木炭、微晶纤维素、玉米淀粉、明胶、藻酸等固体载体。另外,作为固体载体,可以使用例如蛭石、硅砂、云母、浮石、石膏、碳酸钙、白云石、镁、熟石灰、磷石灰、沸石、硫酸铵等无机物质。另外,作为固体载体,也可以使用例如堆肥、泥炭、稻壳、米糠、大豆粉、烟草粉、核桃粉、小麦粉、木粉、淀粉、微晶纤维素等植物性
有机物质。此外,作为固体载体,也可以使用香豆酮树脂、石油树脂、醇酸树脂、聚氯乙烯、聚亚烷基二醇、酮树脂、酯胶、柯伯胶、达玛胶等合成或天然的高分子化合物、巴西棕榈蜡、蜂蜡等蜡类和脲类等。
47.此外,作为辅助剂,可以列举例如烷基硫酸酯类、烷基磺酸盐、烷基芳基磺酸盐、二烷基磺化琥珀酸盐等阴离子表面活性剂、高级脂肪族胺的盐类等阳离子表面活性剂、聚氧乙烯二醇烷基醚、聚氧乙烯二醇酰基酯、聚氧乙烯二醇多元醇酰基酯、纤维素衍生物等非离子表面活性剂、明胶、酪蛋白、阿拉伯胶等增稠剂、增量剂、粘结剂等。
48.如上构成的微生物接种剂可以制成例如液剂、粉剂、粒剂、乳剂、油剂、悬浮剂、水合剂、水溶剂、糊剂、胶囊剂、烟雾剂(气溶胶剂)等任意的制剂形态。
49.<植物的栽培方法>
50.通过使用上述的共生促进剂,能够对作为栽培对象的植物提高丛枝菌根真菌的感染率,其结果是,能够使该植物的生物质增产。在此,“使用共生促进剂”是包括如下方式的含义:将上述共生促进剂供给至土壤,使共生促进剂作用于该土壤中包含的丛枝菌根真菌的方式;将预先被上述共生促进剂作用后的丛枝菌根真菌供给至土壤的方式;将上述微生物接种剂供给至土壤的方式;将上述共生促进剂和丛枝菌根真菌供给至土壤的方式。
51.无论是上述哪种方式,利用上述共生促进剂均大幅提高了丛枝菌根真菌的共生能力,因此能够使作为栽培对象的植物的生物质增产。关于作为栽培对象的植物,只要是丛枝菌根真菌能够共生于根部的植物则没有任何限定。这样的植物可以为单子叶植物也可以为双子叶植物,可以为食用也可以为非食用。作为这样的植物的具体例,作为单子叶植物,可以列举例如:葱、洋葱、蒜、韭菜、香葱、藠头、韭葱等石蒜科;水稻、小麦、大麦、玉米、高粱等禾本科等。另外,作为这样的植物的具体例,作为双子叶植物,分别可以列举例如大豆、菜豆、小豆、豌豆、蚕豆、百脉根、花生、苜蓿、豇豆、百脉根等豆科;草莓等蔷薇科;胡萝卜等伞形科;黄瓜、南瓜、西瓜、甜瓜等葫芦科;茄子、番茄、青椒、马铃薯、辣椒、甜椒、灯笼椒等茄科;秋葵、棉花等锦葵科;番薯等旋花科等。这些之中,优选属于石蒜科葱属、豆科、禾本科或蔷薇科的植物,更优选葱、洋葱、草莓、水稻、小麦、大麦、百脉根、大豆和玉米。
52.作为将共生促进剂或微生物接种剂供给至土壤的方法,没有特别限定,例如可以通过向土中散布、混入、埋入、药液注入、药液灌注等方法来进行。在供给至土中时,可以对栽培植物的土的一部分进行,也可以对整体进行。作为施用共生促进剂或微生物接种剂的场所的具体例,可以列举例如栽植穴或其附近、垄沟或其附近、株间、培土整体、土壤整体、育苗箱、育苗盘、育苗瓶、苗床等。
53.另外,共生促进剂或微生物接种剂优选以粒剂等固体剂的形式供给至土壤。特别是共生促进剂,通过以粒剂等等固体剂的形式供给,能够防止从土壤中流出。
54.此外,优选将丛枝菌根真菌与共生促进剂一起供给至土壤、或者将上述微生物接种剂供给至土壤。通过将丛枝菌根真菌与共生促进剂一起供给至土壤、或者将上述微生物接种剂供给至土壤,能够进一步发挥由丛枝菌根真菌带来的植物生物质增产效果。
55.共生促进剂或微生物接种剂可以在播种或植物移植前预先施用至土中,也可以施用至播种或植物移植后的土中。施用时期可以列举例如播种前、播种时、播种后至出芽前的期间、出芽期、育种期、苗的移植时、插枝或插芽时、定植后的生长期间(开花前、开花中、开花后、即将抽穗前或抽穗期等)、果实的着色开始期等。此时,可以仅对土壤施用一次,也可
以多次施用。从尽量减少施用量、并且充分获得植物的生长促进效果的观点出发,优选在植物的初期生长阶段(具体而言,从出芽至开花或抽穗前的期间)或在此之前施用,更优选在育苗阶段或在此之前施用。
56.另一方面,在将预先被共生促进剂作用后的丛枝菌根真菌供给至土壤的方式中,首先,将丛枝菌根真菌在共生促进剂的存在下进行培养。丛枝菌根真菌的培养可以应用与共生的植物的双培养法,也可以应用仅对丛枝菌根真菌进行培养的方法。
57.仅对丛枝菌根真菌进行培养的方法可以列举例如使用mmn(改良melin
‑
norkrans)培养基进行培养的方法。另外,也可以应用使用在该mmn培养基中添加有色氨酸二聚物、亮氨酰脯氨酸的培养基的方法(例如日本特开2009
‑
095332号公报)、使用蛭石或珠光体等多孔载体的方法(例如日本特开2005
‑
027546号公报)。此外,也可以应用在培养基中添加碳原子数为13~18的饱和脂肪酸的方法(例如日本特开2018
‑
170973号公报)。
58.丛枝菌根真菌的培养中使用的培养基是包含葡萄糖、甘露糖、木糖、果糖、蔗糖、乳糖、棉子糖等可同化糖和磷酸氢钠等无机盐作为必需构成成分的培养基。另外,培养基根据需要还包含酵母粉末或酵母提取物、硫胺素或吡哆醇等各种维生素类、蛋白胨或麦芽提取物、nz胺(酪蛋白的酶水解物)等有机性氮源、无机酸等ph调节剂、以及平板培养基制作用的基剂例如琼脂等。作为公知的基础培养基,可以示出例如滨田培养基、改良滨田培养基、太田培养基、oh培养基、mmn培养基。另外,从孢子形成的观点出发,优选包含蛋白胨这样的有机性氮源的培养基。这些成分在溶解于水中后以液体培养基或平板培养基的形式用于培养。另外,根据需要对培养基的ph进行调节。在使用时ph为酸性侧、优选为5~7。在制成平板培养基的情况下,基剂的添加量大概为1~20mg/ml。培养方法与菌根真菌的一般培养方法相比没有特别变化,将丛枝菌根真菌的孢子接种到培养基(无论是液体培养基还是平板培养基)中,在25~35℃、优选约28℃的合适温度下进行培养。培养后,从接种后的孢子生长出菌丝,从菌丝新发出子孢子,形成多数充分长大的子孢子。
59.为了使共生促进剂预先作用于丛枝菌根真菌,可以应用向培养丛枝菌根真菌的培养基中添加共生促进剂的方法、将丛枝菌根真菌在上述培养基中培养后制成菌体悬浮液并向该菌体悬浮液中添加共生促进剂的方法等。无论利用哪种方法,通过使共生促进剂作用于培养后的丛枝菌根真菌,均能够提高丛枝菌根真菌的共生能力。
60.如上所述,通过提高丛枝菌根真菌的共生能力,能够使丛枝菌根真菌对植物的感染率提高,其结果是,能够发挥植物的生物质增产效果。
61.另外,在使规定的物质作用于作为栽培对象的植物的情况下,存在将给予了该物质的植物移种到土壤中需要耗费工时的问题、即使向土壤中供给该物质也很可能无法作用于作为目标的植物的根等问题。与此相对,如上所述,在使氧化型谷胱甘肽和/或胱硫醚作用于丛枝菌根真菌的方式中,无需移种作为栽培对象的植物的工时,并且能够非常简便地提高丛枝菌根真菌的共生能力。
62.实施例
63.以下,使用实施例更详细地对本发明进行说明,但本发明的技术范围不限于以下的实施例。
64.实施例1
65.在本实施例中,验证氧化型谷胱甘肽(gssg)对丛枝菌根真菌的菌丝伸长的影响。
66.在改良m培养基(0.3%gerlite(固化剂),becard and fortin,1988new phytologist,108,211
‑
218)中添加氧化型谷胱甘肽(10μm或100μm),接种丛枝菌根真菌(异形根孢囊霉(rhizophagus irregularis)daom197198)孢子,在30℃下培养4周。另外,为了进行比较,除了不添加氧化型谷胱甘肽以外,同样地对丛枝菌根真菌进行培养。然后,计数出比从接种了孢子的培养基的中心部起半径7.5mm的圆更伸长的菌丝数,求出单位孢子数的伸长程度。
67.将结果示于图1。由图1可知,与对照(未添加氧化型谷胱甘肽)相比,在添加10μm或100μm氧化型谷胱甘肽的情况下,在丛枝菌根真菌中观察到显著(*p<0.05,dunnett’s检验,n=16
‑
19)的菌丝伸长促进效果。
68.实施例2
69.在本实施例中,在土壤中添加氧化型谷胱甘肽,验证对双子叶植物进行栽培时的丛枝菌根真菌的感染率。
70.具体而言,在添加了gssg的土壤中使豆科植物百脉根(lotus japonicus)感染丛枝菌根真菌(异形根孢囊霉(rhizophagus irregularis)daom197198),测定侵入根内部的菌根真菌的感染率(%)。
71.首先,在无肥料的土壤中添加培养基(1/10量霍格兰(hoagland)no.2基础盐混合物(sigma)、0.1mm kno3),同时准备仅接种了丛枝菌根真菌孢子(4000个孢子或6000个孢子)的对照土壤与添加有丛枝菌根真菌孢子(4000个孢子)和gssg(10或100μm)的土壤。接着,向其中移植在琼脂培养基上发芽的百脉根种子(播种后3天)。使植物在23℃、16小时光照/8小时黑暗的条件下生长4周。4周后挖出百脉根,使用墨汁染色法对根内部的丛枝菌根真菌进行染色,一边在显微镜下观察一边测定菌根真菌的感染率(根的单位长度中存在的菌丝量[%])。
[0072]
将结果示于图2。由图2可知,与未添加gssg的对照(4000个孢子)的植物相比,在添加有gssg的植物中,观察到感染率的显著增加(*p<0.05,**p<0.01,dunnett’s检验,n=8)。该感染率与对接种了1.5倍量的孢子(6000个孢子)的对照植物的感染率相比,在10μm时为同等,在100μm时观察到比此更高的上升效果,能够观测到gssg添加对宿主植物的感染促进效果。
[0073]
与实施例1的结果合并,认为由于gssg添加对菌根真菌菌丝的伸长促进效果而使菌根真菌与宿主植物接触的机会增加,从而带来感染率的提高。
[0074]
实施例3
[0075]
在本实施例中,在土壤中添加氧化型谷胱甘肽,验证对单子叶植物进行栽培时的丛枝菌根真菌的感染率。
[0076]
具体而言,使单子叶植物的葱科植物虾夷葱(allium schoenoprasum)感染丛枝菌根真菌(异形根孢囊霉(rhizophagus irregularis)daom197198),测定侵入根内部的菌根真菌的感染率(%)。
[0077]
丛枝菌根真菌对植物的感染法与实施例2同样,在无肥料的土壤中添加培养基(1/10量霍格兰no.2基础盐混合物(sigma)、0.1mm kno3),作为对照,仅添加丛枝菌根真菌孢子(4000个孢子)、以及除孢子外还添加gssg(10或100μm),将灭菌后的虾夷葱种子直接播种到各土壤中。使植物在23℃、16小时光照/8小时黑暗的条件下生长4周。4周后挖出虾夷葱,使
用墨汁染色法对根内部的丛枝菌根真菌进行染色,一边在显微镜下观察一边测定菌根真菌的感染率(根的单位长度中存在的菌丝量[%])。
[0078]
将结果示于图3。由图3可知,与双子叶植物百脉根同样,在单子叶植物虾夷葱中也能够确认到gssg的添加对丛枝菌根真菌的感染率的显著(**p<0.01,dunnett’s检验,n=8)提高效果。
[0079]
实施例4
[0080]
在本实施例中,代替氧化型谷胱甘肽,进行胱硫醚(cystathionine)对丛枝菌根真菌感染率的影响的验证。
[0081]
植物使用虾夷葱,在无肥料的土壤中添加培养基(1/10量霍格兰no.2基础盐混合物(sigma)、0.1mm kno3),作为对照,仅添加丛枝菌根真菌孢子(500个孢子或1000个孢子)、以及添加孢子和胱硫醚(0.1或1mm),将灭菌后的虾夷葱种子直接播种到该土壤中。使植物在23℃、16小时光照/8小时黑暗的条件下生长4周。4周后挖出虾夷葱,使用墨汁染色法对根内部的菌根进行染色,一边在显微镜下观察一边测定菌根真菌的感染率(根的单位长度中存在的菌丝量[%])。
[0082]
将结果示于图4。由图4可知,与未添加的对照相比,通过添加1mm的胱硫醚而观察到显著的感染率上升效果。根据该结果,与氧化型谷胱甘肽同样地,通过添加作为谷胱甘肽合成中间体的胱硫醚,也能够确认到感染促进效果。
[0083]
比较例1
[0084]
在本比较例中,使用根瘤菌代替丛枝菌根真菌,验证氧化型谷胱甘肽对根瘤菌的感染的影响。
[0085]
在本比较例中,作为根瘤菌,使用百脉根根瘤菌(mesorhizobium loti、导入有荧光蛋白dsred的转化体)。在蛭石中混合b&d培养基(broughton and dilworth,1971)、终浓度0.1mm的kno3和根瘤菌、进而添加0、10、100μm氧化型谷胱甘肽而准备培养基。将该培养基50ml加入到装在瓶中的无肥料的土(蛭石)300ml中,将播种后第3天的百脉根幼苗种植于其中。在生长1周和2周后分别测量百脉根的根毛细胞中形成的成为根瘤菌的感染路径的感染丝、根中形成的作为共生器官的根瘤。将结果示于图5。由图5可知,在生长后1周对根瘤、感染丝形成均观察到显著的抑制效果,但在2周后不再观察到该效果。由该结果表明,氧化型谷胱甘肽对根瘤菌的感染没有效果、或者抑制根瘤形成。
[0086]
比较例2
[0087]
在本比较例中,使用还原型谷胱甘肽(gsh)和谷胱甘肽耗竭剂phoron代替氧化型谷胱甘肽和胱硫醚,验证还原型谷胱甘肽(gsh)和谷胱甘肽耗竭剂phoron对丛枝菌根真菌的感染的影响。
[0088]
利用与实施例3同样的方法在无肥料的土壤中添加培养基(1/10量霍格兰no.2基础盐混合物(sigma)、1mm kno3),作为对照,仅添加丛枝菌根真菌孢子(500个孢子、1000个孢子)、以及除接种500个孢子以外还添加胱硫醚(0.1或1mm)、gsh(0.1或1mm)和phoron(0.1或1mm),将灭菌后的虾夷葱种子直接播种到各土壤中。使植物在23℃、16小时光照/8小时黑暗的条件下生长1个月。1个月后挖出虾夷葱,使用墨汁染色法对根内部的丛枝菌根真菌进行染色,一边在显微镜下观察一边测定菌根真菌的感染率(根的单位长度中存在的菌丝量[%])。
[0089]
将结果示于图6。由图6可知,添加胱硫醚时,与接种500个孢子的对照相比感染率提高,在添加1mm时,观察到与接种1000个孢子相同程度的感染,但添加还原型谷胱甘肽gsh时,菌根真菌的感染受到抑制。在添加谷胱甘肽耗竭剂phoron的情况下,菌根真菌的感染也受到抑制。
[0090]
比较例3
[0091]
在本比较例中,使用还原型谷胱甘肽(gsh)代替氧化型谷胱甘肽和胱硫醚,验证还原型谷胱甘肽(gsh)对丛枝菌根真菌的菌丝伸长的影响。
[0092]
利用与实施例1同样的方法,在改良m培养基(0.3%gerlite)中添加还原型谷胱甘肽(10mm),接种丛枝菌根真菌(异形根孢囊霉(rhizophagus irregularis)daom197198)孢子,在30℃下培养1周。另外,为了进行比较,除了不添加还原型谷胱甘肽以外,同样地对丛枝菌根真菌进行培养。将结果示于图7。由图7可知,在添加有还原型谷胱甘肽gsh的培养基中,通过添加,发生丛枝菌根真菌的菌丝伸长的降低等,生长受到抑制,在高浓度(10mm)下菌丝完全不伸长、孢子死亡。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。