1.本发明涉及在活细胞中研究蛋白质
‑
蛋白质相互作用的荧光成像方法,具体涉及一种可有效识别假阳性信号的双分子荧光互补技术。
背景技术:
2.以蛋白质
‑
蛋白质相互作用(protein
‑
protein interactions,ppis)为基础的信号通路网络在众多生物学过程中扮演着非常重要的角色。尽管一些传统的实验方法,如免疫共沉淀(co
‑
immunoprecipitation)和酵母双杂交(yeast two
‑
hybrid assay)等,可以比较准确地鉴别蛋白质
‑
蛋白质相互作用,但这些技术仍有一定的局限性,例如,它们都无法在活细胞生理条件下对细胞内的蛋白质
‑
蛋白质相互作用进行直接观察和研究。为了解决这一问题,几种基于不同原理的活细胞蛋白质
‑
蛋白质相互作用可视化技术被相继开发应用,其中最具代表性的两种分别为荧光共振能量转移(fluorescence resonance energy transfer,fret)技术和双分子荧光互补(bimolecular fluorescence complementation,bifc)技术。fret技术基于两个激发和发射光谱有一定重叠的荧光蛋白在空间距离足够靠近时所发生的能量转移现象,可以实时检测瞬间发生的蛋白质
‑
蛋白质相互作用,但其对目标蛋白发生相互作用的距离以及排列方式有较高要求,并且对于较弱的相互作用检测能力有限。bifc技术利用荧光蛋白n末端和c末端这两个非荧光片段之间的结构互补能力来检测蛋白质
‑
蛋白质相互作用。该方法分别将这两个非荧光片段与可能发生相互作用的两个目标蛋白融合,如果两个目标蛋白确实发生相互作用,非荧光片段会由于空间距离的靠近而紧密结合并重构形成完整的荧光蛋白,进而可以使用荧光显微镜进行成像和定量计算。相比于fret技术,bifc技术具有易实现、灵敏度高等优势,可以检测到较弱的蛋白质
‑
蛋白质相互作用。近十几年来,基于bifc技术的实验方法已经被广泛应用于各类蛋白质
‑
蛋白质相互作用的研究。
3.尽管具备上述优点,bifc技术在用于可视化蛋白质
‑
蛋白质相互作用时仍存在假阳性信号较高的问题。这是由于两个非荧光片段n末端和c末端即使没有连接融合蛋白,也会由于随机碰撞导致空间距离靠近,引起自发的组装,进而产生大量假阳性信号。现行的实验方案无法有效区分由目标蛋白特异性结合产生的真实bifc信号与由随机碰撞产生的假阳性信号。此外,bifc荧光信号的强度严重依赖其表达质粒在细胞中的转染水平,细胞间质粒转染水平的差异也会影响研究人员对蛋白质
‑
蛋白质相互作用强弱的判断。
技术实现要素:
4.针对上述bifc技术的不足,本发明通过加入参考荧光蛋白的方法对现有bifc成像技术进行改进,旨在开发出一种能够有效识别假阳性信号的荧光标记方法,克服现有工具存在的无法区分真实信号和假阳性信号的问题。
5.本发明提供的技术方案的策略如下:
6.改造bifc表达质粒:本发明方案使用一种广泛应用于bifc标记的黄色荧光蛋白
venus作为bifc成像的报告荧光蛋白。除此之外,bifc系统还可以利用其他荧光蛋白进行标记成像,包括黄色荧光蛋白yfp和citrine、青色荧光蛋白cfp和cerulean、红色荧光蛋白mcherry以及光转化荧光蛋白meos3.2等,基于这些荧光蛋白的bifc系统理论上均可以使用本发明的方法进行改造。实现bifc荧光标记需要应用分子克隆技术在特定位点将荧光蛋白切分成非荧光片段n末端和c末端。venus荧光蛋白包含238个氨基酸,基于venus的bifc标记系统可以选择多种切分位点,包括第155位氨基酸、第173位氨基酸以及第210位氨基酸等。本发明方案将venus蛋白切分成n末端venus
‑
n(第1
‑
172氨基酸,vn)和c末端venus
‑
c(第155
‑
238氨基酸,vc)。为了识别假阳性信号,需要使用一个与报告荧光蛋白光学成像互不干扰的荧光蛋白作为参考荧光蛋白,并将其与报告荧光蛋白的非荧光片段n末端或c末端连接形成融合蛋白。本发明方案使用一种红色荧光蛋白mcherry作为参考荧光蛋白,并将其与vn连接形成vn
‑
mcherry标记片段。此外蓝色荧光蛋白bfp、绿色荧光egfp、红色荧光蛋白mirfp670、mirfp670nano和mirfp703等也可以作为参考荧光蛋白。完整的mcherry蛋白与切分后的venus蛋白形成共表达系统,mcherry荧光信号的强度可以用来表征质粒的表达水平,对表征bifc信号的venus荧光信号强度进行归一化处理——二者荧光信号强度的比值(venus荧光信号强度/mcherry荧光信号强度,f
venus
/f
mcherry
)可以作为识别假阳性信号的参数。如背景技术中提到的,bifc信号容易受到细胞与细胞之间质粒表达水平差异的影响,因此仅使用bifc信号无法对假阳性信号做出有效判断(例如,对于同一对融合了非荧光片段的目标蛋白,某个转染条件下bifc信号较强可能是由于该条件下质粒表达水平较高导致的),而本发明使用bifc信号与参考荧光信号的强度比值作为评估参数,消除了质粒表达水平差异的影响,在这一新体系中,荧光信号强度比值f
venus
/f
mcherry
较高即可反映该转染条件下存在假阳性信号,由此实现对假阳性信号的有效识别。
7.这一策略可以简单高效地应用于各种研究蛋白质
‑
蛋白质相互作用的bifc标记系统,可以在不影响bifc成像效果的前提下识别假阳性信号,作为外源表达系统获得最接近真实状态的细胞内蛋白质
‑
蛋白质相互作用情况。
8.在本发明的第一方面,提供了一种能够有效识别假阳性信号的bifc标记系统,包括用于待测蛋白a和标记荧光蛋白的n端片段融合表达的第一载体,以及用于待测蛋白b和标记荧光蛋白的c端片段融合表达的第二载体,其特征在于,所述第一载体或第二载体同时表达参考荧光蛋白。
9.本发明的bifc标记系统中,所述标记荧光蛋白作为bifc成像的报告荧光蛋白,可以是广泛应用于bifc标记的黄色荧光蛋白venus,还可以是其他荧光蛋白,例如黄色荧光蛋白yfp和citrine、青色荧光蛋白cfp和cerulean、红色荧光蛋白mcherry以及光转化荧光蛋白meos3.2等。以黄色荧光蛋白venus为例,可以选择多种切分位点将venus荧光蛋白分成非荧光n端片段和c端片段,所述切分位点可以是自n末端起的第155位氨基酸、第173位氨基酸以及第210位氨基酸等。在本发明的一个实施例中,将venus蛋白切分成n端的venus
‑
n片段(第1
‑
172氨基酸残基组成的肽段,vn)和c端的venus
‑
c片段(第155
‑
238氨基酸残基组成的肽段,vc)。
10.所述参考荧光蛋白与标记荧光蛋白在光学成像上互不干扰。在所述第一载体或第二载体上,参考荧光蛋白与标记荧光蛋白的n端片段或c端片段连接形成融合蛋白。红色荧光蛋白mcherry、蓝色荧光蛋白bfp、绿色荧光egfp、红色荧光蛋白mirfp670、mirfp670nano
和mirfp703等都可以作为参考荧光蛋白。
11.在本发明的第二方面,基于上述bifc标记系统,提供了一种能够有效识别假阳性信号的荧光标记方法,包括以下步骤:
12.1)基于bifc标记系统,构建标记荧光蛋白的n端片段和c端片段,分别命名为fp_n和fp_c;
13.2)选择在光学成像上与标记荧光蛋白互不干扰的另一个荧光蛋白作为参考荧光蛋白,命名为ref_fp;
14.3)构建待测蛋白a
‑
fp_n
‑
ref_fp融合表达的第一载体,和待测蛋白b
‑
fp_c融合表达的第二载体;或者,构建待测蛋白a
‑
fp_n融合表达的第一载体,和待测蛋白b
‑
fp_c
‑
ref_fp融合表达的第二载体;
15.4)用步骤3)构建的第一载体和第二载体转染活细胞;
16.5)对转染后活细胞进行荧光显微镜成像,计算标记荧光蛋白与参考荧光蛋白的荧光信号强度比值,检测假阳性信号的强弱。
17.上述步骤1)中,所述标记荧光蛋白可选择黄色荧光蛋白venus、yfp和citrine、青色荧光蛋白cfp和cerulean、红色荧光蛋白mcherry以及光转化荧光蛋白meos3.2等。优选的,以黄色荧光蛋白venus作为标记荧光蛋白,以其第155位氨基酸、第173位氨基酸或第210位氨基酸为切分位点,将venus蛋白切分成n端片段venus
‑
n(vn)和c端片段venus
‑
c(vc)。
18.上述步骤2)中,所述参考荧光蛋白可选择红色荧光蛋白mcherry、蓝色荧光蛋白bfp、绿色荧光egfp、红色荧光蛋白mirfp670、mirfp670nano和mirfp703等。优选的,以红色荧光蛋白mcherry作为参考荧光蛋白。
19.上述步骤3)中,参考荧光蛋白与标记荧光蛋白的n端片段或c端片段连接形成融合蛋白,参考荧光信号的强度可以用来表征载体的表达水平。
20.上述步骤5)中,对表征bifc信号的标记荧光信号强度进行归一化处理,以f
fp
代表标记荧光蛋白的荧光信号强度,以f
ref_fp
代表参考荧光蛋白的荧光信号强度,则二者荧光信号强度的比值f
fp
/f
ref_fp
可以作为识别假阳性信号的参数,该比值越高,说明产生的假阳性信号越多。因此,通过上述荧光标记方法不仅可以研究待测蛋白a和待测蛋白b的相互作用,还能够有效识别假阳性信号。
21.本发明的有益效果主要体现在:有效识别现有bifc成像方法存在的假阳性信号,有利于更准确地在活细胞中研究蛋白质
‑
蛋白质相互作用。
附图说明
22.图1.用于表达gag
‑
vn
‑
mcherry和gag
‑
vc的质粒结构图。
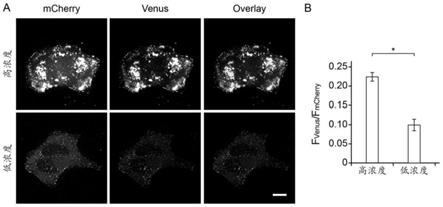
23.图2.bifc在不同质粒转染条件下标记gag的荧光成像与信号分析结果,其中:a为宽场显微镜荧光成像效果图,比例尺=10μm;b为venus和mcherry荧光信号强度比值f
venus
/f
mcherry
,图中数值代表平均值
±
标准误,*代表显著性差异(独立样本t检验,p<0.001)。
具体实施方式
24.下面的实施例以hiv
‑
1病毒的结构蛋白gag作为模式蛋白对本发明改进的bifc技术进行说明。
25.hiv
‑
1病毒在细胞膜上组装形成病毒颗粒需要依赖gag蛋白的多聚化,因此研究人员可以使用bifc技术对gag蛋白之间的特异性相互作用进行成像,进而研究hiv
‑
1的组装过程。本实施例构建了两种bifc表达质粒gag
‑
vn
‑
mcherry和gag
‑
vc,分别用于表达融合了vn
‑
mcherry标记片段和vc标记片段的gag蛋白。为了验证本发明可有效识别假阳性信号,本实施例设置了高浓度和低浓度两种不同的转染条件,分别给hela细胞转染200ng(高浓度组)和10ng(低浓度组)bifc表达质粒(gag
‑
vn
‑
mcherry和gag
‑
vc的质量比始终保持1:1,其他细节见实验方法2.2),具体实施方式如下。
26.1试剂与仪器
27.1.1主要试剂与材料
28.1)质粒hiv
‑
1 gag
‑
vn(用于构建表达gag
‑
vn
‑
mcherry的质粒,构建方法见实验方法2.1)和质粒hiv
‑
1 gag
‑
vc(用于表达gag
‑
vc,结构如图1所示)(二者均来自ronald c.montelaro,原始文献为distinct intracellular trafficking of equine infectious anemia virus and human immunodeficiency virus type 1 gag during viral assembly and budding revealed by bimolecular fluorescence complementation assays(j virol.2007oct;81(20):11226
‑
35.epub 2007aug 8.));空载体pbapo
‑
cmv neo(用于保持总质粒转染量恒定,见实验方法2.2;可购于takara bio公司)。
29.2)相关限制性内切酶、t4连接酶(可购于new england biolabs公司)。
30.3)感受态大肠杆菌细胞。
31.4)质粒提取试剂盒(可购于omega bio
‑
tek公司)。
32.5)人宫颈癌细胞系(hela细胞)。
33.6)含10%(vol/vol)胎牛血清(可购于pan
tm biotech公司)和1
×
glutamax
tm
(可购于thermo fisher公司)的dmem培养基(可购于corning公司);10
×
pbs(可购于corning公司);胰蛋白酶(可购于thermo fisher公司)。
34.7)转染试剂6(可购于promega公司)。
35.1.2主要仪器
36.1)pcr仪、凝胶电泳仪、生化培养箱、摇床、恒温孵化器。
37.2)细胞培养箱、生物安全柜。
38.3)荧光显微镜。
39.2实验方法
40.2.1质粒构建
41.构建hiv
‑
1 gag
‑
vn
‑
mcherry质粒(用于表达gag
‑
vn
‑
mcherry,结构如图1所示)。构建方法分为四步。第一步,以hiv
‑
1 gag
‑
vn质粒为模板,利用引物对p1/p2(引物序列见表1)pcr扩增出hiv
‑
1 gag
‑
vn的spei
‑
ecori片段(包含gag蛋白的部分编码区域和vn蛋白片段的完整编码区域),然后将扩增产物插入被nhei和ecori酶切(用于去除原质粒上的egfp)后的pegfp
‑
c1质粒中,得到pgag
partial
‑
vn
‑
c1质粒。第二步,以pmcherry
‑
c1质粒为模板,利用引物对p3/p4(引物序列见表1)pcr扩增得到mcherry蛋白的完整编码区域,然后将扩增产物插入被noti和agei酶切(用于去除原质粒上的vn)后的pgag
partial
‑
vn
‑
c1质粒中,得到pgag
partial
‑
mcherry
‑
c1质粒。第三步,以hiv
‑
1 gag
‑
vn质粒为模板,利用引物对p5/p6(引物序列见表1)pcr扩增得到vn蛋白片段的完整编码区域,然后将扩增产物插入被noti和xhoi
酶切后的pgag
partial
‑
mcherry
‑
c1质粒中,得到pgag
partial
‑
vn
‑
mcherry
‑
c1质粒。第四步,使用spei和agei酶切pgag
partial
‑
vn
‑
mcherry
‑
c1质粒得到gag
partial
‑
vn
‑
mcherry片段,并将其插入被spei和agei酶切(用于去除原质粒上的gag
partial
‑
vn)后的hiv
‑
1gag
‑
vn质粒中,得到目标质粒hiv
‑
1 gag
‑
vn
‑
mcherry。
42.2.2细胞转染
43.在细胞生长至50%
‑
70%覆盖率时,使用转染试剂6将hiv
‑
1 gag
‑
vn
‑
mcherry和hiv
‑
1 gag
‑
vc共转染进入hela细胞。对于高浓度组,hiv
‑
1 gag
‑
vn
‑
mcherry和hiv
‑
1 gag
‑
vc转染量各100ng(即bifc表达质粒总量为200ng);对于低浓度组,hiv
‑
1 gag
‑
vn
‑
mcherry和hiv
‑
1 gag
‑
vc转染量各5ng(即bifc表达质粒总量为10ng),并加入190ng空载体pbapo
‑
cmv neo使得总转染量保持200ng不变。
44.2.3荧光成像与结果分析
45.1)在细胞转染24小时后,使用奥林巴斯倒置荧光显微镜(olympus ix83)进行荧光成像,并使用成像软件cellsens dimension获取细胞图像(参数设置:曝光时间设为100ms,电子倍增增益(em gain)设为30)。
46.2)荧光成像结果如图2中a所示。在高浓度组和低浓度组中,venus信号均与mcherry信号在细胞膜上很好地共定位。不同的是,高浓度组中,细胞膜上的mcherry和venus信号呈现为形态异常的荧光斑块;而低浓度组细胞的细胞膜上的mcherry和venus信号呈现为较小的荧光亮点,更接近典型的病毒组装平台的形态结构。荧光成像结果提示,高浓度组细胞中产生了较多的bifc假阳性信号。
47.3)对细胞图像的荧光信号进行定量分析。使用图像处理软件imagej打开细胞图像,用freehand selections工具画出细胞轮廓,再通过measure命令分别测量venus通道和mcherry通道的细胞内荧光强度,使用相同的方法画出细胞外区域轮廓并测量得到各通道的背景荧光强度,各通道的细胞内荧光强度减去背景荧光强度即为该通道所对应的荧光蛋白的信号强度。通过该方法,我们可以计算得到venus荧光强度f
venus
与mcherry荧光强度f
mcherry
,其比值f
venus
/f
mcherry
的大小即可反映gag
‑
vn
‑
mcherry与gag
‑
vc之间的相互作用水平。对大于20个细胞进行分析与统计后,可得出该实验条件下f
venus
/f
mcherry
比值的平均值及标准误(分析数据见表2和表3,统计结果如图2中b所示)。在本实施例中,高浓度组的f
venus
/f
mcherry
比值显著高于低浓度组的f
venus
/f
mcherry
比值,证实高浓度组细胞产生了较多的bifc假阳性信号,进而说明在高浓度组细胞的细胞膜上所观察到的形态异常的荧光斑块(如图2中a所示)是由vn与vc非特异性自组装(而非gag蛋白之间的特异性相互作用)造成的。
48.表1.本实施例所使用的引物序列
[0049][0050]
表2.高浓度组的荧光信号分析结果
[0051]
[0052][0053]
表3.低浓度组的荧光信号分析结果
[0054]
[0055]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。