1.本发明涉及细菌快速检测技术领域,具体涉及一种快速检测细菌的微流控芯片、检测仪及检测方法及应用。
背景技术:
2.食源性致病菌作为引发食源性疾病的重要因素,已经引起各界的广泛重视。通常引发食源性疾病的致病菌主要有以下几种:致病性大肠埃希菌、沙门氏菌、志贺氏菌、单核细胞增生李斯特氏菌、副溶血性弧菌、溶血性链球菌、蜡状芽孢杆菌以及金黄色葡萄球菌。食物中的致病细菌可引起食物安全问题。这些细菌侵入人体,产生毒素可令人患病。因此,针对食源性致病菌的快速检测对于相关疾病的有效控制至关重要。
3.目前关于食源性细菌的检测方法主要有常规检测方法、免疫学检测方法、分子生物学方法以及生物传感器方法。常规的方法操作简便、成本低,但是检测周期长、速度慢。免疫学方法主要是利用抗原抗体的特异性反应来检测,检测速度快但成本较高。利用pcr技术的分子生物学方法特异性强,但是对设备及操作技能要求较高,不利于现场诊断。基于荧光或电化学的生物传感器检测速度快、灵敏度高,但是设备昂贵,不利于广泛使用。因此急需发展一种具有快速、灵敏且成本低廉的现场诊断或及时诊断(poct,point
‑
of
‑
care testing)的方法与装置。
技术实现要素:
4.鉴于上述现有技术中存在的问题,本发明的目的在于提供一种检测细菌的微流控芯片,包含上述微流控芯片的检测仪,以及方法和在细菌快速检测技术领域的应用。采用本发明所述微流控芯片,能够实现操作简便、灵敏度高,只需通过裸眼即可实现细菌的快速检测。
5.本发明第一方面提供了一种检测细菌的微流控芯片,包括:采样口、反应腔室及芯片通道;其中,
6.所述采样口及所述反应腔室通过芯片通道连接;
7.所述反应腔室预先包被引发链和适配体,用于细菌捕获及信号放大;
8.所述微流控芯片至少包括上层和下层,所述上层用于构建微通道,所述下层用于修饰包被的引发链和适配体,所述上层和所述下层贴合形成反应腔室,所述反应腔室内,进行杂交链式反应和g
‑
四联体介导的h2o2显色反应。
9.根据本发明所述的芯片的一些优选实施方式,所述反应腔室至少一侧的芯片材料为透明可视材料;优选地,所述微流控芯片由上层和下层组成,所述下层的材料为玻璃,和/或,所述上层的材料为聚二甲基硅氧烷(pdms)。
10.所述反应腔室内进行细菌捕获及信号放大,借助微流控芯片技术结合杂交链式反应(hcr)和g
‑
四联体介导的h2o2显色反应的方法,实现检测结果的快速可读取。
11.根据本发明所述的芯片的一些优选实施方式,所述微流控芯片还包括加样口,用
于所述引发链和适配体的注入,所述加样口位于所述反应腔室的上方。所述加样口用于引发链和适配体的提前注入包被,注入完成后可使用聚二甲基硅氧烷(pdms)微柱对加样口进行封口。
12.根据本发明所述的芯片的一些优选实施方式,所述微流控芯片还包括接口,所述接口位于与采样口相对的一侧;所述采样口与所述反应腔室通过进样通道连接,所述接口与所述反应腔室通过流出通道和表面张力细通道连接。
13.根据本发明所述的芯片的一些优选实施方式,所述进样通道与反应腔室连接端的宽度等于进样通道与采样口连接端的宽度。
14.根据本发明所述的芯片的一些优选实施方式,所述表面张力细通道与反应腔室连接端的宽度小于流出通道与接口连接端的宽度。
15.以上设计利用了表面张力原理,以防止加样口注入引发链和适配体时不慎进入流出通道中。
16.根据本发明所述的芯片的一些优选实施方式,所述进样通道与所述反应腔室连接端的宽度、所述进样通道与所述采样口连接端的宽度,以及所述流出通道与所述接口连接端的宽度为0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm以及它们之间的任意值,优选为1mm。
17.根据本发明所述的芯片的一些优选实施方式,所述表面张力细通道与所述反应腔室连接端的宽度为80μm、85μm、90μm、95μm、100μm、105μm、110μm、115μm、120μm、125μm、130μm、135μm、140μm、145μm、150μm以及它们之间的任意值,优选为100~120μm,更优选为100μm。
18.根据本发明所述的芯片的一些优选实施方式,所述芯片为梯形,所述梯形的上底设置所述采样口,所述梯形的下底设置所述接口。
19.根据本发明所述的芯片的一些优选实施方式,所述采样口的尺寸为(0.8~1.5)mm
×
(100~200)μm,优选为1mm
×
150μm。
20.根据本发明所述的芯片的一些优选实施方式,所述接口的尺寸为(0.8~1.5)mm
×
(100~200)μm,优选为1mm
×
150μm。
21.根据本发明所述的芯片的一些优选实施方式,所述反应腔室为圆形或椭圆形,优选为椭圆形。
22.根据本发明所述的芯片的一些优选实施方式,所述反应腔室为椭圆形,反应腔室的尺寸为:长轴长0.8~1.5cm,优选为1cm;短轴长0.3~0.7cm,优选为0.5cm。
23.根据本发明所述的芯片的一些优选实施方式,所述微流控芯片具有多个并联的反应腔室,所述进样通道和所述流出通道分别通过多个连接端与多个并联的所述反应腔室相连。设置多个反应腔室并联,一方面可以增强检测结果的可靠性,对于待测样品中仅有一种细菌的情况,采用多个反应腔室平行检测,最终取多个反应腔室检测的平均结果。另一方面可以提高细菌的检测效率,对于待测样品中有多种细菌的情况,可以在不同的反应腔室中预先包被不同的适配体,一次检测过程即可同时检测出多种细菌分别在待测样品中的大致浓度。通常设置4个反应腔室并联。
24.本发明第二方面提供了一种细菌检测仪,包括取样器及上述微流控芯片。
25.根据本发明所述的检测仪的一些优选实施方式,所述取样器包括芯片卡槽和微型泵,所述芯片卡槽上方的连接口与所述微型泵的入口相连;当所述微流控芯片插入芯片卡
槽时,位于芯片卡槽上方的连接口与所述微流控芯片的接口相连通。
26.根据本发明所述的检测仪的一些优选实施方式,所述连接口与所述微型泵相连的一端设置海绵片,防止取样时待测样品流入微型泵。
27.根据本发明所述的检测仪的一些优选实施方式,所述取样器与所述微流控芯片气密性连接。
28.根据本发明所述的检测仪的一些优选实施方式,所述采样器与所述微流控芯片可拆卸地连接。
29.根据本发明所述的检测仪的一些优选实施方式,所述取样器还包括控制芯片和控制按钮;所述控制芯片控制所述微型泵,例如但不限于,控制所述微型泵,进而控制所述微流控芯片采样的流速和体积。
30.本发明第三方面提供了利用上述细菌检测仪检测细菌的方法,包括:
31.s1.使用所述细菌检测仪吸取待测样品,在细菌检测仪的微流控芯片的反应腔室中与适配体接触,排出待测样品;
32.s2.使用细菌检测仪吸取试剂,在细菌检测仪的的微流控芯片的反应腔室中停留,排出试剂;
33.s3.使用所述细菌检测仪吸取h2o2和显色试剂溶液,观察颜色变化。
34.s1中,待测样品从采样口处进入微流控芯片的反应腔室,目标细菌与适配体充分接触,暴露出引发链序列。所述引发链的序列如seq id no.1所示。
35.根据本发明所述方法的一些优选实施方式,s2中,所述试剂包括用于发生杂交链反应的h1链和h2链,以及氯化血红素溶液。所述试剂与所述引发链在反应腔室中充分反应以发生杂交链式反应并形成g
‑
四链体结构。
36.根据本发明所述方法的一些优选实施方式,所述显色试剂包括2,2'
‑
联氮
‑
双
‑3‑
乙基苯并噻唑啉
‑6‑
磺酸(abts)。
37.在本发明的一些优选的实施例中,所述s3中,h2o2或显色试剂溶液的浓度对所述反应腔室中溶液最终的颜色具有较大影响,因此通常选h2o2的浓度为1~8mm,优选为2~5mm;和/或,所述显色试剂的浓度为1~6mm,优选为1~3mm。
38.在本发明的一些优选的实施例中,h2o2的浓度为2.92mm,显色试剂的浓度为1.8mm。
39.根据本发明,所述引发链与所述适配体互补结合,若样本中存在目标细菌,则目标细菌与适配体结合,并使所述引发链暴露。引发链在h1、h2以及氯化血红素存在的情况下发生杂交链式反应并形成g
‑
四联体结构,g
‑
四连体催化h2o2介导abts的显色反应。
40.h2o2和显色试剂溶液在反应腔室中反应约1min后即可裸眼观察反应腔室内的颜色,与制备的标准比色卡进行颜色对比,进而判断待测样品中目标细菌含量大致处于何种数量级。所述标准比色卡的制备按照上述步骤s1
‑
s3测定已知细菌浓度的待测样品,记录与目标细菌浓度相对应的显色溶液的颜色。重复上述操作,测定目标细菌的不同浓度下的显色溶液的颜色,即得目标细菌的标准比色卡。
41.本发明第四方面提供了上述微流控芯片或上述细菌检测仪或上述方法在细菌检测中的应用。
42.根据本发明所述的应用的一些优选实施方式,所述细菌为食源性病菌。
43.根据本发明所述的应用的一些优选实施方式,所述食源性病菌包括致病性大肠埃
希菌、沙门氏菌、志贺氏菌、单核细胞增生李斯特氏菌、副溶血性弧菌、溶血性链球菌、蜡状芽孢杆菌和金黄色葡萄球菌中的至少一种。
44.根据本发明所述的应用的一些优选实施方式,所述食源性病菌为致病性大肠埃希菌,所述适配体序列如seq id no.2所示,所述h1链的序列如seq id no.3所示,所述h2序列如seq id no.4所示。
45.根据本发明所述的应用的一些优选实施方式,所述食源性病菌为蜡状芽孢杆菌,所述适配体序列如seq id no.5所示,所述h1链的序列如seq id no.6所示,所述h2序列如seq id no.7所示。
46.根据本发明所述的应用的一些优选实施方式,所述食源性病菌为金黄色葡萄球菌,所述适配体序列如seq id no.8所示,所述h1链的序列如seq id no.9所示,所述h2序列如seq id no.10所示。
47.本发明的有益效果:
48.本发明提供的一种快速检测食源性病菌的微流控芯片及检测仪,体积小、成本低廉、利于批量生产,便于携带。本发明所述的微流控芯片、检测仪及检测方法,将对细菌的识别转化为对引发链的识别,基于微流控芯片技术及杂交链式反应(hcr)和g
‑
四联体催化h2o2介导的abts显色方法相结合,操作简单。与现有的利用pcr扩增检测细菌的方法相比,本发明的适配体能够实现对全细胞的检测识别,不需要对细菌的前处理,对于细菌浓度在103~107cfu/ml的待测液体检测可以在半小时之内完成,且检测灵敏度得到极大地提高,检测结果裸眼可视,无需其他辅助设备读数,有助于食源性致病菌的现场快速检测,适合于商业推广应用。
附图说明
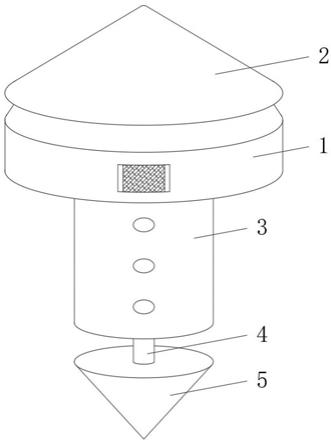
49.图1是实施例1中的微流控芯片的结构示意图。
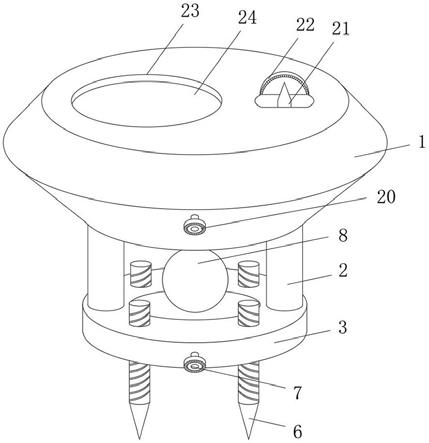
50.图2是实施例1中的细菌检测仪的结构示意图。
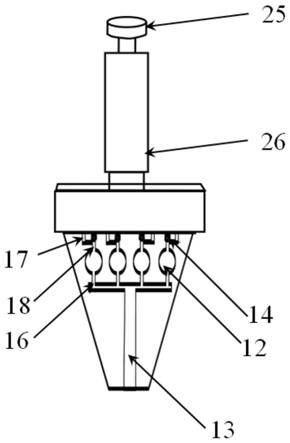
51.图3是实施例1中的取样器的结构示意图。
52.图4是实施例1
‑
3中的标准比色卡示意图。
53.附图标记说明:1
‑
微流控芯片;11
‑
采样口;12
‑
反应腔室;13
‑
芯片通道;14
‑
加样口;15
‑
接口;16
‑
进样通道;17
‑
流出通道;18
‑
表面张力阀细通道;2
‑
取样器;21
‑
芯片卡槽;211
‑
连接口;22
‑
微型泵;23
‑
海绵片;24
‑
控制芯片;25
‑
控制按钮;26
‑
壳体;3
‑
细菌检测仪。
具体实施方式
54.以下通过实施例对本发明进行详细说明,但本发明的保护范围并不限于下述说明。
55.实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购途径获得的常规产品。
56.下述实施例中,使用的细菌检测仪3由取样器2及微流控芯片1组成。其中,微流控芯片1的结构如图1所示:采样口11及反应腔室12通过进样通道16连接;反应腔室12预先包被引发链和适配体。微流控芯片1为两层,底层材料为玻璃,上层材料为pdms,芯片通道13位于上层。微流控芯片1为梯形,上底设置采样口11,下底设置接口15,采样口11的尺寸为1mm
×
150μm,接口15的尺寸为1mm
×
150μm。微流控芯片1包括4个椭圆形反应腔室12,反应腔室12的长轴长为1cm,短轴长为0.5cm。每个反应腔室12上方设有加样口14,注入引发链和/或适配体后,使用pdms微柱对加样口14进行封口。进样通道16与反应腔室12连接端的宽度,表面张力阀细通道18与反应腔室12连接端的宽度均为100μm。进样通道16与采样口11连接端的宽度,以及表面张力阀细通道18与接口15连接端的宽度均为1mm。
57.如图2和图3所示,取样器2的芯片卡槽21上方的连接口211与微型泵22的入口相连;当所述微流控芯片1插入芯片卡槽21时,位于芯片卡槽21上方的连接口211与微流控芯片1的接口15相连通。连接口211与微型泵22相连的一端设置海绵片23。取样器2与微流控芯片1气密性连接。控制芯片25控制所述微型泵22,进而控制微流控芯片1采样的流速和体积。
58.对目标病菌的具体检测步骤为:
59.s1.使用细菌检测仪吸取待测样品,在细菌检测仪的微流控芯片的反应腔室中与适配体接触15min后,排出待测样品;
60.s2.使用细菌检测仪吸取试剂,在细菌检测仪的微流控芯片的反应腔室中停留15min后,排出试剂;
61.s3.使用细菌检测仪吸取h2o2和显色试剂溶液,1min后观察颜色变化,判断待测样品中目标病菌的含量。h2o2的浓度为2.92mm,显色试剂的浓度为1.8mm。
62.在以下实施例1
‑
3中,如没有特殊说明,标准比色卡的制备过程为:
63.按照上述的目标病菌的检测方法,使用细菌检测仪分别吸取浓度为102cfu/ml、103cfu/ml、104cfu/ml、105cfu/ml、106cfu/ml和107cfu/ml的细菌溶液,记录特定浓度下步骤s3中所得显色试剂的颜色,形成目标病菌的标准比色卡。
64.在以下对比例1
‑
3中,如没有特殊说明,病菌含量测定均采用平板计数法,具体测定过程为:
65.取无菌平皿9套,分别标明10
‑4、10
‑5、10
‑6各3套。另取6支盛有4.5ml无菌水的试管,排列于试管架上,依次标明10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、10
‑6。
66.使用1ml无菌吸管精确地吸取0.5ml待测病菌悬液放入10
‑1的试管中,仍用此吸管将管内悬液来回吸吹三次,吸时伸入管底,吹时离开水面,使待测病菌悬液与无菌水混合均匀。另取一支吸管自上述10
‑1试管吸0.5ml放入10
‑2试管中,吸吹三次,其余依次类推,至10
‑6试管。
67.用3支1ml无菌吸管分别精确地吸取10
‑4、10
‑5、10
‑6的稀释菌液0.2ml,对号放入编好号的无菌培养皿中。
68.于上述盛有不同稀释度菌液的培养皿中,倒入溶化后冷却至45℃左右的肉膏蛋白胨琼脂培养基约15ml,置水平位置,迅速旋动混匀,待凝固后,倒置于37℃温室中培养。
69.培养24小时后,取出培养皿,算出同一稀释度三个平皿上的菌落平均数,并按下列公式进行计算:
70.每毫升中总活菌数=同一稀释度三次重复的菌落平均数
×
稀释倍数
×571.【实施例1】
72.采用上述方法及装置对致病性大肠埃希菌进行含量检测。
73.致病性大肠埃希菌:bncc 133264,购于北纳生物公司。
74.引发链的序列如seq id no.1所示,由上海生工生物公司合成。
75.适配体序列如seq id no.2所示,由上海生工生物公司合成。
76.试剂为用于杂交链反应的h1链和h2链,以及氯化血红素。其中,h1链的序列如seq id no.3所示,h2序列如seq id no.4所示,均由上海生工公司合成。氯化血红素的cas#为16009
‑
13
‑
5,购于sigmaaldrich。
77.按照本技术所述检测步骤进行,至s3后,观察到反应腔室中试剂颜色达到五级绿色,与标准比色卡对比后判断的致病性大肠埃希菌含量在106cfu/ml的数量级。
78.【对比例1】
79.对实施例1中的致病性大肠埃希菌进行含量测定,致病性大肠埃希菌含量为2.2
×
106cfu/ml。
80.由此可知,采用本技术所述的测定方法,测定致病性大肠埃希菌含量与实际量为同一个数量级。
81.【实施例2】
82.采用上述方法及装置对蜡状芽孢杆菌行含量检测。
83.蜡状芽孢杆菌:bncc 336744,购于北纳生物公司。
84.引发链的序列如seq id no.1所示,由上海生工生物公司合成。
85.适配体序列如seq id no.5所示,由上海生工生物公司合成。
86.试剂为用于杂交链反应的h1链和h2链,以及氯化血红素。其中,h1链的序列如seq id no.6所示,h2链的序列如seq id no.7所示,均由上海生工公司合成。氯化血红素与实施例1中的相同。
87.按照本技术所述检测步骤进行,至s3后,观察到反应腔室中试剂颜色达到二级绿色,与比色卡对比后判断的蜡状芽孢杆菌含量为103cfu/ml。
88.【对比例2】
89.对实施例1中的蜡状芽孢杆菌进行含量测定,蜡状芽孢杆菌含量为1.6
×
103cfu/ml。
90.由此可知,采用本技术所述的测定方法,测定蜡状芽孢杆菌含量与实际值为同一个数量级。
91.【实施例3】
92.采用上述方法及装置对金黄色葡萄球菌进行含量检测。
93.金黄色葡萄球菌:bncc 186335,购于北纳生物公司。
94.引发链的序列如seq id no.1所示,由上海生工生物公司合成。
95.适配体序列如seq id no.8所示,由上海生工生物公司合成。
96.试剂为用于杂交链反应的h1链和h2链,以及氯化血红素。其中,h1链的序列如seq id no.9所示,h2链的序列如seq id no.10所示,均由上海生工公司合成。氯化血红素与实施例1中的相同。
97.按照本技术所述检测步骤进行,至s3后,观察到反应腔室中试剂颜色达到六级绿色,与比色卡对比后判断的金黄色葡萄球菌含量为107cfu/ml。
98.【对比例3】
99.对实施例1中的金黄色葡萄球菌进行含量测定,金黄色葡萄球菌含量为2.8
×
107cfu/ml。
100.由此可知,采用本技术所述的测定方法,测定金黄色葡萄球菌含量与实际值为同一个数量级。
101.应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。