基于crispr/dcas9的宿主与病原微生物dna快速分离方法
技术领域
1.本发明专利涉及一种基于crispr/dcas9的宿主与病原微生物dna快速分离方法,属于生物技术领域。
背景技术:
2.病原微生物检测是疾病诊断领域的重要项目,基于rt
‑
qpcr或者分子标志物的传统检测方法只能检测某一个或者某一类病原微生物,无法对于未知病原或未知病症进行有效的诊断。随着肠道微生物和病原微生物领域的兴起,许多疾病或症状是多种微生物共同作用的结果。因此,高通量基因组学技术和高通量转录组学技术被用于系统鉴定病理学样本中的微生物种类,为病原微生物致使疾病的诊断提供了强大的诊断工具,被称为宏基因组新一代测序技术(metagenomics next generation sequencing,mngs)。但是,病理样本中通常含有大量的病人自身的细胞和核酸(高达90
‑
99%),这极大地占据了测序的数据,使得有效数据的占比只有不到10%。这不仅提高了测序的数据量和测序成本,也降低了病原微生物检出的效率和准确性。因此,开发一种能够有效靶向去除人类自身dna或者rna的技术,对于提高病理样本中致病微生物的检出效率,降低检测成本,具有重要的意义。
3.目前市面上主要还是利用差异裂解法来去除宿主基因组,其主要原理是利用细菌通常具有细胞壁,因此可以承受较为剧烈的裂解条件,从而达到针对性裂解宿主细胞的目的。宿主细胞裂解后可以通过核酸酶消解去除宿主核酸,完整的细菌和真菌随后被分离以及进一步核酸提取。但是,这种差异裂解法对宿主基因组的去除效率低,对微生物核酸的保留也不完整。而且反复的洗涤过程会导致大量的损失。这些导致回收的微生物损失严重,且具有严重的偏好性(越难被裂解和越容易回收的微生物保留越完整,如革兰氏阳性菌)。这些导致利用差异裂解法进行mngs检测具有严重的偏好性和较大的微生物种类损失,阻碍了mngs在致病微生物诊断领域的应用。很多病理学样本在取样和储存过程中就会造成病原微生物细胞破裂(如高温灭活处理和低温冷藏等),这些样本无法使用差异裂解法来进行病原微生物核酸富集,影响了病原微生物的检测精确性。此外,因为病理学样本具有较强的传染性和致病性,因此在分离过程中需要在指定要求的生物安全柜和高生物安全等级的实验室中进行,这既增加了病原微生物分离的难度和成本,也给操作人员的安全带来了隐患。而且,对于寄生于宿主细胞内部的病毒类病原微生物,无法使用差异裂解法进行病毒核酸的富集。因此,开发更加高效便捷且安全的宿主基因组去除技术,对于病原微生物检测领域,具有重要的价值和作用。
4.crispr/cas9基因编辑系统从被开发出来就一直受到基因诊断和治疗领域的重点关注。相较于传统的基因编辑技术,crispr技术具有编辑效率高、特异性高、操作简单等优点。因此,crispr技术在生命科学和医疗领域收到了广泛的应用和改进,包括crispr/dcas9系统、crispr/cas12系统、crispr/cas13系统等工具。crispr/dcas9系统将cas9核酸酶进行了核酸内切酶活性位点(d10a和h840a)失活突变,但不改变cas9蛋白结合靶dna的高亲和力和高特异性。因此,crispr/dcas9可以作为靶位点dna捕获的高效率高特异性工具。
技术实现要素:
5.本发明的目的是提供一种基于crispr/dcas9的宿主与病原微生物dna快速分离方法。
6.本发明采用的技术方案为:
7.一种基于crispr/dcas9的宿主与病原微生物dna快速分离方法,其步骤包括:
8.(1)设计全覆盖宿主全基因组的sgrna库;具体为利用http://www.e
‑
crisp.org/e
‑
crisp/、gpp(https://zlab.bio/guide
‑
design
‑
resources)或benchling crispr(https://benchling.com/editor)设计sgrna,每隔1mbp的dna中取1kb dna作为sgrna靶标,将这1kb dna输入到上述网站中进行sgrna设计,网站会自动生成这1kb dna上的sgrna列表并配有相应的打分,然后根据sgrna库中每条sgrna的sae值中的特异性分数和效率分数不低于0.4、sgrna在微生物基因组dna上没有靶位点或上靶位点的特异性分数不高于0.2的标准挑选打分最合适的sgrna,每隔1mbp挑选1条sgrna探针,共同组成sgrna库;
9.(2)根据步骤(1)中设计的sgrna库,合成sgrna引物,并混合成sgrna引物库;
10.(3)使用步骤(2)获得的宿主全基因组sgrna引物库,扩增出全基因组sgrna的双链dna模板;
11.(4)根据步骤(3)中的双链dna模板,体外转录sgrna库,dnase i消解,回收sgrna库;
12.(5)将步骤(4)中获得的sgrna库,与带标签的dcas9蛋白孵育组装,获得dcas9
‑
sgrna复合物;
13.(6)将步骤(5)组装的dcas9
‑
sgrna复合物与待测宿主样本dna孵育;
14.(7)用亲和磁珠或树脂特异性捕获带对应标签的dcas9
‑
sgrna
‑
宿主dna复合物;
15.(8)dna磁珠回收步骤(7)中上清的dna,即为富集的病原微生物dna;
16.(9)将步骤(7)中的亲和磁珠或树脂洗脱,即为宿主基因组dna。
17.优选的,步骤(1)中sgrna库相对均匀地覆盖宿主全基因组,相邻两个sgrna探针的靶位点之间的距离不高于2mbp。
18.优选的,sgrna库中每条sgrna探针的sae值中的特异性分数和效率分数不低于0.4,sgrna在微生物基因组dna上没有靶位点或上靶位点的特异性分数不高于0.2。
19.优选的,sgrna引物库中的每条引物的投入摩尔量基本相同。
20.优选的,sgrna引物库中的每条引物为在sgrna探针的5’端加上t7启动子序列,3’端加上tracrrna序列。
21.优选的,步骤(4)中体外转录使用t7 rna聚合酶。
22.优选的,步骤(5)dcas9蛋白是经核酸内切酶活性位点失活突变的cas9蛋白。
23.优选的,步骤(5)中带标签的dcas9蛋白是biotin
‑
dcas9、spy
‑
dcas9或flag
‑
dcas9。
24.优选的,步骤(7)中亲和磁珠为链霉亲和素磁珠、snap
‑
tag磁珠或anti
‑
flag磁珠。
25.优选的,步骤(7)中亲和树脂为链霉亲和素琼脂糖树脂或anti
‑
flag琼脂糖树脂。
26.优选的,步骤(5)中dcas9与sgrna的总量摩尔比为1:4
‑
1:96。
27.优选的,sgrna库总量与dna总量的投入质量比为30:1
‑
300:1。
28.本发明利用crispr/dcas9系统,开发了一种快速分离宿主全基因组和病原微生物
dna的技术,并应用到高通量测序技术上。将其命名为cas
‑
mngs(crispr/dcas9
‑
associatedseparation and metagenomics next generation sequencing)。相较于传统的差异裂解法,cas
‑
mngs具有以下几大优势:
29.1、特异性高、偏好性小。利用crispr/dcas9的高特异性的特点对宿主基因组基因快速靶向分离。
30.2、分离效果好。采用大规模sgrna探针库对宿主基因组进行全覆盖,保证了宿主基因组的分离效率。
31.3、不需要在生物安全柜和高等级实验室中进行操作、安全性高。操作极其简单,不需要对病原微生物进行复杂的分离。病理样本在操作前可以充分裂解、变性和灭活,不具备任何传染和感染能力,因此不需要在严格防感染的生物实验室中操作。这既降低了病理样本操作和储存的难度和成本,也提高了操作的安全性。
32.4、适用范围广。对完整细胞的样本和已经裂解的样本都适用。cas
‑
mngs不仅能够对细菌和真菌等具有细胞结构的病原进行富集,还能够对不具有细胞结构的病毒类病原微生物核酸进行富集。因此cas
‑
mngs比差异裂解法应用范围更广。
33.5、损失小、操作简单、耗时短、灵敏度高和成本低。
34.6、cas
‑
mngs能够保留宿主的基因组信息,既能够对增强病理样本中微生物dna的检测效率和灵敏度,也能够对宿主自身的基因组进行测序分析。这对于既要提高病原检测效率又要检测宿主基因组信息变化的疾病检测需求具有重要的意义。
35.综上,cas
‑
mngs是一种使用范围更广、灵敏度更高、安全性更好、效率更高的宿主与病原微生物核酸分离并测序技术。cas
‑
mngs不需要复杂的提取分离操作,也不需要保留病理样本中细胞的完整性,能够适用于各类经医学处理的病理样本(如高温灭活、低温储藏、强裂解液处理或者极端条件处理)。这既减少了病理样本储存和处理的难度和成本,也极大增强了病理样本储存和处理的安全性。因此,cas
‑
mngs可以广泛适用于各类病理学样本的检测,尤其是高传染高致病性的样本。
附图说明
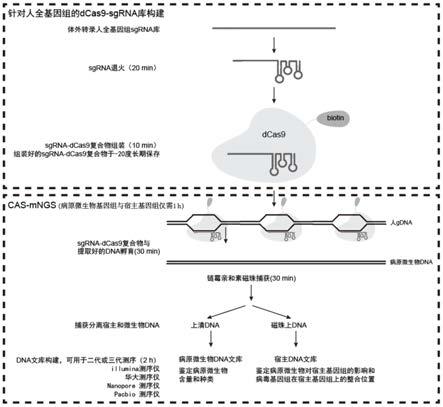
36.图1 cas
‑
mngs流程示意图。
37.图2 qsep验证sgrna库的dna模板片段大小。
38.图3 dna
‑
seq验证sgrna库的dna模板碱基分布。
39.图4 dna
‑
seq验证sgrna库的dna模板均一性。
40.图5 qsep验证sgrna文库片段大小。
41.图6 rna
‑
seq验证sgrna文库的碱基分布。
42.图7 rna
‑
seq验证sgrna文库的均一性。
43.图8 dna
‑
seq验证dna标准品中宿主人类染色质和微生物dna的含量。
44.图9 dna
‑
seq验证biotin
‑
dcas9和链霉亲和素磁珠对宿主人类染色质的捕获分离效果。
45.图10 dna
‑
seq验证biotin
‑
dcas9和链霉亲和素琼脂糖凝胶树脂对宿主人类染色质的捕获分离效果。
46.图11 dna
‑
seq验证spy
‑
dcas9和snap
‑
tag磁珠对宿主人类染色质的捕获分离效
果。
47.图12 dna
‑
seq验证flag
‑
dcas9和anti
‑
flag磁珠对宿主人类染色质的捕获分离效果。
48.图13 dna
‑
seq验证flag
‑
dcas9和anti
‑
flag琼脂糖凝胶树脂对宿主人类染色质的捕获分离效果。
49.图14 dna
‑
seq验证不同dcas9和sgrna摩尔比对cas
‑
mngs效率的影响。
50.图15 dna
‑
seq验证不同sgrna退火条件对cas
‑
mngs效率的影响。
51.图16 dna
‑
seq验证dcas9
‑
sgrna组装时间对cas
‑
mngs效率的影响。
52.图17 dna
‑
seq验证dcas9
‑
sgrna复合物与dna的孵育时间对cas
‑
mngs效率的影响。
53.图18 dna
‑
seq验证链霉亲和素磁珠孵育时间对cas
‑
mngs效率的影响。
54.图19可定量的dna
‑
seq验证cas
‑
mngs捕获分离前后宿主和微生物dna的含量。
55.图20可定量的dna
‑
seq验证cas
‑
mngs对宿主和病原微生物dna的回收效率和回收偏好性。
56.图21 dna
‑
seq验证cas
‑
mngs对不同dna投入量样本的捕获分离效果。
具体实施方式
57.下面结合附图对本发明的具体实施方式做进一步说明。
58.实施例中所使用的接头引物序列如表1所示。
59.表1接头序列
[0060][0061]
实施例1:人类全基因组sgrna的dna模板库的设计、制备及均一性鉴定。
[0062]
在本实施例中,我们设计并制备了人类全基因组sgrna库。具体实施方式如下:
[0063]
1)sgrna设计。利用e
‑
crispr(http://www.e
‑
crisp.org/e
‑
crisp/)对人类的全基因组进行sgrna的设计。每隔1mbp的dna中取1kb dna作为sgrna靶标,将这1kb dna输入到上述网站中进行sgrna设计,网站会自动生成这1kb dna上的sgrna列表并配有相应的打分。sgrna库中每条sgrna的sae值中的特异性分数和效率分数不低于0.4,sgrna在微生物基因组dna上没有靶位点或上靶位点的特异性分数不高于0.2。每隔1mbp挑选1条sgrna,共同组成sgrna库。hg38人类基因组序列上每间隔1mbp左右设计一条sgrna,总共2954条。根据sgrna设计相对应的引物,序列见附表18。也可以用gpp(https://zlab.bio/guide
‑
design
‑
resources)和benchling crispr(https://benchling.com/editor)来设计sgrna,sgrna设计要求与上面相同。
[0064]
2)sgrna引物库的制备。按照附表18进行引物合成,加depc水将每条引物溶解至10μm,每条引物取1μl,混合在一起,即为10μm sgrna引物库。
[0065]
3)pcr扩增sgrna库模板。使用翊圣生物的2
×
hieffgold pcr master mix(cat#10149)进行sgrna库模板的扩增,扩增体系和条件如下:
[0066]
表2
[0067][0068]
表3
[0069][0070]
反应结束后,使用翊圣生物的dna selection beads(cat#10601)进行rna回收。取88μl hieffdna selection beads,充分混匀后静置5min。将pcr管置于磁力架中分离磁珠和液体,待溶液澄清后(约3min),小心移除上清。保持pcr管始终置于磁力架中,加入200μl depc h2o新鲜配制的80%乙醇漂洗磁珠,室温孵育30sec后,小心移除上清。重复漂洗一次。用10μl移液器吸干净残留液体。保持pcr管始终置于磁力架中,室温下开盖干燥磁珠(5min)。加入22μl depc h2o,吹打至充分混匀,室温静置5min。将pcr管短暂离心并置于磁力架中静置,待溶液澄清后(约5min),小心移取20μl上清至新pcr管中。用nanodrop测定文库浓度。
[0071]
4)sgrna的模板dna库均一性测定。使用翊圣生物的hieffultima dna library prep kit for illumina对sgrna的模板dna库进行文库构建,用qbuit测定文库浓度,并用qsep100测定文库大小。构建好的文库在illumina novaseq 6000平台进行高通量测序。文库大小见图2,碱基分布见图3,sgrna的dna模板库中每条均一性见图4。
[0072]
结果如图2
‑
图4所示,制备的sgrna模板dna库均一性较好,适合用于体外转录sgrna库。
[0073]
实施例2:人类全基因组sgrna库的制备和均一性鉴定。
[0074]
在本实施例中,我们利用neb的nebnext small rna library prep kit(cat#e7300)对体外转录获得的sgrna库进行文库构建及测序,以鉴定sgrna库的均一性。具体实施方式如下:
[0075]
1)sgrna库体外转录。使用翊圣生物的t7high yield rna synthesis kit(cat#10623)对sgrna进行体外转录。反应体系如下:
[0076]
表4
[0077]
组分用量10
×
transcription buffer4μl
25mm ntps mix16μlt7 rna polymerase mix4μlsgrna的模板dna库1μg补加depc水至40μl
[0078]
37℃反应4h。加入2μl dnase i(1u/μl),37℃反应30min。
[0079]
反应结束后,使用翊圣生物的hieffrna cleaner(cat#10602)进行rna回收。取88μl hieffrna cleaner,充分混匀后静置5min。将pcr管置于磁力架中分离磁珠和液体,待溶液澄清后(约3min),小心移除上清。保持pcr管始终置于磁力架中,加入200μl depc h2o新鲜配制的80%乙醇漂洗磁珠,室温孵育30sec后,小心移除上清。重复漂洗一次。用10μl移液器吸干净残留液体。保持pcr管始终置于磁力架中,室温下开盖干燥磁珠(5min)。加入22μl depc h2o,吹打至充分混匀,室温静置5min。将pcr管短暂离心并置于磁力架中静置,待溶液澄清后(约5min),小心移取20μl上清至新pcr管中。用nanodrop测定文库浓度。
[0080]
2)sgrna库均一性测定。取100ng体外转录的sgrna文库,按照vahts small rna library prep kit for illumina(cat#nr801
‑
01)进行文库构建。用qbuit测定文库浓度,并用qsep100测定文库大小。构建好的文库在illumina novaseq 6000平台进行高通量测序。文库大小见图5,碱基分布见图6,sgrna库中每条sgrna的含量及均一性见图7。
[0081]
结果如图5
‑
图7所示,制备的sgrna库均一性较好,适合用于全基因组范围对人类gdna进行捕获。
[0082]
实施例3:含病原微生物dna的标准品制备与检测。
[0083]
在本实施例中,我们制备了病原微生物dna的标准品,并利用dna建库测序验证标准品中病原微生物的含量比例。具体实施方式如下:
[0084]
1)dna标准品混合物的制备。使用翊圣生物的cell/tissue dna kit(cat#18700)提取293f细胞的基因组dna。使用翊圣生物的bacterial dna kit(cat#18806)提取大肠杆菌和嗜热脂肪芽孢杆菌的基因组dna。使用翊圣生物的fungal dna kit(cat#18812)提取毕赤酵母和串珠状赤霉菌的基因组dna。支原体基因组dna标准品购买自minerva biolabs,hbv dna标准品购买自zeptometrix(cat#p0060),t7噬菌体dna标准品购买自applichem(cat#a5197)。使用qubit测定标准品浓度。将以上dna按照下表的比例进行混合:
[0085]
表5
[0086]
[0087][0088]
qubit测定dna标准品浓度,并用depc水稀释成100ng/μl的dna标准品。
[0089]
2)dna标准品文库构建。取100ng dna标准品,使用翊圣生物的hieffonepot dna library prep kit for illumina(cat#12203)进行dna文库构建,并在illumina novaseq 6000平台进行测序。将测序结果分别比对到人类、大肠杆菌、嗜热脂肪芽孢杆菌、酵母、串珠状赤霉菌、t7噬菌体、支原体和hbv dna上,计算测序结果中各病原微生物dna的占比,结果见图8。
[0090]
如图8所示,标准品中97.3%的dna为人类的基因组dna,剩余病原微生物的含量为2.7%,其中7种病原微生物包含细菌、真菌、支原体、噬菌体和病毒,dna含量占比在0.019%
‑
42.54%不等。这比例能够很好地模拟病理样本中宿主基因组和病原微生物dna的含量占比,可以用于后续人类宿主基因组和病原微生物的分离检测与分析。
[0091]
实施例4:五种不同dcas9捕获方式的比较。
[0092]
在本实施例中,我们比较了三种不同dcas9捕获方式分离实施例3制备的dna标准品中人类宿主基因组和病原微生物dna的效果。具体实施方式如下:
[0093]
1)sgrna库退火。取10μg体外转录的sgrna库,按照以下方式退火。
[0094]
表6
[0095]
组分用量sgrna库1μg/0.3nmol10
×
退火缓冲液1μl补加depc水至10μl
[0096]
85℃5min,(85℃
‑
15℃)
‑
0.1℃/s,15℃5min。此时sgrna的浓度为30μm。
[0097]
10
×
退火缓冲液:100mm tris
‑
hcl(ph 7.5),500mm nacl。
[0098]
2)生物素标记dcas9介导的人类宿主dna捕获。
[0099]
dcas9
‑
sgrna复合物组装:使用sigma的dcas9
‑
3xflag
‑
biotin protein(cat#dcas9prot),按照说明书稀释成25μm。在退火好的sgrna中加入1μl 25μm dcas9
‑
3xflag
‑
biotin protein混匀后室温孵育10min。加入5μl甘油后即为1.67μm dcas9
‑
sgrna复合物,组装好的dcas9
‑
sgrna复合物可保存于
‑
20℃。
[0100]
dcas9
‑
sgrna
‑
dna孵育:按照下表进行配制:
[0101]
表7
[0102]
组分用量1.67μm dcas9
‑
sgrna复合物3μl
10
×
dcas9结合缓冲液2μldna投入量10ng补加depc水至20μl
[0103]
37℃反应1h。
[0104]
链霉亲和素磁珠或链霉亲和素琼脂糖树脂捕获:
[0105]
a.取10μl dynabeads
tm m
‑
270链霉亲和素磁珠(thermofisher,cat#65305),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。将pcr管置于磁分离架上,回收上清,磁珠使用25μl 1
×
dcas9结合缓冲液悬浮。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。
[0106]
b.取10μl streptavidin,agarose conjugate(millipore,cat#16
‑
126),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。100
×
g离心3min,回收上清,琼脂糖树脂使用25μl 1
×
dcas9结合缓冲液悬浮。上清和琼脂糖树脂中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。琼脂糖树脂高速离心后取上清。
[0107]
3)spy dcas9(snap
‑
tag)介导的人类宿主dna捕获。
[0108]
dcas9
‑
sgrna复合物组装:使用neb的spy dcas9(snap
‑
tag)。在退火好的sgrna中加入1.25μlspy dcas9混匀后室温孵育10min。加入5μl甘油后即为1.67μm dcas9
‑
sgrna复合物,组装好的dcas9
‑
sgrna复合物可保存于
‑
20℃。
[0109]
dcas9
‑
sgrna
‑
dna孵育:按照下表进行配制:
[0110]
表8
[0111][0112][0113]
37℃反应1h。
[0114]
snap
‑
capture magnetic beads捕获:取5μl snap
‑
capture magnetic beads(neb,cat#s9145s),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。将pcr管置于磁分离架上,回收上清,磁珠使用25μl 1
×
dcas9结合缓冲液悬浮。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。
[0115]
4)flag
‑
dcas9介导的人类宿主dna捕获。
[0116]
dcas9
‑
sgrna复合物组装:使用sigma的dcas9
‑
3xflag
‑
biotin protein(cat#dcas9prot),按照说明书稀释成25μm。在退火好的sgrna中加入1μl 25μm dcas9
‑
3xflag
‑
biotin protein混匀后室温孵育10min。加入5μl甘油后即为1.67μm dcas9
‑
sgrna复合物,
组装好的dcas9
‑
sgrna复合物可保存于
‑
20℃。
[0117]
dcas9
‑
sgrna
‑
dna孵育:按照下表进行配制:
[0118]
表9
[0119]
组分用量1.67μm dcas9
‑
sgrna复合物3μl10
×
dcas9结合缓冲液2μldna投入量10ng补加depc水至20μl
[0120]
37℃反应1h。
[0121]
anti
‑
flag磁珠或链霉亲和素琼脂糖树脂捕获:
[0122]
a.取5μlm2磁珠(millipore,cat#m8823),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。将pcr管置于磁分离架上,回收上清,磁珠使用25μl 1
×
dcas9结合缓冲液悬浮。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。
[0123]
b.取5μl抗
‑
flag m2亲和琼脂糖凝胶(millipore,cat#a2220),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。100
×
g离心3min,回收上清,琼脂糖树脂使用25μl 1
×
dcas9结合缓冲液悬浮。上清和琼脂糖树脂中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。琼脂糖树脂高速离心后取上清。
[0124]
5)dna文库构建。
[0125]
使用翊圣生物的onepot dna library prep kit for illumina(cat#12203)进行dna文库构建,并在illumina novaseq 6000平台进行测序。将测序结果分别比对到人类、大肠杆菌、嗜热脂肪芽孢杆菌、酵母、串珠状赤霉菌、t7噬菌体、支原体和hbv dna上,计算测序结果中各病原微生物dna的占比,结果见图9
‑
图13。
[0126]
结果如图9
‑
13所示,五种dcas9捕获方式都能够有效捕获分离宿主人类的基因组dna。其中biotin
‑
dcas9和链霉亲和素磁珠的捕获方式具有最高的捕获分离效率和特异性。溶液中宿主人类基因组从97.3%去除到只剩下9.16%,而捕获下来的dna中人类宿主dna占比达到99.63%。捕获之后的上清对于不同投入量的微生物都具有很好的检出能力,这也说明基于crispr/dcas9的宿主基因组捕获分离方法能够显著提高细菌、真菌、支原体、噬菌体和病毒等微生物dna的检出效率。因此,biotin
‑
dcas9和链霉亲和素磁珠的捕获方式是最合适的宿主基因组捕获分离方式,我们将其命名为cas
‑
mngs(crispr/dcas9
‑
associated separation and metagenomics next generation sequencing)。在接下来的实施例中,我们验证了影响cas
‑
mngs的条件并完善了cas
‑
mngs的流程。
[0127]
实施例5:sgrna库投入量对cas
‑
mngs效率的影响。
[0128]
在本实施例中,我们验证了sgrna库对cas
‑
mngs效率的影响。具体实施方式如下:
[0129]
1)sgrna库退火。将不同浓度sgrna库按照以下方式退火。
[0130]
表10
[0131][0132]
85℃5min,(85℃
‑
15℃)
‑
0.1℃/s,15℃5min。此时sgrna的浓度为10
‑
240μm。
[0133]
2)生物素标记dcas9介导的人类宿主dna捕获。
[0134]
dcas9
‑
sgrna复合物组装:使用sigma的dcas9
‑
3xflag
‑
biotin protein(cat#dcas9prot)。在退火好的sgrna中加入1μl 25μm dcas9
‑
3xflag
‑
biotin protein混匀后室温孵育10min。加入5μl甘油后即为1.67μm dcas9
‑
sgrna复合物,组装好的dcas9
‑
sgrna复合物可保存于
‑
20℃。dcas9与sgrna摩尔浓度比见下表:
[0135]
表11
[0136]
sgrna投入量(μg)0.330.661248dcas9与sgrna摩尔比1:41:81:121:241:481:96
[0137]
3)dcas9
‑
sgrna
‑
dna孵育:按照下表进行配制:
[0138]
表12
[0139]
组分用量dcas9
‑
sgrna复合物3μl10
×
dcas9结合缓冲液2μldna投入量10ng补加depc水至20μl
[0140]
37℃反应1h。
[0141]
4)链霉亲和素磁珠或链霉亲和素琼脂糖树脂捕获:取10μl dynabeads
tm m
‑
270链霉亲和素磁珠(thermofisher,cat#65305),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。将pcr管置于磁分离架上,回收上清,磁珠使用25μl 1
×
dcas9结合缓冲液悬浮。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。
[0142]
5)dna文库构建:使用翊圣生物的onepot dna library prep kit for illumina(cat#12203)进行dna文库构建,并在illumina novaseq 6000平台进行测序。将测序结果分别比对到人类、大肠杆菌、嗜热脂肪芽孢杆菌、酵母、串珠状赤霉菌、t7噬菌体、支原体和hbv dna上,计算测序结果中各病原微生物dna的占比,结果见图14。
[0143]
结果如图14所示,当dcas9与sgrna库的摩尔投入量比为1:12
‑
1:48时,宿主人类基因组捕获分离的效率最好。当比例为1:24时,上清中人类宿主dna的占比只剩下5.93%,而磁珠捕获下来的dna中宿主人类基因组的占比达到99.73%。上清中剩下的dna能够显著提高对细菌、真菌、支原体、噬菌体和病毒等病原微生物的检出能力和效率。
[0144]
实施例6:sgrna退火条件对cas
‑
mngs效率的影响。
[0145]
在本实施例中,我们验证了sgrna退火条件对cas
‑
mngs效率的影响。具体实施方式如下:
[0146]
1)sgrna库退火。将sgrna库按照以下方式退火。
[0147]
表13
[0148][0149]
退火条件如下:
[0150]
条件1:不退火
[0151]
条件2:85℃5min,(85℃
‑
15℃)
‑
0.1℃/s,15℃5min。
[0152]
条件3:85℃5min,4℃5min。
[0153]
条件4:85℃5min,75℃5min,65℃5min,55℃5min,45℃5min,35℃5min,25℃5min,15℃5min。
[0154]
dna孵育、磁珠捕获、dna建库和数据分析方式如实施例5相同。结果见图15。
[0155]
结果如图15所示,退火条件2的捕获分离效果最好。
[0156]
实施例7:dcas9
‑
sgrna组装时间对cas
‑
mngs效率的影响。
[0157]
在本实施例中,我们验证了dcas9
‑
sgrna组装时间对cas
‑
mngs效率的影响。具体实施方式如下:
[0158]
1)sgrna库退火。将不同浓度sgrna库按照以下方式退火。
[0159]
表14
[0160][0161]
85℃5min,(85℃
‑
15℃)
‑
0.1℃/s,15℃5min。
[0162]
2)生物素标记dcas9介导的人类宿主dna捕获。
[0163]
dcas9
‑
sgrna复合物组装:使用sigma的dcas9
‑
3xflag
‑
biotin protein(cat#dcas9prot)。在退火好的sgrna中加入1μl 25μm dcas9
‑
3xflag
‑
biotin protein混匀后分别在室温孵育10、20、30、60min。加入5μl甘油后即为1.67μm dcas9
‑
sgrna复合物。
[0164]
dna孵育、磁珠捕获、dna建库和数据分析方式如实施例5相同。结果见图16。
[0165]
结果如图16所示,dcas9与sgrna的组装时间在10min时即可达到很好的捕获分离
效果,延长时间并不会明显改善捕获分离的效率。
[0166]
实施例8:dcas9
‑
sgrna复合物与dna的孵育时间对cas
‑
mngs效率的影响。
[0167]
在本实施例中,我们验证了dcas9
‑
sgrna复合物与dna的孵育时间对cas
‑
mngs效率的影响。具体实施方式如下:
[0168]
1)sgrna库退火。与实施例6相同。
[0169]
2)生物素标记dcas9介导的人类宿主dna捕获。
[0170]
dcas9
‑
sgrna复合物组装:使用sigma的dcas9
‑
3xflag
‑
biotin protein(cat#dcas9prot)。在退火好的sgrna中加入1μl 25μm dcas9
‑
3xflag
‑
biotin protein混匀后分别在室温孵育10min。加入5μl甘油后即为1.67μm dcas9
‑
sgrna复合物,组装好的dcas9
‑
sgrna复合物保存于
‑
20℃。
[0171]
dcas9
‑
sgrna
‑
dna孵育:按照下表进行配制:
[0172]
表15
[0173]
组分用量1.67μm dcas9
‑
sgrna复合物3μl10
×
dcas9结合缓冲液2μldna投入量10ng补加depc水至20μl
[0174]
37℃反应0.5、1、2、4h。
[0175]
磁珠捕获、dna建库和数据分析方式如实施例5相同。结果见图17。
[0176]
结果如图17所示,dcas9与sgrna的组装时间在0.5h
‑
1时即可达到很好的捕获分离效果,延长时间会导致捕获分离特异性降低。
[0177]
实施例9:链霉亲和素磁珠孵育时间对cas
‑
mngs效率的影响。
[0178]
在本实施例中,链霉亲和素磁珠孵育时间对cas
‑
mngs效率的影响。具体实施方式如下:
[0179]
1)sgrna库退火。与实施例6相同。
[0180]
2)生物素标记dcas9介导的人类宿主dna捕获。
[0181]
dcas9
‑
sgrna复合物组装:与实施例7相同。
[0182]
dcas9
‑
sgrna
‑
dna孵育:孵育体系与实施例7相同。37℃孵育30min。
[0183]
链霉亲和素磁珠捕获:取10μl dynabeads
tm m
‑
270链霉亲和素磁珠(thermofisher,cat#65305),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,分别在室温旋转结合10、20、30和60min。将pcr管置于磁分离架上,回收上清,磁珠使用25μl 1
×
dcas9结合缓冲液悬浮。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。
[0184]
dna建库和数据分析方式如实施例5相同。结果见图18。
[0185]
结果如图18所示,链霉亲和素磁珠孵育时间为30min时,宿主人类基因组捕获分离效果最好,延长链霉亲和素磁珠孵育时间会导致捕获分离特异性降低。
[0186]
实施例10:可定量的dna测序验证cas
‑
mngs对病原微生物的回收效率和回收偏好性。
[0187]
本实施例利用掺入的lambda dna(neb,n3011s)作为测序结果定量的标准,验证cas
‑
mngs对病原微生物的回收效率和回收偏好性。具体实施方式如下:
[0188]
1)dcas9
‑
sgrna
‑
dna孵育。按照下表进行配制:
[0189]
表16
[0190][0191]
37℃反应30min。
[0192]
2)链霉亲和素磁珠捕获。取10μl dynabeads
tm m
‑
270链霉亲和素磁珠(thermofisher,cat#65305),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。将pcr管置于磁分离架上,回收上清,上清中加入10pg lambda dna。磁珠使用25μl 1
×
dcas9结合缓冲液悬浮,加入100pg lambda dna。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。另取10ng制备的标准品,加入110pg lambda dna,补1
×
dcas9结合缓冲液至25μl,作为富集前的对照样品。
[0193]
3)dna文库构建。使用翊圣生物的hieffonepot dna library prep kit for illumina(cat#12203)进行dna文库构建,并在illumina novaseq 6000平台进行测序。将测序结果分别比对到人类、大肠杆菌、嗜热脂肪芽孢杆菌、酵母、串珠状赤霉菌、t7噬菌体、支原体、hbv和lambda dna上,根据投入的lambda dna量计算测序样品中各病原微生物dna的含量和占比,结果见图19和图20。
[0194]
结果如图19和图20所示,cas
‑
mngs能够有效捕获分离dna样本中的人类宿主染色质和其他微生物dna。cas
‑
mngs具有捕获效率高(96.31%的宿主人类染色质被捕获)、特异性高(其他微生物被非特异性捕获的比例低)、损失小(上清中病原微生物dna的损失只有10%左右)和捕获偏好性低(上清中各微生物dna含量比与未捕获样品具有高度一致性)等优点。这说明cas
‑
mngs不仅能够有效地降低损失和提高检出的灵敏性,而且能够很大程度上保证样本中各微生物dna含量的真实比例,引入更低的操作偏好性。
[0195]
实施例11:cas
‑
mngs对不同dna投入量样本的捕获分离效果。
[0196]
本实施例验证cas
‑
mngs对100pg
‑
100ng样本的捕获分离效果。具体实施方式如下:
[0197]
1)dcas9
‑
sgrna
‑
dna孵育。按照下表进行配制:
[0198]
表17
[0199][0200]
37℃反应30min。
[0201]
2)链霉亲和素磁珠捕获。取10μl dynabeads
tm m
‑
270链霉亲和素磁珠(thermofisher,cat#65305),用1
×
dcas9结合缓冲液清洗磁珠两次后悬浮于5μl 1
×
dcas9结合缓冲液中,并加入到上述20μl dcas9
‑
sgrna
‑
dna孵育混合物中,室温旋转结合30min。将pcr管置于磁分离架上,回收上清。磁珠使用25μl 1
×
dcas9结合缓冲液悬浮。上清和磁珠中各加入2.5μl 1m naoh,50度孵育10min。加入2.5μl 0.5m h2so4。磁珠置于磁力架上取上清。
[0202]
3)dna文库构建。使用翊圣生物的hieffonepot dna library prep kit for illumina(cat#12203)进行dna文库构建,并在illumina novaseq 6000平台进行测序。将测序结果分别比对到人类、大肠杆菌、嗜热脂肪芽孢杆菌、酵母、串珠状赤霉菌、t7噬菌体、支原体和hbv dna上,计算测序样品中各病原微生物dna的占比,结果见图21。
[0203]
如图21所示,cas
‑
mngs对100pg
‑
100ng dna投入量的样本都能够有效的捕获分离宿主人类基因组染色质和其他微生物dna,且偏好性和损失小。因此,对于100pg
‑
100ng dna投入量的样本,cas
‑
mngs对病原微生物具有很高的检出效率。
[0204]
综上,cas
‑
mngs是一种使用范围更广、灵敏度更高、安全性更好、效率更高、偏好性更小、操作更简单、耗时更短的宿主与病原微生物核酸分离并测序技术。cas
‑
mngs不需要复杂的提取分离操作,也不需要保留病理样本中细胞的完整性,能够适用于各类经医学处理的病理样本(如高温灭活、低温储藏、强裂解液处理或者极端条件处理)。这既减少了病理样本储存和处理的难度和成本,也极大增强了病理样本储存和处理的安全性。因此,cas
‑
mngs可以广泛适用于各类病理学样本的检测,尤其是高传染高致病性的样本。
[0205]
表18实施例1设计的sgrna引物库
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213]
[0214]
[0215]
[0216]
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225]
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238]
[0239]
[0240]
[0241]
[0242]
[0243]
[0244]
[0245]
[0246]
[0247]
[0248]
[0249]
[0250]
[0251]
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263]
[0264]
[0265]
[0266]
[0267]
[0268]
[0269]
[0270]
[0271]
[0272]
[0273]
[0274]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。