一种奥拉帕利
‑
镓复合纳米药物及其制备方法和应用
技术领域
1.本发明属于生物医药领域,更具体地,涉及一种镓
‑
奥拉帕利复合纳米药物的绿色简便制备方法及其在抗肿瘤医药领域的应用。
背景技术:
2.卵巢癌作为一种常见的女性生殖器官恶性肿瘤,发病率居妇科恶性肿瘤第三位,死亡率更是高居妇科肿瘤首位。在过去三十年中,国内对于卵巢癌的治疗主要还是采用肿瘤细胞减灭术及基于铂类、紫杉烷类的化学疗法,存活率虽有所改善,但依然难以达到满意的减瘤效果,且存在着化疗耐药、复发转移、并发症多等问题,使得患者的5年存活率仅为39%。奥拉帕尼是一种parp抑制剂,这类药物可以通过抑制parp,减少甚至阻止携带有受损brca基因的癌细胞进行dna修复,从而在dna损伤位点parp
‑
dna复合物增加,达到杀死癌细胞死亡的目的。然后,parp抑制剂也与其他化疗药同样面临耐药问题,了解该药物产生耐药性的分子机制,寻找可以联合或单独用药克服耐药性的适当化合物迫在眉睫。
3.镓元素的化学性质与铁元素具有众多的相似性,如铁离子和镓离子在核半径上有广泛的相似性,配位化学、电离势、电负性、电子亲和和离子键的趋势也具有较大的类比性。因而,生物系统或者组织很难或者不能区分这两种金属元素。镓也能与铁蛋白和血清蛋白结合,从而镓能与铁进行竞争来清除血浆中铁蛋白结合的铁,清除肿瘤细胞中营养铁元素,并且破坏肿瘤细胞内铁代谢水平。先前的大量的研究证明铁元素是许多含铁和硫的酶的重要组成部分,也是柠檬酸循环和线粒体电子传递链,在细胞生命活动中发挥着重要作用。同时,铁是核糖核苷酸r2亚基活性所必需的还原酶,负责脱氧核糖核苷酸合成的酶,是dna合成中的限速步骤,在dna合成修复过程中具有重要的作用。因此镓离子作为破坏肿瘤细胞铁代谢,从而肿瘤细胞增殖在临床上具有较大的应用前景。但是,在正常生理ph条件下,镓离子主要以氢氧化镓[ga(oh)4‑
]盐的形式存在,其溶解性差且生物利用度差。此外,其可能引起肾毒性和肾酸中毒,其他报道的不良反应还包括小细胞性贫血,阻碍其在体内广泛应用前景。因此,本专利将能扰乱耐药肿瘤细胞的铁代谢过程的镓离子与牛血清白蛋白形成金属离子配位复合溶液,然后与没食子酸酚族反应生成配位聚合物纳米粒子,最后奥拉帕利通过疏水效应自主装形成镓
‑
奥拉帕利复合纳米药物,结合了镓离子和奥拉帕利疗效优点的同时,还能克服分别的缺点,在卵巢癌治疗领域具有较大的应用前景。
技术实现要素:
[0004]
本发明的目的是针对现有技术的不足,提供一种奥拉帕利
‑
镓复合纳米药物及其制备方法和应用。
[0005]
本发明采用的技术方案具体如下:
[0006]
一种奥拉帕利
‑
镓复合纳米药物的制备方法,包含以下步骤:
[0007]
(1)配置金属离子配位复合溶液;所述金属离子配位复合溶液中,牛血清白蛋白、ga离子的质量比为33.3:2.2,ga离子的浓度为0.44mg/ml。
[0008]
(2)在金属离子配位复合溶液中滴加没食子酸酚族化合物水溶液,室温反应3小时生成配位聚合物纳米粒子,得到聚合物纳米粒子溶液;滴加的没食子酸酚族化合物与ga离子的质量比为8.8:20.5。
[0009]
(3)将奥拉帕利溶解在疏水有机溶剂中形成溶液并滴加到聚合物纳米粒子溶液中,奥拉帕利通过疏水效应自主装形成镓
‑
奥拉帕利复合纳米药物,纯化干燥后得到成品。其中,奥拉帕利与ga离子的摩尔配比为1:12.6。优选地,将奥拉帕利溶液滴加到a溶液中后搅拌12小时,使其自组装完全。
[0010]
进一步地,所述步骤1中,将牛血清白蛋白、ga离子分别溶解于水中后再混合形成金属离子配位复合溶液。其中,牛血清白蛋白水溶液的质量浓度为6.65~8mg/ml,三价ga离子水溶液的质量浓度为4mg/ml。
[0011]
优选的,可在避光条件下将ga离子的水溶液和牛血清白蛋白的水溶液不计先后顺序地混合。
[0012]
进一步地,所述步骤2中,没食子酸酚族化合物为3,4,5
‑
三羟基苯甲酸。
[0013]
进一步地,3,4,5
‑
三羟基苯甲酸水溶液的质量浓度为10mg/ml。
[0014]
进一步地,所述ga离子通过氯化镓(gacl3)、硝酸镓(ga(no3)2)中的一种或两种按任意比例溶于水中获得。
[0015]
进一步地,所述步骤3中,所述疏水有机溶剂由二甲基亚砜,酒精中一种或多种按任意比例混合组成。
[0016]
进一步地,所述步骤3中,奥拉帕利溶解在疏水有机溶剂的浓度为100mm。
[0017]
进一步地,所述步骤3中,采用透析袋纯化,干燥方法为冷冻干燥。
[0018]
本发明还提供一种上述制备方法制得的镓
‑
奥拉帕利复合纳米药物,所述镓
‑
奥拉帕利复合纳米药物包含ga、c、o、n、s五种元素,包含静电键和配位键,复合纳米药物的粒径范围为1~10nm。在水溶液中呈现均匀的粒径分布。
[0019]
上述镓
‑
奥拉帕利复合纳米药物在制备作为人和/或动物体内和/或者体外细胞抗卵巢癌药物中的应用。
[0020]
本发明的有益效果在于:本发明将金属镓离子(ga
3
)与生物相容性大分子白蛋白以及小分子没食子酸酚族化合物在水溶液中通过配体结合的方法形成配位聚合物纳米粒子,最后奥拉帕利通过疏水效应自主装形成镓
‑
奥拉帕利复合纳米药物。该方法生产工艺在室温下进行,且操作简易、产率高、重复性好,可实现低成本大规模生产。制备的纳米药物在保留具有干扰肿瘤细胞铁代谢的ga离子与干扰肿瘤细胞dna修复的奥拉帕利药物抗肿瘤效应的同时,还发挥了联合治疗效果的效应即ga离子促进了奥拉帕利药物的对卵巢癌抗肿瘤效应。且提高ga离子生物利用度以及提高ga离子的生物相容性,对于临床
‑
奥拉帕利parp抑制剂的抗肿瘤效应具有较大的促进效应。
附图说明
[0021]
图1:奥拉帕利
‑
镓复合纳米药物(olaparib
‑
ga)的合成与表征结果示意图。其中,a、b分别为tem明暗场图像(比例尺为20nm)。c为olaparib
‑
ga的dls谱图。d为olaparib
‑
ga的能量色散x射线能谱图。e为olaparib
‑
ga,olaparib以及超纯水的紫外可见分光光度谱图。f为olaparib
‑
ga复合纳米药物的tg曲线示意图。
[0022]
图2:olaparib、olaparib
‑
ga两种药物不同浓度条件下处理后skov3(a)和ovcar3(b)两种细胞存活率结果图及olaparib、olaparib
‑
ga两种药物不同时间条件下,skov3(c)和ovcar3(d)两种细胞存活率吸光度曲线示意图。
[0023]
图3:流式细胞术检测olaparib、olaparib
‑
ga两种药物处理后skov3和ovcar3细胞凋亡结果示意图(a)及统计柱状图(b)。
[0024]
图4:olaparib、olaparib
‑
ga两种药物处理后skov3和ovcar3细胞凋亡过程中相关蛋白bax和cleaved
‑
caspase3的表达结果图(a)及统计柱状图(b)。
[0025]
图5:olaparib、olaparib
‑
ga两种药物体外抗肿瘤效应的dna损伤的替代标记(γh2ax)的共聚焦图(a)以及量化分析柱状图(b)。
[0026]
图6:olaparib、olaparib
‑
ga两种药物处理后γ
‑
h2ax蛋白表达结果图(a)以及量化图(b)。
[0027]
图7:olaparib、olaparib
‑
ga两种药物处理后skov3(a)和ovcar3(b)细胞的rrm2 mrna表达量结果图。
[0028]
图8:olaparib、olaparib
‑
ga两种药物处理后skov3和ovcar3细胞rrm2蛋白表达量结果图(a)及量化分析柱状图(b)。
[0029]
图9:体内skov3模型不同时间、不同治疗组别下的生物发光成像技术检测skov3
‑
luc细胞荧光素酶信号活体成像图(a)及荧光信号量化分析结果图(b)。
[0030]
图10:体内skov3模型不同治疗组别收集的各组(5组)肿瘤组织的数码相机拍摄图。
[0031]
图11:侵袭转移评价图。
[0032]
图12:e(ki
‑
67)、f(clcasp3)免疫组化检测其抗肿瘤活性结果图。
[0033]
图13:体内skov3模型不同治疗组别收集的主要器官的数码相机拍摄图(a)及h&e病理切片图(b)。
[0034]
图14:体内skov3模型不同治疗组别治疗后的血常规(a)和血液生化结果图(b)。
[0035]
图15:体内ovcar3模型不同时间、不同治疗组别下的生物发光成像技术检测ovcar3
‑
luc细胞荧光素酶信号活体成像图(a)及荧光信号量化分析结果图(b)。
[0036]
图16:体内ovcar3模型不同治疗组别收集的主要器官的h&e病理切片图。
[0037]
图17:体内ovcar3模型不同治疗组别治疗后的血常规(a)和血液生化(b)结果图。
具体实施方式
[0038]
下面结合实施例和附图对发明作进一步说明;本实施例中,以olaparib
‑
ga纳米药物绿色制备技术以及体内对卵巢癌抗肿瘤效应来说明。
[0039]
实施例1.olaparib
‑
ga纳米药物的合成与表征
[0040]
首先制备bsa
‑
ga
3
金属有机配合物溶液,具体为:将133.2mg牛血清白蛋白溶于17.6ml水中,搅拌,然后再加入2.2ml浓度为10mg/ml的氯化镓溶液并且搅拌1小时。随后,在bsa稳定的bsa
‑
ga
3
金属有机配合物溶液中缓慢滴加2.1ml浓度为10mg/ml的3,4,5
‑
三羟基苯甲酸水溶液,并且避光常温搅拌3小时制备聚合物纳米粒子配体溶液。最后,将浓度为100mm的奥拉帕尼二甲亚砜溶液0.1ml加入聚合物纳米粒子配体溶液继续搅拌12小时,通过疏水效应自主装制备了olaparib
‑
ga纳米药物。用透射电镜研究了制备的纳米药物的形貌
和粒径。如图1a和b所示,olaparib
‑
ga自组装纳米药物为球形单分散纳米颗粒,平均粒径为~7纳米。元素能谱表明,c、n、o、s以及ga元素存在(图1c)。用x射线光电子能谱(xps)研究了olaparib
‑
ga自组装纳米药物的化学组成。如图所示,olaparib
‑
ga xps光谱包含c1s、o1s、n1s和ga3d峰(图1d)。olaparib
‑
ga,olaparib以及超纯水的紫外可见分光光度谱图1e表明olaparib
‑
ga存在olaparib药物的吸收峰。进一步热重分析表明,有机组成去除后剩下的重量即为无机组成ga的氧化物质量(图1f)。以上结果表明olaparib
‑
ga纳米药物的成功制备。
[0041]
实施例2.olaparib
‑
ga纳米药物的体外抗肿瘤性能表征
[0042]
为了测试olaparib
‑
ga自组装纳米药物对卵巢癌细胞系的抗癌活性,本实施例分别用olaparib和olaparib
‑
ga处理人类卵巢癌细胞skov3和ovcar3细胞研究了细胞存活率(图2a
‑
d)。用不同浓度的olaparib或olaparib
‑
ga处理24小时后,两种细胞株表现出相似的剂量依赖性细胞毒倾向。olaparib
‑
ga组显示出更强的癌细胞杀伤能力。在培养24、48和72h后,olaparib
‑
ga纳米药物对两种细胞系也显示出更有效的抗癌性能。值得注意的是,olaparib
‑
ga纳米药物比olaparib药物对两种卵巢癌细胞都更敏感(图2c和d)。流式细胞术检测不同处理方式后skov3和ovcar3细胞的凋亡,如图3所示,olaparib药物治疗组显示出少量的凋亡率,而olaparib
‑
ga纳米药物诱导的凋亡率大约是olaparib治疗组的5倍。此外,在细胞凋亡过程中,相关蛋白(bax和cleaved
‑
caspase 3)的表达如图4所示。与对照组相比,olaparib
‑
ga和olaparib均能诱导bax和cleaved
‑
caspase
‑
3蛋白表达水平升高。并且与olaparib治疗相比,olaparib
‑
ga纳米药物组治疗后bax和cleaved
‑
caspase 3的水平显著升高。综上所述,olaparib
‑
ga纳米药物可能通过ga离子与奥拉帕利的协同作用促进肿瘤细胞凋亡。
[0043]
实施例3.体外抗肿瘤效应的dna损伤修复表征
[0044]
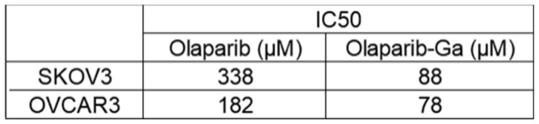
parp抑制剂(olaparib作为其中的一种常见药物)可以调节dna损伤对细胞凋亡的反应。本实施例研究了olaparib及olaparib
‑
ga纳米药物是否能抑制dna损伤修复效应,具体如下:将skov3和ovcar3细胞与olaparib ga或olaparib(ic50,如表1所示)共培养24小时,然后对细胞dna损伤替代标记,即:进行染色γh2ax(ser139)。如图5所示,免疫荧光强度在两种细胞类型中,olaparib
‑
ga纳米药物治疗后h2ax显著增强,表明olaparib
‑
ga纳米药物比olaparib对dna的损伤更大。并且与olaparib治疗的细胞相比,olaparib
‑
ga纳米药物治疗组h2ax蛋白表达也同步增加(图6),与上述共聚焦免疫荧光数据一致。rrm2 mrna表达量(图7)以及rrm2蛋白表达量(图8)表明olaparib
‑
ga纳米药物显著降低rrm2基因和蛋白的表达,说明olaparib
‑
ga纳米药物中的ga离子能取代细胞内铁含量从而抑制rrm2表达。
[0045]
表1:ic50值
[0046][0047]
实施例4.体内skov3模型抗肿瘤效果与生物安全性初步评估
[0048]
首先,通过腹腔注射将荧光素酶标记的卵巢癌细胞skov3(skov3
‑
luc)导入小鼠体内,建立卵巢癌体内skov3模型,分为3组后分别用无菌过滤的纯水(对照)、0.5mm olaparib和olaparib
‑
ga对小鼠尾静脉注射,200μl/日,连续5日。在治疗期间,通过无创生物发光成
像检测skov3
‑
luc细胞的荧光素酶信号以评估治疗效果。各组(n=5)的生物发光图像和第0天(加药当天)或第22天生物发光强度的定量计算分别如图9a和9b所示。各组的生物发光强度在第0天基本保持不变,但在第22天三个治疗组之间出现了不同的生物发光强度现象,其中olaparib
‑
ga纳米药物治疗组的生物发光强度最低,表明其治疗效果最好。相反,游离奥拉帕利药物olaparib对skov3癌细胞的抑瘤作用有限。随后处死小鼠,收集各组肿瘤组织,用数码相机拍摄,如图10所示,与其他两个治疗组相比,olaparib
‑
ga纳米药物治疗证明了增强的抗肿瘤性能。同时,olaparib
‑
ga纳米药物治疗可明显减弱skov3肿瘤细胞的转移,且在结肠、脾脏和肝脏几乎不形成腹部肿瘤结节。而对照组和olaparib组的腹部肿瘤结节清晰可见(图11)。免疫组化检测其抗肿瘤活性结果如图12所示,olaparib
‑
ga纳米药物治疗组ki
‑
67a细胞增殖标记物表达下调(图12a)。同时,在olaparib
‑
ga纳米药物治疗后,clcasp 3的表达上调(图12b)。表明olaparib
‑
ga纳米药物对肿瘤具有明显的增殖抑制作用。最后,进行了安全性评估。图13为体内skov3模型不同治疗组别收集的主要器官的数码相机拍摄图及h&e病理切片图,可以看出,三个治疗组的主要器官(包括心、肺、脾、肾和肝)的照片图像大部分保持相同的形式(图13a)且治疗后,心、肝、脾、肺、肾的h&e染色显示,olaparib
‑
ga治疗组组织结构正常,无明显损伤或炎症性病变(图13b),表明olaparib
‑
ga药物不会对生物体造成其他损伤,无毒副作用。另外,olaparib组和olaparib
‑
ga纳米药物组血常规均提示白细胞和中性粒细胞较对照组降低,与奥拉帕利本身有一定的骨髓抑制作用一致,三组其余血常规和血液生化结果均无显著性差异,表明其良好的生物相容性(图14)。
[0049]
实施例5.体内ovcar3模型抗肿瘤效果与生物安全性初步评估
[0050]
本实施例研究了olaparib
‑
ga纳米药物在ovcar3动物模型中的抗肿瘤作用。首先,通过腹腔注射将荧光素酶标记的卵巢癌细胞ovcar3(ovcar3
‑
luc)导入小鼠体内,建立卵巢癌体内ovcar3模型。然后,测试了三种治疗方法(同实施例4)对荷ovcar3
‑
luc肿瘤小鼠的抗肿瘤效果。利用ivis,通过荧光素酶生物发光信号鉴定ovcar3
‑
luc模型,各组(n=5)的生物发光图像在第0天生物发光强度的定量计算几乎保持相同(图15a和b)。其中,olaparib
‑
ga纳米药物治疗组的生物发光强度在第22天左右最低,这与对照组和olaparib组的小鼠有显著差异。为了满足转化治疗应用的可能性,有必要对治疗后的毒性进行评估。进行主要脏器组织学、血常规及血液生化实验。图16是不同治疗组别收集的主要器官的h&e病理切片图,可以看出静脉注射olaparib
‑
ga纳米药物没有导致主要器官任何形态学改变。并且血常规(图17a)和血液生化图17b)结果表明奥拉帕利
‑
ga纳米药物具有良好的生物安全性。
[0051]
综上,本发明设计了由金属镓离子(ga
3
)和牛血清白蛋白形成金属离子配位复合溶液,然后与没食子酸酚族反应生成配位聚合物纳米粒子,最后奥拉帕利药物分子通过疏水效应自主装于聚合物纳米粒子上形成镓
‑
奥拉帕利复合纳米药物。该纳米药物具有较低的副作用,以及较高的生物利用度。能高效的靶向聚集到肿瘤细胞,发挥高效的抗肿瘤效应。
[0052]
所制备的镓
‑
奥拉帕利复合纳米药物可通过干扰肿瘤细胞铁代谢,进行抑制其dna损失修复过程,联合并且促进奥拉帕利药物的抗肿瘤效应,且skov3和ovcar3两种耐药卵巢癌细胞不会对镓
‑
奥拉帕利复合纳米药物产生抗性。对两种肿瘤细胞都具有较强的杀伤效果。
[0053]
本发明开发的新型镓
‑
奥拉帕利复合纳米药物在保留ga离子与奥拉帕利抗肿瘤效
应的同时,还发挥了联合治疗效果的效应即ga离子促进了奥拉帕利药物的对卵巢癌抗肿瘤效应。且提高ga离子生物利用度以及提高ga离子的生物相容性,对于临床
‑
奥拉帕利parp抑制剂的抗肿瘤效应具有较大的促进效应。
[0054]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法把所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。