1.本技术涉及生物医药技术领域,尤其涉及一种新生儿脐部护理液及其制备方法。
背景技术:
2.脐带是胎儿在母体同由母亲供给胎儿营养和胎儿排泄废物的通道。胎儿出生后,医务人员会将脐带结扎并切断,随后脐带残端会逐渐干枯变细,并在宝宝出生后3
‑
7天后脱落。但,在断脐前后,如果护理不当,很容易造成细菌污染,引起新生儿脐部发炎。
3.目前市面上主要用于新生儿脐部护理的产品主要有:(1)醇类(如75%酒精、聚乙二醇等);(2)碘类(如碘酊、碘伏);敷料类。但上述类型的产品在对新生儿脐部消毒时均存在缺陷:(1)75%酒精的主要用于完整皮肤(如用于注射、穿刺或手术前的皮肤消毒),不能使用在皮肤破损处及糜烂和渗液部位;且对伤口有刺激。(2)碘酊是用于完整皮肤灭菌,1分钟后需要使用70%乙醇脱碘;大面积皮肤缺损不可使用,会伤害肉芽组织。碘伏用于皮肤消毒、黏膜冲洗、医务人员刷手、泡手、注射、手术部位皮肤消毒、治疗皮肤黏膜细菌性感染,但存在对碘或聚维酮碘过敏者慎用的问题,而且中国药典明确婴儿外用有可见碘明显地经皮吸收,应慎用于婴儿。(3)医用敷料类:液体敷料,主要成分为高分子材料如卡波姆、聚乙烯醇、透明质酸钠等,作用于伤口处形成薄膜,不利于伤口的透气和保持干燥,且形成产品的工艺组成成分多,易引起刺激和过敏;创面敷贴,通常由涂胶基材、吸收性敷垫和可剥离的保护层组成,此类敷料透气差,需要粘胶固定,固定处易引起过敏,出现红、肿、痒等不良反应。
4.如何解决上述问题,是本领域技术人员需要考虑的。
技术实现要素:
5.本技术实施例提供一种新生儿脐部护理液,包括:
6.液态溶剂,重量比为96
‑
99份;
7.第一溶质,包括石墨烯;
8.第二溶质,包括聚六亚甲基双胍盐酸盐;以及
9.分散剂,用于协助所述第一溶质及所述第二溶质在所述液态溶剂中分散,重量比为0.4至1.6份。
10.在一种可能的实施方式中,所述石墨烯包括纳米石墨烯或氧化石墨烯。
11.在一种可能的实施方式中,所述石墨烯的重量比为0.005至0.008份。
12.在一种可能的实施方式中,所述聚六亚甲基双胍盐酸盐的重量比为0.05至0.1份。
13.在一种可能的实施方式中,所述分散剂包括十二烷基苯磺酸钠、聚乙烯醇、聚丙烯酰胺、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮中的至少一种。
14.在一种可能的实施方式中,所述液态溶剂为纯化水或去离子水。
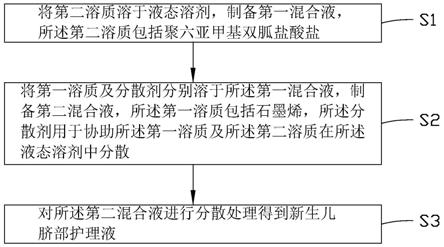
15.本技术实施例还提供一种新生儿脐部护理液的制备方法,包括如下步骤:
16.将第二溶质溶于液态溶剂,制备第一混合液,所述第二溶质包括聚六亚甲基双胍
盐酸盐;
17.将第一溶质及分散剂分别溶于所述第一混合液,制备第二混合液,所述第一溶质包括石墨烯,所述分散剂用于协助所述第一溶质及所述第二溶质在所述液态溶剂中分散;以及
18.对所述第二混合液进行分散处理得到新生儿脐部护理液。
19.在一种可能的实施方式中,所述石墨烯包括纳米石墨烯或氧化石墨烯,所述石墨烯的重量比为0.005至0.008份,所述聚六亚甲基双胍盐酸盐的重量比为0.05至0.1份。
20.在一种可能的实施方式中,所述分散剂包括十二烷基苯磺酸钠、聚乙烯醇、聚丙烯酰胺、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮中的至少一种,所述液态溶剂为纯化水或去离子水。
21.在一种可能的实施方式中,对所述第二混合液进行分散处理的方法包括超声波分散。
22.相比于现有技术,本技术的新生儿脐部护理液及其制备方法。一方面,石墨烯及其衍生物的杀菌能力主要源于其物理性破坏作用,细菌很难对其产生抗性,且,石墨烯及其衍生物抗菌材料具有作用效率高、用量少及易于修饰、制备工艺简单、可有效降低其生物毒性从而具有较好的生物相容性等特点。另一方面,聚六亚甲基双胍盐酸盐在具备一定杀菌作用的同时,可与石墨烯及其衍生物协同作用,使杀菌效果更明显。
附图说明
23.图1为本技术实施例的新生儿脐部护理液的制备流程示意图。
24.图2为本技术实施例的实验现象电镜示意图。
25.如下具体实施方式将结合上述附图进一步说明本技术。
具体实施方式
26.以下描述将参考附图以更全面地描述本技术内容。附图中所示为本技术的示例性实施例。然而,本技术可以以许多不同的形式来实施,并且不应该被解释为限于在此阐述的示例性实施例。提供这些示例性实施例是为了使本技术透彻和完整,并且将本技术的范围充分地传达给本领域技术人员。类似的附图标记表示相同或类似的组件。
27.本文使用的术语仅用于描述特定示例性实施例的目的,而不意图限制本技术。如本文所使用的,除非上下文另外清楚地指出,否则单数形式“一”,“一个”和“该”旨在也包括复数形式。此外,当在本文中使用时,“包括”和/或“包含”和/或“具有”,整数,步骤,操作,组件和/或组件,但不排除存在或添加一个或多个其它特征,区域,整数,步骤,操作,组件,组件和/或其群组。
28.除非另外定义,否则本文使用的所有术语(包括技术和科学术语)具有与本技术所属领域的普通技术人员通常理解的相同的含义。此外,除非文中明确定义,诸如在通用字典中定义的那些术语应该被解释为具有与其在相关技术和本技术内容中的含义一致的含义,并且将不被解释为理想化或过于正式的含义。
29.以下内容将结合附图对示例性实施例进行描述。须注意的是,参考附图中所描绘的组件不一定按比例显示;而相同或类似的组件将被赋予相同或相似的附图标记表示或类
似的技术用语。
30.下面参照附图,对本技术的具体实施方式作进一步的详细描述。
31.本技术实施例提供一种新生儿脐部护理液,包括液态溶剂、第一溶质、第二溶质以及分散剂,第一溶质、第二溶质以及分散剂溶于所述液态溶剂。
32.于一实施例中,所述液态溶剂为纯化水或去离子水,重量比为96
‑
99份。
33.于一实施例中,所述第一溶质包括石墨烯,所述石墨烯包括纳米石墨烯或氧化石墨烯,所述石墨烯的重量比为0.005至0.008份。具备此比例的新生儿脐部护理液具有较强的杀菌效果,展示如下:
34.1.分别取金黄色葡萄球菌(attcc6538)、大肠杆菌(atcc25922)、白色念珠菌(atcc10231),制备成含菌量为1
×
108cfu/ml的菌液。
35.2.称取一定量的石墨烯或氧化石墨烯,配制成质量浓度为1、2、3、5、8mg/ml系列水溶液。
36.3.分别取100ul上述菌液。取1ml上述各浓度的石墨烯或氧化石墨烯水溶液加到各待测试菌液中,使混匀。空白对照为各菌液加入等量体积蒸馏水,使混匀。取上述混匀液100ul涂布lb琼脂培养基,37℃培养箱中培养24h,统计平板上菌落数。
37.4.抑菌率计算方法:
38.抑菌率=(空白对照菌落数
‑
样品菌落数)/空白对照菌落数
×
100%
39.5.结果如下:
40.[0041][0042]
结果如上表所示,当石墨烯或氧化石墨烯的质量浓度在1
‑
3mg/ml时,石墨烯水溶液其各试验菌株的抑菌率分别为金黄色葡萄球菌30.55
‑
73.94%;大肠杆菌为40.23
‑
70.12%;白色念珠菌47.56
‑
70.64%;氧化石墨烯水溶液其各试验菌株的抑菌率分别为金黄色葡萄球菌32.48
‑
76.89%;大肠杆菌为45.56
‑
75.19%;白色念珠菌49.23
‑
72.11%。而当石墨烯水溶液、氧化石墨烯水溶液的质量浓度在5
‑
8mg/ml时,其各试验菌株的杀菌率均达到99.99%。呈现了高效的杀菌作用。
[0043]
可以理解的,当石墨烯水溶液、氧化石墨烯水溶液的质量浓度达到一定值,会引起细胞毒性。如图2所示,当石墨烯的质量浓度为3mg/ml时,可见细胞状态良好,细胞与石墨烯粘附良好,并对部分石墨烯出现吞噬、包裹现象;当浓度为8mg/ml时,细胞体变小,表面分泌物明显增多,细胞表面微绒毛变长,表明细胞受到刺激;当浓度为9mg/ml时,细胞出现皱缩、变形,多数细胞失活、死亡,表明石墨烯对细胞有较高的细胞毒性。
[0044]
在其他实施例中,所述第一溶质还可以包括其他石墨烯类衍生物,所述石墨烯的重量比例可以为0.5至1份、1至1.5份以及1.5至2份。
[0045]
于一实施例中,所述第二溶质包括聚六亚甲基双胍盐酸盐,所述聚六亚甲基双胍盐酸盐的重量比为0.05至0.1份。
[0046]
聚六亚甲基双胍盐酸盐在具备一定杀菌作用的同时,可与石墨烯及其衍生物协同作用,使杀菌效果更明显。
[0047]
聚六亚甲基双胍盐酸盐(phmb)是一种广谱抗菌素,对革兰氏阳性菌,革兰氏阴性菌、真菌和酵母菌等均有杀灭作用,能有效杀灭金黄色葡萄球菌、大肠杆菌、痢疾杆菌、白色念珠菌等各类细菌病毒。并且在低浓度时就能达到很好的杀菌效果,同时不会使细菌产生耐药性。聚六亚甲基双胍盐酸盐为细胞膜活性抗菌剂,其抗菌机理为:首先聚六亚甲基双胍盐酸盐为聚阳离子型化合物,会吸附在带负电荷的微生物表面,阻止其分裂繁殖;同时吸附在微生物表面的聚六亚甲基双胍盐酸盐通过跨膜运输作用于细胞质中磷脂双分子层,与带负电磷酸基结合,从而改变了细胞膜的选择透过性,破坏了细胞代谢,从而杀死微生物。
[0048]
利用聚六亚甲基双胍盐酸盐带正电荷的特性,聚六亚甲基双胍盐酸盐与石墨烯复合后,可使石墨烯表面携带阳离子基团,增强了石墨烯对细菌的静电吸附作用。同时复合后的石墨烯具有更大的表面积,使其更容易与细菌接触,使得细菌的整体死亡率增加,使杀菌作用更强,产生了协同增效作用。同时,由于杀菌之后物体表面还吸附着phmb阳离子,所以能在较长时间内抑制细菌的生长。
[0049]
抗菌长效性确认:
[0050]
1.方法:取直径为3cm的圆片状织物5片叠加,将样品喷于织物上,使织物完全浸润,参照日本抗菌制品协会提出的“抗菌加工制品抗菌力持续性试验法”对样品进行50℃,16小时持久性模拟热处理、紫外灯照射100h耐光处理后,进行抗菌持久性模拟评价。
[0051]
2.以金黄色葡萄球菌和大肠杆菌为试验菌株。
[0052]
3.结果:增加了杀菌剂(phmb)的样品,相对于未增加的,在经过热和光实验后仍显示出很好的抗菌效果。
[0053][0054][0055]
于一实施例中,所述分散剂包括十二烷基苯磺酸钠、聚乙烯醇、聚丙烯酰胺、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮中的至少一种。
[0056]
所述分散剂用于协助所述第一溶质及所述第二溶质在所述液态溶剂中分散,重量比为0.4至1.6份。所述分散剂可提升石墨烯在液体溶剂中的分散效果,使石墨烯用于杀菌的效果更佳。
[0057]
如图1所示,本技术实施例还提供一种新生儿脐部护理液的制备方法,包括如下步骤:
[0058]
步骤s1:将第二溶质溶于液态溶剂,制备第一混合液,所述第二溶质包括聚六亚甲基双胍盐酸盐。
[0059]
于一实施例中,所述聚六亚甲基双胍盐酸盐的重量比为0.05至0.1份。
[0060]
步骤s2:将第一溶质及分散剂分别溶于所述第一混合液,制备第二混合液,所述第一溶质包括石墨烯,所述分散剂用于协助所述第一溶质及所述第二溶质在所述液态溶剂中分散。
[0061]
于一实施例中,所述石墨烯包括纳米石墨烯或氧化石墨烯,所述石墨烯的重量比为0.005至0.008份。
[0062]
于一实施例中,所述分散剂包括十二烷基苯磺酸钠、聚乙烯醇、聚丙烯酰胺、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮中的至少一种,所述液态溶剂为纯化水或去离子水。
[0063]
步骤s3:对所述第二混合液进行分散处理得到新生儿脐部护理液。
[0064]
于一实施例中,所述第二混合液进行分散处理的方法包括超声波分散。
[0065]
实施案例1
[0066]
氧化石墨烯0.05
聚乙烯吡咯烷酮0.5聚六亚甲基双胍盐酸盐0.1纯化水99.0
[0067]
将聚乙烯吡咯烷酮加入到装有聚六亚甲基双胍盐酸盐水溶液的容器中,搅拌使分散溶解,加入氧化石墨烯,超声,使分散均匀,分装到适宜的容器中,即得护理液。
[0068]
对上述制备的护理液进行效果测试:
[0069]
细菌定量杀灭试验:
[0070]
1.测试所用仪器及菌种:
[0071]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;金黄色葡萄球菌(attcc6538)、铜绿假单胞菌(atcc15442)、大肠杆菌(atcc25922),以上菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0072]
2.测试方法:
[0073]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0074]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为大肠杆菌,试验重复3次。
[0075]
2.3杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.7试验方法进行试验,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,试验重复3次,试验温度21℃~22℃。
[0076]
3.测试结果:
[0077]
3.1大肠杆菌中和剂鉴定结果:
[0078]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为4.94%、6.87%、3.83%。
[0079][0080]
注:阴性对照均无菌生长。
[0081]
3.2细菌定量杀灭试验结果:
[0082]
[0083][0084]
注:1)阴性对照均无菌生长。
[0085]
2)
[0086][0087]
4.结论:
[0088]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对大肠杆菌的作用,该中和剂和中和产物对大肠杆菌及培养基无影响。
[0089]
2)经3次重复实验表明,在21~22℃条件下,该样品原液作用2.5分钟,对悬液中大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的杀灭对数值均>5.00,符合《消毒技术规范》(2002
年版)的要求。
[0090]
真菌定量杀灭试验:
[0091]
1.测试所用仪器及菌种:
[0092]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;白色念珠菌(atcc10231),菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0093]
2.测试方法:
[0094]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0095]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为白色念珠菌,水浴控制作用温度19~21℃,试验重复3次。
[0096]
2.3定量杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.9真菌杀灭试验操作程序,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,水浴控制作用温度19~21℃,试验重复3次。
[0097]
3.测试结果:
[0098]
3.1白色念珠菌中和剂鉴定试验结果:
[0099]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为2.61%、3.04%、2.82%。
[0100][0101]
注:阴性对照均无菌生长。
[0102]
3.2真菌定量杀灭试验结果:
[0103][0104]
注:1)阴性对照均无菌生长。
[0105]
2)
[0106][0107]
4.结论:
[0108]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对白色念珠菌的作用,该中和剂和中和产物对白色念珠菌及培养基无影响。
[0109]
2)经3次重复实验表明,在19~21℃条件下,该样品原液作用2.5分钟,对悬液中白色念珠菌的杀灭对数值均>4.00,符合《消毒技术规范》(2002年版)的要求。
[0110]
实施例2
[0111]
氧化石墨烯0.08聚乙烯吡咯烷酮1.6聚六亚甲基双胍盐酸盐0.05纯化水96.4
[0112]
将聚乙烯吡咯烷酮加入到装有聚六亚甲基双胍盐酸盐水溶液的容器中,搅拌使分散溶解,加入氧化石墨烯,超声,使分散均匀,分装到适宜的容器中,即得护理液。
[0113]
对上述制备的护理液进行效果测试:
[0114]
细菌定量杀灭试验:
[0115]
1.测试所用仪器及菌种:
[0116]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;金黄色葡萄球菌(attcc6538)、铜绿假
单胞菌(atcc15442)、大肠杆菌(atcc25922),以上菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0117]
2.测试方法:
[0118]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0119]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为大肠杆菌,试验重复3次。
[0120]
2.3杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.7试验方法进行试验,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,试验重复3次,试验温度21℃~22℃。
[0121]
3.测试结果:
[0122]
3.1大肠杆菌中和剂鉴定结果:
[0123]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为4.91%、6.85%、3.80%。
[0124][0125]
注:阴性对照均无菌生长。
[0126]
3.2细菌定量杀灭试验结果:
[0127]
[0128][0129]
注:1)阴性对照均无菌生长。
[0130]
2)
[0131][0132]
4.结论:
[0133]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对大肠杆菌的作用,该中和剂和中和产物对大肠杆菌及培养基无影响。
[0134]
2)经3次重复实验表明,在21~22℃条件下,该样品原液作用2.5分钟,对悬液中大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的杀灭对数值均>5.00,符合《消毒技术规范》(2002年版)的要求。
[0135]
真菌定量杀灭试验:
[0136]
1.测试所用仪器及菌种:
[0137]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;白色念珠菌(atcc10231),菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0138]
2.测试方法:
[0139]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0140]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为白色念珠菌,水浴控制作用温度19~21℃,试验重复3次。
[0141]
2.3定量杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.9真菌杀灭试验操作程序,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,水浴控制作用温度19~21℃,试验重复3次。
[0142]
3.测试结果:
[0143]
3.1白色念珠菌中和剂鉴定试验结果:
[0144]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为2.61%、2.84%、2.82%。
[0145][0146]
注:阴性对照均无菌生长。
[0147]
3.2真菌定量杀灭试验结果:
[0148][0149]
注:1)阴性对照均无菌生长。
[0150]
2)
[0151][0152]
4.结论:
[0153]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对白色念珠菌的作用,该中和剂和中和产物对白色念珠菌及培养基无影响。
[0154]
2)经3次重复实验表明,在19~21℃条件下,该样品原液作用2.5分钟,对悬液中白色念珠菌的杀灭对数值均>4.00,符合《消毒技术规范》(2002年版)的要求。
[0155]
实施例3
[0156]
氧化石墨烯0.065聚乙烯吡咯烷酮1聚六亚甲基双胍盐酸盐0.075纯化水97.75
[0157]
将聚乙烯吡咯烷酮加入到装有聚六亚甲基双胍盐酸盐水溶液的容器中,搅拌使分散溶解,加入氧化石墨烯,超声,使分散均匀,分装到适宜的容器中,即得护理液。
[0158]
对上述制备的护理液进行效果测试:
[0159]
细菌定量杀灭试验:
[0160]
1.测试所用仪器及菌种:
[0161]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;金黄色葡萄球菌(attcc6538)、铜绿假
单胞菌(atcc15442)、大肠杆菌(atcc25922),以上菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0162]
2.测试方法:
[0163]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0164]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为大肠杆菌,试验重复3次。
[0165]
2.3杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.7试验方法进行试验,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,试验重复3次,试验温度21℃~23℃。
[0166]
3.测试结果:
[0167]
3.1大肠杆菌中和剂鉴定结果:
[0168]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为4.84%、6.65%、3.29%。
[0169][0170]
注:阴性对照均无菌生长。
[0171]
3.2细菌定量杀灭试验结果:
[0172]
[0173]
[0174][0175]
注:1)阴性对照均无菌生长。
[0176]
2)
[0177][0178]
4.结论:
[0179]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对大肠杆菌的作用,该中和剂和中和产物对大肠杆菌及培养基无影响。
[0180]
2)经3次重复实验表明,在21~22℃条件下,该样品原液作用2.5分钟,对悬液中大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的杀灭对数值均>5.00,符合《消毒技术规范》(2002年版)的要求。
[0181]
真菌定量杀灭试验:
[0182]
1.测试所用仪器及菌种:
[0183]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;白色念珠菌(atcc10231),菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0184]
2.测试方法:
[0185]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0186]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为白色念珠菌,水浴控制作用温度19~21℃,试验重复3次。
[0187]
2.3定量杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.9真菌杀灭试验操作程序,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,水浴控制作用温度19~21℃,试验重复3次。
[0188]
3.测试结果:
[0189]
3.1白色念珠菌中和剂鉴定试验结果:
[0190]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为2.44%、2.26%、2.48%。
[0191][0192]
注:阴性对照均无菌生长。
[0193]
3.2真菌定量杀灭试验结果:
[0194][0195][0196]
注:1)阴性对照均无菌生长。
[0197]
2)
[0198][0199]
4.结论:
[0200]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对白色念珠菌的作用,该中和剂和中和产物对白色念珠菌及培养基无影响。
[0201]
2)经3次重复实验表明,在19~21℃条件下,该样品原液作用2.5分钟,对悬液中白
色念珠菌的杀灭对数值均>4.00,符合《消毒技术规范》(2002年版)的要求。
[0202]
实施例4
[0203]
纳米石墨烯0.05聚乙烯吡咯烷酮1.6聚六亚甲基双胍盐酸盐0.1纯化水96.4
[0204]
将聚乙烯吡咯烷酮加入到装有聚六亚甲基双胍盐酸盐水溶液的容器中,搅拌使分散溶解,加入纳米石墨烯,超声,使分散均匀,分装到适宜的容器中,即得护理液。
[0205]
对上述制备的护理液进行效果测试:
[0206]
细菌定量杀灭试验:
[0207]
1.测试所用仪器及菌种:
[0208]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;金黄色葡萄球菌(attcc6538)、铜绿假单胞菌(atcc15442)、大肠杆菌(atcc25922),以上菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0209]
2.测试方法:
[0210]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0211]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为大肠杆菌,试验重复3次。
[0212]
2.3杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.7试验方法进行试验,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,试验重复3次,试验温度21℃~23℃。
[0213]
3.测试结果:
[0214]
3.1大肠杆菌中和剂鉴定结果:
[0215]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为4.84%、6.77%、3.73%。
[0216][0217]
注:阴性对照均无菌生长。
[0218]
3.2细菌定量杀灭试验结果:
[0219]
[0220][0221]
注:1)阴性对照均无菌生长。
[0222]
2)
[0223][0224]
4.结论:
[0225]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对大肠杆菌的作用,该中和剂和中和产物对大肠杆菌及培养基无影响。
[0226]
2)经3次重复实验表明,在21~22℃条件下,该样品原液作用2.5分钟,对悬液中大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的杀灭对数值均>5.00,符合《消毒技术规范》(2002年版)的要求。
[0227]
真菌定量杀灭试验:
[0228]
1.测试所用仪器及菌种:
[0229]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;白色念珠菌(atcc10231),菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0230]
2.测试方法:
[0231]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0232]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为白色念珠菌,水浴控制作用温度19~21℃,试验重复3次。
[0233]
2.3定量杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.9真菌杀灭试验操作程序,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,水浴控制作用温度19~21℃,试验重复3次。
[0234]
3.测试结果:
[0235]
3.1白色念珠菌中和剂鉴定试验结果:
[0236]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为2.31%、2.04%、2.82%。
[0237][0238]
注:阴性对照均无菌生长。
[0239]
3.2真菌定量杀灭试验结果:
[0240][0241][0242]
注:1)阴性对照均无菌生长。
[0243]
2)
[0244][0245]
4.结论:
[0246]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对白色念珠菌的作用,该中和剂和中和产物对白色念珠菌及培养基无影响。
[0247]
2)经3次重复实验表明,在19~21℃条件下,该样品原液作用2.5分钟,对悬液中白
色念珠菌的杀灭对数值均>4.00,符合《消毒技术规范》(2002年版)的要求。
[0248]
实施例5
[0249]
纳米石墨烯0.08聚乙烯吡咯烷酮0.5聚六亚甲基双胍盐酸盐0.05纯化水99.0
[0250]
将聚乙烯吡咯烷酮加入到装有聚六亚甲基双胍盐酸盐水溶液的容器中,搅拌使分散溶解,加入纳米石墨烯,超声,使分散均匀,分装到适宜的容器中,即得护理液。
[0251]
对上述制备的护理液进行效果测试:
[0252]
细菌定量杀灭试验:
[0253]
1.测试所用仪器及菌种:
[0254]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;金黄色葡萄球菌(attcc6538)、铜绿假单胞菌(atcc15442)、大肠杆菌(atcc25922),以上菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0255]
2.测试方法:
[0256]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0257]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为大肠杆菌,试验重复3次。
[0258]
2.3杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.7试验方法进行试验,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,试验重复3次,试验温度21℃~23℃。
[0259]
3.测试结果:
[0260]
3.1大肠杆菌中和剂鉴定结果:
[0261]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为4.94%、6.87%、3.83%。
[0262][0263]
注:阴性对照均无菌生长。
[0264]
3.2细菌定量杀灭试验结果:
[0265]
[0266][0267]
注:1)阴性对照均无菌生长。
[0268]
2)
[0269][0270]
4.结论:
[0271]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对大肠杆菌的作用,该中和剂和中和产物对大肠杆菌及培养基无影响。
[0272]
2)经3次重复实验表明,在21~22℃条件下,该样品原液作用2.5分钟,对悬液中大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌的杀灭对数值均>5.00,符合《消毒技术规范》(2002年版)的要求。
[0273]
真菌定量杀灭试验:
[0274]
1.测试所用仪器及菌种:
[0275]
营养琼脂、培养皿、立式压力蒸汽灭菌器、电热鼓风干燥箱、生化培养箱、电热恒温培养箱、刻度吸管(0.1ml、1.0ml、5.0ml、10.0ml)等;白色念珠菌(atcc10231),菌种代数为4代,并用含0.03mol/l pbs配制菌悬液。中和剂:d/e中和肉汤。
[0276]
2.测试方法:
[0277]
2.1菌悬液制备方法:《消毒技术规范》(2002年版)2.1.1.2.3。
[0278]
2.2中和剂鉴定试验:按照《消毒技术规范》(2002年版)2.1.1.5中和剂鉴定试验进行试验,试验菌种为白色念珠菌,水浴控制作用温度19~21℃,试验重复3次。
[0279]
2.3定量杀灭试验:按照《消毒技术规范》(2002年版)2.1.1.9真菌杀灭试验操作程序,用该样品原液,作用时间2.5分钟、5分钟、7.5分钟,水浴控制作用温度19~21℃,试验重复3次。
[0280]
3.测试结果:
[0281]
3.1白色念珠菌中和剂鉴定试验结果:
[0282]
3次重复试验中,原液作用0.5分钟,3、4、5组间菌落误差率分别为2.21%、2.34%、2.72%。
[0283][0284]
注:阴性对照均无菌生长。
[0285]
3.2真菌定量杀灭试验结果:
[0286][0287][0288]
注:1)阴性对照均无菌生长。
[0289]
2)
[0290][0291]
4.结论:
[0292]
1)中和剂(d/e中全肉汤)可中和该消毒液中杀菌成分对白色念珠菌的作用,该中和剂和中和产物对白色念珠菌及培养基无影响。
[0293]
2)经3次重复实验表明,在19~21℃条件下,该样品原液作用2.5分钟,对悬液中白
色念珠菌的杀灭对数值均>4.00,符合《消毒技术规范》(2002年版)的要求。
[0294]
上文中,参照附图描述了本技术的具体实施方式。但是,本领域中的普通技术人员能够理解,在不偏离本技术的精神和范围的情况下,还可以对本技术的具体实施方式作各种变更和替换。这些变更和替换都落在本技术所限定的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。