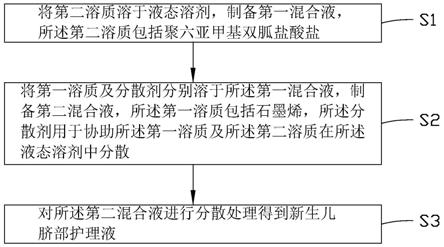
胡黄连苷ⅱ的新用途
技术领域
1.本发明涉及环烯醚萜苷类物质胡黄连苷ⅱ的新用途,具体是胡黄连苷ⅱ在制备治疗结直肠癌药物中的应用。
背景技术:
2.胡黄连(picrorhiza scrophulariiflora pennell)是我国的传统中草药,为玄参科多年生草本植物,胡黄连具清热,泻火,燥湿,凉血之效。胡黄连苷ⅱ(picrosideⅱ)是从胡黄连中提取的一种具有生物活性的小分子化合物,具有天然、低毒、价格低廉的特征,其为环烯醚萜苷类物质,化学式为c
23
h
28
o
13
,分子量为512.46;随着对胡黄连现代药理作用研究的深入,胡黄连苷ⅱ作为胡黄连的有效生物活性单体之一,被许多学者注意到;有研究表明胡黄连苷ⅱ除了抗炎、抗过敏的作用还具有神经心脏保护、免疫调节等作用。
3.目前未见关于胡黄连苷ⅱ在治疗结直肠癌的相关报道。
技术实现要素:
4.本发明提供了胡黄连苷ⅱ的新的药用用途,即其在在制备治疗结直肠癌药物中的应用,胡黄连苷ⅱ结构式如下所示:本发明结直肠癌药是以胡黄连苷ⅱ为活性成分,用于制备治疗结直肠癌的药物,还可以加入一种或多种药物制剂上可接受的辅料,所述辅料包括药学领域常规的填充剂、稀释剂、粘合剂、赋形剂、吸收促进剂、填充剂、表面活性剂和稳定剂等,必要时还可加入香味剂、色素和甜味剂等;或者与其他活性成分复配发挥协同预治结直肠癌的作用;可以制成药剂学上适宜的使用剂型,例如胶囊、丸剂、粉剂、片剂、粒剂、口服液和注射液等多种形式。
5.本发明对胡黄连苷ⅱ抑制结直肠癌细胞的增值进行了研究,实验结果显示胡黄连苷ⅱ对结直肠肿瘤细胞(sw480、sw620)增殖有明显的抑制作用,与不加该化合物的对照组相比有显著性差异(p < 0.01);本发明为胡黄连苷ⅱ可以用于治疗结直肠癌药物的开发。
附图说明
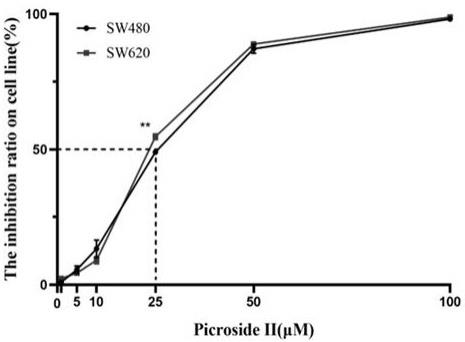
6.图1为cck
‑
8法检测结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ处理48h的抑制率结果;图2为cck
‑
8法检测结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理24、48、72h后的相对细胞存活率拟合曲线;图3为结直肠癌sw480(a、d图)、sw620(b、c图)细胞经不同浓度胡黄连苷ⅱ分别处理72h后的克隆形成结果;图4为结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理48h后的edu阳性率结果;图5为结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理48h后的edu阳性率统计结果;图6为结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理48h后的划痕实验结果;图7为结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理48h后的划痕实验结果统计图;图8为结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ分别处理48h后的transwell迁移实验结果;图9为结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理48h后的transwell迁移实验结果统计图;图10为结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ分别处理48h后的transwell侵袭实验结果;图11为结直肠癌sw480(a图)、sw620(b图)细胞经不同浓度胡黄连苷ⅱ分别处理48h后的transwell侵袭实验结果统计图;图12为结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ分别处理48h后,其emt过程中标志性蛋白表达量变化的结果示意图;图13为结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ分别处理48h后,其emt过程中标志性蛋白相对表达量统计结果图;图14为结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ分别处理48h后,其notch1信号通路标志性蛋白表达变化的结果示意图;图15为结直肠癌sw480、sw620细胞经不同浓度胡黄连苷ⅱ分别处理48h后,其notch1信号通路标志性蛋白相对表达量变化的统计结果图。
具体实施方式
7.下面通过实施例对本发明作进一步详细说明,但本发明的内容并不局限于此,本实施例中方法如无特殊说明的均按常规方法操作,所用试剂如无特殊说明的采用常规市售试剂或按常规方法配置的试剂;实施例中抗体及稀释比例如下:
实施例1:cck法测定不同浓度胡黄连苷ⅱ对结直肠癌细胞增殖的影响(1)结直肠癌细胞(sw480、sw620)悬液的制备选取对数生长期的细胞,依照细胞计数步骤制备浓度为10
×
104个/ml(根据48h
‑
标准曲线选择的细胞密度)的结直肠癌细胞(sw480、sw620)悬液;(2)供试液的制备本实验药物胡黄连苷ⅱ购于成都乐美天医药科技有限公司;于分析天平称取单体化合物2mg,放入1.5ml ep管备用;加入相对应体积的dmso(根据所需不同药物母液浓度计算出dmso的体积),盖紧,利用微量振荡器将ep管内液体混匀,使药物充分溶解直至ep管内液体澄清透亮,得到10mmol/l的药物母液,
‑
20℃避光密封保存备用。
8.药物的稀释:取出10mmol/l药物母液,在生物安全柜中用10�s dmem培养基配制成5ml 100μmol/l的药物工作液(5μl药物母液 4995μl10�s dmem培养基),用0.22μm的过滤器过滤备用(一般现配现用)。将100μmol/l的药物工作液用10�s dmem培养基稀释成1ml不同浓度(1μmol/l、5μmol/l、10μmol/l、25μmol/l、50μmol/l)的药物工作液,稀释后的dmso终浓度不超过0.1%。
9.(3)实验分组在96孔板四周边缘的孔加100μl 1
×
pbs缓冲液以减弱边缘孔液体的蒸发,再依次从左到右设置空白对照组,dmso对照组,不同药物浓度组,阳性药物对照组,每组设置6个复孔;分别在空白对照组、dmso对照组、不同药物浓度组、阳性药物对照组的各个孔中加入吹匀的结直肠癌细胞悬液100μl;将96孔板标记好细胞系、细胞密度、铺板时间及操作人,75%酒精喷洒消毒之后立即放入37℃、5%co2细胞培养箱中培养12
‑
24h后取出96孔板于倒置显微镜下观察细胞是否贴壁,若细胞均匀贴壁生长,即可加药干预,将96孔板稍微倾斜小心吸净各孔中的培养基,避免枪头接触孔底,向空白对照组各孔中加入100μl 10�s dmem培养基;向dmso对照组中加入100μl 0.1%dmso 10�s dmem培养基;不同药物浓度组中添加100μl不同浓度药物工作液(1μmol/l、5μmol/l、10μmol/l、25μmol/l、50μmol/l、100μmol/l);阳性药物组中添加100μl浓度2μmol/l的5
‑
fu;
(4)培养每种细胞各铺三个96孔板,在96孔板上标记好药物浓度及加药时间后75%酒精消毒放入细胞培养箱,每种细胞的三个96孔板分别培养24h、48h、72h(三个不同96孔板的铺板细胞数按照培养时间的长度递减,分别为1.5
×
104个/孔、1
×
104个/孔、0.3
×
104个/孔);(5)cck
‑
8法测定细胞od值在细胞培养箱中培养24h、48h、72h后,将96孔板取出,75%酒精消毒后在生物安全柜中将各孔中的培养基、最后一列孔的1
×
pbs缓冲液吸出,用100μl 1
×
pbs缓冲液小心轻柔冲洗各实验组的各孔,避免药物与cck
‑
8试剂反应;按照总孔数配制cck
‑
8反应液并且吹打混匀,100μl dmem完全培养基 10μl cck
‑
8试剂/孔(根据cck
‑
8说明书),配制过程注意避光,向空白对照组、dmso对照组、不同药物浓度组、阳性药物对照组以及最后一列无细胞的孔中加入110μl cck
‑
8反应液;将96孔板75%酒精消毒后置于37℃细胞培养箱中避光孵育2.5
‑
3h左右(孵育时间根据od值确定,od值为1.0
‑
1.5的时间最为合适);用全波段酶标仪测定各个孔在450nm处的光密度(optical density,od值)。
10.细胞生长抑制率(%)=〔1
‑
(as
‑
ac)/(ac
‑
ab)〕
×
100%;相对细胞存活率(%)=1
‑
细胞生长抑制率(%);as:不同药物浓度组od值(孔内包括实验细胞、培养基、不同浓度药物、cck
‑
8);ac:空白对照组od值(孔内包括实验细胞、培养基、不含药物、cck
‑
8);ab:空白组od值(孔内只有培养基、cck
‑
8);(6)数据处理实验数据细胞生长抑制率(%)、相对细胞存活率(%)均采用“平均数
±
标准差”来表示,用spss 2.0和prism 8等软件对数据进行处理,计算出药物的ic50(半效抑制浓度);实验结果见表1;阳性药物5
‑
fu对sw480、sw620的抑制率分别为51.365
±
0.8198%、50.29
±
0.5655%,p <0.0001;表1 不同浓度胡黄连苷ⅱ处理sw480、sw620细胞48h的细胞生长抑制率(均数
±
标准差,n=6);cck
‑
8实验结果显示,对不同作用时间及不同浓度的各组相对细胞存活率进行组
间比较,结果均有显著统计学意义(p<0.0001);胡黄连苷ⅱ对结直肠癌细胞增殖的抑制作用随着药物作用时间和药物浓度的增加而增强,呈现出明显的时间
‑
剂量
‑
效应关系;根据实验数据统计分析得到拟合较好的剂量
‑
反应曲线,如图2所示,计算出sw480、sw620两株细胞经胡黄连苷ⅱ分别处理24h、48h、72h后的ic
50
,如表2所示;表2 sw480、sw620细胞经不同浓度胡黄连苷ⅱ处理24、48、72h后的ic
50
、95%ci;从实验结果可以看出:一定浓度的胡黄连苷ⅱ能显著地抑制人结直肠癌sw480、sw620细胞的增殖;胡黄连苷ⅱ作用人结直肠癌sw480细胞48h的ic
50
=24.35μmol/l;sw620细胞48h的ic
50
=25.06μmol/l。
11.实施例2:细胞平板克隆形成实验检测不同浓度胡黄连苷ⅱ对结直肠癌细胞增殖的影响(1)结直肠癌细胞(sw480、sw620)悬液的制备选取对数生长期的结直肠癌细胞,依照细胞计数步骤制备浓度为300个/ml的细胞悬液;(2)实验药物工作液的制备根据胡黄连苷ⅱ的ic50选取10μmol/l、25μmol/l、100μmol/l作为低、中、高剂量孔的浓度,配制方法同实施例1;(3)实验分组及实验步骤6孔板的每个孔都用1
×
pbs缓冲液润洗一遍,设置空白对照孔、胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔,每个孔加入2ml吹打均匀的细胞悬液(大概600个细胞/孔);将6孔板标记好细胞系、细胞数、时间等,75%酒精消毒后放入细胞培养箱培养24h;将6孔板置于倒置显微镜下观察细胞是否贴壁,若细胞均匀贴壁生长,即可加药干预。弃去6孔板内原有的培养基,在空白对照孔内沿孔壁加入2ml10�s dmem培养基,在胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔中分别加入2ml10μmol/l、25μmol/l、100μmol/l药物工作液。在6孔板上标记好药物浓度及加药时间后75%酒精消毒放入细胞培养箱培养72h。培养72h后将6孔板4个孔中的培养基吸出,每个孔加入2ml10�s dmem培养基,继续在细胞培养箱中培养10
‑
14天;每隔2
‑
3天将6孔板取出观察,当培养皿中出现肉眼可见的克隆时,终止培养。吸掉培养基,用1
×
pbs缓冲液小心浸洗2次。将6孔板甩干,每孔加3ml 4%多聚甲醛固定细胞15
‑
20min。然后吸去固定液,每孔加1ml结晶紫染色液染20
‑
30min,吸去染色液,然后用pbs缓慢洗去染色液,将6孔板放置于通风处晾干。将6孔板倒置在空白a4纸上拍照,用肉眼直接计数克隆,最后计算克隆形成率,克隆形成率=(克隆数/接种细胞数)
×
100%,细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。
12.(4)数据处理及结果实验数据克隆形成率(%)采用“平均数
±
标准差”来表示,用spss 21.0和prism 8
等软件对数据进行处理;实验结果见图3,结果显示两株结直肠癌细胞的未经药物干预组与胡黄连苷ⅱ干预组的细胞克隆形成数量有明显的差异,高、中、低剂量胡黄连苷ⅱ干预组的细胞集落数明显比未经药物干预组少,而且细胞集落的体积也较小;在高、中、低剂量胡黄连苷ⅱ干预组之间,随着胡黄连苷ⅱ给药浓度的增加,处理后的细胞集落数显著变少、细胞集落体积也显著变小,表现出明显的药物剂量依赖性。未经药物干预组与胡黄连苷ⅱ干预组之间的差异有统计学意义(p<0.0001),不同浓度胡黄连苷ⅱ干预组之间也有显著性差异(p<0.0001),胡黄连苷ⅱ对结直肠癌sw480、sw620细胞的增殖能力有明显抑制作用。
13.实施例3:edu
‑
555细胞增殖实验检测不同浓度胡黄连苷ⅱ对结直肠癌细胞增殖的影响(1)结直肠癌细胞(sw480、sw620)悬液的制备选取生长状态稳定、处于对数生长期的细胞,依照细胞计数步骤制备密度为10
×
104个/ml的细胞悬液;(2)实验药物工作液的制备根据胡黄连苷ⅱ的ic50选取10μmol/l、25μmol/l、100μmol/l作为低、中、高剂量孔的浓度,配制方法同实施例1;(3)实验分组及实验步骤a、6孔板的每个孔都用1
×
pbs缓冲液润洗一遍,设置空白对照孔、胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔,每个孔加入2ml吹打均匀的细胞悬液(大概15
‑
20
×
104个细胞/孔,密度控制在40
‑
50%)。将6孔板标记好细胞系、细胞数、日期等,75%酒精消毒后放入细胞培养箱培养24h,将6孔板置于倒置显微镜下观察细胞是否贴壁,若细胞均匀贴壁生长,即可加药干预。弃去6孔板内原有的培养基,在空白对照孔内沿孔壁加入2ml10�s dmem培养基,在胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔中分别加入2ml10μmol/l、25μmol/l、100μmol/l药物工作液;在6孔板上标记好药物浓度及加药时间后75%酒精消毒放入细胞培养箱培养48h;b、按照说明书配制2
×
edu工作液:14μl edu 7ml dmem完全培养基;将配好的工作液置于37℃、5%co2细胞培养箱中孵育30
‑
60min;c、将6孔板取出,75%酒精消毒后在生物安全柜中操作,吸去各孔原有培养基,各孔加入1ml10�s dmem培养基及1mledu工作液,盖上盖,于操作台上十字法摇匀,放入37℃、5%co2细胞培养箱中孵育2h,孵育2h后,吸去各孔液体,每孔加入1ml 4%多聚甲醛,固定15
‑
20min;去除各孔固定液,每孔加入1ml 3%bsa洗涤液(于分析天平称取1.5gbsa,加入pbs溶液定容至50ml,充分摇匀后4℃保存备用),将6孔板放置于水平摇床上匀速洗3
‑
5min,洗3次;去除各孔洗涤液,每孔加入1ml 0.3%pbst通透液(用移液枪吸取triton x
‑
100 300ul,加入pbs溶液定容至100ml,充分摇匀后4℃保存备用),将6孔板放置室温孵育10
‑
15min,去除各孔通透液,每孔加入1ml 3%bsa洗涤液,将6孔板放置于水平摇床上匀速洗3
‑
5min;洗2次;d、将beyoclick
tm edu
‑
555细胞增殖检测试剂盒提前从
‑
20℃拿出来解冻,配制click反应液,配置好后每孔加501μl,室温避光孵育30min,15min内加完;edu工作液配制表如下:
表3 edu工作液配制表;e、去除各孔中的click反应液,每孔加入1ml 3%bsa洗涤液,将6孔板放置于水平摇床上匀速洗3
‑
5min,洗3次,一定要注意避光;去除各孔洗涤液,对各孔细胞进行细胞核染色,按照试剂盒内说明书hoechst 33342:pbs=1:1000配制细胞核染色液(7μl hoechst 33342 7mlpbs),配置后混匀,每孔加1ml,室温避光孵育10min;去除细胞核染色液,每孔加入1ml 3%bsa洗涤液,将6孔板放置于水平摇床上匀速洗3
‑
5min,洗3次,注意避光;用倒置荧光显微镜拍照,计数统计edu阳性细胞的百分比,细胞edu阳性率=edu /dapi
×
100%。
14.(4)数据处理实验数据细胞edu阳性率(%)采用“平均数
±
标准差”来表示,用spss 21.0和prism 8等软件对数据进行处理。
15.实验结果见图4所示,荧光倒置显微镜下看见的红色荧光即为具有增殖能力的细胞,而蓝色荧光则代表被dapi标记的所有细胞,当两种荧光重叠在一起,就可以很直观地观察到所有细胞中具有增殖能力的细胞比例;图5实验结果显示,两株细胞相较于未经药物干预组,高、中、低剂量胡黄连苷ⅱ干预组edu阳性的细胞明显减少,表明胡黄连苷ⅱ对结直肠癌细胞的增殖有明显的抑制作用,各组的细胞edu阳性率有显著的差异性(p<0.05);不同浓度胡黄连苷ⅱ干预组的细胞edu阳性率也随着浓度的梯度增加而减小,胡黄连苷ⅱ低剂量组、胡黄连苷ⅱ中剂量组以及胡黄连苷ⅱ高剂量组之间具有明显的统计学意义(p<0.05),结果表明胡黄连苷ⅱ对结直肠癌sw480、sw620细胞的增殖能力有明显抑制作用。
16.实施例4:细胞划痕实验检测胡黄连苷ⅱ对结直肠癌细胞迁移能力的影响(1)结直肠癌细胞(sw480、sw620)悬液的制备选取对数生长期的细胞,依照细胞计数步骤制备密度为70
×
104个/ml的细胞悬液;(2)实验药物工作液的制备根据胡黄连苷ⅱ的ic50选取10μmol/l、25μmol/l、100μmol/l作为低、中、高剂量孔的浓度,配制方法同实施例1;(3)实验分组及实验步骤a、将6孔板倒扣在生物安全柜操作台上用超细油漆笔划线,线平行于6孔板的长轴,每孔5条线,每条线间隔0.5
‑
1.0cm;1
×
pbs缓冲液润洗一遍6孔板,设置空白对照孔、胡黄连苷ⅱ低剂量孔(10μm)、胡黄连苷ⅱ中剂量孔(25μm)以及胡黄连苷ⅱ高剂量孔(100μm),每个孔加入2ml吹打均匀的细胞悬液(每孔150
‑
200
×
104个细胞,24h后大概密度为80%
‑
90%)。加完所有细胞悬液后盖上盖子,将6孔板标记好细胞系、细胞数、时间,移放入细胞培
养箱培养24h或过夜待细胞贴壁;将6孔板置于倒置显微镜下观察细胞是否贴壁,若细胞均匀单层铺满整个孔底,则可以制造划痕。用10μl的枪头靠着灭菌的直尺在垂直于6孔板长轴孔中线位置划一条直线;去除旧培养基,用无菌pbs轻柔冲洗各个孔2
‑
3次。
17.b、加药干预:在空白对照孔内沿孔壁加入2ml10�sdmem培养基,在胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔中分别加入2ml10μmol/l、25μmol/l、100μmol/l药物工作液;c、将6孔板标记好药物浓度、加药时间等放入37℃、5%co2细胞培养箱,培养;按0h、48h置于倒置显微镜下拍照;(4)数据处理用imagej、prism8软件等进行图像数据分析;实验结果见图6、7,与高、中、低剂量胡黄连苷ⅱ干预组相比,未经药物干预组中的细胞相对迁移率显著增加(p<0.0001);不同浓度的胡黄连苷ⅱ干预组之间的细胞相对迁移率也有明显的差异(p<0.0001),随着胡黄连苷ⅱ浓度的升高细胞相对迁移率就有所减少,说明胡黄连苷ⅱ对结直肠癌细胞的迁移能力有明显抑制作用。
18.实施例5:transwell实验检测胡黄连苷ⅱ对结直肠癌细胞迁移能力的影响(1)结直肠癌细胞(sw480、sw620)悬液的制备选取对数生长期的细胞,在进行实验前对细胞进行换液,用dmem完全培养基饥饿处理细胞12
‑
24h,将贴壁细胞消化为细胞悬液,并用无菌pbs冲洗细胞2
‑
3次(反复用pbs重悬细胞并离心,倒掉上清)然后进行细胞计数,用dmem完全培养基将细胞制备成浓度200
×
104个/ml的细胞悬液;(2)实验药物工作液的制备用20�sdmem培养基配制2ml浓度为10μmol/l、25μmol/l、100μmol/l的胡黄连苷ⅱ工作液,用dmem完全培养基配制2ml浓度为20μmol/l、50mmol/l、200μmol/l的胡黄连苷ⅱ工作液;(3)实验分组及实验步骤a、在24孔板中分别设置空白对照孔、胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔,每组设3个复孔,向空白对照孔下室加入600μl20�sdmem培养基,向胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔的下室分别加入600μl10μmol/l、25μmol/l、100μmol/l20�sdmem培养基的药物工作液;在各孔上室中加入吹打均匀的150μl细胞悬液和150μl不同浓度dmem完全培养基药物工作液,使上下室药物工作液浓度保持一致(上室细胞数大约为25
×
104‑
30
×
104个),将transwell24孔板标记好药物浓度、加药时间等用75%酒精消毒后放入37℃、5%co2细胞培养箱培养48h;b、取出transwell24孔板(8.0μm),小心吸去上室培养基,用无菌棉签轻柔擦去小室上侧未穿透聚碳酸酯薄膜的细胞,将小室分别用无菌1
×
pbs缓冲液清洗3次;c、在各空白下室加入600μl4%多聚甲醛,将上室放入下室中固定细胞15
‑
20min;将上室取出,吸去上室中多余的固定液,用无菌棉签轻柔擦拭小室上侧,特别是小室边缘;在各空白下室加600μl结晶紫染色液染,将上室放入下室染色20
‑
30min,小心取出上室,用1
×
pbs缓冲液小心缓慢洗去染色液,2
‑
3次,注意不要将上室下侧穿过聚碳酸酯薄膜的细胞冲掉,将各个小室放置于通风处晾干;d、将小室倒立在干净的载玻片上,用正置显微镜进行观察,每个小室取左上、左
下、右上、右下以及中央视野拍照;(4)数据处理用imagej、prism 8软件等进行图像数据分析;胡黄连苷ⅱ对两株结直肠癌细胞迁移与侵袭能力的结果见图8、9,未经药物干预组中穿过聚碳酸酯膜的细胞明显多于高、中、低剂量胡黄连苷ⅱ干预组穿过聚碳酸酯膜的细胞(p<0.0001),结果表明胡黄连苷ⅱ可以抑制结直肠癌细胞迁移能力;不同浓度的胡黄连苷ⅱ干预组之间的穿过聚碳酸酯膜的细胞也有明显的差异(p<0.0001),随着胡黄连苷ⅱ浓度的升高细胞穿过聚碳酸酯膜的细胞明显减少,说明胡黄连苷ⅱ对结直肠癌sw480、sw620细胞的迁移能力有明显抑制作用。
19.实施例6:transwell实验检测胡黄连苷ⅱ对结直肠癌细胞侵袭能力的影响(1)结直肠癌细胞(sw480、sw620)悬液的制备选取对数生长期的细胞,在进行实验前对细胞进行换液,用dmem完全培养基饥饿处理细胞12
‑
24h,将贴壁细胞消化为细胞悬液,并用无菌pbs冲洗细胞2
‑
3次(反复用pbs重悬细胞并离心,倒掉上清)然后进行细胞计数,用dmem完全培养基将细胞制备成浓度200
×
104个/ml的细胞悬液;(2)实验药物工作液的制备用20�s dmem培养基配制2ml浓度为10μmol/l、25μmol/l、100μmol/l的胡黄连苷ⅱ工作液,用dmem完全培养基配制2ml浓度为20μmol/l、50μmol/l、200mmol/l的胡黄连苷ⅱ工作液;(3)实验分组及实验步骤a、放置灭菌枪头、transwell24孔板于4℃冰箱中预冷,将标准型matrigel基质胶于
‑
80℃冰箱取出放置在4℃冰箱24h或过夜至液体状态,之后在冰上进行分装备用;b、提前将1ml dmem完全培养基装入1.5mlep管中,放在冰上预冷,按照matrigel基质胶:无血清培养基=1:8的比例,往预冷的dmem完全培养基中加入125μl液态的标准型matrigel基质胶小心混匀,注意不要产生气泡。将预冷的24孔板放置在冰上,取80μl稀释后的matrigel基质胶小心均匀地加在上室内,使胶均匀完整地覆盖上室的聚碳酸酯薄膜,避免气泡产生;c、将铺好胶的transwell 24孔板用75%酒精消毒后放入37℃、5%co2细胞培养箱培养数小时,直到小室内matrigel基质胶凝固成半透明果冻状;待胶凝固后,吸取适量dmem完全培养基于上室水化基底膜,室温静置30min,然后小心吸出培养基,注意不要碰到基质胶;d、在24孔板中分别设置空白对照孔、胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ⅱ高剂量孔,每组设3个复孔,向空白对照孔下室加入600μl20�s dmem培养基,向胡黄连苷ⅱ低剂量孔、胡黄连苷ⅱ中剂量孔以及胡黄连苷ii高剂量孔的下室分别加入600μl 10μmol/l、25μmol/l、100μmol/l 20�s dmem培养基的药物工作液;在各孔上室中加入吹打均匀的150μl细胞悬液和150μl不同浓度dmem完全培养基药物工作液,使上下室药物工作液浓度保持一致(上室细胞数大约为25
×
104‑
30
×
104个),将transwell 24孔板标记好药物浓度、加药时间等用75%酒精消毒后放入37℃、5%co2细胞培养箱培养48h;e、取出transwell 24孔板(8.0μm),小心吸去上室培养基,用无菌棉签轻柔擦去小室上侧未穿透聚碳酸酯薄膜的细胞,将小室分别用无菌pbs清洗3次;f、在各空白下室加入600μl4%多聚甲醛,将上室放入下室中固定细胞15
‑
20min;将
上室取出,吸去上室中多余的固定液,用无菌棉签轻柔擦拭小室上侧,特别是小室边缘;在各空白下室加600μl结晶紫染色液染,将上室放入下室染色20
‑
30min,小心取出上室,用pbs小心缓慢洗去染色液,2
‑
3次,注意不要将上室下侧穿过聚碳酸酯薄膜的细胞冲掉,将各个小室放置于通风处晾干;g、将小室倒立在干净的载玻片上,用正置显微镜进行观察,每个小室取左上、左下、右上、右下以及中央视野拍照;(4)数据处理用imagej、prism 8软件等进行图像数据分析。
20.胡黄连苷ⅱ对两株结直肠癌细胞侵袭能力的影响结果见图10、11,未经药物干预组中穿过聚碳酸酯膜的细胞明显多于高、中、低剂量胡黄连苷ⅱ干预组穿过聚碳酸酯膜的细胞(p<0.0001),提示胡黄连苷ⅱ可以抑制结直肠癌细胞侵袭能力;不同浓度的胡黄连苷ii干预组之间的穿过聚碳酸酯膜的细胞也有明显的差异(p<0.0001),随着胡黄连苷ⅱ浓度的升高细胞穿过聚碳酸酯膜的细胞明显减少,说明胡黄连苷ⅱ对结直肠癌sw480、sw620细胞的侵袭能力有明显抑制作用。
21.实施例7:western blot实验检测胡黄连苷ⅱ对结直肠癌细胞上皮间质转化(emt)相关标志蛋白及notch1信号通路相关蛋白的影响(1)不同处理方法的蛋白样品的制备收集处理48h后的未经药物干预组、胡黄连苷ⅱ低剂量组(10μmol/l)、胡黄连苷ⅱ中剂量组(25μmol/l)、胡黄连苷ⅱ高剂量组(100μmol/l)细胞的总蛋白,用western blot方法检测胡黄连苷ⅱ处理后结直肠癌sw480、sw620细胞的蛋白表达变化。
22.a、选择生长状态好处于对数生长期的细胞(密度大概为60%
‑
70%),分成4个组(t
25
细胞培养瓶),依次为空白对照组、胡黄连苷ⅱ低剂量组(10μmol/l)、胡黄连苷ⅱ中剂量组(25μmol/l)、胡黄连苷ⅱ高剂量组(100μmol/l);吸去各个瓶中的旧培养基,用灭菌1
×
pbs缓冲液洗2次,分别向空白对照组、胡黄连苷ⅱ低剂量组、胡黄连苷ⅱ中剂量组以及胡黄连苷ⅱ高剂量组加入5ml 10�s dmem培养基,5ml浓度为10μmol/l、25μmol/l、100μmol/l药物工作液;分别标记好培养瓶,放入细胞培养箱培养48h;b、取出t
25
细胞培养瓶,倒掉原有培养基,用预冷的无菌1
×
pbs洗2
‑
3次,将细胞培养瓶中的液体甩干,放置在冰上备用;c、取无菌1.5ml ep管,按ripa裂解液:pmsf=100:1的比例取适量ripa裂解液及pmsf混合均匀,放在冰上备用;每个培养瓶加入150
‑
300μl 混合裂解液(视细胞数量增减混合裂解液的量),左右晃动培养瓶使混合裂解液覆盖整个瓶底,让细胞与混合裂解液充分接触,将细胞培养瓶放置冰上充分裂解20
‑
30min;d、准备洗净干燥的细胞刮,将细胞刮伸进细胞培养瓶中多次来回刮取整个瓶底的细胞,将瓶中的液体转移到标记好的1.5ml ep管内,放置到冰上备用;若ep管中有透明半凝胶状液体可适量增加混合裂解液,用微量振荡器充分混匀裂解;e、将所有裂解好的蛋白样品对称放入预冷好的高速冷冻离心机中,注意配平,4℃,15000rpm离心20
‑
25min;f、将ep管小心取出放置冰上,将管内上清液小心吸出转移到新的标记好的ep管内,将吸出液体的体积标记在管侧壁;将制备好的蛋白样品放入
‑
80℃冰箱备用;g、bca法测定蛋白浓度备用;
(2)实验步骤1、将玻璃厚板与玻璃薄板底边对齐后用配胶夹夹紧,将底边对齐的玻璃板固定在有胶垫的制胶架上;2、根据目标蛋白分子量大小选择配制不同浓度的sds
‑
page分离胶(根据实验需求一般配制10%的分离胶);;3、将分离胶用振荡器混匀,用1000μl的移液枪沿双层玻璃板间的缝隙加入,液面大概到玻璃板上缘以下1.5cm处;4、沿着玻璃板上缘用无水乙醇将胶液水平面压平,放置于室温待其凝固;当无水乙醇与胶之间出现一条明显的直线时,即为分离胶已经完全凝固;将制胶架倒立放置控干无水乙醇,用滤纸吸干残留的无水乙醇;5、配制5% sds
‑
page浓缩胶;6、将配制好的浓缩胶用振荡器充分混匀,用1000μl的移液枪沿双层玻璃板间的缝隙加入到分离胶上,直到液面与玻璃板上缘齐平,然后迅速地将干燥的梳子插入双层玻璃板之间,过程中一定要避免气泡产生,将其放置于室温下至完全凝固;7、梳子与胶的接触面出现一条明显的分界线时,即为浓缩胶已经完全凝固;小心将玻璃板从配胶夹中取出,然后将玻璃板在电极架上固定好放入电泳槽中,在两块玻璃板中间倒入配制好的1
×
tris
‑
甘氨酸电泳液,使液面与玻璃板上缘齐平,双手握住梳子两端,垂直向上地拔出梳子;8、各目标蛋白上样:将蛋白样品从
‑
80℃冰箱中取出,放置于冰上直到融化,将各
蛋白样品置于振荡器上充分混匀然后再短暂离心,放在冰上备用。在胶中央的上样槽依次加入3μlmarker、各组蛋白样品、3μlmarker(使上样槽两侧重力对称);上样完成后在电泳槽中加入足量的1
×
tris
‑
甘氨酸电泳液(依次于分析天平上称取tris 3.03g、甘氨酸18.77g、sds 1g至容器中,加入蒸馏水定容至1000ml;待其完全溶解后室温保存备用,终浓度25mmol/l tris 250mmol/l甘氨酸(ph8.3) 0.1%sds);9、将电泳槽盖子盖好,将正负电极插上电泳仪电源。打开电源开关,设置参数,将模式调到v(电压),数值调到60v(当蛋白样品跑至胶中间时可调大电压数值),点击run(开始);观察电极架下方的铂丝是否出现密集的气泡,当蛋白电泳至电极架绿色胶条处可停止电泳(一般2个小时左右)。
23.10、湿转法:将pvdf膜剪成合适的大小,用黑色签字笔标记好,浸泡在甲醇中进行活化(过程中要戴好橡胶手套避免蛋白沾到pvdf膜上)备用;将需要的转膜滤纸剪成合适大小,浸泡在1
×
浸渍电转移缓冲液中备用。将转膜夹板打开平放在装有1
×
浸渍电转移缓冲液的托盘中,把转膜海绵浸湿铺在转膜板两侧,将pvdf膜平放在转膜滤纸上,用滚轮轻滚pvdf膜表面排出膜与滤纸间的气泡。用切胶塑料板将双层玻璃板小心撬开,根据marker切包含目标蛋白的胶条,然后将其小心转移至pvdf膜上,按头尾顺序放置好,再在胶条上铺上浸湿的转膜滤纸,注意用滚轮排出气泡。按转膜夹板透明侧
→
转膜海绵
→
转膜滤纸
→
pvdf膜
→
目标胶带
→
转膜滤纸
→
转膜海绵
→
转膜夹板黑色侧的顺序夹紧转膜夹板,小心插入转膜槽中,透明侧朝红色侧,黑色朝黑色侧。在转膜槽中加入1l预冷的1
×
浸渍电转移缓冲液,再往转膜槽中加入小的冰袋以降低转膜槽的温度,盖紧电极盖后将转膜槽埋入放有有冰袋、碎冰及冰水的小盆中。将正负极插入电泳仪电源,打开电源开关,设置参数,将模式调到a(电流),数值调到300a,根据蛋白分子量大小设置转膜时间(60kda,60min),点击run(开始);浸渍电转移缓冲液的配制:依次于分析天平上称取tris 5.8g、甘氨酸2.9g、sds 0.37g至容器中,加入200ml甲醇,再加入蒸馏水定容至1000ml。待其完全溶解后4℃保存备用,终浓度0.048mmol/l tris
‑
hcl 0.039mmol/l甘氨酸 0.0375%(w/v)sds 20%(v/v)甲醇;11、等转膜完成后,用镊子将pvdf膜取出放入洗膜塑料盒中,加入适量1
×
tbst,放在水平摇床上中速洗3次,10min/次;12、封闭pvdf膜:取配制好的封闭液(称取5g脱脂奶粉,加入100ml tbst溶液,充分混匀至4℃保存备用),每个条带加入适量封闭液(完全浸没),放置在水平摇床上室温下封闭2h;13、pvdf膜孵育一抗:回收封闭液,放置4℃保存备用;按照一抗说明书稀释抗体;准备好合适大小的干净塑料薄膜,将pvdf膜依次放在塑料薄膜中用塑封机封好只留顶部的一侧(注意不要封到pvdf膜),将对应的一抗加入到放pvdf膜的塑料薄膜中,排出气泡,用塑封机封住塑料薄膜的顶部,将封闭好的pvdf膜塑料条带粘在放置在4℃ 冰箱的3d旋转混匀仪上,打开开关,4℃ 孵育一抗过夜;14、pvdf膜孵育二抗:将薄膜孵育袋取出放置于室温20min;一抗回收后保存于
‑
20℃备用;取出pvdf膜,放入洗膜塑料盒中,倒入适量1
×
tbst,放置于水平摇床上洗3次,10min/次;配制一抗对应的二抗,将二抗加到对应的pvdf膜格子中,洗膜塑料盒放在水平摇床上室温孵育2h;
15、洗膜:吸出二抗并回收至
‑
20℃保存备用,每格倒入适量1
×
tbst,放置于水平摇床上洗3次,10min/次;16、曝光:打开ai600化学发光成像系统,用镊子将pvdf膜取出放在干净滤纸上蘸干液体,在小曝光盒中按1:1的比例配制底物显色液a、b,现配现用,少量多次,将蘸干液体的pvdf膜放入底物显色液中浸湿数秒,然后放入ai600化学发光成像系统中,按照软件操作步骤曝光pvdf膜,保存图像;(3)数据处理imagej软件对条带进行定量分析,得到灰度值(intden),用目标蛋白条带的灰度值除以内参蛋白(β肌动蛋白,β
‑
actin)的灰度值,得到相对灰度值,用graphpad prism 8进行统计分析;胡黄连苷ⅱ对sw480、sw620两株结直肠癌细胞emt相关标志蛋白及notch1信号通路相关蛋白的影响结果见如图12
‑
15,在两株细胞中,与未经药物干预组相比较,高、中、低剂量胡黄连苷ⅱ干预组中的e
‑
cadherin蛋白表达水平明显升高,n
‑
cadherin 、vimentin、zeb2蛋白表达水平有所降低,提示胡黄连苷ⅱ抑制了结直肠癌sw480、sw620细胞的emt过程,造成了emt相关标志蛋白表达水平发生了变化;notch信号通路相关蛋白notch1、cleaved notch1的表达水平显著降低,同时其下游的转录因子rbpsuh及hes1的蛋白表达水平明显降低,提示胡黄连苷ⅱ影响了结直肠癌细胞sw480、sw620的notch信号通路的激活。
24.综上,cck
‑
8细胞增殖实验、edu细胞增殖实验、细胞平板克隆实验结果均证实了胡黄连苷ⅱ对两株人结直肠癌细胞增殖有明显抑制作用,48h时的ic50(sw480)=24.35μmol/l、ic50(sw620)=25.06μmol/l,高剂量(100μmol/l)时抑制效果最明显,抑制效果具有明显浓度、时间依赖性。
25.细胞迁移能力实验、划痕实验和transwell实验结果证明了胡黄连苷ⅱ有效地抑制了sw480、sw620细胞的迁移和侵袭。胡黄连苷ⅱ除了对人结直肠癌细胞增殖具有毒性作用以外,还具有抑制sw480、sw620细胞emt的作用,通过抑制结直肠癌细胞emt过程,胡黄连苷ⅱ抑制了人结直肠癌sw480、sw620的细胞迁移与侵袭。
26.为了研究胡黄连苷ⅱ抑制人结直肠癌细胞emt及迁移侵袭的可能作用机制,接下来我们通过wb实验在蛋白水平上对emt标志性蛋白和notch信号通路相关蛋白及下游靶蛋白进行验证。wb结果证明了,胡黄连苷ⅱ干预后e
‑
cadherin蛋白表达水平明显升高,n
‑
cadherin、vimentin、zeb2蛋白表达水平有所降低,notch信号通路相关蛋白notch1、cleaved notch1的表达水平显著降低,同时其下游的转录因子rbpsuh及hes1的蛋白表达水平明显降低,实验结果说明胡黄连苷ⅱ抑制了结直肠癌sw480、sw620细胞的emt过程,同时也抑制了notch信号通路,胡黄连苷ⅱ可能通过抑制notch通路中的notch1受体蛋白的表达,减少notch受体与配体的结合,继而其下游转录因子的表达也受到抑制,最终抑制了人结直肠癌细胞emt和转移的生物学过程。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。