一种源于香樟齿喙象气味结合蛋白ptsuobp24及监测防治香樟齿喙象引诱剂和应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种源于香樟齿喙象气味结合蛋白ptsuobp24及监测防治香樟齿喙象引诱剂和应用。
背景技术:
2.香樟齿喙象(pagiophloeus tsushimanus)为鞘翅目(coleptera),象甲科(curculionidae),齿喙象属(pagiophloeus),是一种钻蛀为害香樟的中国新纪录种害虫。成虫主要取食1~2年生的嫩枝表皮,幼虫取食形成层,虫口密度较大时,导致香樟长势衰弱或整株枯死。目前,香樟齿喙象仅分布于中国上海市,1年发生1代,以幼虫和成虫越冬。
3.昆虫通过嗅觉系统感知外界环境中的气味物质调节其行为,基于昆虫嗅觉感受机制研发的调控昆虫行为的方法已经应用于农林害虫的防治。目前,许多昆虫的信息素都被用于害虫的监测和防治,然而对害虫具有生理活性的气味分子的筛选过程需要花费大量的人力、物力和财力,这就严重制约了有生理活性的气味分子的筛选和推广应用。有鉴于此,一些研究者提出了“反向化学生态学(reverse chemical ecology)”的概念,即以气味分子与嗅觉相关蛋白的结合力来筛选具有生物活性的挥发性化学物质,而不是用大量的气味分子逐一观察其引起的昆虫行为反应的传统方法,可以明显减少有生理活性气味分子筛选的工作量,显著提高工作效率。
4.气味结合蛋白(odorant
‑
binding proteins,obps)是昆虫嗅觉相关蛋白的主要种类之一,是由昆虫嗅觉感器内部的支持细胞分泌,浸润于感器淋巴液中并分布于感觉神经元轴突周围的水溶性酸性蛋白。也是气味分子进入触角感器后最先接触的第一类嗅觉蛋白。obps是昆虫识别外界气味物质的必要载体蛋白,其主要功能是结合并转运外界的气味分子穿过触角感器的疏水性淋巴液至嗅觉受体处释放,从而将化学信号转变为电信号,因此,obps在昆虫的气味嗅觉识别过程中起决定性的作用,明确昆虫obps的功能对理解昆虫嗅觉感受系统至关重要。
5.荧光竞争性结合实验(fluoresecence competitive binding assays)是研究昆虫obps与气味分子结合能力的主要方法之一,该方法已广泛应用于昆虫obps的功能研究中,如蟑螂(leucophaea maderae)、华北大黑鳃金龟(holotrichia oblita)、樟巢螟(orthaga achatina)、松墨天牛(monochamus alternatus)、美国白蛾(hyphantria cunea)与暗黑鳃金龟(holotrichia parallela)等。
6.目前已有多种昆虫obps已被克隆和研究,但香樟齿喙象成虫气味结合蛋白obps尚未见报道。研究香樟齿喙象成虫气味结合蛋白obps不但可以为解析香樟齿喙象为害香樟的嗅觉分子机制奠定基础,而且可以为寄主植物香樟挥发性化合物的关键组分鉴定提供反向验证的方法,也为进一步开发以昆虫嗅觉关键基因为靶点的害虫监测防控技术提供参考依据。
技术实现要素:
7.本发明的目的在于提供一种源于香樟齿喙象气味结合蛋白ptsuobp24,对香樟齿喙象寄主植物香樟中多种挥发性化合物具有结合性。
8.本发明的目的还在于提供一种香樟齿喙象引诱剂,基于香樟齿喙象的触头上广泛表达气味结合ptsuobp24,将能与ptsuobp24蛋白的化合物作为引诱剂的活性成分用于监测和/或防治香樟齿喙象。
9.本发明提供了一种源于香樟齿喙象气味结合蛋白ptsuobp24,所述ptsuobp2的氨基酸序列如seq id no:1所示。
10.本发明提供了所述ptsuobp24在识别和/或结合香樟的挥发性化合物中的应用。
11.优选的,所述挥发性化合物包括以下成分中的一种或几种:樟脑、罗勒烯、桉叶油素、α水芹烯和β石竹烯。
12.优选的,所述ptsuobp24与挥发性化合物的解离常数10μm<ki<20μm。
13.本发明提供了一种所述源于香樟齿喙象气味结合蛋白ptsuobp24的编码基因,所述编码基因的核苷酸序列如seq id no:2所示。
14.本发明提供了一种表达外源基因的重组载体,所述外源基因包括所述编码基因。
15.本发明提供了所述编码基因或所述重组载体在重组表达源于香樟齿喙象气味结合蛋白ptsuobp24中的应用。
16.本发明提供了一种香樟齿喙象引诱剂,以与所述ptsuobp24结合的香樟的挥发性化合物为活性成分;所述香樟的挥发性化合物包括以下成分中的一种或几种:樟脑、罗勒烯、桉叶油素、α水芹烯和β石竹烯。
17.优选的,当引诱剂的活性成分仅为1种时,所述香樟的挥发性化合物为樟脑;
18.所述引诱剂的活性成分仅为2种时,所述香樟的挥发性化合物包括樟脑和罗勒烯。
19.本发明提供了所述引诱剂在监测和/或防治香樟齿喙象中的应用。
20.本发明提供的源于香樟齿喙象气味结合蛋白ptsuobp24,氨基酸序列如seq id no:1所示。本发明通过克隆和原核表达方法获得一种源于香樟齿喙象气味结合蛋白ptsuobp24。本发明提供的蛋白通过荧光竞争性结合实验表明,ptsuobp24与1
‑
npn的荧光值随1
‑
npn浓度的增加均存在饱和效应,同时表明ptsuobp24具有单一的结合位点,可用于荧光竞争性结合力测定。此外,ptsuobp24与1
‑
npn的结合常数k1‑
npn
=8.40
±
0.85。同时本技术通过反向验证寄主植物香樟挥发性化合物的活性组分鉴定,结果表明,ptsuobp24对樟脑(k
i
=10.28μm)、罗勒烯(k
i
=13.31μm)、桉叶油素(ki=18.72μm)、α水芹烯(ki=13.53μm)与β石竹烯(ki=14.95μm)的结合能力,而对寄主香樟的其他挥发性信息化合物(右旋龙脑、芳樟醇、3蒈烯与反式橙花叔醇)无结合能力。本发明提供的ptsuobp24解析香樟齿喙象为害香樟的嗅觉分子机制奠定分子基础,同时为开发以昆虫嗅觉关键基因为靶点的害虫监测防控技术提供参考依据。
附图说明
21.图1为ptsuobp24基因在香樟齿喙象雌雄成虫组织的相对表达量图;
22.图2为ptsuobp24纯化的sds
‑
page分析结果图,注:图中泳道m为marker;1为纯化收集的目的蛋白ptsuobp24;
23.图3为ptsuobp24与1
‑
npn的结合曲线图(a)及scatchard图(b);
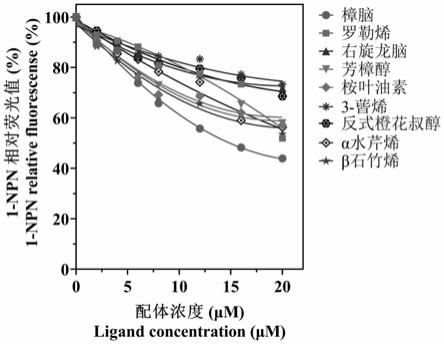
24.图4为ptsuobp24与香樟挥发物的荧光竞争结合曲线图。
具体实施方式
25.本发明提供了一种源于香樟齿喙象气味结合蛋白ptsuobp24,所述ptsuobp2的氨基酸序列如seq id no:1(mkvlivicgllmvalasdphgikpvhekcqtdpesridesvlvditknhdkavlpsnfvkhvicmskglglitdegkvsvegvkthvqhvvhdadkvekivkecavdaatveetsehiwkclyknhivnihygpghshensseesgehhhghh)所示。所述ptsuobp24蛋白由153个氨基酸编码;含有16aa组成的信号肽;蛋白质分子质量为15.23kda;等电点为5.97。
26.经ptsuobp24蛋白的功能实验验证,本发明提供了所述ptsuobp24在识别和/或结合香樟的挥发性化合物中的应用。所述挥发性化合物优选包括以下成分中的一种或几种:樟脑、罗勒烯、桉叶油素、α水芹烯和β石竹烯。所述ptsuobp24与挥发性化合物的解离常数优选10μm<ki<20μm。采用荧光竞争性结合实验进行。所述荧光竞争性结合实验预先测定荧光探针1
‑
npn的适用性分析,结果表明,ptsuobp24与1
‑
npn的荧光值随1
‑
npn浓度的增加均存在饱和效应,同时表明ptsuobp24具有单一的结合位点,可用于荧光竞争性结合力测定,ptsuobp24与1
‑
npn的结合常数k1‑
npn
=8.40
±
0.85。以1
‑
npn作为荧光探针进行配体气味分子的竞争结合实验,通过分析9种寄主植物香樟的挥发性化合物,结果表明,ptsuobp24对樟脑(ki=10.28μm)、罗勒烯(ki=13.31μm)、桉叶油素(ki=18.72μm)、α水芹烯(ki=13.53μm)与β石竹烯(ki=14.95μm)的结合能力,而对寄主香樟的其他挥发性信息化合物(右旋龙脑、芳樟醇、3蒈烯与反式橙花叔醇)无结合能力,可见,所述ptsuobp24对香樟挥发性化合物的结合能力具有选择性。
27.本发明提供了一种所述源于香樟齿喙象气味结合蛋白ptsuobp24的编码基因,所述编码基因的核苷酸序列如seq id no:2(atgaaagttttaatagttatttgtggtcttctcatggtcgctttggcaagtgatccacatggtatcaaaccagtccatgagaagtgccaaactgatccagaaagtcgtattgacgaatcagttcttgtggacattactaaaaaccatgacaaagctgttcttccttcgaattttgtcaaacacgtcatatgtatgtctaaagggctcggcctgataacagatgaaggaaaagttagtgtagaaggagtcaaaacgcacgttcaacatgttgtacacgacgccgataaagtggaaaaaatagtcaaagagtgcgctgtagacgcggccacagtagaagaaacttcggaacatatttggaagtgcttgtacaagaaccacattgtcaacattcattatggccctggacatagccatgaaaatagtagcgaagaaagtggagaacatcatcatggtcatcactaa)所示。所述编码基因以香樟齿喙象的cdna为模版,pcr扩增ptsuobp11基因的orf得到。所述pcr扩增用引物包括核苷酸序列如seq id no:3(5
′‑
atgaaagttttaatagttatttgtg
‑3′
)所示的正向引物和核苷酸序列如seq id no:4(5
′‑
ttagtgatgaccatgatgatgttct
‑3′
)所示的反向引物。所述pcr扩增的反应体系为750ng/μl cdna模板1μl、2
×
primerstar max premix 25μl、10μm正向引物1μl、10μm反向引物1μl,rnase free ddh2o补充至50μl。所述pcr扩增的反应程序为94℃10min;98℃10sec,46℃30sec,72℃60sec;35个循环;72℃2min;4℃保持。
28.本发明提供了一种表达外源基因的重组载体,所述外源基因包括所述编码基因。本发明对所述重组载体的骨架载体没有特殊限制,采用本领域所熟知的表达载体即可,例如ta/blunt
‑
zero载体。所述重组载体的构建优选采用ta/blunt
‑
zero cloning kit完成。
29.本发明提供了所述编码基因或所述重组载体在重组表达源于香樟齿喙象气味结
合蛋白ptsuobp24中的应用。
30.在本发明中,所述香樟齿喙象气味结合蛋白ptsuobp24的重组表达方法,优选将上述技术方案构建的重组载体导入原核表达系统中,经筛选培养和诱导,得到重组表达的香樟齿喙象气味结合蛋白ptsuobp24。
31.基于香樟齿喙象的气味结合蛋白ptsuobp24对寄主植物香樟的挥发性化合物具有特异性结合能力,因此本发明提供了一种香樟齿喙象引诱剂,以与所述ptsuobp24结合的香樟的挥发性化合物为活性成分;所述香樟的挥发性化合物包括以下成分中的一种或几种:樟脑、罗勒烯、桉叶油素、α水芹烯和β石竹烯。当引诱剂的活性成分仅为1种时,所述香樟的挥发性化合物优选为樟脑。所述引诱剂的活性成分仅为2种时,所述香樟的挥发性化合物优选包括樟脑和罗勒烯;所述樟脑和罗勒烯的体积比为(1~10):(1~10),更优选为(2~5):(2~5),最优选为1:1。所述引诱剂的活性成分仅为3种时,所述香樟的挥发性化合物优选包括樟脑、α水芹烯和罗勒烯;所述樟脑、α水芹烯和罗勒烯的体积比为(1~10):(1~10):(1~10),更优选为(2~5):(2~5):(2~5),最优选为1:1:1。所述引诱剂的活性成分仅为4种时,所述香樟的挥发性化合物优选包括樟脑、β石竹烯、α水芹烯和罗勒烯;所述樟脑、β石竹烯、α水芹烯和罗勒烯的体积比为(1~10):(1~10):(1~10):(1~10),更优选为(2~5):(2~5):(2~5):(2~5),最优选为1:1:1:1。所述引诱剂还包括本领域可接受的其他辅料,例如溶剂和诱芯等。本发明对所述引诱剂的制备方法不做特殊限制,采用本领域所熟知的引诱剂的种类即可。
32.本发明提供了所述引诱剂在监测和/或防治香樟齿喙象中的应用。所述引诱剂还优选配合其他引诱装置或试剂进行监测防治香樟齿喙象。
33.下面结合实施例对本发明提供的一种源于香樟齿喙象气味结合蛋白ptsuobp24及监测防治香樟齿喙象引诱剂和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
34.实施例1
35.源于香樟齿喙象的ptsuobp24基因的克隆方法
36.(一)香樟齿喙象的饲养
37.饲养时在饲养盒中间用纱网将香樟齿喙象雌雄成虫隔开,收集同批羽化的雌雄成虫(35日龄,正常取食但均未交配)用于转录组测序。雌雄成虫均分别设置3个独立的生物学重复,每个重复包含6头相同性别的成虫。所有样品同时采集并用75%酒精清洗干净后,立即在液氮中迅速冷冻,置于-80℃下储存或直接进行总rna提取。
38.(二)香樟齿喙象雌雄成虫rna的提取
39.选用trizol(宝生物工程(大连)有限公司takara,japan)法提取香樟齿喙象雌雄成虫的总rna,提取步骤如下:
40.(1)将收集的各样品置于无rna酶的1.5ml ep管中,加入500μl trizol,用研磨棒充分研磨样品;
41.(2)充分研磨后向ep管中再次加入500μl trizol,室温下静置5min;
42.(3)在4℃、12000rpm下离心10min后,将上清液转入新的无rna酶的1.5ml ep管中;
43.(4)往新的ep管中加入200μl氯仿,盖紧离心管后剧烈震荡15sec,室温下静置3min;
44.(5)在4℃、12000rpm下离心15min,此时混合物分为三层,用移液器少量多次取上层的无色水相(rna溶在水相里),转至新的无rna酶的ep管中;
45.(6)加入与步骤(5)所得无色水相等体积的异丙醇,混匀,室温下放置30min,以充分沉淀rna;
46.(7)在4℃、12000rpm下离心10min后,去除上清液;
47.(8)往获得的rna沉淀物种加入1ml 75%乙醇洗涤沉淀,在4℃、5000rpm下离心5min,小心去除上清液;
48.(9)然后重复步骤(8)三次;
49.(10)室温放置晾干5~10min后,加入20μl rnase free ddh2o以充分溶解沉淀,即获得rna溶液,置于-80℃贮存备用;
50.(11)选用nanodrop 2000检测rna样品的浓度与纯度,od
260/280
的值在1.8~2.1之间;用1.5%的琼脂糖凝胶电泳检测是否存在基因组残留或蛋白质污染,以及rna条带的完整性。
51.(三)ptsuobp24基因的克隆
52.根据开放阅读框(open reading frames,orfs)预测网址(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析ptsuobp24基因的orfs,利用primer premier 5.0软件设计ptsuobp24基因的特异性引物,通过pcr扩增其orf;
53.pcr扩增所用的引物如下:
54.f:5
′‑
atgaaagttttaatagttatttgtg
‑3′
(seq id no:3);
55.r:5
′‑
ttagtgatgaccatgatgatgttct
‑3′
(seq id no:4)。
56.反应体系见表1。
57.表1 pcr扩增的反应体系
58.cdna模板1μl(750ng/μl)primerstar max premix(2
×
)25μlprimer1(10μm)1μlprimer2(10μm)1μlrnase free ddh2o补充至50μl
59.轻弹混匀后低速短暂离心将反应液收集至管底,反应程序见表2。
60.表2 pcr扩增的反应程序
[0061][0062]
(4)反应结束后,用琼脂糖凝胶(2%)电泳检测pcr产物的条带与目的基因大小是
no:1所示。
[0087]
(四)ptsuobp24蛋白的生物信息学分析
[0088]
expasy软件表明,ptsuobp24蛋白由153个氨基酸编码;含有16aa组成的信号肽;蛋白质分子质量为15.23kda;等电点为5.97。
[0089]
实施例2
[0090]
ptsuobp24基因在香樟齿喙象雌雄成虫组织的相对表达量
[0091]
(一)香樟齿喙象饲养与样品收集
[0092]
香樟齿喙象的野外采集与饲养同实施例1。饲养时在饲养盒中间用纱网将雌雄成虫隔开,收集同批羽化的雌雄成虫(35日龄,正常取食但均未交配)用于解剖。雌雄成虫均分别设置3个独立的生物学重复,每个重复包含30头相同性别的成虫。所有样品同时采集并均用75%酒精清洗干净后,立即在冰上解剖分别获取触角、头(不含触角)、胸、腹部末端、翅与足等组织,并迅速置于液氮中冷冻,冷冻后立即在-80℃下储存或直接进行总rna提取.
[0093]
(二)各样品的总rna提取
[0094]
方法及步骤同实施例1。
[0095]
(三)qrt
‑
pcr引物设计及其扩增效率计算
[0096]
根据测序验证的ptsuobp24基因的orf,利用在线程序(https://www.ncbi.nlm.nih.gov/tools/primer
‑
blast/)设计ptsuobp24基因的qrt
‑
pcr引物。qrt
‑
pcr扩增引物如下:
[0097]
f:5
′‑
tggtcttctcatggtcgctt
‑3′
(seq id no:5);
[0098]
r:5
′‑
tatcaggccgagccctttag
‑3′
(seq id no:6)。
[0099]
将样品的cdna模板浓度稀释成500ng/μl,再逐次稀释10倍,共稀释4次,最终共得到5个浓度的cdna模板,分别为500ng/μl、500
×
10
‑1(50ng/μl)、500
×
10
‑2(5ng/μl)、500
×
10
‑3(0.5ng/μl)与500
×
10
‑4(0.05ng/μl)。qrt
‑
pcr的反应体系见表4。
[0100]
表4 qrt
‑
pcr的反应体系
[0101]
hieff qpcr sybr green master mix10μlcdna模板2μl引物(f/r)1 1μlrnase free ddh2o6μl
[0102]
低速短暂离心将反应液收集至管底,qrt
‑
pcr的反应程序见表5。
[0103]
表5 qrt
‑
pcr的反应程序
[0104]
[0105]
每个处理包含3个生物学重复并分别进行3次技术重复,扩增标准曲线,得到标准曲线方程的相关系数r2及斜率slope,根据公式i计算引物的扩增效率。
[0106]
扩增效率e=(10
[-1/slope]-1
)
×
100
ꢀꢀꢀ
公式i
[0107]
反应后显示ptsuobp24基因qrt
‑
pcr引物的溶解曲线为单峰,表明该引物具有特异性,不存在引物二聚体。此外,ptsuobp24基因qrt
‑
pcr引物的扩增特征如下表6。
[0108]
表6 ptsuobp24基因qrt
‑
pcr引物的扩增特征
[0109][0110][0111]
引物扩增效率为102.157%,在80%~120%之间,表示引物特异性扩增良好。ptsuobp24基因在雌雄成虫的触角组织中相对表达量最高且显著高于其它组织;在雌雄成虫的足中的相对表达量次之;在雌成虫腹、翅与足中的相对表达量显著高于雄成虫,而在雄成虫的触角中的相对表达量显著高于雌成虫(见图1)。
[0112]
实施例3
[0113]
ptsuobp24的原核表达与纯化
[0114]
(一)基于同源重组原理的原核表达载体构建
[0115]
(1)将ptsuobp24基因的信号肽序列(seq id no:9:atgaaagttttaatagttatttgtggtcttctcatggtcgctttggca)去除,根据不含信号肽的序列及原核表达载体pet28a( )的序列利用引物设计软件ce design(http://www.vazyme.com,诺唯赞官网)设计含有线性化载体两端的同源序列目的片段引物;构建原核表达载体的ptsuobp24基因扩增引物如下:
[0116]
f:5
′‑
cgcggatccgaattcgagctcagtgatccacatggtatcaaacca
‑3′
(seq id no:7);
[0117]
r:5
′‑
tggtggtgctcgagtgcggccgcttagtgatgaccatgatgatgttctc
‑3′
(seq id no:8)。
[0118]
(2)用两个限制性内切酶对表达载体pet28a( )进行双酶切,使pet28a( )线性化,pcr的反应体系见表7。
[0119]
表7 pcr的反应体
[0120]
10
×
quickcut buffer5μl限制性内切酶ⅰ1μlpet28a( )质粒<1μgrnase free ddh2oup to 50μl
[0121]
(3)轻弹混匀后低速短暂离心将反应液收集至管底,pcr仪中37℃孵育15min;
[0122]
(4)结束后加入1μl限制性内切酶ⅱ,pcr仪中37℃再孵育15min;
[0123]
(5)选用1.5%琼脂糖凝胶电泳检测产物,将目的条带切胶回收纯化;
[0124]
(6)以克隆质粒为模板,选用高保真酶与含同源序列目的片段引物进行pcr扩增、产物切胶回收纯化、载体连接与测序;
[0125]
(7)重组反应:在冰上配制重组反应体系见表8。
[0126]
表8 重组反应体系
[0127]5×
ceⅱ缓冲液2μl线性化片段80ng线性化载体100ngexnaseⅱ1μlrnase free ddh2o补充至o10μl
[0128]
轻弹混匀后低速短暂离心将反应液收集至管底,pcr仪中37℃孵育30min;
[0129]
(8)重组产物转化:选用dh5α克隆重组质粒ptsuobp24/pet28a( ),并选用m13f/r验证阳性克隆,最后测序验证;
[0130]
(9)阳性克隆质粒提取及转化:
[0131]
①
分别取过夜摇培的菌液10ml,在12000rpm下离心1min,去除培养基;
[0132]
②
分别加入solutionⅰ500μl充分重悬菌体,再加入solutionⅱ500μl,迅速颠倒充分混匀至透明蛋清状,最后加入solutionⅲ700μl,充分混匀,室温静置5min,在12000rpm下离心10min;
[0133]
③
分别将上清液分数次加入质粒提取专用吸附管(吸附柱已作平衡处理)中,在12000rpm下离心1min,去除收集管中的废液,重复此步骤至废液去除彻底;
[0134]
④
向管中加入solution w1 500μl,在12 000rpm下离心1min,去除收集管中的废液;
[0135]
⑤
向管中加入wash solution 600μl,在12 000rpm下离心1min,去除收集管中的废液,重复此步骤至废液去除彻底;
[0136]
⑥
在12000rpm下离心2min,将吸附管转至新的1.5ml ep管中,室温下晾置10min;
[0137]
⑦
向吸附管中的膜中间滴加rnase free ddh2o 100μl,室温下放置2min,在12000rpm下离心2min,获得纯化的质粒;
[0138]
⑧
琼脂糖凝胶(1.5%)电泳与nano drop 2000检测质粒的纯度及浓度,
[0139]
⑨
将阳性克隆质粒转入表达载体bl21(de3),热激时间延长为90sec,固体培养基为kana抗性,挑取阳性菌斑摇培,划线纯化后取单克隆再次摇培5h,菌液pcr检测后,送测序验证并保留菌种备用。
[0140]
(二)重组质粒诱导表达
[0141]
重组质粒诱导表达:将保留的ptsuobp24甘油菌活化后,按1:100的比例将甘油菌接入1l液体lb培养基中(含kana),
[0142]
①
选用终浓度为0.6mm的异丙基
‑
β
‑
d
‑
硫代半乳糖昔(isopropy
‑
β
‑
d
‑
thiogalactoside,iptg),在20℃的温度条件下进行诱导;
[0143]
②
其他相同条件与步骤为:在150rpm的转速下培养至od值为0.6~0.8之间,分别加入iptg,继续诱导培养12h。在12000rpm、4℃条件下离心15min,收集菌体,分别加入100ml缓冲液(50mm pb,300mm nacl,20mm咪唑,ph=7.4)重悬菌体,同时加入蛋白酶抑制剂pmsf至终浓度1mm,冰浴条件下对重悬液进行超声破碎(破碎循环条件为:超声破碎3sec,停5sec),在12000rpm下离心30min,分别收集上清备用。分别取上清各20μl,分别加入5μl的loading buffer混匀后于100℃条件下水浴10min,短暂离心收集至管底,用12.5%的聚丙
烯酰胺凝胶电泳(sds
‑
page,100v,120min)结合考马斯亮蓝法染色脱色法检测蛋白表达情况。
[0144]
(三)关键ptsuobp24重组蛋白的纯化
[0145]
①
超声破碎后的上清液均过0.2μm孔径的滤膜;
[0146]
②
重悬液平衡镍离子树脂重力柱(1ml ni /柱)备用;
[0147]
③
经滤膜过滤后的上清液逐次过重力柱(2遍);
[0148]
④
选用6ml
×
4wash buffer(50mm pb,300mm nacl,80mm咪唑,ph=7.4)洗脱目的蛋白上清液中的杂蛋白;
[0149]
⑤
分别用300μl
×
5elution buffer(300mm nacl,300mm咪唑,50mm pb,10%甘油,1mm pmsf,ph=7.4)洗脱收集目的蛋白;
[0150]
⑥
将收集的目的蛋白分别装入透析袋中,分别用透析液ⅰ(200mm nacl,200mm咪唑,40mm pb,ph=7.4)于4℃条件下对各目的蛋白透析16h;再用透析液ⅱ(100mm nacl,100mm咪唑,20mm pb,ph=7.4)对各目的蛋白于相同条件下再透析16h;最后转入纯水中再透析16h;
[0151]
⑦
于-80℃中冷冻透析后的目的蛋白4h,再转至冷冻干燥仪中冷冻干燥目的蛋白至蛋白完全干燥成粉末状;
[0152]
⑧
用rnase free ddh2o溶解干燥后的目的蛋白;
[0153]
⑨
用sds
‑
page(100v,120min)检测纯化后的目的蛋白溶液,并保存于-80℃条件下备用。
[0154]
ptsuobp24的纯化结果如图2所示,纯化收集获得的ptsuobp24,可用于开展气味结合蛋白的功能验证。
[0155]
实施例4
[0156]
ptsuobp24的功能验证
[0157]
目的蛋白的荧光竞争性结合实验,步骤如下:
[0158]
(一)蛋白溶液与配体气味分子溶液的配制:选用50mm tris
‑
hcl缓冲液(ph=7.4)将ptsuobp24的蛋白冻干粉溶解,nanodrop 1 000核酸蛋白定量仪测定蛋白的浓度。选用色谱级甲醇溶解荧光探针n
‑
苯基
‑1‑
萘胺(n
‑
phenyl
‑
l
‑
naphthylamine,1
‑
npn)与寄主植物香樟挥发物(樟脑、罗勒烯、右旋龙脑、芳樟醇、桉叶油素、3
‑
蒈烯、反式
‑
橙花叔醇、α水芹烯与β石竹烯)等配体气味分子,配成10mm的母液存于-20℃备用,实验时再用甲醇将母液稀释成1mm的工作液。
[0159]
(二)荧光探针1
‑
npn的适合性测定:荧光探针1
‑
npn的激发波长为337nm,向96黑色微孔板的微孔中分别加入适量20mm tris
‑
hcl(ph=7.4)缓冲液(反应体系总体积250μl),再分别加入荧光探针1
‑
npn,使其终浓度也为2μm,选用扫描法(spectrum)在em=400~500nm波长范围条件下进行扫描测定,发现460nm波长处存在荧光发射峰,依据目的蛋白ptsuobp24的浓度计算加入量,使目的蛋白ptsuobp24的终浓度为2μm,室温下反应2min使目的蛋白与1
‑
npn充分结合,在相同实验条件下检测反应体系的荧光发射峰是否发生明显的蓝移且荧光强度是否显著上升。否则,需选用其他种类探针再测试。随后向2μm的目的蛋白溶液中逐次加入1
‑
npn至终浓度分别为2μm、4μm、6μm、8μm、10μm、12μm、14μm、16μm、18μm和20μm,室温下分别反应2min,分别记录荧光值,目的蛋白ptsuobp24分别设置3个技术重复。实
验参数条件为:激发光(ex)为337nm,吸收光(em)为1
‑
npn与ptsuobp24结合光谱蓝移后的最大荧光发射峰所对应的取值。根据ptsuobp24的荧光值与荧光探针1
‑
npn的浓度拟合作图并计算结合常数。同时选用scatchard法线性化曲线,横坐标为结合配体1
‑
npn的浓度,纵坐标为结合配体1
‑
npn的浓度和自由配体1
‑
npn浓度的比值。以此检测荧光探针1
‑
npn是否适用于ptsuobp24的荧光竟争性结合实验。若ptsuobp24与荧光探针1
‑
npn的结合存在饱和效应且存在显著的scatchard线性化关系,表明目的蛋白ptsuobp24与荧光探针1
‑
npn之间存在单一的结合位点且不存在别构效应的影响,荧光探针1
‑
npn适用于后续的荧光竞争性结合实验。
[0160]
(三)配体气味分子的竞争结合实验:在96黑色微孔板的微孔中分别加入适量20mm tris
‑
hcl(ph=7.4)缓冲液(反应体系总体积250μl),依据目的蛋白ptsuobp24的浓度计算加入量,使ptsuobp24的终浓度为2μm,再分别加入1
‑
npn,使其终浓度也为2μm,室温下分别反应2min,在337nm激发光与最大发射峰波长条件下,利用终点法(endpoint)测定并分别记录荧光值(初始荧光值)。随后分别向反应体系中逐次加入终浓度为2μm、4μm、6μm、8μm、12μm、16μm与20μm的寄主香樟挥发物,室温下分别反应2min,在337nm激发光与最大发射峰波长条件下,利用终点法(endpoint)测定并分别记录荧光值。
[0161]
(四)数据分析:选用graphpad prism 7.0对ptsuobp24结合荧光探针1
‑
npn的最大发射峰处的荧光值与荧光探针1
‑
npn的浓度拟合作图,并选用scatchard法线性化该曲线(y=bound/free,x=bound)并获得曲线的回归方程,再利用scatchard方程计算结合常数(bingding constant,k1‑
npn
)。计算各种配体气味分子的ic
50
值,即荧光值降至ptsuobp24结合荧光探针1
‑
npn的初始荧光值的一半时配体气味分子的浓度。最后利用公式计算获得各种配体气味分子的解离常数(dissociation constant,ki)。
[0162]
ki=[ic
50
]/(1 [1
‑
npn]/k1‑
npn
)
ꢀꢀꢀꢀ
公式ii
[0163]
式中,ic
50
(halfmaximal inhibitoryconcentration)为荧光强度下降一半时的配体气味分子浓度;[1
‑
npn]为未结合的荧光探针1
‑
npn浓度。
[0164]
结果如下:
[0165]
(1)ptsuobp24与1
‑
npn的结合特性
[0166]
由图3可知,ptsuobp24气味结合蛋白与荧光探针1
‑
npn之间存在显著的线性化关系且回归方程的r2=0.92,结果表明,ptsuobp24与1
‑
npn的荧光值随1
‑
npn浓度的增加均存在饱和效应,同时表明ptsuobp24具有单一的结合位点,可用于荧光竞争性结合力测定。此外,ptsuobp24与1
‑
npn的结合常数k1‑
npn
=8.40
±
0.85。
[0167]
(2)ptsuobp24与气味配体的结合特性
[0168]
植物挥发物的结合力判断标准:ki<10μm表示结合力强;10μm<ki<20μm表示结合力弱;ki>20μm表示不结合。
[0169]
ptsuobp24与香樟挥发物的结合亲和力如表9所示。
[0170]
表9 ptsuobp24与香樟挥发物的结合亲和力结果
[0171][0172][0173]
注:r.f.(relative fluorescense)表示在最大配基浓度时的相对荧光百分数。
[0174]
如图4与表9所示,在9种寄主香樟的挥发性信息化合物中,(1)ptsuobp24对樟脑(ki=10.28μm)、罗勒烯(ki=13.31μm)、桉叶油素(ki=18.72μm)、α水芹烯(ki=13.53μm)与β石竹烯(ki=14.95μm)的结合力弱;(2)ptsuobp24对右旋龙脑、芳樟醇、3蒈烯与反式橙花叔醇不结合。
[0175]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。