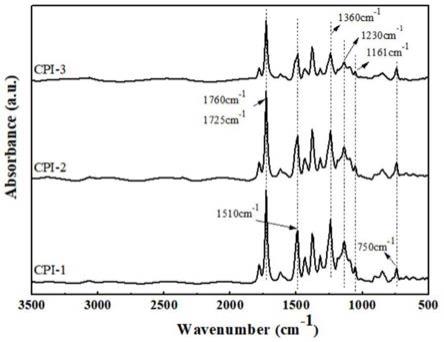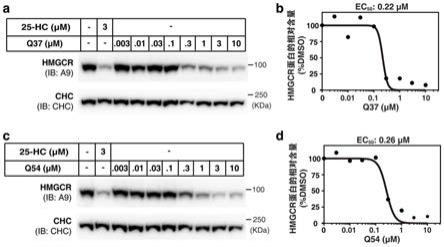
1.本发明属于医药及其制备和应用技术领域,具体涉及一种胆酸衍生物及其制备方法和在抗动脉粥样硬化及抗非酒精性脂肪性肝炎方面的应用。
背景技术:
2.心血管疾病是目前发病率非常高的一类疾病。血液中的胆固醇含量过高,尤其是低密度脂蛋白过高,是其最主要的发病因素之一。目前主流的用于降低高胆固醇的药物主要是他汀类药物包括:阿托伐他汀(atorvastatin)、辛伐他汀(simvastatin)、洛伐他汀(lovastatin)、普伐他汀(pravastatin)、氟伐他汀(fluvastatin)和瑞舒伐他汀(rosuvastatin)等。他汀类药物的作用机制,主要是其结构模拟了hmg-coa,因此可以竞争性的结合hmg-coa的还原酶(hmgcr),进而抑制hmg-coa转化为甲羟戊酸,也就限制了胆固醇在体内的生物合成。
3.他汀类药物的安全性越来越受到人们的关注,最为严重的常见副作用是肝脏损害和肌肉毒性(肌肉痛、肌炎及横纹肌溶解等),其它表现包括胃肠不适、头痛、睡眠障碍、周围神经病变等。特别是长期服用他汀类药物后,使得hmgcr蛋白代偿性增多,因此患者不得不通过提高药物剂量来抑制细胞内增多的hmgcr,该效应严重削弱了他汀的疗效和增加了副作用。尽管他汀类药物的该缺点从开始在临床使用时就被认识到,但到目前为止仍没有方法阻止他汀诱导的hmgcr累积及其副作用。针对hmgcr蛋白泛素化降解,我们实验室首次设计、合成了第一代类石胆酸系列衍生物,从中筛选并获得了一些结构新颖的活性小分子化合物。其中代表性化合物hmg499,其促hmgcr蛋白泛素化降解活性为ec
50
=0.41μm。该化合物不仅在细胞水平能显著促进hmgcr蛋白的泛素化降解,减少他汀诱导的hmgcr蛋白积累,有效抑制胆固醇的生成;而且在动物水平也表现出明显的降脂、降胆固醇效果。该研究工作于2018年12月发表在国际权威期刊《自然通讯》(nature communications,2018,9,5138)上,通过后续研究我们发现文章中涉及的第一代化合物虽然能显著促进hmgcr蛋白的泛素化降解,减少他汀诱导的hmgcr蛋白积累,并在小鼠体内有效抑制胆固醇的合成,减少动脉粥样硬化斑块的产生,但该第一代化合物还会导致胆固醇在细胞内堆积(如图1所示)。
4.胆固醇堆积会影响神经细胞的存活,从而引发严重的神经退行性疾病,如c型尼曼-匹克病;此外细胞内胆固醇堆积还会导致脂类物质在肝脏、肾脏、脾脏和脑部的过量积累,造成这些器官发生病变,并可能致死。如何解决该类化合物引起的胆固醇堆积问题,成为该类化合物新药研发进程中的关键。
5.
技术实现要素:
6.本发明在保留第一代类石胆酸系列衍生物优良活性的基础上,进一步对化合物的结构改造,获得了完全不产生胆固醇堆积的一系列化合物,对该类新药的研发具有重要意义。
7.本发明提供了一种胆酸衍生物,其结构如式(i)所示:
[0008][0009]
其中,n选自自然数,
[0010]
r1选自各种杂环及取代杂环。
[0011]
r2选自氢、羟基、羰基、卤素、烷基。
[0012]
r3选自醇、羧基、酰胺。
[0013]
c5、c6连接键为单键或双键。
[0014]
优选地,
[0015]
所述自然数n选自0,1,2,3,4。
[0016]
r1包括吡嗪环、吡唑环及取代吡唑环、取代噻唑环、1,2,3-噁二唑环、2-氨基嘧啶环、异噁唑环及取代异噁唑环;
[0017]
所述吡嗪环为
[0018]
所述吡唑环为
[0019]
所述取代吡唑环包括n-乙酰基吡唑n-丙酰基吡唑n-丁酰基吡唑
n-异丁酰基吡唑n-甲基丙烯酰基吡唑1-苯基吡唑环1-(2-氟)苯基吡唑环
[0020]
优选地,所述取代吡唑环为n-乙酰基吡唑n-异丁酰基吡唑
[0021]
进一步优选地,所述取代吡唑环为n-乙酰基吡唑
[0022]
所述取代噻唑环包括2-甲基噻唑环2-胺基噻唑环
[0023]
所述1,2,3-噁二唑环为
[0024]
所述2-氨基嘧啶环为
[0025]
所述异噁唑环为
[0026]
所述取代异噁唑环为
[0027]
所述r2的羟基为α或β构型,优选β构型氢为
[0028]
所述r3选自叔醇、羧基、酰胺;
[0029]
所述叔醇包括二乙基叔醇二烯丙基叔醇二甲基叔醇二正丙基叔醇异丙基叔醇二正丁基叔醇二异丙基叔醇二炔丙基叔醇二苯基叔醇二苄基叔醇
[0030]
优选地,所述叔醇包括二乙基叔醇二烯丙基叔醇
[0031]
所述羧基为
[0032]
所述酰胺包括甲酰胺乙酰胺正丙酰胺2-甲基苯酰胺对甲基苯酰胺5-硝基噻唑酰胺n-3-吡啶酰胺哌啶酰胺吗啉酰胺n-boc-4-哌啶酰胺n-乙酰基-4-哌啶酰胺六氢吡喃-4-酰胺吗啉-2-乙基酰胺
[0033]
本发明还提供了一种胆酸衍生物,其结构如式q27所示:
[0034][0035]
本发明还提供了一种胆酸衍生物,其结构如式q63所示:
[0036][0037]
本发明还提出了一种胆酸衍生物的制备方法,以式q1所示的胆酸衍生物为起始原料,经tbs保护、4,4-二甲基化、脱tbs保护、氧化、witting反应、还原得到化合物q7;然后以化合物q5为起始原料,经氧化、酯化得到化合物q9;或以化合物q4为起始原料,经碘代、氰基取代、水解、酯化分别得到化合物q13;所述制备方法如路线(1)所示:
[0038][0039]
具体地,所述方法包含以下步骤:
[0040]
(a)tbs保护反应
[0041]
将化合物q1溶于有机溶剂中,低温加入tbs保护所用的试剂及碱,tbs保护反应得到化合物q2。
[0042]
步骤(a)中,所述有机溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二氯甲烷、三氯甲烷、四氯化碳等中任意一种或多种;优选地,为n,n-二甲基甲酰胺。
[0043]
步骤(a)中,所述碱选自三乙胺、咪唑、二异丙基乙基胺等中任意一种或多种;优选地,为咪唑。
[0044]
步骤(a)中,所述化合物q1与碱的摩尔比为1:(2~20);优选地,为1:8。
[0045]
步骤(a)中,所述tbs保护所用试剂选自叔丁基二甲基氯化硅(tbscl)、叔丁基二甲硅基三氟甲磺酸酯(tbsotf)等中任意一种或多种;优选地,为tbscl。
[0046]
步骤(a)中,所述化合物q1与tbs保护所用的试剂的摩尔比选自1:(1~10);优选地,为1:4。
[0047]
步骤(a)中,所述低温为-10~10℃;优选地,为0℃。
[0048]
步骤(a)中,所述tbs保护反应的温度为25~70℃;优选地,为25℃。
[0049]
步骤(a)中,所述tbs保护反应的时间为2~12h;优选地,为5h。
[0050]
(b)4,4-二甲基化反应
[0051]
将化合物q2溶于有机溶剂中,加入碱及甲基化试剂,甲基化反应得到化合物q3。
[0052]
步骤(b)中,所述有机溶剂选自t-buoh、苯、四氯化碳、四氢呋喃等中任意的一种或多种;优选地,为t-buoh。
[0053]
步骤(b)中,所述碱选自t-buok、koc(et)me2等中任意的一种或多种,优选的,为t-buok。
[0054]
步骤(b)中,所述甲基化试剂为ch3cl、ch3br、ch3i等中任意的一种或多种;优选地,为ch3i。
[0055]
步骤(b)中,所述化合物q2与碱的摩尔比为1:(2~8);优选地,为1:4。
[0056]
步骤(b)中,所述化合物q2与甲基化试剂的摩尔比为1:(2~10);优选地,为1:8。
[0057]
步骤(b)中,所述甲基化试剂最优加入方法为缓慢滴入。
[0058]
步骤(b)中,所述碱为分批加入。
[0059]
步骤(b)中,所述加入甲基化试剂期间反应的温度为0℃。
[0060]
步骤(b)中,所述甲基化反应的温度为0~60℃,优选地,为25℃。
[0061]
步骤(b)中,所述甲基化反应的时间为2~12h;优选地,为4h。
[0062]
(c)脱tbs保护反应
[0063]
将化合物q3溶于有机溶剂中,加入脱保护所需的酸,反应得到化合物q4。
[0064]
步骤(c)中,所述有机溶剂为乙醚、四氢呋喃、乙酸乙酯、甲醇、乙醇等任意一种或多种;优选地,为乙醚。
[0065]
步骤(c)中,所述酸为对甲苯磺酸、盐酸气、硫酸、盐酸溶液等任意一种或多种;优选地,为盐酸气。
[0066]
步骤(c)中,所述脱tbs保护反应的时间为1~5h;优选地,为2h。
[0067]
步骤(c)中,所述脱tbs保护反应的温度为25~60℃;优选地,为25℃
[0068]
(d)氧化反应
[0069]
将化合物q4溶于有机溶剂中,加入氧化剂,反应得到化合物q5。
[0070]
步骤(d)中,所述有机溶剂选自甲苯、四氢呋喃、二氯甲烷等中任意的一种或多种;优选地,为二氯甲烷。
[0071]
步骤(d)中,所述氧化剂为pdc、ddq、pcc、ibx等中任意的一种或多种;优选地,为pdc。
[0072]
步骤(d)中,所述化合物q4与氧化剂的摩尔比为1:(1~3);优选地,为1:1.5。
[0073]
步骤(d)中,所述氧化反应的温度为20~35℃;优选地,为25℃。
[0074]
步骤(d)中,所述氧化反应的时间为7~10h;优选地,为8h。
[0075]
(e)witting反应
[0076]
将碱溶于有机溶剂中,分别加入witting试剂、化合物q5,反应得到化合物q6。
[0077]
步骤(e)中,所述有机溶剂选自四氢呋喃、甲苯、石油醚、苯等中任意的一种或多种;优选地,为四氢呋喃。
[0078]
步骤(e)中,所述碱为甲醇钠、乙醇钠、氢化钠(60%)中的一种或多种;优选地,为氢化钠(60%)。
[0079]
步骤(e)中,所述witting试剂优选为磷酰基乙酸三乙酯。
[0080]
步骤(e)中,所述化合物q5与碱、witting试剂的摩尔比为1:(3~8):(3~8);优选地,为1:4.5:5。
[0081]
步骤(e)中,所述witting试剂的加入方式为滴加,滴加时间为5~30min;优选地,为10min。
[0082]
步骤(e)中,所述witting反应的温度为25~75℃;优选地,为25℃。
[0083]
步骤(e)中,所述witting反应的时间为1~3h;优选地,为1h。
[0084]
(f)还原反应
[0085]
将化合物q6溶于有机溶剂中,加入还原剂,得到化合物中间体,然后再加入氧化剂,氧化得到化合物q7。
[0086]
步骤(f)中,所述还原反应的有机溶剂优选为干燥过的无水甲醇。
[0087]
步骤(f)中,所述还原反应所用的还原剂优选为镁屑。
[0088]
步骤(f)中,所述化合物q6与还原剂的摩尔比为1:(2~10);优选地,为1:10。
[0089]
步骤(f)中,所述还原反应的温度为25~60℃;优选地,为25℃。
[0090]
步骤(f)中,所述得到中间体反应的时间为3~8h;优选地,为5h。
[0091]
步骤(f)中,所述氧化反应的有机溶剂选自甲苯、四氢呋喃、dmso等中任意的一种或多种;优选地,为dmso与甲苯混合溶剂。
[0092]
步骤(f)中,所述氧化剂的作用为氧化c-3位少量被还原的羟基。
[0093]
步骤(f)中,所述氧化剂选自ibx、pdc、pcc、ddq等中的任意的一种或多种;优选地,为ibx。
[0094]
步骤(f)中,所述化合物q6与氧化剂的摩尔比为1:(0.5~3);优选地,为1:1。
[0095]
步骤(f)中,所述氧化反应的温度为25~60℃;优选地,为25℃。
[0096]
步骤(f)中,所述氧化反应的时间为2~8h;优选的,为4h。
[0097]
(g)氧化反应
[0098]
将化合物q5溶于有机溶剂,低温加入氧化剂,反应得到化合物q8。
[0099]
步骤(g)中,所述氧化反应的有机溶剂选自吡啶、三氯甲烷、二氯乙烷、1,2-二氯丙烷等中任意的一种或多种;优选地,为吡啶。
[0100]
步骤(g)中,所述加入氧化剂时反应液的温度为0~10℃;优选地,为0℃。
[0101]
步骤(g)中,所述氧化剂选自四丁基高锰酸铵、高锰酸钾、重铬酸钾、o3等中任意的一种或多种;优选地,为四丁基高锰酸铵。
[0102]
步骤(g)中,所述q5与氧化剂的摩尔比为1:(1~4);优选地,为1:2。
[0103]
步骤(g)中,所述氧化反应的温度为0~60℃;优选地,为25℃。
[0104]
步骤(g)中,所述氧化反应的时间为1~2h;优选地,为1h。
[0105]
(h)酯化反应
[0106]
将化合物q8溶于有机溶剂中,加入酸进行酯化反应,得到化合物q9。
[0107]
步骤(h)中,所述有机溶剂选自甲醇、四氢呋喃和甲醇的混合溶剂等中任意的一种或多种;优选地,为甲醇。
[0108]
步骤(h)中,所述酯化反应中酸选自浓硫酸、对甲苯磺酸、二氯亚砜等中任意的一种或多种;优选地,为浓硫酸。
[0109]
步骤(h)中,所述化合物q8与酸的摩尔比为1:(0.5~2);优选地,为1:0.7。
[0110]
步骤(h)中,所述酯化反应的温度为25~70℃;优选地,为70℃。
[0111]
步骤(h)中,所述酯化反应的时间为2~12h;优选地,为2h。
[0112]
(i)碘代反应
[0113]
将碘代试剂、催化剂和缚酸剂溶于有机溶剂,搅拌一段时间,然后加入化合物q4,反应得到化合物q10。
[0114]
步骤(i)中,所述有机溶剂选自甲苯、二氯甲烷、苯等中的一种或多种;优选地,为甲苯。
[0115]
步骤(i)中,所述碘代试剂选自i2、n-碘代丁二酰亚胺等中任意的一种或多种;优选地,为i2。
[0116]
步骤(i)中,所述碘代反应中催化剂和缚酸剂分别为pph3和咪唑。
[0117]
步骤(i)中,所述化合物q4与碘代试剂、催化剂和缚酸剂的摩尔比例为1:(3~8):(3~8):(6~16);优选地,为1:7:7.3:14。
[0118]
步骤(i)中,所述碘代反应加入化合物q4前反应温度为25~60℃;优选地,为25℃。
[0119]
步骤(i)中,所述碘代反应加入化合物q4前反应时间为0.5h~3h;优选地,为1h。
[0120]
步骤(i)中,所述碘代反应加入化合物q4后反应温度为25~60℃;优选地,为25℃。
[0121]
步骤(i)中,所述碘代反应加入化合物q4后反应时间为1~2h;优选地,为2h。
[0122]
(j)氰基取代反应
[0123]
将化合物q10溶于有机溶剂中,加入碱、氰代试剂,反应得到化合物q11。
[0124]
步骤(j)中,所述有机溶剂选自dmf、四氢呋喃、dmso、甲苯等中的一种或多种;优选地,为dmf。
[0125]
步骤(j)中,所述碱选自氢氧化钠、氢氧化钾、氟化钾、氟化钠、乙酸钾、乙酸钠等中的一种或多种;优选地,为氟化钾。
[0126]
步骤(j)中,所述氰代试剂选自氰化钠、三甲基硅氰等中的一种或多种;优选地,为三甲基硅氰。
[0127]
步骤(j)中,所述化合物q10与碱、氰代试剂的摩尔比为1:(2~20):(2~10);优选地,为1:16:8。
[0128]
步骤(j)中,所述氰取反应的温度为40~80℃;优选地,为50℃。
[0129]
步骤(j)中,所述氰取反应的时间为2~12h;优选地,为4h。
[0130]
(k)水解反应
[0131]
将化合物q11溶于有机溶剂中,加入碱,水解得到化合物q12。
[0132]
步骤(k)中,所述有机溶剂选自甲醇、四氢呋喃、乙醇、水与乙醇混合溶剂、水与甲醇混合溶剂等中任意的一种或多种;优选地,为水与乙醇混合溶剂。
[0133]
步骤(k)中,所述水与乙醇混合溶剂的体积比为1:(1~3);优选地,为1:3。
[0134]
步骤(k)中,所述碱选自氢氧化锂、氢氧化钠、氢氧化钾、碳酸钾等中任意的一种或多种;优选地,为氢氧化钠。
[0135]
步骤(k)中,所述化合物q11与碱的摩尔比为1:(1~10);优选地,为1:10。
[0136]
步骤(k)中,所述水解反应的温度为70~120℃;优选地,为100℃。
[0137]
步骤(k)中,所述水解反应的时间为24~72h;优选地,为72h。
[0138]
(l)酯化反应
[0139]
化合物q13的合成类似于路线(1)中化合物q9的酯化方法。
[0140]
本发明还提出了一种胆酸衍生物的制备方法,以化合物q7为起始原料,经乙二醇
保护、还原、碘代、氰基取代、水解、酯化得到q19,所述制备方法如路线(2)所示:
[0141][0142]
具体地,所述方法包含以下步骤:
[0143]
(a)乙二醇保护反应
[0144]
将化合物q7溶于有机溶剂,加入催化剂、脱水剂、乙二醇,反应得到化合物q14。
[0145]
步骤(a)中,所述有机溶剂选自四氢呋喃、四氢呋喃与乙二醇混合溶液;优选地,为四氢呋喃与乙二醇混合溶液。
[0146]
步骤(a)中,所述四氢呋喃与乙二醇体积比为3:(1~3);优选地,为3:1。
[0147]
步骤(a)中,所述催化剂优选为对甲苯磺酸。
[0148]
步骤(a)中,所述脱水剂选自原甲酸三乙酯、原甲酸三甲酯;优选地,为原甲酸三乙酯。
[0149]
步骤(a)中,所述化合物q7与催化剂、脱水剂的摩尔比为1:(0.2~0.5):(5~10);优选地,为1:0.2:5。
[0150]
步骤(a)中,所述乙二醇保护反应的时间为2~12h;优选地,为3h。
[0151]
步骤(a)中,所述乙二醇保护反应的温度为25~60℃;优选地,为25℃。
[0152]
(b)还原反应
[0153]
将化合物q14溶于有机溶剂中,加入还原剂,反应得到化合物q15。
[0154]
步骤(b)中,所述有机溶剂选自四氢呋喃、乙醚、甲醇、乙醇等中任意的一种或多种;优选地,为四氢呋喃。
[0155]
步骤(b)中,所述还原剂为lialh4、nabh4、红铝、二异丁基氢化铝等中任意的一种或多种;优选地,为lialh4。
[0156]
步骤(b)中,所述还原剂优选分批加入。
[0157]
步骤(b)中,所述化合物q14与还原剂的摩尔比为1:(2~20);优选地,为2:10。
[0158]
步骤(b)中,所述还原反应的温度为-10~10℃;优选地,为0℃。
[0159]
步骤(b)中,所述还原反应的时间为1~5h;优选地,为2h。
[0160]
(c)碘代反应
[0161]
化合物q16的合成类似于路线(1)中化合物q10的碘代方法。
[0162]
(d)氰基取代反应
[0163]
化合物q17的合成类似于路线(1)中化合物q11的取代方法。
[0164]
(e)水解反应
[0165]
化合物q18的合成类似于路线(1)中化合物q12的水解方法。
[0166]
(f)酯化反应
[0167]
化合物q19的合成类似于路线(1)中化合物q9的酯化方法。
[0168]
本发明还提出了一种胆酸衍生物的制备方法,以化合物q15为原料,经氧化、witting反应、脱乙二醇保护、还原得到q23,所述制备方法如路线(3)所示:
[0169][0170]
具体地,所述方法包含以下步骤:
[0171]
(a)氧化反应
[0172]
将化合物q15溶于有机溶剂中,加入氧化剂,反应得到化合物q20。
[0173]
步骤(a)中,所述有机溶剂选自dmso、甲苯、四氢呋喃、dmso与甲苯混合溶液等中任意的一种或多种;优选地,为dmso与甲苯混合溶液。
[0174]
步骤(a)中,所述氧化剂选自ibx、ddq、pcc、pdc等中任意的一种或多种;优选地,为ibx。
[0175]
步骤(a)中,所述化合物q15与氧化剂的摩尔比为1:(1~3);优选地,为1:1.5。
[0176]
步骤(a)中,所述氧化反应的温度为20~35℃;优选地,为25℃。
[0177]
步骤(a)中,所述氧化反应的时间为7~10h;优选地,为8h。
[0178]
(b)witting反应
[0179]
化合物q21的合成类似于路线(1)中化合物q6的合成反应方法。
[0180]
(c)乙二醇脱保护反应
[0181]
将化合物q21溶于有机溶剂中,加入酸,反应得到化合物q22。
[0182]
步骤(c)中,所述有机溶剂选自甲醇、乙醇、四氢呋喃、甲醇与水混合溶剂、乙醇与水混合溶剂、四氢呋喃与水混合溶剂等中的一种或多种;优选地,为甲醇与水混合溶剂。
[0183]
步骤(c)中,所述酸选自稀硫酸、2m稀盐酸、盐酸气、对甲苯磺酸等中的一种或多
种;优选地,为2m稀盐酸水溶液。
[0184]
步骤(c)中,所述反应溶剂与2m稀盐酸的体积比为5:(1~2);优选地,为5:1。
[0185]
步骤(c)中,所述反应的时间为1~5h;优选地,为2h。
[0186]
步骤(c)中,所述反应的温度为0~60℃;优选地,为25℃。
[0187]
(d)还原反应
[0188]
化合物q23的合成类似于路线(1)中化合物q7的还原反应方法。
[0189]
本发明还提出了一种胆酸衍生物的制备方法,以化合物q7为起始原料,经缩合、加成环化、水解、乙酰化得到化合物q27;然后以化合物q27为起始原料,与胺类化合物缩合,得到如式q28-q39所示的胆酸衍生物;并以化合物q25为起始原料,与格氏试剂发生格氏反应得到胆酸衍生物q56;所述制备方法如路线(4)所示:
[0190][0191]
具体地,所述方法包含以下步骤:
[0192]
(a)缩合反应
[0193]
将化合物q7溶于有机溶剂中,加入缩合剂,反应得到化合物q24。
[0194]
步骤(a)中,所述缩合反应优选在氮气保护下进行。
[0195]
步骤(a)中,所述有机溶剂选自四氢呋喃、甲酸乙酯和四氢呋喃与甲酸乙酯的混合溶剂;优选地,为甲酸乙酯。
[0196]
步骤(a)中,所述缩合剂选自氢化钠(60%)、甲醇钠、乙醇钠等中的一种或多种;优选地,为氢化钠(60%)。
[0197]
步骤(a)中,所述化合物q7与氢化钠的摩尔比为1:(5~10);优选地,为1:10。
[0198]
步骤(a)中,所述缩合反应的温度为25~45℃;优选地,为25℃。
[0199]
步骤(a)中,所述缩合反应的时间为20~60min;优选地,为20min。
[0200]
(b)加成环化反应
[0201]
将化合物q24溶于有机溶剂中,加入水合肼、碱,反应得到化合物q25。
[0202]
步骤(b)中,所述有机溶剂选自乙醇、乙醇与水混合溶剂、乙酸中的一种或多种;优选地,为乙酸。
[0203]
步骤(b)中,所述加成环化反应所用碱选自乙酸钠、乙酸钾、乙醇钠、乙醇钾中的一种或多种;优选地,为乙酸钾。
[0204]
步骤(b)中,所述加成环化反应化合物q24、水合肼及碱的摩尔比为1:(1~3):(1~2);优选地,为1:3:2。
[0205]
步骤(b)中,所述加成环化反应的温度为80~140℃;优选地,为130℃。
[0206]
步骤(b)中,所述加成环化反应的时间为3~10h;优选地,为5h。
[0207]
(c)水解反应
[0208]
将化合物q25溶于有机溶剂中,加入碱,水解得到化合物q26。
[0209]
步骤(c)中,所述有机溶剂选自甲醇、四氢呋喃、乙醇、水与乙醇混合溶剂、水与甲醇混合溶剂等中任意的一种或多种;优选地,为水与乙醇混合溶剂。
[0210]
步骤(c)中,所述水与乙醇混合溶剂的体积比为1:(1~3);优选地,为1:3。
[0211]
步骤(c)中,所述碱选自氢氧化锂、氢氧化钠、氢氧化钾、碳酸钾等中任意的一种或多种;优选地,为氢氧化锂。
[0212]
步骤(c)中,所述化合物q25与碱的摩尔比为1:(1~40);优选地,为1:30。
[0213]
步骤(c)中,所述水解反应的温度为10~70℃;优选地,为25℃。
[0214]
步骤(c)中,所述水解反应的时间为1~12h;优选地,为8h。
[0215]
(d)乙酰化反应
[0216]
将化合物q26溶于有机溶剂中,加入乙酰化试剂及催化剂,得到化合物q27。
[0217]
步骤(d)中,所述有机溶剂选自吡啶、三乙胺、二乙胺、二异丙基乙基胺、四氢呋喃、dmf等中的一种或多种;优选地,为四氢呋喃。
[0218]
步骤(d)中,所述乙酰化试剂选自乙酸酐、乙酰氯等中的一种或多种;优选地,为乙酸酐。
[0219]
步骤(d)中,乙酰化试剂的加料方式优选为分批加入。
[0220]
步骤(d)中,所述q26、乙酰化试剂的摩尔比为1:(1~5);优选地,为1:3。
[0221]
步骤(d)中,所述催化剂选自dmap。
[0222]
步骤(d)中,所述q26与dmap的摩尔比为1:(0.1~1);优选地,为1:0.2。
[0223]
步骤(d)中,所述乙酰化反应的温度为0~100℃;优选地,为60℃。
[0224]
步骤(d)中,所述乙酰化反应的时间为1~5h;优选地,为2h。
[0225]
(e)酰化反应
[0226]
将化合物q27溶于有机溶剂中,加入edci、hobt、dmap及相应的胺,得到化合物q28-q39。
[0227]
步骤(e)中,所述有机溶剂选自dcm、乙醚、丙酮、四氢呋喃、四氯化碳、甲苯、苯、氯仿等中任意的一种或多种;优选地,为dcm。
[0228]
步骤(e)中,所述edci、hobt、dmap的作用为促进酰胺化反应。
[0229]
步骤(e)中,所述化合物q27、edci、hobt、dmap及相应的胺的摩尔比为1:(1~2):(1~2):(2~4):(1~2);优选地,为1:2:2:4:2。
[0230]
步骤(e)中,所述酰化反应的温度为25~40℃;优选地,为25℃。
[0231]
步骤(e)中,所述酰化反应的时间为6~12h;优选地,为12h。
[0232]
(f)格式反应
[0233]
将化合物q25溶于有机溶剂中,加入格式试剂,得到化合物q56。
[0234]
步骤(f)中,所述反应优选在氮气保护下进行。
[0235]
步骤(f)中,该反应中的有机溶剂为乙醚、无水四氢呋喃、甲苯、苯等中任意的一种或多种;优选地,为无水四氢呋喃。
[0236]
步骤(f)中,所述格式反应试剂为c2h5mgcl或ch2=chch2mgcl;优选地,为c2h5mgcl。
[0237]
步骤(f)中,所述格氏反应的温度为0~60℃;优选地,为0℃。
[0238]
步骤(f)中,所述化合物q25与格式试剂的摩尔比为1:(10~30);优选地,为1:20。
[0239]
步骤(f)中,所述格氏反应的时间为0.5~5h;优选地,为2h。
[0240]
本发明还提出了一种胆酸衍生物的制备方法,以化合物q36为起始原料,经过水解、缩合,得到胆酸衍生物q43;所述制备方法如路线(5)所示:
[0241][0242]
化合物q36溶于有机溶剂,加入三氟乙酸,先脱boc基团,得到中间体;然后将上述中间体乙酰化,得到化合物q43。
[0243]
其中,在脱boc基团的反应中,所述有机溶剂选自二氯甲烷、四氢呋喃、丙酮、甲苯等中任意的一种或多种;优选地,为二氯甲烷。
[0244]
其中,所述反应物q36与三氟乙酸的摩尔比为1:(2~3);优选地,为1:3。
[0245]
其中,所述脱boc反应的时间为2~8h;优选地,为3h。
[0246]
其中,所述脱boc反应的温度为0~50℃;优选地,为25℃。
[0247]
其中,所述乙酰化反应所用溶剂选自吡啶、三乙胺、二乙胺、二异丙基乙基胺、四氢呋喃、dmf等中的一种或多种;优选地,为四氢呋喃。
[0248]
其中,所述乙酰化反应所用催化剂选自dmap,所述q36化合物与dmap的摩尔比为1:(0.1~1);优选地,为1:0.2。
[0249]
其中,所述乙酰化试剂为乙酸酐、乙酰氯等中的一种或多种;优选地,为乙酸酐。
[0250]
其中,所述乙酰化试剂最优加料方式为分批加入。
[0251]
其中,所述q36、乙酰化试剂的摩尔比为1:(2~6);优选地,为1:4。
[0252]
其中,所述乙酰化反应的温度为0~100℃;优选地,为60℃。
[0253]
其中,所述乙酰化反应的时间为1~5h;优选地,为2h。
[0254]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q24为起始原料,经加成环化、水解、酰化得到化合物q45、q46,或以化合物q44为起始原料,经氧化、还原,再与c2h5mgcl或ch2=chch2mgcl分别发生格氏反应得到如式q49、q50所示的胆酸衍生物,所述制备方法如路线(6)所示:
[0255][0256][0257]
具体地,所述方法包含以下步骤:
[0258]
(a)加成环化反应
[0259]
将化合物q24溶于有机溶剂中,加入盐酸苯肼,反应得到化合物q44。
[0260]
步骤(a)中,所述有机溶剂选自乙醇、乙醇与水混合溶剂、乙酸中的一种或多种;优选地,为乙醇与水混合溶剂。
[0261]
步骤(a)中,所述反应化合物q24与盐酸苯肼的摩尔比为1:(1~3);优选地,为1:3。
[0262]
步骤(a)中,所述反应的温度为80~140℃;优选的,为100℃。
[0263]
步骤(a)中,所述反应的时间为3~10h;优选地,为3h。
[0264]
(b)水解反应
[0265]
化合物q45的合成类似于路线(4)中q26的水解反应方法。
[0266]
(c)酰化反应
[0267]
化合物q46的合成类似于路线(4)中q37的酰化反应方法。
[0268]
(d)氧化反应
[0269]
化合物q44溶于有机溶剂,加入nhpi、乙酸、氧化剂,反应得到化合物q47。
[0270]
步骤(d)中,所述有机溶剂选自丙酮、dcm、乙酸等中的一种或多种;优选地,为丙酮。
[0271]
步骤(d)中,所述氧化剂选自重铬酸钠、重铬酸钾、三氧化铬等中的一种或多种;优选地,为重铬酸钠。
[0272]
步骤(d)中,所述化合物q44与nhpi、乙酸、氧化剂的摩尔比为1:(1~4):(0.2~2):(1~2);优选地,为1:2:1:1.2。
[0273]
步骤(d)中,所述氧化反应的温度为25~50℃;优选地,为50℃。
[0274]
步骤(d)中,所述氧化反应的时间为1~4h;优选地,为2h。
[0275]
(e)还原反应
[0276]
化合物q47溶于有机溶剂,加入还原剂,反应得到化合物q48。
[0277]
步骤(e)中,所述还原反应中的溶剂选自二氯甲烷、甲醇、二氯甲烷:甲醇=1:1的混合溶液或者二氯甲烷:甲醇=5:1的混合溶液;优选地,为甲醇。
[0278]
步骤(e)中,所述还原反应的温度为25~50℃;优选地,为25℃。
[0279]
步骤(e)中,所述还原试剂选自氢气、硼氢化钠、硼氢化钾等中的一种或多种;优选的,为硼氢化钠。
[0280]
步骤(e)中,所述化合物q47与还原剂的摩尔比为1:(5~20);优选地,为1:10。
[0281]
步骤(e)中,所述反应的时间为1~4h;优选地,为2h。
[0282]
(f)格式反应
[0283]
化合物q49的合成方法类似于路线(4)中q56的格式反应合成。
[0284]
化合物q50的合成方法类似于路线(4)中q56的格式反应合成。
[0285]
本发明还提出了一种胆酸衍生物的制备方法,以化合物q26为起始原料,经酰化、酸酐保护反应,得到如式q51-q55所示的胆酸衍生物,所述制备方法如路线(7)所示:
[0286][0287]
(a)酰化反应
[0288]
化合物q51的合成类似于路线(4)中q37的酰化反应方法。
[0289]
(b)酸酐保护反应
[0290]
化合物q52-q55的合成类似于路线(4)中q27的乙酰化反应方法。
[0291]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q7为起始原料,经环化、水解、酰化、羰基还原得到化合物q58、q59、q61,所述制备方法如路线(8)所示:
[0292][0293]
(a)环化反应
[0294]
化合物q7溶于有机溶剂,加入硫、乙二胺,反应得到化合物q57。
[0295]
步骤(a)中,所述有机溶剂为吗啡啉。
[0296]
步骤(a)中,所述硫为单质硫粉末。
[0297]
步骤(a)中,所述q7与硫、乙二胺摩尔比为1:(5~10):(5~10);优选地,为1:10:10。
[0298]
步骤(a)中,所述环化反应的温度为100~150℃;优选的,为120℃。
[0299]
步骤(a)中,所述环化反应的时间为3~10h;优选的,为5h。
[0300]
(b)水解反应
[0301]
化合物q58的合成类似于路线(4)中q26的水解反应方法。
[0302]
(c)酰化反应
[0303]
化合物q59的合成类似于路线(4)中q37的酰化反应方法。
[0304]
(d)氧化反应
[0305]
化合物q60的合成类似于路线(6)中q47的氧化反应方法。
[0306]
(e)还原反应
[0307]
化合物q61的合成类似于路线(6)中q48的还原反应方法。
[0308]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q7为起始原料,经溴代、环化、水解得到化合物q64、q66,所述制备方法如路线(9)所示:
[0309][0310]
(a)溴代反应
[0311]
将化合物q7溶于有机溶剂中,加入溴代试剂,反应得到化合物q62。
[0312]
步骤(a)中,所述有机溶剂选自二氯甲烷、甲醇、ccl4、dmso、dmf、苯等中的一种或多种;优选地,为二氯甲烷。
[0313]
步骤(a)中,所述溴代试剂为三溴化吡啶鎓、nbs、br2等中的一种或多种;优选地,为三溴化吡啶鎓。
[0314]
步骤(a)中,所述化合物q7与溴代试剂摩尔比为1:(1~2);优选地,为1:1.5。
[0315]
步骤(a)中,所述溴代反应的温度为0~30℃;优选地,为25℃。
[0316]
步骤(a)中,所述溴代反应的时间为1~3h;优选地,为2h。
[0317]
(b)环化反应
[0318]
将化合物q62溶于有机溶剂中,加入硫脲或硫代乙酰胺,反应得到化合物q63或q65。
[0319]
步骤(b)中,所述有机溶剂选自乙醇、甲醇、四氢呋喃中的一种或多种;优选地,为乙醇。
[0320]
步骤(b)中,所述化合物q62与硫脲的摩尔比为1:(1~3);优选地,为1:2。
[0321]
所述化合物q62与硫代乙酰胺的摩尔比为1:(1~3);优选地,为1:2。
[0322]
步骤(b)中,所述杂环化反应的温度为80~120℃;优选地,为100℃。
[0323]
步骤(b)中,所述杂环化反应的时间为2~5h;优选地,为3h。
[0324]
(c)水解反应
[0325]
化合物q64、q66的合成类似于路线(4)中q26的水解反应方法。
[0326]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q7为起始原料,经水解、酰化得到胆酸衍生物q68;或以q68为起始原料,经缩合、环化、酰化得到胆酸衍生物q71、q72;或以化合物q68为起始原料,经酯缩合、分别环化得到胆酸衍生物q74或q75;所述制备方法如路线(10)所示:
[0327][0328]
(a)水解反应
[0329]
化合物q67的合成类似于路线(4)中q26的水解反应方法。
[0330]
(b)酰化反应
[0331]
化合物q68的合成类似于路线(4)中q37的酰化反应方法。
[0332]
(c)缩合反应
[0333]
化合物q68溶于有机溶剂中,加入碱,搅拌一段时间后,滴入亚硝酸异戊酯,反应得到化合物q69。
[0334]
步骤(c)中,所述碱选自叔丁醇钾、甲醇钠、甲酸钠、乙醇钠、氢氧化钾等中的一种或多种;优选地,为叔丁醇钾。
[0335]
步骤(c)中,所述有机溶剂选自叔丁醇、正丁醇、异丙醇、甲苯、苯、四氯化碳等中的一种或多种;优选地,为叔丁醇。
[0336]
步骤(c)中,所述加入叔丁醇钾后搅拌温度为25~50℃;优选地,为30℃;
[0337]
步骤(c)中,所述加入叔丁醇钾后搅拌时间为0.5~3h,优选地,为0.5h。
[0338]
步骤(c)中,所述亚硝酸异戊酯为缓慢滴入。
[0339]
步骤(c)中,所述化合物q68、碱、亚硝酸异戊酯的摩尔比为1:(2~5):(2~5);优选地,为1:5:5。
[0340]
步骤(c)中,所述反应的温度为25~50℃;优选地,为25℃。
[0341]
步骤(c)中,所述反应的时间为3~8h;优选地,为5h。
[0342]
(d)缩合反应
[0343]
化合物q69溶于有机溶剂中,加入盐酸羟胺及碱,反应得到化合物q70。
[0344]
步骤(d)中,所述有机溶剂为甲醇、乙醇、吡啶等中的一种或多种;优选地,为吡啶。
[0345]
步骤(d)中,所述碱为吡啶、三乙胺、na2co3、k2co3、乙酸钠等中的一种或多种;优选地,为吡啶。
[0346]
步骤(d)中,所述化合物q69与盐酸羟胺摩尔比为1:(2~5);优选地,为1:3。
[0347]
步骤(d)中,所述缩合反应的温度为80~120℃;优选地,为100℃。
[0348]
步骤(d)中,所述缩合反应的时间为2~6h;优选地,为3h。
[0349]
(e)脱水环化反应
[0350]
化合物q70溶于有机溶剂,加入碱反应,得到化合物q71。
[0351]
步骤(e)中,所述有机溶剂选自乙二醇、二氧六环、乙二醇与二氧六环混合溶剂中的一种或多种;优选地,为乙二醇与二氧六环混合溶剂。
[0352]
步骤(e)中,所述乙二醇与二氧六环混合溶剂最优比例为2:1。
[0353]
步骤(e)中,所述脱水环化反应的碱选自氢氧化钾、氢氧化钠、乙酸钾、乙酸钠等中的一种或多种;优选地,为氢氧化钾。
[0354]
步骤(e)中,所述反应的温度为100~220℃;优选地,为130℃。
[0355]
步骤(e)中,所述反应的时间为3~8h;优选地,为5h。
[0356]
(f)酰化反应
[0357]
化合物q72的合成类似于路线(4)中q37的酰化反应方法。
[0358]
(g)缩合反应
[0359]
将化合物q68溶于有机溶剂中,加入缩合剂、草酸二乙酯,反应得到化合物q73。
[0360]
步骤(g)中,所述有机溶剂选自无水四氢呋喃、二氯甲烷,乙醚,四氯化碳、苯、甲苯
等中的一种或多种;优选地,为无水四氢呋喃。
[0361]
步骤(g)中,所述化合物q68与草酸二乙酯的摩尔比为1:(1~5);优选地,为1:2。
[0362]
步骤(g)中,所述缩合剂选自氢化钠、甲醇钠、乙醇钠等中的一种或多种;优选地,为氢化钠。
[0363]
步骤(g)中,所述q68与缩合剂的摩尔比为1:(5~10);优选地,为1:10。
[0364]
步骤(g)中,所述缩合反应的温度为25~45℃;优选地,为25℃。
[0365]
步骤(g)中,所述缩合反应的反应时间为20~60min;优选地,为20min。
[0366]
(h)加成环化反应
[0367]
化合物q74的合成类似于路线(4)中q25的环化反应方法。
[0368]
(i)加成环化反应
[0369]
将化合物q73溶于有机溶剂中,加入盐酸羟胺,反应得到化合物q75。
[0370]
步骤(i)中,所述有机溶剂选自乙醇、乙醇与水混合溶剂、乙酸等中的一种或多种;优选地,为乙醇与水混合溶剂。
[0371]
步骤(i)中,所述化合物q73与盐酸羟胺的摩尔比为1:(1~3);优选地,为1:3。
[0372]
步骤(i)中,所述反应的温度为80~140℃;优选地,为100℃。
[0373]
步骤(i)中,所述反应的时间为3~10h;优选地,为3h。
[0374]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q24为起始原料,经环化、氧化、还原、格式反应得到化合物q79,所述制备方法如路线(11)所示:
[0375][0376]
(a)加成环化反应
[0377]
化合物q76的合成类似于路线(10)中q75的环化反应方法。
[0378]
(b)氧化反应
[0379]
化合物q77的合成类似于路线(6)中q47的氧化反应方法。
[0380]
(c)还原反应
[0381]
化合物q78的合成类似于路线(6)中q48的还原反应方法。
[0382]
(d)格式反应
[0383]
化合物q79的合成类似于路线(4)中q56的格式反应方法。
[0384]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q68为起始原料,经缩合、环化得到化合物q81,所述制备方法如路线(12)所示:
[0385][0386]
(a)缩合反应
[0387]
化合物q80的合成类似于路线(4)中q24的缩合反应方法。
[0388]
(b)环化反应
[0389]
将化合物q80溶于有机溶剂中,加入邻氟盐酸苯肼,反应得到化合物q81。
[0390]
步骤(b)中,所述有机溶剂选自乙醇、乙醇与水混合溶剂、乙酸等中的一种或多种;优选地,为乙醇与水混合溶剂。
[0391]
步骤(b)中,所述q80与邻氟盐酸苯肼的摩尔比为1:(1~3);优选地,为1:3。
[0392]
步骤(b)中,所述环化反应的温度为80~140℃;优选地,为100℃。
[0393]
步骤(b)中,所述环化反应的时间为3~10h;优选地,为3h。
[0394]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q6为起始原料,经还原得到化合物q82,然后以q82为起始原料,经缩合、环化、水解、酰化得到胆酸衍生物q87;所述制备方法如路线(13)所示:
[0395][0396]
(a)还原反应
[0397]
将化合物q6溶于有机溶剂中,加入还原试剂,加压下进行还原反应得到化合物q82。
[0398]
步骤(a)中,所述有机溶剂选自甲醇、乙醇、四氢呋喃、二氯甲烷、乙酸乙酯等中的一种或多种;优选的,为乙酸乙酯。
[0399]
步骤(a)中,所述还原试剂选自钯碳、雷尼镍等中的一种或多种;优选地,为钯碳
[0400]
步骤(a)中,所述化合物q6与还原试剂的质量比为1:(0.2~1);优选地,为1:0.5。
[0401]
步骤(a)中,所述反应加压为4mpa。
[0402]
步骤(a)中,所述反应的温度为10~60℃;优选地,为25℃。
[0403]
步骤(a)中,所述反应的时间为24~72h;优选地,为24h。
[0404]
(b)缩合反应
[0405]
化合物q83的合成类似于路线(4)中q24的缩合反应方法。
[0406]
(c)加成环化反应
[0407]
化合物q84的合成类似于路线(4)中q25的环化反应方法。
[0408]
(d)水解反应
[0409]
化合物q85的合成类似于路线(4)中q26的水解反应方法。
[0410]
(e)乙酰化反应
[0411]
化合物q86的合成类似于路线(4)中q27的乙酰化反应方法。
[0412]
(f)酰化反应
[0413]
化合物q87的合成类似于路线(4)中q37的酰化反应方法。
[0414]
本发明还提供了一种胆酸衍生物的制备方法,以化合物q9、q13、q19或q23为起始原料,经缩合、环化、水解、酰化得到化合物q94~q111,所述制备方法如路线(14)所示:
[0415][0416]
(a)aldol缩合反应
[0417]
化合物q107、q102、q88、q97的合成类似于路线(4)中q24的缩合反应方法。
[0418]
(b)加成环化反应
[0419]
化合物q108、q103、q89、q98的合成类似于路线(4)中q25的环化反应方法。
[0420]
(c)水解反应
[0421]
化合物q109、q104、q90、q99的合成类似于路线(4)中q26的水解反应方法。
[0422]
(d)酰化反应
[0423]
化合物q110、q105的合成类似于路线(7)中q54的酰化反应方法。
[0424]
化合物q93、q100的合成类似于路线(4)中q27的乙酰化反应方法。
[0425]
(e)酰化反应
[0426]
化合物q111、q106、q96、q101的合成类似于路线(4)中q37的酰化反应方法。
[0427]
化合物q94的合成类似于路线(4)中q36的酰化反应方法。
[0428]
(f)先水解后酰化反应
[0429]
化合物q95的合成类似于路线(5)中q43的反应方法。
[0430]
(g)酰化反应
[0431]
化合物q91的合成类似于路线(4)中q37的酰化反应方法。
[0432]
(h)酰化反应
[0433]
化合物q92的合成类似于路线(7)中q54的酰化反应方法。
[0434]
本发明制备方法中,上述反应通过薄板层析法跟踪测定反应的进度,反应完毕后采用的后处理方法包括浓缩、萃取、柱层析分离等步骤,最终产物以核磁共振谱及高分辨质谱来验证。
[0435]
本发明还提出了所述的胆酸衍生物在制备抑制细胞胆固醇合成的药物中的应用。
[0436]
本发明还提出了所述的胆酸衍生物在制备预防和/或治疗高胆固醇血症,高甘油三酯血症,动脉粥样硬化,和/或非酒精性脂肪性肝炎的药物中的应用。
[0437]
所述药物还可以与他汀类药物联合使用。
[0438]
所述他汀类药物包括洛伐他汀、辛伐他汀、普伐他汀、氟伐他汀、阿托伐他汀、瑞舒伐他汀。
[0439]
本发明的有益效果在于:本发明所述的胆酸衍生物不仅能有效促进羟甲基戊二酰辅酶a还原酶(3-hydroxy-3-methyl-glutaryl-coenzyme areductase,hmgcr)降解,还可减少他汀类药物引起的hmgcr蛋白增多,从而降低内源性胆固醇水平,为降胆固醇和抗动脉粥样硬化以及抗非酒精性脂肪性肝炎新药的研发提供有益参考,具有良好的应用前景。
附图说明
[0440]
图1为第一代化合物的细胞内胆固醇堆积情况。
[0441]
图2为化合物q37及化合物q54 western图示及q37和q54的ec50值;其中,图a为化合物q37的western图示,图b为化合物q37的ec50,图c为化合物q54的western图示,图b为化合物q54的ec50。
[0442]
图3为第二代部分化合物的细胞内胆固醇堆积情况(完全无堆积)。
具体实施方式
[0443]
结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
[0444]
下述实施例中化合物结构由核磁共振仪测定;试剂主要由上海国药化学试剂公司
提供了;产品纯化主要通过柱色谱,硅胶(200-300目)由青岛海洋化工厂生产。
[0445]
实施例1化合物q2-q4的制备
[0446]
将化合物q1(10g,0.03mol)置于250ml单口烧瓶中,加入150ml无水dmf搅拌至溶清,0℃下加入咪唑(16.34g,0.24mol)、tbscl(18.09g,0.12mol),n2置换三次,搅拌均匀后提至室温,搅拌5小时,tlc检测原料反应完全后,加入50ml饱和氯化铵溶液淬灭反应,加入乙酸乙酯(100ml)萃取分液,水相再用乙酸乙酯(30ml
×
3)萃取,合并有机相。有机相分别用饱和氯化铵溶液(50ml
×
2)、水(50ml
×
3)、饱和氯化钠溶液(50ml
×
2)洗涤,无水na2so4干燥,减压浓缩得化合物q2(白色固体13.45g,产率99%),直接用于下一步。
[0447]
将化合物q2(13.45g,0.03mol)置于三口烧瓶中,加入200ml无水叔丁醇搅拌至溶解,n2置换三次,0℃下分批加入叔丁醇钾(13.47g,0.12mol)至溶清,可见体系变橙黄色,缓慢滴入碘甲烷(14ml,0.24mol),可见体系逐渐变浅黄到白色,反应放热,转移至室温搅拌4小时,tlc检测原料反应完全,加入饱和亚硫酸钠溶液(50ml)淬灭反应,加入水(50ml)和乙酸乙酯(100ml)萃取分液,水相再用乙酸乙酯(30ml
×
3)萃取,合并有机相。有机相分别用水(50ml
×
3)、饱和氯化钠溶液(50ml
×
2)洗涤,无水na2so4干燥,减压浓缩得化合物q3(白色固体),直接用于下一步。
[0448]
将化合物q3直接溶于盐酸乙醚溶液,室温搅拌2h,tlc检测原料反应完全,加入50ml水,加100ml乙酸乙酯萃取分液,水相再用乙酸乙酯(30ml
×
3)萃取,合并有机相。有机相分别用水(50ml
×
3)、饱和氯化钠溶液(50ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=20:1)得到化合物q4(6.88g白色固体,两步产率64%)。
13
c nmr(101mhz,cdcl3)δ217.12,149.52,119.47,67.90,56.44,52.38,48.87,48.67,42.46,39.58,38.73,37.05,33.71,32.07,31.70,31.22,30.22,27.76,27.23,24.28,21.27,19.33,16.78,11.99.
[0449]
实施例2化合物q5的制备
[0450]
将化合物q4(6.88g,0.019mol)、pdc(10.84g,0.029mol)、硅胶(10.84g,0.029mol)置于250ml单口烧瓶中,加入100ml无水二氯甲烷,室温搅拌8小时,tlc检测原料反应完全,抽滤除去硅胶,滤饼用二氯甲烷(20ml
×
3)洗,体系中加入饱和亚硫酸钠淬灭十分钟至体系变浅绿色,萃取分液,水相用二氯甲烷(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q5(白色固体6.83g,产率99%)。
13
c nmr(101mhz,cdcl3)δ216.74,205.03,149.81,119.83,56.02,50.96,49.49,48.88,48.66,42.99,39.43,37.05,33.68,32.08,31.65,31.20,30.22,27.23,27.11,24.55,21.22,19.33,13.44,12.28.
[0451]
实施例3化合物q6的制备
[0452]
冰浴下于250ml三颈烧瓶中加入nah(3.42g,0.142mol),n2置换三次,加入50ml无水thf,搅拌溶解,缓慢滴入磷酰基乙酸三乙酯(18.85ml,0.095mol),约10分钟滴完,可见体系产生气泡。将体系提至室温搅拌10分钟。将化合物q5(6.83g,0.019mol)溶于无水thf(50ml),滴入前述体系,室温搅拌1小时,tlc检测原料反应完全,加入50ml饱和氯化铵溶液淬灭十分钟,加入60ml乙酸乙酯萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用饱和氯化铵(30ml
×
2)、水(30ml
×
3)、饱和氯化钠溶液(30ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q6(7.94g白色固体,产率
98%)。
13
c nmr(101mhz,cdcl3)δ216.72,167.06,154.60,149.78,119.83,118.99,60.11,56.56,54.88,48.86,48.65,42.70,39.72,39.57,37.05,33.69,32.07,31.64,31.19,30.22,28.19,27.22,24.18,21.25,19.33,19.22,14.29,12.15.
[0453]
实施例4化合物q7的制备
[0454]
将化合物q6(7.94g,0.019mol)、金属镁屑(4.56g,0.19mol)置于250ml单口瓶中,加入100ml无水甲醇,室温搅拌5小时,可见体系浑浊,产生气泡,瓶身发热。tlc检测原料反应完全,加水(30ml),乙酸乙酯(50ml),2m稀盐酸至固体溶清,萃取分液,水相再用乙酸乙酯(30ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
2)洗涤,无水na2so4干燥,减压浓缩后干燥得白色固体。将白色固体于250ml单口烧瓶中,加入甲苯至溶清,加入ibx(5.32g,0.019mol)后加入dmso至基本溶清,室温搅拌4小时,tlc检测原料反应完全,加50ml水,50ml乙酸乙酯,可见不溶性固体大量析出,抽滤,滤饼用乙酸乙酯(20ml
×
3)洗,分液,水相用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(50ml
×
5)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q7(白色固体7.08g,产率90%)。
13
c nmr(101mhz,cdcl3)δ216.73,174.36,149.51,119.83,56.72,55.74,51.49,48.90,48.60,42.40,39.70,37.04,35.35,33.70,32.06,31.68,31.17,31.03,30.97,30.21,28.13,27.22,24.14,21.26,19.32,18.29,11.91.
[0455]
实施例5化合物q8的制备
[0456]
将高锰酸钾(2g,12.66mmol)于100ml烧杯中,加入30ml水,搅拌溶解。另将四丁基溴化铵(4.3g,13.34mmol)于50ml烧杯中,加入水(8ml),滴入上述体系,得紫色悬浮液,室温搅拌40分钟后抽滤,滤饼用水(20ml
×
3)洗涤,室温晾干得固体四丁基高猛酸铵备用。
[0457]
将化合物q5(2g,5.61mmol)、上述制备所得四丁基高锰酸铵(4.05g,11.22mmol)于100ml单口烧瓶中,0℃下加入40ml吡啶,搅拌三十分钟后提至室温,继续搅拌1小时,tlc检测原料反应完全,加水(20ml),饱和亚硫酸氢钠溶液(30ml),并用2m稀盐酸调节ph约等于5,加入50ml乙酸乙酯萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q8(白色固体1.98g,产率95%)。
13
c nmr(126mhz,cdcl3)δ216.90,182.52,149.78,119.81,56.38,52.43,48.85,48.69,42.55,42.48,39.56,37.06,33.70,32.07,31.64,31.22,30.23,27.34,27.23,24.27,21.23,19.34,17.07,12.09.
[0458]
实施例6化合物q9的制备
[0459]
将化合物q8(1.98g,5.33mmol)加入100ml单口烧瓶中,加入50ml甲醇,搅拌均匀,缓慢滴加浓硫酸(0.2ml,3.73mmol),70℃加热回流,搅拌2小时,tlc检测原料反应完全,加水(20ml),加入乙酸乙酯(50ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q9(白色固体2.06g,产率99%)。
13
c nmr(126mhz,cdcl3)δ216.73,177.31,149.79,119.81,56.35,52.84,51.35,48.86,48.67,42.46,42.44,39.52,37.05,33.70,32.07,31.64,31.21,30.22,27.23,27.20,24.23,21.23,19.33,17.13,12.08.
[0460]
实施例7化合物q10~q11的制备
[0461]
将碘单质(3.47g,13.7mmol)于100ml三颈烧瓶,加入无水甲苯(30ml)溶清,加入三
苯基膦(3.74g,14.3mmol)、咪唑(1.86g,27.4mmol),氮气保护,可见体系明显变色,室温搅拌1小时得棕黄色体系。于上述体系中加入化合物q4(700mg,1.95mmol),室温搅拌2小时,tlc检测原料反应完全,加入饱和亚硫酸钠溶液(20ml)淬灭十分钟至基本无色,加入乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后得到化合物q10(白色固体),直接投下一步。
[0462]
将化合物q10(前一步全部固体)置于100ml单口烧瓶,加入30mldmf搅拌溶清,加入kf(1.81g,31.2mmol)、三甲基硅氰(1.95ml,15.6mmol),50℃保温4小时,tlc检测原料反应完全,加入30ml水,30ml乙酸乙酯萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q11(白色固体537mg,两步产率75%)。
13
c nmr(126mhz,cdcl3)δ216.71,149.82,119.76,118.94,56.53,54.69,48.72,48.66,42.49,39.35,37.04,33.69,33.53,32.05,31.61,31.19,30.22,28.11(2c),27.23,24.82,24.07,21.19,19.33,12.01.
[0463]
实施例8化合物q12的制备
[0464]
将化合物q11(537mg,1.46mmol)、naoh(584mg,14.6mmol)于50ml单口烧瓶中,加入水、乙醇(1:3)混合溶液(20ml),搅拌使体系基本溶解,100℃加热回流72小时,tlc检测原料反应完全,加入2m稀盐酸溶液调节ph约5,加入乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(10ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q12(白色固体507mg,产率90%)。
13
c nmr(126mhz,cdcl3)δ216.99,179.43,149.79,119.85,56.76,55.75,48.84,48.69,42.51,41.28,39.59,37.06,33.71,33.61,32.08,31.67,31.20,30.21,28.27,27.25,24.12,21.24,19.53,19.34,11.94.
[0465]
实施例9化合物q13的制备
[0466]
将化合物q12(507mg,1.31mmol)置于50ml单口烧瓶内,加入甲醇(20ml),搅拌均匀,缓慢滴加浓硫酸(0.05ml,0.92mmol),70℃加热回流,搅拌2小时,tlc检测原料反应完全,加水(10ml),加入乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(10ml
×
3)萃取,合并有机相。有机相分别用水(10ml
×
3)、饱和氯化钠溶液(10ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q13(白色固体524mg,产率99%)。
13
c nmr(126mhz,cdcl3)δ216.74,173.97,149.81,119.85,56.75,55.89,51.36,48.85,48.66,42.51,41.42,39.60,37.05,33.77,33.71,32.09,31.68,31.20,30.20,28.23,27.25,24.13,21.24,19.55,19.33,11.95.
[0467]
实施例10化合物q14的制备
[0468]
将化合物q7(1g,2.42mmol)、乙二醇(10ml)于100ml单口烧瓶中,加入无水thf(30ml),对甲苯磺酸(96mg,0.484mmol)、原甲酸三乙酯(2ml,12.1mmol),n2保护,室温搅拌3小时,tlc检测原料反应完全,加水(30ml),加入乙酸乙酯(50ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=20:1)得到化合物q14(白色固体1.11g,产率99%)。
13
c nmr(126mhz,cdcl3)δ174.86,149.64,119.89,113.22,65.22,64.87,
57.17,55.57,51.49,50.54,44.82,42.27,39.70,36.26,35.35,35.26,32.30,31.04,31.00,30.88,29.20,28.15,26.83,24.15,22.39,21.70,20.54,18.29,11.86.
[0469]
实施例11化合物q15的制备
[0470]
将化合物q14(1.11g,2.42mmol)加入无水thf(40ml)搅拌溶清,0℃下分批加入氢化铝锂(919mg,24.2mmol),氮气保护,继续搅拌2小时,tlc检测原料反应完全,加0.92ml水,2m氢氧化钠溶液(1.85ml),加入水(0.92ml)淬灭,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=20:1)得到化合物q15(白色固体1.04g,产率99%)。1h nmr(500mhz,cdcl3)δ5.54
–
5.49(m,1h),4.03
–
3.86(m,4h),3.67
–
3.54(m,2h),2.09
–
2.04(m,1h),2.01
–
1.96(m,2h),1.86
–
1.80(m,1h),1.74
–
1.37(m,16h),1.27(dd,j=9.0,6.0hz,1h),1.23(s,3h),1.12(s,3h),1.07(dd,j=5.3,3.0hz,1h),1.04(s,3h),0.96(dd,j=5.1,3.3hz,1h),0.93(d,j=6.5hz,3h),0.67(s,3h).
[0471]
实施例12化合物q16的制备
[0472]
将碘单质(4.31g,16.94mmol)于100ml三颈烧瓶,加入无水甲苯(30ml)溶清,加入三苯基膦(4.63g,17.67mmol)、咪唑(2.31g,33.88mmol),氮气保护,可见体系明显变色,室温搅拌1小时得棕黄色体系。于上述体系中加入化合物q15(1.04g,2.42mmol),室温搅拌2小时,tlc检测原料反应完全,加入饱和亚硫酸钠溶液(30ml)淬灭十分钟至基本无色,加入乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=30:1)得到化合物q16(白色固体1.18g,产率90%)。
13
c nmr(126mhz,cdcl3)δ149.68,119.89,113.20,65.24,64.89,57.19,55.68,50.56,44.84,42.28,39.71,36.89,36.28,35.28,35.08,32.32,30.89,30.35,29.22,28.28,26.85,24.18,22.41,21.72,20.56,18.75,11.88,7.89.
[0473]
实施例13化合物q17的制备
[0474]
将化合物q16(1.18g,2.18mmol)置于100ml单口烧瓶,加入dmf(30ml),搅拌溶清,加入kf(2.02g,34.85mmol)、三甲基硅氰(2.18ml,17.42mmol),50℃保温4小时,tlc检测原料反应完全,加入水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q17(白色固体813mg,产率85%)。
13
c nmr(126mhz,cdcl3)δ149.68,119.87,113.20,65.24,64.89,57.17,55.58,50.54,44.84,42.29,39.72,36.27,35.27,35.23,35.05,32.29,30.88,29.22,28.26,26.84,24.14,22.40,22.19,21.71,20.55,18.52,17.55(2c),11.86.
[0475]
实施例14化合物q18的制备
[0476]
将化合物q17(813mg,1.85mmol)、naoh(741mg,18.5mmol)于50ml单口烧瓶中,加入水和乙醇(1:3)混合溶液(30ml),搅拌使体系基本溶解,100℃加热回流72小时,tlc检测原料反应完全,加入2m稀盐酸溶液调节ph约5,加入30ml乙酸乙酯萃取分液,水相再用乙酸乙酯(15ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
3)洗涤,无水na2so4干燥,减压浓缩后得到化合物q18(白色固体690mg,收率90%)。1h nmr(500mhz,cdcl3)δ5.54(s,1h),2.56
–
2.42(m,2h),2.30(dt,j=23.4,7.9hz,2h),2.09(dt,j
=17.6,4.8hz,1h),2.00(t,j=11.0hz,2h),1.86
–
1.79(m,1h),1.70
–
1.35(m,10h),1.26(d,j=8.2hz,1h),1.22(s,6h),1.17
–
1.04(m,4h),1.04
–
0.98(m,2h),0.93(d,j=6.2hz,3h),0.84(s,3h),0.67(s,3h).
[0477]
实施例15化合物q19的制备
[0478]
将化合物q18(690mg,1.67mmol)置于单口烧瓶内,加入甲醇(20ml),搅拌均匀,缓慢滴加浓硫酸(0.06ml,1.17mmol),70℃加热回流,搅拌2小时,tlc检测原料反应完全,加水(10ml)和乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(15ml
×
3)萃取,合并有机相。有机相分别用水(15ml
×
3)、饱和氯化钠溶液(15ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q19(白色固体715mg,产率99%)。
13
c nmr(126mhz,cdcl3)δ216.84,174.32,149.79,119.91,56.76,55.77,51.43,48.90,48.66,42.38,39.72,37.06,35.48,35.39,34.51,33.72,32.09,31.72,31.20,30.21,28.19,27.24,24.16,21.50,21.28,19.34,18.59,11.90.
[0479]
实施例15化合物q20的制备
[0480]
将化合物q15(1g,2.33mmol)于100ml单口烧瓶中,加入甲苯至溶清,加入ibx(977mg,2.49mmol)后加入dmso至基本溶清,室温搅拌8小时,tlc检测原料反应完全,加水(30ml)和乙酸乙酯(30ml),可见不溶性固体大量析出,抽滤,滤饼用乙酸乙酯(20ml
×
3)洗,分液,水相用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(50ml
×
5)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=20:1)得到化合物q20(白色固体998mg,产率99%)。
13
c nmr(126mhz,cdcl3)δ203.23,149.68,119.86,113.20,65.24,64.88,57.17,55.62,50.53,44.84,42.30,40.90,39.70,36.27,35.33,35.27,32.30,30.89,29.22,28.23,27.97,26.84,24.16,22.40,21.70,20.55,18.41,11.89.
[0481]
实施例16化合物q21的制备
[0482]
冰浴下,于100ml三颈烧瓶中放入nah(419mg,17.48mmol),n2置换三次,加入20ml无水thf,搅拌溶解,缓慢滴入磷酰基乙酸三乙酯(2.31ml,11.65mmol),约10分钟滴完,可见体系产生气泡。将体系提至室温搅拌10分钟。将化合物q20(998mg,2.33mmol)溶于无水thf(20ml),滴入前述体系,室温搅拌1小时,tlc检测原料反应完全,加入饱和氯化铵溶液(30ml)淬灭十分钟,加入乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用饱和氯化铵(20ml
×
2)、水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q21(1.14g白色固体,产率98%)。
13
c nmr(126mhz,cdcl3)δ166.78,149.95,149.66,120.96,119.85,113.17,65.22,64.86,60.08,57.17,55.73,50.53,44.82,42.29,39.72,36.26,35.46,35.25,34.28,32.30,30.88,29.21,28.97,28.23,26.83,24.15,22.39,21.70,20.55,18.45,14.28,11.88.
[0483]
实施例17化合物q22的制备
[0484]
将化合物q21(1.14g,2.33mmol)于单口烧瓶,加入甲醇水混合溶液,搅拌至基本溶解。于体系内加入2m稀盐酸水溶液(6ml),室温搅拌2小时,tlc检测原料反应完全,加入乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q22(1.06g白色固体,产率99%)。
13
c nmr(126mhz,cdcl3)δ216.86,
166.81,149.91,149.78,121.01,119.91,60.13,56.75,55.91,48.89,48.67,42.44,39.74,37.06,35.47,34.28,33.72,32.09,31.70,31.20,30.21,29.00,28.22,27.25,24.15,21.28,19.34,18.45,14.29,11.95.
[0485]
实施例18化合物q23的制备
[0486]
将化合物q22(1.06g,2.33mmol)、金属镁屑(560mg,23.3mmol)置于单口瓶中,加入无水甲醇(40ml),室温搅拌5小时,可见体系浑浊,产生气泡,瓶身发热。tlc检测原料反应完全,加水(20ml),乙酸乙酯(30ml),2m稀盐酸至固体溶清,萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后干燥得白色固体。将白色固体于100ml单口烧瓶中,加入甲苯至溶清,加入ibx(653mg,2.33mmol)后加入dmso至基本溶清,室温搅拌4小时,tlc检测原料反应完全,加水(30ml)和乙酸乙酯(30ml),可见不溶性固体大量析出,抽滤,滤饼用乙酸乙酯(20ml
×
3)洗,分液,水相用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
5)、饱和氯化钠溶液(30ml
×
3)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=15:1)得到化合物q23(白色固体928mg,产率90%)。
13
c nmr(126mhz,cdcl3)δ216.83,174.30,149.78,119.92,56.77,56.03,51.43,48.91,48.66,42.37,39.74,37.06,35.57,35.51,34.16,33.72,32.09,31.73,31.20,30.20,28.25,27.25,25.65,25.39,24.17,21.28,19.33,18.62,11.92.
[0487]
实施例19化合物q24~q25的制备
[0488]
化合物q7(1.00g,2.41mmol)于100ml单口烧瓶,加入30ml甲酸乙酯至溶清,加入nah(578mg,24.1mmol),氮气保护,室温搅拌20分钟,可见体系变橙黄色,tlc检测原料反应完全,加30ml水,30ml乙酸乙酯,水相再用乙酸乙酯20ml萃取一次,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后得淡黄色油状物q24,该化合物不稳定,直接后一步。
[0489]
化合物q24(前一步油状物)于100ml单口烧瓶,加入30ml冰醋酸溶清,乙酸钾(473mg,4.82mmol)、85%水合肼(0.42ml,8.51mmol),130℃加热回流5小时,tlc检测原料反应完全,降至室温,倒入烧杯,加2m氢氧化钠溶液(100ml)搅拌10分钟,再加饱和碳酸氢钠溶液搅拌10分钟,加入乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=5:1)得到化合物q25(白色固体1g,产率91.8%)。1h nmr(500mhz,dmso)δ12.32(s,1h),7.20(s,1h),5.71(t,j=13.9hz,1h),4.11
–
3.96(m,2h),2.63(t,j=24.9hz,1h),2.29(td,j=9.5,4.6hz,1h),2.21
–
2.14(m,1h),2.10
–
1.99(m,3h),1.84
–
1.79(m,1h),1.72
–
1.63(m,2h),1.64
–
1.55(m,2h),1.52
–
1.43(m,2h),1.40(d,j=7.5hz,3h),1.34(t,j=9.0hz,1h),1.27(s,3h),1.24
–
1.20(m,3h),1.19
–
1.14(m,4h),1.11
–
1.01(m,3h),0.89(t,j=8.1hz,3h),0.79(s,3h),0.66(s,3h).
[0490]
实施例20化合物q26的制备
[0491]
化合物q25(1g,2.21mmol)、氢氧化锂(1.60g,66.4mmol)于100ml单口烧瓶,加入40ml水乙醇混合溶液,室温搅拌8小时,tlc检测原料反应完全,加2m稀盐酸水溶液调节ph约5,加入乙酸乙酯(30ml),萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱
层析(dcm/meoh=15:1)得到化合物q26(白色固体1.03g,产率99%)。1h nmr(400mhz,dmso)δ12.05(s,1h),7.19(s,1h),5.68(d,j=25.5hz,1h),2.64(d,j=14.4hz,1h),2.21(s,1h),2.02(dd,j=30.1,15.3hz,4h),1.88
–
1.50(m,6h),1.45(s,1h),1.39(s,3h),1.33(s,1h),1.25(s,3h),1.22
–
0.98(m,7h),0.87(d,j=5.2hz,3h),0.77(s,3h),0.66(d,j=14.9hz,3h).mp:260-261℃。hrms(esi)for c
27
h
41
n2o2[m h]
:calcd 425.3163,found 425.3184.
[0492]
实施例21化合物q27的制备
[0493]
化合物q26(1.03g,2.21mmol)、dmap(73.37mg,0.44mmol)于100ml单口烧瓶,加入thf(40ml)、乙酸酐(0.63ml,6.63mmol),60℃加热搅拌2小时,可见体系逐渐溶清,tlc检测原料反应完全,恢复至室温,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q27(白色固体927mg,产率90%)。1h nmr(500mhz,cdcl3)δ7.88(d,j=1.2hz,1h),5.75(dd,j=5.2,2.3hz,1h),2.77(d,j=14.9hz,1h),2.65(s,3h),2.44
–
2.35(m,1h),2.33
–
2.24(m,1h),2.18
–
2.09(m,2h),2.08
–
2.00(m,1h),1.93
–
1.77(m,2h),1.72
–
1.54(m,4h),1.52(s,3h),1.50
–
1.39(m,2h),1.35(s,3h),1.31
–
1.00(m,7h),0.94(t,j=10.0hz,3h),0.79(s,3h),0.70(s,3h).
13
c nmr(126mhz,cdcl3)δ180.26,169.67,162.93,149.25,124.04,121.19,119.29,56.85,55.73,49.12,42.31,39.71,38.57,36.35,35.32,33.78,32.24,31.94,31.80,31.59,31.02,30.77,28.14,24.19,21.63,21.14,21.01,18.30,11.92.mp:104-105℃。hrms(esi)for c
29
h
42
n2o3[m na]
:calcd 489.3088,found 489.3099.
[0494]
实施例22化合物q28~q42的制备
[0495]
将化合物q27(145mg,0.31mmol)、edci(120.8mg,0.63mmol),hobt(85.2mg,0.63mmol),dmap(154.0mg,1.26mmol),以及相应的胺(0.59mmol)置于100ml单口烧瓶中,加入无水dcm(10ml),室温搅拌12小时,tlc检测原料反应完全后,加20ml水,用dcm(20ml
×
3)萃取水相,合并有机相。有机相分别用水(30ml)、饱和nacl溶液(30ml)洗涤,无水na2so4干燥,经减压浓缩后硅胶柱层析,得到相应的化合物。
[0496]
化合物q28,白色固体,产率95%。1h nmr(500mhz,cdcl3)δ7.87(d,j=1.3hz,1h),5.74(dd,j=5.2,2.3hz,1h),5.53(s,1h),2.80(d,j=4.8hz,3h),2.76(d,j=14.9hz,1h),2.64(s,3h),2.28
–
2.18(m,1h),2.17
–
2.10(m,2h),2.08
–
2.01(m,2h),1.95
–
1.84(m,1h),1.84
–
1.77(m,1h),1.71
–
1.54(m,4h),1.52(s,3h),1.50
–
1.39(m,2h),1.34(d,j=6.9hz,3h),1.32
–
1.00(m,7h),0.93(d,j=6.5hz,3h),0.78(s,3h),0.68(s,3h).
13
c nmr(126mhz,cdcl3)δ174.17,169.63,162.91,149.22,123.99,121.21,119.28,56.85,55.82,49.12,42.30,39.73,38.56,36.34,35.55,33.78,33.56,32.23,31.93,31.83,31.80,31.58,28.21,26.32,24.20,21.63,21.14,21.00,18.43,11.91.mp:178-180℃。hrms(esi)for c
30
h
45
n3o2[m na]
:calcd 502.3404,found 502.3409.
[0497]
化合物q29,白色固体,产率95%。1h nmr(500mhz,cdcl3)δ7.86(s,1h),5.74(dd,j=5.1,2.1hz,1h),5.51(s,1h),3.35
–
3.21(m,2h),2.75(d,j=14.9hz,1h),2.64(s,3h),2.25
–
2.18(m,1h),2.17
–
2.09(m,2h),2.09
–
2.00(m,2h),1.91
–
1.85(m,1h),1.84
–
1.75(m,1h),1.72
–
1.54(m,4h),1.51(s,3h),1.49
–
1.38(m,2h),1.33(d,j=7.2hz,3h),1.30
–
1.15(m,4h),1.12(t,j=7.3hz,4h),1.08
–
0.99(m,2h),0.92(t,j=9.3hz,3h),0.79(d,j=
10.8hz,3h),0.68(s,3h).
13
c nmr(126mhz,cdcl3)δ173.37,169.62,162.91,149.22,123.99,121.21,119.28,56.85,55.83,49.12,42.30,39.73,38.56,36.33,35.53,34.31,33.78,33.69,32.23,31.93,31.83,31.80,31.58,28.22,24.19,21.63,21.14,21.00,18.45,14.94,11.91.mp:125-126℃。hrms(esi)for c
31
h
47
n3o2[m na]
:calcd 516.3560,found 516.3578.
[0498]
化合物q30,白色固体,产率95%。1h nmr(400mhz,cdcl3)δ7.86(s,1h),5.73(s,1h),5.60(s,1h),3.22
–
3.12(m,2h),2.72(d,j=19.5hz,1h),2.63(s,3h),2.26
–
2.17(m,1h),2.11(d,j=15.4hz,2h),2.02(d,j=12.5hz,2h),1.91
–
1.54(m,6h),1.51(s,3h),1.44
–
1.37(m,3h),1.33(s,3h),1.29
–
1.05(m,7h),0.93
–
0.85(m,7h),0.77(s,3h),0.67(s,3h).
13
c nmr(101mhz,cdcl3)δ173.58,169.64,162.93,149.21,123.99,121.21,119.29,56.85,55.83,49.12,42.29,41.20,39.72,38.55,36.33,35.52,33.77,33.71,32.22,31.92,31.87,31.79,31.57,28.21,24.19,22.90,21.62,21.13,20.99,18.43,11.90,11.37.mp:125-126℃。hrms(esi)for c
32
h
49
n3o2[m na]
:calcd 530.3717,found 530.3707.
[0499]
化合物q31,白色固体,产率90%。1h nmr(500mhz,cdcl3)δ8.56(d,j=2.2hz,1h),8.32(d,j=4.2hz,1h),8.20(d,j=8.2hz,1h),8.03(s,1h),7.87(d,j=1.0hz,1h),7.26(t,j=5.1hz,1h),5.75(dd,j=5.1,2.2hz,1h),2.76(d,j=14.9hz,1h),2.65(s,3h),2.51
–
2.41(m,1h),2.35
–
2.24(m,1h),2.17
–
2.10(m,2h),2.03(dd,j=9.2,3.3hz,1h),1.94
–
1.86(m,2h),1.70
–
1.55(m,4h),1.52(s,3h),1.49
–
1.42(m,2h),1.34(s,3h),1.31
–
1.00(m,7h),0.96(d,j=6.2hz,3h),0.78(s,3h),0.67(s,3h).
13
c nmr(126mhz,cdcl3)δ172.57,169.75,162.98,149.20,144.91,140.97,135.20,127.18,123.99,123.74,121.20,119.33,56.85,55.83,49.11,42.33,39.75,38.56,36.35,35.53,34.45,33.78,32.24,31.92,31.81,31.58,31.50,28.25,24.19,21.66,21.15,21.01,18.49,11.94.mp:174-175℃。hrms(esi)for c
34
h
46
n4o2[m h]
:calcd 543.3694,found 543.3697.
[0500]
化合物q32,白色固体,产率90%。1h nmr(400mhz,cdcl3)δ7.87(s,1h),6.00(s,1h),5.72(d,j=21.5hz,1h),3.71(s,4h),3.35(d,j=5.2hz,2h),2.76(d,j=14.8hz,1h),2.64(s,2h),2.51
–
2.42(m,5h),2.30
–
2.21(m,1h),2.16
–
1.56(m,11h),1.52(s,3h),1.44(d,j=8.9hz,1h),1.34(d,j=6.6hz,3h),1.29
–
1.02(m,9h),0.95(d,j=6.1hz,3h),0.78(s,3h),0.68(s,3h).
13
c nmr(101mhz,cdcl3)δ173.62,169.66,162.93,149.22,124.02,121.21,119.29,66.91(2c),57.10,56.85,55.82,53.33(2c),49.10,42.30,39.72,38.56,36.34,35.52,33.78,33.56,32.22,31.93,31.80,31.77,31.58,29.70,28.23,24.20,21.65,21.13,21.01,18.43,11.93.mp:108-109℃。hrms(esi)for c
35
h
54
n4o3[m h]
:calcd 579.4269,found 579.4215.
[0501]
化合物q33,白色固体,产率95%。1h nmr(500mhz,cdcl3)δ7.87(s,1h),7.79(d,j=7.5hz,1h),7.19(dd,j=15.4,7.5hz,2h),7.06(dd,j=15.6,7.8hz,1h),7.01(d,j=18.7hz,1h),5.76(dd,j=5.1,2.2hz,1h),2.77(d,j=14.9hz,1h),2.65(s,3h),2.50
–
2.40(m,1h),2.31(dd,j=14.9,8.8hz,1h),2.26(s,3h),2.17
–
2.10(m,2h),2.09
–
2.03(m,1h),1.93(s,2h),1.74
–
1.55(m,4h),1.53(s,3h),1.51
–
1.42(m,2h),1.36(s,3h),1.34
–
1.04(m,6h),1.01(d,j=7.3hz,3h),0.80(s,3h),0.69(s,3h).
13
c nmr(126mhz,cdcl3)δ171.70,
169.64,162.91,149.24,135.76,130.43,126.78,125.09,124.00,123.23,121.21(2c),119.28,56.87,55.87,49.13,42.34,39.75,38.58,36.35,35.52,34.52,33.79,32.24,31.94,31.81(2c),31.60,28.25,24.21,21.64,21.16,21.02,18.48,17.82,11.95.mp:132-133℃。hrms(esi)for c
36
h
49
n3o2[m na]
:calcd 578.3717,found 578.3704.
[0502]
化合物q34,白色固体,产率95%。1h nmr(500mhz,cdcl3)δ7.88(d,j=1.1hz,1h),7.38(t,j=11.6hz,2h),7.10(d,j=8.1hz,2h),5.75(dd,j=5.2,2.2hz,1h),2.77(d,j=14.9hz,1h),2.65(s,3h),2.45
–
2.36(m,1h),2.30(s,3h),2.27
–
2.20(m,1h),2.18
–
2.10(m,2h),2.05(t,j=6.2hz,1h),1.96
–
1.85(m,2h),1.73
–
1.55(m,4h),1.53(s,3h),1.50
–
1.40(m,3h),1.35(s,3h),1.32
–
1.00(m,7h),0.97(d,j=6.3hz,3h),0.79(s,3h),0.70(s,3h).
13
c nmr(126mhz,cdcl3)δ171.71,169.67,162.94,149.22,135.52,133.68,129.44(2c),124.00,121.22,119.87(2c),119.30,56.86,55.86,49.14,42.32,39.75,38.57,36.35,35.53,34.61,33.79,32.25,31.94,31.81,31.66,31.59,28.24,24.21,21.64,21.16,21.02,20.86,18.50,11.94.mp:159-160℃。hrms(esi)for c
36
h
49
n3o2[m na]
:calcd 578.3717,found 578.3706.
[0503]
化合物q35,白色固体,产率95%。1h nmr(500mhz,cdcl3)δ10.56(s,1h),8.32(s,1h),7.88(s,1h),5.76(d,j=2.8hz,1h),2.75(t,j=19.7hz,1h),2.64(s,3h),2.63
–
2.58(m,1h),2.53
–
2.41(m,1h),2.19
–
2.10(m,2h),2.06(d,j=8.9hz,1h),1.98
–
1.84(m,2h),1.73
–
1.56(m,4h),1.53(s,3h),1.51
–
1.40(m,2h),1.36(s,3h),1.33
–
1.04(m,8h),1.00(d,j=6.0hz,3h),0.95
–
0.83(m,1h),0.80(s,3h),0.71(s,3h).
13
c nmr(126mhz,cdcl3)δ172.09,162.96,161.67,149.23,143.44,139.93(2c),124.03,121.17,119.30,56.84,55.70,49.08,42.38,39.73,38.57,36.36,35.39,33.78,33.17,32.24,31.90,31.81,31.58,30.80,28.26,24.18,21.65,21.14,21.01,18.44,11.94.mp:220-221℃。hrms(esi)for c
32
h
43
n5o4s[m na]
:calcd 616.2928,found 616.2936.
[0504]
化合物q36,白色固体,产率95%。1h nmr(500mhz,cdcl3)δ7.87(s,1h),5.75(d,j=2.9hz,1h),5.33(d,j=7.7hz,1h),4.13
–
3.98(m,2h),3.98
–
3.83(m,1h),2.85(d,j=11.3hz,2h),2.76(d,j=14.9hz,1h),2.64(s,3h),2.25
–
2.17(m,1h),2.17
–
2.09(m,2h),2.09
–
2.01(m,2h),1.89(d,j=13.0hz,3h),1.83
–
1.75(m,2h),1.71
–
1.56(m,5h),1.52(s,3h),1.45(s,9h),1.35(s,3h),1.31
–
1.23(m,5h),1.21
–
1.01(m,6h),0.94(d,j=6.5hz,3h),0.79(s,3h),0.68(s,3h).
13
c nmr(126mhz,cdcl3)δ172.83,169.64,162.91,154.72,149.23,124.00,121.19,119.28,79.67,56.87,55.81,49.12,46.58,42.31(2c),39.73,38.56,36.34,35.50,33.78,33.75,32.23,31.93,31.79,31.77,31.58(2c),28.43(3c),28.24(2c),24.18,21.63,21.14,21.00,18.44,11.91.mp:104-105℃。hrms(esi)for c
39
h
60
n4o4[m na]
:calcd 671.4507,found 671.4548.
[0505]
化合物q37,白色固体,产率90%。1h nmr(400mhz,cdcl3)δ7.86(s,1h),5.74(d,j=3.0hz,1h),3.64(t,j=8.5hz,4h),3.60(d,j=4.0hz,2h),3.46(d,j=4.2hz,2h),2.76(t,j=11.6hz,1h),2.63(s,3h),2.42
–
2.32(m,1h),2.25
–
2.18(m,1h),2.16
–
2.08(m,2h),2.03(t,j=6.0hz,1h),1.95
–
1.84(m,1h),1.82
–
1.73(m,1h),1.71
–
1.54(m,4h),1.50(s,3h),1.47
–
1.39(m,1h),1.33(s,3h),1.31
–
1.00(m,7h),0.95(d,j=6.4hz,3h),0.77(s,3h),0.68(s,3h).
13
c nmr(101mhz,cdcl3)δ172.30,169.61,162.88,149.22,124.00,121.20,
[m na]
:calcd 613.4088,found 613.4071.
[0510]
实施例24化合物q44的制备
[0511]
同实施例19,化合物q7(500mg,1.2mmol)、甲酸乙酯(30ml)、nah(288mg,12.0mmol)反应得淡黄色油状物q24。
[0512]
之后化合物q24(前一步油状物)于100ml单口烧瓶,加入乙醇(30ml),几滴水,盐酸苯肼(520mg,3.6mmol),100℃加热回流3小时,tlc检测原料反应完全,加水(20ml)和乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q44(白色固体570mg,两步产率90%)。
13
c nmr(126mhz,cdcl3)δ174.34,151.33,145.72,142.36,137.66,128.93,128.88(2c),128.55(2c),120.74,114.48,60.19,56.91,55.76,49.60,42.31,39.76,38.52,36.96,35.38,33.40,32.27,32.21,31.44,31.42,31.33,31.02,28.17,24.21,21.30,21.04,18.35,14.28,11.90.
[0513]
实施例25化合物q45的制备
[0514]
类似于q26的合成,化合物q44(114mg,0.22mmol)、氢氧化锂(160mg,6.6mmol)、无水乙醇(10ml)室温反应得到化合物q45(白色固体110mg,产率99%)。1h nmr(500mhz,cdcl3)δ7.47
–
7.34(m,6h),5.67(d,j=3.2hz,1h),2.75(d,j=14.6hz,1h),2.42
–
2.29(m,1h),2.26
–
2.20(m,1h),2.19(d,j=14.7hz,1h),2.15
–
2.06(m,2h),2.02(d,j=13.7hz,1h),1.90
–
1.75(m,2h),1.71
–
1.32(m,8h),1.29(d,j=4.2hz,3h),1.26
–
1.16(m,3h),1.13(s,3h),1.11
–
1.00(m,3h),0.95(s,1h),0.93(s,3h),0.70(s,3h).
[0515]
实施例26化合物q46的制备
[0516]
类似于化合物q37的合成,将化合物q45(110mg,0.22mmol)与edci(84.3mg,0.44mmol)、hobt(59.4mg,0.44mmol)、dmap(119.6mg,0.66mmol)、吗啡啉(0.04ml,0.44mmol)反应,得到化合物q46(白色固体122.7mg,产率98%)。1h nmr(400mhz,cdcl3)δ7.48
–
7.32(m,6h),5.67(d,j=3.2hz,1h),3.64(d,j=11.8hz,4h),3.61(d,j=4.3hz,2h),3.46(d,j=4.3hz,2h),2.75(d,j=14.6hz,1h),2.41
–
2.31(m,1h),2.25
–
2.15(m,2h),2.15
–
2.01(m,2h),1.94
–
1.85(m,1h),1.80(dd,j=11.8,4.3hz,1h),1.73
–
1.31(m,9h),1.29(s,3h),1.26
–
1.17(m,2h),1.13(s,3h),1.10
–
1.01(m,2h),0.96(d,j=6.4hz,3h),0.93(s,3h),0.68(d,j=14.2hz,3h).
13
c nmr(101mhz,cdcl3)δ172.34,151.31,145.73,142.35,137.65,128.95,128.88(2c),128.57(2c),120.75,114.46,66.97,66.70,56.89,55.80,49.58,46.10,42.33,41.88,39.76,38.51,36.95,35.66,33.40,32.27,32.20,31.43,31.42,31.35,30.10,28.27,24.24,21.30,21.03,18.57,11.92.mp:219-220℃.hrms(esi)for c
37
h
51
n3o2[m h]
:calcd 570.4054,found 570.4009.
[0517]
实施例27化合物q47的制备
[0518]
化合物q44(300mg,0.57mmol)、nhpi(186.0mg,1.14mmol)于单口烧瓶,加入丙酮(20ml)搅拌溶清,加入冰醋酸(0.033ml,0.57mmol)、重铬酸钠(205.2mg,0.69mmol),50℃保温2小时,tlc检测原料反应完全后,加水(20ml)和乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(20ml
×
2)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=5:1)得到化合物q47(白色固体216.3mg,产率70%)。
13
c nmr(126mhz,cdcl3)δ202.18,175.90,174.18,143.69,141.78,
137.66,129.31,128.82(2c),128.62(2c),125.72,113.53,60.18,54.51,50.25,49.65,45.04,43.18,40.47,38.70,37.97,35.27,32.24,31.32,31.18,31.01,30.69,28.45,26.27,21.22,18.62,18.50,14.28,11.97.
[0519]
实施例28化合物q48的制备
[0520]
化合物q47(100mg,0.18mmol)于50ml单口烧瓶,加入20ml甲醇,冰浴下缓慢加入硼氢化钠(68.4mg,1.8mmol),室温搅拌2小时,tlc检测原料反应完全后,加水(20ml)和乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(20ml
×
2)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=3:1)得到化合物q48(白色固体58.8mg,产率60%)。
13
c nmr(126mhz,cdcl3)δ174.26,153.97,145.10,142.15,137.65,129.06,128.82(2c),128.63(2c),124.96,114.13,73.60,60.21,56.00,55.13,47.83,42.86,40.52,39.51,38.59,36.84,35.31,33.11,31.97,31.41,31.32,31.02,28.47,26.35,21.07,21.04,18.41,14.28,11.84.
[0521]
实施例29化合物q49、q50的制备
[0522]
化合物q48(29mg,0.053mmol)、无水四氢呋喃(6ml)于单口烧瓶,氮气保护,搅拌溶清,冰浴下滴入2m格式试剂(0.5ml,1mmol),转移至室温搅拌2小时,tlc检测原料反应完全后,加水(8ml)和乙酸乙酯(10ml)萃取分液,水相再用乙酸乙酯(5ml
×
2)萃取,合并有机相。有机相分别用水(10ml
×
3)、饱和氯化钠溶液(8ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=1:1)得到化合物。
[0523]
化合物q49,白色固体28mg,产率95%。1h nmr(400mhz,cdcl3)δ7.49
–
7.33(m,6h),5.60(d,j=23.6hz,1h),3.95(d,j=5.4hz,1h),2.76(d,j=14.6hz,1h),2.21
–
2.12(m,1h),2.09
–
2.02(m,1h),1.95
–
1.65(m,4h),1.55(d,j=9.1hz,2h),1.49(s,1h),1.48
–
1.42(m,5h),1.41
–
1.37(m,2h),1.34(s,1h),1.31(s,3h),1.25(s,3h),1.18(s,3h),1.15
–
1.07(m,2h),1.04(s,1h),0.98(d,j=6.1hz,3h),0.94(d,j=12.2hz,2h),0.87(s,1h),0.85(s,4h),0.82
–
0.79(m,1h),0.69(s,3h).
13
c nmr(126mhz,cdcl3)δ154.11,145.11,142.15,137.67,129.07,128.82(2c),128.64(2c),124.85,114.16,74.72,73.71,56.00,55.10,47.85,42.84,40.58,39.51,38.61,36.86,36.08,34.26,33.11,31.98,31.41,31.18,30.95,29.27,28.60,26.40,21.06,18.92,11.82,7.81,7.72.mp:211-212℃.hrms(esi)for c
37
h
54
n2o2[m h]
:calcd 559.4258,found 559.4271.
[0524]
化合物q50,白色固体28mg,产率95%。1h nmr(500mhz,cdcl3)δ7.45
–
7.33(m,6h),5.91
–
5.80(m,2h),5.56(d,j=2.5hz,1h),5.12(t,j=13.3hz,4h),3.94(dd,j=8.1,2.3hz,1h),2.75(d,j=14.7hz,1h),2.22
–
2.17(m,4h),2.16(s,1h),2.06(dd,j=9.5,3.2hz,1h),2.03(s,1h),1.93
–
1.88(m,1h),1.86
–
1.80(m,1h),1.68
–
1.61(m,2h),1.57
–
1.34(m,7h),1.30(s,3h),1.24(t,j=7.2hz,2h),1.18(s,3h),1.14
–
1.08(m,2h),0.98(s,3h),0.94(d,j=6.5hz,3h),0.70(s,3h).
13
c nmr(101mhz,cdcl3)δ154.01,145.13,142.13,137.66,133.82(2c),133.79(2c),129.08,128.83(2c),128.64(2c),124.94,118.65,118.58,114.16,73.62,56.01,55.11,47.84,43.83,43.61,42.83,40.53,39.50,38.60,36.85,36.06,35.42,33.11,31.97,31.41,29.27,28.62,26.40,21.05,18.90,11.82.mp:188-189℃.hrms(esi)for c
39
h
54
n2o2[m h]
:calcd 583.4258,found 583.4285.
[0525]
实施例30化合物q51的制备
[0526]
类似于化合物q37的合成,化合物q26(500mg,1.18mmol)、edci(450.8mg,2.36mmol)、hobt(318.6mg,2.36mmol)、dmap(783.5mg,4.72mmol)、吗啡啉(0.21ml,2.36mmol)反应得到化合物q51(白色固体112.7mg,产率90%)。1h nmr(500mhz,cdcl3)δ7.26(s,1h),5.75(dd,j=5.2,2.2hz,1h),3.72
–
3.65(m,4h),3.65
–
3.59(m,2h),3.49
–
3.43(m,2h),2.75(dd,j=24.6,10.8hz,1h),2.40
–
2.34(m,1h),2.25
–
2.18(m,1h),2.17
–
2.10(m,2h),2.06
–
1.87(m,2h),1.81
–
1.56(m,5h),1.50(s,3h),1.36(d,j=7.6hz,3h),1.32
–
1.03(m,9h),0.97(t,j=10.7hz,3h),0.85(s,3h),0.70(s,3h).
13
c nmr(126mhz,cdcl3)δ172.37,149.89,120.92(2c),112.93(2c),66.97,66.70,56.92,55.80,49.34,46.11,42.31,41.89,39.78,38.86,35.67,35.51,33.35,32.67,32.41,32.08,31.62,31.36,30.13,28.28,24.25,21.29,21.06,18.56,11.91.mp:200-201℃.hrms(esi)for c
31
h
47
n3o2[m h]
:calcd 494.3741,found 494.3741.
[0527]
实施例31化合物q52~q55的制备
[0528]
化合物q51(50mg,0.1mmol)、dmap(3.5mg,0.02mmol)于单口烧瓶,加入thf(10ml)、不同酸酐(0.03ml,0.3mmol),60℃加热搅拌2小时,可见体系逐渐溶清,tlc检测原料反应完全,恢复至室温,加水(10ml)和乙酸乙酯(10ml)萃取分液,水相再用乙酸乙酯(10ml
×
3)萃取,合并有机相。有机相分别用水(10ml
×
3)、饱和氯化钠溶液(10ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物。
[0529]
化合物q52,白色固体49mg,产率95%。1h nmr(400mhz,cdcl3)δ7.88(dd,j=12.7,4.9hz,1h),5.74(dd,j=5.1,2.1hz,1h),3.66(dd,j=9.1,4.5hz,4h),3.60(d,j=5.0hz,2h),3.48
–
3.42(m,2h),3.10(q,j=7.4hz,2h),2.75(d,j=14.9hz,1h),2.42
–
2.29(m,1h),2.27
–
2.07(m,4h),2.07
–
1.97(m,1h),1.92
–
1.81(m,1h),1.82
–
1.54(m,5h),1.50(s,3h),1.47
–
1.37(m,2h),1.33(s,3h),1.23(dd,j=14.1,6.6hz,4h),1.19
–
1.02(m,5h),0.95(d,j=6.5hz,3h),0.78(s,3h),0.68(s,3h).
13
c nmr(101mhz,cdcl3)δ173.05,172.39,162.62,149.29,124.08,121.17,118.85,66.95,66.69,56.84,55.79,49.11,46.10,42.31,41.89,39.71,38.57,36.32,35.66,33.77,32.25,31.94,31.88,31.58,31.34,30.11,28.25,27.31,24.22,21.12,21.02,18.54,11.92,8.58.mp:160-161℃。hrms(esi)for c
34
h
51
n3o3[m na]
:calcd 572.3823,found 572.3842.
[0530]
化合物q53,白色固体49mg,产率95%。1h nmr(400mhz,cdcl3)δ7.87(d,j=1.2hz,1h),5.74(dd,j=5.1,2.1hz,1h),3.66(dd,j=8.7,4.2hz,4h),3.61(d,j=4.9hz,2h),3.50
–
3.41(m,2h),3.08
–
3.01(m,2h),2.75(d,j=14.9hz,1h),2.36
–
2.26(m,1h),2.14
–
1.90(m,5h),1.89
–
1.79(m,1h),1.78(dd,j=14.8,7.4hz,3h),1.71
–
1.54(m,4h),1.51(s,3h),1.43
–
1.33(m,2h),1.34(s,3h),1.28
–
1.05(m,6h),1.01(t,j=7.4hz,3h),0.95(d,j=6.4hz,3h),0.78(s,3h),0.68(s,3h).
13
c nmr(101mhz,cdcl3)δ172.33,172.24,162.57,149.32,124.03,121.16,118.87,66.96,66.70,56.85,55.81,49.11,46.09,42.31,41.88,39.71,38.57,36.32,35.66,35.61,33.77,32.26,31.94,31.88,31.59,31.34,30.11,28.26,24.22,21.13,21.02,18.55,18.05,13.81,11.92.mp:170-171℃。hrms(esi)for c
35
h
53
n3o3[m na]
:calcd 586.3979,found 586.3991.
[0531]
化合物q54,白色固体49mg,产率95%。1h nmr(500mhz,cdcl3)δ7.86(s,1h),5.75(d,j=3.0hz,1h),3.91
–
3.80(m,1h),3.66(t,j=9.4hz,4h),3.62(d,j=4.8hz,2h),3.47
(d,j=4.4hz,2h),2.76(d,j=14.9hz,1h),2.41
–
2.32(m,1h),2.26
–
2.18(m,1h),2.18
–
2.09(m,2h),2.08
–
2.00(m,1h),1.95
–
1.84(m,1h),1.79
–
1.69(m,1h),1.70
–
1.55(m,4h),1.52(s,3h),1.50
–
1.39(m,2h),1.35(s,3h),1.34
–
1.30(m,1h),1.27(d,j=6.9hz,6h),1.23
–
1.01(m,6h),0.95(d,j=11.6hz,3h),0.79(s,3h),0.68(s,3h).
13
c nmr(126mhz,cdcl3)δ176.20,172.34,162.51,149.32,124.21,121.16,118.83,66.97,66.70,56.86,55.83,49.14,46.11,42.32,41.90,39.73,38.60,36.31,35.67,33.74,32.30,31.95,31.91,31.60,31.35,30.12,28.26,24.22,21.14,21.04,19.35,18.98,18.89,18.55,11.93.mp:198-199℃。hrms(esi)for c
35
h
53
n3o3[m na]
:calcd 586.3979,found 586.3986.
[0532]
化合物q55,白色固体49mg,产率95%。1h nmr(500mhz,cdcl3)δ7.89(s,1h),6.13(s,1h),5.80(s,1h),5.75(d,j=3.2hz,1h),3.67(d,j=3.8hz,4h),3.62(d,j=4.5hz,2h),3.46(s,2h),2.77(dd,j=14.7,9.6hz,1h),2.65(s,1h),2.40
–
2.31(m,1h),2.26
–
2.20(m,1h),2.16(s,3h),2.12(d,j=4.8hz,1h),2.05(d,j=12.2hz,1h),1.94
–
1.87(m,1h),1.79(s,1h),1.68
–
1.58(m,5h),1.52(s,3h),1.50
–
1.43(s,2h),1.36(s,3h),1.29
–
1.16(m,7h),0.96(d,j=6.3hz,3h),0.79(s,3h),0.70(s,3h).
13
c nmr(126mhz,cdcl3)δ172.32,167.15,163.20,149.23,137.87,127.18,125.97,121.22,118.74,66.97,66.70,56.85,55.83,49.12,46.11,42.33,41.90,39.72,38.60,36.35,35.67,33.79,32.21,31.94,31.86,31.60,31.35,30.13,28.26,24.22,21.15,21.04,20.42,18.55,11.93.mp:140-141℃。hrms(esi)for c
35
h
51
n3o3[m na]
:calcd 584.3823,found 584.3815.
[0533]
实施例32化合物q56的制备
[0534]
类似于化合物q49的合成,化合物q25(50mg,0.055mmol)、无水四氢呋喃(6ml)、2m乙基氯化镁(0.5ml,1.1mmol)反应得到化合物q56(50mg白色固体,产率98%)。1h nmr(500mhz,cdcl3)δ7.26(s,1h),5.75(dd,j=5.2,2.2hz,1h),2.72(d,j=14.5hz,1h),2.18
–
2.02(m,3h),1.91
–
1.84(m,1h),1.74
–
1.52(m,5h),1.50(s,3h),1.48
–
1.41(m,5h),1.39(s,1h),1.37(s,3h),1.35
–
0.98(m,11h),0.94(t,j=9.3hz,3h),0.87(d,j=3.5hz,2h),0.86(s,1h),0.85(d,j=3.5hz,3h),0.84(d,j=3.7hz,1h),0.69(s,3h).
13
c nmr(126mhz,cdcl3)δ149.96,120.90,112.90,74.78,73.24,62.97,56.96,55.75,49.39,42.26,39.79,38.87,36.13,35.50,34.22,33.92,33.34,32.68,32.39,32.11,31.64,31.18,30.94,30.35,29.70,29.26,29.15,28.30,24.25,21.29,21.07,18.85,11.87,10.02,7.80,7.72.mp:210-211℃.hrms(esi)for c
31
h
51
n2o[m h]
:calcd 467.3996,found 467.4018.
[0535]
实施例33化合物q57的制备
[0536]
化合物q7(414mg,1mmol)、硫(320mg,10mmol)、乙二胺(0.67ml,10mmol)于100ml单口烧瓶内,加入吗啡啉(40ml)搅拌均匀,120℃加热回流5小时,tlc检测原料反应完全后,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
2)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=20:1)得到化合物q57(360mg白色固体,产率80%)。
13
c nmr(126mhz,cdcl3)δ174.74,159.63,151.19,148.86,142.48,141.15,120.73,56.83,55.76,51.48,48.88,43.86,42.38,41.25,39.69,37.65,35.38,33.52,31.89,31.72,31.41,31.05,31.01,28.16,24.17,21.07,20.39,18.31,11.91.
[0537]
实施例34化合物q58的制备
[0538]
化合物q57(360mg,0.8mmol)、氢氧化锂(576mg,24mmol)于100ml单口烧瓶,加入水乙醇混合溶液,室温搅拌8小时,tlc检测原料反应完全,加2m稀盐酸水溶液调节ph约5,加入乙酸乙酯(30ml),萃取分液,水相再用乙酸乙酯(30ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q58(白色固体349mg,产率99%)。1h nmr(400mhz,cdcl3)δ8.45(s,1h),8.28(s,1h),5.79(s,1h),3.09(d,j=15.6hz,1h),2.63(d,j=15.5hz,1h),2.45
–
2.35(m,1h),2.33
–
2.24(m,1h),2.18(d,j=17.9hz,1h),2.07(d,j=12.5hz,1h),1.95
–
1.78(m,2h),1.71(dd,j=28.3,10.8hz,3h),1.61(s,3h),1.58
–
1.40(m,3h),1.33(s,3h),1.29
–
1.19(m,3h),1.19
–
1.05(m,4h),0.96(d,j=6.1hz,3h),0.78(s,3h),0.70(s,3h).mp:265-266℃.hrms(esi)for c
28
h
41
n2o2[m h]
:calcd 437.3163,found437.3190.
[0539]
实施例35化合物q59的制备
[0540]
类似于化合物q37的合成,化合物q58(349mg,0.8mmol)、edci(306.7mg,1.6mmol)、hobt(243.2mg,1.6mmol)、dmap(531.2mg,3.2mmol)、吗啡啉(0.14ml,1.6mmol)反应,得到化合物q59(白色固体364mg,产率90%)。1h nmr(500mhz,cdcl3)δ8.40(s,1h),8.31
–
8.18(m,1h),5.76(d,j=2.2hz,1h),3.65(s,4h),3.59(s,2h),3.45(d,j=3.1hz,2h),3.06(d,j=15.6hz,1h),2.62(d,j=15.4hz,1h),2.39
–
2.32(m,1h),2.22
–
2.14(m,2h),2.03(dd,j=15.7,6.3hz,1h),1.88(s,1h),1.79
–
1.63(m,4h),1.59(d,j=2.7hz,3h),1.45(dd,j=20.7,17.4hz,2h),1.31(s,3h),1.25
–
1.02(m,7h),1.00
–
0.89(m,3h),0.86
–
0.81(m,1h),0.77(s,3h),0.67(d,j=17.8hz,3h).
13
c nmr(126mhz,cdcl3)δ172.29,159.62,151.17,148.85,142.49,141.16,120.73,66.96,66.69,56.82,55.84,48.87,46.09,43.87,42.40,41.88,41.25,39.70,37.65,35.65,33.52,31.89,31.72,31.41,31.33,30.10,28.25,24.19,21.07,20.38,18.54,11.94.mp:151-152℃.hrms(esi)for c
32
h
47
n3o2[m h]
:calcd 506.3741,found 506.3762.
[0541]
实施例36化合物q60的制备
[0542]
类似于化合物q48的合成,化合物q59(364mg,0.72mmol)、nhpi(234.7mg,1.44mmol)、丙酮(20ml)、冰醋酸(0.042ml,0.72mmol)、重铬酸钠(256.9mg,0.864mmol)反应得到化合物q60(白色固体262mg,产率70%)。
13
c nmr(126mhz,cdcl3)δ201.73,173.43,172.25,157.30,149.65,143.15,141.97,125.51,66.97,66.69,54.58,50.27,49.61,46.12,45.16,43.30,42.33,42.17,41.91,39.55,38.69,35.56,32.46,31.38,30.38,30.10,28.57,26.31,21.33,18.71,17.66,12.04.
[0543]
实施例37化合物q61的制备
[0544]
类似于化合物q48的合成,化合物q60(100mg,0.18mmol)、20ml甲醇、硼氢化钠(68.4mg,1.8mmol)反应得到化合物q61(白色固体58.8mg,产率60%)。1h nmr(500mhz,cdcl3)δ8.50
–
8.36(m,1h),8.28(d,j=1.7hz,1h),5.71(d,j=2.4hz,1h),4.01(d,j=7.8hz,1h),3.70
–
3.63(m,4h),3.61(d,j=4.8hz,2h),3.50
–
3.43(m,2h),3.08(d,j=15.6hz,1h),2.61(d,j=15.6hz,1h),2.40
–
2.32(m,1h),2.25
–
2.18(m,1h),2.07(d,j=12.8hz,1h),1.99
–
1.92(m,1h),1.89
–
1.85(m,1h),1.82
–
1.69(m,3h),1.64(s,3h),1.54
–
1.43(m,4h),1.34(s,3h),1.28
–
1.21(m,3h),1.14
–
1.07(m,2h),0.97(d,j=6.5hz,3h),
0.83(s,3h),0.72(s,3h).
13
c nmr(126mhz,cdcl3)δ172.27,158.94,151.82,150.66,142.72,141.37,124.78,73.32,66.96,66.69,55.96,55.26,47.56,46.09,43.46,42.97,41.90,41.11,40.60,39.48,37.74,35.63,33.48,31.35(2c),30.14,28.57,26.33,21.15,20.11,18.60,11.90.mp:185-186℃.hrms(esi)for c
32
h
47
n3o3[m na]
:calcd 544.3510,found 544.3500.
[0545]
实施例38化合物q62的制备
[0546]
化合物q7(300mg,0.72mmol)、三溴吡啶鎓(278mg,0.87mmol)于100ml单口烧瓶,加入无水dcm(40ml),室温搅拌过夜,tlc检测原料反应完全后,加水(30ml)萃取分液,水相再用二氯甲烷(20ml
×
2)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=20:1)得到化合物q62(白色固体284mg,产率80%)。
13
c nmr(101mhz,cdcl3)δ209.96,174.74,147.98,120.90,56.62,55.68,51.54,50.42,48.50,44.08,43.74,42.38,39.51,38.86,35.35,31.82,31.56,31.03,30.95,30.84,28.37,28.13,24.10,21.24,19.17,18.30,11.93.
[0547]
实施例39化合物q63的制备
[0548]
化合物q62(100mg,0.2mmol)、硫脲(30.4mg,0.4mmol)、乙醇(25ml)于单口烧瓶,加热回流3小时,tlc检测原料反应完全后,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
2)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q63(白色固体56.4mg,产率60%)。
13
c nmr(126mhz,cdcl3)δ174.75,164.62,151.43,149.07,120.79,115.28,56.92,55.72,51.49,49.38,42.28,39.69,38.80,38.77,35.37,35.18,32.19,32.15,31.57,31.17,31.06,31.02,28.16,24.19,21.45,20.93,18.33,11.87.
[0549]
实施例40化合物q64的制备
[0550]
类似于q26的合成,化合物q63(56mg,0.12mmol)、氢氧化锂(87mg,3.6mmol)反应水解得到化合物q64(白色固体50mg,产率99%)。1h nmr(400mhz,dmso)δ11.99(s,1h),6.84(s,2h),5.70(s,1h),2.59(d,j=15.5hz,1h),2.27
–
2.18(m,1h),2.10
–
2.02(m,1h),2.07(d,j=21.3hz,1h),1.97(d,j=9.9hz,1h),1.81(s,1h),1.73
–
1.61(m,2h),1.58(d,j=15.5hz,1h),1.52
–
1.35(m,4h),1.30(s,3h),1.27(d,j=13.8hz,1h),1.23(s,3h),1.18(s,2h),1.12
–
1.02(m,3h),0.97(s,3h),0.89(d,j=5.5hz,3h),0.65(s,3h).mp:267-259℃。hrms(esi)for c
27
h
40
n2o2s[m h]
:calcd 457.2883,found 457.2889.
[0551]
实施例41化合物q65~q66的制备
[0552]
化合物q62(100mg,0.2mmol)、硫代乙酰胺(30.1mg,0.4mmol)、乙醇(25ml)于50ml单口烧瓶,加热回流3小时,tlc检测原料反应完全后,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
2)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后得到白色固体q65,直接后一步。
[0553]
类似于q26的合成,化合物q65、氢氧化锂(87mg,3.6mmol)、水乙醇混合溶液(20ml),反应水解得到化合物q66(白色固体40mg,两步产率50%)。1h nmr(400mhz,cdcl3)δ5.76(s,1h),2.83(d,j=15.3hz,1h),2.65(s,3h),2.53
–
2.20(m,3h),2.14(d,j=17.6hz,1h),2.04(d,j=12.1hz,1h),1.85(d,j=10.0hz,2h),1.77
–
1.52(m,4h),1.49(s,3h),1.40(s,1h),1.36(s,3h),1.32
–
1.02(m,7h),0.98(s,3h),0.95(d,j=5.7hz,3h),0.90
–
0.72(m,
1h),0.70(s,3h).
13
c nmr(101mhz,cdcl3)δ179.41,162.53,155.82,148.93,125.02,121.08,56.90,55.74,49.34,42.30,39.68,38.93,38.70,35.34,35.24,32.52,32.13,31.57(2c),31.09,30.85,28.15,24.20,21.28,20.98,19.02,18.32,11.89.mp:250-251℃。hrms(esi)for c
28
h
41
no2s[m h]
:calcd 456.2931,found 456.2919.
[0554]
实施例42化合物q67的制备
[0555]
类似于q26的合成,化合物q7(1g,2.41mmol)、氢氧化锂(1.73g,72.4mmol)、水乙醇混合溶液(100ml)反应水解得到化合物q67(白色固体964mg,产率99%)。
13
c nmr(101mhz,cdcl3)δ217.14,180.41,149.75,119.91,56.73,55.73,48.85,48.68,42.43,39.71,37.05,35.30,33.71,32.06,31.69,31.19,31.05,30.74,30.23,28.13,27.23,24.15,21.27,19.34,18.28,11.94.
[0556]
实施例43化合物q68的制备
[0557]
类似于化合物q37的合成,化合物q67(964mg,2.41mmol)、edci(924mg,4.82mmol)、hobt(733.4mg,4.82mmol)、dmap(1.6g,9.64mmol)、吗啡啉(0.42ml,4.82mmol)反应,得到化合物q68(白色固体1.02g,产率90%)。
13
c nmr(101mhz,cdcl3)δ216.80,172.27,149.74,119.90,66.94,66.68,56.71,55.83,48.85,48.64,46.07,42.42,41.86,39.70,37.04,35.64,33.70,32.07,31.68,31.30,31.18,30.21,30.10,28.24,27.23,24.17,21.26,19.32,18.52,11.94.
[0558]
实施例44化合物q69的制备
[0559]
化合物q68(100mg,0.21mmol)、叔丁醇钾(100mg,1.05mmol)于50ml单口烧瓶,加入叔丁醇(10ml)溶解,35℃水浴三十分钟,缓慢滴入亚硝酸异戊酯(0.13ml,1.05mmol),室温搅拌5小时,tlc检测原料反应完全后,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q69(白色固体90mg,产率86%)。
13
c nmr(101mhz,cdcl3)δ201.71,172.61,153.22,147.89,121.41,66.95,66.69,56.56,55.77,48.65,48.02,46.14,42.37,41.95,39.53,35.95,35.71,35.66,31.65,31.41,31.36,30.52,30.10,28.21,27.16,24.17,21.25,20.95,18.54,11.90.
[0560]
实施例45化合物q70的制备
[0561]
化合物q69(90mg,0.18mmol)、盐酸羟胺(37.5mg,0.54mmol)于25ml单口烧瓶,加入吡啶(5ml),100℃加热回流3小时,tlc检测原料反应完全后,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用稀盐酸(20ml)、水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q70(白色固体83mg,产率90%)。1h nmr(400mhz,cdcl3)δ12.88(s,1h),10.76(s,1h),5.65(s,1h),3.67(t,j=7.5hz,4h),3.63(s,2h),3.48(d,j=3.7hz,2h),2.38(dd,j=17.7,7.1hz,1h),2.28
–
2.19(m,1h),2.02(d,j=12.9hz,2h),1.88(d,j=17.3hz,1h),1.73(d,j=3.3hz,1h),1.63
–
1.56(m,2h),1.43(s,3h),1.34
–
1.28(m,3h),1.21(s,3h),1.17
–
1.07(m,4h),0.96(d,j=6.1hz,2h),0.88
–
0.85(m,6h),0.84(s,3h),0.82
–
0.81(m,1h),0.67(s,3h).
[0562]
实施例46化合物q71的制备
[0563]
化合物q70(83mg,0.162mmol)、氢氧化钾(2小片)、乙二醇(10ml)、二氧六环(5ml)
于50ml单口烧瓶,130℃加热回流5小时,tlc检测原料反应完全后,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用稀盐酸(20ml)、水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q71(白色固体62.11mg,产率90%)。1h nmr(400mhz,cdcl3)δ5.83(d,j=3.2hz,1h),3.23(d,j=15.5hz,1h),2.45
–
2.36(m,1h),2.34
–
2.25(m,2h),2.24
–
2.01(m,2h),1.97
–
1.67(m,4h),1.63(s,3h),1.59
–
1.47(m,3h),1.42(d,j=12.1hz,3h),1.38
–
1.19(m,5h),1.19
–
1.02(m,3h),0.95(d,j=6.4hz,3h),0.79(s,3h),0.70(s,3h).
13
c nmr(101mhz,cdcl3)δ180.05,159.78,150.69,146.75,122.97,56.65,55.69,48.95,42.26,39.50,38.80,35.30,35.18,33.45,32.35,31.73,31.50,31.34,30.95,30.72,28.11,24.15,21.12,20.91,18.27,11.89.mp:210-211℃。hrms(esi)for c
26
h
38
n2o3[m na]
:calcd 449.2775,found 449.2778.
[0564]
实施例47化合物q72的制备
[0565]
类似于化合物q27的合成,化合物q71(42mg,0.1mmol)、dmap(3.5mg,0.02mmol)、乙酸酐(0.03ml,0.3mmol)加热反应得到化合物q72(45mg,95%)。1h nmr(500mhz,cdcl3)δ5.83(dd,j=5.3,2.3hz,1h),3.67(d,j=4.3hz,4h),3.62(d,j=5.0hz,2h),3.50
–
3.43(m,2h),3.23(d,j=15.5hz,1h),2.40
–
2.83(m,1h),2.29(d,j=15.5hz,1h),2.26
–
2.14(m,2h),2.08(dd,j=9.4,3.3hz,1h),1.94
–
1.87(m,1h),1.85
–
1.75(m,1h),1.74
–
1.64(m,2h),1.62(s,3h),1.60
–
1.46(m,3h),1.43(s,3h),1.34(dt,j=13.5,9.1hz,2h),1.29
–
1.20(m,3h),1.20
–
1.02(m,3h),0.96(d,j=6.5hz,3h),0.78(s,3h),0.70(s,3h).
13
c nmr(126mhz,cdcl3)δ172.25,159.78,150.69,146.71,122.98,66.97,66.70,56.65,55.82,48.95,46.08,42.27,41.89,39.52,38.80,35.65,35.18,33.45,32.35,31.73,31.50,31.34,31.29,30.11,28.22,24.18,21.12,20.91,18.53,11.91.mp:250-251℃。hrms(esi)for c
30
h
45
n3o3[m na]
:calcd 518.3352,found 518.3359.
[0566]
实施例48化合物q73~q74的制备
[0567]
化合物q68(50mg,0.11mmol)于50ml单口烧瓶,加入无水四氢呋喃(20ml)至溶清,加入nah(28.8mg,1.2mmol),草酸二乙酯(0.03ml,0.22mmol)氮气保护,室温搅拌20分钟,可见体系变橙黄色,tlc检测原料反应完全,加水(10ml)和乙酸乙酯(10ml)萃取分液,水相再用乙酸乙酯(10ml)萃取一次,合并有机相。有机相分别用水(10ml
×
3)、饱和氯化钠溶液(10ml
×
2)洗涤,无水na2so4干燥,减压浓缩后得淡黄色固体q73,该化合物不稳定,直接后一步。
[0568]
化合物q73(前一步固体)于50ml单口烧瓶,加入乙酸(20ml),乙酸钾(22mg,0.22mmol),水合肼(0.18ml,3.6mmol),130℃加热回流5小时,tlc检测原料反应完全,加2m氢氧化钠溶液(60ml)搅拌10分钟,碳酸氢钠饱和水溶液(30ml),20ml乙酸乙酯,萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q74(白色固体56mg,两步产率90%)。1h nmr(500mhz,cdcl3)δ5.75(dd,j=5.2,2.2hz,1h),4.44
–
4.27(m,2h),3.70
–
3.63(m,4h),3.61(d,j=5.2hz,2h),3.51
–
3.42(m,2h),3.19(d,j=15.7hz,1h),2.43
–
2.29(m,1h),2.26
–
2.16(m,2h),2.13(dt,j=17.7,5.4hz,1h),2.04(dd,j=9.8,2.8hz,1h),1.92
–
1.82(m,1h),1.81
–
1.74(m,1h),1.71
–
1.54(m,4h),1.51(s,
3h),1.50
–
1.40(m,2h),1.39(s,1h),1.37(s,2h),1.36(s,3h),1.33
–
1.01(m,7h),0.95(d,j=6.5hz,3h),0.85(s,3h),0.69(s,3h).
13
c nmr(126mhz,cdcl3)δ172.42,161.30,149.21(2c),121.07(2c),117.66,66.97,66.70,60.69,56.90,55.79,49.37,46.12,42.31,41.91,39.75,38.48,35.67,35.66,33.20,32.91,32.35,32.05,31.59,31.37,30.12,28.26,24.24,21.42,21.07,18.56,14.38,11.92.mp:144-145℃。hrms(esi)for c
34
h
51
n3o4[m na]
:calcd 588.3772,found 588.3798.
[0569]
实施例49化合物q75的制备
[0570]
等同于实施例48中化合物q73的合成,化合物q68(50mg,0.11mmol)、nah(28.8mg,1.2mmol)、草酸二乙酯(0.03ml,0.22mmol)反应得淡黄色固体q73。
[0571]
化合物q73(前一步固体)、盐酸羟胺(23mg,0.33mmol)于50ml单口烧瓶,加入乙醇水混合溶液(20ml),100℃加热回流3小时,tlc检测原料反应完全,恢复至室温,加水(20ml)和乙酸乙酯(20ml)萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q75(42mg,90%)。1h nmr(500mhz,cdcl3)δ5.83
–
5.67(m,1h),4.48
–
4.33(m,2h),3.71
–
3.62(m,4h),3.59(d,j=4.7hz,2h),3.45(d,j=4.4hz,2h),2.97(t,j=17.1hz,1h),2.38
–
2.31(m,1h),2.24
–
2.19(m,1h),2.16(dd,j=13.9,5.0hz,1h),2.10(dd,j=14.7,9.3hz,1h),2.02(d,j=12.5hz,1h),1.91
–
1.83(m,1h),1.81
–
1.74(m,1h),1.73
–
1.49(m,6h),1.47(d,j=9.4hz,3h),1.39(dd,j=8.2,6.0hz,5h),1.34
–
1.26(m,3h),1.24
–
0.98(m,7h),0.94(d,j=3.5hz,1h),0.93(s,3h),0.68(s,3h).
13
c nmr(101mhz,cdcl3)δ175.71,172.27,160.90,153.61,147.52,122.23,110.80,66.93,66.67,61.69,56.76,55.74,49.36,46.06,42.25,41.86,39.57,38.60,36.98,35.60,32.33,31.96,31.46,31.29,30.50,30.04,29.82,28.21,24.20,21.72,20.93,18.54,14.18,11.87.mp:140-141℃。hrms(esi)for c
34
h
50
n2o5[m na]
:calcd 589.3612,found 589.3638.
[0572]
实施例50化合物q76的制备
[0573]
同实施例19,化合物q7(1.00g,2.41mmol)、甲酸乙酯(30ml)、nah(578mg,24.1mmol)反应得淡黄色油状物q24。
[0574]
化合物q24(前一步油状物)、盐酸羟胺(502mg,7.23mmol)于100ml单口烧瓶,加入乙醇水混合溶液(50ml),100℃加热回流3小时,tlc检测原料反应完全,恢复至室温,加水(30ml)和乙酸乙酯(30ml)萃取分液,水相再用乙酸乙酯(30ml
×
3)萃取,合并有机相。有机相分别用水(30ml
×
3)、饱和氯化钠溶液(30ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q76(952mg,90%)。1h nmr(500mhz,cdcl3)δ8.02(s,1h),5.77(d,j=3.4hz,1h),3.84(s,1h),3.66(s,3h),2.57(d,j=14.9hz,1h),2.39
–
2.31(m,1h),2.27
–
2.19(m,1h),2.14
–
2.10(m,1h),2.05(d,j=12.6hz,1h),1.92
–
1.85(m,1h),1.83
–
1.75(m,1h),1.67
–
1.61(m,3h),1.54(dd,j=10.7,6.7hz,2h),1.48(s,3h),1.39(s,3h),1.34
–
1.30(m,2h),1.26(d,j=8.4hz,3h),1.18(s,1h),0.94(s,3h),0.93(s,3h),0.79(s,1h),0.69(s,3h),0.68(s,1h).
[0575]
实施例51化合物q77~q79的制备
[0576]
类似于化合物q48的合成,化合物q76(250mg,0.57mmol)、nhpi(186.0mg,1.14mmol)、20ml丙酮、冰醋酸(0.033ml,0.57mmol)、重铬酸钠(205.2mg,0.69mmol)反应得
到化合物q77(白色固体182mg,产率70%)。
[0577]
类似于化合物q49的合成,化合物q77(82mg,0.18mmol)、20ml甲醇、硼氢化钠(68.4mg,1.8mmol)反应还原得到化合物q78(白色固体50mg,产率60%)。
[0578]
类似于化合物q49的合成,化合物q78(50mg,0.11mmol)、无水四氢呋喃(6ml)、2m乙基氯化镁试剂(1ml,2.2mmol)反应得到化合物q79。1h nmr(400mhz,cdcl3)δ8.06(d,j=24.1hz,1h),5.70(t,j=10.3hz,1h),3.97(t,j=10.7hz,1h),2.59(d,j=15.0hz,1h),2.12(d,j=15.1hz,1h),2.04(d,j=5.3hz,1h),1.93(dd,j=12.1,7.8hz,1h),1.87
–
1.80(m,1h),1.68
–
1.62(m,2h),1.60
–
1.55(m,2h),1.53(s,3h),1.50(s,1h),1.48
–
1.43(m,5h),1.42(s,3h),1.39
–
1.34(m,2h),1.34
–
1.28(m,2h),1.26(d,j=7.2hz,3h),1.20(d,j=4.6hz,1h),1.19
–
1.13(m,2h),1.11
–
1.03(m,2h),1.01(s,3h),0.96(d,j=6.4hz,3h),0.86(d,j=2.4hz,3h),0.72(s,3h).
13
c nmr(101mhz,cdcl3)δ172.01,151.16,149.63,125.94,108.56,74.73,73.38,55.95,55.09,47.79,42.80,40.71,39.41,38.97,36.68,36.06,34.24,32.04,31.18,30.95,30.31,29.91,29.26,28.55,26.38,21.47,21.04,18.89,11.78,7.80,7.71.mp:191-192℃.hrms(esi)for c
31
h
49
no3[m h]
:calcd 484.3785,found 484.3811.
[0579]
实施例52化合物q80~q81的制备
[0580]
类似于q24的合成,化合物q68(100mg,0.21mmol)、20ml甲酸乙酯、nah(51mg,2.1mmol)反应后得淡黄色油状物q80。
[0581]
化合物q80(前一步油状物)于50ml单口烧瓶,加入20ml乙醇,几滴水,邻氟盐酸苯肼(80mg,0.63mmol),100℃加热回流3小时,tlc检测原料反应完全,加10ml水,20ml乙酸乙酯,萃取分液,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q81(白色固体111mg,两步产率90%)。1h nmr(500mhz,cdcl3)δ7.52
–
7.37(m,3h),7.21(dd,j=16.1,8.4hz,2h),5.68(d,j=3.4hz,1h),3.71
–
3.63(m,4h),3.61(d,j=5.0hz,2h),3.50
–
3.41(m,2h),2.75(d,j=14.6hz,1h),2.41
–
2.31(m,1h),2.26
–
2.14(m,2h),2.14
–
2.02(m,2h),1.94
–
1.83(m,1h),1.83
–
1.75(m,1h),1.71
–
1.41(m,6h),1.41
–
0.99(m,14h),0.97(d,j=3.8hz,2h),0.95(d,j=6.1hz,3h),0.70(s,3h).
13
c nmr(126mhz,cdcl3)δ172.34(2c),138.68(2c),131.19,131.12,123.99,120.80(3c),114.67(2c),66.96,66.69,56.88,55.80,49.58(2c),46.10,42.32,41.89,39.75,38.53,36.73,35.66,33.37,32.19,31.44(2c),31.35(2c),30.11,28.27,24.23,21.03,18.56,11.92.mp:250-251℃。hrms(esi)for c
37
h
50
fn3o2[m h]
:calcd 588.3960,found 588.3952.
[0582]
实施例53化合物q82的制备
[0583]
化合物q6(1g,2.35mmol)、钯碳(500mg)、30ml乙酸乙酯置于高压釜,4兆帕条件下室温搅拌24小时,tlc检测原料反应完全,抽滤,滤饼用乙酸乙酯(10ml
×
3)洗,直接浓缩后硅胶柱层析(pe:ea=10:1)得到化合物q82(白色固体1g,两步产率99%)。
13
c nmr(126mhz,cdcl3)δ174.36,79.09,60.17,56.58,56.34,55.84,54.72,42.50,39.88,38.94,37.36,36.48,35.35,35.07,32.89,31.32,31.00,28.14(2c),27.62,24.19,21.29,20.63,18.27,15.50,14.37,14.26,12.02.
[0584]
实施例54化合物q83~q84的制备
[0585]
类似于q24~q25的合成,化合物q82(1.00g,2.41mmol)、30ml甲酸乙酯、nah(578mg,24.1mmol)反应得淡黄色油状物q83。
[0586]
之后化合物q83(前一步油状物)、30ml冰醋酸、乙酸钾(473mg,4.82mmol)、85%水合肼(0.42ml,8.51mmol)加热回流反应得到化合物q84(白色固体1g,产率91.8%)。
13
c nmr(126mhz,cdcl3)δ174.37,149.38,134.09,112.57,60.19,56.47,55.88,54.97,52.85,42.41,39.95,37.90,35.61,35.36,34.76,33.40,32.56,31.44,31.33,31.00,28.14,24.39,24.27,22.40,20.85,18.30,14.27,13.72,11.94.
[0587]
实施例55化合物q85~q86的制备
[0588]
类似于q26~q27的合成,化合物q84(1g,2.21mmol)、氢氧化锂(1.60g,66.4mmol)水解反应得到化合物q85(白色固体1.03g,产率99%)。之后化合物q85(1.03g,2.21mmol)、dmap(73.37mg,0.44mmol)、乙酸酐(0.63ml,6.63mmol)反应得到化合物q86(白色固体927mg,产率90%)。1h nmr(500mhz,cdcl3)δ7.84(d,j=5.6hz,1h),2.71
–
2.66(m,1h),2.64(s,3h),2.45
–
2.35(m,1h),2.30
–
2.21(m,1h),2.08
–
1.99(m,2h),1.87
–
1.75(m,3h),1.72
–
1.66(m,1h),1.66
–
1.57(m,2h),1.51
–
1.33(m,8h),1.29(s,3h),1.24(s,3h),1.19
–
1.05(m,4h),0.94(d,j=6.5hz,3h),0.89
–
0.83(m,2h),0.79(s,3h),0.67(s,3h).
13
c nmr(126mhz,cdcl3)δ180.06,169.65,162.87,124.41,119.37,56.43,55.84,54.74,52.77,42.40,39.89,37.49,35.60,35.32,34.67,34.55,32.48,31.63,30.97,30.75,28.12,24.95,24.24,22.69,21.61,20.88,18.26,13.70,11.95.mp:135-136℃。hrms(esi)for c
29
h
44
n2o3[m na]
:calcd 491.3244,found 491.3243.
[0589]
实施例56化合物q87的制备
[0590]
类似于化合物q37的合成,化合物q86(145mg,0.31mmol)、edci(120.8mg,0.63mmol),hobt(85.2mg,0.63mmol)、dmap(154.0mg,1.26mmol)、吗啡啉(0.59mmol)反应,得化合物q87(白色固体140mg,产率95%)。1h nmr(500mhz,cdcl3)δ7.81(s,1h),3.64(s,4h),3.59(s,2h),3.45(s,2h),2.65(d,j=10.8hz,1h),2.62(s,3h),2.39
–
2.30(m,1h),2.19
–
2.08(m,1h),2.05
–
1.94(m,2h),1.88
–
1.74(m,3h),1.68(d,j=14.9hz,1h),1.63
–
1.54(m,2h),1.52
–
1.32(m,7h),1.28(s,3h),1.22(s,3h),1.16
–
1.02(m,4h),0.93(d,j=6.7hz,3h),0.88
–
0.81(m,2h),0.77(s,3h),0.67
–
0.62(s,3h).
13
c nmr(126mhz,cdcl3)δ172.32,169.59,162.83,124.38,119.34,66.95,66.69,56.42,55.93,54.74,52.75,46.09,42.40,41.88,39.89,37.48,35.65,35.58,34.66,34.53,32.48,31.63,31.32,30.10,28.22,24.95,24.26,22.67,21.60,20.87,18.51,13.69,11.96.mp:135-136℃。hrms(esi)for c
33
h
51
n3o3[m na]
:calcd 560.3823,found 560.3817.
[0591]
实施例57化合物q88~q89的制备
[0592]
类似于q24~q25的合成,化合物q19(1.00g,2.41mmol)、30ml甲酸乙酯、nah(578mg,24.1mmol)反应,得淡黄色油状物q88。
[0593]
之后化合物q88(前一步油状物)、30ml冰醋酸、乙酸钾(473mg,4.82m mol)、85%水合肼(0.42ml,8.51mmol)加热反应,得到化合物q89(白色固体1g,产率91.8%)。
13
c nmr(101mhz,cdcl3)δ174.00,150.02(2c),120.87(2c),112.81,60.20,56.95,55.78,49.38,42.25,39.78,38.87,35.52,35.40,34.81,33.33,32.71,32.45,32.11,31.63,28.23,24.23,21.56,21.31,21.06,18.63,14.29,11.86.
[0594]
实施例58化合物q90~q92的制备
[0595]
类似于q26的合成,化合物q89(104mg,0.221mmol)、氢氧化锂(160mg,6.64mmol)水解反应得到化合物q90(白色固体103mg,产率99%)。
[0596]
类似于化合物q37的合成,化合物q90(100mg,0.23mmol)、edci(90mg,0.46mmol)、hobt(62mg,0.46mmol)、dmap(152.7mg,0.92mmol)、吗啡啉(0.04ml,0.46mmol)反应缩合,得化合物q91(白色固体111mg,产率95%)。
[0597]
化合物q91(111mg,0.22mmol)、dmap(7.337mg,0.044mmol)于50ml单口烧瓶,加入20mlthf、异丁酸酐(0.063ml,0.663mmol),60℃加热搅拌2小时,可见体系逐渐溶清,tlc检测原料反应完全,恢复至室温,加10ml水,20ml乙酸乙酯,水相再用乙酸乙酯(20ml
×
3)萃取,合并有机相。有机相分别用水(20ml
×
3)、饱和氯化钠溶液(20ml
×
2)洗涤,无水na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q92(白色固体114mg,产率90%)。1h nmr(500mhz,cdcl3)δ7.88
–
7.85(m,1h),5.75(dd,j=5.2,2.2hz,1h),3.92
–
3.81(m,1h),3.66(d,j=4.4hz,4h),3.62(d,j=5.2hz,2h),3.49
–
3.44(m,2h),2.77(d,j=14.9hz,1h),2.33
–
2.22(m,2h),2.17
–
2.10(m,2h),2.04(dd,j=9.4,3.2hz,1h),1.88
–
1.81(m,1h),1.75
–
1.56(m,5h),1.52(s,3h),1.50
–
1.39(m,4h),1.35(s,3h),1.29
–
1.25(m,6h),1.22
–
1.01(m,7h),0.95(d,j=6.5hz,3h),0.90
–
0.82(m,1h),0.79(s,3h),0.69(s,3h).
13
c nmr(126mhz,cdcl3)δ176.22,172.03,162.55,149.35,124.23,121.17,118.89,66.97,66.70,56.88,55.75,49.15,46.09,42.26,41.92,39.71,38.60,36.31,35.74,35.66,33.75,33.59,32.28,31.97,31.94,31.91,31.60,28.28,24.21,21.78,21.14,21.04,19.35,18.98,18.68,11.89.mp:96-97℃。hrms(esi)for c
36
h
55
n3o3[m na]
:calcd 600.4136,found 600.4138.
[0598]
实施例59化合物q93的制备
[0599]
类似于化合物q27的合成,化合物q90(200mg,0.46mmol)、dmap(15.16mg,0.091mmol)、20ml thf、乙酸酐(0.14ml,1.37mmol)加热反应得到化合物q93(白色固体199mg,产率90%)。
13
c nmr(126mhz,cdcl3)δ179.87,169.68,162.90,149.30,124.05,121.18,119.25,56.90,55.87,49.18,42.28,39.75,38.57,36.34,35.59,35.47,35.02,33.77,32.26,31.98,31.83,31.60,28.25,24.24,21.63,21.57,21.16,21.02,18.63,11.90.
[0600]
实施例60化合物q94~q95的制备
[0601]
将化合物q93(110mg,0.23mmol)、edci(90mg,0.46mmol),hobt(62mg,0.46mmol),dmap(152.7mg,0.92mmol),n-boc-4-氨基哌啶(92mg,0.46mmol)置于25ml单口烧瓶中,加入无水dcm(10ml),室温搅拌12小时,tlc检测原料反应完全后,加20ml水,用dcm(10ml
×
3)萃取水相,合并有机相。有机相分别用水(10ml)、饱和nacl溶液(10ml)洗涤,无水na2so4干燥,经减压浓缩后硅胶柱层析,得化合物q94(白色固体145mg,产率95%)。
[0602]
化合物q94(145mg,0.22mmol)于50ml单口烧瓶内,加入15ml二氯甲烷,滴加三氟乙酸(0.048ml,0.66mmol),室温搅拌3小时,tlc检测原料反应完全,直接浓缩得固体,再加入15mlthf、dmap(7.3mg,0.044mmol),乙酸酐(0.083ml,0.88mmol),60℃加热2小时,tlc检测原料反应完全,降至室温,加10ml水,10ml乙酸乙酯,萃取分液,水相再用乙酸乙酯(10ml
×
3)萃取,合并有机相。有机相分别用水(10ml
×
3)、饱和氯化钠溶液(10ml
×
2)洗涤,无水
na2so4干燥,减压浓缩后硅胶柱层析(pe:ea=2:1)得到化合物q95(白色固体93mg,产率70%)。1h nmr(500mhz,cdcl3)δ7.87(s,1h),5.75(dd,j=5.2,2.2hz,1h),5.38(d,j=18.1hz,1h),4.53(d,j=19.7hz,1h),4.03
–
3.94(m,1h),3.76(d,j=18.1hz,1h),3.20
–
3.07(m,1h),2.79
–
2.74(m,1h),2.74
–
2.67(m,2h),2.64(s,3h),2.17
–
2.10(m,4h),2.09(s,3h),2.06
–
2.02(m,2h),1.91(dd,j=16.7,9.4hz,1h),1.85
–
1.77(m,1h),1.74
–
1.55(m,6h),1.52(s,3h),1.48
–
1.37(m,4h),1.35(s,3h),1.31
–
1.00(m,15h),0.94(d,j=6.5hz,3h),0.78(s,3h),0.68(s,3h).
13
c nmr(126mhz,cdcl3)δ172.56,168.92,162.92,149.25(2c),124.01,121.20,119.30,56.86,55.73,49.12,46.50,45.31,42.25,40.56,39.70,38.57,37.28,36.34,35.58,35.48,33.78,32.84,32.22,31.95,31.80,31.58,29.71,28.28,24.20,22.27,21.65,21.46,21.13,21.01,18.67,11.88.mp:110-111℃。hrms(esi)for c
37
h
56
n4o3[m na]
:calcd 627.4245,found 627.4245.
[0603]
实施例61化合物q96的制备
[0604]
类似于化合物q37的合成,化合物q93(110mg,0.23mmol)、edci(90mg,0.46mmol)、hobt(62mg,0.46mmol)、dmap(152.7mg,0.92mmol)、吗啡啉(0.04ml,0.46mmol)反应,得化合物q96(白色固体120mg,产率95%)。1h nmr(500mhz,cdcl3)δ7.86(d,j=1.1hz,1h),5.73(dd,j=5.2,2.3hz,1h),3.64(d,j=4.1hz,4h),3.60(d,j=5.2hz,2h),3.48
–
3.39(m,2h),2.75(d,j=14.9hz,1h),2.63(s,3h),2.32
–
2.19(m,2h),2.16
–
2.07(m,2h),2.05
–
1.99(m,1h),1.83
–
1.75(m,1h),1.73
–
1.54(m,5h),1.50(s,3h),1.47
–
1.36(m,3h),1.33(s,3h),1.27
–
1.01(m,8h),0.94(d,j=6.5hz,3h),0.77(s,3h),0.67(s,3h).
13
c nmr(126mhz,cdcl3)δ171.90,169.59,162.90,149.26,124.01,121.20,119.29,66.96,66.69,56.86,55.74,49.13,46.05,42.25,41.88,39.70,38.56,36.32,35.73,35.64,33.78,33.57,32.21,31.94,31.79,31.58,28.27,24.20,21.74,21.62,21.13,21.00,18.68,11.88.mp:90-91℃。hrms(esi)for c
34
h
51
n3o3[m na]
:calcd 572.3823,found 572.3822.
[0605]
实施例62化合物q97~q98的制备
[0606]
类似于q24~q25的合成,化合物q23(1.07g,2.41mmol)、30ml甲酸乙酯、nah(578mg,24.1mmol)反应得淡黄色油状物q97。
[0607]
之后化合物q97(前一步油状物)、30ml冰醋酸、乙酸钾(473mg,4.82mmol)、85%水合肼(0.42ml,8.51mmol)加热回流反应得到化合物q98(白色固体1.03g,产率91.8%)。
13
c nmr(126mhz,cdcl3)δ173.96,150.01(2c),120.89(2c),112.87,60.18,56.96,56.01,49.40,42.25,39.81,38.88,35.61,35.55,35.50,34.47,33.35,32.70,32.42,32.12,31.64,28.28,25.64,25.45,24.24,21.30,21.07,18.66,14.27,11.89.
[0608]
实施例62化合物q99的制备
[0609]
类似于q26的合成,化合物q98(103mg,0.221mmol)、氢氧化锂(160mg,6.64mmol)水解反应得到化合物q99(白色固体103mg,产率99%)。1h nmr(500mhz,meod)δ7.90(s,1h),5.97
–
5.85(m,1h),2.91(d,j=15.0hz,1h),2.31
–
2.10(m,5h),1.93
–
1.86(m,1h),1.78
–
1.59(m,5h),1.57(s,3h),1.55
–
1.50(m,1h),1.44(s,4h),1.42
–
1.39(m,1h),1.38
–
1.04(m,11h),0.97(d,j=6.5hz,3h),0.90(s,3h),0.79
–
0.71(m,3h).
[0610]
实施例63化合物q100的制备
[0611]
类似于化合物q27的合成,化合物q99(100mg,0.23mmol)、dmap(7.8mg,
[m na]
:calcd 572.3823,found 572.3825.
[0620]
实施例66化合物q107~q111的制备
[0621]
化合物q107~q111的合成以q9为起始原料,类似于化合物q102~q106的合成操作获得。1h nmr(500mhz,cdcl3)δ7.86(s,1h),5.74(dd,j=5.1,2.1hz,1h),3.91
–
3.80(m,1h),3.72
–
3.50(m,8h),2.76(d,j=14.9hz,1h),2.72
–
2.68(m,1h),2.17
–
2.08(m,2h),2.04
–
1.95(m,1h),1.88
–
1.80(m,2h),1.76
–
1.54(m,5h),1.51(s,3h),1.49
–
1.36(m,2h),1.35(s,3h),1.27(s,3h),1.26(s,3h),1.20(dd,j=11.0,3.9hz,1h),1.16(d,j=6.7hz,3h),1.13
–
1.08(m,2h),0.79(s,3h),0.73(s,3h).
13
c nmr(126mhz,cdcl3)δ176.19,175.36,162.47,149.32,124.23,121.10,118.79,67.12,66.89,56.30,52.78,49.05,46.32,42.18,42.07,39.54(2c),38.58,36.31,33.76,32.26,31.91(2c),31.87,31.59,27.87,24.29,21.08,21.06,19.35,18.96,17.42,12.30.mp:248-249℃。hrms(esi)for c
33
h
49
n3o3[m na]
:calcd 558.3666,found 558.3670.
[0622]
实施例67:胆酸衍生物降解hmgcr-gfp的活性测试
[0623]
以下方法运用cho-7/hmgcr-gfp细胞系测定本发明实施例制备的化合物降解hmgcr的活性。cho-7/hmgcr-gfp细胞系是通过在中国仓鼠卵巢上皮细胞cho-7中稳定转染表达了hmgcr-gfp融合蛋白。
[0624]
实验方法简述如下:将cho-7/hmgcr-gfp细胞培养在dmem/f12(1:1)培养基中(含5%fbs,100units/ml penicillin-streptomycin),待细胞汇合度达到80%时,用0.25%胰酶(含edta)消化吹匀后以每孔3
×
104细胞接种到24孔板中。于37℃、5%co2培养箱中培养24小时后,吸掉培养基,用pbs缓冲液(137mm nacl,2.7mm kcl,10mm na2hpo4,2mm kh2po4)洗1遍。再加入配置有不同浓度本发明实施例制备的化合物的去脂蛋白dmem/f12培养基(含5%去脂蛋白血清,1μm洛伐他汀,10μm甲羟戊酸,100units/ml penicillin-streptomycin),在他汀作用下,有利于最大程度诱导hmgcr的堆积。培养16小时后,吸掉培养基,每孔加入150μl细胞裂解液reporter lysis buffer(promega,e397a),将24孔板置于-80℃冰箱中冻结,再室温解冻1次,随后以800rpm在涡旋仪上振荡10分钟,达到充分裂解细胞的目的。
[0625]
吸取100μl裂解液加入到96孔黑色酶标板中(perkinelmer,6005329),用envsion酶标仪(perkinelmer)以激发光为485nm,发射光为535nm,测量绿色荧光蛋白egfp的荧光强度。根据本发明实施例制备的化合物,采用0.003μm,0.01μm,0.03μm,0.1μm,0.3μm,1μm,3μm,10μm浓度梯度,并以dmso未处理组标准化为100%,用graphpad prism软件计算其半效抑制浓度ec50。通过以上方法测定其降解hmgcr的活性,降解效果如表1所示。
[0626]
表1本发明实施例制备的化合物降解hmgcr-gfp的活性数据
[0627]
[0628]
[0629]
[0630]
[0631][0632]
由表1中的数据可以看出,本发明实施例制备的化合物对hmgcr的降解均具有显著效果,其中活性最强的化合物q37和q54的ec50分别为0.49μm和0.45μm。
[0633]
实施例68、根据本发明实施例制备的化合物降解hmgcr的实验
[0634]
以下方法用于测定根据本发明实施例制备的化合物对hmgcr的降解。实验方法简述如下:将cho-7细胞以6
×
105传到60mm培养皿中,培养1天后。吸掉培养基,pbs洗1遍,去掉pbs,加入含有不同浓度本发明实施例制备的化合物的去脂蛋白dmem/f12培养基(含5%去脂蛋白和去脂肪酸血清,1μm洛伐他汀,10μm甲羟戊酸,100units/ml penicillin-streptomycin),处理16小时后。用细胞刮将培养皿中的细胞刮下,转移到15ml离心管中,并置于冰上。4℃1000g离心5分钟后,倒掉培养基,加入1ml pbs缓冲液,并转移至1.5ml离心管,4℃1000g离心5分钟。去掉pbs,加入300μl sds lysis buffer(10mm tris-hcl(ph 7.6),100mm氯化钠,1%十二烷基硫酸钠和蛋白酶抑制剂),过7号针头15次。13200rpm室温离心10分钟,转移270μl上清至新1.5ml离心管,并加入90μl 4x loading buffer(1.2%十二烷基硫酸钠,30%甘油,150mm tris-hcl(ph 6.8),0.6%β-巯基乙醇和适量溴酚蓝),混
匀后95℃煮10分钟,储存于-20℃冰箱中。
[0635]
蛋白免疫印迹杂交(western blot)检测hmgcr的降解
[0636]
1)上样:每个蛋白样品上样量30μl,加于8%sds-page胶的胶孔中。
[0637]
2)电泳:先用85伏电压30分钟让蛋白进入浓缩胶,随后120伏1小时让蛋白进入分离胶。
[0638]
3)转膜:电泳结束后,取出凝胶按照滤纸、硝酸纤维素膜、凝胶、滤纸的顺序放入转膜装置中,并注意排除气泡,100伏恒压转膜1.5小时。
[0639]
4)封闭:转膜结束后,将硝酸纤维素膜浸泡于含有5%脱脂奶粉的tbst缓冲液(20mm tris-hcl(ph 7.4),150mm氯化钠和0.05%tween-20)中,室温摇床孵育1小时。
[0640]
5)一抗孵育:封闭完成后,用tbst缓冲液洗膜3次。加入4μg/ml的hmgcr抗体(igg-a9,识别仓鼠hmgcr的小鼠单克隆抗体),室温孵育2小时或4℃过夜。回收抗体,将膜用tbst洗4次,每次8分钟。
[0641]
6)二抗孵育:弃去tbst,加入1:5000稀释的羊抗小鼠hrp偶联二抗,室温孵育1小时。tbst洗4次,每次8分钟。
[0642]
7)显色拍照:将ecl发光底物覆盖于硝酸纤维素膜上,用保鲜膜封好,用las4000冷光/生物发光影像分析仪(fujifilm)拍摄图片。
[0643]
8)hmgcr蛋白的定量分析,将得到的灰度图片用image j(nih)软件进行定量分析,以未加药组为100%。
[0644]
测定结果如图2(a和c)所示:本发明实施例制备的化合物能够显著地降解hmgcr。图2(b和d)定量分析结果显示:本发明实施例制备的化合物降解hmgcr的活性非常强,q37和q54的ec50值分别为0.22μm和0.26μm。
[0645]
实施例69:细胞内胆固醇堆积情况检测
[0646]
以下方法运用cho-7/hmgcr-gfp细胞系测定本发明实施例制备的化合物降解hmgcr的活性。cho-7/hmgcr-gfp细胞系是通过在中国仓鼠卵巢上皮细胞cho-7中稳定转染表达了hmgcr-gfp融合蛋白。
[0647]
实验方法简述如下:将cho-7/hmgcr-gfp细胞培养在dmem/f12(1:1)培养基中(含5%fbs,100units/ml penicillin-streptomycin),待细胞汇合度达到80%时,用0.25%胰酶(含edta)消化吹匀后以每孔3
×
104细胞接种到12孔板中。于37℃、5%co2培养箱中培养24小时后,吸掉培养基,用pbs缓冲液(137mm nacl,2.7mm kcl,10mm na2hpo4,2mm kh2po4)洗1遍。
[0648]
再加入配置有0μm,1μm和10μm浓度本发明实施例制备的化合物的去脂蛋白dmem/f12培养基(含10%去脂蛋白血清,1μm洛伐他汀,10μm甲羟戊酸,100units/ml penicillin-streptomycin)1ml,于37℃、5%co2培养箱中培养16小时后,吸掉培养基,用pbs缓冲液(137mm nacl,2.7mm kcl,10mm na2hpo4,2mm kh2po4)洗1遍,用4%多聚甲醛(pfa)固定30分钟,再用pbs缓冲液(137mm nacl,2.7mm kcl,10mm na2hpo4,2mm kh2po4)洗3遍,用含有10%fbs的pbs稀释乙醇溶解的filipin母液(5mg/ml)到终浓度50μg/ml,室温避光孵育30分钟。再用pbs缓冲液(137mm nacl,2.7mm kcl,10mm na2hpo4,2mm kh2po4)洗3遍,双蒸水洗2遍。封片,晾干过夜后置于显微镜(zeiss z2宽视野显微镜(非共焦)dapi通道)下观测细胞内胆固醇堆积情况,如图3所示,检测到化合物q37、q46处理后细胞内胆固醇完全无堆积。
[0649]
本发明提出的胆酸衍生物作为降低体内胆固醇和甘油三酯的化合物在预防和/或治疗高胆固醇血症、高甘油三酯血症,动脉粥样硬化及非酒精性脂肪性肝炎方面有着潜在的药物研究价值,为寻找新型的预防和/或治疗高胆固醇血症、高甘油三酯血症,动脉粥样硬化及非酒精性脂肪性肝炎药物提供了新思路。
[0650]
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。