cxorf67在判断肿瘤对dna损伤药物的敏感性中的应用
技术领域
1.本发明涉及肿瘤学和诊断领域。更具体地,本发明涉及cxorf67在判断肿瘤对dna损伤药物的敏感性中的应用。
背景技术:
2.细胞中dna的双链断裂(double strand breaks,dsbs)是细胞面临的最严重的一种dna损伤,dna双链断裂修复一般根据有无同源序列参与分为两种。一种是经典的非同源末端连接(classical non-homologous end joining,cnhej),这是不依赖于同源序列的,主要在细胞周期的g0/g1期发挥作用。另一种是重组(homologous recombination,hr)修复通路,这是一种无错修复,主要在细胞周期的s/g2期利用细胞里面的同源dna作为模版来修复断裂的dna。这种同源dna可以是姐妹染色单体,也可以是同源染色体或是异位染色体上的序列。
3.poly(adp-ribose)polymerase inhibitors(parpi)是最近发现的一个可以利用协同致死杀死癌细胞的药物。poly(adp-ribose)polymerase(parp)有17个家族成员,它们是一类核蛋白,其中parp1和parp2是主要的参与dna损伤响应的蛋白。parp抑制剂最早在2005年报道可以特异杀死brca1或brca2突变的肿瘤。parp抑制剂目前有5个,但是它们在parp-trapping上的能力有很大差异。
4.cxorf67(chromosome x open reading frame 67)位于染色体的xp11.22位置,只有一个外显子,没有内含子,编码503个氨基酸。cxorf67是未知功能的蛋白,主要定位于核内,通过网站预测,没有已知的结构域,大部分是无序的。
5.hr修复通路缺陷的肿瘤是一种对parp抑制剂非常敏感的肿瘤。parp抑制剂阻断了dna单链断裂修复时,dna复制产生双链,如果肿瘤细胞的hr修复缺陷就会导致细胞死亡;而正常的细胞有完整的hr修复,所以不会被杀死。
6.室管膜瘤(ependymoma,epn)是发生在中枢神经系统(central nervous system,cns)中的神经上皮恶性肿瘤,在儿童和成人中都有发生。epn主要发生在三个位置:幕上(supratentorial,st)、后窝(posterior fossa,pf)和脊柱(spinal,sp)。2015年的研究通过dna甲基化的分析,将这三个位置的室管膜瘤进一步进行了分子亚型的分类,st包括st-se、st-epn-yap1和st-epn-rela;pf包括pf-se、pfa和pfb;sp包括sp-se、sp-mpe和sp-epn。pfa主要发生在婴儿和幼儿(平均年龄3岁,范围0-51岁),愈后很差;pfb主要发生在青少年(平均年龄30岁,范围10-65岁),愈后较好。
7.室管膜瘤中的pfa亚型主要发生在儿童的后脑部位,愈后较差,目前以手术和放疗为主,缺少有效的药物治疗。
8.因此,本领域迫切需要开发增强hr修复通路缺陷的肿瘤对dna损伤药物敏感性,从而更有效治疗hr修复通路缺陷的肿瘤的新靶点。
技术实现要素:
9.本发明的目的就是提供增强hr修复通路缺陷的肿瘤对dna损伤药物敏感性,从而更有效治疗hr修复通路缺陷的肿瘤的新靶点。
10.本发明第一方面提供了一种cxorf67基因、mrna、cdna、或蛋白或其检测试剂的用途,(i)用作检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性的标志物;和/或(ii)用于制备检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性的诊断试剂或试剂盒。
11.在另一优选例中,所述dna损伤修复抑制剂药物包括parp抑制剂。
12.在另一优选例中,所述parp抑制剂选自下组:talazoparib、olaparib、veliparib、rucaparib、niraparib。
13.在另一优选例中,所述诊断试剂包括抗体、引物、探针、测序文库、核酸芯片(如dna芯片)或蛋白质芯片。
14.在另一优选例中,所述的蛋白包括全长蛋白或蛋白片段。
15.在另一优选例中,所述蛋白含有palb2结合基序(palb2-binding motif)。
16.在另一优选例中,所述palb2结合基序位于cxorf67蛋白的420-432位。
17.在另一优选例中,所述的cxorf67基因、mrna、cdna、或蛋白来源于哺乳动物,较佳地来源于啮齿动物(如小鼠、大鼠)、灵长动物和人,更佳地,来源于被诊断患有hr修复通路缺陷的肿瘤的患者。
18.在另一优选例中,所述hr修复通路缺陷的肿瘤选自下组:室管膜瘤(ependymoma posterior fossa group a)、肾透明细胞癌(kidney renal clear cell carcinoma,kirc)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,kirp)、或其组合。
19.在另一优选例中,所述室管膜瘤包括pfa。
20.在另一优选例中,所述肿瘤细胞为cxorf67表达或高表达的肿瘤细胞。
21.在另一优选例中,所述肿瘤细胞包括hr修复通路缺陷的肿瘤细胞。
22.在另一优选例中,所述肿瘤细胞选自下组的一种或多种肿瘤:室管膜瘤、肾透明细胞癌(kidney renal clear cell carcinoma,kirc)、肾乳头状细胞癌。
23.在另一优选例中,所述cxorf67基因的登录号为gene id:340602。
24.在另一优选例中,所述cxorf67 mrna的登录号为nm_203407.3。
25.在另一优选例中,所述cxorf67蛋白的登录号为np_981952.1。
26.在另一优选例中,所述检测是组织样本检测。
27.在另一优选例中,所述的检测包括免疫组化、免疫印迹和荧光定量pcr方法检测。
28.在另一优选例中,所述的检测是测定肿瘤组织。
29.在另一优选例中,所述检测试剂包括cxorf67的特异性抗体、cxorf67的特异性结合分子、特异性扩增引物、探针或芯片。
30.在另一优选例中,所述的cxorf67蛋白或其特异性抗体或特异性结合分子偶联有或带有可检测标记。
31.在另一优选例中,所述可检测标记选自下组:生色团、化学发光基团、荧光团、同位素或酶。
32.在另一优选例中,所述cxorf67的特异性抗体是单克隆抗体或多克隆抗体。
33.本发明第二方面提供了一种用于检测肿瘤细胞对dna损伤修复抑制剂药物的敏感
性的诊断试剂盒,所述的试剂盒含有一容器,所述容器中含有检测cxorf67基因、mrna、cdna、或蛋白的检测试剂;以及标签或说明书,所述标签或说明书注明所述试剂盒用于检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性。
34.在另一优选例中,所述的检测cxorf67基因、mrna、cdna、或蛋白的检测试剂包括:
35.(a).抗cxorf67蛋白的特异性抗体;和/或
36.(b).特异性扩增cxorf67的mrna或cdna的特异性引物。
37.在另一优选例中,所述检测是组织样本检测。
38.本发明第三方面提供了一种判断对dna损伤修复抑制剂药物的敏感性的方法,所述方法包括:
39.a)提供来自受试者的测试样品;
40.b)检测测试样品中cxorf67蛋白的表达量;和
41.c)基于步骤b)中所测定的cxorf67蛋白的表达量,从而判断对dna损伤修复抑制剂药物的敏感性。
42.在另一优选例中,当所述测试样本中存在cxorf67蛋白时,则可判断对dna损伤修复抑制剂药物具有敏感性。
43.在另一优选例中,当所述测试样本中的cxorf67蛋白的表达量>0.5,较佳地,>1.5,更佳地,>2时,则可判断对dna损伤修复抑制剂药物具有敏感性。
44.在另一优选例中,所述的受试者为人或非人哺乳动物。
45.在另一优选例中,所述测试样品为cxorf67表达或高表达的肿瘤细胞或组织。
46.在另一优选例中,所述测试样品为hr修复通路缺陷的肿瘤细胞或组织。
47.在另一优选例中,所述检测步骤(b)包括检测cxorf67 mrna的量、或cxorf67 cdna的量;和/或检测cxorf67蛋白的量。
48.在另一优选例中,通过荧光定量pcr或免疫组织化学检测样品中的cxorf67蛋白的表达水平。
49.在另一优选例中,所述方法为非诊断和非治疗性的。
50.本发明第四方面提供了一种确定治疗方案的方法,包括:
51.a)提供来自受试者的测试样品;
52.b)检测测试样品中cxorf67蛋白的表达水平;和
53.c)基于所述样品中的cxorf67蛋白的表达水平来确定治疗方案。
54.在另一优选例中,所述的受试者为人或非人哺乳动物。
55.在另一优选例中,当所述样品中存在cxorf67蛋白(优选cxorf67蛋白的表达量>0.5,较佳地,>1.5,更佳地,>2)时,所述治疗方案包括cxorf67抑制剂疗法、dna损伤修复抑制剂药物疗法、cxorf67抑制剂与dna损伤修复抑制剂药物联用的疗法。
56.在另一优选例中,所述cxorf67抑制剂疗法、dna损伤修复抑制剂药物疗法选自下组:
57.cxorf67抑制剂疗法:抗体、小分子化合物、microrna、sirna、shrna、或其组合;
58.dna损伤修复抑制剂药物疗法:parp抑制剂。
59.在另一优选例中,当受试者对dna损伤修复抑制剂药物的敏感性高于一般人群(对照组人群)时,所述治疗方案还包括cxorf67抑制剂疗法、dna损伤修复抑制剂药物疗法、
cxorf67抑制剂与dna损伤修复抑制剂药物联用的疗法。
60.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
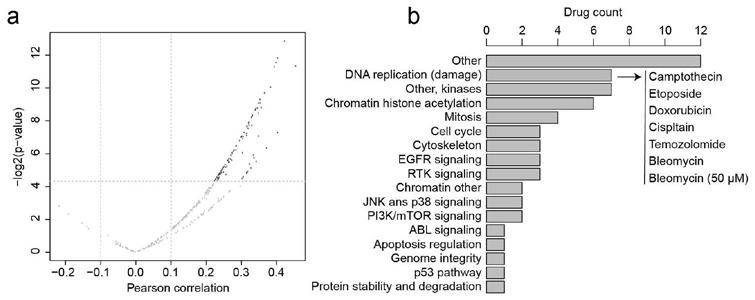
61.图1显示了cxorf67表达量和药物敏感性。(a)分析gdsc数据库中脑细胞系中cxorf67表达量和药物活性的关系。依据相关系数大于0.1,p值小于0.05筛选出93种药物。(b)对93种药物中有归类信息的60种药物进行靶向通路分析。
62.图2显示了cxorf67是一个dna损伤响应蛋白。(a)将u2os细胞铺到带玻璃底的小皿中,24小时后转染egfp-cxorf67质粒。24小时后加hoechst染料15分钟,然后用培液洗三次。在活细胞工作站上用405nm激光损伤,每20秒采集一张图片。(b)用0.1μm cpt刺激u2os,然后在不同的时间点收集细胞,然后进行染色质分离。(c)将u2os细胞铺在24-well的玻片上,然后用ir刺激或加0.1μm的cpt刺激,1小时后用4%的多聚甲醛固定,pbst洗后加cxorf67抗体过夜,第二天加荧光二抗和dapi封闭1小时,然后拍片。
63.图3显示了cxorf67可以抑制dna损伤修复。(a)将cxorf67 wt和ko u2os细胞接种在24-well中,然后用ir(10gy)刺激,在不同的时间点收集样品,wb检测r-h2ax的水平。(b)在cxorf67 ko的u2os中回复表达cxorf67,然后ir刺激,wb检测r-h2ax的水平。(c)在cxorf67 wt、ko和回复cxorf67表达的u2os中,用ir(10gy)刺激,然后收集0.5h和24h的样本,进行免疫荧光染色,检测r-h2ax foci的形成。(d)cxorf67 wt和ko u2os在ir(10gy)刺激后,收集细胞做彗星电泳实验检测细胞核dna的拖尾。图4显示了cxorf67抑制了hr,而不影响nhej。(a)在6-well u2os dr-gfp细胞中转染两个浓度的cxorf67质粒(0.1μg和0.5μg)和i-scei质粒(3μg),48小时后收集细胞做流式分析gfp和rfp阳性细胞数目。t-test检测分析p值。(b)在6-well u2os ej5-gfp细胞中转染cxorf67质粒(0.5μg)和i-scei质粒(3μg),48小时后收集细胞做流式分析gfp和rfp阳性细胞数目。
64.图5显示了cxorf67影响了rad51 foci,而不影响rpa2和brca1 foci。(a)将u2os cxorf67-wt,ko和回转cxorf67的ko细胞接受cpt 0.1μm 4小时处理后,将细胞固定,用rad51抗体做免疫荧光实验观察rad51 foci。并用image-pro plus软件对每个细胞的foci数目进行了统计。t-test检测分析p值。(b,c)将u2os cxorf67-wt和ko细胞接受cpt 0.1μm 4小时处理后,将细胞固定,用rpa2,brca1抗体做免疫荧光实验,观察对应的foci。(d)将daoy cxorf67-wt,ko和回转cxorf67的ko细胞接受cpt 0.1μm 4小时处理后,将细胞固定,用rad51抗体做免疫荧光实验观察rad51 foci。(e,f)将daoy cxorf67-wt和ko细胞接受cpt 0.1μm 4小时处理后,将细胞固定,用rpa2,brca1抗体做免疫荧光实验,观察对应的foci。
65.图6显示了cxorf67与palb2有结合。(a)在daoy细胞中,免疫沉淀cxorf67然后检测palb2、brca1、rpa2和rad51的结合。(b)在293t细胞中转染cxorf67-ha、palb2-flag或brca1-flag,然后用ha抗体免疫沉淀cxorf67,后面western blot分析palb2和brca1。(c)在u2os细胞中转染palb2-ha质粒,然后观察内源cxorf67与palb2的共定位。
66.图7显示了cxorf67与palb2的wd40结构域结合。(a)根据已报道的palb2结构域,构建了三种palb2的片段质粒。(b)在293t细胞中,转染不同形式片段的palb2质粒和cxorf67
质粒,并进行flag免疫沉淀,然后检测cxorf67。(c)在大肠杆菌中分别纯化带his标签的cxorf67蛋白和带gst标签的wd40蛋白,然后进行gst pull-down实验。
67.图8显示了cxorf67通过palb2-binding motif结合palb2(a)序列比对发现cxorf67的420-432氨基酸序列与brca2的26-38氨基酸序列高度类似。合成biotin修饰的cxorf67 wt和w425c突变的多肽(420-432),然后和gst-wd40蛋白一起做链霉亲和素pull-down实验。(b)在293t中转染cxorf67 wt和w425c突变质粒,然后做免疫共沉淀,检测palb2的结合。(c)在u2os dr-gfp细胞中转染i-scei和wt cxorf67或w425c突变体,48h后收集细胞进行facs分析gfp、rfp所占的阳性细胞比例。用t-test检测分析p值。(d)在daoy cxorf67-ko的细胞中分别回补wt cxorf67或w425c突变体,然后加cpt刺激后固定染rad51 foci,t-test检测分析p值。
68.图9显示了cxorf67与brca2竞争结合palb2。(a)在293t细胞中转染palb2-myc、brca2-n-gfp(1-200氨基酸)和梯度的cxorf67-ha质粒,然后免疫沉淀palb2。(b)在u2os细胞中转染palb2-gfp、brca2-n-myc,同时在有无cxorf67的情况下观察palb2和brca2的共定位。(c)在u2os-laco细胞中转染cxorf67-gfp和myc-lacr或myc-lacr-palb2质粒,然后做免疫荧光实验。(d)在u2os-laco细胞中转染gfp-lacr、gfp-lacr-palb2、myc-brca2-n(1-200)或cxorf67-ha质粒,然后做免疫荧光实验。用imagej软件做荧光定量分析。
69.图10显示了高表达cxorf67的daoy细胞对parp抑制剂更敏感。(a)将daoy cxorf67 wt和ko细胞铺在96-well中,加不同浓度的talazoparib处理5天,然后用celltiter-glo试剂盒检测细胞的生存率,two-way anova分析p值。(b)在daoy cxorf67 ko的细胞中回复表达cxorf67,将细胞铺在96-well中加不同浓度的talazoparib或olaparib处理5天,然后用检测细胞的生存率。(c)将daoy cxorf67-ko细胞和在ko中回复cxorf67表达的细胞和matrigel 1:1混合后注射在5周龄balb/c裸鼠的皮下,每组5只,当肿瘤体积达到100mm3时,给予talazoparib(0.33mg/kg)灌胃处理,一周测量两次肿瘤体积。(d)在u251和u87细胞中过表达cxorf67,然后加不同浓度的talazoparib处理5天,用celltiter-glo试剂盒检测细胞的生存率。
70.图11显示了cxorf67在室管膜瘤的pfa亚型中高表达(a)分析gse64415(pfa,72例;non-pfa,137例)和gse94349(pfa,12例;non-pfa,179例)数据中cxorf67的mrna水平。(b)将收集的28例(1-28依次编号)室管膜瘤标本提取蛋白,用western blotting检测cxorf67的蛋白表达水平和γ-h2ax的水平,然后用pearson相关性分析做了检测。
71.图12显示了高表达cxorf67的pfa肿瘤对parp抑制剂更敏感。(a)收集了5例儿童后脑肿瘤的新鲜标本pfa 1-4和mb-1,然后用western blotting检测了cxorf67和γ-h2ax的表达水平。(b)建立了pfa-1和pfa-2肿瘤来源的原代细胞,然后加不同浓度的talazoparib处理5天,然后用celltiter-glo试剂盒检测细胞的生存率。two-way anova分析p值。(c)建立了pfa-3、pfa-4和mb-1肿瘤来源的pdxs。每组pdx各接种10只裸鼠,然后分成打药和不打药两组。当肿瘤体积达到50mm3时,talazoparib(0.33mg/kg)灌胃处理,5天每周,并测量肿瘤体积。当肿瘤体积达到1000mm3时,绘制小鼠生存曲线。用log rank(mantel-cox)检测分析p值。(d)测量给药和不给药组pfa-3、pfa-4和mb-1的肿瘤体积,two-way anova分析p值。
72.图13显示了cxorf67在其他癌症中的表达分析。(a)分析tcga数据库中16种癌症中cxorf67的mrna表达水平。(b)分析kirc(higher,n=55;lower,n=53)、kirp(higher,n=
59;lower,n=57)两种癌症中cxorf67表达水平和病人愈后的关系,log-rank检测分析p值。
具体实施方式
73.本发明人经过广泛而深入的研究,首次意外地发现,高表达cxorf67的肿瘤细胞系或肿瘤组织对dna损伤修复抑制剂药物(如parp抑制剂)更敏感。因此,cxorf67基因或其蛋白可用作检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性的标志物。在此基础上,本发明人完成了本发明。
74.hr修复通路缺陷的肿瘤
75.同源重组(homologous recombination,hr)修复通路,是一种无错修复,主要在细胞周期的s/g2期利用细胞里面的同源dna作为模版来修复断裂的dna。hr的缺陷或不足可以导致基因组的不稳定,进而伴随肿瘤的发生和发展,如hr通路中的brca1、plab2和brca2等基因在很多肿瘤中都发现有基因的突变。这些基因的突变可以导致dna双链断裂不能被有效修复,引起细胞基因拷贝数的改变、重排和突变,进而引起肿瘤和疾病的发生,如乳腺癌、胰腺癌和前列腺癌等。
76.在一优选实施方式中,所述hr修复通路缺陷的肿瘤为cxorf67高表达的肿瘤,选自下组:室管膜瘤(ependymoma posterior fossa group a)、肾透明细胞癌(kidney renal clear cell carcinoma,kirc)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,kirp)室管膜瘤、肾透明细胞癌(kidney renal clear cell carcinoma,kirc)、肾乳头状细胞癌、或其组合。
77.样品
78.本文中使用的术语“样品”或“样本”是指与受试者特异地相关联的材料,从其中可以确定、计算或推断出与受试者有关的特定信息。样品可以全部或部分由来自受试者的生物材料构成。样品也可以是以某种方式与受试者接触过的材料,这种接触方式使得对样品进行的测试可以提供与受试者有关的信息。样品也可以是已经与其它材料接触过的材料,这种其它材料不是受试者的,但是能够使第一材料随后被测试以确定与受试者有关的信息,例如样品可以是探针或解剖刀的清洗液。样品可以为接触受试者之外的生物材料源,只要本技术领域的专业人员仍然能够从样品确定与受试者有关的信息就行。
79.表达
80.如本文所用,术语“表达”包括mrna从基因或基因部分的产生,并且包括由rna或基因或基因部分所编码的蛋白质的产生,还包括与表达相关的检测物质的出现。例如,cdna,结合配体(如抗体)与基因或其它寡核苷酸、蛋白质或蛋白质片段的结合以及结合配体的显色部分都包括在术语“表达”的范围内。因此,在免疫印迹如western印迹上半点密度的增加也处于以生物学分子为基础的术语“表达”的范围内。
81.参比值
82.如本文所用,术语“参比值”是指当与分析结果相比时与特定结果统计学相关的值。在优选的实施方案中,参比值是根据对比较cxorf67的表达与已知的临床结果的研究进行的统计学分析来确定的。在本文的实施例部分中显示了一些这样的研究。但是,来自文献的研究和本文公开的方法的用户经验也可用于生产或调整参比值。参比值也可以通过考虑与患者的医疗史、遗传学、年龄和其它因素特别相关的情况和结果来确定。
83.在本发明中,所述参比值指截断值(cut-off值),指hr修复通路缺陷的肿瘤细胞或组织中的cxorf67的表达水平,优选cxorf67的表达量>0.5,较佳地,>1.5,更佳地,>2。
84.非肿瘤细胞的样品
85.如本文所用,术语“非肿瘤细胞的样品”包括但不限于未患有hr修复通路缺陷的肿瘤的人群。
86.cxorf67蛋白和多核苷酸
87.在本发明中,术语“本发明蛋白”、“cxorf67蛋白”、“cxorf67多肽”可互换使用,都指具有cxorf67氨基酸序列的蛋白或多肽。它们包括含有或不含起始甲硫氨酸的cxorf67蛋白。此外,该术语还包括全长的cxorf67及其片段。本发明所指的cxorf67蛋白包括其完整的氨基酸序列、其分泌蛋白、其突变体以及其功能上活性的片段。
88.cxorf67(chromosome x open reading frame 67)位于染色体的xp11.22位置,只有一个外显子,没有内含子,编码503个氨基酸。cxorf67是未知功能的蛋白,主要定位于核内,通过网站预测,没有已知的结构域,大部分是无序的。
89.人的cxorf67蛋白全长为503个氨基酸(登录号为np_981952.1)。鼠的cxorf67蛋白全长为589个氨基酸(登录号为np_001159905.1)。
90.在本发明中,术语“cxorf67基因”、“cxorf67多核苷酸”可互换使用,都指具有cxorf67核苷酸序列的核酸序列。
91.人cxorf67基因的基因组全长1896bp(ncbi genbank登录号为gene id:340602),其转录产物mrna序列全长1512bp(ncbi genbank登录号为nm_203407.3)。
92.鼠cxorf67基因的基因组全长2203bp(ncbi genbank登录号gene id:102991),其转录产物mrna序列全长1770bp(ncbi genbank登录号为nm_001166433.1)。
93.人和鼠cxorf67,在dna水平的相似性为39%,蛋白序列相似性为39%。
94.需理解的是,当编码相同的氨基酸时,密码子中核苷酸的取代是可接受的。另外需理解的是,由核苷酸取代而产生保守的氨基酸取代时,核苷酸的变换也是可被接受的。
95.在得到了cxorf67的氨基酸片段的情况下,可根据其构建出编码它的核酸序列,并且根据核苷酸序列来设计特异性探针。核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的cxorf67核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
96.一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
97.此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
98.目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(如载体)和细胞中。
99.通过常规的重组dna技术,可利用本发明的多核苷酸序列可用来表达或生产重组的cxorf67多肽。一般来说有以下步骤:
100.(1).用本发明的编码人cxorf67多肽的多核苷酸(或变异体),或用含有该多核苷
酸的重组表达载体转化或转导合适的宿主细胞;
101.(2).在合适的培养基中培养的宿主细胞;
102.(3).从培养基或细胞中分离、纯化蛋白质。
103.本发明中,cxorf67多核苷酸序列可插入到重组表达载体中。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
104.本领域的技术人员熟知的方法能用于构建含cxorf67编码dna序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
105.此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。
106.包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
107.宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属的细菌细胞;真菌细胞如酵母;植物细胞;昆虫细胞;动物细胞等。
108.用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
109.获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
110.在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
111.特异性抗体
112.在本发明中,术语“本发明抗体”和“抗cxorf67的特异性抗体”可互换使用。
113.本发明还包括对人cxorf67多肽具有特异性的多克隆抗体和单克隆抗体,尤其是单克隆抗体。这里,“特异性”是指抗体能结合于人cxorf67基因产物或片段。较佳地,指那些能与人cxorf67基因产物或片段结合但不识别和结合于其它非相关抗原分子的抗体。本发明中抗体包括那些能够结合并抑制人cxorf67蛋白的分子,也包括那些并不影响人cxorf67蛋白功能的抗体。本发明还包括那些能与修饰或未经修饰形式的人cxorf67基因产物结合
的抗体。
114.本发明不仅包括完整的单克隆或多克隆抗体,而且还包括具有免疫活性的抗体片段,如fab’或(fab)2片段;抗体重链;抗体轻链;遗传工程改造的单链fv分子(ladner等人,美国专利no.4,946,778);或嵌合抗体,如具有鼠抗体结合特异性但仍保留来自人的抗体部分的抗体。
115.本发明的抗体可以通过本领域内技术人员已知的各种技术进行制备。例如,纯化的人cxorf67基因产物或者其具有抗原性的片段,可被施用于动物以诱导多克隆抗体的产生。与之相似的,表达人cxorf67蛋白或其具有抗原性的片段的细胞可用来免疫动物来生产抗体。本发明的抗体也可以是单克隆抗体。此类单克隆抗体可以利用杂交瘤技术来制备(见kohler等人,nature 256;495,1975;kohler等人,eur.j.immunol.6:511,1976;kohler等人,eur.j.immunol.6:292,1976;hammerling等人,in monoclonal antibodies and t cell hybridomas,elsevier,n.y.,1981)。本发明的抗体包括能阻断人cxorf67蛋白功能的抗体以及不影响人cxorf67蛋白功能的抗体。本发明的各类抗体可以利用人cxorf67基因产物的片段或功能区,通过常规免疫技术获得。这些片段或功能区可以利用重组方法制备或利用多肽合成仪合成。与人cxorf67基因产物的未修饰形式结合的抗体可以用原核细胞(例如e.coli)中生产的基因产物来免疫动物而产生;与翻译后修饰形式结合的抗体(如糖基化或磷酸化的蛋白或多肽),可以用真核细胞(例如酵母或昆虫细胞)中产生的基因产物来免疫动物而获得。
116.抗人cxorf67蛋白的抗体可用于免疫组织化学技术中,检测标本(尤其是组织样本或血清样本)中的人cxorf67蛋白。由于cxorf67蛋白存在胞外区,因此在胞外区脱落并进入血液的情况下,这些可溶性的cxorf67胞外区就可成为血清检测的靶对象。
117.检测方法
118.利用cxorf67存在于肿瘤(如hr修复通路缺陷的肿瘤,较佳地,室管膜瘤)细胞或组织中,且与dna损伤修复抑制剂药物的敏感性密切相关这一特点,本发明还提供了检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性的方法。
119.在本发明的一个优选例中,本发明提供一种检测cxorf67的高通量二代测序法以及sanger测序、荧光定量pcr(qpcr)、原位免疫荧光法(fish)和免疫组化等。
120.检测试剂盒
121.基于cxorf67高表达的肿瘤细胞与dna损伤修复抑制剂药物的敏感性之间的相关性,即cxorf67高表达的肿瘤细胞对dna损伤修复抑制剂药物更敏感,因此cxorf67可以作为指导dna损伤修复抑制剂药物使用的一种生物标志物。
122.本发明还提供了一种用于检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性的诊断试剂盒,它含有检测cxorf67基因、mrna、cdna、或蛋白的检测试剂;以及标签或说明书,所述标签或说明书注明所述试剂盒用于检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性。
123.检测方法和试剂盒
124.本发明涉及定量和定位检测人cxorf67蛋白水平或mrna水平的诊断试验方法。这些试验是本领域所熟知的。试验中所检测的人cxorf67蛋白水平,可以用于检测肿瘤细胞对dna损伤药物的敏感性。
125.一种检测样品中是否存在cxorf67蛋白的方法是利用cxorf67蛋白的特异性抗体
进行检测,它包括:将样品与cxorf67蛋白特异性抗体接触;观察是否形成抗体复合物,形成了抗体复合物就表示样品中存在cxorf67蛋白。
126.cxorf67蛋白或其多核苷酸可用于cxorf67蛋白相关疾病的诊断和治疗。本发明的多核苷酸的一部分或全部可作为探针固定在微阵列或dna芯片上,用于分析组织中基因的差异表达分析和基因诊断。抗cxorf67的抗体可以固定在蛋白质芯片上,用于检测样品中的cxorf67蛋白。
127.本发明的主要优点包括:
128.(1)本发明首次发现,cxorf67是一个dna损伤响应蛋白,可以被招募至dna断裂位点。cxorf67并且可以抑制dna同源重组(homologous recombination,hr)修复。
129.(2)本发明首次发现,cxorf67高表达的肿瘤细胞对dna损伤修复抑制剂药物(如parp抑制剂)更敏感。
130.(3)本发明首次发现,cxorf67可以做为指导dna损伤修复抑制剂药物(如parp抑制剂)使用的一种生物标志物。
131.(4)本发明首次发现,cxorf67可用作检测肿瘤细胞对dna损伤修复抑制剂药物的敏感性的标志物。
132.(5)本发明首次发现,cxorf67的表达量与dna损伤修复抑制剂药物的敏感性相关。
133.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
134.除非特别说明,否则本发明实施例中所用材料和试剂均为市售产品。
135.通用方法
136.1、细胞培养
137.人u2os细胞和hek293t细胞购买于atcc;daoy细胞购买于中国科学院干细胞库;u2os dr-gfp细胞和u2os ej5-gfp细胞由浙江大学黄俊教授惠赠;u2os laco细胞由浙江大学汪方炜教授惠赠。所有的细胞系都在37℃,5%的二氧化碳培养箱中培养。所有的培养基购买自gibco,加10%的fbs(fetal bovine serum)使用。hek293t使用dmem培养基,u2os使用1640培养基,daoy使用mem培养基。
138.室管膜瘤原代细胞培养使用neurobasal培养基加b27、n2、glutamax、egf、fgf、heparin。poly-d(100mg,配成10mg/ml),过滤。10cm dish加入10μl。
139.fgf用含有0.1%bsa的pbs(0.22μm过滤)配置,配成5μg/ml。egf用含有0.1%bsa的pbs(0.22μm过滤)配置,配成10μg/ml。heparin用pbs配成250μg/ml,过滤。dnase i用无fbs的dmem培液配成1mg/ml(10
×
),过滤,-20度分装保存,工作浓度0.1mg/ml。
140.2、抗体
141.一抗:
142.rad51(ab88572,1:500if)、palb2(ab220861,1:1000wb)、h2a.x(ab11175,1:5000wb)购买于abcam公司。phosphor-h2a.x(ser139)(05-636,1:1000if,1:2000wb)购买于merck millipore。ha-tag(3724,1:1000if)、flag-tag(2368,1:1000wb)、myc-tag(2276,1:
ligation buffer,t4 pnk配好体系。pcr仪中37℃,30min;95℃,5min。逐渐降到25℃)。1:200稀释sgrna后,在连接体系中(pspcas9(bb)-2a-gfp(px458)all-in-one plasmid,diluted oligo,tango buffer,100mm dtt,10mm atp,fastdigest bbsi,t4 ligase)进行pcr反应(程序:37℃,5min;21℃,5min;8个循环)。将构建好的表达质粒转进u2os或daoy细胞中,24h后进行流式分选带有gfp的单细胞。将得到的单细胞铺进96孔板中,最后将来源于一个细胞长成的单克隆进行鉴定。
153.7、hr和nhej报告系统
154.day 1,铺u2os dr-gfp或u2os ej5-gfp细胞,6well每个孔铺20-30万细胞。day 2,用lipo3000转染i-scei质粒(3μg/孔)和cxorf67质粒。(i-scei质粒融合了一个rfp,可以用来分析转染效率)day 4,用胰酶消化细胞,进行流式分析(至少分析5万个细胞)。
155.8、蛋白纯化
156.取甘油菌100μl转接到10ml lb(k /amp ),12h后转接到1l tb培养基中,~3h左右,测od值~0.6-0.8。同时降温,取1ml菌留样检测。加iptg(1m,1:1000使用)。18℃诱导表达24h,取1ml菌检测。其余的离心收集-80℃保存。破菌仪预冷,水洗3次,buffer洗2次。离心机预冷。500ml菌用20ml buffer重悬,要充分,不能有小块。可同时加pmsf(终浓度0.15mm)。倒入破菌仪缓慢加压至800pa,3min左右变澄清,降压收出。13000rpm/1h/4℃。同时准备beads,单蒸水洗三遍,buffer洗两遍。500μl每个样。1750rpm/2min,降速设成2。his:上清倒入50ml管 甘油(终浓度5%) 咪唑(终浓度10mm) beads(28ml上清 1.4g甘油 70ul 4m咪唑 500μl beads)四度旋转2h。gst:上清倒入50ml管直接加500μl beads。上清直接挂柱,5倍beads体积洗三次,后面洗脱(his-tag的蛋白洗的时候分别是20,30,40mm的咪唑浓度,400mm咪唑洗脱,500μl接6-7管,分批加入和收集;gst用gsh洗脱)。
157.9、gst pull down
158.配置netn缓冲液(100mm nacl,20mm tris-hcl,0.5mm edta和0.5%np-40)。在500μl反应体系中加入0.25μg的his-cxorf67蛋白和gst-wd40蛋白或者gst蛋白,4℃旋转20min。然后加入25μl的gst beads,4℃旋转30min。然后用netn缓冲液洗3次beads。加25μl 2xsds loading煮样。
159.10、biotin-peptide pull down
160.取200μl streptavidin agarose beads,先用binding缓冲液(20mm hepes ph 7.5,100mm nacl,1mm dtt,1mm edta,0.01%igepal ca-630)洗3次。将beads分成3份,一份不加,另外两份分别加入10μg c67-wt,c67-mut peptide。4℃旋转1h。将beads用缓冲液洗3次,分别加1μg的gst-wd40蛋白。4℃旋转2h。将beads用缓冲液洗3次,加30ul 2xsds loading煮样。
161.11、免疫荧光
162.将盖玻片用酒精浸泡后在酒精灯火焰上快速烤几下,然后铺到24孔板中。加入培液浸润,然后洗掉培液。将细胞消化计数后,分至24孔板中。第三天将培液吸掉,加入200μl的4%pfa固定15min。用pbst(0.1%triton-x100)洗3次,加5%的bsa封闭1h。再用pbst洗3次,加入一抗溶液4℃放置过夜。隔天用pbst洗去一抗后,加入对应的荧光二抗和dapi,避光封闭1h。用pbst洗去二抗,然后用封片剂将盖玻片封闭在载玻片上,4℃避光保存。
163.12、免疫共沉淀
164.将细胞分至6孔板(外源)或10cm dish(内源)。配制lysis buffer(1xtriton lysis(1%triton,5mm edta,150mm nacl,50mm tris-hcl,ph7.4),10m naf,1xpi,1mm ppi,2mm na3vo4)。将细胞培液吸去后置于冰上,加入lysis buffer。放在摇床上10min。吸取细胞裂解液转至遇冷的1.5ml ep管中,离心13000rpm/15min/4℃。吸取上清转移至新的ep管中,取30μl加入30ul 2xsds loading煮样,做为input。剩余的加入0.25%的bsa和相应的抗体。4℃旋转2h或过夜。用去尖的枪头加30μl protein a/g agarose beads。4℃旋转2h。离心去上清后,用lysis buffer洗3次。加30μl 2xsds loading煮样。
165.13、室管膜瘤原代细胞培养
166.在医院新鲜切除的肿瘤组织放在装有neurobasal培液的50ml离心管中,1h内送到实验室。肿瘤组织送到实验室超净台,先用pbs(加penicillin-streptomycin)洗一遍,清洗血液。用灭菌的镊子和剪刀(提前灭菌)在pbs中把样本剪成小块(在60mm dish中操作)。也有在消化液中剪碎的,但是会有一些血液参杂,最好pbs中,可在清洗一次。把剪碎的样本及pbs转移到15ml离心管中,1000rpm/3min。加accutase消化酶,将离心管放置在37℃的摇床中。再加dnasei(0.1mg/ml)处理10min。将组织消化成单细胞后,用70μm细胞滤网将单细胞过滤到50ml离心管,再转移至15ml离心管离心(1700rpm/5min)。重选细胞计数,依据密度选60mm或10cm培养皿(培养皿要提前用laminin包被)。
167.14、小鼠移植瘤实验
168.订购5周龄balb/c nude免疫缺陷雄性小鼠,在spf级鼠房适应一周。将3x10
6 daoy细胞与matrigel 1:1混合,然后注射到裸鼠的右侧腹部。pdx来源的细胞:先将建模成功的pdx取出肿瘤,然后剪碎加accutase消化酶,消化成单细胞,计数3x106个细胞与matrigel 1:1混合,然后注射到裸鼠的右侧腹部。等到肿瘤体积达到50-100mm3左右时,可以开始给药。talazoparib溶在10%dmac、6%solutol和84%pbs中(母液是溶在dmso中,10mg/ml)。然后按0.33mg/kg,灌胃给药。一周给药5天。每天观察小鼠,一周记录两次小鼠体重和肿瘤大小。(肿瘤体积=(长
×
宽
×
宽)/2)。当肿瘤最大体积到达1000mm3时,给小鼠进行安乐死。
169.实施例1 cxorf67的表达量与dna损伤药物的敏感性相关
170.由于cxorf67是一个未知功能的蛋白,实验室通过对gdsc数据库分析发现发现cxorf67的表达量与dna损伤药物的敏感性相关。在gdsc数据库中对来自中枢神经系统的细胞系分析,筛选敏感性与cxorf67表达量相关的药物(p<0.05,pearson correlation>0.1)。发现了93种药物,在图1a红色标出。在做了靶点通路富集后,发现与dna损伤相关的药物最多,如camptothecin、etoposide、doxorubicin和bleomycin等(图1b)
171.实施例2 cxorf67是一个dna损伤响应蛋白
172.为了探究cxorf67是否在dna损伤修复中发挥作用。首先我们构建了pegfp-cxorf67的质粒,将质粒转染进u2os细胞利用激光微损伤的方法观察到cxorf67蛋白会在dna损伤的位点有募集(图2a)。为了进一步验证,后面做了染色质分离实验发现加cpt 0.1μm处理后cxorf67在染色质上含量增加(图2b)。后面利用免疫荧光实验发现:用ir或cpt处理后,可以在部分细胞中看到cxorf67有形成foci(图2c)。
173.实施例3 cxorf67抑制了dna损伤修复
174.根据前面的实验和生物信息学分析,推测cxorf67可能参与了dna损伤修复。ir和cpt都可以导致dna双链断裂,然后会引起组蛋白h2ax s139位的快速磷酸化(这时磷酸化的
h2ax称为γ-h2ax),随着dna的修复γ-h2ax的信号又逐渐降低至本地水平。首先利用u2os wt和ko细胞接受ir刺激,然后收集不同时间点的细胞去做western blot和免疫荧光分析γ-h2ax。在wb实验中发现:在起始的γ-h2ax 15min和1h信号没有差异,但是在4h以后ko细胞中的γ-h2ax信号下降的更快(图3a)。同时我们在u2os ko中回补cxorf67发现γ-h2ax的水平持续时间增加,暗示dna损伤修复减慢(图3b)。在免疫荧光实验中也发现起始的0.5hγ-h2ax也是没有差异,但是在24h ko和wt相比信号降的更快,而且在ko细胞中回补cxorf67可以回复这一现象(图3c)。为了更近一步确定,我们做了彗星电泳实验,也称为单细胞凝胶电泳分析,其基本原理就是未受损的细胞,核dna也就越完整,在电泳中无拖尾。细胞受损后,dna断裂产生片段,在电泳中产生迁移形成拖尾。我们的实验结果显示在ir处理后的0.5h,wt和ko产生的拖尾无明显差异,但是在4h发现ko的细胞与wt相比拖尾更短(图3d)。以上这些实验结果表明:cxorf67可能是一个抑制dna损伤修复的因子,在缺失cxorf67后细胞的dna损伤修复的能力增加。
175.实施例4 cxorf67抑制了hr,而不影响nhej
176.前面实验用到了ir和cpt处理,这两种dna损伤形式主要是产生了dna双链断裂损伤。双链断裂主要有两种修复方式:一种是同源重组修复(homologous recombination,hr),这是一种无错修复,在s期和g2期利用同源的姐妹染色单体作为模版修复;另外一种修复就是非同源末端连接(non-homologous end joining,nhej),这是一种错配修复,利用连接酶可以直接将dna末端进行连接,产生dna插入或缺失突变。
177.为了探究cxorf67在哪个修复通路中发挥作用,使用了u2os dr-gfp和ej5-gfp报告细胞系(lou et al.,2017)。在这两种报告细胞系中转入切割质粒i-scei,后面通过流式分析可以用来指示细胞中hr或nhej的修复效率。在细胞系中过表达cxorf67发现只抑制hr,而不影响nhej(图4a和4b)。
178.实施例5 cxorf67影响了rad51 foci形成
179.在hr修复中,一个关键的蛋白就是rad51,其可以通过brca1-palb2-brca2复合物被招募至dna损伤修复位点。通过观察dna损伤诱导的rad51 foci可以判断对hr的影响。发现在cpt处理下,u2os ko的细胞与wt相比形成了更多的rad51 foci,而且这种现象可以被转染cxorf67所回复(图5a)。后面观察rad51的上游rpa2和brca1,发现rpa2、brca1 foci并没有变化(图5b和图5c)。为了验证在不同细胞系中是否有同样的现象,后面我们在daoy细胞中同样做了相同的实验,也发现在cpt处理的情况下,ko与wt相比rad51 foci增加(图5d)。rpa2、brca1 foci并没有变化(图5e和图5f)。这些结果表明cxorf67可能在brca1和rad51之间发挥作用。
180.实施例6 cxorf67与palb2有结合
181.根据前面的实验结果:cxorf67影响rad51 foci而不影响brca1 foci,推测cxorf67可能在两者之间发挥作用。在daoy细胞中ip cxorf67,免疫沉淀中可以检测到palb2、brca1,而没有检测到rpa2和rad51(图6a)。在293t细胞中,转染cxorf67-ha、palb2-flag或brca1-flag,免疫沉淀cxorf67,可以看到cxorf67主要结合了palb2,而与brca1的结合很弱。再有palb2存在的情况下,cxorf67与brca1的结合增强,很有可能两者是间接的通过palb2结合的(图6b)。后面我们利用免疫荧光发现cxorf67与palb2在有无损伤刺激的情况下都有共定位(图6c)。我们推测cxorf67可能通过结合palb2发挥了作用。
182.实施例7 cxorf67结合palb2的wd40结构域
183.后面为了寻找cxorf67与palb2结合的区域,根据已知的palb2结构域将其分成了3个片段(图7a)。通过外源的免疫共沉淀发现cxorf67主要与palb2的wd40结构域结合(图7b)。为了验证cxorf67与wd40结构域的结合是否是直接的相互作用,我们纯化了全长的his-cxorf67蛋白和gst-wd40(853-1186aa)蛋白。通过gst pul l-down实验发现wd40确实和cxorf67有直接的相互作用(图7c)。
184.实施例8 cxorf67通过palb2-binding motif结合palb2
185.wd40已知对palb2的功能至关重要,而且brca2也主要结合palb2的wd40,进而招募rad51。非常有趣的是,通过蛋白序列比对我们发现cxorf67(420-432aa)与brca2的palb2-binding motif(26-38aa)有很强的同源性(图8a)。brca2的这一段小肽已经报道足可以结合palb2的wd40结构域,并且其中31位的色氨酸发挥了关键的作用,正好cxorf67的425位也是色氨酸。为了验证cxorf67的420-432氨基酸确实可以直接结合wd40结构域,合成了biotin标记的肽段。在用链霉亲和素pull-down实验中发现这一小肽足可以和wd40结构域结合。然而,w425c突变的肽段则不能结合(图8a)。在co-ip实验中,也发现将全长cxorf67的w425突变成了半胱氨酸后,发现cxorf67与palb2的结合减弱(图8b)。
186.为了检测cxorf67 w425突变后是否还有抑制hr的功能,利用u2os dr-gfp报告系统,发现在转染w425c突变的cxorf67后对hr的抑制作用明显减弱(图8c)。同时,我们在cxorf67 ko的daoy细胞中回补wt或w425c突变体,然后加cpt刺激的情况下,发现w425突变体抑制rad51 foci的能力明显下降(图8d)
187.实施例9 cxorf67可以抑制palb2-brca2结合
188.推测cxorf67发挥作用很有可能就是模拟了brca2的palb2-binding motif,竞争结合palb2来打断了brca2-palb2结合。通过co-ip实验发现,随着cxorf67转染量的增加,palb2和brca2的结合减弱(图9a)。此外,荧光共定位实验也发现,转染了cxorf67的情况下,palb2和brca2的共定位减弱(图9b)为了更近一步验证我们的猜测,使用了u2os-laco的细胞系。这个细胞系是将含有laco的质粒稳转进了u2os细胞,含有lacr标签的蛋白就可以结合laco序列(wang et al.,2010),这个系统可以在单细胞分子水平观察蛋白的共定位。首先构建了myc-lacr-palb2的质粒,转染进细胞系后,共转gfp-cxorf67,就可以观察到其在palb2处有特异性共定位(图9c)。后面为了验证cxorf67、palb2和brca2三者之间的关系,构建了gfp-lacr-palb2、myc-brca2-n(1-200)和ha-cxorf67质粒。发现在有cxorf67的情况下,brca2在palb2上的荧光信号富集就会减少(图9d)。通过这个单分子细胞水平共定位实验更近一步验证了前面的实验结果:一是cxorf67和palb2有相互结合,二是两者的结合可以抑制brca2与palb2的结合。
189.实施例10 cxorf67高表达的癌细胞对parp抑制剂更敏感
190.在高表达cxorf67的daoy细胞中进行了细胞存活实验测试,比较了c67-wt和ko的daoy细胞对parp抑制剂的敏感性差异,发现缺失了cxorf67的daoy细胞对抑制剂的敏感性减弱(图10a)。在ko细胞中回复cxorf67的表达与ko细胞相比,明显增加了细胞对parp抑制剂(talazoparib和olaparib)的敏感性(10b)。同时将构建的稳转细胞系注射到6周的balb/c裸鼠的皮下构建移植瘤模型,等到肿瘤长到100mm3时,给小鼠灌胃talazoparib(0.33mg/kg,5天/周),一周测量二次肿瘤体积,在28天后终止实验。实验结果发现回复cxorf67表达
的移植瘤对药物敏感性更高,在小鼠给药处理后肿瘤体积明显减少(图10c)。综上实验,可以发现高表达cxorf67的daoy细胞对parp抑制剂非常敏感。那么,在不表达cxorf67的肿瘤细胞中过表达cxorf67是否有同样的现象呢?收集了两株不表达cxorf67的人胶质母细胞瘤u251和u87,我们发现在这两株细胞中过表达cxorf67,可以使得肿瘤细胞对parp抑制剂更加敏感(图10d)。
191.实施例11 cxorf67在pfa中高表达并引起了dna损伤的累积
192.通过geo数据分析也证实了cxorf67确实在pfa中高表达(图11a),与复旦大学附属儿童医院合作,收集了2013年-2018年医院冻存的28例室管膜瘤样本(并依次进行了数字编号),这些肿瘤样本来自儿童,平均年龄3岁。在对冻存的样本进行western blot分析后发现在大部分肿瘤样本中都有cxorf67的表达,并且样本之间的表达差异很大。此外,我们同时还检测了反应dna损伤修复指标γ-h2ax的蛋白水平。有意思的是,发现cxorf67的表达量和γ-h2ax的蛋白水平有正相关(r=0.698,p=0.0075),这也在室管膜瘤的组织水平上验证我们前面的发现,即cxorf67的高表达可以抑制dna损伤修复(图11b)。
193.实施例12 cxorf67高表达的室管膜瘤对parp抑制剂更敏感
194.收集手术切除的新鲜室管膜瘤样本来建立一些研究体系。收集了5例新鲜室管膜样本(4例室管膜瘤样本,pfa 1-4和1例髓母细胞瘤,mb-1),检测了这5例肿瘤标本中cxorf67的表达量,发现pfa-1和pfa-4中cxorf67的表达较pfa-2和pfa-3要高,并且mb-1中没有检测到cxorf67的表达(图12a)。我们取pfa-1和pfa-2做了原代细胞培养和药物测试,发现高表达cxorf67的pfa-1与低表达cxorf67的pfa-2相比对talazoparib药物要更敏感(12b)。后面发现原代细胞的传代次数有限,而且体外培养可能已经改变了肿瘤的原来状态。因此,后面收集的新鲜肿瘤样本,我们构建了人源肿瘤异种移植模型(patient-derived tumor xenograft,pdx)。pdx模型相比于肿瘤细胞系更好的保留了肿瘤微环境,而且在组织病理形态上更接近于原始肿瘤,可以更好的用药物评估。我们将pfa-3,pfa-4和mb-1的新鲜肿瘤样本种植在nod-scid小鼠皮下,经过3-6个月的时间,长成第一代的pdx,后面我们取出pdx消化成单细胞,然后将3x106细胞注射到裸鼠的皮下,等到肿瘤长到50mm3时,给小鼠灌胃talazoparib(0.33mg/kg,5天/周)同时一周测量肿瘤体积。以1000mm3为小鼠的死亡终点绘制生存曲线,实验结果显示pfa-3和pfa-4给药组与不给药组相比,生存时间都有所延长,但是高表达cxorf67的pfa-4生存时间延长更加显著,而不表达cxorf67的mb-1在给药和不给药组中生存时间基本没有差异(图12c)。同时也发现pfa-4给药组小鼠的肿瘤体积明显变小(12d)。这些结果表明parp抑制剂对高表达cxorf67的室管膜瘤也是敏感的。
195.实施例13 cxorf67在其他癌症中的表达
196.后面进一步利用tcga数据分析,发现cxorf67在肾透明细胞癌(kidney renal clear cell carcinoma,kirc)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,kirp)等癌症中存在高表达(图13a)。并且对kirc和kirp的病人进行生存率分析,发现cxorf67高表达的病人愈后更差(图13b)。这些结果表明,cxorf67作为一个癌基因可能在肿瘤发生发展中扮演了一定的角色。
197.讨论
198.cxorf67在绝大多数的肿瘤细胞系中是不表达的,但是非常有意思的是cxorf67很特异的在室管膜瘤的pfa亚型中高表达。pfa主要发生在儿童的后脑部位,在过去的几十中
对其治疗方式几乎没有进展。目前仍主要以手术切除为主,放疗为辅,在化疗上仍没有取得一致的结论。本发明通过daoy细胞系和建立的pfa病人来源的原代细胞、pdx模型,都表明cxorf67的表达量越高对papr的抑制剂越敏感。以上的研究都表明,cxorf67是指导pfa病人用药的一个生物标标志物。此外,pfa病人中cxorf67特异的表达,也可作为室管膜瘤一个分子分类的指标。
199.参考文献
200.1.lou,j.,chen,h.,han,j.,he,h.,huen,m.s.y.,feng,x.h.,liu,t.,and huang,j.(2017).aunip/c1orf135 directs dna double-strand breaks towards the homologous recombination repair pathway.nat commun 8,985.
201.2.wang,f.,dai,j.,daum,j.r.,niedzialkowska,e.,banerjee,b.,stukenberg,p.t.,gorbsky,g.j.,and higgins,j.m.(2010).histone h3 thr-3phosphorylation by haspin positions aurora b at centromeres in mitosis.science 330,231-235.
202.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。