一种抗ca125的纳米抗体5d2及其应用
技术领域
1.本发明公开了一种纳米抗体,属于免疫学领域。
背景技术:
2.ca125(cancer antigen 125)卵巢癌相关抗原发现于1981年,是卵巢上皮性类癌的相关性抗原。由胚胎期上皮细胞分泌,正常情况下不分泌或极少分泌,但是当卵巢发生恶性病变时,即使临床上没有表现或病理上难以识别时,ca125值也会升高,因而是较好的卵巢癌诊断及筛查指标,并与卵巢癌的转移及预后有密切关系。ca125最初是由bast等通过卵巢细胞系ovca433免疫原,介导鼠源性单克隆抗体oc125应答,继而识别并确认其存在。ca125抗原为相对分子质量达200ku的糖蛋白,兼有膜结合型与游离型两种态性,是迄今为止研究最全面的卵巢癌血清标志物之一。90%进展期的卵巢癌患者血清中的ca125浓度都会呈现不同程度的升高。
3.尽管卵巢癌患者首选手术或化疗等治疗方法,但其预后的效果并不理想。肿瘤复发,尤其是腹腔内复发以及化疗耐药,往往是影响预后的重要因素。目前,卵巢癌新的治疗方案,特别是生物治疗技术发展迅速,且已部分应用于离体和体内研究及临床试验中。卵巢癌生物治疗包括细胞因子、单克隆抗体、转基因疗法等多种形式。在诸多途径中,ca125单克隆抗体疗法尤其引人瞩目。目前ca125单克隆抗体治疗卵巢癌的技术包括抗原抗体复合物介导人体免疫应答和放射性元素与抗肿瘤药物靶向性诱导两类。不仅如此,在卵巢癌的良恶性判断、分期等方面,ca125更是展现了其突出的特性。he等研究发现检测血清ca125诊断卵巢癌良恶性的准确率为88%,灵敏性92%,特异性80%,故认为血清ca125是鉴别卵巢癌良恶性的主要标记物(journal of obstetrics and gynaecology canada,2012,34:567
‑
574)。nakamura等研究发现血清ca125水平与卵巢癌的分期、淋巴结转移、病理类型密切相关,并且在同期卵巢癌患者中,血清ca125水平高者的生存率显著低于ca125水平低者(acta medica okayama.2012,66:53
‑
60)。
4.基于ca125在临床诊断方面所表现出的突出特性以及巨大应用前景,研发出针对ca125的特异性结合抗体,改善临床诊断效率成为现有技术的迫切需求。但是基于传统抗体的一些缺点,例如亲和力不高,免疫识别效率低下,对于一些隐蔽程度较高的抗原难以达到理想的结合效果。
5.1993年,hamers
‑
casterman等研究发现,在骆驼科动物(骆驼,单峰骆驼和美洲驼)的体内发现了一类仅有重链二聚体(h2)的抗体,其主要是igg2和igg3类型,此类抗体由于缺乏轻链,于是将这种抗体称为仅有重链的抗体(heavy chain only like antibody,hcabs),而它们的抗原结合部位由一个结构域组成,称为vhh区,因此该类抗体也被称为单结构域抗体或者单域抗体(sdab)。由于该类抗体为去除恒定区后的可变区序列,分子量只有15kda,大约10纳米的直径,因此也被称为纳米抗体(nbs)。另外,在鲨鱼中也观察到这类单结构域抗体,称为vnar。这种仅有重链的抗体原来只是作为一种人类b细胞增生性疾病(重链病)的病理形式被人们所认识。这种仅有重链的抗体可能是由于基因组水平的突变和
缺失而导致重链ch1结构域不能表达,使得表达出的重链缺乏ch1,从而缺乏与轻链的结合能力,因此形成一种重链二聚体。
6.相对于常规的四链抗体的scfv而言,纳米抗体在亲和力方面与其对应的scfv相当,但在可溶性、稳定性、对聚集的抗性、可重折叠性、表达产率以及dna操作、文库构建和3
‑
d结构测定的容易性方面超越scfv。
7.纳米抗体因来源于成年骆驼体内hcabs的最小的功能性抗原结合片段,具有高度稳定性和与抗原结合的高亲合力,能与蛋白裂隙和酶活性位点相互作用,使之作用类似于抑制剂。因此,纳米抗体可以为多肽模拟药物设计小分子酶抑制物提供新的思路。由于仅有重链,纳米抗体的制造较单克隆抗体容易。纳米抗体的独特性质,如处于极端温度和ph环境中的稳定性,可以低成本制造大产量。因此,纳米抗体在疾病的治疗和诊断中具有很大的价值及发展前景。
8.鉴于ca125分子量较大,且糖基化位点较多,常规抗体与之结合难以充分识别一些隐匿于间隙或空腔里的抗原决定簇,如果抗体识别抗原决定簇过于单一或者位点过于接近或者重叠,都会导致特异性的抗原抗体结合反应受到影响,从而严重影响检测效率。因此研发抗ca125的纳米抗体,充分发挥纳米抗体超强的抗原识别能力成为抗体技术领域的一种新的需求。本发明的目的就是提供一种能够充分发挥纳米抗体的优越性能,又能克服其固有缺陷的抗ca125的纳米抗体,即所述抗体既具有高度特异的抗原识别能力,具有高度的亲和力,并且具有独特的抗原决定簇识别位点,能够在ca125抗原的免疫检测特别是双抗体夹心法中获得优异的检测效率。
技术实现要素:
9.基于上述发明目的,本发明首先提供了一种抗ca125的纳米抗体,所述纳米抗体的可变区具有3个互补决定区cdr1、cdr2、cdr3,其中,cdr1的氨基酸序列如seq id no.1所示,cdr2的氨基酸序列如seq id no.2所示,cdr3的氨基酸序列如seq id no.3所示。所述抗体具有独特的抗原决定簇识别位点。
10.在一个优选的技术方案中,所述纳米抗体的可变区氨基酸序列如seq id no.4所示。在本发明中具有该可变区序列的纳米抗体的一个优选实施例的纳米抗体被命名为“5d2”。
11.其次,本发明提供了一种含有上述纳米抗体可变区的抗体,所述抗体还具有恒定区,所述抗体恒定区的氨基酸序列如seq id no.13所示。
12.第三,本发明还提供了一种编码上述纳米抗体的核酸,所述核酸的序列如seq id no.5所示。
13.第四,本发明提供了一种含有上述核酸的表达载体。
14.在一个优选的技术方案中,所述表达载体为pmes4。
15.第五,本发明提供了一种含有上述表达载体的宿主细胞。在一个优选的技术方案中,所述宿主细胞为大肠杆菌bl21(de3)。
16.最后,本发明还提供了上述纳米抗体在制备免疫法检测ca125试剂盒中的应用。
17.在一个优选的技术方案中,所述免疫法为双抗夹心免疫法,上述纳米抗体连接有抗体恒定区,并作为捕获一抗使用。第二抗体的可变区氨基酸序列如seq id no.6所示,在
本发明中具有该可变区序列的纳米抗体的一个优选实施例的纳米抗体被命名为“2h7”。
18.本发明提供的纳米抗体5d2对ca125抗原具有特异的识别和结合能力,该纳米抗体亲和力可达到3.051e
‑
10,且具有独特的抗原决定簇识别位点,因此,显示出本发明提供的纳米抗体具有高度特异的结合活性。另外,本发明提供的纳米抗体5d2在作为捕获一抗应用于双抗夹心免疫法检测ca125的方法中显示了优异的检测性能,其可以与作为酶标二抗的纳米抗体2h7配对使用,显示其与纳米抗体2h7在抗原识别表位上具有较低的重叠性,该特性得以保证本发明提供的纳米抗体于作为捕获一抗与特异性适配的酶标二抗应用于双抗夹心免疫法检测ca125的方法中。
附图说明
19.图1.sds
‑
page与western blot检测亲和纯化ca125鉴定图;
20.图2.sds
‑
page与western blot检测分子筛纯化ca125鉴定图;
21.图3.提取的总rna电泳鉴定图;
22.图4.第一轮pcr扩增抗体可变区基因电泳鉴定图;
23.图5.第二轮pcr扩增抗体可变区基因电泳鉴定图;
24.图6.pmes4载体双酶切反应产物电泳鉴定图;
25.图7.菌落pcr鉴定转化子电泳鉴定图;
26.图8.纳米抗体纯化sds
‑
page图;
27.图9.biacore分析纳米抗体亲和力曲线图。
具体实施方式
28.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的保护范围构成任何限制。
29.实施例1.天然ca125抗原的制备
30.1.1饱和硫酸铵沉淀法纯化卵巢癌患者腹水中的ca125
31.将2l卵巢癌患者的腹水在磁力搅拌器上冰浴搅拌,慢慢加入228g硫酸铵,使硫酸铵的终浓度为20%,4℃静置过夜,10000g离心10分钟,保留上清液。将上清液在磁力搅拌器上冰浴搅拌,慢慢加入524g硫酸铵,使硫酸铵的终浓度为60%,4℃静置过夜,10000g离心10分钟,保留沉淀。用约400ml pbs溶液吹打混匀沉淀,10000g离心10分钟,保留上清液。将上清液用100kd超滤管4000g浓缩至200ml,分装为50ml/管。
32.1.2免疫亲和层析纯化卵巢癌患者腹水中的ca125
33.在10ml离心管中加入置换了缓冲液的affi
‑
gel hz hydrazidegel与去除氧化剂的anti
‑
h ca125 mcab,颠倒混匀,用封口膜封口,将离心管插入浮漂固定好后,在30℃的水平摇床中混匀10
‑
24小时。将离心管在室温静置直至hydrazide gel沉降至管底,用1ml的微量移液器去除上层溶液后,加入5ml pbs溶液,颠倒混匀,室温静置直至hydrazide gel沉降至管底,用1ml的微量移液器去除上层溶液,重复用5ml pbs溶液洗3
‑
5次。将交联好的affi
‑
gel hz hydrazide gel与40ml腹水浓缩液加入到50ml离心管中,在30℃,240rpm水平摇床中亲和结合过夜。将affi
‑
gel hz hydrazide gel与腹水混合液通过重力柱,收集穿透液。用含0.5m nacl的pbs溶液洗脱10个柱体积(洗脱杂蛋白),用0.1m柠檬酸(ph 3.0)洗脱5个
柱体积(洗脱目的蛋白),收集洗脱液。将affi
‑
gel hz hydrazide gel用pbs溶液平衡5个柱体积。将收集的洗脱液用100kd超滤管4000g浓缩并置换为pbs溶液,至终体积为1ml,于
‑
20℃保存。将收集的洗脱液用0.22μm的滤膜过滤,与平衡过的affi
‑
gel hz hydrazide gel在50ml离心管中,于30℃,240rpm水平摇床中亲和结合过夜,经还原性sds
‑
page、western blot及质谱分析,亲和纯化的ca125(大小为180kd、55kd及25kd处均为ca125的部分蛋白条带)中含有部分人血清白蛋白(大小为70kd的蛋白条带)(图1:m为彩虹180广谱蛋白分子量标记;1
‑
3为亲和纯化后的ca125)。
34.1.3利用分子筛分离ca125及白蛋白
35.利用hiprep 16/60sephacryl s
‑
300high resolution(ge)分离亲和纯化后的ca125与白蛋白,将收集的洗脱液用10kd超滤管4000g浓缩洗脱液至1ml,通过还原性sds
‑
page及western blot分析纯化效果(图2:m为彩虹180广谱蛋白分子量标记;1为未经分子筛纯化的ca125;2
‑
9为分段收集的ca125洗脱液)。可见在3
‑
5段和7
‑
9段收集的蛋白中含有大部分的人血清白蛋白,因此将2段和6段收集的蛋白合并浓缩,即得到纯度较高的ca125蛋白。
36.实施例2.纳米抗体噬菌体展示文库的构建及筛选
37.2.1羊驼的免疫
38.选取健康成年羊驼一只,将ca125抗原(genbank:aao52683.1,通过hindⅲ和ecorⅰ两个酶切位点构建在pcdna3.1载体上,通过人293细胞采用常规分子生物学技术进行表达)与弗氏佐剂按1:1的比例混匀,按6
‑
7μg/kg采用背部皮下多点注射的方式免疫羊驼,共免疫四次,免疫间隔为2周。之后采集羊驼外周血,用于构建噬菌体展示文库。
39.2.2驼源淋巴细胞的分离
40.将采集的羊驼外周血利用骆驼外周血淋巴细胞分离液试剂盒(天津灏洋公司,货号lts1076)说明书操作进行分离淋巴细胞,每2.5
×
107个活细胞加入1ml rna分离试剂,取1ml进行rna提取,其余
‑
80℃保存。
41.2.3总rna提取
42.将含有淋巴细胞的1ml tipure isolation reagent反复吹打,放置5分钟;加入200μl氯仿,涡旋30秒后继续放置5分钟;4℃,12000g离心15分钟,吸取水相转入新的ep管中;加入等量异丙醇,放置10分钟;4℃,12000g离心10分钟,弃上清;用1ml预冷的70%乙醇洗涤,4℃,7500g离心5分钟,弃上清并干燥5分钟;加入30μl rnase
‑
free水溶解沉淀,调整浓度到1μg/μl进行凝胶电泳检测,结果见图3。
43.2.4反转录合成cdna
44.根据逆转录试剂盒说明书(roche公司的transcripor first stand cdna synthesis kit)以2.3步骤获得的rna为模板进行逆转录cdna。
45.2.5抗体可变区基因扩增
46.将反转录得到的cdna作为模版进行pcr反应。扩增共进行两轮,第一轮pcr的引物序列如下:
47.call001:gtcctggctgctcttctacaagg
48.call002:ggtacgtgctgttgaactgttcc
49.pcr反应条件及程序为:95℃5分钟;95℃30秒,57℃30秒,72℃30秒,30个循环;72
℃7分钟。使用琼脂糖凝胶回收试剂盒胶回收700bp左右的条带,最终用水调整核酸浓度至5ng/μl(图4:m为trans 2k dna marker;1为第一轮pcr产物)。第二轮pcr的引物序列如下:
50.vhh
‑
back:gatgtgcagctgcaggagtctggrggagg
51.vhh
‑
for:ctagtgcggccgctggagacggtgacctgggt
52.pcr反应条件及程序为:95℃5分钟;95℃30秒,55℃30秒,72℃30秒,15个循环;72℃7分钟。使用pcr产物回收试剂盒纯化pcr产物(图5:m为marker;1为第二轮pcr产物)。
53.2.6载体构建
54.将pmes4(购自biovector)与第二次pcr产物分别进行psti、bsteii双酶切,取1.5μg酶切后载体和450ng酶切后的第二次pcr产物,加15μlt4 dna连接酶,补充缓冲液和水至150μl总体积,16℃过夜连接并回收连接产物。使用pcr产物回收试剂盒进行产物回收,20μl水洗脱。1%琼脂糖电泳凝胶检测pmes4载体双酶切结果(图6:m为trans 2k dna marker;1为pmes4载体未酶切质粒;2为pmes4载体双酶切后产物)。
55.2.7电转化及库容测定
56.取10μl纯化后的连接产物,加入到含有50μl大肠杆菌tg1感受态细胞的预冷电转杯中置入电转仪(美国btx的ecm630电转仪)进行电转化,取出电转杯,复苏并培养转化子。随机挑选克隆,进行菌落pcr鉴定(图7:m为marker;1
‑
19为随机挑选的单克隆pcr鉴定产物)。根据pcr阳性率推算库容(库容量=克隆数
×
稀释倍数
×
pcr鉴定阳性率
×
10)。引物序列如下:
57.mp57:ttatgcttccggctcgtatg
58.giii:ccacagacagccctcatag
59.2.8噬菌体扩增
60.取复苏的菌液接种至yt
‑
ag培养基中,37℃200rpm培养到培养物od
600
=0.5。取出10ml菌液加入4
×
10
10
vcsm13,37℃静止感染30分钟。4000rpm,常温离心10分钟,去净上清。用2
×
yt
‑
ak(含氨苄青霉素和卡那霉素)培养基重悬菌体,37℃200rpm培养过夜。离心取上清40ml管中,加入10ml peg/nacl(20%/2.5m)溶液充分混合,离心弃上清,沉淀用1ml冰pbs洗涤离心,取上清250μl预冷的peg/nacl,充分混匀并洗涤重悬。
61.测定噬菌体滴度:将tg1培养至od
600
=0.4,用lb培养基梯度稀释噬菌体,取倍比稀释的噬菌体tg1培养物混合培养,次日观察培养板中噬菌斑形成情况,对噬菌斑数在30
‑
300的稀释梯度平板进行计数并按照下列公式计算噬菌体滴度(pfu)。
62.噬菌体滴度(pfu/ml)=稀释倍数
×
噬菌斑数目
×
100
63.2.9纳米抗体筛选
64.通过elisa方法以抗原筛选阳性克隆。以抗原包被elisa板,5%bsa封闭,pbst洗涤。每孔加入100μl噬菌体上清液,37℃放置1小时。弃上清,加入hrp标记的小鼠抗m13的二抗,37℃放置1小时。弃上清,加入tmb溶液,室温孵育5小时,每孔加入2m硫酸终止液,用酶标仪450nm读数。
65.2.10纳米抗体在大肠杆菌中的表达和纯化
66.挑选噬菌体elisa结果阳性的克隆,提取质粒并转化至菌株bl21感受态细胞,以iptg诱导纳米抗体蛋白表达,收集上清(周质提取物),并将周质提取物透析至pbs,使用ni
‑
nta树脂进行纯化,使用不同浓度咪唑进行洗脱和收集,将收集的样品进行还原型蛋白电泳
分析,最后将纳米抗体透析到pbs中。
67.通过羊驼免疫、细胞分离、噬菌体文库的构建、纳米抗体的筛选,筛选出抗ca125的纳米抗体。用vector nti软件对测序结果进行抗体轻链和重链基因的分析,以确定可变区的框架区(framework regions,fr)和互补决定区(complementary determining regions,cdr)。
68.本发明筛选到的一个优选实施方案的纳米抗体被命名为“5d2”。通过dna测序,所述纳米抗体5d2重链核酸序列为seq id no.5所示,可变区氨基酸序列为seq id no.4所示,其中第1
‑
25位氨基酸序列为fr1,第26
‑
33位氨基酸序列为cdr1,第34
‑
50位氨基酸序列为fr2,第51
‑
57位氨基酸序列为cdr2,第58
‑
95位氨基酸序列为fr3,第96
‑
113位氨基酸序列为cdr3,第114
‑
124位氨基酸序列为fr4。
69.实施例3.纳米抗体5d2的制备
70.3.1纳米抗体原始菌株tg1扩增及纳米抗体重组质粒转化大肠杆菌bl21(de3)
71.将含有纳米抗体核酸的原始菌株tg1甘油菌,按照1:1000比例接种于5ml新鲜lb
‑
a培养基,37℃200rpm过夜培养。次日,使用plasmid mini kit(omega)按照说明书提取质粒。经验证后将上述质粒1μl转化于100μl感受态细胞中,轻轻混匀,冰上放置30分钟,42℃水浴热击90秒,冰浴冷却3分钟。向离心管加入600μl lb培养基,37℃振荡培养60分钟。取上清100μl,用三角涂布器涂布在lb
‑
a平板上,37℃倒置培养过夜。
72.3.2纳米抗体的诱导表达
73.挑取上述单克隆菌落于lb
‑
a培养基中,37℃振荡培养过夜。次日,取该菌液按照1:100比例加入100ml新鲜lb
‑
a培养基,37℃振荡培养3小时至菌液od
600
=0.8左右,加入终浓度为1mm iptg,30℃诱导过夜。第三日,8000rpm,离心10分钟收集菌体,加入1.5ml的预冷tes缓冲液重悬沉淀。冰浴2分钟后,轻柔振荡30秒,重复此循环6次。加3.0ml tes/4(将tes用水稀释4倍),轻柔振荡30秒后,冰浴静置2分钟,同样重复振荡和静置步骤共6次。9000rpm,4℃离心10分钟,收集约4.5ml的上清(周质提取物)。
74.3.3纳米抗体的纯化和鉴定
75.将imac sepharose(ge公司)重悬后,取2ml加入到重力柱内,静置30分钟,使sepharose自然沉降于重力柱底部,流出保存缓冲液。加入2倍柱体积的硫酸镍溶液(0.1m),按照约8秒/滴的流速流出硫酸镍溶液;加入10倍柱体积的平衡缓冲液平衡并洗涤sepharose,流速维持不变;将样品使用平衡缓冲液2倍稀释后,加入重力柱中,调节流速为6秒/滴,收集穿透液;加入10倍柱体积洗涤缓冲液洗涤sepharose,维持流速不变,收集洗涤液;加入3倍柱体积的洗脱缓冲液,流速维持在6秒/滴,收集含有目的蛋白的洗脱液;最后依次加入10倍柱体积的平衡缓冲液、10倍柱体积的纯水和10倍柱体积的20%乙醇洗涤sepharose,并最终保留4ml的20%乙醇来保存柱子。上述收集的样品分别进行sds
‑
page检测(图8:m为彩虹180广谱蛋白marker;1为大肠杆菌诱导表达纯化后的纳米抗体)。
76.实施例4.纳米抗体与抗原的亲和活性测定
77.4.1芯片抗原偶联
78.将抗原用不同ph的醋酸钠缓冲液(ph 5.5,ph 5.0,ph 4.5,ph 4.0)配制成20μg/ml的工作液,同时准备50mm的naoh再生溶液,利用biacore t100蛋白相互作用分析系统仪器中的模板方法对不同ph条件的抗原与芯片(ge公司)表面之间的静电结合进行分析,以信
号增加的量达到5倍rl为标准,选择合适的最偏中性的ph体系并根据需要调整抗原浓度作为偶联时的条件。按照仪器中自带的模板方法对芯片进行偶联:其中1通道选择空白偶联模式,2通道选择target偶联模式,目标设置为设计好的理论偶联量。偶联过程大概耗时60分钟。
79.4.2分析物浓度设置条件探索及再生条件优化
80.采取手动进样模式,选择1,2通道2
‑
1模式进样,流速设置为30μl/分钟。进样条件均为120秒,30μl/分钟。再生条件均为30秒,30μl/分钟。首先持续空走运行缓冲液直至所有基线均稳定。准备浓度跨度较大的纳米抗体溶液,以运行缓冲液配置,建议设置200μg/ml,150μg/ml,100μg/ml,50μg/ml,20μg/ml,10μg/ml,2μg/ml。准备再生溶液,选择谷氨酸盐酸体系四个ph梯度的再生溶液:1.5,2.0,2.5,3.0。手动进样200μg/ml分析物样品,观察2通道,从最偏中性ph的再生缓冲液进行再生,直至2通道再生后的响应线回到与基线同一高度。再手动进样一次200μg/ml分析物样品,观察2
‑
1通道的信号变化并记录结合量,用上一步中最后使响应线回到基线的再生溶液进行再生后,再次收手动进样200μg/ml分析物样品,观察2
‑
1通道的信号变化并记录结合量与刚才的结合量数值对比,若偏差小于5%,即认为此ph的再生溶液为最佳的再生溶液,若再次进样的结合量偏低,则继续以更低ph的再生缓冲液进行实验。以选择的最佳再生溶液,作为每次进样后的芯片表面再生试剂。分别进样上面设置的分析物浓度样品,并对每个浓度的结合量进行分析,最终确定亲和力测试所需的浓度梯度。
81.4.3亲和力测试
82.按优化好的样品浓度梯度,再生溶液,使用仪器自带的模板方法(其中设置进样条件为60秒,30μl/min;解离时间:600秒;再生条件:30秒,30μl/min)对纳米抗体及抗原之间的亲和力进行测试。随时观察2
‑
1通道的信号情况。亲和力测试过程大概耗时200分钟。
83.4.4结果分析
84.选择合适的几个浓度梯度的结合解离曲线采用1:1binding的模式对所有曲线进行拟合,最终得到亲和力数值及结合常数和解离常数等重要参数(见表1和图9)。抗ca125纳米抗体5d2的亲和力数值为3.051e
‑
10。其中,4h10、2h7和4c1均为中国发明专利申请cn108178799a中公开的三株纳米抗体。
85.表1:纳米抗体亲和力数据
86.样品编号结合常数解离常数亲和力5d27.624e 052.326e
‑
043.051e
‑
10vhh
‑
ca125
‑
4h102.381e 056.775e
‑
052.85e
‑
10vhh
‑
ca125
‑
2h75.374e 043.857e
‑
057.18e
‑
10vhh
‑
ca125
‑
4c11.593e 051.012e
‑
046.35e
‑
10
87.实施例5.纳米抗体的elisa叠加数据分析
88.5.1抗原饱和浓度的确定
89.以2μg/ml的浓度包被抗原,100μl/孔,4℃包被24小时,洗板5遍。以1%bsa作为封闭剂过夜封闭,洗板5遍。酶标板中加入不同梯度稀释的纳米抗体、阴性对照(阴性血清1:100)、pbs空白对照,37℃孵育30分钟,洗板5遍。加入1:4000比例稀释的hrp标记的羊抗羊驼igg,37℃孵育30分钟,洗板5遍。加tmb显色液,37℃孵育10分钟,2m硫酸终止反应。读取吸光
值450nm读数,绘制抗体饱和曲线,根据结果选择随浓度增加读数不再增加的浓度为饱和浓度。
90.5.2位点叠加实验
91.先加入第一种抗体进行反应,洗板后再加第二种抗体,洗板后加酶标二抗,tmb显色读数(方法同5.1)。计算两株抗体叠加率ai,ai>50%说明被测2株抗体抗原位点不同,ai<50%说明被测两株抗体抗原表位相同,ai值越大,位点重叠可能性越低。公式为:ai=[2
×
a(1 2)
‑
(a1 a2)]/a(1 2)
×
100%
[0092]
a1—第一株抗体读数
[0093]
a2—第二株抗体读数
[0094]
a(1 2)—叠加2种抗体读数
[0095]
表2:抗体抗原表位叠加实验
[0096] 1st抗体2nd抗体1st抗体 2nd抗体叠加率5d2 4h100.4940.6380.91376.0%5d2 2h70.4940.5271.127109.4%5d2 4c10.4940.4890.69257.9%4h10 2h70.5730.5980.83760.1%4h10 4c10.5730.6210.97577.5%2h7 4c10.6110.6300.93967.8%
[0097]
实验结果见表2,5d2与4h10、2h7和4c1三株纳米抗体分别针对ca125抗原不同的抗原表位,这预示着在ca125的检测应用上,该三株纳米抗体组成检测抗体对的几率大大增加,从而可以增大检测效率。
[0098]
实施例6.利用biacore分析纳米抗体结合位点
[0099]
biacore系统主要原理就是通过表面分子的浓度改变使spr(折射率)发生偏移,在监测器上表现为ru值的变化。由于该系统的灵敏度更高,本发明设计了相关实验来验证elisa叠加的实验结果。首先重复进2针第一个纳米抗体a,观察ru值的变化,以确认相应的抗原结合位点的饱和并记录;之后进入第二个纳米抗体b,观察并记录ru值:如该ru值比单一的纳米抗体b的ru值相差不超过20%,即可认为两者识别不同的抗原决定簇;如相差值超过20%但低于60%,认为两者有位阻效应;若相差值超过了60%,判定两者识别了同一抗原。具体操作为首先单纯进样抗体b记录ru增加值r
b1
,并对芯片再生;之后重复进两次抗体a,记录ru增加值r
a
,并确认饱和后,直接进样抗体b,观察ru值的增加量r
b2
;之后使用公式(r
b2
‑
r
a
)/r
b1
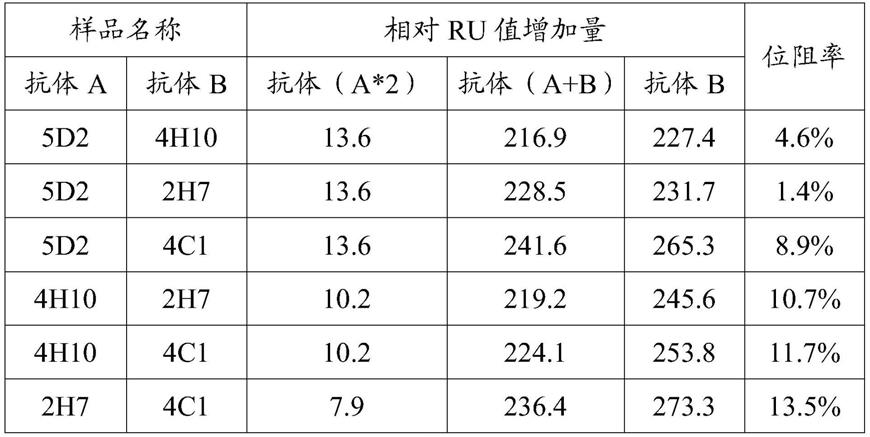
来计算位阻率,以此判定二者是否识别同一抗原决定簇。该实施例结果见表3。可见5d2纳米抗体与4h10、2h7和4c1纳米抗体均识别不同抗原位点,该结果与elisa叠加实验推测的结果一致,验证了该三株纳米抗体在ca125检测领域的应用前景。
[0100]
表3:biacore检测纳米抗体叠加实验ru值变化表
[0101][0102]
实施例7.5d2在检测标准血清中的ca125含量中的应用
[0103]
以人碱性磷酸酶的结合位点序列作为化学发光区氨基酸序列,如seq id no:7所示。4h10或2h7或4c1纳米抗体作为二抗,其可变区序列含有如seq id no.8或seq id no.6或seq id no.9所述的氨基酸序列所示,使之通过柔性多肽与发光区相融合成为带有化学发光区序列的纳米抗体4h10
‑
hap、2h7
‑
hap和4c1
‑
hap,其氨基酸序列如seq id no:10、seq id no.11和seq id no:12所示。在所述核酸编码序列的两个末端添加有hindⅲ和ecorⅰ两个酶切位点,以该两个酶切位点连接到载体pcdna3.1( )上。无内毒素大提质粒后利用状态处于对数生长的293细胞进行转染。获得转染的细胞培养至36小时后将细胞培养液倒入50ml离心管中,12000g离心5分钟,收集上清,用0.22μm滤膜过滤,利用阴离子交换层析对培养上清进行纯化。利用实施例3相同的方法对4h10
‑
hap、2h7
‑
hap和4c1
‑
hap进行亲和力测试,结果4h10
‑
hap的亲和力数值为1.193e
‑
11,2h7
‑
hap的亲和力数值为1.080e
‑
11,4c1
‑
hap的亲和力数值为6.904e
‑
11。经过筛选配对,结果见表4所示。选取fc融合纳米抗体5d2为捕获一抗(融合方法见cn106749667a中的实施例5),其氨基酸序列如seq id no:14所示,2h7
‑
hap为酶标二抗进行双抗体夹心免疫法检测血清标本中的ca125抗原,获得了优异的检测效果,具体过程如下:
[0104]
使用无菌cbs稀释捕获抗体至终浓度为10μg/ml;按照每孔100μl加入96孔酶标板中,4℃静置18小时;弃上清后,每孔加入300μl洗涤液,水平震动3分钟,吸弃上清;重复洗板四次。每孔加入200μl浓度为1%的bsa,于37℃静置1小时。重复洗板四次;每孔中加入50μl阳性对照、阴性对照或者待测样本;随即每孔加入50μl新鲜稀释的酶标二抗(即纳米抗体2h7
‑
hap,稀释至工作浓度为2μg/ml),置于摇床上摇动3~5秒;37℃下温育1小时。重复洗板四次,每孔加入100μl ap化学发光显色液(bm chemiluminescence elisa substrate),在摇床上摇动3~5秒;室温避光孵育10分钟;选择酶标仪程序luminescence,测定各孔的lum值并计算质控血清ca125值。结果5d2与2h7纳米抗体对线性指数r2>0.99。
[0105]
表4:纳米抗体5d2与4h10、2h7和4c1三株纳米抗体配对检测血清中ca125含量曲线线性指数结果
[0106]
捕获抗体检测抗体线性指数(r2)5d24h10
‑
hap0.8472
5d22h7
‑
hap0.99315d24c1
‑
hap0.7469
[0107]
本实施例显示,5d2与2h7配对使用,线性指数趋近于1,取得了优异的检测效果,显示其与纳米抗体2h7在抗原识别表位上具有较低的重叠性,该特性得以保证本发明提供的纳米抗体于作为捕获一抗与特异性适配的酶标二抗应用于双抗夹心免疫法检测ca125的方法中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

