1.本发明属于生物技术领域,具体涉及一种转谷氨酰胺酶的高效制备方法及其专用工程菌。
背景技术:
2.转谷氨酰胺酶(transglutaminase,ec 2.3.2.13,tgase)是一种通过异肽键[ε-(γ-谷氨酰基)赖氨酸]来催化蛋白质或多肽链之间的酰基转移反应的转移酶。它可以催化谷氨酰胺残基的γ-羧酰胺基与各种酰基受体发生反应,实现蛋白质分子内、分子间交联,从而极大地改变蛋白质的性质。由于其优良的交联性能,目前已广泛应用于食品和制药等行业以改善产品的硬度,粘度,弹性和持水能力等。tgase在自然界中广泛存在。1989年,微生物来源的tgase(microbial tgase,mtg)被首次发现,与其它来源tgase相比,mtg不受ca
2
或鸟嘌呤5'-三磷酸(gtp)的调节。由于一些蛋白质如酪蛋白、大豆球蛋白和肌球蛋白等对ca
2
敏感且容易被ca
2
沉淀,这就使得mtg在食品工业中具有更广泛的应用价值。此外,mtg具有更广泛的底物特异性,较低的脱酰胺活性,并且可以通过传统发酵技术降低生产成本等特点,使其在食品、生物制药、化妆品、纺织等领域有着更广泛的应用前景,尤其是在食品工业中,是生产各种新型蛋白类加工产品的重要酶制剂。
[0003]
内含肽是一种能够实现自我剪接的功能元件。目前为止,经过鉴定的约340个内含肽中的大多数都由两个结构和功能独立的结构域组成,即核酸内切酶结构域和剪接结构域。reca是一种来源于结核分枝杆菌的含有440个氨基酸的内含肽。经过不断的优化改造,最终确定保留其第1-110和383-440位残基是保留其剪切功能的最小作用单元。通过定向进化,确定含有两个突变位点即v67l和d422g的δicm能够增强其c端剪切活性并且这种剪切活性对ph有较强的敏感性。
[0004]
mtg通常以无活性的酶原形式(pro-mtg)分泌到胞外,经蛋白酶作用切除掉酶原区(pro区),才能形成有活性的成熟mtg。而pro区对mtg形成正确的空间构型并分泌到胞外具有重要的作用。目前mtg已在多种不同的表达系统中实现表达,但是依然存在包涵体,后期需蛋白酶二次处理等问题。也有一些研究利用内含肽在大肠杆菌、枯草芽孢杆菌中成功实现了mtg的表达,但是仍需经过ph或者温度变化的二次处理来实现pro区的剪切,极大的增加了工业生产成本及时间成本。
技术实现要素:
[0005]
本发明的目的是提供一种转谷氨酰胺酶的高效制备方法及其专用工程菌。
[0006]
本发明提供了一种蛋白质(蛋白质甲),为如下(a1)或(a2):
[0007]
(a1)序列表的序列2第1-546位氨基酸残基所示的蛋白质;
[0008]
(a2)序列表的序列2所示的蛋白质。
[0009]
编码所述蛋白质甲的核酸分子也属于本发明的保护范围。
[0010]
编码所述蛋白质甲的dna分子也属于本发明的保护范围。
[0011]
所述dna分子具体为如下(b1)至(b6)中的任一:
[0012]
(b1)编码区如序列表的序列1第6389-8023位核苷酸所示的dna分子;
[0013]
(b2)编码区如序列表的序列1第6386-8023位核苷酸所示的dna分子;
[0014]
(b3)编码区如序列表的序列1第6389-8041位核苷酸所示的dna分子;
[0015]
(b4)编码区如序列表的序列1第6386-8041位核苷酸所示的dna分子;
[0016]
(b5)编码区如序列表的序列1第6389-8044位核苷酸所示的dna分子;
[0017]
(b6)编码区如序列表的序列1第6386-8044位核苷酸所示的dna分子。
[0018]
具有所述dna分子的表达盒、重组载体或重组微生物均属于本发明的保护范围。
[0019]
所述重组载体具体为如下(c1)或(c2):
[0020]
(c1)具有序列表的序列1第6304-8044位核苷酸的重组载体;
[0021]
(c2)如序列表的序列1所示的重组载体。
[0022]
所述重组微生物是所述重组载体导入谷氨酸棒状杆菌(corynebacterium glutamicum)得到的。
[0023]
所述谷氨酸棒状杆菌具体可为谷氨酸棒状杆菌c.glutamicum t7。
[0024]
谷氨酸棒状杆菌c.glutamicum t7是将t7-plac导入谷氨酸棒杆菌atcc13032得到的重组菌。谷氨酸棒状杆菌c.glutamicum t7是将t7-plac整合到谷氨酸棒杆菌atcc13032的基因组dna后得到的重组菌。t7-plac为序列表的序列4第537-4951位核苷酸组成的dna分子。
[0025]
与谷氨酸棒杆菌atcc13032相比,谷氨酸棒状杆菌c.glutamicum t7的差异仅在于:用序列表的序列4第17-5461位核苷酸所示的双链dna分子取代了谷氨酸棒杆菌atcc13032的基因组dna中的序列表的序列5所示的双链dna分子。
[0026]
本发明还保护所述蛋白质甲或者所述核酸分子或者所述dna分子或者所述表达盒或者所述重组载体或者所述重组微生物在制备转谷氨酰胺酶中的应用。
[0027]
本发明还保护一种制备转谷氨酰胺酶的方法,包括如下步骤:培养所述重组微生物。
[0028]
制备转谷氨酰胺酶的方法还包括如下步骤:完成所述培养后,收集菌体并进行菌体破碎。
[0029]
制备转谷氨酰胺酶的方法还包括如下步骤:完成所述菌体破碎后收集上清液。
[0030]
制备转谷氨酰胺酶的方法还包括如下步骤:取所述上清液,通过镍柱亲和层析收集具有his6标签的蛋白质。
[0031]
制备转谷氨酰胺酶的方法还包括如下步骤:完成镍柱亲和层析后,脱盐并更换溶剂体系。溶剂体系具体可为ph8.0、50mm的tris-hcl缓冲液。
[0032]
培养所述重组微生物的方法具体包括如下步骤:
[0033]
(1)采用液态培养基培养所述重组微生物至od
600nm
值=1;
[0034]
(2)完成步骤(1)后,向培养体系中加入iptg并使其在体系中的浓度为0.1-1mm,然后进行培养。
[0035]
步骤(1)的培养条件可为:30℃、200r/min振荡培养。
[0036]
步骤(2)的培养条件可为:16-30℃培养。
[0037]
步骤(2)的培养条件可为:25℃、200r/min振荡培养48h。
[0038]
iptg在体系中的浓度具体可为0.5mm。
[0039]
所述液态培养基具体可为含17μg/ml氯霉素的发酵培养基。
[0040]
本发明还保护一种蛋白质(蛋白质乙),自n端至c端依次由如下元件组成:mtg的pro区、δicm内含肽、氨基酸残基m、mtg的成熟区。
[0041]
mtg即微生物来源的转谷氨酰胺酶。
[0042]
mtg具体为来源于茂源链霉菌(streptomyces mobaraensis)的mtg。
[0043]
mtg的pro区如序列表的序列2第2至46位氨基酸残基所示,或者如序列表的序列2第1至46位氨基酸残基所示。
[0044]
δicm内含肽为含有两个突变位点即v67l和d422g的δicm内含肽。
[0045]
δicm内含肽如序列表的序列2第47-214位氨基酸残基所示。
[0046]
mtg的成熟区如序列表的序列2第216-546位氨基酸残基所示。
[0047]
编码所述蛋白质乙的核酸分子也属于本发明的保护范围。
[0048]
编码所述蛋白质乙的dna分子也属于本发明的保护范围。
[0049]
具有所述dna分子的表达盒、重组载体或重组微生物均属于本发明的保护范围。
[0050]
所述重组微生物可用于生产转谷氨酰胺酶。
[0051]
所述重组微生物是将所述重组载体导入谷氨酸棒状杆菌得到的。
[0052]
本发明还保护一种蛋白质(蛋白质丙),自n端至c端依次包括如下区段:蛋白质乙、蛋白质标签。所述蛋白质标签具体可为his6标签。
[0053]
编码所述蛋白质丙的核酸分子也属于本发明的保护范围。
[0054]
编码所述蛋白质丙的dna分子也属于本发明的保护范围。
[0055]
具有所述dna分子的表达盒、重组载体或重组微生物均属于本发明的保护范围。
[0056]
所述重组微生物是将所述重组载体导入谷氨酸棒状杆菌得到的。
[0057]
所述重组微生物可用于生产转谷氨酰胺酶。
[0058]
本发明将来源于茂源链霉菌(streptomyces mobaraensis)的mtg在t7启动子下进行表达,并在mtg的pro区与成熟区之间插入δicm内含肽成功实现了mtg在谷氨酸棒杆菌中的高效表达,发酵所得菌体经超声破碎后,无需蛋白酶处理或者其他条件改变,即可得到具有生物活性的mtg。
[0059]
本发明得到的重组微生物,25℃发酵48h酶活可达13u/ml。
[0060]
本发明可用于制备转谷氨酰胺酶,进而应用于组织工程、纺织品和皮革加工等领域,具有应用推广价值。
附图说明
[0061]
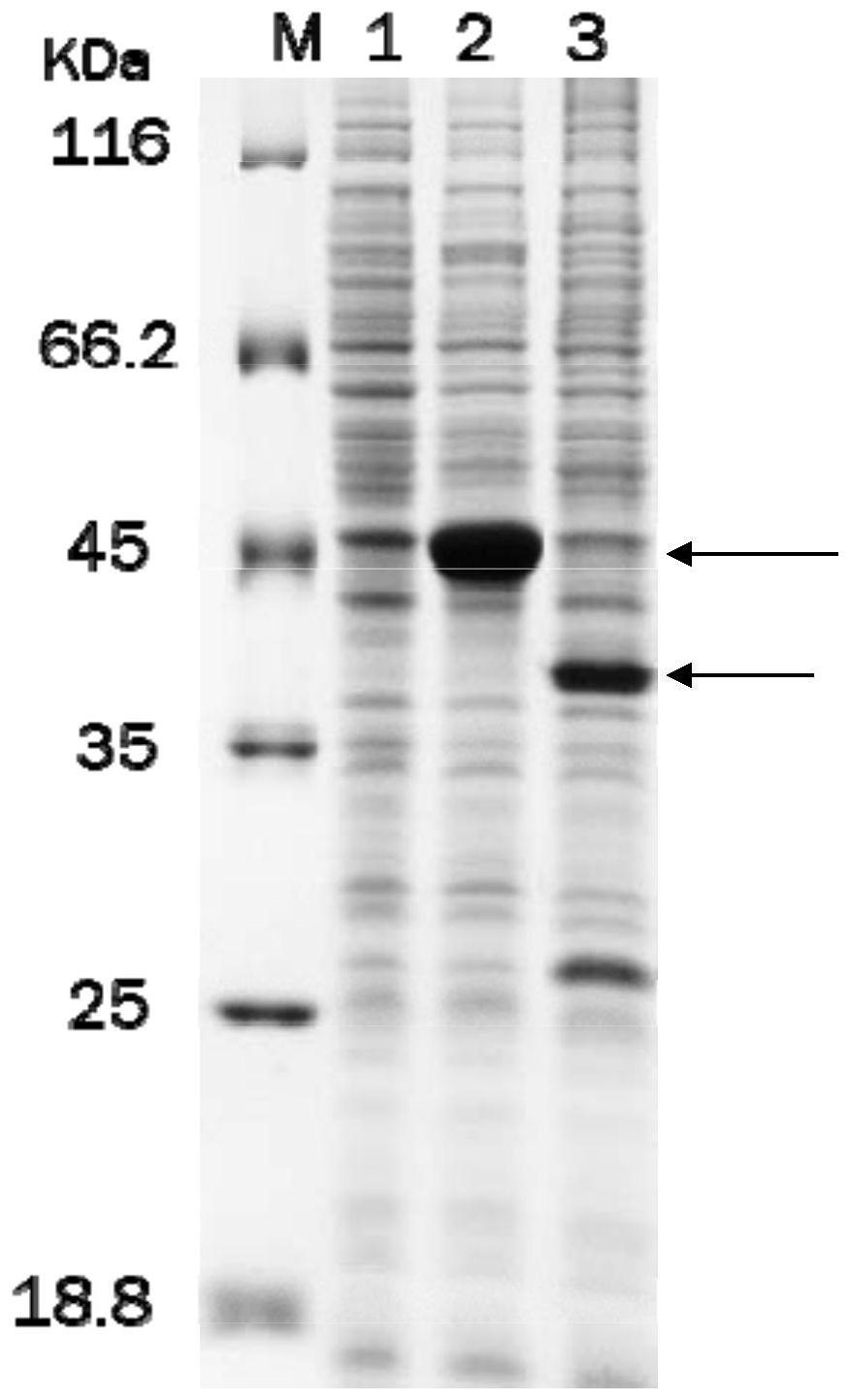
图1为实施例2的步骤五中的蛋白电泳图。
[0062]
图2为实施例3中的最适反应温度结果图。
[0063]
图3为实施例3中的温度稳定性结果图。
[0064]
图4为实施例3中的最适ph结果图。
[0065]
图5为实施例3中的ph稳定性结果图。
具体实施方式
[0066]
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。l-谷氨酸-γ-单羟基肟酸:sigma,产品编号g2253。n-苄氧羰基-l-谷氨酰甘氨酸(n-cbz-gln-gly):sigma,产品编号c6154。谷氨酸棒杆菌atcc13032即atcc13032的谷氨酸棒杆菌。
[0067]
脑心浸出液肉汤培养基(液体bhi培养基):将37g复合干粉溶于水并定容至1l。复合干粉:北京润泽康生物科技有限公司,品牌oxoid,货号cm1135b。
[0068]
发酵培养基(ph7.0):3-(n-吗啉基)丙磺酸21g、尿素5g、硫酸铵5g、磷酸氢二钾1g、磷酸二氢钾1g、酵母粉2g、葡萄糖40g、硫酸镁0.25g、氯化钙0.01g、生物素0.2mg、微量元素溶液1ml,用水补足至1l。微量元素溶液:feso4·
7h2o 16.4g、mnso4·
h2o 100mg、cuso
4 200mg、znso4·
7h2o 1g、nicl2·
6h2o 20mg,用水补足至1l。
[0069]
实施例1、构建重组质粒和重组菌
[0070]
一、构建重组质粒
[0071]
1、构建重组质粒pxmj19-pro-δicm-mtg。
[0072]
重组质粒pxmj19-pro-δicm-mtg为环形质粒,如序列表的序列1所示。
[0073]
序列表的序列1中,第6304-6322位核苷酸组成t7启动子,第6323-6347位核苷酸组成lac operator,第6350-6385位核苷酸组成rbs,第6386-8044位核苷酸为完整的开放阅读框(编码融合蛋白)。序列表的序列1中,第6386-6388位为起始密码子,第6389-6523位核苷酸编码pro区,第6524-7027位核苷酸编码δicm内含肽,第7028-7030位核苷酸编码氨基酸残基m,第7031-8023位核苷酸编码成熟mtg,第8024-8041位核苷酸编码his6标签,第8042-8044位核苷酸为终止密码子。
[0074]
融合蛋白如序列表的序列2所示。序列表的序列2中,第47-214位氨基酸残基组成δicm内含肽,第215位氨基酸残基为m,第216-546位氨基酸残基组成成熟mtg,第547-552位氨基酸残基组成his6标签。
[0075]
由于δicm内含肽的存在,融合蛋白发生自剪切(剪切位点为序列2的第214位氨基酸残基和第215位氨基酸残基之间),得到序列表的序列3所示的mtg-his6蛋白。
[0076]
2、构建重组质粒pxmj19-pro-mtg。
[0077]
与重组质粒pxmj19-pro-δicm-mtg相比,重组质粒pxmj19-pro-mtg的差异仅在于缺少了编码δicm内含肽的部分(即缺少了序列表的序列1中的第6524-7027位核苷酸)。
[0078]
二、构建谷氨酸棒状杆菌c.glutamicum t7
[0079]
1、采用限制性内切酶bamhi酶切pk18mobsacb质粒,利用gibson assembly试剂盒(neb)连接线性化质粒和t7同源重组片段,获得的重组质粒命名为重组质粒pk18-t7。
[0080]
t7同源重组片段为序列表的序列4所示的双链dna分子。序列表的序列4中,第17-502位核苷酸组成上游同源臂,第537-4951位核苷酸组成t7-plac,第4955-5461位核苷酸组成下游同源臂。
[0081]
2、将重组质粒pk18-t7电转化谷氨酸棒杆菌atcc13032(电击条件:电压2.5kv,电阻200ω,电容25μf),通过两次筛选获得重组菌(在含25mg/l卡那霉素的bhi平板上进行第
一次筛选得到单交换重组菌,之后在液体bhi培养基中培养过夜,之后在含200g/l蔗糖的bhi平板上进行二次筛选得到同源重组双交换菌株),即为谷氨酸棒状杆菌c.glutamicum t7。
[0082]
3、进行测序验证。
[0083]
与谷氨酸棒杆菌atcc13032相比,谷氨酸棒状杆菌c.glutamicum t7的差异仅在于:用序列表的序列4第17-5461位核苷酸所示的双链dna分子取代了谷氨酸棒杆菌atcc13032的基因组dna中的序列表的序列5所示的双链dna分子。谷氨酸棒杆菌atcc13032的基因组dna如genbank:nc_003450所示。
[0084]
三、构建重组菌
[0085]
将重组质粒pxmj19-pro-δicm-mtg导入谷氨酸棒状杆菌c.glutamicum t7,得到重组菌,命名为菌株cg-pxmj19-pro-δicm-mtg。
[0086]
将重组质粒pxmj19-pro-mtg导入谷氨酸棒状杆菌c.glutamicum t7,得到重组菌,命名为菌株cg-pxmj19-pro-mtg。
[0087]
实施例2、重组菌的摇瓶发酵
[0088]
一、菌株cg-pxmj19-pro-δicm-mtg的诱导发酵培养
[0089]
1、将菌株cg-pxmj19-pro-δicm-mtg单菌落接种至装有5ml含17μg/ml氯霉素的液体bhi培养基的试管中,30℃、200r/min振荡培养12h,即为种子液。
[0090]
2、将1ml种子液接种至装有50ml含17μg/ml氯霉素的发酵培养基的250ml锥形瓶中,30℃、200r/min振荡培养至od
600nm
值=1。
[0091]
3、完成步骤2后,向培养体系中加入iptg并使其在体系中的浓度为0.5mm,然后25℃、200r/min振荡培养48h,此时体系od
600nm
值为20左右,此时的体系命名为发酵产物。
[0092]
4、取发酵产物(菌量为:od
600nm
值
×
体积=20;体积单位为ml),12000r/min离心5min,收集菌体沉淀;将菌体沉淀重悬于1ml tris-hcl缓冲液(ph8.0、50mm),然后进行超声破碎(超声破碎参数:200w,工作5s停5s,总时间为20min),完成超声破碎后离心(10000
×
g,5min)收集上清液。
[0093]
二、菌株cg-pxmj19-pro-δicm-mtg的非诱导发酵培养
[0094]
不加入iptg,其他同步骤一。
[0095]
三、菌株cg-pxmj19-pro-mtg的诱导发酵培养
[0096]
用菌株cg-pxmj19-pro-mtg代替菌株cg-pxmj19-pro-δicm-mtg,其他同步骤一。
[0097]
四、蛋白电泳
[0098]
取步骤一得到的上清液,步骤二得到的上清液,步骤三得到的上清液,进行sds-page。
[0099]
电泳图见图1。图1中的各个泳道:泳道1:步骤二得到的上清液;泳道2:步骤三得到的上清液;泳道3:步骤一得到的上清液;泳道m:蛋白marker。
[0100]
结果表明:在不进行iptg诱导的情况下,菌株cg-pxmj19-pro-δicm-mtg不能产生目标蛋白;在没有δicm的情况下(即菌株cg-pxmj19-pro-mtg),不能产生成熟mtg。
[0101]
五、检测mtg酶活的方法
[0102]
mtg酶活定义:在37℃下每分钟催化生成1μmol l-谷氨酸-γ-单羟基肟酸所需要的酶量定义为1u。
[0103]
mtg酶活测定方法(比色法):
①
取200μl 37℃预热后的待测样本或待测样本稀释液(如无特殊说明,稀释采用的溶剂为ph6.0、0.2mol/l的tris-hcl缓冲液),加入500μl 37℃预热后的底物溶液,37℃反应10min,然后加入200μl终止剂,然后10000
×
g离心5min,收集上清液,525nm波长处测定吸光值;
②
以l-谷氨酸-γ-单羟基肟酸为溶质,以水为溶剂,制备不同浓度的标准品溶液,分别525nm波长处测定吸光值,制作标准曲线方程(标准曲线方程中,x为l-谷氨酸-γ-单羟基肟酸浓度,y为吸光值);
③
将步骤
①
得到的吸光值代入步骤
②
得到的标准曲线方程,计算得到待测样本的mtg酶活。
[0104]
底物溶液的制备方法:100mg n-cbz-gln-gly溶于2ml 0.2mol/l的naoh水溶液,然后加入4ml tris-hcl缓冲液(ph6.0、0.2mol/l)、2ml 0.1mol/l羟胺水溶液和2ml 0.01mol/l还原型谷胱甘肽水溶液,调ph至6.0。
[0105]
终止剂:含1mol/l hcl、4g/100ml三氯乙酸、5g/100ml fecl3·
6h2o,余量为水。
[0106]
六、检测mtg酶活
[0107]
取步骤一得到的上清液和步骤三得到的上清液,分别作为待测样本,检测mtg酶活,计算得到发酵产物的酶活。
[0108]
步骤一得到的发酵产物的酶活为13u/ml。
[0109]
步骤三得到的发酵产物的酶活为0u/ml。
[0110]
七、制备mtg-his6溶液并测序鉴定和检测酶活
[0111]
1、取步骤一得到的上清液,用0.22μm滤膜过滤,然后进行镍柱亲和层析,收集含有具有目标蛋白的过柱后溶液(目标蛋白即mtg-his6蛋白)。
[0112]
2、取步骤1得到的过柱后溶液,采用3kd孔径的柱式超滤膜和ph8.0、50mm的tris-hcl缓冲液进行脱盐,得到以ph8.0、50mm的tris-hcl缓冲液为溶剂体系的蛋白溶液,将该蛋白溶液命名为mtg-his6溶液。
[0113]
3、进行n-端测序
[0114]
取步骤2得到的mtg-his6溶液,进行12.5%sds-page,将其转印到pvdf膜上,并用丽春红染色检查转印效果。送北京大学生命中心蛋白质测序实验室采用edman法测定n-末端5个氨基酸序列为m-d-s-d-d。结果可知,菌株cg-pxmj19-pro-δicm-mtg在胞内表达融合蛋白,由于δicm内含肽的存在,融合蛋白发生自剪切(剪切位点为序列2的第214位氨基酸残基和第215位氨基酸残基之间),得到序列表的序列3所示的mtg-his6蛋白。上述步骤无需二次处理,即可得到有活性的mtg-his6蛋白。
[0115]
4、检测mtg酶活
[0116]
取步骤2得到的mtg-his6溶液,作为待测样本,检测mtg酶活。
[0117]
取步骤2得到的mtg-his6溶液,采用bradford法检测蛋白浓度。
[0118]
mtg-his6溶液的酶活除以mtg-his6溶液的蛋白浓度,得到mtg-his6蛋白比活力,为47u/mg。
[0119]
实施例3、mtg酶学性质的研究
[0120]
mtg-his6溶液为实施例2的步骤七制备的mtg-his6溶液。
[0121]
一、最适反应温度及温度稳定性
[0122]
1、最适反应温度
[0123]
取mtg-his6溶液,作为待测样本,检测mtg酶活。检测mtg酶活的方法参照实施例2
的步骤五。反应温度分别设置为30℃、37℃、45℃、50℃、55℃或60℃。
[0124]
将酶活最高点作为100%酶活,计算其他温度下的相对酶活。结果见图2。
[0125]
将酶活最高点作为最适反应温度。最适反应温度为50℃。
[0126]
2、温度稳定性
[0127]
取mtg-his6溶液,分别置于三个温度(40℃、50℃或60℃)下放置,每20分钟取样,作为待测样本,检测mtg酶活。
[0128]
取mtg-his6溶液,作为待测样本,检测mtg酶活,作为参比酶活。
[0129]
检测mtg酶活的方法参照实施例2的步骤五。
[0130]
将参比酶活作为100%,绘制热稳定性曲线。结果见图3。40℃处理100分钟约保留60%的活性,50℃处理20分钟活性基本丧失,60℃处理20分钟活性基本丧失。
[0131]
二、最适ph及ph稳定性
[0132]
底物缓冲液分别为:ph4.0、50mm的醋酸-醋酸钠缓冲液,ph5.0、50mm的醋酸-醋酸钠缓冲液,ph6.0、50mm的tris-hcl缓冲液,ph7.0、50mm的tris-hcl缓冲液,ph8.0、50mm的tris-hcl缓冲液,ph9.0、50mm的tris-hcl缓冲液。
[0133]
1、最适ph
[0134]
取mtg-his6溶液,用底物缓冲液稀释至10倍体积,作为待测样本,检测mtg酶活。
[0135]
检测mtg酶活的方法参照实施例2的步骤五。
[0136]
底物溶液的制备方法:100mg n-cbz-gln-gly溶于2ml 0.2mol/l的naoh水溶液,然后加入4ml底物缓冲液、2ml 0.1mol/l羟胺水溶液和2ml 0.01mol/l还原型谷胱甘肽水溶液,调ph至底物缓冲液的ph。
[0137]
将酶活最高点作为100%酶活,计算其他ph下的相对酶活。结果见图4。
[0138]
酶活最高点为最适反应ph。最适反应ph为8.0。
[0139]
2、ph稳定性
[0140]
取mtg-his6溶液,用底物缓冲液稀释至10倍体积,室温放置1h,作为待测样本,检测mtg酶活。
[0141]
取mtg-his6溶液,用ph8.0、50mm的tris-hcl缓冲液稀释至10倍体积,作为待测样本,检测mtg酶活,作为参比酶活。
[0142]
检测mtg酶活的方法参照实施例2的步骤五。
[0143]
将参比酶活作为100%,绘制ph稳定性曲线。结果见图5。ph8.0处理1h,活性基本没影响;ph5.0-7.0处理1h,保留80%以上活性;ph4.0处理1h,保留50%以上的活性;ph9.0处理1h,保留50%以上的活性。
[0144]
三、金属离子及edta、pmsf对酶活性的影响
[0145]
取mtg-his6溶液,作为待测样本,检测mtg酶活,作为参比酶活。
[0146]
取mtg-his6溶液,加入抑制剂并使其浓度为1mm,室温放置1h,作为待测样本,检测mtg酶活。
[0147]
检测mtg酶活的方法参照实施例2的步骤五。
[0148]
将参比酶活作为100%,计算各个抑制剂作用后的相对酶活。
[0149]
结果见表1。cu
2
、mn
2
、na
、k
、ca
2
、mg
2
对酶活有一定的抑制作用,但仍保留80%左右的活性。fe
2
对酶活有较强的抑制作用,经过处理后活性约丧失了70%。zn
2
对酶活抑
制作用最大,经过处理后95%活性基本丧失。edta对酶活并没有产生抑制作用。经过pmsf处理后,活性丧失了10%左右。
[0150]
表1
[0151]
供试液含有的抑制剂相对酶活(%)cuso482.57
±
4.63mnso477.12
±
4.07nacl81.26
±
7.92kcl81.78
±
6.69cacl282.96
±
4.46znso44.55
±
0.50feso428.55
±
0.22mgso482.01
±
5.09edta98.26
±
2.45pmsf88.16
±
6.00
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

