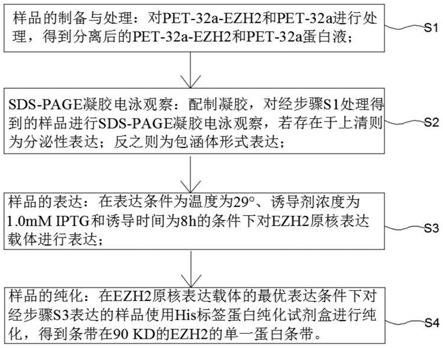
预防或治疗移植物抗宿主病(gvhd)的抗ccr7 mab的用途
发明领域
1.本发明一般涉及医学和药学领域,尤其涉及用于器官、组织或细胞移植和植入的生物制药领域。更具体地,本发明涉及可用于预防和治疗移植物抗宿主病的抗ccr7受体抗体。
背景技术:
2.近年来,造血干细胞移植(hsct)已经广泛用于治疗各种血液系统疾病的目的,如造血器官肿瘤、白血病或发育不良性贫血。此外,细胞移植在医学领域也是一种有用的治疗方法。根据在干细胞来源或供体选择中的差异对hsct进行分类。常见的干细胞来源包括从髂嵴采集的骨髓(aschan.j.br med bull.2006;77
‑
78:23
‑
36)、粒细胞集落刺激因子(g
‑
csf)或perixaflor动员的外周血干细胞(bacigalupo et al.,haematologica.2002aug;87(8suppl):4
‑
8)及脐带血(kestendjieva et al.,cell biol int.2008jul;32(7):724
‑
32)。当干细胞来自患者自身时,hsct可以是自体的,或当干细胞来自健康人时,hsct可以是同种异体的,所述健康人包括共享主要和次要组织相容性相同性的个体基因型相同的相关供体、人白细胞抗原(hla)相同的同胞供体、扩展的家族成员中hla匹配的供体、hla相同的不相关供体、错配的相关供体、错配的不相关供体、错配的脐带血供体、和单倍型错配的相关供体。
3.然而,且尽管使用了高度精细的治疗方法,hsct仍然与由许多并发症引起的相当高的死亡率有关,所述并发症例如移植物抗宿主病(gvhd)、感染性疾病、静脉闭塞性疾病、供体移植排斥以及基础疾病(underlying disease)的复发,其中gvhd是需要解决的同种异体hsct后最常见和最严重的并发症,因为其影响高达30
‑
70%的患者,并且与显著的发病率和死亡率相关。
4.gvhd通常分为急性和慢性形式。急性gvhd(agvhd)典型发生在移植之后100天的植入时间之间,且慢性gvhd(cgvhd)发生在hsct后100天之后的时间之间。这两种类型的gvhd根据疾病的临床严重性进一步细分至程度。然而,随着新的治疗方法,这种时间上的区别变得模糊,且其包括具有这两种特征的重叠综合征(ferrara,jl,et al.,lancet,2009.373(9674):p.1550
‑
61;filipovich,ah,et al.,biol blood marrow transplant,2005.11(12):p.945
‑
56)。此外,gvhd通常被认为是一种单一疾病,其分为两个阶段:在hsct后早期发生的急性期gvhd,以及在移植过程后期出现gvhd的慢性期(macdonald et al.blood.2017;129(1):13
‑
21)。
5.急性gvhd主要影响皮肤、胃肠道和肝脏。皮肤损伤通常包括斑丘疹,其在最极端的情况中会出现水疱和溃疡,伴有大疱和类似于stevens
‑
johnson综合征的中毒性表皮坏死松解症。胃肠道表现包括腹部绞痛和疼痛、腹泻、便血、肠梗阻、厌食、恶心和呕吐。肝病是由于胆小管受损导致胆汁淤积,且从而导致高胆红素血症和碱性磷酸酶升高。
6.慢性gvhd通常类似于自身免疫性疾病,如系统性硬化症等,其硬化和纤维化通常影响皮肤、眼、口腔、肠道、肝、肺、关节和泌尿生殖系统。典型的皮肤表现是硬化和皮肤异色
病以及苔藓样病变。在肺的情况中,闭塞性细支气管炎是细支气管损伤和阻塞的结果,并导致高死亡率。
7.造血系统在急性和慢性gvhd中也普遍受到影响,伴有胸腺损伤和血细胞减少。
8.一些预防、治疗或抑制gvhd的方法是使用免疫抑制药物,例如钙调磷酸酶抑制剂(环孢菌素a(cyclosporin a)和他克莫司(tacrolimus,fk506)、抗增殖剂(氨甲蝶呤(methotrexate)和吗替麦考酚酯(mycophenolate mofetil))、mtor抑制剂(西罗莫司(sirolimus)或雷帕霉素(rapamycin))以及类固醇如强的松(prednisone)。近来的方法旨在预防或限制自身反应性t或b淋巴细胞的活化和/或增殖,包括使用环磷酰胺或抗胸腺细胞球蛋白(atg)和其它处理方法在体内从移植细胞群(移植物)中去除成熟t细胞,所述其它处理方法如身体外光分离法(extracorporeal photoapheresis)、单克隆抗体如利妥昔单抗(rituximab)、阻碍b细胞信号传导的激酶抑制剂、调节性t细胞扩张物等。然而,尽管这些进展是有希望的,但糖皮质激素仍然构成标准的一线治疗,即使长期使用有很大的副作用,因为这些药物具有非特异性和广泛的免疫抑制作用,其毒性很高,并因此由于免疫系统受损导致的感染性疾病或肿瘤复发成为一个难题(zeiser and blazard.n engl j med 2017;377:2565
‑
79.doi:10.1056/nejmra1703472)。因此,目前仍期待开发一种更有选择性地避免gvhd的有效治疗或预防方法和药物。因此,本领域仍然需要不具有现有技术方法的严重缺点的替代和改进的治疗方法。
9.人cc基序受体7(在下文称作“ccr7”)是一种七个跨膜结构域g蛋白偶联受体(gpcr),最初发现其通过ebv感染以淋巴细胞选择性方式表达(birkenbach et al.,1993,j.virol.67:2209
‑
2220)。ccr7选择性结合名为ccl19和ccl21的两种趋化因子。在内稳态和炎症中,ccr7在初始t和b淋巴细胞、中枢记忆t细胞(tcm)、天然杀伤细胞(nk细胞)的一些亚群、半成熟和成熟dc以及浆细胞样dc上表达(forster r,et al,.cell1999;99:23
–
33.;comerford i,et al.cytokine growth factor rev.2013jun;24(3):269
‑
83)。在这些白细胞亚群中,ccr7控制迁移、组构和激活。
10.一些出版物报告表达ccr7的供体t细胞可能与gvdh发病机制相关(portero et al.,2014,blood 124:3930;portero
‑
sainz et al.2017,bone marrow transplant.52,pg:745
–
752;coghill et al.,2010,blood.115(23):4914
‑
22)。然而,这些文献无一揭示了可以将ccr7靶向有效地用于预防或治疗gvhd而没有现有技术方法副作用的缺点。
11.因此,本发明的一个目的是提供克服用于预防和治疗gvhd的现有技术方法的缺点的药物和治疗方法。特别地,本发明的一个目的是改善同种异体hsct的存活率。
技术实现要素:
12.第一方面,本发明涉及抗ccr7抗体或其抗原结合片段,用于在包含供体细胞的移植物的接受者中预防或治疗移植物抗宿主病(gvhd)。优选地,抗ccr7抗体具有不超过100nm的ic50,用于通过选自ccl19和ccl21的至少一种ccr7
‑
配体抑制ccr7依赖性胞内信号传导和ccr7受体内在化中的至少一项。更优选地,抗ccr7抗体抑制ccr7依赖性胞内信号传导而没有明显的激动作用。最优选地,抗ccr7抗体对于人ccr7的n末端胞外结构域具有的kd比参考抗ccr7抗体的kd高不超过20倍,由此参考抗ccr7抗体是小鼠抗ccr7抗体,其重链可变区的氨基酸序列是seq id no:1且其轻链可变区的氨基酸序列是为seq id no:2。
13.在一个实施方案中,用于所述用途的根据本发明的抗ccr7抗体或其抗原结合片段是嵌合抗体、人源化抗体或人抗体。优选地,抗ccr7抗体是这样的抗体,其具有重链可变结构域的氨基酸序列是seq id no:1且轻链可变结构域的氨基酸序列是seq id no:2的抗人ccr7抗体的hvr。
14.在一个实施方案中,用于所述用途的根据本发明的抗ccr7抗体或其抗原结合片段是在接受者中起以下作用的至少一项的抗ccr7抗体:杀伤表达ccr7的细胞、诱导表达ccr7的细胞的细胞凋亡、阻断表达ccr7的细胞的迁移、阻断表达ccr7的细胞的活化、阻断表达ccr7的细胞的增殖和阻断表达ccr7的细胞的播散。
15.在本发明的在接受者中预防或治疗gvhd的方法或用途中,包含供体细胞的移植物优选是包含器官、组织、祖细胞、干细胞和造血细胞的一种或多种的移植物。更优选地,包含供体细胞的移植物是包含造血干细胞或祖细胞的移植物。最优选地,接受者患有恶性病症及其中优选预防或治疗ghvd维持或促进移植物抗肿瘤作用或移植物抗白血病作用。
16.在本发明的在接受者中预防或治疗gvhd的方法或用途中,优选ghvd的预防或治疗包括如下至少一项:a)在所述接受者接受包含所述供体细胞的所述移植物之前,向所述接受者施用所述抗ccr7抗体;b)在所述接受者已接受包含所述供体细胞的所述移植物之后,且优选在所述接受者表现出ghvd症状之前或在所述接受者已被诊断患有ghvd之前,向所述接受者施用所述抗ccr7抗体;c)在所述接受者已接受包含所述供体细胞的所述移植物之后,且优选在所述接受者表现出ghvd症状之后或在所述接受者已被诊断患有ghvd之后,向所述接受者施用所述抗ccr7抗体;d)向接受包含所述供体细胞的移植物的所述接受者施用所述抗ccr7抗体,所述移植物在移植前已通过与所述抗ccr7抗体或其抗原结合片段的离体孵育而制备;以及e)在ghvd复发后向所述接受者施用所述抗ccr7抗体。
17.另一方面,本发明涉及从供体中离体制备器官、组织或细胞制备物以移植到接受者中的方法,所述方法包括如下步骤:a)将器官、组织或细胞制备物与如上定义的抗ccr7抗体或其抗原结合片段一起孵育,由此抗ccr7抗体起如下至少一项作用:i)在所述器官、组织或细胞制备物中降低表达ccr7的供体细胞的数量,及ii)在所述器官、组织或细胞制备物中抑制表达ccr7的供体细胞的活性;以及b)任选从所述器官、组织或细胞制备物中去除抗ccr7抗体和表达ccr7的供体细胞中的至少一种。优选地,在所述方法中,抗ccr7抗体包含在用于在移植前保存所述器官、组织或细胞制备物的保存溶液中。更优选地,在所述方法中,将所述器官或组织用包含抗ccr7抗体的保存溶液灌注或洗涤。最优选地,在所述方法中,通过亲和纯化抗ccr7抗体和与其结合的表达ccr7的供体细胞,从细胞制备物中去除抗ccr7抗体和表达ccr7的供体细胞。
18.根据本发明的离体方法优选用于制备待用于所述用途的根据本发明的方法的步骤d)中的移植物。
19.发明描述
20.定义
21.在本说明书中,“gvhd”被定义为移植到宿主的移植物中的淋巴细胞等将宿主组织识别为异物并攻击这些组织的疾病。在这种情况中,如本文所用术语“接受者”或“宿主”是指接受移植的或植入的细胞、组织或器官的对象(移植患者)。这些术语可以指例如接受供体骨髓、供体纯化的造血祖细胞、供体外周血、供体脐带血、供体t细胞或胰岛移植物的对
象。移植的组织可以来自同基因供体或同种异体供体。如本文所用,术语“供体”是指从其获得组织以移植或植入到接受者或宿主中的对象。例如,供体可以是从其得到待施用至接受者或宿主的骨髓、外周血、脐带血、t细胞或其它组织的对象。本发明主要针对人及适用于人患者。然而,本发明可用于其中至少观察到通过免疫反应形成抗体的非人动物。术语人被认为是任何对象,如成人对象和儿童群体,其中术语儿童群体是指从出生到十八(18)岁的群体部分。
22.术语“抗体”以最广泛的含义使用,且特别涵盖例如单一抗ccr7单克隆抗体,包括拮抗剂,中和抗体,全长或完整单克隆抗体,具有多表位特异性的抗ccr7抗体组合物,多克隆抗体,多价抗体,单链抗ccr7抗体和抗ccr7抗体的片段(见下文),包括fab、fab’、f(ab)’2和fv片段、diabody、单结构域抗体(sdab),只要其表现出所需生物学和/或免疫学活性。术语“免疫球蛋白”(ig)在本文中与抗体可互换使用。抗体可以是人的和/或人源化的。
23.术语“抗ccr7抗体”或“结合ccr7的抗体”是指能以足够的亲和性结合ccr7的抗体,使得所述抗体可用作靶向ccr7的诊断和/或治疗剂。优选地,抗ccr7抗体与不相关的非ccr7蛋白的结合程度比抗体与ccr7结合程度低约10%,如通过放射免疫测定(ria)或elisa所测量。在某些实施方案中,结合ccr7的抗体具有≤1mm、≤100nm、≤10nm、≤1nm或≤0.1nm的解离常数(k
d
)。在某些实施方案中,抗ccr7抗体结合在不同物种的ccr7中保守的ccr7表位。
[0024]“分离的抗体”是已经鉴别且与其天然环境的组分分离和/从其天然环境的组分回收的抗体。
[0025]
基本的4链抗体单元是一种异源四聚体糖蛋白,由两条相同的轻(l)链和两条相同的重(h)链组成(igm抗体由5个基本的异源四聚体单元以及称为j链的额外的多肽组成,及因此含有10个抗原结合位点,而分泌的iga抗体可以聚合形成多价组件,其包含2
‑
5个伴随j链的基本的4链单元)。在igg的情况中,4链单元通常为约150,000daltons。每个l链通过共价二硫键与h链连接,而取决于h链的同种型,两个h链通过一个或多个二硫键相互连接。每个h和l链还具有规则间隔的链内二硫键桥。每个h链在n末端具有可变结构域(v
h
),随后是针对每个α和γ链的三个恒定结构域(c
h
),以及针对μ和ε同种型的四个c
h
结构域。每个l链在n末端具有可变结构域(v
l
),随后是在其另一端的恒定结构域(c
l
)。将v
l
与v
h
对齐,且将c
l
与重链的第一恒定结构域(c
h
1)对齐。相信特定氨基酸残基在轻链和重链可变结构域之间形成界面。v
h
和v
l
配对一起形成单个抗原结合位点。关于不同类别抗体的结构和性质,见例如basic and clinical immunology,8th edition,daniel p.stites,abba i.terr and tristram g.parslow(eds.),appleton&lange,norwalk,ct,1994,page 71and chapter 6。
[0026]
基于其恒定结构域的氨基酸序列,可以将来自任何脊椎动物物种的l链归属于两种明显不同类型之一,称为κ和λ。根据其重链恒定结构域(c
h
)的氨基酸序列,免疫球蛋白可以归属于不同类别或同种型。现有五类免疫球蛋白:iga、igd、ige、igg和igm,其重链分别称作α、δ、ε、γ和μ。γ和α类别基于c
h
序列和功能的相对较小差异进一步分为亚类,例如人表达以下亚类:igg1、igg2、igg3、igg4、iga1和iga2。
[0027]
抗体的“可变区”或“可变结构域”是指抗体重链或轻链的氨基末端结构域。重链的可变结构域可称为“v
h”。轻链的可变结构域可称为“v
l”。这些结构域通常是抗体的最可变部分,及包含抗原结合位点。
[0028]
术语“可变的”是指可变结构域的某些节段在抗体序列中有很大差异的事实。v结
构域介导抗原结合并定义特定抗体对其特定抗原的特异性。然而,所述可变性在可变结构域的110个氨基酸跨度上并不是均匀分布的。相反,v区由15
‑
30个氨基酸的称为构架区(fr)的相对不变的序列片段组成,其由长度为9
‑
12个氨基酸的称为“高变区”(hvr)的具有极度可变性的较短区域分隔。各个天然重链和轻链的可变结构域包含四个fr,主要采用β
‑
折叠构型,由三个高变区连接,形成环状连接,且在某些情况中形成β
‑
折叠结构的部分。每个链中的高变区通过fr紧密结合在一起,并与来自另一个链的高变区促成抗体的抗原结合位点的形成(参见kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.(1991))。恒定结构域不直接参与抗体与抗原的结合,但呈现出各种效应子功能,例如抗体参与抗体依赖性细胞毒性(adcc)、补体依赖性细胞毒性(cdc)和抗体依赖性细胞吞噬作用(adcp)。
[0029]“完整”抗体是包含抗原结合位点以及cl和至少重链恒定结构域c
h
1、c
h
2和c
h
3的抗体。恒定结构域可以是天然序列恒定结构域(例如人天然序列恒定结构域)或其氨基酸序列变体。优选地,完整抗体具有一种或多种效应子功能。
[0030]
用于本发明目的的“裸抗体”是未与细胞毒性部分或放射性标记缀合的抗体。
[0031]“抗体片段”包含完整抗体的一部分,优选完整抗体的抗原结合区或可变区。抗体片段的实例包括fab、fab’、f(ab’)2和fv片段;diabody;线性抗体(见美国专利号5,641,870,实施例2;zapata et al.,protein eng.8(10):1057
‑
1062[1995]);单链抗体分子;及由抗体片段形成的多特异性抗体。在一个实施方案中,抗体片段包含完整抗体的抗原结合位点及因此保留结合抗原的能力。
[0032]
fc片段包含由二硫键连接在一起的两个h链的羧基末端部分。抗体的效应子功能由fc区中的序列决定,该区域也是在某些类型细胞上发现的由fc受体(fcr)识别的部分。
[0033]
如本文所用,术语“单克隆抗体”是指从一群基本上同质的抗体中获得的抗体,即除了可能以少量存在的天然发生的突变之外,这个群体包含的各个抗体是相同的。与包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相反,单克隆抗体针对单个抗原位点具有高度特异性。单克隆抗体的优势在于其可以不被其它抗体污染而合成。修饰语“单克隆”不应解释为需要通过任何特定方法产生抗体。例如,可用于本发明的单克隆抗体可以通过由kohler et al.,nature,256:495(1975)首先描述的杂交瘤方法制备,或者可以使用重组dna方法在细菌、真核动物或植物细胞中制备(参见例如美国专利号4,816,567)。“单克隆抗体”也可以分离自噬菌体抗体文库,使用例如clackson et al.,nature,352:624
‑
628(1991)和marks et al.,j.mol.biol.,222:581
‑
597(1991)所述技术。
[0034]
本文所述单克隆抗体包括“嵌合”抗体,其中重链和/或轻链的一部分与源自特定物种或属于特定抗体类别或亚类的抗体以及这种抗体的片段中的相应序列相同或同源,而链的其余部分与源自另一个物种或属于另一抗体类别或亚类的抗体以及这种抗体的片段中的相应序列相同或同源,只要其呈现出希望的生物活性(参见美国专利号4,816,567;及morrison et al.,proc.natl.acad.sci.usa,81:6851
‑
6855(1984))。本文中感兴趣的嵌合抗体包括“灵长类化的”抗体,其包含源自非人灵长类动物(例如旧大陆猴、猿等)的可变结构域抗原结合序列和人恒定区序列。
[0035]“人源化”形式的非人(例如啮齿动物)抗体是嵌合抗体,其包含最少的源自非人抗体的序列。在大多数情况中,人源化抗体是人免疫球蛋白(接受者抗体),其中来自接受者高
变区的残基被具有所需抗体特异性、亲和性和能力的来自非人物种(例如小鼠、大鼠、兔或非人灵长类动物)的高变区的残基(供体抗体)置换。在一些情况中,人免疫球蛋白的一些构架区(fr)残基被相应的非人残基置换。此外,人源化抗体可包含在接受者抗体或供体抗体中未发现的残基。进行这些修饰是为了进一步改进抗体性能。通常,人源化抗体包含两个可变结构域,其中所有或基本上所有的高变环对应于非人免疫球蛋白的那些高变环,以及所有或基本上所有的fr是人免疫球蛋白序列的那些fr。人源化抗体任选地还包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的fc的至少一部分。进一步的详细描述见jones et al.,nature 321:522
‑
525(1986);riechmann et al.,nature 332:323
‑
329(1988);及presta,curr.op.struct.biol.2:593
‑
596(1992)。也见于如下文献综述及其中引用的参考文献:vaswani and hamilton,ann.allergy,asthma and immunol.,1:105
‑
115(1998);harris,biochem.soc.transactions,23:1035
‑
1038(1995);hurle and gross,curr.op.biotech.,5:428
‑
433(1994)。
[0036]
术语“高变区”、“hvr”在本文中使用时是指抗体可变结构域的区域,其在序列中是高变的和/或形成负责抗原结合的结构上确定的环。通常,抗体包含六个高变区;三个在vh中(h1、h2、h3)和三个在vl中(l1、l2、l3)。许多高变区描绘在使用中并且包含在本文中。高变区通常包含来自“互补决定区”或“cdr”的氨基酸残基(例如当根据kabat编号系统编号时,在vl中的大约残基24
‑
34(l1)、50
‑
56(l2)和89
‑
97(l3),和vh中的大约残基31
‑
35(h1)、50
‑
65(h2)和95
‑
102(h3);kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.(1991));和/或来自“高变环”的那些残基(例如根据chothia编号系统编号时,vl中的残基24
‑
34(l1)、50
‑
56(l2)和89
‑
97(l3),及vh中的残基26
‑
32(h1)、52
‑
56(h2)和95
‑
101(h3);chothia and lesk,j.mol.biol.196:901
‑
917(1987));和/或来自“高变环”/cdr的那些残基(例如当根据imgt编号系统编号时,vl中的残基27
‑
38(l1)、56
‑
65(l2)和105
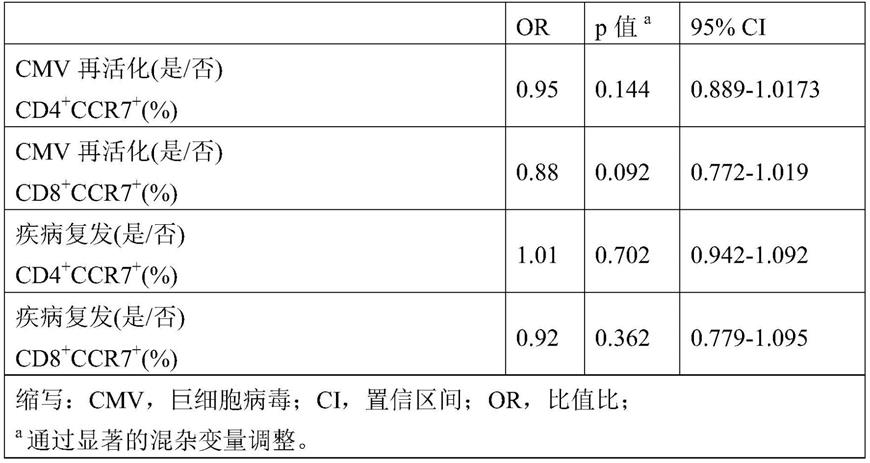
‑
120(l3)及vh中的残基27
‑
38(h1)、56
‑
65(h2)和105
‑
120(h3);lefranc,m.p.et al.nucl.acids res.27:209
‑
212(1999),ruiz,m.et al.nucl.acids res.28:219
‑
221(2000))。任选地,当根据honneger,a.and plunkthun,a.j.(mol.biol.309:657
‑
670(2001))编号时,抗体在如以下一或多点具有对称插入:在vl中的28、36(l1)、63、74
‑
75(l2)和123(l3)及在vh中的28、36(h1)、63、74
‑
75(h2)和123(h3)。本发明抗体的高变区/cdr优选根据imgt编号系统定义和编号。
[0037]“构架”或“fr”残基是除了本文定义的高变区残基之外的那些可变结构域残基。
[0038]“阻断”抗体或“拮抗”抗体是抑制或降低其结合的抗原的生物活性的抗体。优选的阻断抗体或拮抗抗体基本上或完全抑制抗原的生物活性。
[0039]
如本文所用,“激动抗体”是模拟感兴趣的多肽的至少一种功能活性的抗体。
[0040]“结合亲和性”通常是指分子(例如抗体)的单个结合位点与其结合配对体(例如抗原)之间非共价相互作用总和的强度。除非另有说明,如本文所用,“结合亲和性”是指反映结合对的成员(例如抗体和抗原)之间1:1相互作用的内在结合亲和性。分子x对其配对体y的亲和性通常可以用解离常数(k
d
)表示。亲和性可以通过本领域已知的常用方法测量,包括本文所述的那些方法。低亲和性抗体通常与抗原结合缓慢且倾向于易于解离,而高亲和性抗体通常与抗原结合更快且倾向于保持更长时间结合。本领域已知多种测量结合亲和性
的方法,其中任何一种均可用于本发明的目的。具体的示例实施方案在下文描述。
[0041]“k
d”或“k
d
值”可以通过使用表面等离子共振测定法,使用biacore
tm
‑
2000或biacore
tm
‑
3000(biacore,inc.,piscataway,nj)在25℃用固定的抗原cm5芯片在~10
‑
50个共振单位(ru)进行测量。简而言之,将羧甲基化葡聚糖生物传感器芯片(cm5,biacore inc.)根据供应商的说明用n
‑
乙基
‑
n
’‑
(3
‑
二甲基氨基丙基)
‑
碳二亚胺盐酸盐(edc)和n
‑
羟基琥珀酰亚胺(nhs)活化。在以5μl/min的流速注射前,将抗原用10mm醋酸钠(ph4.8)稀释为5μg/ml(~0.2μm),以获得大约10个反应单位(ru)的偶联蛋白。注射抗原后,注射1m乙醇胺以封闭未反应的基团。对于动力学测量,在25℃以约25μl/min流速在具有0.05%tween 20的pbs(pbst)中注射抗体或fab的两倍系列稀释液(0.78nm
‑
500nm)。缔合率(k
on
)和解离率(k
off
)是使用简单的一对一langmuir结合模型(biacore evaluation software version 3.2)通过同时拟合缔合和解离传感图计算的。平衡解离常数(k
d
)计算为k
off
/k
on
比率。见例如chen,y.,et al.,(1999)j.mol biol 293:865
‑
881。如果通过上述表面等离子体共振测定法的结合率超过106m
‑1s
‑1,则可以使用荧光猝灭技术确定结合率,其测量在pbs、ph7.2中20nm的抗抗原抗体(fab形式)在25℃在存在增加浓度的抗原的条件下的荧光发射强度的增加或减少(激发=295nm;发射=340nm,16nm带通),如在在分光计中例如配备截流的分光光度计(aviv instruments)或带有搅拌红色比色皿的8000
‑
系列slm
‑
aminco分光光度计(thermospectronic)中测量。
[0042]
根据本发明的“结合率”或“缔合的比率”或“缔合比率”或“k
on”也可以用上述相同的表面等离子体共振技术使用上述biacore
tm
‑
2000或biacore
tm
‑
3000(biacore,inc.,piscataway,nj)确定。
[0043]“结合”感兴趣抗原例如多肽ccr7抗原靶标的抗体,是一种以足够亲和性结合抗原的抗体,由此所述抗体在靶向表达所述抗原的细胞或组织中可用作治疗剂,且与其它蛋白质不发生明显交叉反应。在这种实施方案中,如通过荧光激活细胞分选(facs)分析或放射免疫沉淀法(ria)所确定,抗体与“非靶”蛋白的结合程度比抗体与其特定靶蛋白的结合低大约10%。关于抗体与靶分子的结合,术语“特异性结合”或“特异性结合于”或“特异于”特定多肽或特定多肽靶标上的表位是指与非特异性相互作用相比可测量地不同的结合。特异性结合可以例如通过确定分子的结合相比于对照分子的结合进行测量,对照分子通常是不具有结合活性的类似结构的分子。例如,特异性结合可以通过与对照分子竞争而确定,所述对照分子与靶标相似,例如过量的未标记靶标。在这种情况中,如果标记的靶标与探针的结合被过量的未标记的靶标竞争性抑制,则表明特异性结合。如本文所用,术语“特异性结合”或“特异性结合于”或“特异于”特定多肽或特定多肽靶标上的表位可以例如通过分子对于靶的k
d
呈现(其可以如上所述确定),所述k
d
为至少约10
‑4m、或者至少约10
‑5m、或者至少约10
‑6m、或者至少约10
‑7m、或者至少约10
‑8m、或者至少约10
‑9m、或者至少约10
‑
10
m、或者至少约10
‑
11
m、或者至少约10
‑
12
m、或更大。在一个实施方案中,术语“特异性结合”是指这样的结合,其中分子与特定多肽或特定多肽上的表位结合而基本上不与任何其它多肽或多肽表位结合。
[0044]
抗体“效应子功能”是指可归因于抗体fc区(天然序列fc区或氨基酸序列变体fc区)的那些生物学活性,且其随着抗体同种型而变化。示例的抗体效应子功能包括:c1q结合和补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);抗体
依赖性细胞介导的吞噬作用(adcp);下调细胞表面受体(例如b细胞受体);和b细胞活化。
[0045]
本文中的术语“fc区”用于定义免疫球蛋白重链的c末端区域,包括天然序列fc区和变体fc区。尽管免疫球蛋白重链fc区的边界可以变化,但人igg重链fc区通常定义为是从cys226位的氨基酸残基或pro230位的氨基酸残基至其羧基末端的段。fc区的c
‑
末端赖氨酸(根据eu编号系统的第447位残基)可以例如在抗体的生产或纯化期间被去除,或通过重组工程化编码抗体重链的核酸被去除。因此,完整抗体的组分可以包含去除所有k447残基的抗体群、没有去除k447残基的抗体群,以及具有含有和不含有k447残基的抗体混合物的抗体群。
[0046]“功能性fc区”具有天然序列fc区的“效应子功能”。示例的“效应子功能”包括c1q结合;cdc;fc受体结合;adcc;吞噬作用;下调细胞表面受体(例如b细胞受体;bcr)等。这种效应子功能通常需要将fc区与结合结构域(例如抗体可变结构域)组合,并且可以使用例如在本文的定义中所公开的各种测定法进行评估。
[0047]“抗体依赖性细胞介导的细胞毒性”或“adcc”是指一种细胞毒性形式,其中分泌的ig与某些细胞毒性细胞(例如天然杀伤(nk)细胞、中性粒细胞和巨噬细胞)上存在的fc受体(fcr)结合使得这些细胞毒性效应细胞特异性结合携带抗原的靶细胞,并随后用细胞毒素杀死靶细胞。抗体“武装”细胞毒性细胞并且是这种杀伤所绝对需要的。介导adcc的主要细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii和fcγriii。造血细胞上的fcr表达概括示于ravetch and kinet,annu.rev.immunol.9:457
‑
92(1991)第464页表3中。为了评估感兴趣分子的adcc活性,可以进行体外adcc测定,例如美国专利no.5,500,362或5,821,337中所述的测定。可用于这种测定的效应细胞包括外周血单个核细胞(pbmc)和天然杀伤(nk)细胞。可选地或额外地,可以在体内评估感兴趣分子的adcc活性,例如在如clynes et al.(usa)95:652
‑
656(1998)中揭示的动物模型中评估。wo 2000/42072(presta)描述了与fcr结合增强或减弱的抗体变体。也见例如shields et al.j.biol.chem.9(2):6591
‑
6604(2001)所述。
[0048]“人效应细胞”是表达一种或多种fcr及执行效应子功能的白细胞。优选地,所述细胞至少表达fcγriii及执行adcc效应子功能。介导adcc的人白细胞的示例包括外周血单个核细胞(pbmc)、天然杀伤(nk)细胞、单核细胞、细胞毒性t细胞和中性粒细胞;优选pbmc和nk细胞。效应细胞可以从天然来源例如从血液中分离。
[0049]“补体依赖性细胞毒性”或“cdc”是指在补体存在下靶细胞的裂解。经典补体途径的激活是通过补体系统的第一个成分(c1q)与结合其同源抗原的(适当亚类的)抗体结合而启动的。为了评估补体激活,可以进行cdc测定,例如gazzano
‑
santoro et al.(1996,j.immunol.methods 202:163)所述。具有改变的fc区氨基酸序列(具有变体fc区的抗体)和增加或降低的c1q结合能力的抗体变体在例如美国专利no.6,194,551b1和wo1999/51642中描述。也见例如idusogie et al.(2000,j.immunol.164:4178
‑
4184)所述。增加c1q结合并从而增加cdc活性的一种这样的取代是e333a取代,其可有利地应用于本发明的抗体中。
[0050]“序列相同性”在本文中定义为通过序列对比确定的两个或更多个氨基酸(多肽或蛋白质)序列或两个或更多个核酸(多核苷酸)序列之间的关系。在本领域中,“相同性”还指氨基酸序列或核酸序列之间的序列相关程度,视情况而定,通过这种序列串之间的匹配确定。两个氨基酸序列之间的“相似性”是通过将一个多肽的氨基酸序列及其保守氨基酸取代
与第二多肽的序列进行对比而确定的。“相同性”和“相似性”可以通过已知方法容易地计算。术语“序列相同性”或“序列相似性”是指当两个(多)肽或两个核苷酸序列最佳比对时,优选是在整个长度上(至少是对比中最短的序列)及使匹配数最大化及缺口数最小化,例如通过使用默认参数的程序clustalw(1.83)、gap或bestfit,其共享至少一定百分比的序列相同性,如本文别处所定义。gap使用needleman和wunsch整体比对算法在两个序列的整个长度上比对,最大化匹配数及最小化缺口数。通常,使用gap默认参数,缺口产生罚分=50(核苷酸)/8(蛋白质),并且缺口延伸罚分=3(核苷酸)/2(蛋白质)。对于核苷酸,使用的默认评分矩阵是nwsgapdna,且对于蛋白质,默认评分矩阵是blosum62(henikoff&henikoff,1992,pnas 89,915
‑
919)。比对本发明的蛋白质序列的优选多重比对程序是clustalw(1.83),使用blosum矩阵和默认设置(缺口开放罚分:10;缺口延伸罚分:0.05)。序列比对和序列相同性百分比评分可以使用计算机程序确定,例如得自accelrys inc.,9685scranton road,san diego,ca 92121
‑
3752usa的gcg wisconsin package,version 10.3,或使用开源软件,例如embosswin version 2.10.0中的程序“needle”(使用整体needleman wunsch算法)或“water”(使用局部smith waterman算法),使用与上述针对gap相同的参数,或使用默认设置(对于“needle”和“water”以及对于蛋白质和dna比对,默认的缺口开放罚分均是10.0,且默认缺口延伸罚分均是0.5;默认评分矩阵对于蛋白质是blossum62及对于dna是dnafull)。当序列具有明显不同的总长度时,优选局部比对,例如使用smith waterman算法的那些比对法。或者,可以通过搜索公共数据库,使用如fasta、blast等算法确定相似性或相同性百分比。
[0051]
发明详述
[0052]
本发明基于发现ccr7受体在一些淋巴细胞和抗原呈递细胞(apc)中高度表达。在所述细胞中,ccr7在进入包括淋巴结(ln)在内的淋巴组织中起主要作用,这是gvhd发生和演化的基础。本发明人惊奇地发现抗ccr7抗体在小鼠gvhd模型中产生显著的治疗效果。通过将抗ccr7抗体施用至移植物接受者,可以抑制gvhd,而不会产生明显的副作用。体内模型示出抗体靶向ccr7如何预防疾病及改善一旦发生的gvhd,从而使ccr7受体在急性和慢性gvhd中作为mab疗法的感兴趣的靶位。ccr7的单克隆抗体(mab),即识别ccr7受体中表位及优选能抑制ccr7依赖性胞内信号传导的抗体,其能在体内杀死ccr7
供体和接受者免疫细胞和/或阻断其迁移、活化和/或增殖,和/或播散,而其使ccr7
‑
免疫细胞不受影响,从而维持例如gvl,并在体内改善gvhd症状和存活率。
[0053]
因此,第一方面,本发明涉及抗ccr7抗体或其抗原结合片段,用于在包含供体细胞的移植物的接受者中预防和治疗gvhd的至少一项。优选地,接受者细胞和供体细胞至少之一是人的。移植物优选地包含供体细胞,所述供体细胞包含免疫细胞,更优选包含引起针对接受者组织的免疫应答以介导gvhd的免疫活性细胞(例如成熟t细胞)。gvdh可以是急性或慢性gvhd。优选地,gvdh是急性gvhd。如本文所用,“治疗”gvhd被理解为是指抑制gvhd、降低gvhd的发生百分比、治疗gvhd、改善或减轻gvhd的一种或多种临床表现,及提高治疗对象的存活率。如本文所用,“预防”gvhd被理解为是指“防治”。体内防治是指抑制gvhd的发生,延缓gvhd的发作,降低gvhd的发生百分比,一旦gvhd发生则减少其一种或多种临床表现等。
[0054]
用于本发明的抗ccr7抗体或其抗原结合片段可以是特异性结合ccr7的任何抗原结合蛋白。结合ccr7的本发明的抗原结合蛋白优选是上文定义的最广义的抗ccr7抗体,包
括例如抗ccr7抗体、抗体片段、抗体衍生物、抗体突变蛋白和抗体变体。本发明的抗ccr7抗体优选是分离的抗体。优选地,本发明的抗ccr7抗体结合灵长类动物ccr7,更优选结合人ccr7。人ccr7的参考氨基酸序列是例如np_001288643、np_001288645、np_001288646、np_001288647、np_001829、np_001288642和np_031745。这个序列的氨基酸1
‑
24包含膜易位信号肽,其在表达期间被切割掉。人ccr7的氨基酸25
‑
59构成n末端胞外结构域,这个结构域在y
32
和y
41
位包含硫酸化酪氨酸残基。已知与上述参考序列相比具有一个或多个氨基酸取代的人ccr7的各种等位基因变体。本发明中的“人ccr7”包括这些等位基因变体,至少具有胞外结构域和ccr7功能的变体范围。用于本发明的抗ccr7抗体优选特异性结合ccr7(优选人ccr7)的n
‑
末端胞外结构域。
[0055]
用于本发明的抗ccr7抗体优选是中和抗体,其通过选自ccl19和ccl21的至少一种ccr7配体抑制ccr7依赖性胞内信号传导、ccr7依赖性功能和/或ccr7受体内在化。抗ccr7抗体优选对于通过选自ccl19和ccl21的至少一种ccr7配体抑制ccr7依赖性胞内信号传导和/或ccr7受体内在化具有不高于150、100、80、50、30、25、20、15、10、5或3nm的ic
50
,例如可以在如本发明实施例所述的测定中确定的。可选地,抗体的最大ic
50
是参照在相同测定中测试时参考抗ccr7抗体的ic
50
来定义的。因此,优选本发明的抗ccr7抗体具有的ic
50
比参考抗ccr7抗体的ic
50
高出不超过10、5、2、1.5、1.2、1.1或1.05倍,其中参考抗ccr7抗体是小鼠抗ccr7抗体,其重链可变结构域的氨基酸序列是seq id no:1,且其轻链可变结构域的氨基酸序列是seq id no:2。
[0056]
本发明的抗ccr7抗体优选抑制如上所述的ccr7依赖性胞内信号传导ccr7,而没有显著的激动作用,更优选地没有可检测的激动作用,例如可以在如本文实施例中所述的测定中确定的。
[0057]
用于本发明的抗ccr7抗体优选对ccr7(优选人ccr7)的n
‑
末端胞外结构域具有最小亲和性。抗体的最小亲和性在本文中优选参照在相同测定中测试时参考抗ccr7抗体的k
d
来定义。因此,优选本发明的抗ccr7抗体对于人ccr7的n末端胞外结构域具有的k
d
比参考抗ccr7抗体对于人ccr7的n末端胞外结构域的k
d
高出不超过100、50、20、10、5、2、1.5、1.2、1.1或1.05倍,其中参考抗ccr7抗体是小鼠抗ccr7抗体,其重链可变结构域的氨基酸序列是seq id no:1且其轻链可变结构域的氨基酸序列是seq id no:2。在本文中应理解,其k
d
与参考k
d
相比高出不超过10倍的抗体是其亲和性与参考抗体的亲和性相比低不少于10倍的抗体。因此,如果参考抗体具有的k
d
为1
×
10
‑9m,则所讨论的抗体的k
d
为1
×
10
‑8m或更低。
[0058]
具有一种或多种上述定义的特征及适用于本发明的抗ccr7抗体的实例包括例如us 8,865,170、wo 2009/139853、wo 2014/151834和wo 2017/025569中描述的单克隆抗体,所有这些均通过引用并入本文。
[0059]
用于本发明的优选抗ccr7抗体是特异性结合包含氨基酸序列“zxlfe”或由氨基酸序列“zxlfe”组成的表位的抗体,其中z是硫酸化酪氨酸,且x可以是任何氨基酸,且f可以是被疏水氨基酸置换。因此,本发明的抗体优选特异性结合在人ccr7的n
‑
末端胞外结构域中的第41
‑
45位包含氨基酸序列“ztlfe”或由氨基酸序列“ztlfe”组成的表位。所述抗体优选特异于人ccr7。这种优选的抗ccr7抗体优选对于人ccr7或对包含“ztlfe”表位的合成抗原、优选对如本文实施例中所述的合成抗原sym1899具有最小亲和性。因此,优选地,抗ccr7抗体具有的k
d
为1
×
10
‑8m、5
×
10
‑9m、2
×
10
‑9m、1.8
×
10
‑9m、1
×
10
‑9m、1
×
10
‑
10
m或1
×
10
‑
11
m或更
小,优选对于合成抗原sym1899。可选地,抗体的最小亲和性参照在相同测定中测试时参考抗ccr7抗体的k
d
来定义。因此,优选地,本发明的抗ccr7抗体具有的对于人ccr7或包含“ztlfe”表位的合成抗原(优选如本文实施例中所述的合成抗原sym1899)的k
d
,比参考抗ccr7抗体对抗原的k
d
高出不超过10、5、2、1.5、1.2、1.1或1.05倍,其中参考抗ccr7抗体是小鼠抗ccr7抗体,其重链可变结构域的氨基酸序列是seq id no:1且其轻链可变结构域的氨基酸序列是seq id no:2。在本文中应理解,其k
d
比参考k
d
高出不超过10倍的抗体是其亲和性比参考抗体的亲和性低不少于10倍的抗体。因此,如果参考抗体的k
d
为1
×
10
‑9m,则所讨论的抗体的k
d
为1
×
10
‑8m或更小。
[0060]
用于本发明的抗ccr7抗体优选以最大k
off
率常数结合人ccr7或包含“ztlfe”表位的合成抗原(优选如本文实施例中所述的合成抗原sym1899;seq id no:3)。因此,优选地,本发明的抗ccr7抗体具有1
×
10
‑3、1
×
10
‑4或1
×
10
‑5s
‑1或更小的k
off
率常数。可选地,抗体的最大k
off
率常数通过参照在相同测定中测试时参考抗ccr7抗体的k
off
率常数来定义。因此,优选地,本发明的抗ccr7抗体结合人ccr7或包含“ztlfe”表位的合成抗原(优选如本文实施例中所述的合成抗原sym1899),其k
off
率常数比参考抗ccr7抗体对抗原的k
off
率常数高出不超过10、5、2、1.5、1.2、1.1或1.05倍,其中参考抗ccr7抗体是小鼠抗ccr7抗体,其重链可变结构域的氨基酸序列为seq id no:1且其轻链可变结构域的氨基酸序列为seq id no:2。
[0061]
用于本发明的一种这样的优选抗体是具有参考小鼠抗人ccr7抗体的hvr的抗体,所述参考小鼠抗人ccr7抗体的重链可变结构域的氨基酸序列为seq id no:1且其轻链可变结构域的氨基酸序列为seq id no:2,其hvr如在wo 2017/025569中定义,所述专利通过引用并入本文。
[0062]
用于本发明的抗ccr7抗体可以是嵌合抗体,例如小鼠
‑
人抗体。然而,优选所述抗体是人源化抗体或人抗体。
[0063]
用于本发明的人源化抗体优选在施用该抗体的对象中引起针对该抗体的很少或没有免疫原性应答。例如,用于本发明的人源化抗体在宿主对象中引发和/或预期引发与原始小鼠抗体相比明显降低水平的人抗小鼠抗体应答(hama),所述原始小鼠抗体例如包含seq id no:1和2的序列。优选地,人源化抗体引发和/或预期引发最小人抗小鼠抗体应答(hama)或不引发和/或预期不引发人抗小鼠抗体应答(hama)。最优选地,本发明的抗体引发处于或低于临床可接受水平的抗小鼠抗体应答。
[0064]
可以基本上按照winter及同事所述方法(jones et al.,nature,321:522
‑
525(1986);reichmann et al.,nature,332:323
‑
327(1988);verhoeyen et al.,science,239:1534
‑
1536(1988)),通过将高变区序列取代为人抗体的相应序列进行人源化。在实践中,人源化抗体通常是人抗体,其中一些高变区残基和可能的一些构架区(fr)残基被啮齿动物抗体中类似位点的残基取代。用于产生人源化抗体的轻链和重链人可变结构域的选择对于降低保持对抗原的特异性和亲和性的免疫原性非常重要。根据所谓的“最佳拟合”方法,针对已知的人类可变结构域序列的整个文库筛选啮齿动物抗体的可变结构域序列。与啮齿动物序列最接近的人序列随后被接受为人源化抗体的人构架区(fr)(suns et al.,j.immunol.,151:2296(1993);chothia et al.,j.mol.biol,196:901(1987))。另一种方法使用源自特定轻链或重链亚组的所有人抗体的共有序列的特定构架区。相同的构架可用于几种不同的人源化抗体(carter et al.,proc.natl.acad.sci.usa,89:4285(1992);
presta et al.,j.immunol.,151:2623(1993))。
[0065]
更重要的是抗体是人源化的,其保留对抗原的高亲和性和其它有利的生物学性质。为了实现这个目标,根据优选方法,通过使用亲本和人源化序列的三维模型分析亲本序列和各种概念上的人源化产物的过程来制备人源化抗体。根据上述任一本发明实施方案,人源化抗ccr7抗体优选包含重链恒定区,即igg1、igg2、igg3或igg4区。根据上述任一本发明实施方案的人源化抗ccr7抗体,优选包含具有至少一种效应子功能的功能性fc区,所述效应子功能选自:c1q结合、补体依赖性细胞毒性;fc区结合、抗体依赖性细胞介导的细胞毒性和吞噬作用。
[0066]
用于本发明的优选人源化抗体是这样的抗体,其重链可变结构域的氨基酸序列为seq id no:4,且其轻链可变结构域的氨基酸序列为seq id no:5,例如wo 2017/025569中描述。
[0067]
作为对于人源化的另一种方案,可以产生人抗体。“人抗体”是指通过任何已知的标准方法产生的完全包含人轻链和重链以及恒定区的抗体。例如,可以获得转基因动物(例如小鼠),其在免疫后在不产生内源性免疫球蛋白的情况下能产生全人抗体库。例如,已经描述了在嵌合和种系突变小鼠中抗体重链连接区ph基因的纯合缺失导致内源性抗体产生的完全抑制。在这种种系突变小鼠中转移人种系免疫球蛋白基因阵列导致在免疫后产生人抗体。见例如jakobovits et al.,proc.nat.acad.sci.usa,90:255 1(1993);jakobovits et al.,nature,362:255
‑
258(1993)所述。可选地,噬菌体展示技术(mccafferty et al.,nature 348:552
‑
553(1990))可用于从供体的免疫球蛋白可变(v)结构域基因库中在体外产生人抗体和抗体片段。根据这种技术,抗体v结构域基因框内克隆进丝状噬菌体例如m13或fd的主要或次要包被蛋白基因中,并在噬菌体颗粒表面展示为功能性抗体片段。由于丝状颗粒包含噬菌体基因组的单链dna拷贝,因此基于抗体功能性质的选择也会导致选择出编码表现出这些性质的抗体的基因。因此,噬菌体模拟了b细胞的一些性质。噬菌体展示可以以多种形式进行;关于其的综述见例如johnson,kevin s.and chiswell,david j.,current opinion in structural biology 3:564
‑
57 1(1993)。人抗体也可以由在体外活化的b细胞或其免疫系统用人细胞重建的scid小鼠产生。一旦获得人抗体,其编码dna序列可被分离、克隆及导入合适的表达系统即细胞系(优选来自哺乳动物的细胞系)中,其随后表达并将其释放至从中可以分离抗体的培养基中。
[0068]
用于本发明的用途的优选人抗体是这样的抗体,其重链可变结构域的氨基酸序列为seq id no:6,且其轻链可变结构域的氨基酸序列为seq id no:7或8,例如如wo 2014/151834中描述。
[0069]
用于包含在本发明内的用途的结合ccr7受体的抗体的功能性片段保留了其所源自的全长抗体的至少一种结合功能和/或调节功能。优选的功能性片段保留相应全长抗体的抗原结合功能(例如结合哺乳动物ccr7受体的能力)。特别优选的功能性片段保留了抑制哺乳动物ccr7受体的一种或多种功能性特征的能力,例如结合活性和/或阻断信号传导活性,和/或刺激细胞应答。例如,在一个实施方案中,功能性片段可以抑制ccr7与其一种或多种配体的相互作用和/或可以抑制一种或多种受体介导的功能。
[0070]
在一些实施方案中,本发明的抗ccr7抗体包含轻链和/或重链抗体恒定区。可以使用本领域已知的任何抗体恒定区。轻链恒定区可以是例如κ型或λ型轻链恒定区,例如人κ型
或λ型轻链恒定区。重链恒定区可以是例如α
‑
、δ
‑
、ε
‑
、γ
‑
或μ
‑
型重链恒定区,例如人α
‑
、δ
‑
、ε
‑
、γ
‑
或μ
‑
型重链恒定区。本发明的抗ccr7抗体因此可以具有任何同种型的恒定区,即包括igg、igm、iga、igd和ige恒定区以及igg1、igg2、igg3或igg4恒定区。在一个实施方案中,轻链或重链恒定区是天然存在的恒定区的片段、衍生物、变体或突变蛋白。本领域已知从感兴趣的抗体中衍生不同亚类或同种型的抗体的技术,即亚类转换。因此,例如igg抗体可以源自igm抗体,且反之亦然。这种技术允许制备具有给定抗体(亲本抗体)的抗原结合性质的新抗体,也表现出与不同于亲本抗体的抗体同种型或亚类相关的生物学性质。可以采用重组dna技术。这种方法中可以使用编码特定抗体多肽的克隆dna,例如编码希望的同种型抗体恒定结构域的dna。也见lantto et al.(2002,methods mol.bio1.178:303
‑
16)。因此,本发明的抗ccr7抗体包括这样的抗体,其包含例如本文公开的一个或多个可变结构域序列及具有希望的同种型(例如iga、igg1、igg2、igg3、igg4、igm、ige和igd),以及其fab或f(ab’)2片段。此外,如果需要igg4,也可能需要如bloom等人(1997,protein science 6:407)所述在铰链区引入点突变(cpscp
‑
>cppcp),以减轻可能导致igg4抗体的异质性的h链内二硫键形成的倾向。
[0071]
本发明的抗ccr7抗体优选包含具有至少一种效应子功能的功能性fc区,所述至少一种效应子功能选自:c1q结合、补体依赖性细胞毒性;fc受体结合、抗体依赖性细胞介导的细胞毒性和吞噬作用。
[0072]
可以修饰本发明的抗ccr7抗体以改善效应子功能,例如以增强抗体的adcc和/或cdc。这可以通过在抗体的fc区引入一个或多个氨基酸取代而实现。本发明抗体的fc区中的优选取代是增加c1q结合及由此增加cdc活性的取代,例如在idusogie et al.(2000,j.immunol.164:4178
‑
4184)中描述。增加c1q结合的fc区中优选取代是e333a取代。
[0073]
加入糖蛋白例如抗体的氨基酸主链的糖基是由几种单糖或单糖衍生物形成,得到在不同哺乳动物或组织的细胞中产生的同一抗体可以不同的组合物。此外,已经表明糖基的不同组成可以影响抗体介导抗原依赖性细胞介导的细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc)的效力。因此,可以通过研究来自不同来源的抗体的糖基化模式来改善这些性质。这种方法的一个示例如niwa et al.(2004,cancer res,64(6):2127
‑
33)所述。
[0074]
可选地或额外地,可以将半胱氨酸残基引入fc区,从而在这个区域中允许形成链间二硫键。由此产生的同源二聚体抗体可具有改善的内在化能力和/或增强的补体介导的细胞杀伤和抗体依赖性细胞毒性(adcc)。见caron et al.(1992,j.exp med.176:1191
‑
1195)和shopes,(1992,immunol.148:2918
‑
2922)。也可以如wolff et al.(1993,cancer research53:2560
‑
2565)所述使用异双功能交联剂制备具有增强的抗肿瘤活性的同源二聚体抗体。可选地,可以对具有双fc区的抗体进行工程化,并从而可具有增强的补体裂解和adcc能力。见stevenson et al.(1989,anti
‑
cancer drug design 3:2 19
‑
230)。为了延长抗体的血清半衰期,可以例如us 5,739,277所述将补救受体结合表位掺入抗体(尤其是抗体片段)中。如本文所用,术语“补救受体结合表位”是指负责igg分子的体内血清半衰期延长的igg分子(例如igg1、igg2、igg3或igg4)的fc区的表位。
[0075]
本发明优选的抗ccr7抗体包含人同种异型g1m17,1的重链恒定区(见jefferis and lefranc(2009)mabs vol.1issue 4,pp 1
‑
7),所述重链恒定区包含seq id no:9的氨基酸序列。更优选地,本发明的抗体中人同种异型g1m17,1的重链恒定区包含e333a取代,所
述重链恒定区包含seq id no:10的氨基酸序列。
[0076]
用于本发明的抗ccr7抗体可以通过多种常规技术中的任何一种来制备。其通常使用本领域已知的任何技术在重组表达系统中产生。见例如shukla and(2010,“recent advances in large
‑
scale production of monoclonal antibodies and related proteins”,trends in biotechnol.28(5):253
–
261),harlow and lane(1988)“antibodies:a laboratory manual”,cold spring harbor laboratory press,cold spring harbor,ny,及sambrook and russell(2001)"molecular cloning:a laboratory manual(3rd edition),cold spring harbor laboratory,cold spring harbor laboratory press,ny。本领域已知的任何表达系统均可用于制备本发明的重组多肽。通常,将宿主细胞用包含编码希望的多肽的dna的重组表达载体转化。
[0077]
在一个实施方案中,本发明涉及如上文定义的抗ccr7抗体或其抗原结合片段在包含供体细胞的移植物的接受者中治疗和/或预防gvhd中的应用,其中优选抗ccr7抗体作用包括对ccr7表达细胞的杀伤、诱导细胞凋亡、阻断迁移和/或阻断播散、阻断ccr7表达细胞的活化、阻断ccr7表达细胞的成熟和分化中的至少一种,优选在所述接受者中。抗ccr7抗体对其发挥一种或多种这些作用的ccr7表达细胞优选是表达ccr7的免疫细胞,其可以是源自供体的移植的免疫细胞或可以是源自宿主即源自接受者的免疫细胞。源自供体或宿主的表达ccr7的免疫细胞的示例包括例如t细胞,cd4
和cd8
t细胞,例如初始t细胞、中央记忆t细胞、调节t细胞、辅助t细胞和细胞毒性t细胞,b细胞,例如初始b细胞和滤泡b细胞,抗原呈递细胞(apc),例如树突细胞,包括例如成熟树突细胞(mdc)和浆细胞样dc。例如表达ccr7受体的细胞可通过常规方法鉴定;例如可以通过本领域已知的流式细胞术分析ccr7受体的表面表达。表达ccr7受体的细胞的死亡可以通过任何常规方法确定,例如通过确定接受者中ccr7
细胞的缺失或清除而确定。优选地,根据本发明的抗ccr7抗体的使用防止或降低cd45
供体细胞在接受者的淋巴器官中对淋巴结、外周血、脾、胸腺和骨髓中至少之一的浸润,或防止或降低其浸润进入接受者中gvhd的任何上皮靶组织,更优选地,抗ccr7抗体或其抗原结合片段防止或降低ccr7
、cd45
供体细胞在接受者的淋巴器官中淋巴结、外周血、脾脏、胸腺和骨髓至少之一中的浸润,或浸润进接受者中gvhd的任何上皮靶组织。
[0078]
不希望受理论束缚,根据本发明的抗ccr7抗体的治疗用途有利地应允许通过如下方式在接受者中在体内特异性预防或治疗gvhd,例如通过杀死ccr7
t细胞和apc,和/或通过削弱ccr7
t细胞和apc迁移和/或阻断ccr7
t细胞和apc播散,和/或通过削弱或阻断ccr7
t细胞和apc的活化或分化或成熟。在大多数情况中,补体依赖性细胞裂解(cdc)、抗体依赖性细胞介导的吞噬作用(adcp)和抗体依赖性细胞介导的细胞毒性(adcc)被认为是造成未缀合的抗ccr7临床效用,虽然诱导细胞凋亡或细胞周期停滞也可能发挥实质作用。在应用抗ccr7抗体的情况中,削弱和/或阻断免疫细胞的迁移和/或削弱或阻断免疫细胞的激活、分化、增殖或成熟是额外的相关作用机制。
[0079]
因此,优选地,在一个实施方案中,本发明涉及根据本发明的抗ccr7抗体的用途,其中抗ccr7抗体削弱表达ccr7受体的供体和/或接受者细胞向次级淋巴组织的迁移和/或阻断供体细胞向次级淋巴组织(包括淋巴结、脾脏和粘液相关淋巴组织(malt),如派尔集合淋巴结(peyer patches))的播散。
[0080]
根据本发明预防或治疗其gvhd的移植物接受者,优选是包含器官、祖细胞、干细
胞、造血细胞、造血祖细胞或造血干细胞的移植物或植入物的接受者。移植物或植入物可以是同基因移植物或同种异体移植物,但优选是包含同种异体供体细胞的移植物或植入物。移植物可以包括任何类型的器官或组织,包括例如心脏、肺、肾、肝、胰腺、肠、面部(或其部分)、角膜、皮肤、手、腿、阴茎、骨、子宫、胸腺等。
[0081]
在一个优选的实施方案中,本发明的抗ccr7抗体或抗原结合片段用于在造血细胞移植物的接受者中预防或治疗gvhd。更具体地,用于预防或治疗同种异体造血干细胞移植(hsct)后的gvhd。
[0082]
本发明方法中使用的供体细胞可以是完整的或纯化的骨髓细胞、来自骨髓的纯化的造血祖细胞或干细胞、来自外周血的纯化的造血祖细胞或干细胞、在用生长因子如g
‑
csf或抗cxcr4药剂如普乐沙福(plerixafor)动员骨髓中造血祖细胞后来自造血祖细胞或干细胞富集的单采产品中(纯化的)脐带血细胞或外周血细胞。在导入供体t细胞的本发明方法中,细胞移植物可包含具有添加回去的t细胞的完整的或纯化的骨髓细胞、脐带血细胞或纯化的干细胞。因此,在一个实施方案中,根据本发明待使用的供体细胞包含或源于以下至少一种:t细胞,脾,脐带血,羊水和来自华尔通胶(wharton's jelly)的牙髓细胞,胎盘衍生的细胞、毛根衍生的细胞和/或脂肪组织衍生细胞,包含淋巴细胞、单核细胞和/或巨噬细胞的细胞悬浮液,含有干细胞的组织,含有干细胞的器官,含有免疫细胞的组织和含有免疫细胞的器官。在一个实施方案中,根据本发明待使用的供体细胞是造血干细胞(也称为造血祖细胞),其包含或源自骨髓干细胞、外周血干细胞、脐带血干细胞、成人骨髓干细胞例如非贴壁骨髓衍生的细胞(na
‑
bmc)、胚胎干细胞和/或重编程的成人干细胞(即诱导的多能细胞)。
[0083]
造血(干)细胞移植物的接受者可患有血液疾病或非血液疾病。所述血液疾病可以是非肿瘤性血液疾病或恶性血液病。非恶性血液疾病、特别是造血细胞缺陷疾病可选自:先天性或获得性免疫缺陷,导致血红蛋白病的遗传性疾病,酶缺陷疾病,或自身免疫性疾病,严重再生障碍性贫血,地中海贫血,镰状细胞性贫血,免疫缺陷,严重联合免疫缺陷(scid),wiskott
‑
aldrich综合征(was),噬血细胞性淋巴组织细胞增生症(hlh),先天性代谢障碍,溶酶体贮积症,过氧化物酶体功能障碍、自身免疫性疾病、风湿性疾病以及上述任一疾病的再发。恶性血液疾病可选自:白血病,急性髓性白血病(aml),早幼粒细胞白血病(pml),急性淋巴细胞白血病(all),慢性淋巴细胞白血病(cll),套细胞淋巴瘤(mcl),慢性髓系白血病(cml),骨髓增生异常综合征(mds),非霍奇金淋巴瘤(nhl),霍奇金淋巴瘤(hl),多发性骨髓瘤(mm)和神经母细胞瘤。造血(干)细胞移植物的接受者可患有非血液学实体瘤(例如肾细胞癌、结直肠癌等)。
[0084]
造血(干)细胞移植物的接受者可已经或可未经清髓性预处理方案、或非清髓性预处理方案或降低强度预处理方案的治疗,优选在接受造血(干)细胞移植物之前可已经或可未经清髓性预处理方案、或非清髓性预处理方案或降低强度预处理方案的治疗。
[0085]
在一个实施方案中,本发明涉及根据本发明的抗ccr7抗体的用途,其中ghvd的预防或治疗包括在接受者接受包含供体细胞的移植物之前、(大约)同时和/或之后向接受者施用抗ccr7抗体。在接受者接受包含供体细胞的移植物(大约)同时施用抗ccr7抗体优选是指分别在96、72、24、12、6或3小时内施用抗ccr7抗体。优选地,ghvd的预防或治疗包括以下至少一项:a)在接受者接受包含供体细胞的移植物之前向接受者施用抗ccr7抗体;b)在接受者接受包含供体细胞的移植物后48、72或96小时向接受者施用抗ccr7抗体;c)在接受者
接受包含供体细胞的移植物之后向接受者施用抗ccr7抗体,且优选在接受者显示出ghvd症状之后或在接受者中诊断出ghvd之后向接受者施用抗ccr7抗体;及d)在ghvd复发后向接受者施用抗ccr7抗体。
[0086]
在接受者接受移植物之前施用抗ccr7抗体被认为是期望的,因为这样将对接受者进行预处理以接受包含供体细胞的移植物,并因此允许防止ghvd或至少降低发生ghvd的风险。因此,优选至少在接受者接受移植物之前、更优选在接受者接受移植物之前至少5、10、20或40分钟或者1、2、4、8、12、24或48小时施用抗ccr7抗体。
[0087]
在接受者接受移植物之后施用抗ccr7抗体被认为是期望的,因为这将减少对接受者宿主的供体免疫攻击及进一步促进接受者接受供体的移植物和/或细胞。优选地,在接受者接受移植物之后施用抗ccr7抗体,只要根据需要施用以降低gvhd的发生和/或改善或减轻gvhd的一种或多种症状。施用频率和剂量也将取决于抗ccr7抗体的血清半衰期,并可相应地进行调整。在本发明的一个优选实施方案中,在接受者接受移植物之前和之后施用抗ccr7抗体。
[0088]
然而,如本文实施例所证实,在接受移植物的接受者中已经发展同种异体反应性应答之后向接受者施用抗ccr7抗体,在治疗ghvd中仍然有效,至少在提高存活率方面。因此,在本发明的一个实施方案中,向包含供体细胞的移植物的接受者施用抗ccr7抗体,之后接受者显示出ghvd的临床表现和/或可检测的同种异体反应性应答,和/或优选之后在接受者中确诊ghvd。在这种情况中,接受者可没有接受过用抗ccr7抗体的预先处理或抗ccr7抗体的施用。
[0089]
在接受者接受移植物后向接受者施用的抗ccr7抗体可以在以下至少一项后至少1、2、3、5、7、10、14、21或28天施用:i)接受者接受移植物或植入物;ii)接受者中出现ghvd症状;iii)在接受者中检测到同种异体反应应答;iv)接受者已被诊断患有ghvd。
[0090]
在本发明的另一个实施方案中,向接受包含供体细胞的移植物的接受者施用抗ccr7抗体,所述移植物在移植前通过与抗ccr7抗体的离体孵育而制备,优选根据如下所述方法制备。向接受者施用的抗ccr7抗体可以但非必需与在移植前制备移植物的离体方法中使用的抗ccr7抗体相同。
[0091]
在本发明的一个优选实施方案中,抗ccr7抗体或其抗原结合片段与移植物至少一次分开施用,优选在施用移植物之前不久或之后不久。在上下文中“不久”是指24小时内,优选8小时内,更优选6小时内,更优选4小时内,更优选2小时内,最优选1小时内。“与
…
分开”是指将ccr7抗体或其抗原结合片段包含在与移植物不同的另一个容器例如注射器中施用。优选地,ccr7抗体或其抗原结合片段在施用移植物之前至少10秒、更优选地之前至少1分钟、更优选地之前至少10分钟、最优选地之前至少1小时施用。在另一个优选的实施方案中,在施用ccr7抗体或其抗原结合片段之前至少10秒、更优选之前至少1分钟、更优选之前至少10分钟、最优选之前至少1小时施用移植物。
[0092]
优选地,所述治疗因此包括至少一次与移植物分开向接受者施用所述抗ccr7抗体或其抗原结合片段。
[0093]
在本发明的又一个实施方案中,抗ccr7抗体是在ghvd复发后向接受者施用,由此接受者可能未接受过抗ccr7抗体的先前治疗或施用。
[0094]
在另一方面,本发明涉及包含本文定义的抗ccr7抗体(或其抗原结合片段)的药物
组合物,其用于根据本发明的用途。所述药物组合物优选至少包含抗ccr7抗体或其药学衍生物或前药,以及药学上可接受的载体、佐剂或载具,用于向对象施用。所述药物组合物可通过向有需要的对象施用有效量的组合物而用于下文所述的治疗方法中。术语“对象”在本文中与术语“接受者”可互换使用,且如本文所用,是指归类为哺乳动物的所有动物,包括但不限于灵长类动物和人。所述对象优选地是任何年龄或种族的男人或女人。
[0095]
如本文所用,术语“药学上可接受的载体”旨在包括与药物施用方式相容的任何和所有溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等(见例如“handbook of pharmaceutical excipients”,rowe et al eds.7th edition,2012,www.pharmpress.com)。本领域熟知这种介质和试剂对于药物活性物质的用途。除非任何常规介质或试剂与活性化合物不相容,否则均考虑其在组合物中的用途。可接受的载体、赋形剂或稳定剂在所采用的剂量和浓度下对接受者是无毒性的,且包括缓冲剂例如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;六甲铵氯化物;苯扎氯铵,苄索氯铵;苯酚、丁醇或苯甲醇;烷基对羟基苯甲酸酯(alkyl parabens),例如甲基或丙基对羟基苯甲酸酯;邻苯二酚;间苯二酚;环己醇;3
‑
戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖,二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂如edta;糖,如蔗糖、甘露糖醇、海藻糖或山梨糖醇;形成盐的平衡离子,如钠;金属络合物(例如锌
‑
蛋白质络合物);和/或非离子表面活性剂,例如tween
tm
、pluronics
tm
或聚乙二醇(peg)。
[0096]
本发明的抗体可以在相同的制剂中或可以在不同的制剂中施用。施用可以是同时的或相继的,且以任一顺序均可有效。
[0097]
补充的活性化合物也可以加入到本发明的药物组合物中。因此,在特定实施方案中,本发明的药物组合物还可包含被治疗的特定适应症需要的一种以上的活性化合物,优选不会不利影响彼此的具有互补活性的那些活性化合物。例如,可需要进一步提供化疗剂、细胞因子、镇痛剂或免疫调节剂,例如免疫抑制剂或免疫刺激剂。除此之外,这种其它活性剂的有效量取决于药物组合物中存在的本发明抗体的量、疾病或病症或治疗的类型等。
[0098]
除了用于单一药剂治疗或预防gvhd之外,本发明的抗体和药物组合物可以与其它药物一起使用以提供联合疗法。所述其它药物可以构成同一组合物的部分,或者作为在同时或不同时间施用的分开的组合物提供。联合疗法可对患者产生协同治疗效果。在一个特定的实施方案中,本发明的抗体可以与本文描述的医学病况的其它治疗组合。其它治疗剂包括但不限于烷化剂(例如氮芥[例如二氯甲基二乙胺(mechloretamine)],环磷酰胺,美法仑(melphalan)和苯丁酸氮芥(chloambucil)),烷基磺酸盐(例如白消安(busulphan)),亚硝基脲(例如卡莫司汀(carmustine),洛莫司汀(lomustine),司莫司汀(semustine)和streptoxocine),三氮烯(例如达卡巴嗪(dacarbazine)),抗代谢药(例如叶酸类似物如氨甲蝶呤),嘧啶类似物(例如氟尿嘧啶和阿糖胞苷),嘌呤类似物(例如氟达拉滨(fludarabine),伊达比星(idarubicin),胞嘧啶阿糖胞苷,巯基嘌呤和硫鸟嘌呤),长春花生物碱(例如长春碱(vinblastine),长春新碱(vincristine)和vendesine),表鬼臼毒素类(依托泊苷(etoposide)和替尼泊苷(teniposide)),抗生素(放线菌素(dactinomycin),道
诺霉素(daunorubicin),阿霉素(doxorubicin),博来霉素(bleomycin),普卡霉素(plicamycin)和丝裂霉素(mitomycin)),二溴甘露醇,脱氧精胍菌素,二甲基马勒兰(dimethyl myleran)和噻替派(thiotepa),蛋白酶体抑制剂(bortezomib),喷司他丁(pentostatin),免疫抑制剂如类固醇(例如强的松(prednisone)和甲基强的松龙(methylprednisolone)),钙调神经磷酸酶抑制剂(例如环孢菌素a,他克莫司(tacrolimus)或fk506),哺乳动物雷帕霉素靶(mtor)抑制剂(西罗莫司(sirolimus)或雷帕霉素(rapamycin)),吗替麦考酚酯(mycophenolate mofetil),沙利度胺(thalidomide),来那度胺(lenalidomide),硫唑嘌呤,单克隆抗体(例如daclizumab(抗白细胞介素(il)
‑
2),infliximab(抗肿瘤坏死因子),依那西普(etanercept),medi
‑
205(抗cd2),abx
‑
cbl(抗cd147),阿仑单抗(alemtuzumab)(抗cd52),利妥昔单抗(rituximab)(抗cd20),和多克隆抗体(例如atg(抗胸腺细胞球蛋白)),抗组胺药,化学疗法,放射疗法,免疫疗法,手术,烷化剂,抗代谢药,抗激素药,各种症状的治疗剂例如止痛药、利尿剂、抗利尿剂、抗病毒药、抗生素、细胞因子、营养补充剂、贫血治疗剂、凝血治疗剂、骨治疗剂、精神病和心理治疗剂等。此外,本发明的抗体和药物组合物可以与其它类型的疗法联合使用以在移植之前或大约同时预防gvhd,所述其它类型的疗法包括但不限于免疫抑制剂,例如钙调神经磷酸酶抑制剂(例如环孢菌素a、他克莫司或fk506),哺乳动物雷帕霉素靶(mtor)抑制剂(西罗莫司或雷帕霉素),或抗增殖剂(例如吗替麦考酚酯、氨甲蝶呤),胸腺照射,光疗,美法仑,用环磷酰胺或atg在体内耗竭t细胞,或者用抗体(例如抗cd3)离体耗竭t细胞,以预防gvhd的发生。此外,本发明的抗体和药物组合物可以与其它类型的疗法联合使用以治疗gvhd,所述其它类型的疗法包括但不限于类固醇(例如强的松和甲基强的松龙),体外光分离术,喷司他丁(pentostatin),激酶抑制剂(例如鲁索利替尼(ruloxitinib)、依鲁替尼(ibrutinib)),蛋白酶体抑制剂(硼替佐米(bortezomib)),用nk细胞或调节t细胞或间充质干细胞的细胞疗法,用单克隆抗体(例如利妥昔单抗(rituximab)、阿仑单抗(alemtuzumab)、托珠单抗(tocilizumab)等)的免疫疗法,或融合蛋白(例如阿巴西普(abatacept)、阿法西普(alefacept)),t细胞迁移抑制剂(例如马拉韦罗(maraviroc))等。
[0099]
在施用本发明的抗体之前用细胞因子治疗患者以上调靶细胞表面上ccr7或其它靶蛋白的表达也可以是有用的。细胞因子也可以在施用消耗抗体或放射标记抗体同时或之前或之后施用,以刺激免疫效应子功能。
[0100]
此外,根据本发明的抗ccr7抗体用于治疗或预防gvhd的用途还可以包括在移植前对移植物的接受者施用预处理方案,包括清髓性、非清髓性或强度降低的预处理。这些处理可以根除潜在的疾病,并抑制和根除宿主免疫系统,其允许供体干细胞进入骨髓而不会出现移植排斥的风险。施用清髓性或强度降低或非清髓性处理可用于诱导混合的造血嵌合体或完全造血嵌合体。全身照射(tbi)和/或使用白消安和/或环磷酰胺的化疗方案是示例的清髓方案。如本文所用,“非清髓性”是指杀死骨髓细胞但在大量接受者中不会导致因骨髓衰竭而死亡的处理。这样允许供体干细胞至少以混合供体/接受者嵌合状态移植。宿主造血功能的最终消除是通过免疫供体细胞的移植物抗宿主作用实现的,最终导致完全供体嵌合。低剂量tbi、氟达拉滨(fludarabine)、atg、降低剂量的白消安或其组合用作非清髓方案。ric方案是一种中间方法,可防止清髓方案的高毒性,但提供对潜在疾病的足够控制和足够的免疫抑制作用以防止移植排斥。常见的ric方案包括氟达拉滨和美法仑,但ric治疗
方案中已经引进了许多其它药剂。
[0101]
在一个实施方案中,本发明的抗体与将保护所述化合物免于从体内快速消除的载体一起制备,所述免于从体内快速消除的载体例如控释制剂,包括植入体和微囊化释放系统,例如脂质体。可以使用可生物降解的生物相容性聚合物,例如乙烯醋酸乙烯酯、聚酐、聚乙醇酸、胶原蛋白、聚原酸酯和聚乳酸。制备这种制剂的方法对本领域技术人员来说是显而易见的。脂质体悬浮液,包括靶向脂质体也可用作药学上可接受的载体。这些可根据本领域技术人员已知的方法制备,例如如美国专利4,522,811、wo2010/095940所述。
[0102]
本发明的抗体(或其片段)的施用途径可以是口服、肠胃外、吸入或局部。如本文所用,术语“肠胃外”包括静脉内、动脉内、淋巴管内、腹膜内、肌内、皮下、直肠或阴道施用。优选肠胃外施用的静脉注射形式。“全身施用”是指口服、静脉内、腹膜内和肌内施用。当然,治疗性或预防性作用所需的抗体量根据所选抗体、所治疗病况的性质和严重程度以及患者而变化。此外,抗体可以通过脉冲输注适当地施用,例如以递减剂量的抗体。优选通过注射给药,最优选静脉内或皮下注射,部分取决于施用是短暂的还是长期的。
[0103]
因此,在一个特定的实施方案中,本发明的药物组合物可以是适合肠胃外施用的形式,例如合适单位剂型的无菌溶液、悬浮液或冻干产品。适于可注射使用的药物组合物包括无菌水溶液(在水溶性情况中)或分散体和用于即时制备无菌注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophorem(basf,parsippany,n.j.)或磷酸盐缓冲盐水(pbs)。在所有情况中,组合物必须是无菌的且应该是易于注射程度的流动状态。其在生产和储存条件下必须是稳定的,且必须防止微生物如细菌和真菌的污染。载体可以是溶剂或分散介质,其例如包含例如水、乙醇、药学上可接受的多元醇如甘油、丙二醇、液体聚乙二醇及其合适混合物。可以通过使用如卵磷脂包被、通过在分散的情况中维持所需的粒度以及通过使用表面活性剂以保持适当的流动性。可以通过各种抗菌剂和抗真菌剂例如对羟基苯甲酸酯(parabens)、氯丁醇、苯酚、抗坏血酸、硫柳汞等实现防止微生物的作用。在一些情况中,将优选在组合物中包括等渗剂,例如糖、多元醇如甘露醇、山梨糖醇或氯化钠。
[0104]
可注射组合物的延长吸收可以通过在组合物中包含延迟吸收的试剂例如单硬脂酸铝和明胶来实现。
[0105]
无菌可注射溶液可通过根据需要将活性化合物(例如多肽或抗体)以需要量与上文列举的成分的一种或组合掺入适当的溶剂中,然后过滤除菌来制备。通常,分散体是通过将活性化合物掺入到无菌载具中而制备,所述无菌载具包含基本分散介质和上文列举的所需的其它成分。在用于制备无菌可注射溶液的无菌粉末的情况中,优选的制备方法是真空干燥和冷冻干燥,其从其先前无菌过滤的溶液产生活性成分加上任何其它所需成分的粉末。
[0106]
在一个特定实施方案中,所述药物组合物通过静脉内(iv)或皮下(sc)施用。可以使用足够的赋形剂,例如填充剂、缓冲剂或表面活性剂。所提及的制剂是使用本领域熟知的及在各种来源中更详细描述的制备可肠胃外施用的组合物的标准方法制备,包括例如“remington:the science and practice of pharmacy”(ed.allen,l.v.22nd edition,2012,www.pharmpress.com)。
[0107]
特别有利的是以易于施用和均匀剂量的单位剂型配制药物组合物,即肠胃外组合
物。如本文所用,单位剂型是指适合作为待治疗对象的单位剂量的物理离散单位;每个单位包含经计算与所需的药物载体组合产生期望的治疗效果的预定量的活性化合物(本发明的抗体)。本发明的单位剂型的规格由活性化合物的独特特性和要实现的特定治疗效果,以及合成这种用于治疗个体的活性化合物的领域中固有的限制支配且直接取决于活性化合物的独特特性和要实现的特定治疗效果,以及合成这种用于治疗个体的活性化合物的领域中固有的限制。
[0108]
通常,本发明抗体的有效施用量将取决于所选化合物的相对功效、所治疗病症的严重程度和患者的体重。然而,活性化合物通常将每天施用一次或多次,例如每天1、2、3或4次,其典型的每日总剂量范围为0.001
‑
1,000mg/kg体重/天,优选约0.01
‑
100mg/kg体重/天,最优选约0.05
‑
10mg/kg体重/天。更具体地,用于根据本发明的用途,抗ccr7抗体优选以1
‑
1000、2
‑
500、5
‑
200、10
‑
100、20
‑
50或25
‑
35mg/kg体重/天的剂量施用,优选以每1、2、4、7、14或28天一次的剂量数施用。
[0109]
除了向患者施用抗体之外,本技术考虑通过基因疗法施用抗体。wo 96/07321涉及使用基因疗法产生胞内抗体。
[0110]
药物组合物可与施用说明书一起包含在容器、包装或分配器中。
[0111]
本发明的抗体和药物组合物可以与其它药物一起使用以提供联合疗法。所述其它药物可以构成同一组合物的部分,或者作为在同时或不同时间施用的分开的组合物提供。
[0112]
在另一方面,本发明涉及从供体制备用于移植到接受者中的器官、组织或细胞制备物的离体或体外方法。所述方法优选包括以下步骤:a)将器官、组织或细胞制备物与本文定义的抗ccr7抗体或其抗原结合片段一起孵育,由此优选所述抗ccr7抗体具有如下至少一项:i)降低器官、组织或细胞制备物中表达ccr7的供体细胞的数量,和ii)抑制器官、组织或细胞制备物中表达ccr7的供体细胞活性;及b)任选地,从器官、组织或细胞制备物中去除抗ccr7抗体和表达ccr7的供体细胞中的至少一种。优选地,将抗ccr7抗体与供体器官、组织或细胞制备物以足以/有效地降低器官、组织或细胞制备物中表达ccr7的供体细胞的数量和/或抑制其活性至足以降低所述器官、组织或细胞制备物的接受者中发生ghvd的风险和/或降低其中ghvd严重程度的程度的量和时间孵育。例如,将抗ccr7抗体与供体器官、组织或细胞制备物以足以/有效地明显抑制移植物中表达ccr7的供体细胞的活性的量和时间孵育,优选活性降低至少40%,更优选活性降低至少80%,且最优选活性降低至少90%。或者,例如将抗ccr7抗体与供体器官、组织或细胞制备物以足以/有效地明显降低移植物中表达ccr7的供体细胞的数量的量和时间孵育,优选数量降低至少40%,更优选数量降低至少80%,且最优选数量降低至少90%。据此理解,供体器官、组织或细胞制备物中表达ccr7的供体细胞优选地是表达ccr7的免疫细胞,更优选包括t
‑
淋巴细胞、b
‑
淋巴细胞、nk细胞或apc中的至少一种或多种细胞。
[0113]
本发明从供体制备用于移植到接受者中的器官、组织或细胞制备物的方法优选是在体外或离体环境中实施的方法,其中离体不排除通过将所述抗ccr7抗体施用至供体机体,将供体器官、组织或细胞制备物用抗ccr7抗体处理同时其仍在脑死亡供体或因循环系统死亡而死亡的供体体内。
[0114]
关于在体外或离体环境中临床治疗或预防gvhd的所有上述公开内容均适用于本实践。因此,抗ccr7抗体可包含在用于在移植前保存器官、组织或细胞制备物的保存溶液
中。例如,抗ccr7抗体可以以足以结合和抑制器官的免疫细胞活性的量加入器官移植物的保存溶液中。此外,抗ccr7抗体可以以足以结合和降低器官的免疫细胞数量的量加入器官移植物的保存溶液中。这种保存溶液可以适用于不同种类的器官(如心脏、肾和肝)及源于其中的组织的保存。可商购的保存溶液的一个示例是plegisol(abbott),且其它根据其来源命名的保存溶液包括uw
‑
溶液(university of wisconsin)、stanford溶液和modified collins溶液(j.heart transplant(1988)vol.7(6):456 4467)。保存溶液还可以包含常规的共溶剂、赋形剂、稳定剂和/或缓冲剂。含有抗ccr7抗体的保存溶液或缓冲液也可用于在移植或储存之前洗涤或冲洗器官移植物。因此,可以用包含抗ccr7抗体的保存溶液灌注待移植的器官或组织,优选在移植之前。例如,可以使用含有抗ccr7抗体的保存溶液冲洗灌注分离的心脏,然后将其在4℃保存在保存溶液中。
[0115]
在另一个实施方案中,本发明的实践可用于在移植前对器官或组织移植物进行预处理。在移植之前,可以将抗ccr7抗体或片段加入洗涤缓冲液中以从移植物去除活性t淋巴细胞、b淋巴细胞、nk细胞或apc。
[0116]
保存溶液或洗涤缓冲液中抗ccr7抗体或片段的浓度可以根据移植物类型而异。根据本发明,所述孵育可以例如进行1分钟至7天。根据本发明的方法和用途从器官、组织或细胞制备物中去除抗ccr7抗体(例如未结合的抗ccr7抗体)和表达ccr7的供体细胞中的至少一种,本领域技术人员已知进行所述步骤的各种方式。从植入物中去除抗体的一种示例方式是洗涤植入物。例如在植入物包含细胞悬浮液或是细胞悬浮液的情况中,可以通过应用离心进行洗涤。可选地,可以通过亲和纯化抗ccr7抗体及优选与其结合的表达ccr7的供体细胞,从待移植的细胞制备物(例如骨髓细胞、外周血细胞或脐带血细胞)中去除抗ccr7抗体和表达ccr7的供体细胞。因此,优选用于纯化的亲和配体不影响抗ccr7抗体的抗原结合能力,从而可以从细胞制备物中共同纯化结合至抗ccr7抗体的表达ccr7的供体细胞。亲和纯化方法为本领域熟知,且包括例如其中将亲和配体固定在固相载体材料例如磁珠或用于亲和(柱)层析的固相载体材料上的方法。
[0117]
上述孵育步骤中应用的抗体量没有特别限制。本领域技术人员可以容易地确定合适的量及可以例如取决于所使用的植入物类型。优选地,根据本发明,所述孵育以0.1μg
‑
100mg的抗体量进行。选择合适量的抗体完全在本领域技术人员的专业知识范围内。通常,当植入物包含组织或器官或者是组织或器官时,分别优选更高量或更高浓度的抗体。此外,所用抗体的精确量或浓度的选择也将取决于这种组织或器官的大小。
[0118]
在本文件及其权利要求中,动词“包含”及其词形变化以其非限制性意义使用以表示包括该词之后的项目,但不排除未具体提及的项目。此外,涉及某元件时使用的不定冠词“一个”不排除存在多个元件的可能性,除非上下文明确要求存在一个且仅一个元件。因此,不定冠词“一个”(a)和“一个”(an)通常表示“至少一个”。
[0119]
当与数值(例如约10)关联使用时,单词“约”或“大约”优选表示该数值可以是比给定数值(10)多或少0.1%的值。
[0120]
本说明书中引用的所有专利和参考文献均以其全部内容通过引用并入本文。
[0121]
通过以下实施例进一步描述本发明,但不应将其理解为对本发明范围的限制。
[0122]
附图简述
[0123]
图1.抗ccr7抗体有效预防gvhd发生。
[0124]
a)三个实验组的相对体重减轻。对照组中小鼠用pbs处理(n=4)、同种型对照(ic)组中小鼠用无关抗体处理(n=5),以及抗ccr7组中小鼠用靶向ccr7的抗体处理(n=5)。第0天的体重被认为是100%。p值是指抗ccr7组和其它组的比较分析。
[0125]
b)所有实验组的kaplan
‑
meier生存曲线。
[0126]
c)在得自每个实验组的外周血(pb)连续样本中发现的人cd45
细胞的百分比。
[0127]
d)在动物被安乐死时收集的淋巴组织(骨髓和脾)中发现的人cd45
细胞的百分比。
[0128]
图2.抗ccr7抗体有效治疗早期gvhd。
[0129]
a)实验组的相对体重减轻。同种型对照(ic)组中小鼠用无关抗体处理(n=5),以及抗ccr7组中小鼠用靶向ccr7的抗体处理(n=5)。第0天的体重被认为是100%。p值指抗ccr7组与其它组的比较分析。
[0130]
b)每个实验组的kaplan
‑
meier生存曲线。
[0131]
c)得自每个实验组的外周血(pb)连续样本中发现的人cd45
细胞的百分比。
[0132]
d)在动物被安乐死时收集的淋巴组织(骨髓和脾)中发现的人cd45
细胞的百分比。
[0133]
图3.抗ccr7抗体有效治疗早期和晚期gvhd。
[0134]
a)实验组的相对体重减轻。同种型对照(ic)组中小鼠首先在第 3天(n=2)、第 7(n=2)或第 10天(n=1)用无关抗体处理。抗ccr7组中小鼠首先用靶向ccr7的抗体(n=5)在第 7天(n=5)或在第 10天(n=5)处理。第0天的体重被认为是100%。p值指抗ccr7组与其它组的比较分析。
[0135]
b)每个实验组的kaplan
‑
meier生存曲线。来自每个ic臂(ic arm)的所有动物被分成一个单一组。
[0136]
图4.抗ccr7 mab的选择。将靶向ccr7的几种商业抗体克隆基于其阻断ccr7介导的朝向ccl19和ccl21迁移的能力(a)以及诱导补体介导的靶细胞杀伤(cdc)的效力(b)进行表征。在表达ccr7的慢性淋巴细胞白血病细胞上测试这两种迁移(输入百分比,在基础、ck、150503和2h4中n=2;在6b3、3d12、h60中n=1)和cdc(特异性裂解百分比,n=2),根据在材料和方法部分中描述的过程进行。条形代表平均值
±
sd。基于这些结果,选择克隆150503进行gvhd的体外和体内概念验证。
[0137]
图5.中和抗ccr7抗体的作用机制。
[0138]
a)阻断ccr7中和来自单采分离术的tn和tcm细胞的靶介导的迁移。针对cd4
和cd8
t细胞亚群示出了ccr7
‑
配体相互作用的特异性拮抗作用,以迁移的输入细胞百分比降低表示。在这两种情况中,将分离自单采分离术(n=3)的血清饥饿的pbmc与10μg/ml抗ccr7或相应的同种型对照(ic)预孵育30分钟。然后,在裸transwell皿中测定由1μg/ml的ccl19或ccl21诱导的趋化性(4小时)。基础迁移代表自发迁移,没有趋化刺激。将迁移至下层皿的细胞染色及通过流式细胞术计数。如材料和方法所述,计算迁移细胞的百分比(%输入)
[0139]
b)抗ccr7mab特异性消耗t
n
和t
cm
。针对cd4
和cd8
t细胞亚群示出ccr7阳性细胞的特异性消耗,以补体激活介导的特异性裂解(cdc)的百分比表示。在这两种情况中,将来自单采分离术的靶细胞(n=3)与10μg/ml抗ccr7或相应的同种型对照(ic)孵育30分钟,并然后暴露于兔补体1.5小时。通过流式细胞术量化每个亚群中7
‑
aad的掺入确定细胞裂解。根
据材料和方法中所示的公式计算特异性裂解的百分比。条形代表平均值
±
sd。ns,不显著;*,p<0.05;**,p<0.01;***,p<0.001。
[0140]
图6.单采分离术中输注的ccr7
t细胞亚群的比例与cmv或复发率不相关。
[0141]
a
‑
b)比较移植后前六个月内接受者的cmv感染状态的单采分离术中输注ccr7
t细胞亚群的比例。通过流式细胞术分析单采样品,并将其分为输注至示出cmv dna的患者(n=60)和输注至移植后未示出cmv dna的患者(n=43)。示出有或没有cmv的cd4
ccr7 (a)和cd8
ccr7 (b)输注患者亚群的百分比。为了确定cmv的再活化,使用了病毒载量>57拷贝/ml的截止值。
[0142]
c
‑
d)比较有或没有疾病复发的患者的单采分离术中输注ccr7
t细胞亚群的比例。通过流式细胞术分析单采分离术样品,并将其分为输注至复发的患者(n=25)和输注至移植后未复发的患者(n=78)。示出有或没有疾病复发的cd4
ccr7
(c)和cd8
ccr7
(d)输注患者亚群的百分比。
[0143]
图7.单采分离术中输注的ccr7
t细胞亚群的比例与疾病复发不相关。通过流式细胞术分析单采分离术样品,并将其分为输注至复发的患者(yes)和输注至移植后未复发的患者(no)。
[0144]
示出对于不同血液病症,比较有或没有疾病复发的患者在单采分离术中ccr7
t细胞(cd4
或cd8
)亚群的比例,包括:
[0145]
a)骨髓增生异常综合征(mds);“yes”ns cd4
p=0.4199;cd8
p=0.2117;
[0146]
b)急性淋巴细胞白血病(all);“yes”ns cd4
p=0.5758;cd8
p=0.1908;
[0147]
c)急性髓系白血病(aml);“yes”ns cd4
p=0.1638;cd8
p=0.4126;
[0148]
d)霍奇金淋巴瘤(hd);“yes”ns cd4
p=0.5106;cd8
p=0.8873;
[0149]
e)非霍奇金淋巴瘤(nhl);“yes”ns cd4
p=0.9926;cd8
p=0.7369;
[0150]
f)多发性骨髓瘤(mm)。
实施例
[0151]
实施例1:ccr7的抗体作为工具以治疗gvhd
[0152]
材料和方法
[0153]
样品、试剂和流式细胞术(fcm)
[0154]
知情同意后获得健康志愿者的外周血样本。随后对正常t和b淋巴细胞进行ccr7表达分析。藻红蛋白(pe)缀合的小鼠抗人ccr7购自r&d systems(mckinley place,mn)。在所有情况中均包括适当的同种型对照(ic)。使用diva软件(bd biosciences)在facs canto ii流式细胞仪上分析免疫荧光染色。通过ficoll梯度离心(histopaque
‑
1077,sigma
‑
aldrich,madrid,spain)分离外周血单核细胞(pbmc)。
[0155]
gvhd的异种小鼠模型
[0156]
在nod/scid
‑
il2rγ
null
小鼠中建立gvhd体内模型。为此,在所有模型中,将动物进行2gy亚致死照射,以及4小时后将来自健康志愿者的8
×
106人外周血单核细胞(pbmc)(在200μl的pbs中)静脉内接种到每只照射的小鼠中。6
‑
10周龄的雄性和雌性小鼠用于体内概念验证。根据西班牙法律和cbmso伦理委员会指南,在centro de biolog
í
a molecular severo ochoa(cbmso)的动物设施中进行实验。
[0157]
在小鼠中评估的临床参数包括体重减轻、弯腰姿势(驼背)、皮肤改变、后腿麻痹(或运动能力下降)和呼吸急促。为了研究外周血(pb)中的浸润,在实验中的不同时间收集血液样本。为了分析在不同组织中的浸润,对小鼠实施安乐死,并收集并解离包括脾和骨髓(bm)的器官/组织。在这两种情况中,将细胞用人特异性抗cd45 fitc
‑
mab(clone hi30,bd biosciences,www.bdbiosciences.com)标记,并然后通过流式细胞术分析。
[0158]
小鼠中抗ccr7抗体的预防性用途
[0159]
为了评估在供体细胞中阻断ccr7的效力,将小鼠用于预防环境中。为此,小鼠首先用纯化的鼠抗人ccr7 mab(n=5只小鼠;克隆150503,同种型igg2a,r&d systems,minneapolis,mn,usa)或不相关的同种型对照(ic)抗体(n=5只小鼠;igg2a,biolegend,san diego,ca,usa)或pbs(n=4只小鼠)处理。抗ccr7 mab和ic均以~10mg/kg(~200μg/小鼠)腹膜内注射。2小时后,为每只动物接种来自单一健康供体的pbmc。动物每4天接受4剂以上的抗ccr7、ic或pbs。在移植后第10、 13、 18和 21天分析pb样品。在对动物实施安乐死后分析bm和脾。
[0160]
在gvhd峰值期间抗ccr7抗体的治疗性用途
[0161]
为了研究抗ccr7 mab的治疗性效力,建立模型以评估抗ccr7 mab是否影响pb中发现的同种异体反应性群体,以及这种方法是否减轻gvhd症状。在这个模型中,将携带pbmc的小鼠首先在植入后第 5天用抗ccr7(n=5)或其相应的ic(n=5)以~10mg/kg(~200μg/小鼠)处理。每3天重复一次处理。在移植后第 10、 13、 18天和 25天进行pb采样。当动物被安乐死时进行脾和bm采样。实验在pbmc植入后33天终止。
[0162]
通过另一个模型,我们评估了在同种异体反应峰值期间或之后的不同时间点使用抗ccr7的效力。为此,用抗ccr7(n=15)或ic(n=5)处理20只携带人pbmc的小鼠。在抗ccr7处理组中,5只小鼠在第 3天接受第一剂;5只小鼠在第 7天接受第一剂;以及5只小鼠在第 10天接受第一剂。在ic处理组中,在植入后2只小鼠第 3天首次处理;2只小鼠在第 7天首次处理,以及1只小鼠在第 10天首次处理。实验在第 26天终止。
[0163]
确定抑制ccr7依赖性胞内信号传导的测定
[0164]
抗ccr7抗体在过表达人ccr7的中国仓鼠卵巢(cho)细胞中抑制ccl19和/或ccl21介导的胞内信号传导的能力,通过既定的标准β
‑
抑制蛋白募集测定法(pathhuntertm,discoverx,fremont,ca,usa;southern et al.,2013,j biomol screen.18(5):599
‑
609)确定。
[0165]
确定抑制细胞迁移的测定
[0166]
在细胞迁移测定中确定抗ccr7抗体抑制人t细胞淋巴瘤细胞迁移(趋化性)的能力,所述人t细胞淋巴瘤细胞由配体ccl19和ccl21诱导内源性表达人ccr7受体。
[0167]
使用具有8μm孔径的插入组件的transwell双皿进行细胞迁移测定(costar,cambridge,ma,usa)。下层皿含有在补加0.5%bsa的hamf12培养基中稀释的配体(ccl19或ccl21)。将与抗ccr7单克隆抗体预孵育的内源性表达ccr7的细胞(t细胞淋巴瘤(hut
‑
78))置于插入组件中,及将所述皿组件在37℃孵育。在细胞裂解后,通过dna染色(cyquant gr染色溶液,life technologies ltd,uk)确定下层室中跨膜迁移的细胞的数量。
[0168]
补体依赖性细胞毒性(cdc)测定
[0169]
如cuesta
‑
mateos等(cancer immunol immunother.2015,64:665
‑
76)所述进行
cdc测定。简而言之,将2
×
105的pbmc靶细胞与指定浓度的纯化的抗ccr7、阿仑单抗(抗cd52)或ic抗体一起铺板在96孔圆底平板中。在37℃孵育30分钟后,洗涤细胞并加入有或没有经过预先热灭活(56℃,30分钟)的含有25%兔补体(serotec,oxford,uk)的完整rpmi 1640培养基。1.5小时后,将细胞用抗cd19
‑
fitc、抗cd3
‑
pe和抗cd5
‑
apc mab染色,以区分cll细胞和t细胞群。7
‑
aad用作生存能力排除染料。使用下式计算特异性裂解的百分比(%sl):100
×
(具有活化的补体的死亡细胞%
‑
具有失活的补体的死亡细胞%)/(100
‑
具有失活的补体的死亡细胞%)。
[0170]
确定不存在激动作用的测定
[0171]
在高浓度(267nm)下测试,检测抗人ccr7结合单克隆抗体在过表达人ccr7的中国仓鼠卵巢(cho)细胞中(不存在)诱导的可检测的胞内激动作用,使用既定的标准β
‑
抑制蛋白募集测定(pathhuntertm,discoverx,fremont,ca,usa;southern et al.,2013,j biomol screen.18(5):599
‑
609)进行(数据未显示)。不相关的igg2a用作阴性对照,以及ccl21(ccr7的天然配体)用作阳性对照。如果抗人ccr7结合抗体诱导的胞内激动作用不超过阴性对照,认为所述抗体缺乏可检测的胞内激动作用。
[0172]
biacore亲和性测定
[0173]
在标准条件下通过biacore测量确定单克隆抗体的亲和性。将单克隆抗体固定在合适的传感器表面,且将硫酸化的包含源自人ccr7的n
‑
末端的19
‑
49残基的抗原sym1899溶液((pyroglu)devtddzigdnttvdztlfeslcskkdvrnk;seq id no:3;其中z表示硫酸化酪氨酸)通过传感器表面。
[0174]
结果
[0175]
预防性施用抗ccr7阻断gvhd发生
[0176]
在植入hpbmc之前接受第一次预防性剂量的抗ccr7及植入后连续四次给药的小鼠没有出现任何gvhd临床症状。相反,接受ic或pbs的小鼠表现出临床症状,包括体重减轻(图1a)。在移植后 9天和 12天之间观察到体重差异(ic相对于抗ccr7,p=0.045;pbs相对于抗ccr7,p=0.0134)。值得注意的是,在整个实验过程中,接受抗ccr7的动物甚至体重增加。因此,抗ccr7抗体延长了总生存期(图1b)。用抗ccr7 mab处理的动物没有出现任何临床症状且存活长达32天,即处死动物的时间点,且这被认为是真实的无病期。相反,表现出严重临床症状的对照小鼠在 11、 13、 14和 18天被安乐死。在第 13、 14和 18天,处死来自抗ccr7处理组的一只动物以安排器官浸润的比较分析。接受抗ccr7抗体的动物无一表现出临床症状,且其被处死只是为了实验目的。因此,在这些天里,抗ccr7处理的小鼠没有出现任何临床症状且体重增加,并因此在来自抗ccr7处理的小鼠的pb中没有检测到反应性供体细胞的存在(图1c)。相比之下,对照组pb中pro
‑
gvhd细胞的存在随时间增加。在处死时,在bm和脾中分析浸润情况(图1d)。与在pb中的发现一致,在用抗ccr7 mab处理的动物的淋巴组织中未观测到pro
‑
gvhd细胞。相反,对照组中这些组织出现持续浸润(对照组bm相对于抗ccr7组bm:34.6%相对于0.57%,p=0.002;ic组bm相对于抗ccr7组bm:41.7%相对于0.57%,p=0.003;对照组脾相对于抗ccr7组脾:70.1%相对于0.17%,p=<0.001;ic组脾相对于抗ccr7组脾,71.3%相对于0.17%,p=<0.001)。对照组之间没有观察到差异(pbs相对于ic:bm,p=0.57/脾,p=0.86)。
[0177]
治疗性施用抗ccr7改善gvhd
[0178]
为了证实抗ccr7抗体在体内的治疗效力,使用模型,其中一旦出现同种异体反应性应答,就对动物进行治疗。这些通常在 3至 5天发生的应答是gvhd病原性的主要原因。也就是说,在一个模型中,将人pbmc植入到免疫缺陷小鼠中。将动物用ic(n=5)或抗ccr7抗体(n=5)处理。在第 5天施用第一剂抗体,且每两天进行一次连续给药。在这个模型中,抗ccr7抗体对动物体重产生积极影响(图2a)。相比之下,对照动物体重减轻。在第 12天首次观测到差异。此外,抗ccr7疗法延长总生存期(图2b)。
[0179]
用抗ccr7 mab处理的动物没有出现任何临床症状,且存活长达33天,即处死动物的时间点,且这被认为是真实的无病期。相比之下,表现出严重临床症状的对照小鼠在 12、 20和 28天被安乐死。在第 12和 28天,处死来自抗ccr7处理组的一只动物以安排对器官浸润的比较分析。这些接受抗ccr7抗体的动物无一表现出临床症状,处死是为实验目的。因此,在这些天里,抗ccr7处理的小鼠未出现任何临床症状且体重增加,并因此在来自抗ccr7处理的小鼠pb中未检测到反应性供体细胞的存在(图2c)。相比之下,对照pb中pro
‑
gvhd细胞的存在随时间增加。值得注意的是,从第 10天开始观察到pb浸润的显著差异(对照组相对于抗ccr7组:12.6%相对于2.6%;p=0.02)。这些差异在第 12天增加并保持不同直到实验结束(47.3%相对于6.5%;p<0.001)(图2c)。在处死时,在bm和脾中分析浸润情况(图2d)。与在pb中的发现一致,在用抗ccr7 mab处理的动物的淋巴组织(bm和脾)中观察到一小部分pro
‑
gvhd细胞(图2d)。相反,对照组中这些组织持续浸润(对照组bm相对于抗ccr7组bm:27.3%相对于3.5%;p=0.005;对照组脾相对于抗ccr7组脾:59.2%相对于8.4%;p=0.006)。
[0180]
在另一模型中,我们旨在评估抗ccr7抗体在疾病发作后不同时间治疗gvhd的效力。为此,在植入后的不同时间点施用抗ccr7抗体。在植入供体pbmc后第 3、 7和 10天处理动物。15只小鼠用抗ccr7抗体处理(第 3天5只;第 7天5只;第 10天5只),以及5只小鼠用ic处理(第 3天2只;第 7天2只;和第 10天1只)。所有小鼠每两天接受一次连续剂量,直到实验结束。在第 3天接受第一剂抗ccr7抗体的小鼠体重增加,且总生存期延长(图3a和3b)。用抗ccr7 mab处理的动物未出现任何临床症状且存活长达被处死时的26天,这被认为是真实的无病期。相比之下,对照小鼠的中位总生存期为14天。值得注意的是,不是在第 7天或第 10天之前用抗ccr7抗体处理的动物表现出比在第 3天开始处理的小鼠更差的结果。然而,仅在第 7天或第 10天开始处理的动物仍显示出比其各自的对照更好的结果。一些在第 7或 10天接受第一剂的动物活到第 19天,而相应对照组中没有动物存活时间超过第 12天。
[0181]
抗ccr7抗体削弱人t
n
和t
cm
细胞朝向ccl19和ccl21的体外趋化性
[0182]
这些结果促使我们评估ccr7不是作为选择合适植入物的生物标志物而是作为基于抗体疗法的可靶向受体的效用。为此,我们选择并使用了一种抗体,其具有阻断ccr7配体相互作用及通过cdc或抗体依赖性细胞毒性(adcc)杀死靶细胞的能力(图4)。
[0183]
然后,我们首先评估了所选mab抑制来自单采分离术的hpbmc的配体驱动趋化性的能力。正如预期的那样,当pbmc与ic一起预孵育时,向培养基中加入ccl19或ccl21触发ccr7
t
n
和t
cm
亚群的迁移(图5a),且在t
n
区室中具有更显著的作用。然而,10μg/ml抗ccr7 mab的结合降低这些细胞向基础水平的迁移。相反,t
em
和t
emra
不响应ccr7配体而迁移,并因此抗ccr7不影响其行为。
[0184]
抗ccr7抗体通过cdc特异性消耗ccr7 人t
n
和t
cm
细胞
[0185]
如先前所述(cuesta
‑
mateos c.targeting ccr7 in t
‑
cell prolymphocytic leukemia.control
‑
t:international conference april 2016mature t
‑
cell lymphomas
‑
molecular pathology,modeling of cellular dynamics,and therapeutic approaches.2016),选择的抗体足够强力以通过cdc杀死肿瘤t细胞,但其对健康ccr7
t细胞亚群的作用在先前未得到解决。因此,我们使用来自单采分离术的新鲜hpbmc进行了体外cdc测定。在与cd4
t
n
或t
cm
细胞结合后,10μg/ml抗ccr7介导强力的cdc活性(图5b)。在cd8
t
n
细胞中观测到类似结果。相反,抗ccr7 mab不影响ccr7阴性的t
em
和t
emra
,表明抗ccr7疗法将维持效应细胞,并从而保护其免受病原体和gvl影响。为了进一步探索这一想法,我们研究了植入物中ccr7
细胞的数量是否与移植后前6个月内的cmv再活化相关,但在有或没有cmv再活化的患者之间观测cd4
ccr7
或cd8
ccr7
细胞在比例(图6a和6b)或绝对数量(数据未显示)方面没有明显差异。此外,多变量逻辑回归分析(表1)证实植入物中ccr7
细胞的比例不是cmv再活化的危险因素。
[0186]
表1:多变量分析
[0187][0188]
[cd4
(p=0.144);cd8
(p=0.092)]。类似地,植入物中ccr7
细胞的比例或绝对数量与移植后疾病复发率无关,且同样,复发患者和未复发患者之间没有观察到明显差异(图6c和6d,数据未显示)。因此,多变量逻辑回归分析(表1)证实植入物中ccr7
细胞的比例不是疾病复发的危险因素[cd4
(p=0.702);cd8
(p=0.362)]。最后,当根据潜在疾病的诊断对患者进行分组时,进一步证实了植入物中ccr7
细胞比例与复发率之间缺乏关联(图7)。总之,这些结果排除了使用ccr7(在单采分离术中)作为预测cmv感染或疾病复发的生物标志物,但作为附加读出,其提示任何旨在减少植入物中ccr7
细胞比例的方法不会与更高的感染风险或更高的复发率相关联。
[0189]
抗ccr7 mab阻断ccr7信号传导而无激动作用
[0190]
在高浓度(267nm)下测试,通过既定的标准b
‑
抑制蛋白募集测定(pathhunter
tm
,disco verx,fremont,ca,usa;southern et al,2013,j biomol screen.18(5):599
‑
609)确定具有seq id no:1和2的hvr的单克隆抗体在过表达人ccr7的中国仓鼠卵巢(cho)细胞中未显示任何可检测的激动作用(数据未显示)。
[0191]
讨论
[0192]
gvhd是同种异体移植后常见的并发症,其可以是致命的。近年来已经证实,供体细胞中较高的ccr7表达与较高级别的接受者次级淋巴器官(slo)浸润相关,因此有更多机会发现可导致同种异体免疫反应的同种异体抗原。来自本发明人的先前数据表明,向slo的迁移依赖于ccr7,并且已经确定了向ccr7配体迁移与gvhd发生和等级之间的关联(portero
‑
sainz,i et al.,bone marrow transplantation(2017),1
–
8)。相似地,其它出版物提出初始t细胞和tcm是agvhd和cgvhd发生的主要参与者(yakoub
‑
agha,i.,et al.,leukemia,2006.20(9):p.1557
‑
65;distler,e.,et al.,haematologica,2011.96(7):p.1024
‑
32;cherel,m.,et al.,eur j haematol,2014.92(6):p.491
‑
6.),尽管初始t细胞对接受者抗原的反应能力比tcm强。这些数据表明,在免疫疗法中使用ccr7作为治疗靶的可能性不仅是因为其在t细胞tcm和几种apc中的高密度,还因为其在疾病进展和病原性中的关键作用。从这个意义上说,我们证实在体内将抗ccr7抗体施用至nhp导致初始t细胞以及tcm细胞的选择性减少(数据未显示)。此外,抗ccr7抗体已显示有效阻断表达ccr7的t细胞向ccr7配体迁移(数据未显示)。最后,如体内小鼠模型所证实,抗ccr7抗体有效预防和治疗gvhd。值得注意的是,最有效的治疗方法包括在第 3至 5天施用抗ccr7抗体,从而反映了使用环磷酰胺预防hsct中的同种异体反应性的治疗窗口(luznik,l.,et al.,biol blood marrow transplant,2002.8(3):p.131
‑
8)。总之,抗ccr7抗体的临床前使用结果证实,消耗和/或中和表达ccr7的细胞(包括初始t细胞和tcm)向slo的迁移是预防和/或治疗gvhd的合理方法。因此,通过消耗表达ccr7的细胞和/或阻止其迁移到slo,同种异体反应性表达ccr7的细胞将不被激活,从而削弱gvhd的发生。
[0193]
因此,sasaki et al.(2003,j immunol,170(10:p.588
‑
96.)表明早期使用ccl21拮抗剂阻止供体t细胞进入淋巴结,并从而阻止gvhd发生。dutt等人表明在临床前体内模型中,初始cd62l细胞的消耗延迟gvhd发作并延长os(dutt,s.,et al.,blood,2005.106(12):p.4009
‑
15)。类似地,在临床环境中,来自单采分离术的表达cd45ra的初始t细胞的消耗会削弱gvhd的发生率和发展(touzot,f.,et al.,j allergy clin immunol,2015.135(5):p.1303
‑
9e1
‑
3;shook,d.r.,et al.,pediatr blood cancer,2015.62(4):p.666
‑
73;triplett,b.m.,et al.,bone marrow transplant,2015.50(7):p.1012)。然而,在所有这些研究中以及与抗ccr7疗法相比,均未靶向tcm细胞。总之,值得一提的是近年来的证据表明,针对感染的免疫力并不依赖于ccr7 细胞(choufi,b.,et al.,bone marrow transplant,2014.49(5):p.611
‑
5),因此消耗和/或阻断表达ccr7的细胞对于接受者患者看起来是安全方法。
[0194]
实施例2:鉴别患有低风险gvhd的患者
[0195]
材料和方法
[0196]
我们分析了在la princesa university hospital,madrid,spain(portero
‑
sainz et al,2017)接受同种异体hsct的103对供体
‑
接受者对的队列(见表2)。研究方案经伦理委员会批准(参考pi
‑
624)并按照赫尔辛基宣言(declaration of helsinki)进行。
[0197]
表2:移植特性
[0198]
[0199][0200]
表型鉴定
[0201]
如先前所述(portero
‑
sainz et al,2017),将单采分离术样品用七色抗体组(表
3)染色。t细胞亚群的相对和绝对数量指的是总白细胞计数。t
n
、t
cm
、t
em
和t
emra
亚群用以下抗体鉴定:cd45ra
‑
fitc,cd62l
‑
pe,cd3
‑
apc,cd4
‑
pb(bd biosciences,san jose,ca)。
[0202]
表3:研究中使用的抗体克隆
[0203]
靶克隆荧光物来源cd8sk1fitcbdcd4rpa
‑
t4pbbdcd62lsk11pebdcd3sk7percpbdcd3sk7apcbdcd19sj25c1pecy7bdcd452d1pobdcd45rahi100fitcbdccr7150503apcr&dccr7150503无(纯化的)r&digg2amopc
‑
173无(纯化的)biolegend
[0204]
治疗性抗体
[0205]
纯化的小鼠抗人ccr7 mab(igg2a同种型)购自r&d systems(mn,usa),且匹配的同种型对照(ic)购自biolegend(ca,usa)。
[0206]
统计学分析
[0207]
定性变量以相对(百分比,%)和绝对(数量,n)频数表示。定量变量以集中趋势(平均值)和离差(sd或sem)度量表示。视情况通过pearson’s x2检验或fisher精确检验比较组间的定性数据。使用t检验或单向方差分析(anova)分析等方差的定量变量(levene检验)。mann
‑
whitney u或kruskal
‑
wallis检验用于异方差性。
[0208]
视情况通过portero
‑
sainz等(2017)描述的患者队列中进行二元逻辑回归分析,以鉴别通过混杂变量调整的gvhd和cmv再激活(或疾病复发)的预测因子:年龄,hla和cmv状态,性别,预处理方案,输注的cd3
和cd34
数量,同种异体致敏作用,造血干细胞移植后复发,基础疾病,植入物来源和预防。
[0209]
进行探索性单变量分析以搜索与因变量agvhd、cgvhd和cmv感染或疾病复发相关的变量(p<0.05)。在单变量分析中达到概率阈值的混杂变量(p<0.10)包括在多变量逻辑回归模型中。通过roc曲线从我们之前的模型(portero
‑
sainz et al,2017)的agvhd风险评分中估算灵敏性
±
95%ci。以相同方式计算来自cmv感染风险评分的敏感性。显著性设定为p值<0.05。为了确定cmv再活化,使用病毒载量>57拷贝/ml的截止值。使用stata version 13.0(college station,tx,usa)进行统计分析。
[0210]
结果
[0211]
基于ccr7
细胞比例的单采分离术选择不阻止或延迟gvhd
[0212]
为了建立潜在的截止点以选择低风险发生gvhd的单采分离术,我们对我们的队列进行敏感性分析(roc曲线),并任意选择第25个百分位(<3.6%)以鉴别用低比例ccr7 t细胞移植的患者。如表4所示,接受具有在第25百分位内比例的cd4 ccr7 细胞(<3.6%)的植入物的87.88%(75.23%
‑
100%)的患者未发生agvhd。在cd8 ccr7 的情况中,单采分离术
中选择<2.2%的细胞(第25个百分位数)与88.57%对于cgvhd的敏感性(76.60%
‑
100%)相关。
[0213]
表4:单采分离术和agvdh(或cgvhd)中cd4
ccr7
细胞百分比(或cd8
ccr7
细胞百分比)的roc分析(以第25个百分位为截止值)
[0214]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。