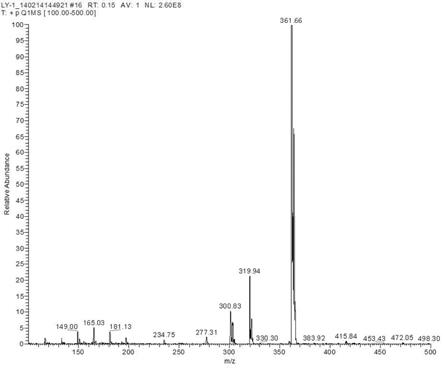
一种由过氧化物酶催化制备
β
‑
卤代醚和
β
‑
卤代醇的方法
技术领域
1.本发明涉及一种由过氧化物酶催化制备β
‑
卤代醚和β
‑
卤代醇的方法,属于生物技术领域。
背景技术:
2.卤代醚类化合物应用广泛。如今市场常用的几种全身麻醉药物如七氟醚、异氟醚等就包含卤代醚结构单元。例如,七氟醚是应用广泛的全身麻醉药物之一,具有低代谢率、刺激小以及消除迅速等优点。1981年,coon clifford l等人以1,1,1,3,3,3
‑
六氟
‑2‑
丙醇(hfip)为原料,在过量氟化氢气体与发烟硫酸中,与多聚甲醛反应来合成七氟醚。该反应中氟化氢为带有刺激气味的有毒气体,价格昂贵,还会造成环境污染,且发烟硫酸属于危化品,对人体的皮肤粘膜、组织等都有强烈的刺激性以及腐蚀作用。可见,含卤醚类化合物的合成条件苛刻,这些原因使其大规模合成受到一定限制。2000 年,christopher bieniarz等人开发出一种无需使用毒害试剂相对环境友好的合成方法。同样以hfip为原料,引入三氯化铝催化合成hfip的氯甲醚化合物,然后在反应体系中加入多聚甲醛来合成目标化合物。虽然对上述方法有一定改进,但反应过程中会放出大量的热,容易引发火灾,需要严格控制体系温度。多聚甲醛遇明火也有燃烧爆炸的危险,这也使得该方法的大规模生产及应用收到一定的局限。
3.卤代醇在有机合成、医药、工业化学等领域是一种重要的结构单元,也广泛应用于合成颜料、照相材料等。卤代醇可以被进一步转化为环氧化物或其他官能团化合物。传统的合成卤代醇的方法为用卤素在水溶液中处理烯烃得到,但是由于这种方法中的卤素反应活性较高,会有副产物的产生。除上述方法外环氧化物与金属卤化物或者卤化氢的开环也可以产生相应的卤代醇化合物,但该方法也会产生相应的二卤代物与二醇化合物的副产物。近年,报道了多种优化的卤代醇合成方法。2002年,m.arjun reddy 等人用卤化氢或卤化锂在环糊精存在下将环氧化物开环,实现了环氧化物向β
‑
卤代醇的高产率转化。随后,开发了烯烃直接转化为卤代醇的方法,但通常试剂昂贵,产率较低。n
‑
溴代丁二酰亚胺(nbs)由于其反应条件温和、廉价等优点成为较受欢迎的溴化剂之一。其副产物琥珀酰亚胺也可以很容易的回收与再转化为nbs而重复利用。但使用nbs也存在一些缺陷如反应时间较长、对缺电子烯烃反应情况并不理想等。 2005年,j.s.yadav等人将可循环使用的离子液体作为反应介质,以n
‑
卤代丁二酰亚胺为卤源,将烯烃进行羟卤化反应,提高了选择性。但是有的离子液体价格昂贵,制备复杂,需要用到有机溶剂,并且还有副产物的生成,除此之外,离子液体制备时间较长,有的为24小时。在一些条件下形成溴代醇的时间也较长。2006年,prodeep phukan 等人对卤代醇的合成方法进行优化,报道了一种无需催化剂,以n,n
‑
二溴对甲苯磺酰胺(tsnbr2)为溴化剂,快速将烯烃合成β
‑
卤代醇的方法。除此之外,若将本发明生产的卤代醚化合物脱去β
‑
卤素又可形成各种醚类化合物。醚类化合物也是一种重要的化学中间体,并且具有更为广泛的应用。
4.目前,直接合成卤代醚类化合物的报道很少,也没有酶催化方法由烯烃一步法直
接转化为β
‑
卤代醚化合物的相关报道。因此,亟需一种该类化合物的合成的新思路与方法。
技术实现要素:
5.本发明的目的是提供一种由过氧化物酶催化制备β
‑
卤代醚和β
‑
卤代醇的方法。
6.本发明以廉价易得的环己烯、异戊烯、苯乙烯等各种结构相同或相似的烯烃与醇为原料,以过氧化物及卤盐为共底物,以水为溶剂、过氧化物酶为催化剂,一步法合成卤代醇或卤代醚类化合物。本发明中仅仅需省去醇供体,即可方便地合成β
‑
卤代醇,实现对目标产物的调控。本发明以过氧化物酶作为催化剂的环境友好、条件温和、操作简便的绿色合成方法,使用的过氧化物酶稳定性很好,可扩大反应,进行工业化生产。
7.本发明提供的一种由过氧化物酶催化制备β
‑
卤代醚和β
‑
卤代醇的方法,包括如下步骤:在缓冲液中加入过氧化氢、卤盐、式ⅲ所示的烯烃,最后加入过氧化物酶,反应,即得到式ⅰ所示的β
‑
卤代醇;
8.当上述反应体系中还加入式ⅳ所示的醇时,即得到式ⅱ所示的β
‑
卤代醚;
[0009][0010]
式ⅰ、式ⅱ、式ⅲ、式ⅳ中,r1为烷基、苯基、取代苯基、芳基或取代芳基;
[0011]
r2为氢、烷基、苯基、取代苯基、芳基或取代芳基;其中,还包括r1和r2连接为环烷基;
[0012]
r3为烷基、苯基、取代苯基、芳基或取代芳基。
[0013]
本发明中,式ⅰ、式ⅱ、式ⅲ、式ⅳ中,r1具体可为碳原子数为5~12的烷基; r2具体可为碳原子数为0~10的烷基;r3具体可为碳原子数为1
‑
10的烷基。
[0014]
本发明中,所述烯烃具体可选自环己烯、1
‑
戊烯和苯乙烯中的至少一种。
[0015]
本发明中,所述取代苯基、芳基或取代芳基具体可为本领域常见的基团,所述芳基具体可为萘基。
[0016]
本发明中,所述式ⅰ所示的β
‑
卤代醇的结构式具体如下所示:
[0017][0018]
所述式ⅱ所示的β
‑
卤代醚的结构式具体如下所示:
[0019][0020]
上述的方法中,所述过氧化物酶可选自以下(1)
‑
(20)中至少一种:
[0021]
(1)来源于curvularia inaequalis的钒依赖性氯过氧化物酶civcpo;
[0022]
(2)来源于leptoxyphium fumago的卤代过氧化物酶lfucpo;
[0023]
(3)来源于caldariomyces fumago的卤代过氧化物酶cfcpo;
[0024]
(4)来源于corallina piltllifera的钒依赖性溴过氧化物酶cpvbpo;
[0025]
(5)来源于ascophyllum nodosum的钒依赖性氯过氧化物酶anvbpo;
[0026]
(6)来源于agrocybe aegerita的过氧化酶aaeupo;
[0027]
(7)来源于chaetomium globosum的过氧化酶cglupo;
[0028]
(8)来源于marasmius rotula的过氧化酶mroupo;
[0029]
(9)来源于marasmius wettsteinii的过氧化酶mweupo;
[0030]
(10)来源于coprinopsis cinerea的过氧化酶cciupo;
[0031]
(11)来源于collariella virescens的过氧化酶cvupo;
[0032]
(12)来源于myceliophthora fergusii的过氧化酶mfeupo;
[0033]
(13)来源于myceliophthora hinnulea的过氧化酶mhiupo;
[0034]
(14)来源于myceliophthora thermophila的过氧化酶mthupo;
[0035]
(15)来源于thielavia terrestris的过氧化酶tteupo;
[0036]
(16)来源于humicola insolens的过氧化酶hinupo;
[0037]
(17)来源于coprinus verticillatus的过氧化酶cveupo;
[0038]
(18)来源于coprinellus radians的过氧化酶craupo;
[0039]
(19)来源于marasmius rotula的过氧化酶mroupo;
[0040]
(20)来源于psathyrella aberdarensis的过氧化酶pabupo。
[0041]
上述的方法中,所述过氧化物酶或过氧化酶均以全细胞、粗酶粉、粗酶液或者纯酶的形式发挥催化作用。
[0042]
上述的方法中,所述过氧化物酶的浓度可为50~2000nm(其酶活力可为0.02~04 u/ml,1u为室温下,在1分钟内能转化1微摩尔底物所需的酶量),具体可为500nm、 50~500nm、500~2000nm、100~1000nm或50~1500nm。
[0043]
上述的方法中,所述醇具体自甲醇、乙醇、异丙醇、异戊醇、环己醇、苯甲醇或苯乙醇中的至少一种;
[0044]
所述醇的体积占所述反应的体系总体积量的5~50%;具体可为10%、30%、50%、 10~30%、30~50%或10~50%。
[0045]
上述的方法中,所述卤代盐选自溴化钾、氯化钾、溴化钠、氯化钠、碘化钠和碘化钾中的至少一种;
[0046]
所述反应的体系中,所述卤代盐浓度可为50~200mm;具体可为50mm、75mm、 100mm、150mm或50~150mm。
[0047]
上述的方法中,所述反应温度可为15~60℃,具体可为30℃、15~30℃、30~60℃、 20~40℃或25~45℃;
[0048]
所述反应时间可为1~24h,具体可为9h、1~9h、9~24h、5~15h或5~20h。
[0049]
上述的方法中,所述缓冲液选自柠檬酸盐缓冲液、磷酸盐缓冲液和heps缓冲液中的至少一种;
[0050]
所述缓冲液的ph可为3.5~7.5,具体可为6、3.5~6、6~7.5或5~7。
[0051]
上述的方法中,所述过氧化物为过氧化氢或有机过氧化物;
[0052]
所述反应的体系中,所述过氧化物浓度可为50~200mm,具体可为100mm、 50~100mm、100~200mm或70~150mm,具体采用质量浓度为10~30%过氧化物(一个具体例子中采用质量分数为30%的过氧化氢溶液)加入体系中。
[0053]
上述的方法中,所述有机过氧化物具体选自过氧化叔丁醇、四氢呋喃过氧化物、过氧化苯甲酰、乙二醇二甲醚过氧化物、过氧化甲乙酮、过氧乙酰硝酸酯、三过氧化三丙酮、双环氧乙烷及其衍生物、乙醚过氧化物、过氧乙酸和过氧化氢异丙苯中的至少一种。
[0054]
上述的方法中,所述反应的后处理如下:所述反应后体系经萃取后取有机相,然后干燥后除去有机溶剂,最后经柱层析洗脱得到纯化的β
‑
卤代醚或β
‑
卤代醇化合物;
[0055]
所述萃取采用的所述有机溶剂具体为乙酸乙酯;
[0056]
所述干燥具体采用无水硫酸钠或无水硫酸镁进行;
[0057]
所述柱层析洗脱剂具体为含体积百分含量1%~3%乙酸乙酯的石油醚。
[0058]
本发明具有以下优点:
[0059]
本发明原料简单易得,反应条件温和,操作简便,所使用的溶剂为水,与常规的有机溶剂相比,更绿色环保。过氧化氢在反应体系中也最终转化为水,以酶为催化剂,不会对环境造成任何危害。与直接加入次卤酸相比,原位生成次卤酸的形式不仅增加了反应活性,也减小对环境的污染。最后,与其他氧化酶相比,过氧化物酶或过氧化酶的稳定性更好,更能耐受有机溶剂,更利于工业化的大规模生产。
附图说明
[0060][0061]
图1为本发明制备β
‑
卤代醚化合物的反应通式。
[0062]
图2为本发明制备β
‑
卤代醇化合物的反应通式。
[0063]
图3为本发明制备(2
‑
溴
‑1‑
丙氧基乙基)苯的核磁共振氢谱。
[0064]
图4为本发明制备(2
‑
溴
‑1‑
丙氧基乙基)苯的核磁共振碳谱。
[0065]
图5为本发明制备(2
‑
溴
‑1‑
异丙氧基乙基)苯的核磁共振氢谱。
[0066]
图6为本发明制备(2
‑
溴
‑1‑
异丙氧基乙基)苯的核磁共振碳谱。
[0067]
图7为本发明制备2
‑
(2
‑
溴
‑1‑
丙氧基乙基)萘的核磁共振氢谱。
[0068]
图8为本发明制备2
‑
(2
‑
溴
‑1‑
丙氧基乙基)萘的核磁共振碳谱。
[0069]
图9为本发明制备1
‑
(2
‑
溴
‑1‑
丙氧基乙基)
‑2‑
甲氧基苯的核磁共振氢谱。
[0070]
图10为本发明制备1
‑
(2
‑
溴
‑1‑
丙氧基乙基)
‑2‑
甲氧基苯的核磁共振碳谱。
[0071]
图11为本发明制备(2
‑
溴
‑1‑
丙氧基乙基)苯的核磁共振氢谱。
[0072]
图12为本发明制备(2
‑
溴
‑1‑
丙氧基乙基)苯的核磁共振碳谱。
[0073]
图13为本发明制备1
‑
(2
‑
溴
‑1‑
(叔丁氧基)乙基)
‑4‑
甲氧基苯的核磁共振氢谱。
[0074]
图14为本发明制备1
‑
(2
‑
溴
‑1‑
(叔丁氧基)乙基)
‑4‑
甲氧基苯的核磁共振碳谱。
[0075]
图15为本发明制备(2
‑
溴
‑3‑
氯
‑1‑
丙氧基丙基)苯的核磁共振氢谱。
[0076]
图16为本发明制备(2
‑
溴
‑3‑
氯
‑1‑
丙氧基丙基)苯的核磁共振碳谱。
[0077]
图17为本发明制备1
‑
(2
‑
氯
‑1‑
乙氧基乙基)
‑4‑
甲氧基苯的核磁共振氢谱。
[0078]
图18为本发明制备1
‑
(2
‑
氯
‑1‑
乙氧基乙基)
‑4‑
甲氧基苯的核磁共振碳谱。
具体实施方式
[0079]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0080]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0081]
下述实施例中vcpo酶,来源于curvularia inaequalis的钒依赖性氯过氧化物酶vcpo,具体制备方法如下:
[0082]
37℃条件下,在补充有100μg/ml氨苄青霉素的lb培养基中将将2l大肠杆菌转化体培养至od
600nm
为0.6~0.8。然后将发酵液冷却至20℃,添加0.02%l阿拉伯糖后诱导蛋白质表达,孵育72小时。以8000rpm离心(温度为4℃)10分钟收获细胞。将细胞重悬,然后溶于ph为8.1的tris/h2so4缓冲液中。破碎细胞,以15000 rpm离心1小时去除碎片。离心后,向上清液中加入等体积的异丙醇。离心(15000rpm 30分钟)后,将澄清的上清液加到deae sephacel柱上。用2倍体积tris/h2so4和2 倍体积nacl的tris/h2so4(ph=8.1)洗涤柱子,然后用tris/hcl中的nacl洗脱酶。最后,将纯脱辅基酶在tris h2so4(ph 8.1)中对100μm原钒酸盐进行透析,以获得全酶,即vcpo酶。
[0083]
下述实施例中upo酶的制备方法如下:
[0084]
含有raaeupo的巴斯德毕赤酵母细胞培养液通过在4℃下以8000rpm离心2小时至澄清。上清液通过20μm过滤器过滤并保持在
‑
80℃。raaeupo活性通过在ph 5.0 的napi缓冲液中使用abts测定法测定;
[0085]
蛋白质纯化:将上清液浓缩并用100mm磷酸钠,ph 7进行透析。使用ngc色谱系统(biorad)一步纯化aaeupo。分离在q sepharose ff 30
‑
ml小柱上进行,流速为5ml/min。90ml后,保留的蛋白质用450ml中的0~50%nacl梯度洗脱,然后是50ml中的50~100%梯度和75ml中的100%nacl过氧化物酶活性之后是在h2o2存在下的abts氧化,将合适的部分合并、浓缩并用100mm磷酸钠缓冲液(ph 7)进行透析。raaeupo的纯化通过十二烷基硫酸钠(sds)
‑
page在12%凝胶中用考马斯亮蓝r
‑
250(sigma)染色证实。
[0086]
实施例1、化合物1
‑
溴
‑2‑
乙氧基环己烷的制备:
[0087][0088]
在100ml反应瓶中,加入31.5ml ph=6的磷酸盐缓冲溶液(磷酸二氢钠100 mm),将
无水乙醇(13.5ml)加入到上述缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g 溴化钾以及0.820g环己烯,最后加入150μl vcpo酶(原料酶浓度为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢 (浓度为5.38mol/l,反应体系中浓度为100mm)以及0.820g环己烯,共补加三次。分开批加入以保证酶的最大催化活性。
[0089]
上述反应体系于30℃条件下搅拌反应约9h,反应结束后,加入100ml乙酸乙酯萃取,萃取两次,合并有机相,有机相于30~40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物1
‑
溴
‑2‑
乙氧基环己烷(产率42%,纯度98%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0090]
实施例2、化合物(2
‑
溴
‑1‑
丙氧基乙基)苯的制备:
[0091][0092]
在100ml反应瓶中,加入31.5ml磷酸盐缓冲溶液(与上述相同ph=6),再加入13.5ml无水乙醇溶于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.16g 苯乙烯,最后加入150μl vcpo酶(与上述酶浓度相同为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢(浓度为5.38 mol/l)以及0.16g苯乙烯,共三次。
[0093]
上述反应体系于30℃水浴锅中磁子搅拌反应9h后,结束反应,加入100ml乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物(2
‑
溴
‑1‑
丙氧基乙基)苯(产率48%,纯度99%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0094]
由图3、4可知,其结构正确。
[0095]
实施例3、化合物1
‑
溴戊烷
‑2‑
醇的制备:
[0096][0097]
在100ml反应瓶中,加入31.5ml磷酸盐缓冲溶液(与上述相同ph=6),然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.11g 1
‑
戊烯,最后加入150μl vcpo酶(与上述酶浓度相同为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59 g溴化钾、0.93ml过氧化氢(5.38m)以及0.105g 1
‑
戊烯,共补加三次。
[0098]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物1
‑
溴戊烷
‑2‑
醇(产率82%,纯度98%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0099]
实施例4、化合物(2
‑
溴
‑1‑
异丙氧基乙基)苯的制备:
[0100][0101]
在100ml反应瓶中,加入31.5ml柠檬酸盐缓冲溶液(ph=5,柠檬酸100mm),再加入13.5ml异丙醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.16g 苯乙烯,最后加入150μl vcpo酶(与上述酶浓度相同为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢(5.38m)以及0.16g苯乙烯,共补加三次。
[0102]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物(2
‑
溴
‑1‑
异丙氧基乙基)苯(产率53%,纯度98%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0103]
由图6、5可知,其结构正确。
[0104]
实施例5、化合物2
‑
(2
‑
溴
‑1‑
丙氧基乙基)萘的制备:
[0105][0106]
在100ml反应瓶中,加入31.5ml柠檬酸盐缓冲溶液(ph=5,柠檬酸100mm),再加入13.5ml丙醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.23g 2
‑ꢀ
乙烯基萘,最后加入150μl vcpo酶(与上述酶浓度相同为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢(5.38m) 以及0.23g 2
‑
乙烯基萘,共补加三次。
[0107]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物2
‑
(2
‑
溴
‑1‑
丙氧基乙基)萘(产率49%,纯度99%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0108]
由图7、8可知,其结构正确。
[0109]
实施例6、化合物1
‑
(2
‑
溴
‑1‑
丙氧基乙基)
‑2‑
甲氧基苯的制备:
[0110][0111]
在100ml反应瓶中,加入31.5ml磷酸盐缓冲溶液(ph=6,磷酸二氢钠100mm),再加入13.5ml丙醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.20g 2
‑ꢀ
甲氧基苯乙烯,最后加入1ml upo酶(原酶浓度相同为2mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢(5.38m)以及 0.20g 2
‑
甲氧基苯乙烯,共补加三次。
[0112]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙
酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物1
‑
(2
‑
溴
‑1‑
丙氧基乙基)
‑2‑
甲氧基苯(产率56%,纯度98%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0113]
由图9、10可知,其结构正确。
[0114]
实施例7、化合物(2
‑
溴
‑1‑
丙氧基乙基)苯的制备:
[0115][0116]
在100ml反应瓶中,加入31.5ml柠檬酸盐缓冲溶液(ph=5,柠檬酸100mm),再加入13.5ml丙醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.18g反
ꢀ‑
β
‑
甲基苯乙烯,最后加入1ml upo酶(与上述酶浓度相同为2mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢(5.38m) 以及0.18g反
‑
β
‑
甲基苯乙烯,共补加三次。
[0117]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物(2
‑
溴
‑1‑
丙氧基乙基)苯(产率43%,纯度99%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0118]
由图11、12可知,其结构正确。
[0119]
实施例8、化合物1
‑
(2
‑
溴
‑1‑
(叔丁氧基)乙基)
‑4‑
甲氧基苯的制备:
[0120][0121]
在100ml反应瓶中,加入31.5ml磷酸盐缓冲溶液(ph=6,磷酸二氢钠100mm),再加入13.5ml叔丁醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.20g 对甲氧基苯乙烯,最后加入150μl vcpo酶(与上述实施例中酶浓度相同为13.5 mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml 过氧化氢(5.38m)以及0.20g对甲氧基苯乙烯,共补加三次。
[0122]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物1
‑
(2
‑
溴
‑1‑
(叔丁氧基)乙基)
‑4‑
甲氧基苯(产率49%,纯度 99%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0123]
由图13、14可知,其结构正确。
[0124]
实施例9、化合物(2
‑
溴
‑3‑
氯
‑1‑
丙氧基丙基)苯的制备:
[0125][0126]
在100ml反应瓶中,加入31.5ml磷酸盐缓冲溶液(ph=6,磷酸二氢钠100mm),再加入13.5ml丙醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.23g肉桂基氯,最后加入150μl vcpo酶(与上述实施例中酶浓度相同为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢(5.38 m)以及0.23g肉桂基氯,共补加三次。
[0127]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物(2
‑
溴
‑3‑
氯
‑1‑
丙氧基丙基)苯(产率47%,纯度99%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0128]
由图15、16可知,其结构正确。
[0129]
实施例10、化合物1
‑
(2
‑
氯
‑1‑
乙氧基乙基)
‑4‑
甲氧基苯的制备:
[0130][0131]
在100ml反应瓶中,加入31.5ml磷酸盐缓冲溶液(ph=6,磷酸二氢钠100mm),再加入13.5ml乙醇于缓冲溶液中,然后依次加入0.93ml质量分数为30%的过氧化氢溶液(浓度为5.38mol/l,反应体系中浓度为100mm),0.59g溴化钾以及0.20g对甲氧基苯乙烯,最后加入150μl vcpo酶(与上述实施例中酶浓度相同为13.5mg/ml,反应体系中酶浓度为500nm)。反应约3小时后补加0.59g溴化钾、0.93ml过氧化氢 (5.38m)以及0.20g对甲氧基苯乙烯,共补加三次。
[0132]
上述反应体系于30℃水浴锅中,磁子搅拌反应9h后,结束反应,加入100ml 乙酸乙酯萃取,共两次,合并有机相,有机相于30
‑
40℃下减压蒸馏除去有机溶剂。最后柱层析得到目标化合物1
‑
(2
‑
氯
‑1‑
乙氧基乙基)
‑4‑
甲氧基苯(产率45%,纯度99%),其中洗脱剂为乙酸乙酯
‑
石油醚混合液,其中乙酸乙酯的体积百分含量为1~3%。
[0133]
由图17、18可知,其结构正确。
[0134]
对比例、
[0135]
化学方法制备:
[0136]
以次氯酸代替过氧化氢、溴化钾、vcpo酶化学法制备,反应方程式如下:
[0137][0138]
在0.63ml水中加入0.27ml丙醇,然后加入16.85μl苯乙烯储备液(0.1854g 苯乙烯
溶于1ml乙腈中),80μl次氯酸钠溶液(0.5mol/l),摇床800r条件下反应 5h。
[0139]
后处理:取200μl反应液,用0.4ml带有十二烷内标的乙酸乙酯萃取,吸取有机层,经无水硫酸钠干燥后,用气相色谱监测反应情况。
[0140]
根据气相色谱结果显示,对比例中仅观察到微量产物生成,没有达到分离出纯品化合物的浓度,无法分离。化学法制备该类化合物中使用的次氯酸钠溶液很容易分解,反应失败率很高,而酶法制备中原位生成次卤酸根,反应更易进行。
[0141]
由上述实验结果可知,对比例中化学法制备该类化合物中使用的次氯酸钠溶液很容易分解,反应失败率很高,而本发明酶法制备中原位生成次卤酸根,反应更易进行。
[0142]
以上所述,实施案例仅为本发明较好的实施方式,本领域的技术人员应当理解的是,实施示例并不是范例性的,不对本发明的保护范围构成任何限制。任何熟悉本技术领域的技术人员在本发明所提出的的技术范围内,根据本发明的技术方案及其发明构思,在其细节或者形式的做出等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。