本发明涉及用于析氢反应(her)的催化剂和在水分解工艺中使用该催化剂的方法。本发明还提供了包含该催化剂的组合物、材料和电极。
背景技术:
水分解工艺被认为是一种可持续制氢和储氢的方法,因为它们可以利用大量的可用水和低碳密集型能源,例如可再生能源(例如太阳能)作为输入。水分解可以在电解器进行,通过析氢反应(her)在阴极产生氢气。氧气可以通过析氧反应(oer)在阳极产生。当前的重点是制备用于析氢的催化剂,因为氢气更容易用作多种应用的燃料,如燃料电池。
pt基催化剂(例如pt/c)由于在析氢开始时极低的超电势(η)和大的电流密度(j),目前是水电解器中阴极材料的主要选择。然而,pt基her催化剂价格昂贵且供应不可持续,因此不适合大规模应用。
当前的工作集中在开发基于富含于地球的金属的水分解催化剂。富含于地球的金属不包括re、ru、os、rh、ir、pd、pt、ag和au。
已经表明镍阴极能有效地催化her。然而,镍阴极由于形成钝化阴极层而具有不稳定性。一些报告表明,电解液中包含钒氧化物(v2o5)可以阻止镍阴极的钝化。随着时间推移,在镍阴极的表面上会形成钒氧化物沉积物。
需要持续提供可替代的her催化剂。特别地,需要开发基于富含于地球的过渡金属的催化剂。
技术实现要素:
本发明至少部分基于以下发现:散布有钒物质的金属催化剂物质(例如,ni或co)的催化剂增加了金属催化剂材料的her催化活性。此外,还防止了金属催化剂物质的钝化。出人意料的是,本发明的掺钒催化剂在碱性和中性溶液中也表现出很强的her催化活性。
一方面,本发明提供了一种析氢反应(her)催化剂,包括:
·包含活性催化剂物质的催化金属物质,以及
·钒物质,
其中,催化金属物质和钒物质散布在her催化剂内。
在另一方面,本发明提供了一种催化材料,其包括本文所述的her催化剂和基材。
在另一方面,本发明提供了一种电极,其包括本文所述的导电基材和her催化剂。该her催化剂通常被涂覆(例如通过电沉积)到导电基材的表面上。
在另一方面,本发明提供了一种制备本文所述的her催化剂、本文所述的催化材料和/或本文所述的电极的方法,该方法包括将导电基材与包含金属催化剂物质源和钒物质源的溶液接触,并通过所述溶液在基材和对电极之间施加电压,以将金属催化剂物质和钒物质电沉积到所述导电基材的表面上。
在另一方面,本发明提供了一种从水中析氢的方法,该方法包括:提供包括至少两个电极和电解质溶液的电化学电池,使水与至少两个电极接触,以及在至少两个电极之间施加电压,其中,至少两个电极中的至少一个包括本文所述的her催化剂、本文所述的催化材料或本文所述的电极。
在另一方面,本发明提供了一种包括至少两个电极和电源的电解器,其中,所述至少两个电极中的至少一个包括本发明的her催化剂。
在详细描述本发明之前,应当理解,本发明不限于特别示例性的实施方式、生产或使用方法,其当然可以变化。
本文所描述和要求保护的发明具有许多属性和实施方式,包括但不限于在本发明内容部分阐述、描述或参考的那些,其并不旨在包括所有方面。本文所描述和要求保护的发明不限于或不受本发明内容部分中所标识的特征或实施方式的限制,其仅出于本发明内容部分说明而非限制的目的而被包括。
本文引用的所有出版物、专利和专利申请,无论是上文还是下文,均通过全文引用而并入本文。
应当理解,如果在本文中引用了任何现有技术出版物,则该引用并不意味着承认该出版物构成了本领域公知常识的一部分。
附图说明
将参考附图仅通过举例的方式进一步描述本申请,其中:
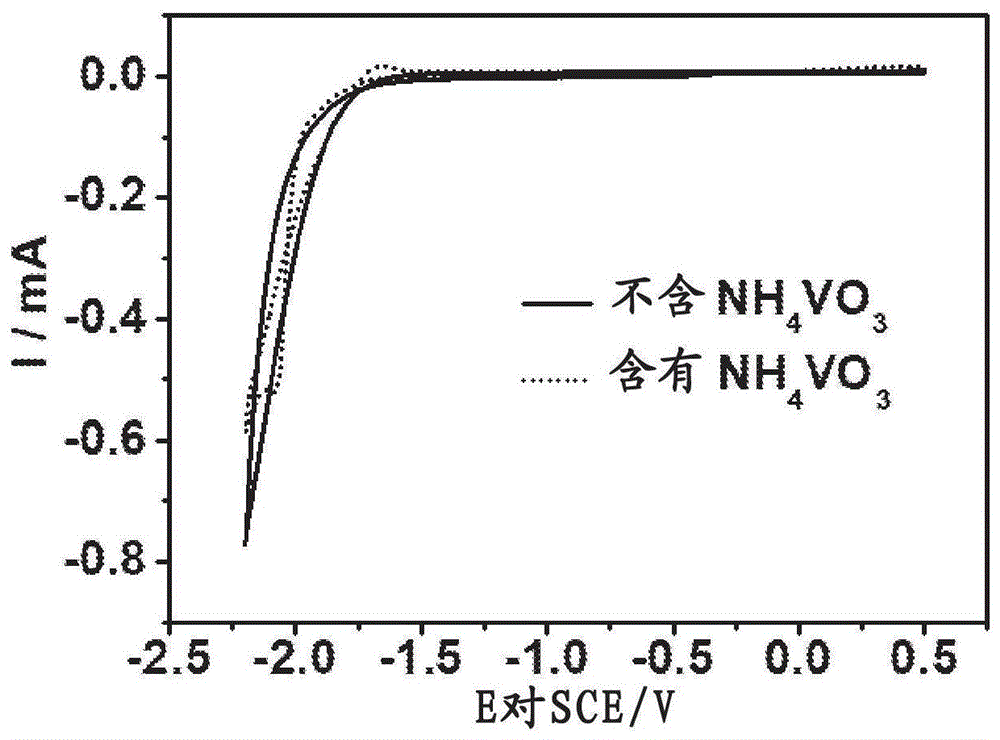
图1表示:浸入含有或不含偏钒酸铵的溶液中的掺氟氧化锡(fto)基材上的循环伏安曲线。
图2表示:在作为基材的掺氟氧化锡(fto)上,根据实施例1制备的各种her催化剂的一系列x射线衍射(xrd)衍射图。
图3表示:根据实施例1的一般方法用不同浓度的nh4vo3前体制备的nicuvox的一系列xrd衍射图。
图4a-h表示:(a)本发明的her催化剂的扫描电子显微镜(sem)图像;(b)所述her催化剂的透射电子显微镜(tem)图像;(c)所述her催化剂的高分辨率透射电子显微镜(hrtem)图像;(d)所述her催化剂的高角度环形暗场扫描透射电子显微镜(haadf-stem)图像;(e)-(h)所述her催化剂中存在的ni、cu、v和o原子的每一个her催化剂的能量色散x射线光谱(tem-eds)映射图像。
图5a-c表示:根据实施例1制备的(a)ni、(b)nicu、(c)nivox电极的sem图像。
图6表示:本发明的her催化剂的(a)ni2p、(b)cu2p、(c)v2p和(d)o1s的x射线光电子能谱(xps)光谱。
图7a-d表示:(a)在碱性(1mkoh,ph=14)条件下,本发明的her催化剂(nicuvox-测量值和内阻(ir)校正值-和nivox)与其非钒当量(nicu和ni)和pt/c催化剂相比的线性扫描伏安(lsv)曲线;(b)在碱性(1mkoh,ph=14)条件下本发明的her催化剂(nicuvox–测量值和内阻(ir)校正值-和nivox)与其非钒当量(nicu和ni)和pt/c催化剂相比较的塔菲尔图;(c)nicuvox的多电流曲线;(d)nicuvox和ni电极的计时电位曲线。
图8a和b表示:在1mkoh中,不同电沉积条件下获得的nicuvox的lsv曲线:(a)不同量的cu前体;和(b)不同的阳极氧化时间。
图9表示:在1mkoh中,电解质中含或不含nh4vo3的情况下nicuvox(实施例1)的lsv曲线。
图10a-d表示:(a)在1.0mph=7的磷酸盐缓冲溶液中未经ir补偿的nicuvox和对照样品的lsv曲线,黑色虚线是经过ir校正的nicuvox。(b)在1.0mph=7磷酸盐缓冲溶液中,电流密度为50macm-2时nicuvox的计时电位曲线;(c)中nicuvox的lsv曲线;(d)nicuvox在海水中的计时电位曲线。
图11表示:涂覆有铬氧化物的nicuvox电极的超电势与时间的关系,显示了稳定性和耐用性。
图12a和b表示:(a)在30wt%的koh电解质中,在80℃的温度下,与镍阴极(双电极电解)相比,nicuvox的多电流曲线;(b)nicuvox在电流密度为300macm-2时和中断10个循环电源(连续电解1小时,然后关闭电源0.5小时)的计时电位曲线。
图13a-e表示:(a)在计时电位实验中用作催化剂后nicuvox(实施例1)的tem图像(结果如图11b所示);以及(b)ni、(c)cu、(d)v和(e)o在用作催化剂一段时间后的tem-eds映射图像。
图14表示:nicuvox(实施例1)在用作催化剂前后延长的时间段的x射线衍射图。1mkoh电解质在各种扫描速率下的循环伏安法和电化学表面积的相关计算(a和b:nf;c和d:cofe/nf;e和f:cofecr/nf)。
图15a-d表示:(a)ni上的k边x射线吸收近边结构(xanes);(b)ni上的扩展x射线吸收精细结构(exafs);(c)v上的k边xanes;(d)cu上的k边xanes。
图16表示:在1mkoh中,沉积在泡沫镍(nf)、镍网和碳纤维纸(cfp)基材上的nicuvox(实施例1)的lsv曲线。
图17表示:本发明的her电极(nicuvox;实施例1)沉积在0.5cmx0.5cm基材与21cmx21cm基材的活性相比较的lsv曲线。
图18a和b表示:(a)本发明的her催化剂(co-v;实施例2)与co(实施例2)和pt/c(经ir校正)的lsv曲线;和(b)根据实施例2制备的co-v和co的塔菲尔斜率。
图19表示:在中性电解质中根据实施例2制备的co-v和co的lsv曲线。
术语
如本文所用,术语“水分解”涉及从水作为起始材料生成元素氢或氧的任何工艺。本文所述的水分解工艺本质上是电解的。这些电解工艺通常包括阴极的析氢反应(her)和阳极的析氧反应(oer)。
如本文和所附权利要求书所使用的,除非上下文另有明确规定,否则单数形式“一(a)”、“一(an)”和“该(the)”包括复数引用。因此,例如,对“(一)表面”的引用可以包括多个表面,或者可以是对一个或多个表面的引用,等等。
除非另有定义,否则本文中使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常理解的含义相同。应当理解,可以使用与本文所描述的材料和方法类似或等效的任何材料和方法来实践或测试本发明;描述了各种材料和方法的最知名的实施方式。
名词后面的“(s)”一词指的是单数形式或复数形式,或两者兼有。
术语“和/或”可指“和”或“或”。
除非上下文另有要求,否则本文所述的所有百分比均为材料重量百分比。
参考特定值或值的范围描述了本发明的各种特征。所述值旨在与各种适当测量技术的结果相关,因此应解释为包括任何特定测量技术中固有的误差范围。本文所述的一些值由术语“约”表示,至少部分地考虑了该可变性。当用于描述值时,术语“约”可以表示该值的±25%,±10%,±5%,±1%或±0.1%以内的量。
在本说明书中使用的术语“包括(comprising)”(或诸如“包括(comprise)”或“包括(comprises)”的变体),除非上下文由于表达语言或必要的暗示而另外要求,否则以包括性含义使用,即,在本发明的各个实施方式中,指定存在所述特征,但不排除其他特征的存在或增加。
具体实施方式
本发明提供了包含催化金属物质和钒物质的析氢反应(her)催化剂,其中催化金属物质和钒物质散布在该催化剂内。
令人惊讶的是,散布的钒和金属催化剂物质改善了材料的her催化活性。此外,即使在延长的电解条件下,her催化剂在碱性和中性电解质中也表现稳定。本发明的her催化剂可有利地提供低成本和高活性的阴极材料,用于工业规模的水分解。
金属催化剂物质和钒物质散布在her催化剂中。在一些实施方式中,金属催化剂物质和钒物质包含在颗粒内。在一些实施方式中,在整个her催化剂中金属催化剂物质和钒物质的分布基本上均匀。所述her催化剂中所含各种原子的分布和/或分配可通过tem-eds图谱确定。例如,在实施例1中描述的本发明的一个实施方式中,所述实施方式包括作为金属催化剂物质的镍和铜合金以及作为钒物质的钒氧化物,镍、铜、钒和氧原子基本上均匀地散布在整个催化剂中。
关于钒对镍催化剂的预防作用的早期报告描述了在阴极表面形成钒沉积物。然而,在本发明中,钒物质和金属催化剂物质散布在her催化剂中。钒物质和金属催化剂物质的散布,不仅可以阻止催化金属物质的钝化,而且可以提高其催化活性。所述催化剂活性的增加表现为相关的超电势降低,以达到所需的电流密度。
相对于可逆氢电极(rhe),用于电极电解水的理论电势为1.23v。通过给定电极驱动水电解所需的超过该理论极限的任何过量电势称为超电势(η)。相对于rhe,本发明的her催化剂需要极低的超电势。
在一些实施方式中,为了使本发明的her催化剂提供10macm-2的电流密度,需要约5mv至约50mv,例如约5mv至约30mv,或约8mv至约30mv的超电势。在碱性条件下,本发明的her催化剂相对于rhe的超电势可以为约5mv至约14mv,以提供10macm-2的电流密度。在中性条件下,本发明的her催化剂相对于rhe提供10macm-2的电流密度的超电势可以为约10mv至约50mv,例如,约15mv至约40mv或约20mv至约35mv。相比之下,对于现有的商用pt/c(20%)电极,实现10macm-2的电流密度所需的超电势约为5mv至20mv。
在一些实施方式中,为了提供100macm-2的电流密度本发明的her催化剂需要约15mv至约200mv,例如约20mv至约150mv或约30mv至约140mv的超电势。在碱性条件下,本发明的her催化剂相对于rhe的超电势可以为约15mv至约100mv,以提供100macm-2的电流密度,例如,约15mv至约44mv,或约25mv至约4mv,或约35mv至约44mv。在中性条件下,相对于rhe,本发明的her催化剂提供100macm-2的电流密度的超电势可以为约50mv至约200mv,例如,约50mv至约180mv或约100mv至约150mv。相比之下,对于现有的商用pt/c(20%)电极,实现100macm-2的电流密度所需的超电势约为10mv至50mv。
所述her催化剂包含催化金属物质。所述催化金属物质包括活性催化剂物质。任何能够催化her的金属物质都可以用作活性催化剂物质。在一些实施方式中,催化金属物质由活性催化剂物质组成。
在一些实施方式中,活性催化剂物质是过渡金属物质,优选第一行过渡金属。所述活性催化剂物质可以是富含于地球的金属物质,例如能够催化her的除了re、ru、os、rh、ir、pd、pt、ag和au以外的任何金属物质。
在具体的实施方式中,活性催化剂物质选自镍(ni)和钴(co)。镍和/或钴可以与不会显著降低her催化剂的催化活性的任何其他金属物质形成合金。
通常,活性催化剂物质为金属形式。因此,所述活性催化剂物质的氧化态通常为零。然而,在一些实施方式中,所述活性催化剂物质可以以非金属形式包括,如氧化物、硫化物或盐的形式。
催化金属物质通常以结晶形式提供。所述结晶金属的刚性、有组织的结构被认为进一步增强了her催化剂的催化活性。优选具有高比表面积的晶体形态,例如结晶纳米颗粒。
所述her催化剂还包括钒物质。可以使用能够阻止催化金属物质钝化的任何钒物质。
在一些实施方式中,钒物质是钒氧化物,例如钒(ii)氧化物(vo2)、五氧化二钒(v2o5)或vo1.95的水合物。
钒物质本身不能催化her。据信,her催化剂中钒物质的存在影响金属催化剂物质的性质和形态,以阻止其钝化并提高其催化活性。
所述her催化剂中钒物质与活性催化剂物质的摩尔比可不超过约20%。例如,钒物质与活性催化剂物质之摩尔比可不大于约15%、约12%、约10%、约8%、约7%、约6%、约5%、约4%、约3%、约2%、约1.7%或更小。存在于所述her催化剂中的钒物质的最小量可以是高于钒物质的检测限的任何量,例如通过电感耦合等离子体光发射光谱(icp-oes)。在一些实施方式中,钒物质与活性催化剂物质的摩尔比可至少约为0.1%。例如,钒物质与活性催化剂物质的最小摩尔比可为至少约0.5%、约1%、约1.5%或约2%。钒物质与活性催化剂物质的摩尔比可以从这些最小量中的任何一个到上述摩尔比中的任何一个,例如,0.1%至20%、1.5%至12%或2%至10%。
在一些实施方式中,金属催化剂物质还包括金属改性剂。在不希望被理论束缚的情况下,据信:金属催化剂物质内金属改性剂的加入影响了活性催化剂物质的金属特性。在理想情况下,活性催化剂物质会具有平衡其对水反应物和氢反应产物的相对结合亲和力的金属特性。对her产物的结合亲和力过高导致较低的催化活性。因此,金属改性剂的加入可能有助于优化金属催化剂物质内的活性催化物质的金属特性。在一些实施方式中,金属改性剂可以是通常而言与活性催化剂物质相比电负性相等或更低的金属物质。因此,金属改性剂的精确选择取决于所选择的活性催化剂物质。例如,当活性催化剂物质包括镍或钴时,金属改性剂可以选自铜、铁和/或锰物质。
所述金属改性剂可以以任何形式存在于her催化剂中,使其能够作为活性催化剂物质的金属改性剂。通常,金属改性剂可以是金属的形式(例如,具有活性催化剂物质的合金)。
在一些实施方式中,所述金属催化剂物质包括活性催化剂物质和金属改性剂的合金。所述合金可能具有结晶形态。
所述金属改性剂与活性催化剂物质的摩尔比不得超过约25%。例如,金属改性剂与活性催化剂物质之摩尔比可不大于约24%、约23%、约22%、约21%、约20%、约19%、约18%、约17%、约16%、约15%、约14%、约13%、约12%、约11%或约10.5%。在包含金属改性剂的实施方式中,金属改性剂与活性催化剂物质的最小摩尔比可为至少约0.1%,例如,至少约0.5%、1%或5%。所述金属改性剂与活性催化剂物质的摩尔比可以从这些最小量中的任何一种到上述摩尔比中的任何一种,例如,0.1%至25%、1%至20%或10%至17%。
在一些实施方式中,所述金属催化剂物质包括镍、镍铜合金或钴。
在一些实施方式中,所述金属催化剂物质和钒物质呈颗粒形式。因此,在一些实施方式中,her催化剂包括:包含散布有钒物质的金属催化剂物质的颗粒。通常,颗粒将采用有序排列。
所述颗粒的形状取决于制造方法和组成成分的化学性质。因此,颗粒的形状不受限制。例如,当金属催化剂物质包括镍和铜合金以及钒氧化物时,该颗粒是球形的。
所述颗粒可以是非晶形、半晶形和/或晶形。在一些实施方式中,所述颗粒包括结晶部分和非晶部分。例如,金属催化剂物质可为晶态,而钒物质可在相同颗粒内为非晶态。在一些实施方式中,纳米晶体的平均直径为约0.1nm至约15nm,例如约0.1nm至约12nm或约0.5nm至约10nm。粒径越小,比表面积越大。在电解过程中,较大的表面积增加了水与活性催化剂物质的接触。
在一些实施方式中,her催化剂可包括涂层,以提高催化剂的长期稳定性和耐久性,特别是当催化剂将在碱性溶液中长期使用时。合适的涂层包括金属氧化物,例如铬氧化物(cro)。在某些情况下,可以使用涂层来最小化或减少在碱性条件下可能随时间发生的钒物质的溶解。
所述her催化剂中存在的每种物质的浓度可通过电感耦合等离子体发射光谱法(icp-oes)测定。
还提供了包含本文所述的her催化剂的催化材料。所述催化材料通常还包括基材。可以使用不干扰her催化剂的her催化活性的任何合适的基材。合适的基材包括导电的金属基材(例如金属基材,如泡沫金属或金属网或掺氟氧化锡(fto))和导电的非金属基材(例如碳纤维纸基材)。合适的泡沫金属包括泡沫镍和泡沫铜。合适的金属网包括镍网。
还提供了包括her催化剂和导电基材的电极。可以使用包括上述那些在内的不干扰her催化剂的her催化活性的任何导电基材。
制备方法
her催化剂和包含其的材料可以通过本领域已知的任何方法来制备,只要将钒物质散布在金属催化剂物质中即可。
在一些实施方式中,本发明的催化材料和/或电极可以通过简单的电沉积工艺来制备。
因此,本文描述了一种制备her催化剂的方法,所述her催化剂包含散布在导电基材上的金属催化剂物质的钒物质,所述方法包括在与导电基材接触的溶液中电解包含金属催化剂物质源和钒物质源的溶液。通常,溶液是水溶液。
所述方法通常包括使导电基材与包含钒盐和金属催化剂物质的盐形式的溶液接触,并通过该溶液在导电基材和对电极之间施加第一电压以电沉积钒物质和金属。所述催化剂物质在基材上的散布,使得钒物质散布在金属催化剂物质中。在一些实施方式中,该方法在三电极系统中进行,所述三电极系统包括工作电极,其包括导电基材、对电极和参比电极,并通过溶液在工作电极和参比电极之间施加第一电压以将金属催化剂物质和钒物质电沉积到导电基材的表面上。在其他实施方式中,使用包括导电基材的阳极和阴极的两电极系统来执行该方法,并通过该溶液将第一电压施加阳极和阴极,以将金属催化剂物质和钒物质电沉积到导电基材的表面。
所述第一电压约为-10v至-0.5v。第一电压可维持一段时间,足以在基材上电沉积一层催化剂。在一些实施方式中,第一电压维持从1分钟到约1小时的时段,例如,从约1分钟到约30分钟、约2分钟到约15分钟或约10分钟。电沉积可在室温下进行。如本文所用,室温是指约20℃到约30℃,优选约25℃的环境温度。
在这些制备方法中,金属催化剂物质的盐形式可以包括活性催化剂物质的盐和可选地金属改性剂的前体,例如金属改性剂的盐形式。因此,当金属催化剂物质包含镍作为活性催化剂物质时,溶液可包含镍盐。类似地,当金属催化剂物质包含钴作为活性催化剂物质时,溶液可包含钴盐。可以使用能够电还原的任何盐形式的活性催化剂物质。优选地,所述盐选自硝酸盐、氯化物和硫酸盐或其组合。
所述溶液可包含浓度不超过约1m的活性催化剂物质的盐(或“活性催化剂盐”)。例如,该溶液可包含浓度不超过约900mm、约800mm、约700mm、约600mm或约500mm的活性催化剂物质的盐。所述活性催化剂盐的最小浓度是在外加电压下,将足够的活性催化剂物质电沉积到基材上所需的浓度。因此,活性催化剂盐的最小浓度可为至少约10mm、约15mm、约50mm、约100mm、约200mm、约250mm、约400mm或约500mm。所述活性催化剂盐的浓度可以在这些最小浓度中的任何一个到本文所述的活性催化剂盐的任何其他浓度之间,例如从10mm至1m或400mm至600mm。
所述溶液可包含浓度不超过约100mm的金属改性剂的盐(或“金属改性剂盐”)。例如,溶液可以包含的金属改性剂盐的量不超过约80mm、约70mm、约60mm、约50mm、约40mm、约30mm或约20mm。当存在时,金属改性剂盐的最小浓度可以为约1mm或约5mm。金属改性剂盐的浓度可以在这些最小浓度中的任何一个到本文所述的金属改性剂盐的任何其他浓度之间,例如1mm至80mm或5mm至20mm。
可以通过在电沉积之前选择溶液中各个前体的适当浓度来控制her催化剂中金属改性剂与活性催化剂物质的摩尔比。在一些实施方式中,可通过进一步的电解步骤将金属改性剂选择性地从金属催化剂物质中去除。不希望受到理论的束缚,认为活性催化剂物质通过与钒物质和金属改性剂的相互作用而在电沉积材料中动力学稳定。另外,据信至少部分去除金属改性剂可进一步增加her催化剂的表面积,因为在水分解电解过程中选择性去除之前金属改性剂所占据的区域变得可与水接触。此外,据信,在复合物形成之后,通过去除金属改性剂,活性金属物质的金属特性没有受到显著影响。因此,在一些实施方式中,该方法包括通常通过在与溶液接触的整个导电基材上施加第二电压来从金属催化剂物质中选择性去除金属改性剂。所述第二电压可以是约0.4v至约1v,例如约0.6v的阳极电势。可以将第二电压维持足以去除期望量的金属改性剂的一段时间。所述第二电压可以维持约1分钟至约30分钟的时间,例如,约200秒至约600秒。电解选择性去除金属改性剂可以在室温下进行。
所述溶液包括钒物质的前体(或“钒前体”)。可使用任何可溶性钒源;但是,钒物质的前体通常是含钒盐,例如钒酸铵(nh4vo3)、钒氧化物(v2o5)或钒酸钠(navo3)。
所述溶液可包含浓度不超过约50mm、约40mm、约30mm、约25mm、约20mm、约15mm或约10mm的钒前体。所述钒前体的最小浓度可为至少约0.01mm、约0.1mm、约1mm或约2mm。所述钒前体的浓度可在这些最小浓度中的任何一个到本文所述的钒前体的任何其他浓度之间,例如约0.1mm至约50mm、约1mm至约25mm或约2mm至约15mm。可选择钒前体和活性金属催化剂盐的相对浓度以提供钒物质与活性催化剂物质的所需摩尔比。
所述溶液通常具有酸性ph(即ph小于7)。因此,该溶液可包含酸。酸的浓度可为约100mm至约1m,例如,约250mm至约750mm或约500mm。合适的酸包括硼酸(h3bo3)、盐酸(hcl)、硫酸(h2so4)、硝酸(hno3)和铵离子(例如nh4cl或nh4br)及其组合。
所述溶液可以进一步包含一种或多种电解质。合适的电解质包括盐,例如金属硝酸盐、金属硫酸盐和/或金属氯化物盐。通常,电解质盐的金属将对应于her催化剂中包含的一种或多种金属。电解质可以约1m的浓度存在。
在一些实施方式中,该方法进一步包括基材预处理步骤,其中用强酸(例如4mhcl)洗涤基材并超声处理。预处理步骤通常在电沉积her催化剂之前从基材表面去除氧化物和其他杂质。
在一些实施方式中,该方法还涉及在电解池中包括参比电极,并且参比电极也与溶液接触。合适的参比电极包括ag/agcl、参比氢电极、ag/ag2so4电极、calomel电极、hg/hg2so4电极和hg/hgo电极。在特定实施方式中,参比电极在使用时是ag/agcl电极。
导电基材可为掺氟氧化锡(fto)、不锈钢、泡沫金属(例如泡沫镍或泡沫铜)、金属网(例如镍网或铜网)或非金属导电基材(例如碳纤维纸(cfp)或碳布)。在电沉积之后,导电基材可具有约1mg/cm2到约50mg/cm2的her催化剂的质量负载。
在一些实施方式中,her催化剂可以涂覆有金属氧化物。例如,可以将在基材例如泡沫镍上制备的含nicuvox的电极浸入金属盐溶液中。从溶液中去除后,将电极真空干燥并在惰性气氛中在高温下退火,然后冷却。在一个实实施例中,通过将泡沫镍上的nicuvox电极浸入硫酸铬(iii)溶液(10ml,0.005m)中1分钟,用铬氧化物涂覆泡沫镍上的nicuvox电极。从溶液中取出电极,真空干燥并在ar气氛中于350℃退火2小时,升温速率为3℃/min。然后将电极冷却到环境温度。
使用方法
本发明提供了一种通过水分解工艺析氢的方法。该方法在包括至少两个电极和电解质溶液的电化学电池中进行,其中至少两个电极之一包含本发明的her催化剂。在一些实施方式中,电化学电池是包含阳极和包含本发明的her催化剂的阴极的2-电极系统。在其他实施方式中,电化学电池是3-电极系统,其包括包含本发明的her催化剂的工作电极、对电极和参比电极。该方法包括使水与电化学电池的至少两个电极接触,并通过电解质溶液在至少两个电极上施加电压。由于her半反应通常发生在2-电极系统的阴极或3-电极系统的工作电极上,因此该阴极或工作电极包含本发明的her催化剂。在一些实施方式中,电解质溶液是电解质水溶液。所述电解质水溶液也可以是水的来源。电解质溶液可具有约7或更大的ph,例如,约7至约14的ph。在一些实施方式中,当ph为碱性时,电解质溶液包含强碱,例如氢氧化物碱,如naoh或koh。电解质溶液还可以包含钒盐(例如nh4vo3),特别是当电解质溶液具有碱性ph时。电解质溶液中钒盐的浓度可高达约50mm,例如约0.2mm至约25mm。
通常,这些方法中使用的阳极将包含析氧反应(oer)催化剂,如ir/c或ruo2/c。
当在这些方法中使用时,本发明的her催化剂向本发明的领先的her催化剂提供改进的催化活性。出乎意料的是,所述her催化剂在使用富含于地球的金属的同时能够提供这种改进的催化作用。同样出乎意料的是,所述her催化剂能够提供改善的催化活性,并且与其他已知的富含于地球的金属基her催化剂,包括相应的基于ni或co的体系相比,需要较低的超电势。此外,本发明的her催化剂在中性和碱性电解条件下是出乎意料的稳定和活性的。
在一些实施方式中,析氢方法以高达50mvdec-1(例如,高达45mvdec-1、30mvdec-1或约25mvdec-1)的塔菲尔斜率进行。通常,her动力学模型表明,对于约120、40或30mvdec-1的塔菲尔斜率,volmer、heyrovsky或tafel反应将是决定速率的步骤。
应选择施加在阳极上的电压以匹配或超过her催化剂的超电势,从而驱动her。
还提供了一种电解器,其包括阳极和阴极、电源和可选的参比电极。通常,阴极包含本发明的her催化剂。在一些实施方式中,电源提供从低碳密集型电源产生的电。所述电源可以是可再生电源,例如一个或多个太阳能电池板或风力涡轮机,或不可再生电源,例如核反应堆。
实施例
本发明将通过非限制性实施例进行进一步描述。本发明领域的技术人员将理解,在不脱离本发明的精神和范围的情况下,可以进行许多修改。
实施例1–镍基催化剂
材料合成
nicuvox电极的制备。所有电沉积均在标准的三电极电化学装置中进行。通过以泡沫镍(nf)或氟掺氧化锡(fto)为工作电极,以石墨板为辅助电极,并且以饱和甘汞电极(sce)为参比电极,在泡沫镍(nf)或氟掺氧化锡(fto)基材上电沉积nicuvox催化剂。在沉积之前,首先在5mhcl溶液中超声处理泡沫镍20分钟以去除nio层,随后用水和乙醇冲洗,然后在空气中干燥。电沉积且选择性去合金化溶液由500mmniso4、8mm~32mmcuso4、8mmnh4vo3和500mmh3bo3组成。采用chi660d电化学工作站(ch仪)在室温下进行电沉积。首先,在-2.0v(相对于sce)下将nicuvox膜电沉积到nf表面600s。可选地,然后在室温下通过施加0.6v的阳极电位200s至600s选择性地溶解nicu膜中的cu。
vox和nivox电极的制备。以与nicuvox电极相同的方法制备vox和nivox电极。对于在fto上沉积vox,所有其他条件都相同,但8mmnh4vo3和500mmh3bo3的前体在-2.0v(相对于sce)下沉积到nf表面600s。对于nivox沉积,电解液包含500mmniso4、8mmnh4vo3和500mmh3bo3,并且在-2.0v(相对于sce)下沉积到nf或fto表面600s。
ni和nicu电极的制备。对于ni沉积,电解质包含500mmniso4和500mmh3bo3,并且在-2.0v(相对于sce)下沉积到nf或fto的表面600s。对于nicu沉积,电解质包含500mmniso4、16mmcuso4和500mmh3bo3,并且在-2.0v(相对于sce)下沉积到nf或fto的表面600s。
计时电位法实验
在三电极系统(nicuvox作为工作电极,石墨板作为参比电极,sce作为参比电极)中,在1mpbs中性溶液中保持50macm-2的恒定电流密度20h。该实验的结果示于图10b。
通过使用nicuvox作为阴极,商用镍作为阴极的双电极系统,在80℃的30wt%koh电解液中,通过将电流密度从10macm-2增加到500macm-2,进行了进一步的实验(结果示于图11a)。此外,使用相同设置的电池,通过先在300macm-2的电流密度下运行10小时,然后在300macm-2的相同电流密度下10个启动和关闭的循环,评估her催化剂的长期稳定性(图11b)。
表征技术
x射线衍射光谱法(xrd)。xrd测量是使用装有标准cu阳极、k-α波长=1.54nm的panalyticalx’pertempyrean仪器进行的。典型的扫描范围是10°~80°,以0.039°s-1的步长进行收集。
x射线光电子能谱(xps)。xps测量是使用thermoescalab250ix射线光电子能谱仪进行的,以确保结果的一致性,在4个不同点进行了扫描。
拉曼光谱法。拉曼光谱分析,使用配备有1800lmm-1的514(绿色)ar离子激光器的renishawinvia拉曼显微镜。所有拉曼样品都是负载在cfp上的催化剂。
透射电子显微镜(tem)。用菲利普斯cm200显微镜进行tem。为了制备tem样品,用锋利的刀对电极进行物理划伤,将泡沫镍(nf)负载的催化剂转移到cu栅上。用超声波将所得粉末分散在无水乙醇中15min。然后将所得混合物滴到cu栅上,并且室温下干燥。
高分辨率透射电子显微镜(hrtem)。用phillipscm200显微镜进行hrtem。为了制备hrtem样品,通过在无水乙醇中将样品从nf中超声处理15分钟,将nf负载的her催化剂转移到涂有多孔碳的cu栅上。然后将所得混合物滴铸到cu栅上,并在室温下干燥。
扫描电子显微镜。用jeolf7001以17kv的加速电压进行sem分析。
光学显微镜。显微镜图像是用nikoneclipselv100pol拍摄的。
x射线吸收近边结构(xanes)和扩展x射线吸收精细结构(exafs)。xanes和exafs被记录在澳大利亚同步加速器(australiansynchrotron)的多个wiggler-xas光束线12id上。
电感耦合等离子体光学发射光谱法(icp-oes)。通过在分析前将样品溶于10ml的王水酸溶液中,在perkinelmeroptima7300dv电感耦合等离子体发射光谱仪上进行icp-oes。
结果与讨论
循环伏安法和观察到的fto在电沉积前后的颜色变化证实了钒复合材料沉积的成功。如图1循环伏安图(cv)所示,无钒前体导致没有明显的氧化还原峰,表明没有发生电化学反应。然而,在钒离子存在的情况下,cv在-2.0v处出现明显的还原峰,这被认为是由于钒酸盐离子的还原所致(图1)。
通过沉积在fto上沉积的含钒材料(黑色)与在无钒情况下沉积在fto上的材料(灰银色)相比较的颜色差异证明了钒掺杂的镍和镍-铜合金材料的成功形成。
所制备电极的结构也通过x射线衍射(xrd)技术进行了表征。沉积在fto玻璃上的样品用于xrd研究,因为nf基材会对衍射图样产生干扰。如图2所示,ni和nicu电极的xrd图谱在2θ=44.44°、51.26°和76.35°处显示三个主要衍射峰,与面心立方镍(jcpds,no.70-0989)的(111)、(200)和(220)面非常匹配。至于nicu,除了ni的三个特征峰外,ni(111)、(200)和(220)峰的底部还出现了另外三个特征峰,表明ni和cu合金的形成。对于含钒的样品,xrd图谱在44.44°处仅出现一个小而宽的峰,表明在沉积过程中nh4vo3存在时形成了超细ni样纳米晶(ncs),根据scherrer方程计算出超细ncs的平均尺寸仅为~4.65nm,比纯镍的~26.79nm和nicu合金的~19.07nm小得多。电沉积过程中用于形成超细ni样ncs的v:ni前体的摩尔比仅为1.7%(即1.7:100摩尔nh4vo3:100摩尔niso4),表明钒对晶体演化的强烈影响(图3)。超细ncs被认为增加了催化剂结构中活性中心的暴露。为了进一步提供更多暴露的活性中心,使用上述阳极溶解工艺对铜进行选择性去合金化。使用电感耦合等离子体发射光谱(icp-oes)技术分析去合金化前后铜/镍比率从15.4%降至10.55%(见下表1),证实了部分铜去除。值得注意的是,催化剂中铜的存在在催化析氢反应时起着重要作用,这将在下文中讨论;然而,在部分去除的铜催化剂和去除铜之前的催化剂之间,没有观察到其催化作用的差异。部分去除的铜催化剂在本实施例中称为nicuvox。
表1:根据本实施例制备的镍-铜-钒复合材料的两个样品的icp-oes结果。
含钒(nivox和nicuvox)的电沉积样品导致了超细ncs的形成,这通过表面形貌研究得到证实。从图4a和图5a-c中的sem图像可以看出,获得了尺寸约为5nm的精细ncs,而观察到ni和nicu的较大晶体,表明复合材料中钒的存在起到了细化晶粒的作用。利用tem和高分辨tem(hrtem)进一步研究了制备的nicuvox的形貌和结构。低分辨率tem清楚地显示了nicuvox的精细晶体结构(图4b)。hrtem检查表明,形成了尺寸为~4~5nm的超细nicuvox纳米晶(图4c),与xrd和sem结果非常吻合。在nicuvox的超细nc结构中,可分辨和不可分辨的晶格条纹共存,这意味着这些ncs具有晶体结构,并伴随着一个基本均匀分布的非晶形钒沉积物。对hrtem结果的进一步研究表明,d间距为0.202nm(图4c,插图),对应于fccni的(111)面。典型的tem-eds图显示了ni、cu、v和o元素的均匀分布(图4e-h)。对于cu,由于在高亮度ni位中观察到较少的cu,部分cu已从nicu合金中阳极去除。
通过x射线光电子能谱法(xps,图6a-d)研究了nicuvox的组成和元素的氧化态。对于ni2pxps(图6a),在852.8ev(ni2p3/2线)和870.0ev(ni2p1/2线)处的结合能与金属ni有关,并且ni2p峰分裂自旋轨道分量为17.3ev,说明镍金属在nicuvox复合材料中的形成。图6b显示了分别在峰932.8ev和952.6ev处铜的cu2p3/2和cu2p1/2光谱区域,其中ni2p峰分裂自旋轨道成分为19.8ev,表明铜的氧化态为铜(0)金属。v2p3/2的结合能在516.9和515.2ev处显示两个峰值(图6c),表明存在v4 和v3 的混合价态,其中v4 为主要价态(v4 /v3 =9),与沉积钒复合材料的黑色相吻合,表明在电化学沉积过程中v5 的还原成功。o1s的拟合峰(图6d)在529.7ev处指向o-v键,位于531.2ev位置的峰对应于形成的含钒氧化物的沉积物,而532.9ev可以分配给表面吸附的h2o分子中的氧物质。根据以上结果,电沉积含钒复合物的化合物分子式可写为vo1.95·xh2o。
采用线性扫描伏安法(lsv)和计时电位法技术对制备的nicuvox、nicu、niv和ni催化剂在碱性、中性和腐蚀性海水介质中对her的催化性能进行了评价。为了进行比较,还测量了商用基准pt/c催化剂(碳黑上20wt%pt)的电催化活性(图7a)。对于nicuvox,首先评估了优化的电沉积和去合金化条件,发现沉积槽中cu2 /ni2 =2.5%(16mm铜)的摩尔比和400秒的阳极去合金化时间产生的催化剂具有最强的制氢性能(图8)。优化后,在1.0m氢氧化钾(koh)中比较了催化活性,nicuvox对her的超电势几乎为零。令人印象深刻的是,nicuvox催化剂在22mv的超电势(无ir校正)下达到10macm-2的电流密度,分别小于nivox、nicu和镍的49、49和87mv。如果去除电解液和电极之间的电阻(ir补偿,图7a中的黑色虚线),则仅需10mv的超电势即可达到10macm-2的电流密度,而对于nicuvox催化剂,则需要42mv的超电势才能达到100macm-2的电流密度。nivox催化剂的ir校正超电势为44mv,达到10macm-2的电流密度;和101mv,达到100macm-2的电流密度。
塔菲尔斜率被视为电极反应的固有特性,塔菲尔斜率值由速率限制步骤决定。通常,her动力学模型表明,volmer、heyrovsky或tafel(塔菲尔)反应将是塔菲尔斜率分别为约120、40或30mvdec-1的速率决定步骤。nicuvox、nivox、nicu、ni和20%pt/c的塔菲尔斜率分别为24、45、72、74和34mvdec-1(图7b)。nicuvox的最小塔菲尔斜率为24mvdec-1,表明随着外加超电势的增加,制氢速率增加较快,而volmer-tafel机制是通过nicuvox纳米粒子在低超电势下hads速率决定步骤的化学复合。
电催化稳定性是her催化剂的一个重要指标。首先将fto上的钒沉积物(vox;通过电沉积制备)浸入电解质溶液(1m磷酸盐缓冲盐(pbs)溶液和1m氢氧化钾)中,测试其稳定性。选择fto基材是因为它的透明性。沉积在fto上的vox可以在中性1mpbs溶液中浸泡超过6个月而没有任何视觉变化,而沉积在fto上的黑色vox在1mkoh中浸泡一段时间后变得无色,这表明在碱性条件下钒沉积溶解。此外,在碱性条件下,发现nicuvox在碱性电解质(图9)中的恒定电流密度下在较长时间内稍微失去活性。这种现象可以从在碱性中长期稳定后检测到的微弱xpsv2p信号进一步证明,这意味着沉积的钒氧化物(至少在表面)几乎溶解到溶液中。但是,这个问题可以通过在koh溶液中加入nh4vo3来解决(图9)。如图7c、d和9所示,nicuvox电极在多电流试验条件下或在电解液中含有nh4vo3的低(50macm-2)和高电流密度(100macm-2)下显示出良好的稳定性和传质性能,与相同条件下测得的镍电极稳定性差形成鲜明对比。在中性溶液中不含nh4vo3的情况下,nicuvox表现出出色的长期电化学鲁棒性,在计时电位法实验中,其稳定的超电势约为190mv,以达到50macm-2超过20h(图10b)。
此外,vox在碱性中的溶解问题对长期稳定性的影响也可以通过在nicuvox上涂覆一层非晶态铬氧化物(命名为:cro-nicuvox)来解决。如图11所示,随着析氢反应(her)稳定性试验的延长,在稳定前her活性持续增加,活性从开始增加了~25%。其优异的耐久性使其在实际水电解应用中具有广阔的前景。
现有的电化学水分解工艺为在苛性碱或苛性酸条件下制氢。在这种苛性条件下的腐蚀阻碍了ph值接近于中性的海水等丰富水源的大规模制氢。her在碱性介质中的机理与中性条件下的机理相似。因此,在ph=7时,进一步考察了钒改性前后催化剂的her活性。所制备的电极也可作为电催化剂,用于在中性ph条件下制氢。如图10a所示,nicuvox只需要少量的η=56mv的超电势即可达到10macm-2的电流密度,这与纯ni电极的η=284mv、nicu电极的η=202mv和nivox电极的η=114相比是有利的。如果采用ir补偿,在ph=7的条件下,nicuvox催化剂的析氢超低的超电势在10macm-2时为28mv,并且在100macm-2时为126mv。
目前,海水电解制氢仍然是一项具有挑战性的任务,海水环境中的主要问题是大多数水分解催化剂容易失活或腐蚀,导致效率降低。因此,开发一种在模拟海水或天然海水环境中具有高活性和高稳定性的催化剂是非常必要的。在悉尼和中国南太平洋的模拟海水和天然海水中进一步研究了制备高效、稳定的nicuvox析氢电极。有趣的是,对于nicuvox,在模拟海水和天然海水条件下,需要194mv的超电势(无ir校正)才能达到10macm-2的电流密度(图10c),这与其他报道的催化剂在类似条件下的情况相比具有优势。长期稳定性试验表明,海水中的催化活性略有下降(图10d);然而,据信这种下降是由于反应过程中不断形成沉淀,电解过程中在电极表面形成白色沉淀。据信形成沉淀是由于包含na、ca和mg盐的海水的复杂组成。然而,这些白色沉积物很容易通过超声波去除,并且在去除沉淀物后催化剂的高催化活性得以恢复,证明了nicuvox电极的鲁棒性。
为了进一步评估所制备的nicuvox材料在实际工业碱性水电解中作为阴极电极的鲁棒性和高活性,实际工业碱性水电解在高电流密度(300macm-2)、高电解质浓度(30wt%koh)和高温下操作(80℃),使用两电极电解池通过与商用电极(苏州竞立制氢设备有限公司)进行比较来测试制氢能力。电池设置与商用配置之间的唯一区别是将阴极与nf上制备好的nicuvox电极交换,但保持镍网阳极上的ni不变。首先,在80℃的30wt%koh电解质中,在10macm-2至500macm-2的不同电流密度下,测量nicuvox阴极电极与商用电极相比的电解活性。如图12a所示,当使用nicuvox电极时,水分解性能比商用阴极的性能显著提高。例如,与在使用商用阴极时的电池电压为1.52v相比,当在阴极处使用nicuvox时,仅需要1.35v的电池电压来递送10macm-2的电流密度。同样,与商用阴极的2.08v电池电压相比,使用nicuvox阴极需要1.89v的电池电压便能提供500macm-2的电流密度。与商用阴极相比,nicuvox催化活性的提高,可节能约10%。通过气相色谱法对电化学电池中镍氧阴极产生的氢进行了定量分析,得到了近100%的法拉第效率。
所有电解工艺的重要目标是开发能够承受长期运行和频繁/快速停机/启动的催化剂,因为电极可以去极化,并且由于间歇操作期间的反向电流而容易腐蚀/失活。此外,能够承受突然电源变化的电极对于与间歇可再生资源(如太阳能和风能)产生的电力结合使用非常重要。因此,在30wt%koh电解液(80℃,300macm-2;至少10次停机/启动循环,停机间隔1h)下,测试了连续电解和间歇电解在高温和高电流密度下停机/启动的稳定性。从这些试验中获得的恒流曲线如图12b所示。通过这些试验,电池电压在每次关闭后保持稳定在约1.78v。这些结果表明,在苛刻的连续碱性水电解操作过程中,电池电位变化很小,表明所制备的nicuvox电极具有良好的长期鲁棒性。
通过在其用于催化her后重复进行表征研究,进一步支持了nicuvox催化剂的稳定性和鲁棒性。长期碱性水电解后,nicuvox的tem图像表明,催化剂保持了其结构,ni、cu、v和o元素分布均匀(图13)。此外,稳定性测试后的nicuvox样品的xrd图与测试前的xrd图完全匹配,其中ni(111)峰为唯一峰,进一步证明了nicuvox作为阴极材料的稳定性(图14)。
为了获得关于元素氧化态的进一步信息,并且特别是确定沉积的含钒化合物对her的影响,进行了对元素的氧化态敏感的ni、cu和vk-边xanes测量。图15a显示了不同样品和标准nio的ni-k边光谱。所有光谱都显示出前缘肩峰,其归属于从1s核能级(corelevel)到费米能级附近的束缚态d态的跃迁,这意味着制得的镍催化剂的氧化态与镍金属相似。然而,由于钒的存在,前缘位置向较高能量移动,而在共沉积cu后,前缘位置向负位置移动。这种现象表明,当cu存在时,ni趋于表现出更多的金属特性,这对于h吸附是有利的,但是ni-h的强化学键会阻碍h2的解吸,从而降低her的反应速率。对于nivox,白线峰强度高于nicuvox和nicu,表明ni处于更高的氧化态,意味着h2解吸增强,但h吸附减弱。因此,据信nicuvox材料中的ni的金属特性对应于最佳的氢结合能。对于nicuvox复合材料,镍的前缘位于nicu合金和nivox的前缘之间,这表明在电化学水分解性能中,ni的氧化态是轻微氧化的,这会显著影响催化水分解的活性。从ni-k边的exafs分析中还可以看出镍的部分氧化和结构无序,表明与ni箔相比n降低了ni-ni相互作用峰强度并且缩短了键长(图15b)。
在制备的催化剂中测量了钒的k-边。图15c显示了nicuvox和nivox样品的光谱,以及作为参比样品的钒的不同价态。已知vk-边的前峰是形式上被禁止的1s-3d电子跃迁,并且这种前峰的强度从完美八面体对称性(vo)增加到畸变八面体vo6群(v2o3和vo2),并进一步增加到畸变方锥体vo5群(v2o5)的较低配位。从图15c中可以看出,根据xps结果表明,与参比v2o5相比,该前峰的强度都向较低的能量位置移动,并且强度略有降低,这意味着钒的氧化态降低并形成vo2样结构。
还测量了cuk-边信号,结果如图15d所示,并添加了金属cu参比以进行比较。光谱轮廓和边位置表明铜接近于氧化态cu0。
电沉积方法允许将电极材料沉积在包括掺氟氧化锡(fto)、泡沫镍(nf)、镍网和碳纤维纸(cfp)的各种导电基材上。以这种方式生产的电极表现出相似的高性能(图16)。沉积工艺也是可扩展的,可以成功地将nicuvox沉积到尺寸为21cm×21cm的大基材上,显示出与在1mkoh中观察到的制备的小电极几乎相同的her活性(图17)。
实施例2–钴基催化剂
使用类似于实施例1中所述的方法,制备了掺钒氧化物的钴催化剂。制备了没有钒掺杂的参比材料用于比较。图18和19所示的结果表明,在碱性和中性条件下,掺钒钴催化剂都具有优于仅钴催化剂的her催化活性。此外,在碱性条件下,cov催化剂具有与商用铂催化剂竞争的活性。
cov阴极制备。所有电沉积均在实施例1所述的三电极电化学装置中进行。通过以泡沫镍(nf)为工作电极、以石墨板为辅助电极并且以饱和甘汞电极(sce)为参比电极,将cov催化剂电沉积到nf基材。在沉积之前,首先在5mhcl溶液中超声处理泡沫镍20分钟以去除nio层,随后用水和乙醇冲洗,然后在空气中干燥。电沉积电解液由500mmcocl2、18mmnh4vo3和500mmh3bo3组成。采用chi660d电化学工作站(ch仪)在室温下进行电沉积。在2.0v(相对于sce)下,在nf基材上电沉积cov膜600s。前驱体中v/co的摩尔比为3.6%。
在nf对照样品上制备钴。除了添加nh4vo3钒前体外,在上述的相同条件下制备了在nf上co控制电极。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。