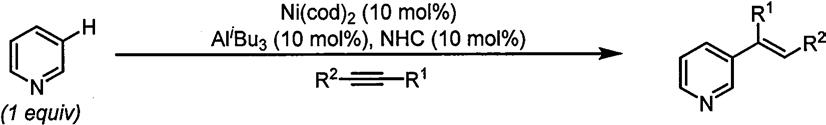
:
1.本发明涉及一类新型一种含有羟基的新型咪唑盐卡宾前体的合成方法,并利用新发展的卡宾配体,开发了一种配体桥联的双金属镍/铝反应体系,制备3
‑
烯基吡啶,属于方法学研究及应用技术领域。.
背景技术:
2.由于氮杂卡宾配体对过渡金属强的σ供电子能力,使其具备活化惰性键入c
‑
h、c
‑
c键的能力,使氮杂卡宾作为配体在金属催化反应中应用十分广泛,因而开发新的卡宾配体受到人们的广泛关注。相关报道详见:(a)diez
‑
gonzalez,s.;marion,n.;nolan,s.p.chem.rev.2009, 109,3612;(b)shogo okumura,shuwei tang,teruhiko saito,kazuhiko semba,shigeyoshi sakaki, j.am.chem.soc.2016,138,14699;yoshiaki nakao,natsuko kashihara,kyalo stephen kanyiva, and tamejiro hiyama;angew.chem.int.ed.2010,49,4451.其中,1,3
‑
二芳基咪唑为骨架的氮杂咪唑盐作为氮杂卡宾的前体,具有十分稳定,易于储存等优势,常被用作为卡宾配体的替代物而存在。
[0003]3‑
烯基吡啶是一类非常重要的化学结构单元,广泛存在于各类药物分子中。在众多合成方法中,通过对吡啶c3位c
‑
h键直接烯基化,无疑是原子经济性以及步骤经济性最高的合成方法。但是,由于吡啶对金属的强配位作用,会毒化金属,显著降低金属的催化活性,所以如何解决反应的选择性以及催化活性,一直是有机化学领域的难点和热点。直到2011年,美国scripps研究所的yu课题组通过加大吡啶在反应体系中的底物浓度,提高金属与底物吡啶碰撞的几率来提高反应活性,实现吡啶c3位c
‑
h键选择性烯基化,但大大过量的吡啶极大地限制了方法的应用范围,降低了反应的应用价值。
[0004]
2008年,ong课题组使用含有氨基的双官能卡宾配体,在金属镍催化下,实现吡啶c4位烯基化反应,同时反应中能检测到少量c3位烯基化产物的生成,相关报道详见chung
‑
chih tsai, wei
‑
chih shih,cyong
‑
hui fang,chia
‑
yi li,tiow
‑
gan ong,glenn p.a.yap,j.am.chem.soc. 2010,132,11887;同年,nakao与hiyama课题组使用imes与ipr作为配体,在金属镍催化下,实现吡啶c4位烷基化反应,相关报道详见:yoshiaki nakao,yuuya yamada,natsuko kashihara, and tamejiro hiyama,j.am.chem.soc.2010,132,13666。而如何实现当量吡啶c3位选择性烯基化,仍然是目前催化领域的难点,急需得到开发和利用。
bromide的合成
[0018][0019]
将咪唑1a(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到1.12g棕色固体2a,反应收率65%。1h nmr(400mhz,cdcl3)δ10.45(s,1h),8.00(d,j=8.4hz,1h),7.72(t,j= 7.8hz,1h),7.62(t,j=7.8hz,1h),7.29(d,j=1.8hz,1h),7.09(s,2h),5.17(t,j=5.0hz,2h), 4.95(s,1h),4.15(t,j=4.6hz,2h),2.40(s,3h),2.02(s,6h).
13
c nmr(100mhz,cdcl3)δ 143.3,141.7,135.4,131.7,131.4,131.1,130.2,127.9,127.7,113.8,113.3,59.0,49.5,21.3,17.7. hrms(esi)m/z:calcd.for c
18
h
21
n2o[m
‑
br]
281.1648,found 281.1645.
[0020]
实施例2:3
‑
(2
‑
hydroxyethyl)
‑1‑
mesityl
‑
4,5
‑
dimethyl
‑
1h
‑
imidazol
‑3‑
ium bromide的合成
[0021][0022]
将咪唑1b(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到0.95g白色固体2b,反应收率56%。1h nmr(400mhz,cdcl3)δ9.50(s,1h),7.01(s,2h),4.95
‑
4.85(m,1h),4.76
‑ꢀ
4.68(m,2h),3.99(s,2h),2.38(s,3h),2.35(s,3h),2.00(s,6h),1.96(s,3h).
13
c nmr(100 mhz,cdcl3)δ141.3,136.1,135.0,129.9,128.9,127.1,59.1,49.3,21.2,17.6,9.1,8.3.hrms (esi)m/z:calcd.for c
16
h
23
n2o[m
‑
br]
259.1805,found 259.1802.
[0023]
实施例3:1
‑
(2,6
‑
diethyl
‑4‑
methylphenyl)
‑3‑
(2
‑
hydroxyethyl)
‑
4,5
‑
dimethyl
‑
1h
‑
imidazol
‑ꢀ3‑
ium bromide的合成
[0024][0025]
将咪唑1c(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却
至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到1.24g棕色固体2c,反应收率68%。1h nmr(400mhz,cdcl3)δ9.42(s,1h),7.04(s,2h),4.87(t,j=6.8hz,1h), 4.72(t,j=4.8hz,2h),4.02
‑
3.90(m,2h),2.38(s,6h),2.18(q,j=7.6hz,4h),1.93(s,3h), 1.13(t,j=7.6hz,6h).
13
c nmr(100mhz,cdcl3)δ141.8,140.7,136.7,128.0,127.7,127.5, 126.8,59.1,49.2,23.9,21.5,14.6,9.0,8.6.hrms(esi)m/z:calcd.for c
18
h
27
n2o[m
‑
br]
287.2118,found 287.2114.
[0026]
实施例4:1
‑
(4
‑
(dimethylamino)
‑
2,6
‑
dimethylphenyl)
‑3‑
(2
‑
hydroxyethyl)
‑
4,5
‑
dimethyl
‑ꢀ
1h
‑
imidazol
‑3‑
ium bromide的合成
[0027][0028]
将咪唑1d(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到1.36g棕色固体2d,反应收率74%。1h nmr(400mhz,cdcl3)δ9.37(s,1h),6.42(s,2h),4.94(t,j=7.0hz,1h), 4.76
‑
4.64(m,2h),4.02
‑
3.93(m,2h),2.99(s,6h),2.35(s,3h),1.97(s,9h).
13
c nmr(100 mhz,cdcl3)δ151.5,136.6,135.6,127.9,126.6,119.9,111.7,59.1,49.1,40.3,18.2,9.1,8.3. hrms(esi)m/z:calcd.for c
17
h
26
n3o[m
‑
br]
288.2070,found 288.2067.
[0029]
实施例5:1
‑
(2,6
‑
dimethyl
‑4‑
(pyrrolidin
‑1‑
yl)phenyl)
‑3‑
(2
‑
hydroxyethyl)
‑
4,5
‑
dimethyl
‑
1h
‑ꢀ
imidazol
‑3‑
ium bromide的合成
[0030][0031]
将咪唑1e(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到1.36g棕色固体2e,反应收率50%。1h nmr(400mhz,cdcl3)δ9.24(s,1h),6.26(s,2h),4.93(t,j=6.8hz,1h), 4.76
‑
4.55(m,2h),3.96(dd,j=10.7,5.9hz,2h),3.28(t,j=6.4hz,4h),2.36(s,3h),2.05
‑ꢀ
1.99(m,4h),1.94(s,9h).
13
c nmr(100mhz,cdcl3)δ148.9,136.7,135.6,128.0,126.4,119.1, 111.2,59.1,49.1,47.6,25.5,18.1,9.0,8.3.hrms(esi)m/z:calcd.for c
19
h
28
n3o[m
‑
br]
314.2227,found 314.2223.
[0032]
实施例6:3
‑
(2
‑
hydroxyethyl)
‑1‑
(4
‑
methoxy
‑
2,6
‑
dimethylphenyl)
‑
4,5
‑
dimethyl
‑
1h
‑
imidazol
‑3‑
iumbromide的合成
[0033][0034]
将咪唑1f(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到1.22g白色固体2f,反应收率69%。hnmr(400mhz,cdcl3)δ9.53(s,1h),6.72(s,2h),4.92(t,j=7.0hz,1h),4.73(t,j=4.8hz,2h),4.05
‑
3.93(m,2h),3.84(s,3h),2.37(s,3h),2.02(s,6h),1.97(s,3h).
13
cnmr(100mhz,cdcl3)δ160.8,136.8,136.3,127.4,127.1,124.1,114.3,59.1,55.6,49.3,18.0,9.1,8.3.hrms(esi)m/z:calcd.forc
16
h
23
n2o2[m
‑
br]
275.1754,found275.1749.
[0035]
实施例7:1
‑
(4
‑
benzhydryl
‑
2,6
‑
dimethylphenyl)
‑3‑
(2
‑
hydroxyethyl)
‑
4,5
‑
dimethyl
‑
1h
‑
imidazol
‑3‑
iumbromide的合成
[0036][0037]
将咪唑1g(5mmol)和2
‑
溴乙醇(625mg,5mmol)在甲苯(15ml)中回流12小时后冷却至室温,减压下除去溶剂。通过柱色谱法(dcm/etoh)纯化得到1.74g棕色固体2g,反应收率71%。1hnmr(400mhz,cdcl3)δ9.44(s,1h),7.33(t,j=7.3hz,4h),7.26(d,j=8.8hz,2h),7.13(d,j=7.3hz,4h),6.96(s,2h),5.53(s,1h),4.89(t,j=6.3hz,1h),4.74(t,j=4.2hz,2h),3.97(d,j=4.2hz,2h),2.39(s,3h),1.97(s,9h).
13
cnmr(100mhz,cdcl3)δ147.4,142.8,136.2,135.2,130.3,129.6,129.5,128.6,127.1,127.0,126.8,59.1,56.5,49.2,17.8,9.0,8.4.hrms(esi)m/z:calcd.forc
28
h
31
n2o[m
‑
br]
411.2431,found411.2424.
[0038]
本发明还提供了一种所述的含羟基的双官能卡宾配体的应用。所述的应用为通过双官能卡宾桥联镍/铝双金属,实现对当量吡啶的选择性c3为c
‑
h键烯基化反应,来构建3
‑
烯基吡啶结构化合物,其特征在于该方法的具体步骤为:
[0039]
[0040]
在反应瓶中依次加入金属催化剂,配体以及碱,80℃下搅拌30mins后,冷却至室温,依次加入吡啶,三异丁基铝以及炔烃,100℃下反应12h后降至室温,浓缩后柱层析分离得到目标产物。
[0041]
2.本发明所涉及到的金属催化剂是ni(cod)2,催化剂的用量一般为10
‑
20mol%。
[0042]
3.本发明所涉及到的卡宾配体,其用量一般为10
‑
20mol%。
[0043]
4.本发明所涉及到的碱为叔丁醇钠。
[0044]
5.本发明所用溶剂是甲苯,其用量是为每毫摩尔原料吡啶对应使用范围为1ml至2ml。
[0045]
6.本发明所涉及到的反应温度为100℃。
[0046]
7.本发明所用原料1中r1、r2为烷基。
[0047]
本发明的优点是:
[0048]
1.本发明所用各种试剂均可商业所得,原料来源广泛,价格低廉,且各种试剂常温常压下能够稳定存在,操作处理方便,无须特殊处理。
[0049]
2.本发明操作简便,一步反应即可得到目标产物。
[0050]
3.本发明所使用的是廉价的镍催化剂,在保持良好催化效果、降低成本的同时,达到了简化工艺、降低成本、方便后处理工序,溶剂的回收利用便捷,减少环境污染等要求。
[0051]
4.本发明吡啶使用量可以降低至1个当量,原料后期无需回收利用。
[0052]
具体实施方法
[0053]
下面的实施示例将更好的说明本发明,但需将强调的是本发明决不仅限于这几个实施示例所表示内容。以下实例显示了本发明的不同侧面。所给出的数据包括具体操作和反应条件及产物。产物纯度通过核磁鉴定。
[0054]
实施例8:(e)
‑3‑
(oct
‑4‑
en
‑4‑
yl)pyridine的合成
[0055][0056]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3a(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/20至1/10),得40.8mg黄色油状液体5a,收率54%。1h nmr(400 mhz,cdcl3)δ8.58(br s,1h),8.44(d,j=4.0hz,1h),7.60(d,j=8.0hz,1h),7.20(dd,j=7.8, 4.8hz,1h),5.68(t,j=7.3hz,1h),2.55
‑
2.39(m,2h),2.18(q,j=7.3hz,2h),1.55
‑
1.41(m, 2h),1.40
‑
1.27(m,2h),0.96(t,j=7.4hz,3h),0.87(t,j=7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ148.0,147.7,138.9,137.2,133.6,131.2,123.1,31.5,30.7,
23.0,21.7,14.0,14.0.
[0057]
实施例9:(e)
‑3‑
methyl
‑5‑
(oct
‑4‑
en
‑4‑
yl)pyridine(3b)的合成
[0058][0059]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3b(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/20至1/10),得59.6mg黄色油状液体5b,收率61%。1h nmr (400mhz,cdcl3)δ8.37(d,j=1.6hz,1h),8.27(s,1h),7.40(s,1h),5.65(t,j=7.4hz,1h), 2.50
‑
2.40(m,2h),2.31(s,3h),2.17(q,j=7.4hz,2h),1.46(dd,j=14.8,7.4hz,2h),1.33(dd, j=15.2,7.6hz,2h),0.95(t,j=7.4hz,3h),0.86(t,j=7.4hz,3h).
13
c nmr(100mhz, cdcl3)δ148.1,145.2,138.5,137.2,134.3,132.4,131.0,31.6,30.7,23.0,21.8,18.5,14.0,13.9.
[0060]
实施例10:(e)
‑3‑
methoxy
‑5‑
(oct
‑4‑
en
‑4‑
yl)pyridin的合成
[0061][0062]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3c(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/20至1/10),得54.3mg黄色油状液体5c,收率62%。1h nmr(400 mhz,cdcl3)δ8.21(br s,1h),8.16(br s,1h),7.12(s,1h),5.70(t,j=7.2hz,1h),3.87(s,3h),2.46(t,j=7.6hz,2h),2.19(q,j=7.2hz,2h),1.53
‑
1.43(m,2h),1.35(dt,j=14.6,7.2hz, 2h),0.97(t,j=7.4hz,3h),0.88(t,j=7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ155.5,140.7, 139.7,137.0,135.0,131.4,118.7,55.7,31.7,30.7,23.0,21.8,14.1,14.0.hrms(esi)m/z:calcd. for c
14
h
22
no(m h)
220.1696,found 220.1694.
[0063]
实施例11:(e)
‑
n,n
‑
diisopropyl
‑5‑
(oct
‑4‑
en
‑4‑
yl)nicotinamide的合成
[0064][0065]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3d(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 2a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/20至1/10),得54.3mg黄色油状液体5d,收率62%。1h nmr(400 mhz,cdcl3)δ8.57(br s,1h),8.40(br s,1h),7.61
‑
7.51(m,1h),5.71(t,j=7.4hz,1h),4.04
‑ꢀ
3.36(m,2h),2.59
‑
2.38(m,2h),2.18(q,j=7.4hz,2h),1.75
‑
1.40(m,7h),1.40
‑
1.28(m, 4h),1.28
‑
1.06(m,5h),0.95(t,j=7.2hz,3h),0.86(t,j=7.2hz,3h).
13
c nmr(100mhz, cdcl3)δ168.7,148.1,144.4,138.8,136.6,133.9,132.1,131.2,31.4,30.8,22.9,21.7,20.9,14.0, 13.9.hrms(esi)m/z:calcd.for c
20
h
33
n2o(m h)
317.2587,found 317.2582.
[0066]
实施例12:(e)
‑3‑
(oct
‑4‑
en
‑4‑
yl)
‑5‑
phenylpyridine的合成
[0067][0068]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3e(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/20至1/10),得75.3mg黄色油状液体5e,收率71%。1h nmr(400 mhz,cdcl3)δ8.68(br s,1h),8.57(br s,1h),7.78(d,j=1.4hz,1h),7.59(d,j=7.8hz,2h), 7.48(t,j=7.6hz,2h),7.44
‑
7.36(m,1h),5.76(t,j=7.2hz,1h),2.53(t,j=7.6hz,2h),2.22 (q,j=7.4hz,2h),1.56
‑
1.45(m,2h),1.45
‑
1.34(m,2h),0.98(t,j=7.4hz,3h),0.90(t,j= 7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ146.8,146.3,138.8,138.3,137.2,136.1,132.1,131.5, 129.1,128.1,127.3,31.6,30.8,23.0,21.8,14.0,14.0.hrms(esi)m/z:calcd.for c
19
h
24
n (m h)
266.1903,found 266.1899.
[0069]
实施例13:(1r,2s,5r)
‑2‑
isopropyl
‑5‑
methylcyclohexyl 5
‑
((e)
‑
oct
‑4‑
en
‑4‑
yl)nicotinate的合成
[0070][0071]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3f(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/20至1/10),得111.3mg黄色油状液体5a,收率75%。1h nmr (400mhz,cdcl3)δ9.03(d,j=1.4hz,1h),8.71(d,j=2.0hz,1h),8.22
‑
8.16(m,1h),5.74(t, j=7.4hz,1h),5.02
‑
4.90(m,1h),2.50(q,j=7.6hz,2h),2.20(q,j=7.6hz,2h),2.16
‑
2.08 (m,1h),1.98
‑
1.88(m,1h),1.78
‑
1.68(m,2h),1.63
‑
1.52(m,2h),1.52
‑
1.42(m,2h),1.40
‑ꢀ
1.28(m,2h),1.21
‑
1.07(m,2h),1.02
‑
0.85(m,13h),0.82
‑
0.76(m,3h).
13
c nmr(100mhz, cdcl3)δ165.3,151.4,148.7,138.7,136.4,134.5,132.3,126.2,75.6,47.3,41.0,34.3,31.6,31.4, 30.8,26.7,23.8,23.0,22.1,21.7,20.8,16.7,14.0,13.9.hrms(esi)m/z:calcd.for c
24
h
38
no
2 (m h)
372.2897,found 372.2893.
[0072]
实施例14:(3as,4r,5s,6ar)
‑4‑
(((tert
‑
butyldimethylsilyl)oxy)methyl)
‑2‑
oxohgxahydro
‑ꢀ
2h
‑
cyclopenta[b]furan
‑5‑
yl 5
‑
((e)
‑
oct
‑4‑
en
‑4‑
yl)nicotinate的合成
[0073][0074]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3g(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/10至1/4),得122.2mg黄色油状液体5g,收率61%。1h nmr(400 mhz,cdcl3)δ9.01(d,j=1.8hz,1h),8.72(d,j=2.2hz,1h),8.14(t,j=2.2hz,1h),5.76(t,j =7.4hz,1h),5.35(dt,j=6.2,3.2hz,1h),5.06(t,j=5.8hz,1h),3.74(dd,j=10.2,4.8hz, 1h),3.68(dd,j=10.2,4.6hz,1h),2.96
‑
2.84(m,2h),2.59
‑
2.44(m,4h),2.40
‑
2.25(m,2h), 2.20(q,j=7.43hz,2h),1.55
‑
1.44(m,2h),1.40
‑
1.28(m,2h),0.96(t,j=7.4hz,3h),0.91
‑ꢀ
0.85(m,12h),0.05(s,6h).
13
c nmr(100mhz,cdcl3)δ176.6,
165.3,151.9,148.8,138.8, 136.3,134.4,132.6,125.2,85.1,79.1,63.3,54.9,40.5,39.0,36.2,31.2,30.9,25.9,22.9,21.7,18.3, 14.1,13.9,
‑
5.5.hrms(esi)m/z:calcd.for c
28
h
44
no5si(m h)
502.2983,found 502.2982.
[0075]
实施例15:3
‑
((3s,8r,9s,10r,13s,14s)
‑3‑
((tert
‑
butyldimethylsilyl)oxy)
‑
10,13
‑
dimethyl
‑
2,3 ,4,7,8,9,10,11,12,13,14,15
‑
dodecahydro
‑
1h
‑
cyclopenta[a]phenanthren
‑
17
‑
yl)
‑5‑
((e)
‑
oct
‑4‑
en
‑4‑ꢀ
yl)pyridine的合成
[0076][0077]
在反应瓶中依次加入ni(cod)2(11.0mg,0.04mmol),nhc
·
hbr(14.5mg,0.04mmol),叔丁醇钠(4.6mg,0.05mmol)于干燥脱气的甲苯(2.0ml)中,80℃下搅拌30mins后冷却至室温,加入底物3i(0.4mmol),三异丁基铝(0.04mmol,36.3μl,1.1m in toluene),以及底物 4a(1.2mmol),氮气条件100℃下反应12小时。反应结束,硅藻土过滤,硅胶柱层析,淋洗剂为(乙酸乙酯/石油醚=1/10至1/4),得144.5mg黄色油状液体5i,收率63%。1h nmr(400 mhz,cdcl3)δ8.45(d,j=1.8hz,1h),8.43(d,j=1.8hz,1h),7.63
‑
7.46(t,j=2.0hz,1h), 6.03
‑
5.95(m,1h),5.68(t,j=7.2hz,1h),5.41
‑
5.31(m,1h),3.57
‑
3.42(m,1h),2.53
‑
2.40 (m,2h),2.34
‑
2.15(m,5h),2.10
‑
1.99(m,3h),1.83
‑
1.44(m,11h),1.41
‑
1.30(m,2h),1.12
ꢀ‑
1.00(m,8h),0.96(t,j=7.4hz,3h),0.89(s,12h),0.06(s,6h).
13
c nmr(100mhz,cdcl3)δ 152.0,146.2,145.9,142.0,138.2,137.2,132.3,131.4,131.0,129.1,120.9,72.7,57.7,50.6,47.5, 43.0,37.4,36.9,35.4,32.2,31.9,31.7,31.6,30.8,30.6,26.0,23.1,21.8,21.0,19.5,18.4,16.7,14.0, 14.0,
‑
4.5.hrms(esi)m/z:calcd.for c
38
h
60
nosi(m h)
574.4439,found 574.4440.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

